
Регенерация: мы ее утратили, или не всё потеряно?
16 мая 2025
Регенерация: мы ее утратили, или не всё потеряно?
- 2712
- 2
- 7
Среди животных есть самые настоящие мастера регенерации, и это не только мифическая лернейская гидра, но и вполне реальные существа. К сожалению, люди к ним не относятся: мы утратили способность восстанавливать разрушенные органы и части тела. Наука пытается вернуть то, что отняла Природа, а идеи «подсматривает» у братьев наших меньших.
Рисунок в оригинальном разрешении.
иллюстрация Александры Мартыновой
-
Автор
-
Редакторы
-
Рецензенты
-
Иллюстратор
В то время как одни животные умеют восстанавливаться буквально из состояния «фарша», а другие способны лишь «отращивать» утраченные конечности и части органов, третьим не досталось практически ничего. Восстановить утраченный кончик пальца, «залатать» небольшую дырку в ухе и увеличить оставшуюся часть печени после ее хирургической резекции — вот практически и всё, на что способны взрослые млекопитающие, да и то не все.
Что же такое регенерация: свойство, изначально присущее всему живому, а потом утраченное в разной степени; или полезное приобретение, которое изначально удалось получить лишь некоторым организмам? Почему регенеративные возможности человека так скромны? Можно ли их восстановить — хотя бы частично? Попробуем ответить на эти вопросы в пятой статье спецпроекта, посвященного регенеративной медицине.
Регенеративная медицина

Медицина без преувеличения преобразила жизнь всего человечества, позволив спасать от ран и лечить от болезней, в том числе — в недавнем прошлом неизлечимых. И хотя ее развитие не прекращается, в отдельную новую дисциплину выделяют медицину регенеративную, цель которой — восстанавливать повреждения тканей и органов, а также продлевать их бесперебойную работу, активируя внутренний регенеративный потенциал организма. Применение в реальной клинической практике стволовых клеток и компонентов их секретома; тканевая инженерия; активация обновления и регенерации клеток — уже реальность или пока отдаленная фантастика?
Партнер проекта — российская фармацевтическая компания «Биотехфарм», занимающаяся поставкой и продвижением лекарственных средств и изделий медицинского назначения в сфере гинекологии, урологии и репродуктивной медицины. Компания продвигает высокотехнологичные препараты, в том числе на основе цитокинов, секретомов, гиалуроновой кислоты и лактобактерий.
Главные препараты компании — «Суперлимф®», созданный на кафедре иммунологии РНИМУ им. Н.И. Пирогова, применяющийся для регенеративного лечения раневых поверхностей и инфекционных заболеваний урогенитального тракта; а также средства для интимной гигиены — «Эстрогиал™» и «Ацилакт ДУО».

Фото 1. Мария Борисовна Терёшина, к.б.н., научная сотрудница Лаборатории молекулярных основ эмбриогенеза (зав. лабораторией: Андрей Георгиевич Зарайский) в Институте биоорганической химии Российской академии наук. Соавтор научных работ, посвященных связи между эволюцией позвоночных животных, утратой определенных генов и значительным снижением способности к регенерации.
В первой статье спецпроекта [1] мы упоминали некоторых животных-рекордсменов в области регенерации. И к пятой публикации круг замыкается: мы поговорим подробнее о том, как разные представители животного мира восстанавливают утраченные части тела, какие возможности регенерации сохранились в организме человека и как все эти знания можно использовать для развития регенеративной медицины. Некоторые интересные данные для этого материала мы получили из первых рук в ходе беседы с научной сотрудницей Лаборатории молекулярных основ эмбриогенеза в Институте биоорганической химии Российской академии наук, соавтором научных работ о генах, принимающих участие в регенерации у животных, к.б.н. Марией Борисовной Терёшиной (фото 1).
Для начала разберемся, какими способами живые организмы восстанавливают свое тело.
Морфаллактическая, эпиморфная и компенсаторная регенерация
Репаративная регенерация может происходить тремя основными способами, и у каждого есть свое название: морфаллактическая (морфаллаксис), эпиморфная (эпиморфоз) и компенсаторная (иногда рассматривается как разновидность эпиморфной). Эти способы отражают степени «крутизны», с которой те или иные организмы умеют восстанавливать утраченные части тела (или даже всё тело целиком).
Морфаллаксис
Морфаллактическую регенерацию смогли сохранить только самые примитивные животные. Хрестоматийный пример — гидры. Тело этих кишечнополостных состоит всего из двух слоев клеток и имеет вид трубки длиной пять миллиметров, на одном конце которой находится рот, окруженный щупальцами (гипостома), а на другом — «нога» (базальный диск).
Если разрезать гидру пополам, то ее нижняя часть отрастит новую голову, а верхняя — новую «ногу». Можно нарезать животное на несколько частей, и получится несколько новых маленьких гидр. Во время такой регенерации не образуется стволовых клеток. Вообще необязательно, чтобы появлялись новые клетки: уже существующих вполне достаточно, чтобы перестроиться и образовать новый организм (рис. 2). При этом клетки гидры «понимают», где у нее должна быть голова, где — «нога», и что каждая из этих частей должна находиться на определенном конце тела в количестве одной штуки [2], [3].
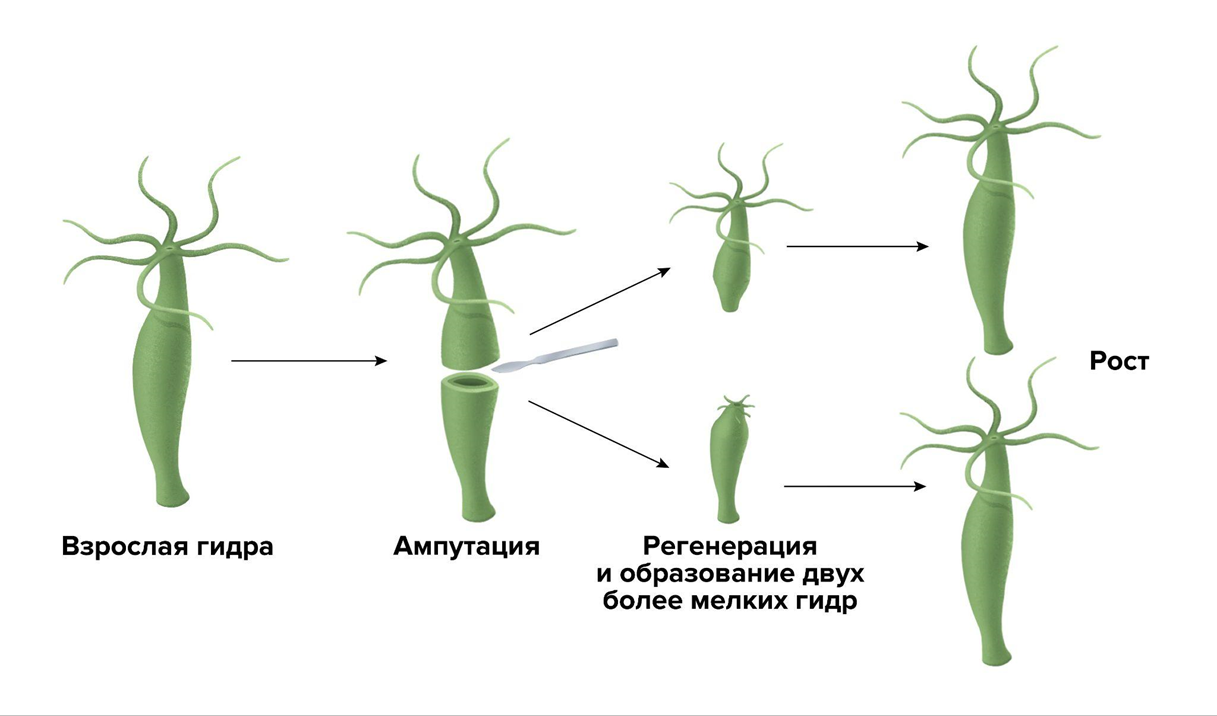
Рисунок 2. Морфаллактическая регенерация. Когда гидру разрезают пополам, из каждой половинки получается новое животное — вдвое меньшее, чем исходное. И только потом они вырастают до размеров «материнской» особи.
иллюстрация Александры Мартыновой по рисунку Онлайн-школы BUJU’s
Эпиморфоз
Совсем по-другому происходит восстановление утраченных частей тела у более сложно организованных животных. Тут один из наиболее типичных примеров — регенерация конечностей у саламандр и тритонов.
После того, как взрослая саламандра лишается части своей лапки, оставшиеся клетки способны полностью ее воссоздать, причем в новой конечности будут присутствовать все ткани, и они будут правильно расположены по отношению друг к другу. Восстанавливается только утраченная часть конечности — ни больше ни меньше. Например, если ампутация произошла на уровне запястья, то отрастет то, что было раньше, а не локоть и тем более не колено [3].
Эпиморфная регенерация состоит из нескольких этапов:
- Примерно через 6–12 часов после того, как саламандра осталась без конечности, клетки эпидермиса, находящиеся по соседству, полностью покрывают рану: образуется апикальный эктодермальный колпачок. При этом дерма не перемещается вместе с эпидермисом, и в области раны не образуется рубца. Это важное отличие заживления у анамний (рыб и амфибий) от амниот (пресмыкающихся, птиц и млекопитающих).
- Далее происходит гистолиз — разрушение ткани протеолитическими (расщепляющими белки) ферментами, такими как лизосомальные кислые гидролазы и матриксные металлопротеиназы. В результате из соединительной ткани высвобождаются клетки-фибробласты, из нервных волокон — шванновские клетки (образуют их оболочки), а мышечные волокна распадаются на одноядерные клетки [4].
- Далее в течение нескольких дней костные, хрящевые, мышечные, нервные клетки и фибробласты под апикальным эктодермальным колпачком начинают терять свои отличительные свойства. Все они становятся похожими друг на друга и сливаются в одну неразличимую массу дедифференцированных клеток, а их скопление называется бластемой.
- Впоследствии за счет деления клеток бластемы утраченная конечность снова отрастает. Клетки заново дифференцируются, то есть приобретают специализацию и становятся фибробластами, миоцитами, клетками костной ткани и пр. [3].
Таким образом, можно выделить два ключевых признака, отличающих эпиморфную регенерацию от морфаллактической: во время нее образуются дедифференцированные клетки и бластема. Но не всё так однозначно.
Регенерация у отдельных видов животных происходит так, как сложилось эволюционно. У всех, вероятно, процессы протекают по-своему, с некоторыми отличиями. Классифицировать всё многообразие довольно сложно. Чтобы не путаться, я бы предложила запомнить, что есть два основных вида репаративной регенерации: морфаллактическая, присущая низшим животным, и эпиморфная, сохранившаяся у некоторых позвоночных.
У млекопитающих тоже может формироваться бластема, и иногда происходит восстановление утраченных частей тела путем эпиморфной регенерации. Но происходит это редко и далеко не в таких масштабах, как у обитателей водоемов. Например, у мышей, приматов и в том числе людей могут восстанавливаться кончики пальцев. Это происходит ровно так же, как у тритонов отрастают лапки — через формирование бластемы. Этот процесс довольно хорошо изучен (рис. 5) [6], [7]. В 2022 году были опубликованы результаты исследования, которое показало, что для успешной регенерации должны сохраниться ткани основания ногтя, включающие мезенхимальные клетки [8].
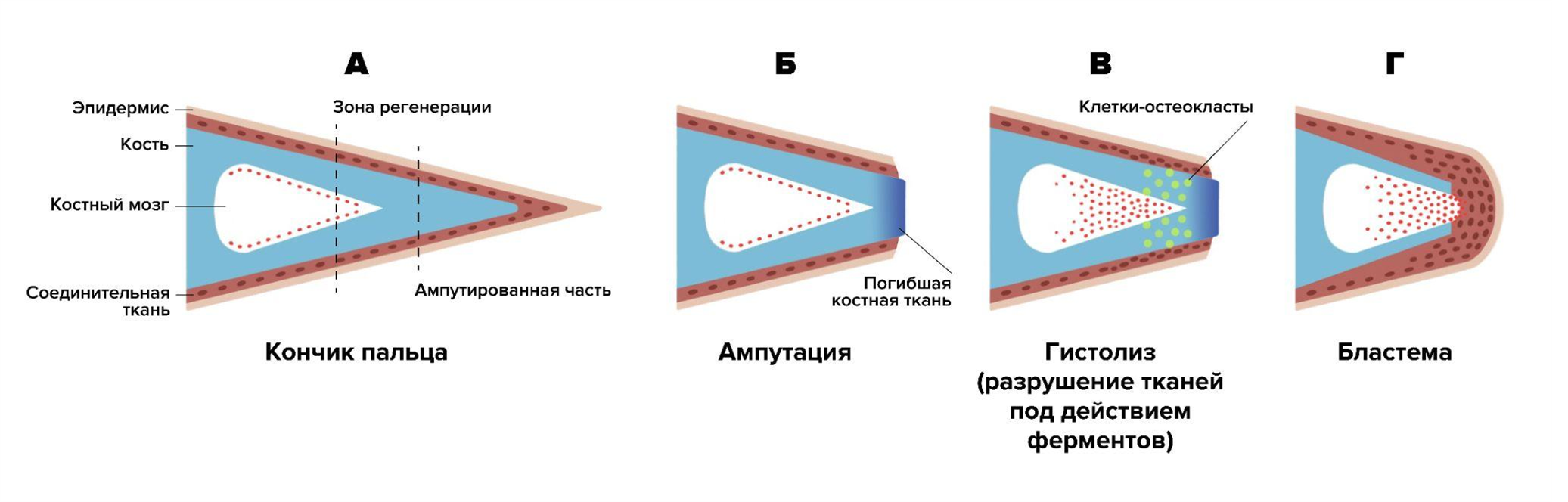
Рисунок 5. Восстановление кончика пальца у мыши. A — схема кончика пальца мыши. Для изучения регенерации проводят ампутацию кончика пальца, не повреждая костного мозга. Б — после ампутации в культе находится погибшая костная ткань. В — клетки-остеокласты обеспечивают гистолиз тканей в области культи. В соединительной ткани и костном мозге увеличивается количество клеток. Г — после того, как завершилась вторичная ампутация (отторгнуты погибшие ткани), эпидермис покрывает культю, и в ней возникает бластема, формируемая клетками красного костного мозга и соединительной ткани. Таким образом, область регенерации находится проксимальнее (ближе к началу пальца), чем изначально произошла ампутация.
иллюстрация Александры Мартыновой по [6]
В 1953 году ученые обнаружили: если сделать в ухе кролика отверстие диаметром 1 см, то спустя некоторое время оно полностью зарастает, и образуется в нем не рубец, а новый хрящ, жировая ткань, кожа и даже волосяные фолликулы. В 2012 году аналогичное явление было описано у иглистых мышей: у них происходит регенерация, если проделать в ушной раковине отверстие диаметром 4 мм [9], [10].
Исследования показали, что тут задействованы всё те же знакомые механизмы. Когда животное получает травму уха, то первым делом в этом месте развивается воспаление и образуется струп. Дальше под струпом отверстие изнутри и снаружи затягивается эпидермисом. Между его слоями накапливаются клетки, и между ними образуется бластема [6], [10].
Еще одна структура, в которой быстро зарастают отверстия, причем и у людей, и у всех остальных млекопитающих, — барабанная перепонка. В 2023 году в журнале Nature были опубликованы результаты исследования на мышах, которое показало, что восстановление барабанной перепонки имеет многие черты эпиморфной регенерации [19]. Тут тоже сначала рана зарастает эпидермисом, в котором активируется белок-рецептор EGFR, стимулирующий клеточные деления. В область дефекта мигрируют клетки, из которых образуется масса, похожая на бластему. Через две недели барабанная перепонка практически полностью восстанавливается, только волокна коллагена в ней расположены хаотично, дезорганизованно. Чтобы коллагеновый каркас стал правильным, структурированным, требуется еще несколько месяцев.
Компенсаторная регенерация
Этот вид регенерации известен человечеству с древнейших времен (вспомним мифы о Прометее и Титусе из первой статьи спецпроекта [1]). Именно так, например, восстанавливается печень. Если удалить одну из ее долей, то она уже не отрастет снова, но оставшаяся часть органа пропорционально увеличится.
Этот эффект наблюдается за счет пролиферации ткани. Клетки печени не становятся стволовыми и из них не образуется бластема. Каждая из них сохраняет свою идентичность. Гепатоциты, клетки печеночных протоков, жировые, эндотелиальные (выстилающие кровеносные сосуды) клетки, макрофаги (клетки Купфера) — все они размножаются сами по себе, создавая собственные копии. В итоге не формируются новые анатомические структуры, просто увеличивается общее число клеток, и растет в размерах та часть органа, которая сохранилась (рис. 9) [3].
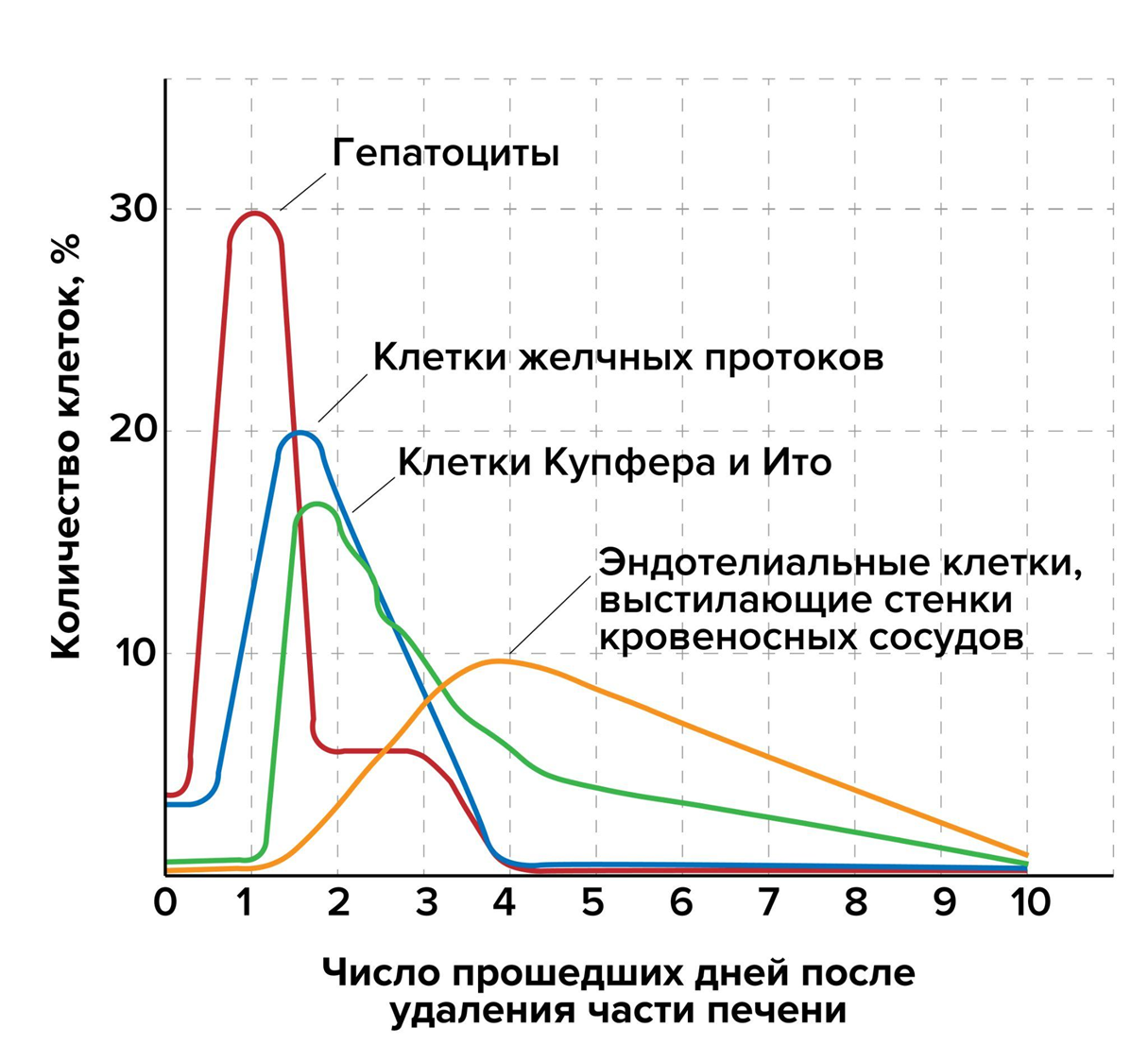
Рисунок 9. Изменение активности синтеза ДНК (показатель активности клеточных делений) в разных типах клеток печени после удаления части органа. Клетки Купфера — печеночные макрофаги, клетки Ито — жирозапасающие клетки печени.
иллюстрация Александры Мартыновой по [3]
Как и клетки в бластеме тритона, ткань в регенерирующей печени отчасти возвращается в эмбриональное состояние, но далеко не так сильно. В итоге и регенерация получается более топорной. И всё же это лучше, чем рубец [3]!
Регенерация, которую мы потеряли
«Человек — венец природы!» — это высказывание подразумевает, что мы в определенном смысле являемся высшей формой жизни на Земле и обладаем способностями, отсутствующими у тех, кого снисходительно называем «братьями нашими меньшими».
Но в природе не бывает ничего идеального. Таков неписаный закон живого мира: за всё нужно платить. Эволюция — это бесконечная череда компромиссов, когда за приобретение новых адаптивных механизмов от чего-то приходится отказываться. Одной из таких жертв стала и способность к регенерации. На пути к «венцу природы» она постоянно ослабевала, и в итоге у нас — людей — выражена в минимальной степени (рис. 10). Оказывается, регенеративные способности позвоночных особенно сильно сдали после того, как те вылезли на сушу. Действительно, восстановление хвостов и конечностей обычно наблюдается у рыб и амфибий, а для птиц и млекопитающих это нехарактерно.
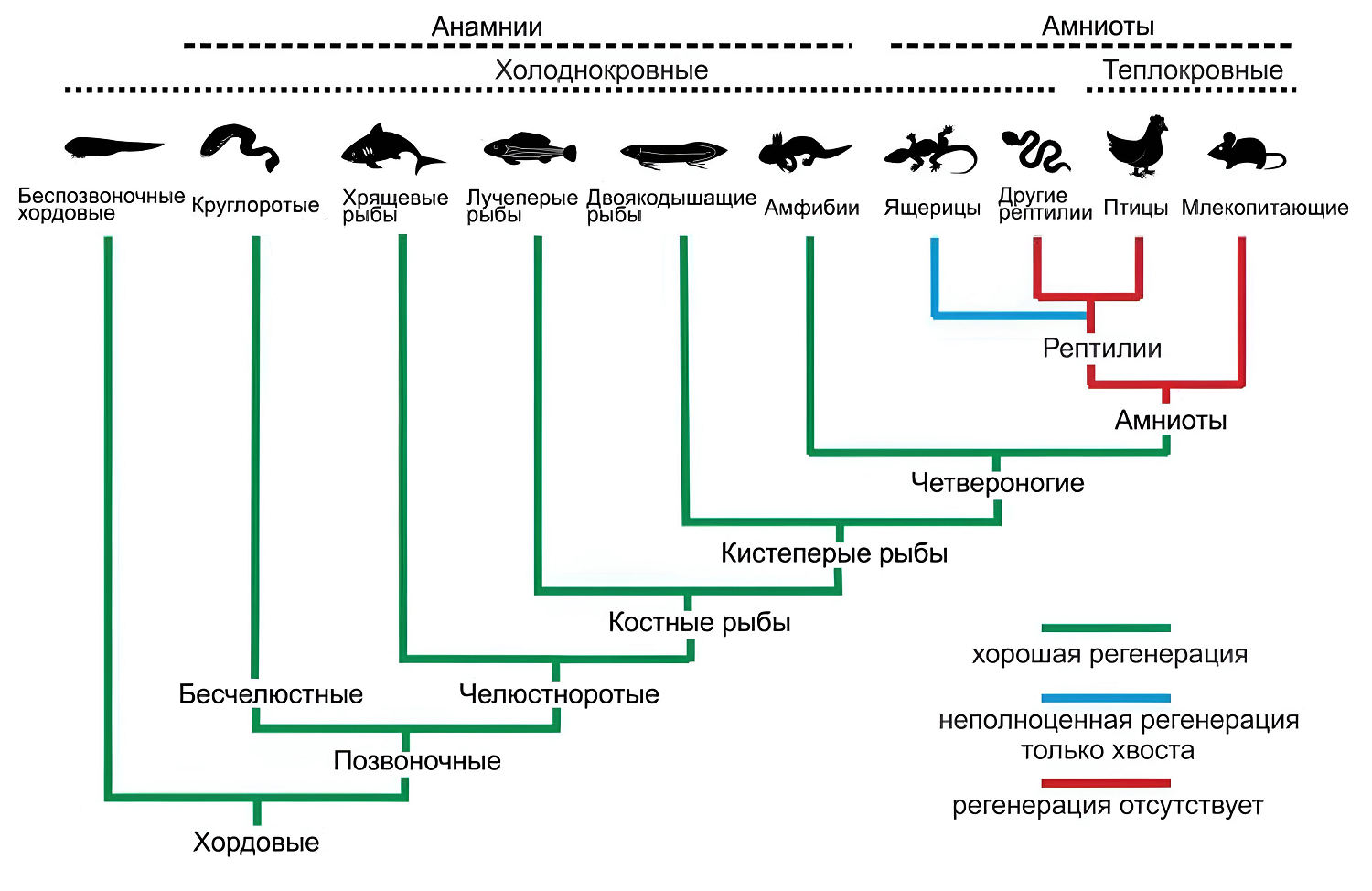
Рисунок 10. Способность к регенерации у разных позвоночных. Можно заметить: своего рода переломный момент наступил, когда наши далекие предки вышли на сушу. Из-за кардинального изменения среды обитания пришлось сильно измениться организму, и в итоге регенерация всё больше отходила на второй план.
Существует довольно много объяснений, почему млекопитающие обладают столь скромными способностями к регенерации по сравнению со своими предками. Рассмотрим некоторые из них.
Вам иммунитет или регенерацию?
Часто в качестве «виновника» называют адаптивный (приобретенный) иммунитет — тот, что связан с T- и B-лимфоцитами и специфически реагирует на патогены. Это подтверждается наблюдениями: например, мыши, у которых регенерируют только кончики пальцев, обладают сложной иммунной системой, в которой хорошо развит и врожденный, и адаптивный (приобретенный) компонент. А иммунная система саламандр, отращивающих целые конечности, весьма примитивна. Ее врожденный компонент силен, а некоторые элементы приобретенного совсем отсутствуют.
У грызунов на ранних стадиях внутриутробного развития наблюдается заживление ран без рубцов. Образование рубцовой ткани более характерно для поздних стадий, которые как раз совпадают с развитием иммунной системы и усилением воспалительных реакций [21], [22].
Но тут не всё так просто.
Например, мыши не могут отращивать хвосты и лапы — предположительно, из-за сложного адаптивного иммунитета. Но почему же тогда иммунная система позволяет восстанавливаться кончикам пальцев? Еще одна странность: во время развития головастиков гладкой шпорцевой лягушки (которая, кстати, является важным модельным организмом [23]) на определенном этапе способность к регенерации временно утрачивается (рис. 12). Однако некоторые факторы (например, противовоспалительные лекарственные препараты, повышенный приток кислорода, активные формы кислорода, изменения в микробиоме) возвращают способность к регенерации хвоста (но не у всех головастиков). Откуда такие различия [22]?
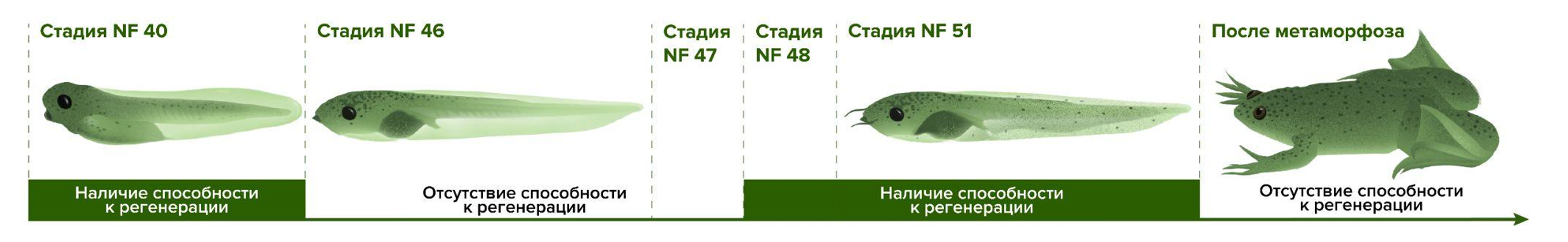
Рисунок 12. Головастики гладкой шпорцевой лягушки (Xenopus laevis) могут восстанавливать утраченные хвосты в течение всей своей жизни до метаморфоза. Но есть короткий рефрактерный период (стадии 46 и 47 по [24]), когда эта способность временно утрачивается. Этот факт сам по себе интересен для изучения: какие механизмы тут задействованы?
иллюстрация Александры Мартыновой по [22]
Вероятно, они возникают из-за того, что иммунная система работает в разных частях тела по-разному. Играют роль определенные местные механизмы регуляции.
Способность к регенерации у амниот сильно уменьшил адаптивный иммунитет, ведь он защищает организм не только от возбудителей инфекций, но и от собственных аномальных клеток, способных образовывать опухоли. Иммунная система запрограммирована на то, чтобы уничтожать „подозрительные“, быстро размножающиеся клетки. Так как иммунитет созревает поздно, он „не знаком“ с дедифференцированными клетками и воспринимает их как „чужаков“, угрозу. Из-за этого он и не дает сформироваться бластеме.
Горе от ума
Высших позвоночных отличает от низших еще одна особенность: большой и более сложно устроенный мозг. Можно предположить, что существуют гены, которые нужны одновременно для развития мозга у анамний и более эффективной регенерации, но из геномов высших позвоночных они были элиминированы (вытеснены) в ходе эволюции. Могло так случиться, что их утрата с одной стороны внесла свою лепту в снижение регенеративной способности, но с другой стороны — дала возможность развиваться переднему отделу мозга в новом направлении. Такое предположение было сделано исследователями из Лаборатории молекулярных основ эмбриогенеза Андрея Георгиевича Зарайского в Институте биоорганической химии Российской академии наук. Ими был найден ряд таких генов, в частности Ag1, Ras-dva, c-Answer, которые сейчас активно исследуются.
Ранее Андрей Георгиевич писал про свою лабораторию на «Биомолекуле»: «Лаборатория молекулярных основ эмбриогенеза: от гена к признаку» [25]. Рекомендуем почитать!
Ген Ag1
относится к семейству Agr, включающему три гена: Ag1, Agr2 и Agr3. У анамний есть все три, а у высших позвоночных — только Agr2 и Agr3. Эксперименты показали, что после ампутации хвостового плавника у рыбок данио рерио и ампутации конечностей у амфибий в культях повышается экспрессия (активность) гена Ag1, а если его заблокировать, то регенерация нарушается. В целом же известно, что белки Agr регулируют рост и дифференцировку клеток во время эмбрионального развития, образование опухолей и регенерацию [26]. В то же время, есть доказательства, что Ag1 регулирует ранние этапы развития — в частности, переднего мозга у гладкой шпорцевой лягушки [27], [28].
Гены Ras-dva1 и Ras-dva2
кодируют белки-ферменты, которые называются малыми ГТФазами. Из всего многообразия малых ГТФаз они наиболее близки к семейству белков RAS, задействованных в ряде сигнальных каскадов в процессе передачи сигналов в клетку. В процессе эволюции гены Ras-dva1 и Ras-dva2 у амниот постепенно утрачивались, а у млекопитающих исчезли полностью (рис. 13) [29].
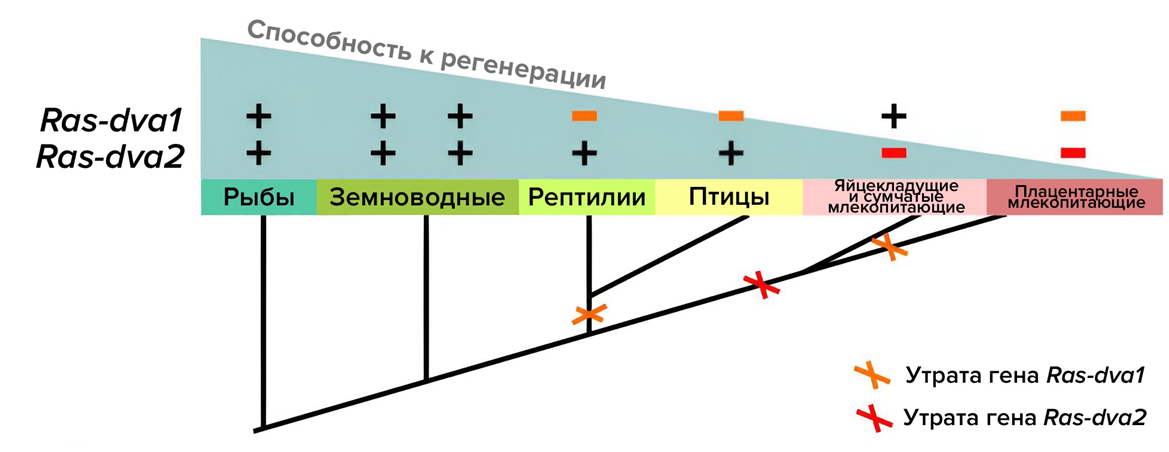
Рисунок 13. Судьба генов Ras-dva1 и Ras-dva2 в ходе эволюции. Группы животных, у которых есть гены Ras-dva1 и Ras-dva2, и те, кто утратили один из них или оба.
пресс-релиз ИБХ: «Ras-dva и готово»
Проводя эксперименты на модельных организмах — рыбах Danio rerio и головастиках гладкой шпорцевой лягушки, — исследователи из Лаборатории молекулярных основ эмбриогенеза обнаружили, что гены Ras-dva ГТФаз резко активируются в клетках раневого эпителия и бластемы, когда начинается регенерация после ампутации плавников или задней конечности и хвоста, соответственно [29].
Ученые обнаружили, что у головастиков во время рефрактерного периода (рис. 11) активность генов Ras-dva сначала увеличивается, но после формирования раневого эпителия они резко «замолкают», и одновременно прекращается процесс регенерации.
Дальнейшие эксперименты показали: если искусственно подавить гены этих ГТФаз, то и регенерация больше не происходит. Если же во время рефрактерного периода у головастиков активировать эти гены, то, напротив, регенеративный процесс восстанавливается, и многие животные заново отращивают ампутированные хвосты.
c-Answer
Этот ген тоже играет важную роль в развитии мозга и регенерации у анамний, а теплокровные животные его утратили. Белок, который он кодирует, встроен в мембрану, играет роль рецептора и участвует в передаче некоторых клеточных сигналов (рис. 14) [30].
На самом деле c-Answer — это аббревиатура, а полное название белка звучит весьма сложно: специфичный для холоднокровных рецептор-связывающий белок раневого эпителия (cold-blooded Animal specific wound epithelium receptor-binding protein) [30].
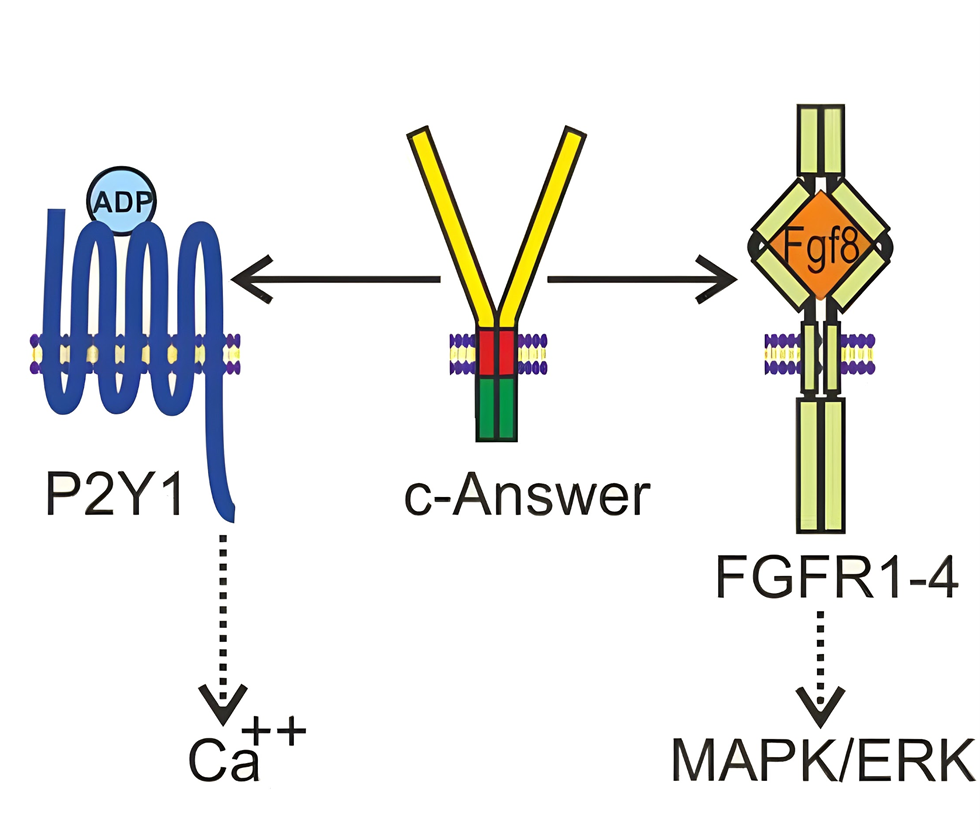
Рисунок 14. c-Answer стимулирует активность рецепторов: рецептора фактора роста фибробластов FGFR и пуринергического P2RY1. В итоге FGFR активируют сигнальный путь под названием MAPK/ERK, который влияет на транскрипционную активацию/репрессию определенных участков ДНК. Рецептор P2RY1 усиливает Ca2+-сигнализацию — особую сигнальную систему, работа которой основана на изменении концентрации ионов кальция (подробнее о ней можно узнать из статьи «Загадочный кальциевый язык»).
Идея о том, что причины утраты способности к регенерации конечностей у амниот стоит искать среди генов, которые были потеряны ими в ходе эволюции, но сохранились у анамний, проста и в то же время имеет под собой веские основания. Существует такое понятие, как плейотропия — когда один ген отвечает сразу за несколько признаков. Млекопитающие избавились от некоторых генов, которые мешали развитию крупного мозга и других полезных приспособлений. Но параллельно эти гены могли отвечать и за другие, нужные, свойства, в том числе за способность к регенерации. Исследования в этом направлении продолжаются, и в их проведении сильно помогают современные биоинформационные технологии. Ученые уже выявили десятки таких утраченных генов, а теперь постепенно разбираются в их функциях.
Теплокровность
Теплокровность дала птицам и млекопитающим немало преимуществ. За счет способности постоянно «топить печку» и поддерживать высокую температуру тела люди и их ближайшие эволюционные собратья могут сохранять высокую активность на холоде, обитать в самых разных климатических условиях, им не нужно впадать зимой в анабиоз, а в ясные дни подолгу сидеть под солнышком, пытаясь согреться.
Главная издержка теплокровности в том, что она требует много энергии. В организм должно поступать достаточное количество топлива в виде калорий, а значит, нужно хорошо питаться и постоянно поддерживать на высоком уровне обмен веществ.
Ученые считают, что утрата способности к регенерации также вошла в «общий прайс» за теплокровность. Есть наблюдения, подтверждающие эту точку зрения. Анамнии, в частности, рыбки данио рерио и саламандры, умеют регенерировать не только утраченные хвосты, но и ткань сердца. В 2019 году ученые из Института сердечно-сосудистых исследований Калифорнийского университета в Сан-Франциско под руководством доктора Го Хуана опубликовали в журнале Science результаты исследования, показавшего, что гормоны, которые сделали птиц и млекопитающих теплокровными, одновременно лишили их способности к регенерации сердца [32].
Речь о гормонах щитовидной железы — трийодтиронине и тироксине. Они усиливают обмен веществ, липолиз (разрушение жиров с выделением энергии), заставляют сердце биться чаще и сильнее, повышают температуру тела. Из-за важной роли в термогенезе (выработке тепла) тиреоидные гормоны называют важной движущей силой в переходе от холоднокровности к теплокровности.
Исследователи во главе с Го Хуаном изучили образцы тканей сердца 41 вида животных, в каждом из которых считали число диплоидных кардиомиоцитов — этот показатель отражает, насколько активно происходит регенерация (диплоидные клетки сердечной мышцы способны активно делиться, а полиплоидные уже не размножаются). Оказалось, чем выше в организме животного концентрация тиреоидных гормонов, тем ниже регенеративный потенциал.
Последующие эксперименты подтвердили этот вывод. Регенерация сердца у мышей с искусственно нарушенной работой гормонов щитовидной железы оказалась весьма активной. Например, это отмечалось у генетически модифицированных животных, у которых в клетках сердца отсутствовали рецепторы к тиреоидным гормонам. А у рыбок данио рерио (в норме они могут восстанавливать до 20% ампутированного сердца), которым вводили лишние гормоны, эта способность, наоборот, нарушилась [32]:
Потеря регенеративной способности сердца у взрослых млекопитающих вызвана повышением уровня тиреоидных гормонов и может быть жертвой ради приобретения теплокровности…
… Для первых млекопитающих теплокровность оказалась более выгодна, чем сохранение регенеративного потенциала. Но теперь, когда достижения современной медицины позволяют нам жить дольше, утрата регенерации превратилась в проблему, ставшую основной причиной болезней сердца.
Увеличение размеров тела
Связь между размерами тела и способностью к регенерации можно объяснить буквально на пальцах. Чем больше животное, тем больше у него размеры отдельных органов и частей тела. Чтобы их восстанавливать, клетки должны много раз делиться. А чем больше клеточных делений, тем выше риск, что что-то пойдет не так, возникнут ошибки при копировании ДНК, приводящие к опасным мутациям, и клетка станет злокачественной. К тому же работу многих клеток надо как-то координировать, чтобы они нарастали не аморфной массой, а восстановили прежнюю структуру. Нужны сложные механизмы регуляции — тем сложнее, чем больший объем необходимо восстановить.
В целом можно сказать, что жизнь многоклеточного крупного животного — это балансирование между двумя концами палки. На одном конце дифференциация, старение и гибель клеток, на другом — риск развития злокачественных опухолей из-за того, что клетки становятся менее дифференцированными и более живучими. А где-то посередине на этой палке, вероятно, находится способность к регенерации. О том, какие механизмы противораковой защиты работают в клетках крупных животных, мы рассказывали в статье «Невыдуманная басня о слоне, ките и раке: как гиганты животного мира защищаются от онкологических заболеваний» [33].
Чем больше утраченная часть тела, тем больше рана. А значит, сложнее происходит реэпителизация — восстановление эпителия. И это тоже затрудняет регенерацию [21]. Учитывая всё это, неудивительно, что рекордсменами регенерации среди млекопитающих стали не гиганты слоны или носороги, а миниатюрные иглистые мыши.
Существует четкая отрицательная зависимость успешности регенерации от размеров тела. Так, небольшие саламандры эффективно восстанавливают поврежденные конечности, в то время как саламандры среднего и крупного размера уже способны лишь к частичной регенерации, у гигантской японской саламандры конечность вовсе не восстанавливается. Можно провести параллели между регенерацией конечностей из бластемы у взрослых особей и формированием конечностей из зачатков у эмбрионов. Дело в том, что почки конечностей у эмбрионов всех животных, даже слонов и китов, всегда меньше миллиметра. В таких небольших масштабах можно эффективно и стабильно выстроить морфогенетические диффузионные градиенты — своего рода рельсы, направляющие развитие конечностей. Соответственно размер формирующейся бластемы при регенерации имеет критическое значение. Чем он больше, тем сложнее задача регулировки морфогенами. Правильно „двигать“ большие массивы клеток тяжелее. А ведь у человека даже культя мизинца много больше миллиметра
Кератинизация кожных покровов
Особенности кожи анамний заключаются в том, что она состоит из относительно малого числа слоев, и в ней есть особые железы, вырабатывающие антимикробные соединения для защиты от инфекций. Кожа млекопитающих сильно меняется в ходе эволюции, она становится многослойной, а наружный ее слой ороговевает (за счет процессов кератинизации). И в этом есть смысл. Роговой слой эпителия защищает более глубокие слои кожи от механических повреждений, помогает сохранить в них влагу, не дает проникать болезнетворным бактериям. Но одновременно из-за кератинизации нарушается эпителизация ран, и это мешает обеспечить такую же регенерацию, как у амфибий.
У млекопитающих в коже нет, как у анамний, желез, вырабатывающих антимикробные агенты и уменьшающих воспаление, а вместо них от инфекций защищают иммунные механизмы. Выше мы уже подробно поговорили о том, как они затрудняют регенерацию.
Метаморфозы и способность к регенерации
Одна из примечательных особенностей животных с широкими регенеративными возможностями состоит в том, что многие из них проходят в своем развитии личиночную стадию, а потом, в процессе превращения во взрослую особь, их тело претерпевает кардинальные изменения — происходит метаморфоз. В частности, это касается амфибий.
Действительно, считается, что способность к регенерации была утрачена далекими предками млекопитающих, когда они окончательно вышли на сушу (рис. 10), и одновременно в их жизни пропала личиночная стадия. Произошло это во время каменноугольного периода.
Когда ученые стали анализировать геномы разных животных в надежде разобраться, почему произошли такие изменения, было замечено, что процессы, связанные с регенерацией и метаморфозом, регулируются разными генами, работающими сообща и организованными в сложные системы — генные сети (рис. 15). Предположительно существует несколько генных сетей: одни включаются во время эмбрионального развития; другие — на личиночной стадии, во время метаморфоза и роста; третьи — у взрослых особей. Эти сети частично накладываются друг на друга, и некоторые животные умеют «переключать» их так, чтобы восстанавливать утраченные части тела [34].
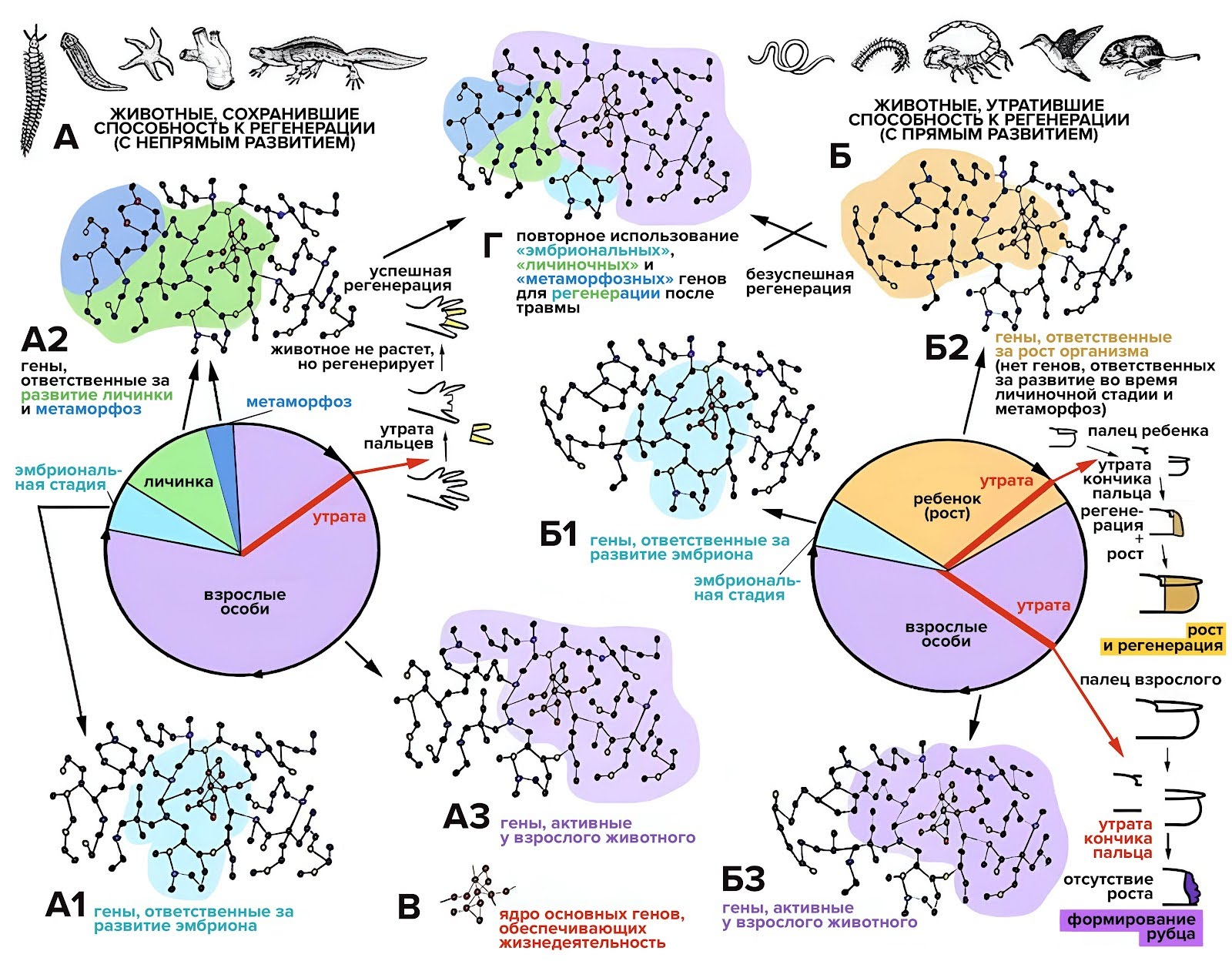
Рисунок 15. Гипотетическая связь между метаморфозами и регенерацией, обусловленная особенностями строения и функционирования «генных сетей». Буквой A обозначены животные, у которых есть личиночная стадия, происходит метаморфоз и выражена способность к регенерации, а буквой Б — животные, у которых всего этого нет. В каждой генной сети есть так называемое центральное ядро: эти гены критически важны для поддержания жизнедеятельности и функционируют на всех стадиях жизненного цикла (они обозначены буквой В). В группе A сначала работает группа генов, необходимых для развития эмбриона (A1). Затем некоторые из них продолжают работать на стадии личинки и во время метаморфоза (A2), а параллельно включаются новые. У взрослой особи (A3) активна своя генетическая сеть, которая также включает как ранее работавшие, так и вновь активированные гены. Когда у взрослой особи происходит травма (например, ампутация пальцев или конечности), она может повторно использовать (реактивировать) эмбриональные, личиночные и гены метаморфоза, чтобы восстановить утраченную часть тела (Г). У животных из группы Б после завершения эмбрионального развития (Б1) наступает фаза роста (Б2), и во время нее активируются по большей части другие гены. Во взрослом возрасте начинает работать третья генетическая сеть (Б3). У этих животных нет личиночной стадии, и они не претерпевают метаморфоз, поэтому у них нет и генов, которые они могли бы впоследствии использовать для регенерации.
Если теперь попытаться перейти в прикладную плоскость, то эта информация сильно усложняет картину. Выше мы перечисляли некоторые гены, которые есть у анамний, отсутствуют у амниот, и они критически важны для регенеративных процессов. Теперь же мы имеем целые генные сети — сложную мозаику. В клетках живого организма могут присутствовать многие гены, необходимые для регенерации, но если мозаика «не складывается» в единое целое — они всё равно не будут регенерировать.
Если теперь попытаться перейти в прикладную плоскость, то эта информация сильно усложняет картину. Выше мы перечисляли некоторые гены, которые есть у анамний, отсутствуют у амниот, и они критически важны для регенеративных процессов. Теперь же мы имеем целые генные сети — сложную мозаику. В клетках живого организма могут присутствовать многие гены, необходимые для регенерации, но если мозаика «не складывается» в единое целое — они всё равно не будут регенерировать.
А если изменить всего один компонент, то может «посыпаться» вся система. Например, во время одного из экспериментов, когда ученые вводили рыбкам данио рерио регуляторные и кодирующие последовательности человеческого гена-супрессора опухолевого роста ARF, он подавлял регенерацию ампутированных плавников [34], [36].
В итоге восстановление способности к регенерации у млекопитающих и человека становится весьма сложной задачей. Нужна тонкая настройка целой системы генов. Некоторые исследователи, которые занимаются концепцией генных сетей, считают, что наиболее реалистичным решением в регенеративной медицине является создание искусственных органов и частей тела с помощью биоинженерных технологий [34]. Впрочем, такого мнения придерживаются не все.
При чем тут выход на сушу?
Жизнь на Земле зародилась более 3,7 миллиардов лет назад, но только 500 миллионов лет назад животные начали осваивать сушу. Более трех миллиардов лет они не вылезали из воды, и на то были причины: условия на поверхности, особенно в жаркой, засушливой местности, сильно отличаются, и к ним еще нужно было приспособиться. В итоге организм наших далеких прапрапрадедушек и прапрапрабабушек, решивших попытать счастья вдали от водоемов, претерпел сильные изменения.
Условия для регенерации в воде весьма благоприятны: чтобы успешно сформировалась бластема, и в дальнейшем восстановилась первоначальная структура, ткани должны быть достаточно гидратированы (увлажнены). На суше с этим зачастую проблемы. Бластема быстро теряет жидкость. Чтобы сохранить ценную влагу и предотвратить в ране опасные инфекции, лучше подходит заживление через рубцевание. Грубо, зато быстро и надежно.
Да, потеря способности к регенерации — это врожденное свойство, обусловленное генетически, и тому есть масса подтверждений. Но, согласно распространенной гипотезе, движущей силой естественного отбора в этом направлении, вероятно, стала необходимость приспосабливаться к суровым условиям жизни на суше [35].
Плата за возможность летать?
У птиц с регенерацией совсем плохо. И это притом, что некоторые представители их ближайших родственников — рептилий — умеют отращивать целые хвосты взамен утраченных (хотя и неполноценные, но всё же). Пока ученые затрудняются сказать точно, почему природа так обделила пернатых. Есть предположение, что утрата регенерации стала платой за способность летать. Подтверждение: аналогичная ситуация наблюдается и у летающих млекопитающих — рукокрылых.
Не всё потеряно
Сравнивая млекопитающих с анамниями, мы несколько раз повторяли, что они утратили способность к регенерации. На самом деле, конечно же, не утратили полностью, просто она свелась к минимуму. Физиологическая регенерация по-прежнему с нами: на протяжении жизни у человека обновляются ткани и органы, у женщин регулярно восстанавливается слизистая оболочка матки после месячных. В плане репаративной регенерации у людей тоже кое-что сохранилось:
- Во многих органах происходит компенсаторная регенерация. О печени мы уже упоминали выше. Компенсаторная гиперплазия (когда в ткани увеличивается количество клеток) также возможна в коже, кишечнике, красном костном мозге. Поджелудочная и щитовидная железы, почки, надпочечники и легкие тоже могут увеличиться, если их часть была повреждена или удалена, но их возможности по сравнению с печенью более скромные.
- У человека возможна эпиморфная регенерация кончиков пальцев. Принято считать, что это происходит только у детей, но есть научные публикации, в которых описывается, как кончики пальцев восстанавливались и у взрослых пациентов, в том числе у людей в возрасте 50+ [37], [38]. Кстати, почитайте: «Регенерация на кончиках пальцев» [39].
- О том, что у человека могут зарастать отверстия в барабанной перепонке, и этот процесс сильно напоминает эпиморфную регенерацию, мы уже упоминали выше. В практике ЛОР-врачей это происходит у большинства пациентов, но не у всех [19], [40].
- В большинстве случаев «бесшовно» (без образования рубцов) срастаются кости после переломов. Причем заживление происходит так же, как когда-то сформировались костные структуры у плода, и в этом процессе важную роль играет надкостница. Впоследствии место заживления практически ничем не отличается от окружающей здоровой ткани. Процесс этот сложный, происходит в несколько этапов, в нем участвуют цитокины и сигнальные молекулы, разные типы клеток. На стадии формирования костной мозоли фибробласты из надкостницы синтезируют компоненты внеклеточного матрикса и превращаются в клетки костной ткани — остеобласты. Сначала образуется мягкая хрящевая мозоль, а потом она постепенно оссифицируется (окостеневает) [41], [42].
- Определенной способностью к регенерации обладают периферические нервы. Помогают им в этом шванновские клетки, образующие их оболочку. Скорость роста поврежденных нервов у человека составляет около 1 миллиметра в день. А если концам мешает срастись слишком большой зазор между ними или рубец, то могут помочь хирурги.
- Очень ограниченной способностью к регенерации обладает сердечная мышца — миокард. У взрослых после гибели ее участка в результате инфаркта на сердце остается рубец. У новорожденных регенеративный потенциал миокарда выше. Недавно ученые разобрались в причинах: оказывается, макрофаги у новорожденных активно занимаются эффероцитозом — поглощением отмерших клеток. Параллельно они синтезируют соединение под названием тромбоксан A2. Оно стимулирует размножение клеток сердца [43].
Как использовать наш оставшийся ресурс?
Как видно из вышеизложенного, некоторые механизмы репаративной регенерации у человека всё же сохранились. А это означает, что можно попробовать искусственно их усилить и развить.
Есть три столпа восстановления утраченных органов и частей тела: протезирование, трансплантация и регенерация. В двух первых наука и медицина продвинулись весьма далеко, а вот для того, чтобы развить регенеративные технологии, предстоит еще много работы.
На этом пути исследователи сталкиваются с немалыми сложностями. За регенерацию у анамний отвечают довольно сложные генетические сети. Не все отдельные гены изучены, а если всё же их полностью изучить и вносить изменения, то легко ненароком «поломать» всю сеть и нарушить другие важные функции. Серьезным ограничением являются и относительно большие размеры тела у человека.
Поэтому пока сложно ответить, что перспективнее: «выращивать» для человека новые органы «в пробирке», а потом проводить трансплантацию; или «отращивать» их прямо внутри организма. Второй путь был бы более физиологичным. Очевидно, полного эволюционного запрета на регенерацию у людей нет, и это хорошая новость. Вероятно, стоит работать в двух направлениях:
- если в каком-то месте обнаружен механизм, блокирующий регенерацию, то его нужно снять (но аккуратно — так, чтобы не «задеть» другие важные биологические процессы);
- если блока нет, а просто что-то не работает — активировать, ввести вещество, работающее как агонист.
Думаю, были бы более актуальны технологии, когда в чашке Петри выращивают несколько бластем, затем их объединяют, обеспечивают навигацию с помощью сигнальных молекул, объединяют их в одну большую бластему и пересаживают ее на культю. Пока сложно сказать, получится ли реализовать что-то подобное. В целом я оптимистично смотрю на идею о том, что когда-нибудь мы сможем восстановить способность человека к регенерации с помощью генной терапии. Видимо, для этого придется оперировать большими массивами данных, проводить тонкую настройку механизмов регуляции размножения клеток и бороться с последствиями в виде злокачественных опухолей.
Проявляя здоровый скепсис, всё же в будущее можно смотреть с оптимизмом. Да, на данный момент ученые не знают, как запустить процесс регенерации конечностей или органов у человека, чтобы всё сработало эффективно и правильно. Сейчас это кажется чем-то из категории научной фантастики. Но если обернуться и вспомнить, что было лет 20 назад, то мы увидим, что многие современные технологии в то время тоже показались бы нам фантастическими. Никто не знает наверняка, какие сюрпризы наука преподнесет нам через десять, пятьдесят, сто лет.
Литература
- Не можешь излечить — восстанови! Как появилась регенеративная медицина и какие у нее возможности сегодня;
- Lorenzo Alibardi. (2024). Regeneration Abilities among Extant Animals Depend on Their Evolutionary History and Life Cycles. JDB. 12, 8;
- Gilbert S. Developmental Biology. 6th edition. Sunderland (MA): Sinauer Associates, 2000;
- David L. Stocum. (2017). Mechanisms of urodele limb regeneration. Regeneration. 4, 159-200;
- Kiyokazu Agata, Yumi Saito, Elizabeth Nakajima. (2007). Unifying principles of regeneration I: Epimorphosis versus morphallaxis. Dev Growth Differ. 49, 73-78;
- Ashley W. Seifert, Ken Muneoka. (2018). The blastema and epimorphic regeneration in mammals. Developmental Biology. 433, 190-199;
- Jennifer Simkin, Mimi C. Sammarco, Lindsay A. Dawson, Paula P. Schanes, Ling Yu, Ken Muneoka. (2015). The mammalian blastema: regeneration at our fingertips. Regeneration. 2, 93-105;
- Neemat Mahmud, Christine Eisner, Sruthi Purushothaman, Mekayla A. Storer, David R. Kaplan, Freda D. Miller. (2022). Nail-associated mesenchymal cells contribute to and are essential for dorsal digit tip regeneration. Cell Reports. 41, 111853;
- Ashley W. Seifert, Ken Muneoka. (2018). The blastema and epimorphic regeneration in mammals. Developmental Biology. 433, 190-199;
- Ashley W. Seifert, Stephen G. Kiama, Megan G. Seifert, Jacob R. Goheen, Todd M. Palmer, Malcolm Maden. (2012). Skin shedding and tissue regeneration in African spiny mice (Acomys). Nature. 489, 561-565;
- Иглистые мыши и их уникальные способности к регенерации;
- Janak Gaire, Justin A. Varholick, Sabhya Rana, Michael D. Sunshine, Sylvain Doré, et. al.. (2021). Spiny mouse (Acomys): an emerging research organism for regenerative medicine with applications beyond the skin. npj Regen Med. 6;
- Jason Orr Brant, Maria-Cecilia Lopez, Henry V. Baker, W. Brad Barbazuk, Malcolm Maden. (2015). A Comparative Analysis of Gene Expression Profiles during Skin Regeneration in Mus and Acomys. PLoS ONE. 10, e0142931;
- Jennifer Simkin, Ashley W. Seifert. (2018). Concise Review: Translating Regenerative Biology into Clinically Relevant Therapies: Are We on the Right Path?. Stem Cells Translational Medicine. 7, 220-231;
- Thomas R. Gawriluk, Jennifer Simkin, Katherine L. Thompson, Shishir K. Biswas, Zak Clare-Salzler, et. al.. (2016). Comparative analysis of ear-hole closure identifies epimorphic regeneration as a discrete trait in mammals. Nat Commun. 7;
- Факты и легенды о мультиомиксных технологиях;
- В объятиях Железной Няньки;
- Aaron Gabriel W. Sandoval, Malcolm Maden. (2020). Regeneration in the spiny mouse, Acomys, a new mammalian model. Current Opinion in Genetics & Development. 64, 31-36;
- Sonia M. Scaria, Stacey M. Frumm, Ellee P. Vikram, Sarah A. Easow, Amar H. Sheth, et. al.. (2023). Epimorphic regeneration in the mammalian tympanic membrane. npj Regen Med. 8;
- Michael Zasloff. (2011). Observations on the Remarkable (and Mysterious) Wound-Healing Process of the Bottlenose Dolphin. Journal of Investigative Dermatology. 131, 2503-2505;
- Siiri E. Iismaa, Xenia Kaidonis, Amy M. Nicks, Nikolay Bogush, Kazu Kikuchi, et. al.. (2018). Comparative regenerative mechanisms across different mammalian tissues. npj Regen Med. 3;
- Can Aztekin, Mekayla A. Storer. (2022). To regenerate or not to regenerate: Vertebrate model organisms of regeneration‐competency and ‐incompetency. Wound Repair Regeneration. 30, 623-635;
- Модельные организмы: ксенопус;
- John Gerhart, Marc Kirschner. (2020) Normal Table of Xenopus Laevis (Daudin);
- Лаборатория молекулярных основ эмбриогенеза: от гена к признаку;
- Anastasiya S. Ivanova, Igor N. Shandarin, Galina V. Ermakova, Andrey A. Minin, Maria B. Tereshina, Andrey G. Zaraisky. (2015). The secreted factor Ag1 missing in higher vertebrates regulates fins regeneration in Danio rerio. Sci Rep. 5;
- Maria B. Tereshina, Anastasiya S. Ivanova, Fedor M. Eroshkin, Daria D. Korotkova, Alexey M. Nesterenko, et. al.. (2019). Agr2‐interacting Prod1‐like protein Tfp4 from
Xenopus laevis is necessary for early forebrain and eye development as well as for the tadpole appendage regeneration. Genesis. 57; - Anastasiya S. Ivanova, Maria B. Tereshina, Karina R. Araslanova, Natalia Y. Martynova, Andrey G. Zaraisky. (2021). The Secreted Protein Disulfide Isomerase Ag1 Lost by Ancestors of Poorly Regenerating Vertebrates Is Required for Xenopus laevis Tail Regeneration. Front. Cell Dev. Biol.. 9;
- Anastasiya S. Ivanova, Daria D. Korotkova, Galina V. Ermakova, Natalia Yu. Martynova, Andrey G. Zaraisky, Maria B. Tereshina. (2018). Ras-dva small GTPases lost during evolution of amniotes regulate regeneration in anamniotes. Sci Rep. 8;
- Daria D. Korotkova, Vassily A. Lyubetsky, Anastasia S. Ivanova, Lev I. Rubanov, Alexander V. Seliverstov, et. al.. (2019). Bioinformatics Screening of Genes Specific for Well-Regenerating Vertebrates Reveals c-answer, a Regulator of Brain Development and Regeneration. Cell Reports. 29, 1027-1040.e6;
- Загадочный кальциевый язык;
- Kentaro Hirose, Alexander Y. Payumo, Stephen Cutie, Alison Hoang, Hao Zhang, et. al.. (2019). Evidence for hormonal control of heart regenerative capacity during endothermy acquisition. Science. 364, 184-188;
- Невыдуманная басня о слоне, ките и раке: как гиганты животного мира защищаются от онкологических заболеваний;
- Lorenzo Alibardi. (2023). Regeneration or Scarring Derive from Specific Evolutionary Environmental Adaptations of the Life Cycles in Different Animals. Biology. 12, 733;
- Lorenzo Alibardi. (2023). Regeneration among animals: An evolutionary hypothesis related to aquatic versus terrestrial environment. Developmental Biology. 501, 74-80;
- Robert G Hesse, Gayle K Kouklis, Nadav Ahituv, Jason H Pomerantz. (2015). The human ARF tumor suppressor senses blastema activity and suppresses epimorphic tissue regeneration. eLife. 4;
- Schultz J., Schröttner P., Leupold S. (2018). Conservative treatment of fingertip injuries in children - first experiences with a novel silicone finger cap that enables woundfluid analysis. GMS Interdiscip Plast Reconstr Surg DGPW. 19;
- Paris Jafari, Camillo Muller, Anthony Grognuz, Lee Applegate, Wassim Raffoul, et. al.. (2017). First Insights into Human Fingertip Regeneration by Echo-Doppler Imaging and Wound Microenvironment Assessment. IJMS. 18, 1054;
- Регенерация на кончиках пальцев;
- David Holmes. (2017). Eardrum regeneration: membrane repair. Nature. 546, S5-S5;
- Sheen J., Mabrouk A., Garla V. Fracture Healing Overview. StatPearls, 2023;
- Rozalia Dimitriou, Elena Jones, Dennis McGonagle, Peter V Giannoudis. (2011). Bone regeneration: current concepts and future directions. BMC Med. 9;
- Connor Lantz, Amanda Becker, Matthew DeBerge, Mallory Filipp, Kristofor Glinton, et. al.. (2025). Early-age efferocytosis directs macrophage arachidonic acid metabolism for tissue regeneration. Immunity. 58, 344-361.e7;
- Музыка регенерации. Секретóм как основа бесклеточной терапии;
- Ганковская Л.В. (2023). Методы регенеративной медицины в урологии;
- Козлов И.Г. (2025). Лечение цистита: взгляд иммунолога. Русский медицинский журнал.;
- Кульчавеня Е.В. (2024). Что нужно изменить в лечении цистита у женщин, чтобы быстро и надолго выздороветь. Русский медицинский журнал.;
- Доброхотова Ю. (2023). Для чего Суперлимф назначают в гинекологии? Мнение эксперта. Русский медицинский журнал..






