
Не можешь излечить — восстанови! Как появилась регенеративная медицина и какие у нее возможности сегодня
26 октября 2024
Не можешь излечить — восстанови! Как появилась регенеративная медицина и какие у нее возможности сегодня
- 2540
- 2
- 8
Люди давно мечтали восстанавливать утраченные, пораженные болезнями, стареющие органы и части тела. Современная регенеративная медицина предлагает это делать с помощью генной и клеточной терапии, тканевой инженерии, использования сигнальных молекул, секретируемых клетками. Перспективы открываются грандиозные, хотя еще и остается много нерешенных проблем.
Иллюстрация Александры Мартыновой.
-
Автор
-
Редакторы
-
Рецензент
-
Иллюстратор
У каждого живого существа есть способность к регенерации, но не у всех она выражена в одинаковой степени. На фоне многих других живых существ человек в данном отношении мало чем может похвастаться. Но то, чего не дала нам природа, мы пытаемся восполнить с помощью науки и технологий. В первой статье спецпроекта, посвященного регенеративной медицине, мы поговорим о том, как она возникла, какие сейчас в ней есть направления и какие сложности еще предстоит преодолеть.

Регенеративная медицина

Медицина без преувеличения преобразила жизнь всего человечества, позволив спасать от ран и лечить от болезней, в том числе — в недавнем прошлом неизлечимых. И хотя ее развитие не прекращается, в отдельную новую дисциплину выделяют медицину регенеративную, цель которой — восстанавливать повреждения тканей и органов, а также продлевать их бесперебойную работу, активируя внутренний регенеративный потенциал организма. Применение в реальной клинической практике стволовых клеток и компонентов их секретома; тканевая инженерия; активация обновления и регенерации клеток — уже реальность или пока отдаленная фантастика?
Партнер проекта — российская фармацевтическая компания «Биотехфарм», занимающаяся поставкой и продвижением лекарственных средств и изделий медицинского назначения в сфере гинекологии, урологии и репродуктивной медицины. Компания продвигает высокотехнологичные препараты, в том числе на основе цитокинов, секретомов, гиалуроновой кислоты и лактобактерий.
Главные препараты компании — «Суперлимф®», созданный на кафедре иммунологии РНИМУ им. Н.И. Пирогова, применяющийся для регенеративного лечения раневых поверхностей и инфекционных заболеваний урогенитального тракта; а также средства для интимной гигиены — «Эстрогиал™» и «Ацилакт ДУО».
Способность к регенерации — фундаментальное свойство живого, которое позволяет поддерживать форму и структуру тела за счет обновления, а также полностью или частично ее восстанавливать после повреждений за счет заживления. В конечном счете это то, что делает отдельные организмы и популяции устойчивыми к суровым внешним условиям, помогает им сохраняться во времени. Регенеративные процессы можно наблюдать на всех уровнях: молекулярном, клеточном, на уровне целых органов и частей тела, а некоторые животные умеют восстанавливать даже весь организм.
Можно выделить два типа регенерации: физиологическая, которая происходит в процессе естественной жизнедеятельности и нужна для обновления тканей, и репаративная, которая включается после повреждений и утраты частей тела. Все животные наделены этим даром в разной степени. Например, раки умеют отращивать новые клешни, а саламандры способны регенерировать не только утраченные конечности, но и до 20% сердца. Животных, устроенных попроще, таких как гидры, морские звезды и планарии, можно разрезать на несколько частей и из каждой вырастет новое существо — точная копия исходного организма (рис. 1) [1, 2]. Но настоящие рекордсмены по репаративной регенерации среди многоклеточных — губки. Эти T-1000 животного мира умеют собирать себя заново даже из состояния фарша, будучи разделенными на отдельные клетки.
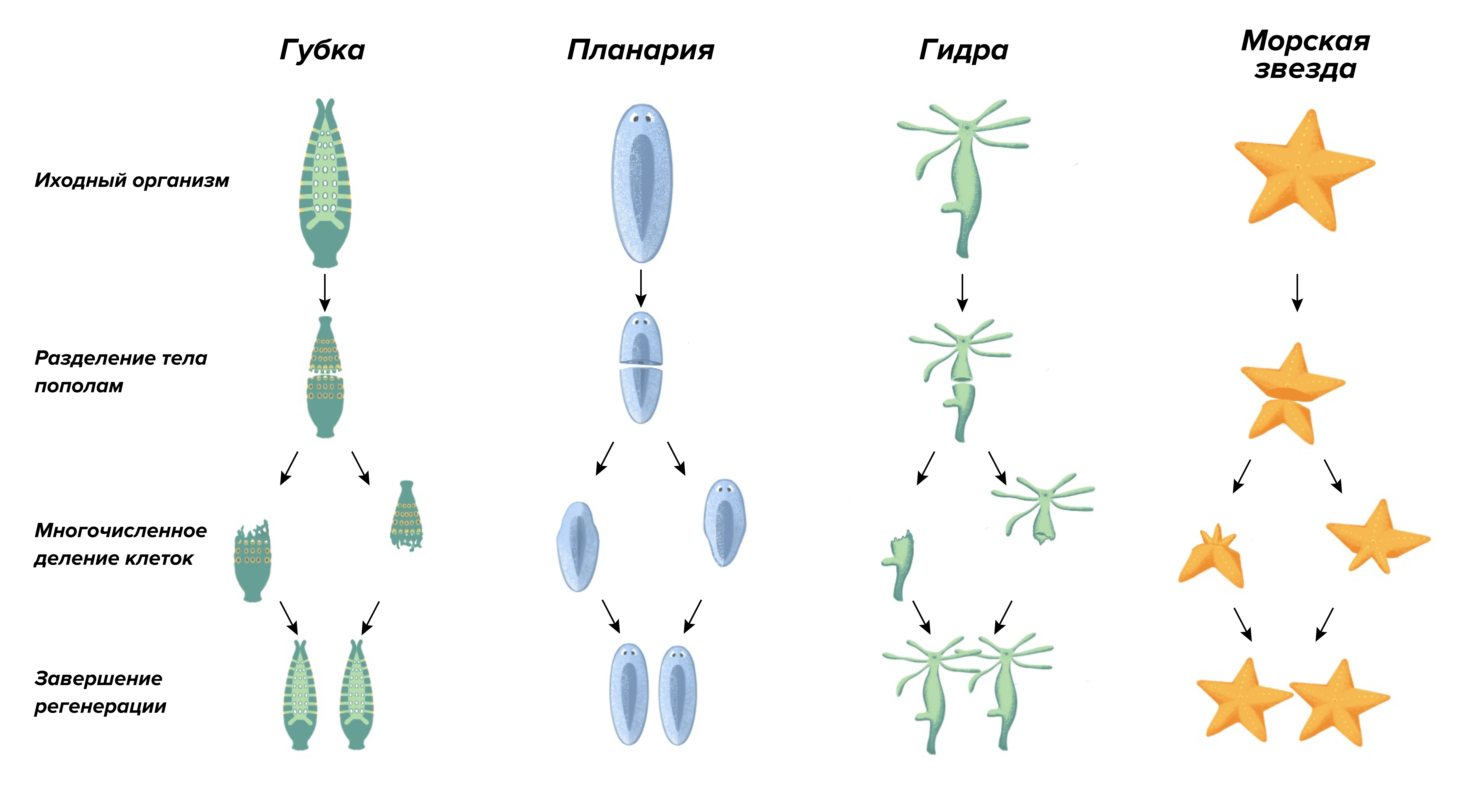
Рисунок 1. Эксперименты над мастерами регенерации: губками, планариями, гидрами и морскими звездами. Вот уж поистине смертельный номер, который способны продемонстрировать далеко не все животные.
иллюстрация Александры Мартыновой по Vedantu [1, 3, 4].
На этом фоне венец природы — человек — смотрится весьма скромно. Да, в наших клетках тоже работают довольно мощные механизмы репарации ДНК, но у некоторых животных они намного круче (например, у слонов — подробнее об этом в материале «Невыдуманная басня о слоне, ките и раке: как гиганты животного мира защищаются от онкологических заболеваний» [4]). Да, клетки в большинстве наших органов регулярно обновляются с разной скоростью (табл. 1). Но чего-то грандиозного наш организм продемонстрировать не может. Мы даже не умеем отращивать новые части тела! Восстановиться способна разве что дистальная (концевая) фаланга пальца у ребенка до 11 лет [5, 6]. В наших органах заживают раны и повреждения, вызванные болезнями, но вместо «рабочей» ткани образуется фиброзная, появляются рубцы (есть лишь некоторые исключения — например, сращение костей) [7]. И даже наша хваленая печень регенерирует не совсем по-настоящему. В ней происходит не истинная регенерация, а компенсаторная гиперплазия. Орган пытается восстановить свою функцию, но не исходную структуру [8]. О регенерации у человека можно почитать в статье «„Резервный“ механизм восстановления печени» [9].
| Тип клеток | Сроки обновления |
|---|---|
| Клетки желудка | 2–9 дней |
| Нейтрофилы крови | 1–5 дней |
| Альвеолы легких | 8 дней |
| Эпидермис кожи | 10–30 дней |
| Кроветворные стволовые клетки | 2 месяца |
| Сперматозоиды | 2 месяца |
| Клетки печени (гепатоциты) | 6–12 месяцев |
| Остеобласты в костях | 3 месяца |
| Эритроциты | 4 месяца |
| Жировые клетки | 8 лет |
| Кардиомиоциты (клетки сердечной мышцы) | 0,5–10% в год |
| Скелет в целом | 10% в год |
| Клетки хрусталика глаза и женские яйцеклетки | Один набор на всю жизнь |
Эволюция наградила людей большим и сложным мозгом, а также некоторыми другими преимуществами, но наши регенеративные возможности, как и у остальных млекопитающих, сильно ограничены. Однако большой и сложно устроенный мозг хочет всего и сразу и пытается восполнить потери на эволюционном пути с помощью науки и технологий. Начав мечтать о восстановлении утраченных частей тела и бессмертии, человечество начало длинный путь, который и привел к возникновению современной регенеративной медицины.
Древняя мифология, натурфилософия с гомункулами и, наконец, современная наука
Термин «регенеративная медицина» появился (по крайней мере, вошел в широкий обиход) совсем недавно — в 1999 году — с подачи американского ученого и бизнесмена Уильяма Хазелтайна (по другой версии, первым был футуролог Леланд Кайзер в 1992 году) [5]. Но люди еще с древних времен хорошо понимали, что такое жизнь и смерть, чем грозит обычный порез на коже, а чем — утрата части руки или ноги. И, конечно же, мечтали найти способы восстанавливать утраченное.
Начало: истоки в мифологии
Впервые идеи о регенерации появились в мифах. Самый знаменитый — миф о Прометее, титане, понесшем суровое наказание за то, что похитил огонь с Олимпа и передал его людям. Владыка богов Зевс сослал бунтаря на Кавказ и велел приковать к одной из гор. Каждую ночь прилетал огромный орел, клевал печень Прометея, а за день она успевала отрасти снова (рис. 2). Так титан, по некоторым данным, мучился целых 30 000 лет, пока его не освободил Геракл [10-12].

Рисунок 2. Тот самый Прометей и тот самый орел. Версия Питера Пауля Рубенса. А вообще этот сюжет воспроизвели многие художники.
Этот миф часто вспоминают в медицинских вузах, когда говорят о регенеративных способностях печени. Знали ли древние греки о том, что известно современным ученым? Убедительных доказательств нет. Этот мифологический сюжет совсем не нашел отражения в древнегреческих медицинских трактатах [11, 13].
Случай Прометея не уникален. У титана есть брат по несчастью (и одновременно «брат по регенерации»). О нем повествует древнегреческий миф, пересказанный Овидием в «Метаморфозах», а еще есть два упоминания в «Одиссее» Гомера [13]. Это гигант по имени Титий (рис. 3). Он понес наказание за вполне реальное и весьма подлое преступление. Титий пытался похитить и растлить возлюбленную Зевса по имени Лето, но был убит и попал в Аид. На этом его страдания не закончились, а только начались: в царстве мертвых к гиганту регулярно прилетали два стервятника и терзали его печень [11, 13]. Естественно, чтобы пытка могла повторяться раз за разом целую вечность, орган должен был регенерировать.

Рисунок 3. Очень похоже на Прометея, но на самом деле — Титий. Наказание гиганта-преступника тут изобразил Микеланджело Буонарроти. Только почему-то вместо каноничных двух стервятников художник изобразил лишь одного.
[13].
Еще дальше в своих фантазиях о возможностях регенерации пошли авторы индуистских мифов. Например, демон-асур по имени Рактабиджа был непобедим за счет того, что из каждой капли его крови вырастали клоны. Всякий, кто наносил демону рану, тем самым лишь способствовал его «размножению» (рис. 4) [12]. В Махабхарате можно найти описание процесса, напоминающего то ли регенерацию в питательной среде, то ли искусственную матку. Одна женщина после двух лет беременности родила буквально массу плоти. Мудрец разделил это нечто на сотню частей и разложил по горшкам с травами и топленым маслом. Спустя еще два года из каждого кусочка вырос человек, и так на свет появились сто братьев Кауравов [12, 14].

Рисунок 4. Непобедимый Рактабиджа. На этом изображении показано, как две богини — Дурга и Кали — всё-таки справились с коварным регенерирующим демоном. Дурга наносила раны, а Кали глотала каждую каплю крови.
Впрочем, не только древняя мифология, но и медицина тех времен могла предъявить довольно интересные вещи, которые можно рассматривать как первые попытки применения регенеративных технологий. Еще 10 000 лет назад, во времена неолита, врачеватели начали накладывать швы, чтобы ускорить заживление. Позже технологии обработки ран были усовершенствованы в Древнем Шумере, Египте, Китае, Индии, Южной Америке. Например, в 1500 году до н. э. древнеегипетские врачи лечили ранения кожи с помощью меда, жира и ворса. Каждый компонент такой повязки играл свою роль [14]:
- мед выступал в качестве антибактериального средства;
- жир создавал барьер, чтобы предотвратить проникновение патогенов;
- ворс служил каркасом, способствующим регенерации ткани.
Отцом пластической хирургии часто называют индийского врачевателя Сушруту, жившего более чем за восемь столетий до нашей эры. Он первым придумал проводить кожную пластику, использовал жировую ткань из области ягодиц и кожные трансплантаты, чтобы исправлять дефекты ушей, носа и губ [14].
Применяли в древние времена и искусственные протезы. Например, исследуя мумию женщины из Фиванского некрополя, жившей около 3000 лет назад, ученые обнаружили, что у нее был ампутирован большой палец на правой стопе, а вместо него красовался весьма реалистичный деревянный протез (рис. 5) [14, 15].

Рисунок 5. Изящная работа древних протезистов. Искусственный деревянный большой палец стопы из Древнего Египта.
Индийская Ригведа рассказывает о царице Вишпале, потерявшей ногу во время битвы и сумевшей вернуться на поле боя благодаря металлическому протезу. В 37 главе «Истории» Геродота можно найти рассказ о неком Гегесистрате, записанный примерно в 400 году до н. э. Главный герой, спасаясь из спартанского плена, отрезал себе ногу, а потом заменил ее на деревянную [14]. Протезирование зубов в древнем мире — отдельная большая тема. О подходах и наработках у разных народов можно рассказать довольно много.
Во времена «мрачного» Средневековья тоже пытались, но всё было плохо
Как и другие науки, медицина в Средние Века пришла в упадок. В те времена лучшим умам человечества было не до размышлений о пользе и перспективах регенерации, потому что на смену экспериментам и эмпирическому подходу пришел авторитет схоластики. Но некоторые любопытные истории всё же сохранились. Самая знаменитая, по преданию, произошла еще до наступления Средневековья, но сохранилась в церковной традиции, и ее главным героям посвящено немало храмов, построенных в разные времена. Эта история повествует о том, как два святых римских врачевателя Косма и Дамиан, жившие предположительно в III–IV веках н. э., выполнили трансплантацию ноги.
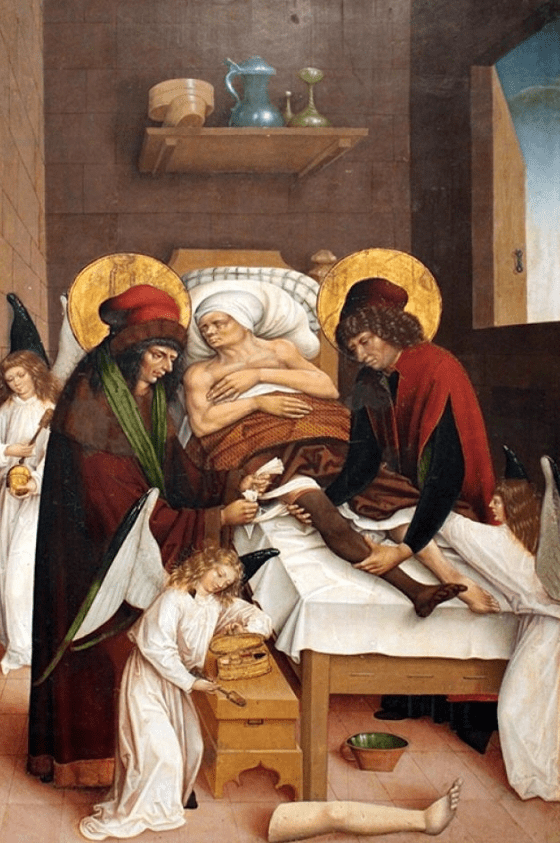
Рисунок 6. Косма и Дамиан проводят легендарное хирургическое вмешательство. Одна из многих картин, на которых запечатлен этот сюжет.
[16].
Все началось с того, что у церковного сторожа обнаружилась злокачественная опухоль правой ноги. Когда несчастный уже метался в горячечном бреду, Косма и Дамиан пришли к нему и решили провести хирургическое лечение. Они ампутировали больную ногу и пришили вместо нее новую. Трансплантат оказался необычным сразу во всех отношениях. Во-первых, ранее он принадлежал мавру. Во-вторых, ногу взяли не у живого человека, а у мертвеца, которого выкопали на кладбище (рис. 6) [16, 17].
Ближе к эпохе Возрождения многие выдающиеся умы Европы увлеклись идеей создания гомункула — искусственного человека. Истоки этого увлечения, возможно, стоит искать еще в трудах Аристотеля, утверждавшего, что главная роль в зачатии ребенка принадлежит мужской сперме. Описание процесса создания гомункула есть в арабской «Книге коровы», написанной в XIII–IX веке и часто ошибочно приписываемой Платону. На выходе, по словам автора, должно получиться «разумное животное», способное рассказывать хозяину «всё, чего нет» [18, 19].
Процесс изготовления гомункула в алхимической лаборатории описан в «Фаусте» Гёте (рис. 7) [16]:

Рисунок 7. Иллюстрация к «Фаусту». Гомункулов представляли себе по-разному. В интерпретации Гёте это маленький человечек в реторте.
[14].
Все происходившее в древние времена, Средние века и эпоху Возрождения было лишь необходимой прелюдией, первыми робкими шагами. Настоящая наука, заложившая основы современной регенеративной медицины, началась позже.
Наука приходит и берет свое
Многие исследования и открытия в биологии можно рассматривать не иначе, как камешки в фундаменте регенеративной медицины. Судьбоносным для биологической науки стало решение английского ученого Роберта Гука в 1665 году рассмотреть образец коры пробкового дуба под микроскопом. Увидев мельчайшие поры, Гук окрестил их клетками. Другие ученые продолжили исследование этого удивительного микромира и принципов его существования. В 1839 году немецкий цитолог Теодор Шванн с ботаником Маттиасом Шлейденом сформулировали клеточную теорию, позже дополненную Рудольфом Вирховым (рис. 8) [20].
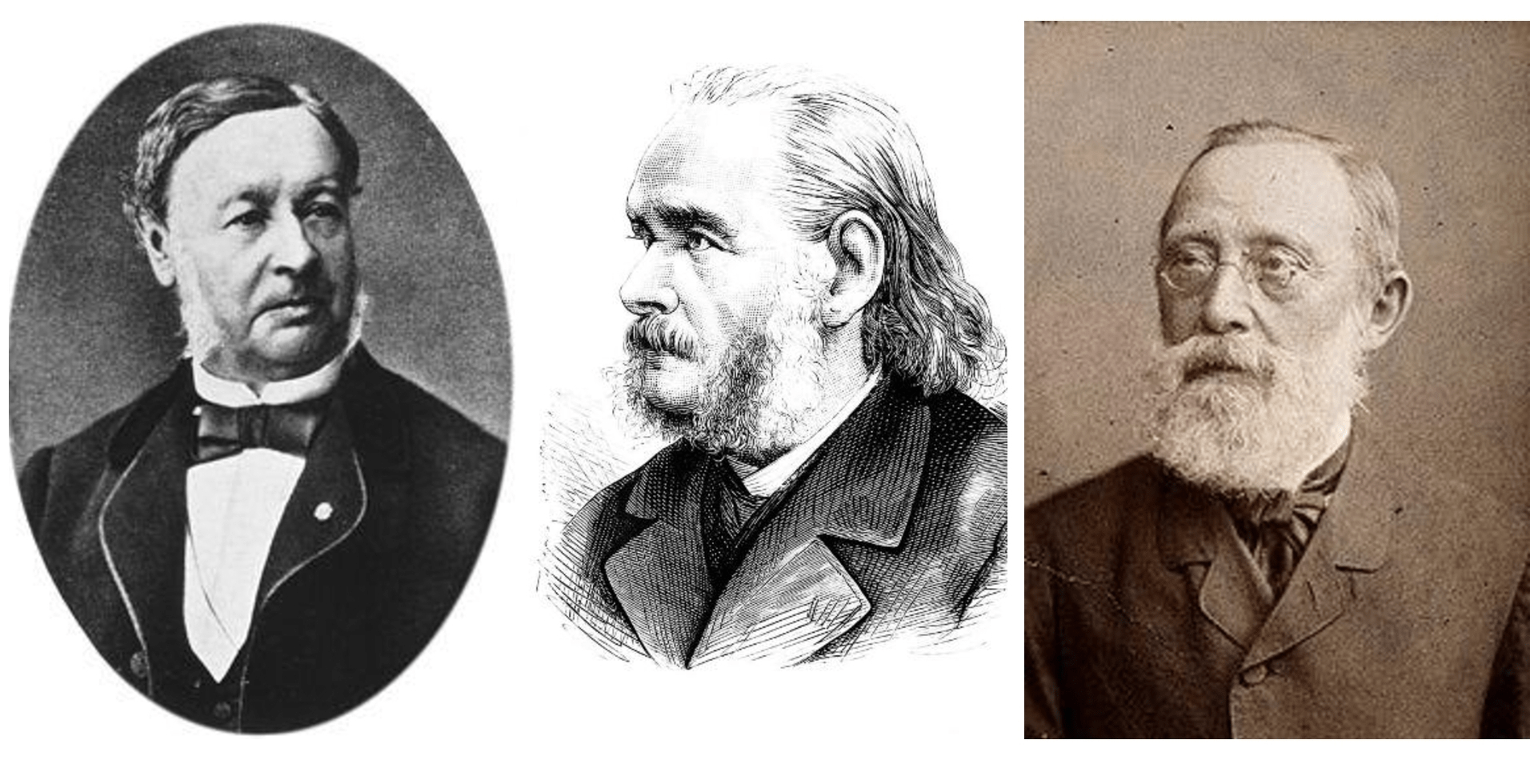
Рисунок 8. Основатели клеточной теории. Слева направо: Теодор Шванн, Маттиас Шлейден, Рудольф Вирхов.
Wikipedia.
Еще за столетие до Шванна и Шлейдена швейцарский натуралист Абраам Трамбле проводил эксперименты над гидрами. Каждый раз, когда он разрезал животное, вне зависимости от направления разреза и количества кусочков, каждая часть регенерировала в целый организм. Это в корне противоречило теории преформации, гласившей, что зародыш любого животного находится в половых клетках уже полностью сформированным, и ему остается лишь вырасти до размеров взрослой особи. В 1744 году Трамбле опубликовал результаты своих опытов. Из них выходило, что отдельные клетки обладают регенеративным потенциалом, и этот вывод оказался революционным. Прежде считалось, что регенерация — свойство целого организма, но не его отдельных частей [12, 14].
В 1858 году Рудольф Вирхов предположил, что регенерация живых тканей происходит путем клеточной пролиферации. За эту идею ухватился американско-немецкий врач Лео Лёб: в 1897 году он предложил выращивать клеточные культуры вне живых организмов, «в пробирке». Реализовать такое культивирование на практике удалось в 1910 году американскому врачу и биологу Россу Гаррисону (рис. 9) [14].

Рисунок 9. Ученые, заложившие основы культивации клеточных культур. Лео Лёб (слева) предложил выращивать живые клетки «в пробирке», а Росс Гаррисон (справа) поддержал эту идею и реализовал на практике. О том, что из этого вышло дальше, можно прочитать в статье «12 методов в картинках: клеточные технологии».
Wikipedia.
К концу XIX столетия в научной среде всё чаще стало звучать словосочетание «стволовая клетка». Оно появилось в научных работах, посвященных изучению развития и регенерации кроветворной системы. Но доказать существование этих таинственных клеток-предшественников получилось только спустя более чем полвека [14].
В середине XIX века усилиями Грегора Менделя начала делать первые шаги и генетика. Ее возможности (в том числе и применительно к регенеративной медицине) врачам и ученым еще предстояло оценить по достоинству спустя многие десятилетия.
Достижения прошлого и нынешнего столетий
За XX и начало XXI столетия биология прошла куда более длинный путь, чем за всю предшествующую историю. Рассказывая обо всех достижениях, повлиявших на развитие регенеративной медицины и приведших ее к современной парадигме, можно написать целую книгу, и не одну. Поэтому мы остановимся только на некоторых значимых вехах (рис. 10):
- 1912 год — методы культивирования тканей ex vivo хорошо известны и активно применяются.
- 1912 год — французский хирург Алексис Каррель получил Нобелевскую премию за то, что разработал метод сшивания кровеносных сосудов. Тем самым он заложил основы для трансплантации органов. Но пересаживать органы от одного человека другому еще долго не получалось, так как их отторгала иммунная система [21].
- 23 декабря 1954 года — первая успешная трансплантация почки. Операцию выполняла хирургическая бригада под руководством американского хирурга-трансплантолога Джозефа Мюррея. В качестве донора выступил однояйцевый брат-близнец пациента, и благодаря этому удалось избежать реакции отторжения [21-23].
- 1968 год — первая успешная трансплантация клеток красного костного мозга [5, 24].
- 1960-е годы — начало исследований в Бостоне, посвященных регенерации кожи и хрящевой ткани. В 1979 году появился первый ткане-инженерный продукт для лечения ожогов — «листы» из культивированных ex vivo кератиноцитов [12].
- 1978 год — обнаружены стволовые гемопоэтические клетки в пуповинной крови [5].
- 1981 год — впервые проведена трансплантация искусственной кожи при обширных ожоговых ранах [5, 25]. Трансплантат был изготовлен из пластика, коровьей ткани и акульего хряща.
- 14 сентября 1990 года — первая успешно проведенная генная терапия. Пациенткой стала четырехлетняя девочка с тяжелым комбинированным иммунодефицитом. С помощью вируса в клетки ее организма ввели нормальный ген аденозиндезаминазы (ADA) вместо дефектного, из-за которого этот фермент не вырабатывался [26, 27].
- 1996 год — впервые успешно выполнено клонирование, на свет появилась овца Долли [28].
- Август 1997 года — Управление по пищевым продуктам и лекарствам (Food and Drug Administration, FDA) в США одобрило первый препарат на основе аутологичных стволовых клеток Carticel.
- 1998 год — изучены методы выращивания эмбриональных стволовых клеток в лабораторных условиях [12].
- 1999 год — Уильям Хазелтайн во время конференции на озере Комо предложил термин «регенеративная медицина». По его задумке, это понятие должно было объединить существующие на тот момент наработки в области тканевой инженерии, трансплантации клеток, биологии стволовых клеток, биомеханического протезирования, нанотехнологий, биохимии [5].
- 1999 год — трансплантация первых искусственных мочевых пузырей, выращенных в лаборатории, при миеломенингоцеле [5, 29].
- 2004 год — возникновение концепции биопечати, после того как удалось создать систему из 12 пьезоэлектрических эжекторов, способных печатать биологические материалы путем выброса капель и воссоздавать любой рисунок [30].
- 2007 год — впервые удалось индуцировать плюрипотентность во взрослых стволовых клетках [14, 31].
- 2009 год — выращена первая искусственная печень с применением донорского материала [5, 32].
- 7 октября 2020 год — французская микробиолог Эмманюэль Шарпантье и американская биохимик и генетик Дженнифер Даудна получили Нобелевскую премию за создание эффективной технологии редактирования генов на основе механизма CRISPR/Cas9. Это весьма перспективный инструмент для генной терапии [33, 34].
- Регенеративная медицина —
- сфера, объединяющая научные исследования и технологии для восстановления или замены тканей и целых органов, пораженных в результате травм, заболеваний, возрастных изменений, врожденных аномалий.
- Старение населения. В наше время этот процесс происходит быстрее, чем когда-либо. По данным экспертов Всемирной организации здравоохранения, в 2020 году людей старше 60 лет в мире стало больше, чем детей младше 5 лет. А с 2015 по 2050 год прогнозируется рост доли людей старше 60 лет от общего населения с 12% до 22% — почти вдвое. Как следствие, увеличивается и распространенность «возрастных», хронических и дегенеративных заболеваний. В большинстве случаев при этих патологиях невозможно полностью добиться выздоровления, — можно лишь, постоянно проводя лечение, держать болезнь под контролем, тормозить ее прогрессирование и пытаться улучшить состояние пациента. Это и многие хронические сердечно-сосудистые патологии, и болезнь Альцгеймера, и сахарный диабет II типа, и поздние стадии онкологических заболеваний, и другие патологии.
Современная медицина не всесильна. Несмотря на ее грандиозные достижения, она способна помочь не всем больным. Хронические заболевания, при которых нельзя добиться выздоровления, встречаются не только у пожилых. Некоторые начинаются в молодом возрасте, например, группа генетических болезней.
Современные врачи пока еще не в силах победить фиброзный процесс. Фиброз, по своей сути, — реакция регенеративная. Так называется разрастание волокнистой соединительной ткани в ответ на повреждение. В норме с помощью фиброза органы восстанавливают сами себя после травм, воспаления и при различных патологиях. Но при определенных условиях фиброзный процесс становится чрезмерным, сам приобретает патологический характер. По статистике в современных развитых странах он становится причиной 45% смертей. Фактически, патологический фиброз можно рассматривать как регенерацию, которая пошла не по плану. Распространенные примеры — фиброз легких, цирроз печени [37, 38].
При некоторых заболеваниях с органом всё настолько плохо, что единственный доступный метод лечения — удалить его полностью или частично. Самый распространенный пример — злокачественные опухоли. Легкие, кишечник, щитовидная железа, почки и другие органы у взрослого человека не умеют восстанавливаться так же, как печень и кончики мизинцев у детей. И если без селезенки человек может в целом жить, как раньше, то без щитовидки придется постоянно принимать гормональные препараты, а без части кишки — страдать от симптомов мальабсорбции и соблюдать множество рекомендаций.
Часть проблем можно решить с помощью трансплантации донорских органов и протезирования. Но донорские органы постоянно в дефиците, который с годами только нарастает, потому что увеличивается число нуждающихся. Например, в 2022 году в листе ожидания во всем мире было 366 тысяч пациентов. Многие из них не доживают до трансплантации [39]. Не все пациенты переносят трансплантации гладко. Бывает, что пересаженный орган отказывается работать или отторгается. Что касается современных протезов, то технологии, конечно, достигли больших высот, но если бы врачи могли предложить в качестве альтернативы «вырастить» обратно «родную» часть тела, то выбор большинства пациентов был бы очевиден.
Технологии шагнули далеко вперед. Чтобы внедрять в медицине что-то принципиально новое, мало иметь потребность и желание. Нужно считаться и с возможностями. Этот фактор не раз тормозил благие начинания. Например, идея трансплантации донорских органов возникла давно, но реализовать ее мешала реакция отторжения трансплантата. Прорыв случился лишь в 80-е годы с появлением иммунодепрессанта (препарата, подавляющего иммунитет) циклоспорина [5].
В настоящее время биотехнологии достигли высокого уровня. Банальное культивирование клеток «в пробирке» уже никого не удивляет — теперь эти клетки перед тем, как возвратить в организм, можно наделить полезными свойствами, например, «научить» T-лимфоциты убивать раковые клетки. Ученые могут быстро редактировать гены с помощью CRISPR-Cas9, доставлять их в клетки живых организмов с помощью вирусов, «печатать» живые ткани на биопринтерах, вплотную подошли к тому, чтобы выращивать у людей новые зубы [40, 41].
Имея в руках подобные технологии, грех ими не воспользоваться, чтобы разработать новые методы лечения. Для того наука и предлагает новые инструменты, чтобы кто-то начал применять их для решения практических задач.
- По сравнению с искусственными конструкциями настоящие органы восстанавливают не только анатомическую структуру и механические функции, но и биологические свойства. Они кровоснабжаются, регенерируют, адаптируются к внешним условиям.
- По сравнению с трансплантатами, тканеинженерные органы могут стать более доступными и не будут вызывать реакции отторжения.
- бесклеточный матрикс мочевого пузыря
- подслизистая основа тонкого кишечника
- бесклеточный матрикс ткани кишечника
- перикард
- плацентарная мембрана
- коллаген
- фибрин
- хитозан
- альгинат
- декстран
- целлюлоза
- желатин
- фиброин
- гиалуроновая кислота
- полимолочная кислота
- полигликолевая кислота
- сополимер гликоевой-молочной кислот
- поликапролактон
- поли(копролактон-со-этилэтиленфосфат)
- полидиоксан
- полиэтиленгликоль
- поли-N-(2-гидроксиэтил)метакриламид
- поли-N-(2-гидроксипропил)метакриламид
- Липоплексы —
- комплексы катионных липосом с ДНК. В качестве переносчиков генетического материала они эффективны, универсальны, обеспечивают защиту от разрушения ферментами. Главный минус — неспецифичность доставки [75-77].
- Полиплексы —
- полимерные системы, в которых комплекс с ДНК образуется за счет электростатических взаимодействий между катионными группами полимера и отрицательно заряженными нуклеиновыми кислотами [76].
- Плазмидные векторы —
- это молекула ДНК, замкнутая в кольцо.
- Бактериальные векторы
- можно использовать двумя способами. Во-первых, существует такое явление, как бактофекция — перенос плазмид из прокариотических клеток в клетки млекопитающих. Во-вторых, геном собственных клеток человека можно вообще не трогать, а вместо этого поселить в организме бактерии, измененные методами генной инженерии, и заставить их синтезировать нужные белки. А управлять этим процессом можно извне [78, 79].
- In vivo — когда вектор (обычно вирусный) вводят сразу в организм пациента, внутривенно или непосредственно в пораженный орган.
- Ex vivo — когда генетическая модификация происходит «в пробирке». Из тела пациента извлекают клетки (например, берут кровь из вены и выделяют из нее лимфоциты), вводят в них нужные гены, размножают, а затем вводят обратно в организм [80].
- Хоуминг — этот термин также используют в зоологии и цитологии. Так же, как многие животные после миграции безошибочно находят место, где они родились, размножаются, зимуют, клетки тела человека склонны мигрировать обратно в ткани, из которых были получены.
- Дифференцировка. По мере того как стволовая клетка созревает, она приобретает определенные внешние черты и начинает выполнять определенные функции (в случае с медицинским применением — те, которые и должны обеспечить терапевтический, регенеративный эффект).
- Секреция биологически активных соединений. Это очень важный механизм, и именно он во многом обеспечивает терапевтические эффекты стволовых клеток. Таким образом, для лечения вместо клеток можно сразу использовать эти соединения. Такое направление называется бесклеточной регенеративной инженерией.
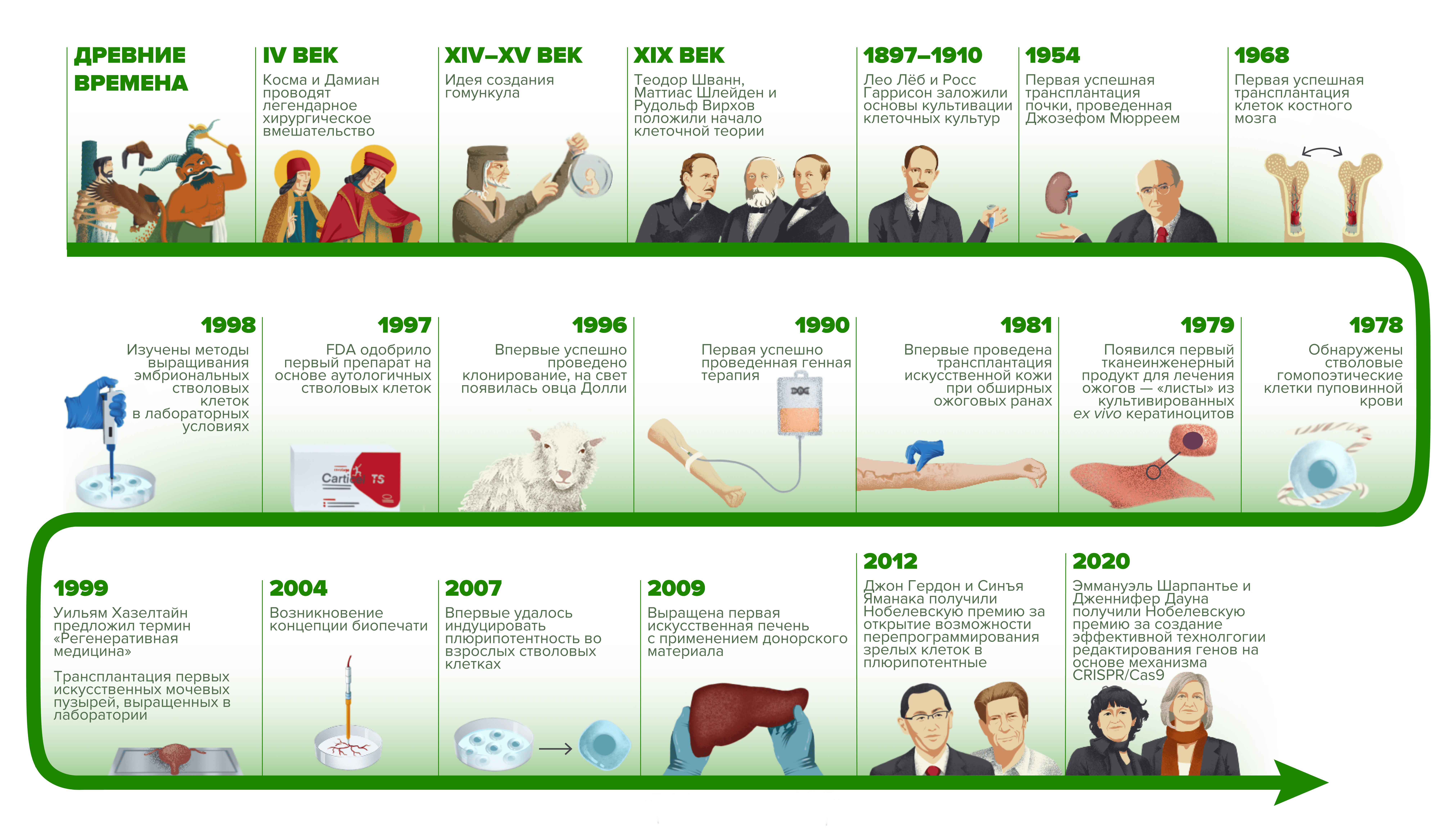
Рисунок 10. Основные вехи развития регенеративной медицины. Древние времена: регенерация в мифологии и первые попытки замещать утраченные части тела искусственными протезами. IV в н.э.: легенда о том, как Косма и Дамиан проводят трансплантацию ноги от мавра. Средние Века и Эпоха Возрождения: увлечения алхимией и созданием гомункулов. XIX в.: Теодор Шванн, Маттиас Шлейден и Рудольф Вирхов разрабатывают клеточную теорию. 1897–1910 г.: Лео Лёб и Росс Гаррисон впервые выращивают клеточные культуры «в пробирке». 23 декабря 1954 года: первая успешная трансплантация почки хирургической бригадой под руководством Джозефа Мюрреея. 1968 г.: первая успешная трансплантация клеток красного костного мозга. 1978 г.: обнаружены стволовые гемопоэтические клетки в пуповинной крови. 1979 г.: появился первый тканеинженерный продукт для лечения ожогов — «листы» из культивированных ex vivo кератиноцитов. 1981 г.: впервые проведена трансплантация искусственной кожи при обширных ожоговых ранах. 14 сентября 1990 года: первая успешно проведенная генная терапия. 1996 г.: впервые успешно выполнено клонирование, на свет появилась овца Долли. Август 1997 года: Управление по пищевым продуктам и лекарствам США одобрило первый препарат на основе аутологичных стволовых клеток Carticel. 1998 г.: изучены методы выращивания эмбриональных стволовых клеток в лабораторных условиях. 1999 г.: Уильям Хазелтайн во время конференции на озере Комо предложил термин «регенеративная медицина»; трансплантация первых искусственных мочевых пузырей, выращенных в лаборатории, при миеломенингоцеле. 2004 г.: возникновение концепции биопечати. 2007 г.: впервые удалось индуцировать плюрипотентность во взрослых стволовых клетках. 2009 г.: выращена первая искусственная печень с применением донорского материала. 2012 г.: британский биолог Джон Гердон и японский врач и ученый Синъя Яманака получили Нобелевскую премию за открытие возможности перепрограммирования зрелых клеток в плюрипотентные. 7 октября 2020 года: французская микробиолог Эмманюэль Шарпантье и американская биохимик и генетик Дженнифер Даудна получили Нобелевскую премию за создание эффективной технологии редактирования генов на основе механизма CRISPR/Cas9.
Иллюстрация Александры Мартыновой.
Регенеративная медицина сегодня
В современном мире регенеративная медицина понимается как сфера, объединяющая научные исследования и технологии для восстановления или замены тканей и целых органов, пораженных в результате травм, заболеваний, возрастных изменений, врожденных аномалий [35, 36]. Потенциальный приз в случае окончательной победы науки — возможность добиваться выздоровления при патологиях, которые в настоящее время считаются неизлечимыми или однозначно смертельными, существенно увеличить продолжительность жизни.
Четко определить границы регенеративной медицины сложно: как и многие современные направления в науке, она носит междисциплинарный характер. Фактически к ней можно отнести всё, что помогает в восстановлении тканей и органов. Но есть четыре главных столпа, четыре технологии, составляющие основу: это клеточная терапия, тканевая инженерия и искусственные органы, использование секретома клеток и генная терапия. При большом желании клонирование, протезирование, киборгизацию (в том числе нашумевшие в последние годы нейрочипы) и технологии anti-age тоже можно отнести к направлениям регенеративной медицины, но обычно их рассматривают отдельно.
Интерес к регенеративной медицине в наши дни сильно растет. Например, согласно отчету исследовательской и консалтинговой компании Allied Market Research (США), в 2023 году объем мирового рынка регенеративной медицины составил 32,1 млрд долларов США, а к 2033 году, по прогнозам, достигнет $ 531,7 B. При этом ежегодный прирост с 2024 до 2033 года составит 32,4% (рис. 11). Похожие цифры представила индийская компания Fortune Business Insights (рис. 10, 11).

Рисунок 11. Рост рынка регенеративной медицины. Общий по данным Allied Market Research (слева) и по отдельным направлениям (справа). Как видно по правой гистограмме, сильнее всего растет спрос на методы клеточной терапии и тканевой инженерии.
Иллюстрация Александры Мартыновой по отчетам Allied Market Research и BioProcess International.
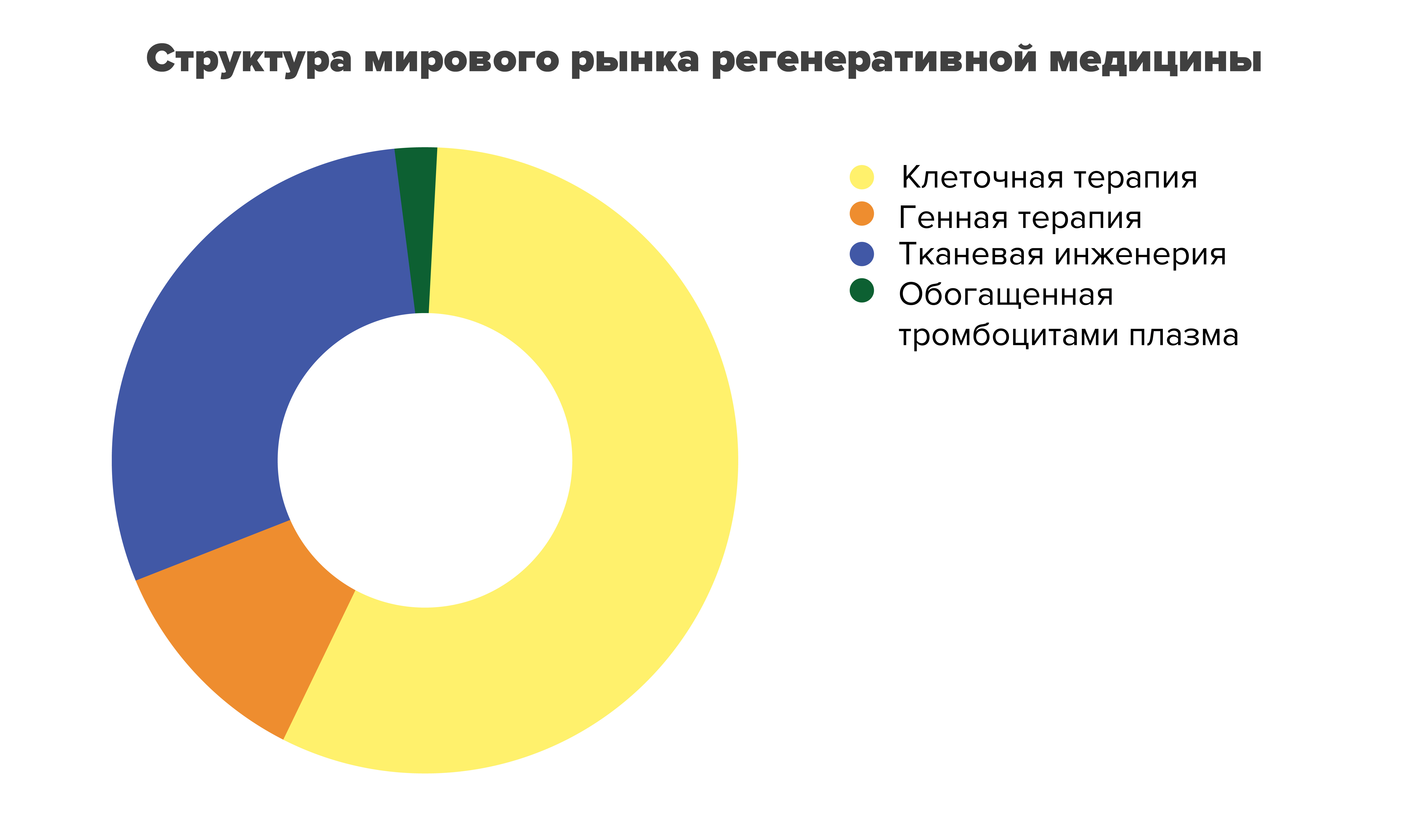
Рисунок 12. Структура мирового рынка регенеративной медицины в 2023 году по данным Fortune Business Insights. Как видно из диаграммы, лидирует клеточная терапия, на втором месте — тканевая инженерия, на третьем — генная терапия.
Иллюстрация Александры Мартыновой по отчету Fortune Business Insights.
Почему же сейчас растет популярность регенеративных технологий? Можно выделить несколько основных причин:
Четыре столпа регенеративной медицины
Рассмотрим четыре основных направления, которые лучше всего подходят для достижения целей регенеративной медицины: клеточную терапию, тканевую инженерию, генную терапию и использование секретома. А подробнее разберем эти направления в следующих статьях спецпроекта.
Клеточная терапия
Тело человека состоит примерно из 30 триллионов клеток (по некоторым данным, около 36 триллионов у мужчины весом 70 кг и около 28 триллионов у женщины весом 60 кг), сильно различающихся по строению и функциям [42]. Сложно представить, но все эти миоциты, нейроны, эпителиальные клетки, фибробласты и пр. происходят всего из одной «универсальной» клетки — зиготы. Происходит это путем дифференцировки.
Если человек всю жизнь посвятил одной профессии, то он может стать высококлассным специалистом, но с годами ему всё сложнее «начать с нуля» что-то новое. Так же и с клетками: по мере дифференцировки, специализации, у них становится всё меньше возможностей выбирать свою дальнейшую судьбу и функцию. Способность более универсальных клеток превращаться в другие, более специализированные, называется потентностью, или дифференцирующим потенциалом (рис. 13).
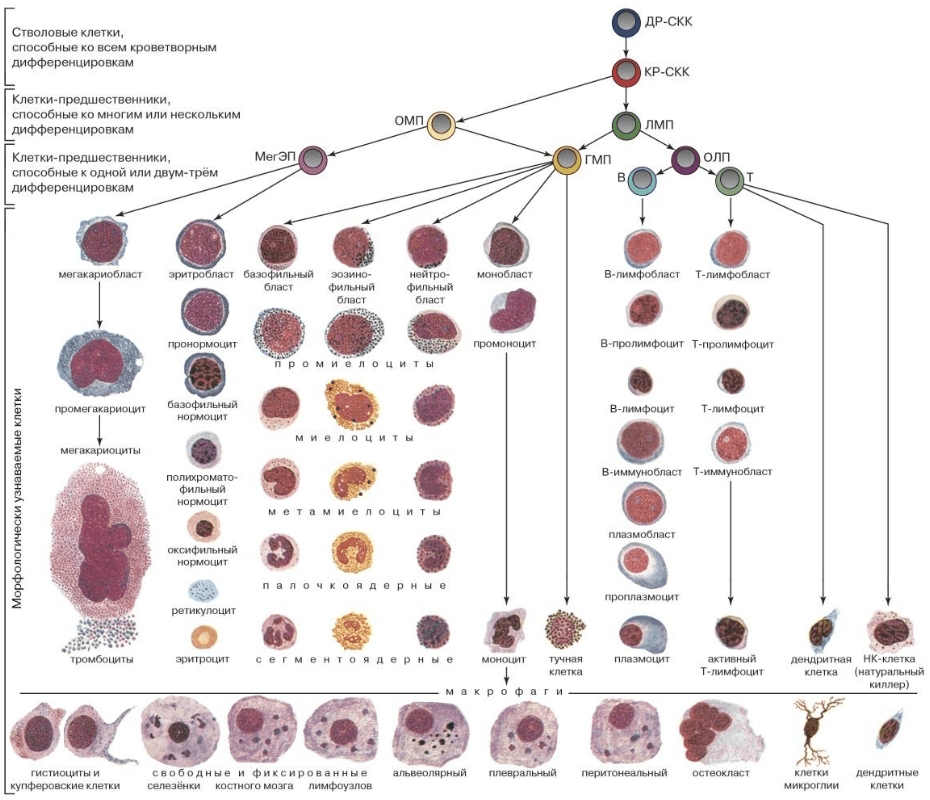
Рисунок 13. Наглядная иллюстрация потентности. Это самая знаменитая схема, на которой показано, как клетки постепенно специализируются и как меняется их потентность по мере дифференцировки, — схема гемопоэза (кроветворения).
СКК — стволовые кроветворные клетки; ДР — длительно репопулирующие клетки; КР — коротко репопулирующие клетки; ОМП — общий миелоидный предшественник; МегЭП — мегакариоцитарно-эритроидный предшественник; ЛМП — лимфомиелоидный предшественник; ГМП — гранулоцитарно-макрофагальный предшественник; ОЛП — общий лимфоидный предшественник; В — клетка-предшественник В-лимфоцитов; Т — клетка-предшественник Т-лимфоцитов.
Также предлагаем вам посмотреть очень милый комикс на эту тему: «Кем быть? Как гемопоэтическая стволовая клетка выбирает профессию» [43].
В клеточной терапии используются разные типы клеток, не только стволовые, но и зрелые, дифференцированные. В общих чертах суть методики в том, что «новые», здоровые клетки вводят в орган, поврежденный патологическим процессом или возрастными изменениями. Этот подход открывает весьма широкие перспективы в регенеративной медицине (рис. 14, 15).
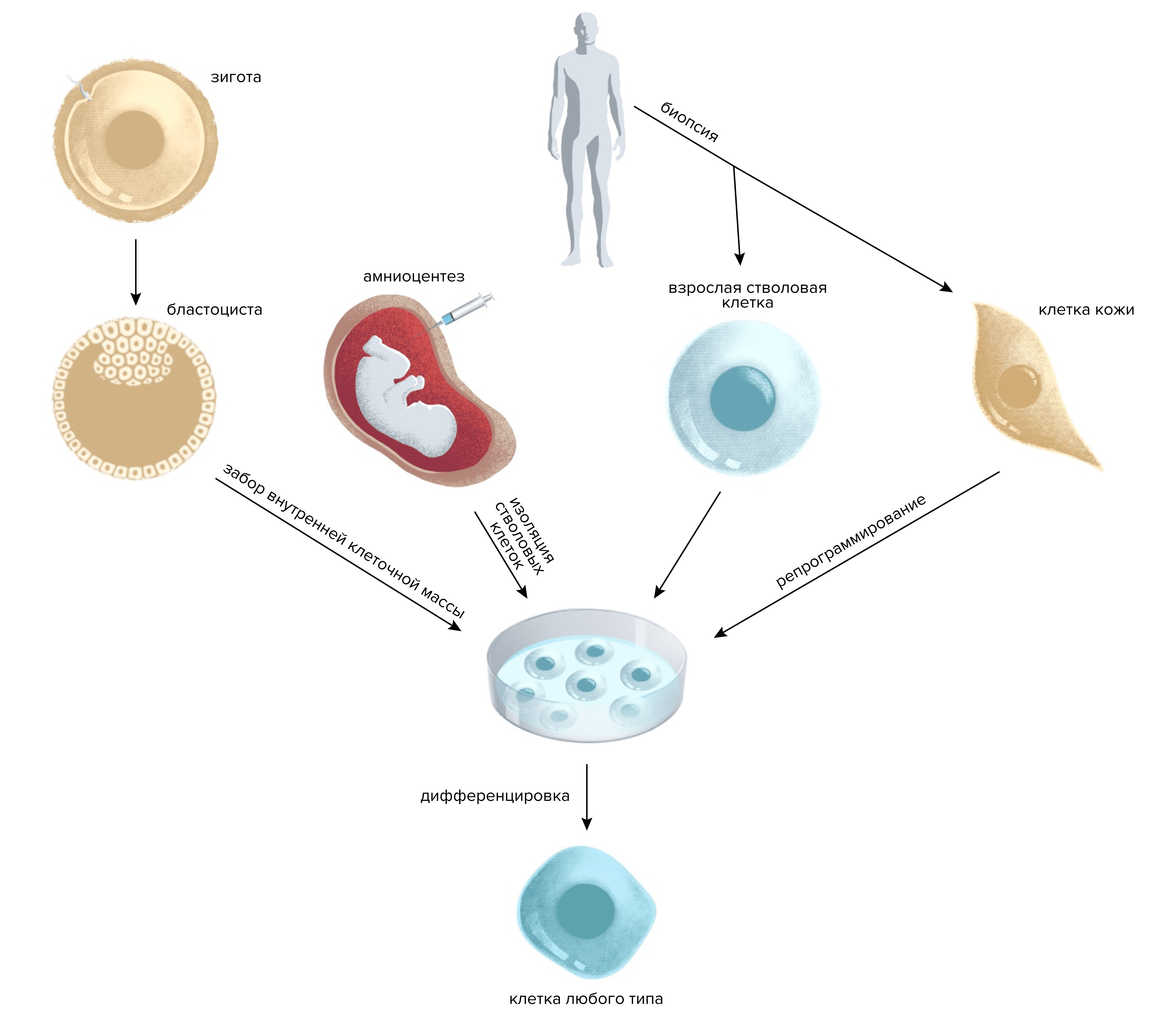
Рисунок 14. Основные типы клеток, которые используют в клеточной терапии: эмбриональные стволовые клетки, стволовые клетки, полученные из амниотической жидкости, индуцированные стволовые клетки.
Иллюстрация Александры Мартыновой по [5].
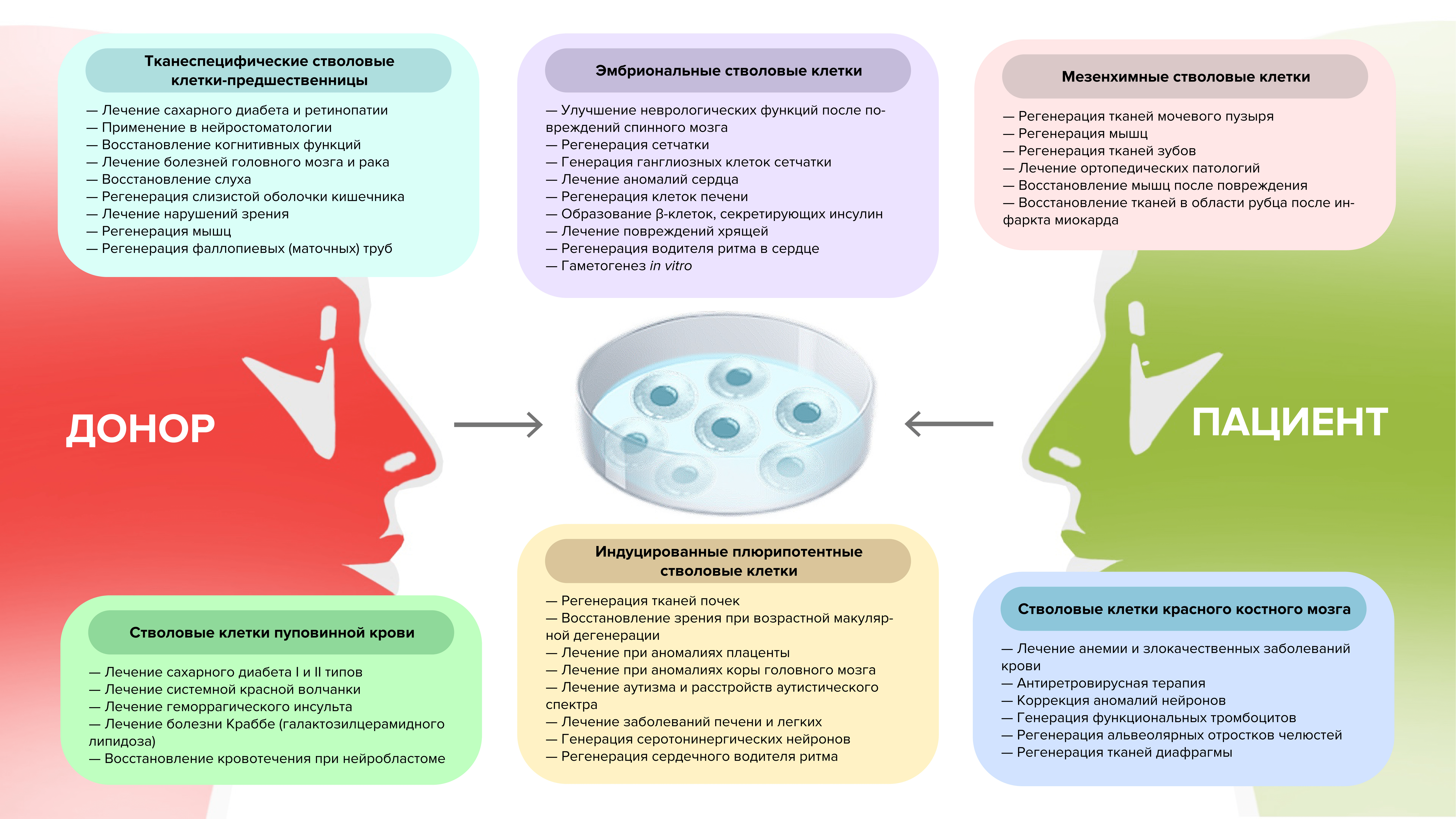
Рисунок 15. Перспективы применения разных типов стволовых клеток в регенеративной медицине. Как видно, спектр возможностей весьма широк. Осталось понять, как их эффективно внедрить в клиническую практику. Во многом это лишь вопрос времени.
Иллюстрация Александры Мартыновой по [46].
Взрослые (постнатальные) стволовые клетки удается выделить практически из всех органов взрослого человека. Их естественная функция — замещать утраченные клетки и обеспечивать обновление тканей и регенерацию после повреждений. Их потентность ограничена по сравнению с клетками эмбриона и плода, но они всё еще способны дифференцироваться в различные типы клеток, и их можно применять для лечения разных заболеваний, затрагивающих в том числе кости, хрящи, мышцы, нервную, сердечно-сосудистую систему, пищеварительный тракт, систему кроветворения. Лучше всего изучены мезенхимальные стволовые клетки, которые получают из красного костного мозга, и именно они на данный момент играют ведущую роль в клеточной терапии [5, 47, 48].
Эмбриональные стволовые клетки — плюрипотентные клетки, из которых состоит эмбрион на стадии бластоцисты до 7 дня после оплодотворения. Их получают путем аспирации внутренней клеточной массы зародыша (эмбриобласта). Если поддерживать правильные условия, то «в пробирке» эти клетки способны размножаться бесконечно и сохранять свою плюрипотентность, пока не дифференцируются. В теории получить эмбриональные стволовые клетки довольно легко: для этого можно использовать «лишние» эмбрионы, оставшиеся после экстракорпорального оплодотворения. Но этот момент вызывает массу морально-этических вопросов. Есть с эмбриональными стволовыми клетками и другие проблемы: они могут вызывать реакцию отторжения (потому что эмбрион по сути является чужеродным донором), перерождаться в тератомы, во время культивирования им нужны специальные «вспомогательные» клетки [5, 48, 49].
Стволовые клетки в амниотической жидкости (околоплодных водах) были обнаружены относительно недавно и пока еще изучены не так хорошо, как другие типы стволовых клеток. Выделяют стволовые клетки амниотической жидкости (AFSCs) и мезенхимальные стволовые клетки амниотической жидкости (AFMSCs). Получить их можно во время процедуры, которая называется амниоцентезом (выполняют с помощью иглы под контролем УЗИ), биопсии хориона (также выполняют иглой под контролем ультразвука) и из плаценты после рождения. Стволовые клетки из амниотической жидкости являются мультипотентными. Их преимущества перед эмбриональными в том, что они не образуют тератом и не требуют вспомогательных клеток во время культивирования [5, 50, 51].
Индуцированные стволовые клетки получают искусственно из дифференцированных соматических (из которых состоят ткани и органы взрослого человека), половых или других стволовых клеток. Обычно превращают соматические клетки в индуцированные плюрипотентные. Это можно сделать путем прямого перепрограммирования. Оно бывает вирусным (с применением вирусных векторов) и невирусным, с внедрением в клетку определенных генов и без него. Чаще всего перепрограммируют фибробласты, вводя в них с помощью вирусов гены факторов транскрипции [5, 52, 53].
Другой способ получить индуцированную стволовую клетку — перенести ядро соматической клетки в ооцит. Эту технологию ученые использовали, чтобы в 1996 году клонировать знаменитую овцу Долли, а впоследствии и других животных. В нашем же случае речь идет о так называемом терапевтическом клонировании. Из яйцеклетки удаляют ядро, вводят вместо него ядро соматической клетки. Затем получившийся эмбрион культивируют, но не для того, чтобы из него развился ребенок, а чтобы получить эмбриональные стволовые клетки. В отличие от «обычных» эмбриональных клеток, они будут для пациента не чужеродными, а аутологичными, как если бы полученными из его собственного организма (рис. 16) [5, 54-56].
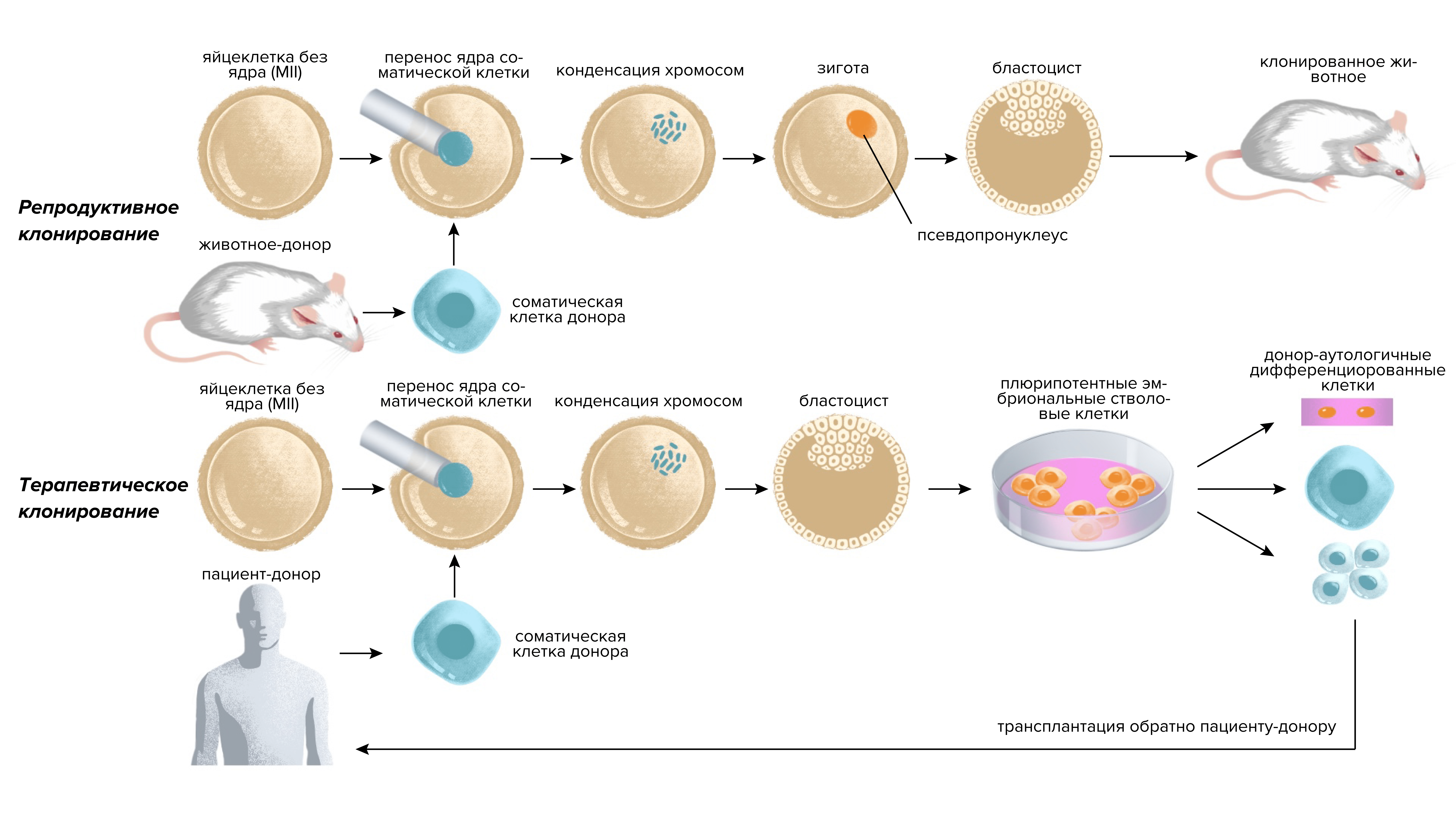
Рисунок 16. «Обычное» (репродуктивное; сверху) и терапевтическое (снизу) клонирование. Поначалу все этапы полностью совпадают, но во втором случае получается не целый организм, а эмбриональные клетки, которые можно использовать, в том числе в репродуктивной медицине.
Иллюстрация Александры Мартыновой по [54].
Как видно из описаний выше, ни один из видов стволовых клеток, полученных разными способами, не идеален. Используя имеющиеся наработки, ученые параллельно ищут и новые решения. Об одном из них мы рассказывали в материале «Эндометрий как альтернативный источник стволовых клеток» [58].
Тканевая инженерия
Идея тканевой инженерии — «выращивать» для пациентов не просто отдельные клетки, а целые новые органы. На данный момент для замещения отсутствующих частей тела широко используют искусственные имплантаты и протезы, а также донорские органы. Тканевая инженерия может предложить решение, которое лучше обоих этих вариантов:
Подробнее о тканевой инженерии можно узнать из материала «Тканевая инженерия — окно в современную медицину» [59].
Чтобы получилась полноценная живая ткань, одних только клеток недостаточно. Нужен еще специальный каркас — внеклеточный матрикс. Причем он представляет собой не просто механическую «арматуру», а среду, через которую клетки обмениваются сигнальными молекулами, факторами роста, а также депо для этих соединений.
Откуда можно взять клетки, мы уже разобрали выше. Что касается каркасов, то тут доступен широкий выбор материалов, как естественного происхождения, так и биосовместимых искусственных. Можно применить «готовое решение» прямо из организма человека: взять кусочек ткани, удалить из него клетки, а внеклеточный матрикс оставить (табл. 2).
| Бесклеточные тканевые матриксы (готовые «каркасы» из органов) | |
| Материалы натурального происхождения | |
| Искусственные биосовместимые материалы |
По сути процесс получения живой ткани сводится к тому, чтобы смешать каркас, клетки и факторы роста. Но это звучит просто только на словах. Материал, из которого сделана матрица, должен быть биоразлагаемым, безопасным, и при этом нужно, чтобы его разрушение и регенерация происходили с одинаковой скоростью. Пористость (в том числе размер пор), текстура и жесткость биоматериала — тоже важные параметры, их нужно правильно подбирать. Сделать большой кусочек ткани невозможно, если сразу не обеспечить для него адекватное кровоснабжение. Есть еще много нюансов, их помогают решать современные подходы и технологии. Например, научные исследования с применением методов тканевой инженерии пошли намного бодрее после того, как появились 3D-биопринтеры.
Еще сложнее создавать в лаборатории целые искусственные органы, состоящие из разных типов тканей: «Искусственные органы и тканевая инженерия» [60], «Органы из лаборатории» [61].
В целом в клинической практике тканевая инженерия пока еще находит весьма ограниченное применение. Тем не менее пациентам такие продукты уже доступны. Например, в мире одобрены тканеинженерные методы лечения при ранах, ожогах, язвах и других поражениях кожи, патологиях хрящей и суставов, тяжелой сердечной недостаточности, дефектах костей.
Генная терапия
Чтобы справляться с неизлечимыми заболеваниями и решать задачи регенеративной медицины, не обязательно вводить в организм человека сразу целые клетки, ткани и органы. Потенциально можно заставить функционировать как нужно то, что уже есть, подкорректировав гены. Так работает генная терапия, и она уже весьма широко применяется в клинической практике. Например, в мире одобрены продукты для лечения онкологических заболеваний, серповидноклеточной анемии, гемофилии A и B, бета-талассемии, мышечной дистрофии Дюшенна, наследственных дистрофий сетчатки, метахроматической лейкодистрофии, спинальной мышечной атрофии и др. О современных подходах к лечению мышечной дистрофии Дюшенна, в том числе о генной терапии, мы рассказывали в статье «Тяжелая жизнь без дистрофина: мышечная дистрофия Дюшенна» [62-66, 67].
Самый популярный способ ввести в клетку нужные гены — использовать вирусы (так называемые вирусные векторы), ведь они созданы для этого самой природой. Наиболее перспективны аденовирусные (самые распространенные — фигурируют в каждом пятом испытании генной терапии), аденоассоциированные вирусные (парвовирус рода Dependovirus) и ретровирусные (как правило, лентивирусные и гамма-ретровирусные) векторы. У каждого из них есть свои преимущества и недостатки [72-74].
Существуют и невирусные способы доставки генов в клетки. Вот некоторые из них:
В зависимости от того, как проводят генную терапию, она бывает двух видов (рис. 18):
В настоящее время применяются оба подхода, есть одобренные продукты. И методики продолжают совершенствоваться, а значит, со временем генная терапия сможет эффективнее решать всё более широкий круг задач, в том числе касающихся регенеративной медицины.
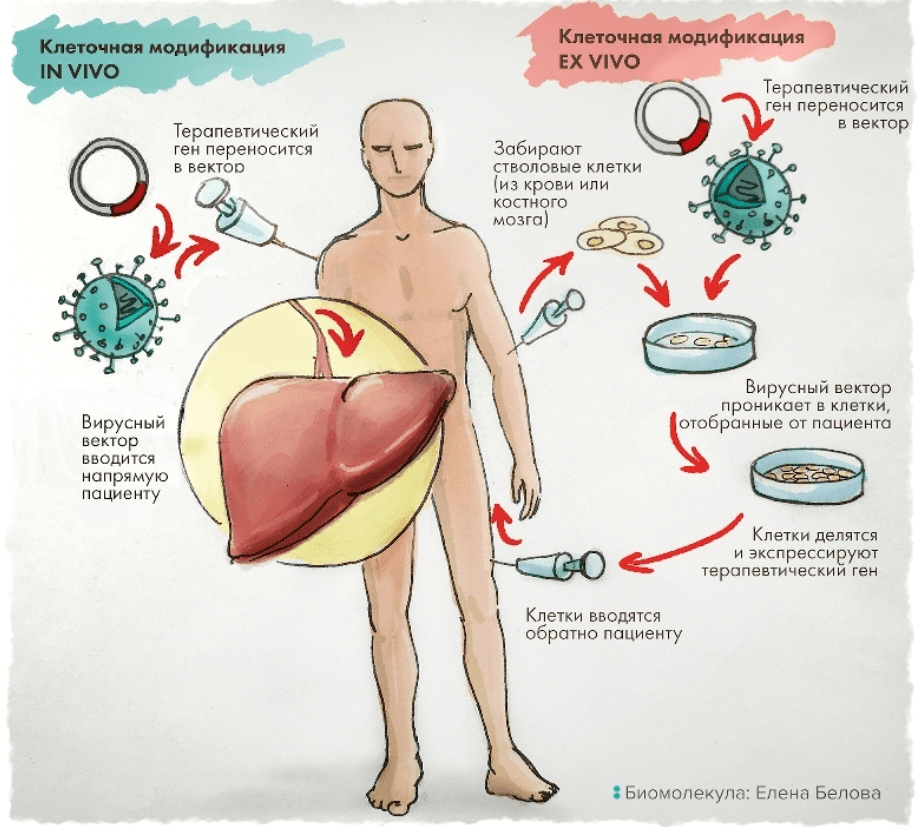
Рисунок 18. Два подхода к генной терапии. Клетки можно модифицировать «в пробирке» (ex vivo, на изображении справа) или прямо в организме пациента (in vivo, слева).
Иллюстрация Елены Беловой из статьи «Генная терапия: познакомьтесь с лекарствами будущего» [74].
Впрочем, чтобы изменить работу генов, вовсе не обязательно менять их структуру. Такую возможность открывает эпигенетика, о которой Биомолекула рассказывала в одноименном спецпроекте. Метилирование ДНК, модификации гистонов, малые РНК — эти и другие механизмы «настраивают» активность разных генов в ответ на меняющиеся внешние условия, они играют роль в старении, дегенеративных изменениях, развитии различных заболеваний. Число исследований, посвященных роли эпигенетики, постоянно растет, и ученые пытаются использовать накопленные знания для разработки методов так называемой эпигенетической терапии [81, 82]. Уже предложен целый ряд решений: например, фармакологические препараты, влияющие на экспрессию генов; применение системы редактирования генов CRISPR/Cas9; некодирующих РНК [83].
Настройка активности генов может обеспечить гораздо более широкий и динамичный диапазон эффектов... не просто включение и выключение генов, а небольшие повышения и снижения их эффектов. Осуществляя настройку эпигенома, мы можем вносить точно контролируемые изменения в экспрессию генов примерно так же, как наши клетки делают это сами изо дня в день. Наши клетки не меняют свой геном. Наши клетки меняют свой эпигеном... Также мы можем контролировать продолжительность эпигенетических эффектов.
В конце концов, именно за счет этого клетки в организме человека такие разные, несмотря на то, что в них один и тот же набор генов. Чтобы приобрести определенный внешний вид и выполнять определенные функции, клетка не мутирует — она решает, какие гены «выключить», а какие оставить активными. И этим процессом потенциально можно управлять.
Использование секретома
Помимо генома (совокупность всех генов), эпигенома (совокупность всех молекулярных меток, регулирующих активность генов) и протеома (совокупность всех производимых белков), у каждой клетки есть еще свой секретом. Так называют совокупность молекул, которые клетка секретирует во внеклеточное пространство (выше мы уже упоминали сигнальные молекулы и факторы роста, говоря о тканевой инженерии).
Вернемся немного к стволовым клеткам. Когда их используют в медицине, то терапевтические эффекты определяются тремя основными механизмами:
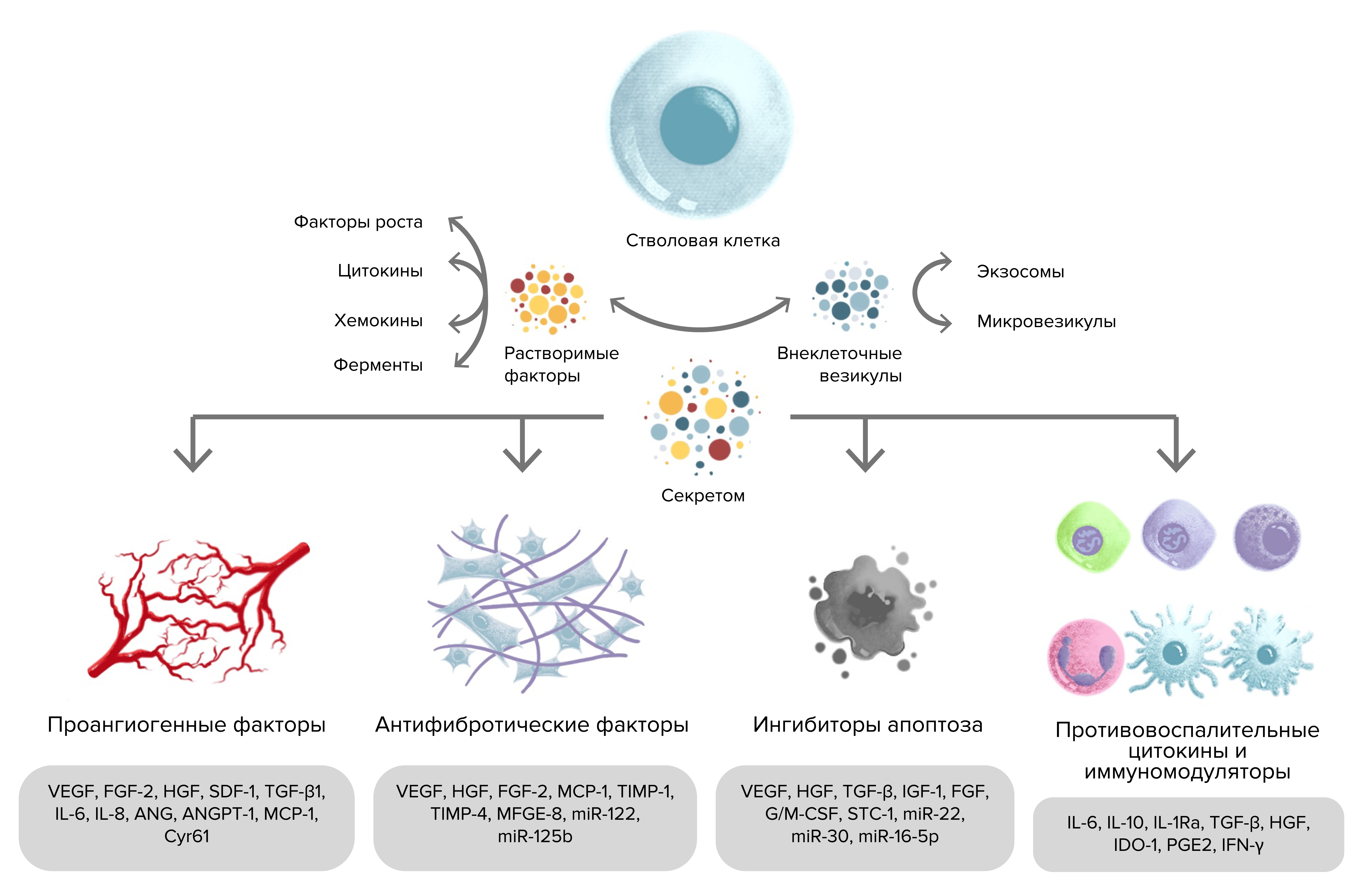
Рисунок 19. Потенциал терапевтического применения соединений, вырабатываемых клетками. На этой схеме показаны эффекты секретома стволовых клеток, которые особенно полезны в регенеративной медицине.
Иллюстрация Александры Мартыновой по [85].
Состав секретома стволовых клеток весьма богат (рис. 19). Он включает сывороточные белки, факторы роста, факторы ангиогенеза (соединения, стимулирующие рост кровеносных сосудов), гормоны, цитокины (сигнальные молекулы, с помощью которых клетки «общаются» между собой), хемокины (способствуют миграции лейкоцитов из крови в ткани), ферменты, белки внеклеточного матрикса, липидные медиаторы, генетический материал. Их эффекты многообразны. В целях регенерации тканей особенно полезны: стимуляция роста кровеносных сосудов, защита от апоптоза (запрограммированной клеточной смерти), подавление воспаления и фиброза, регуляция работы иммунной системы.
Еще одна особенность секретома стволовых клеток в том, что его состав динамичен и зависит от разных факторов. На него влияет тканевое происхождение клеток, особенности их сбора, микросреда, в которой их культивируют, воздействие различных химических, физических факторов и пр. Это дает возможность искусственно моделировать секретом в зависимости от того, каких терапевтических целей нужно достичь (тут к месту вспомнить еще и о возможностях генной инженерии, модификации эпигенома). Вводить секретом в организм пациентов можно разными способами: внутривенно, подкожно, в полость суставов, в виде губок, гидрогелей и др.
Проблемы, которые еще предстоит преодолеть
Конечно же, передовые технологии и бурно развивающаяся наука — это не только заманчивые перспективы, но и определенные сложности, вызовы. Существуют проблемы, которые мешают развитию и широкому внедрению методов регенеративной медицины. Их можно объединить в несколько групп.
Проблемы стандартизации
Для продуктов, созданных на основе технологий, которые мы перечислили выше, очень сложно разработать общие стандарты, потому что эти продукты сложны и постоянно дорабатываются, обновляются. Развитие происходит очень быстро, и всё постоянно меняется. У разных производителей и других заинтересованных сторон сложились собственные представления о том, что считать «качественным» и «некачественным», «правильным» и «неправильным», в итоге зачастую непросто прийти к общему консенсусу. Здесь большая роль принадлежит своевременной и эффективной работе организаций-регуляторов. В сотрудничестве с учеными и представителями индустрии они постоянно разрабатывают и обновляют руководства, чтобы дать разработчикам ориентиры по качеству, валидации процессов производства и контроля. К сожалению, эта работа не всегда поспевает за бурно развивающимися технологиями.
Еще одна большая сложность в том, что многие продукты для регенеративной медицины нужно изготавливать персонально для каждого пациента, и поэтому они не совсем вписываются в рамки классической доказательной медицины с ее клиническими исследованиями и регистрацией одного препарата сразу для многих пациентов. Примеры одобренных CAR-T, других видов аутологичной тканевой и клеточной терапии показывают, что доказательная медицина способна находить способы справиться с этой проблемой.
Проблемы инфраструктуры
В настоящее время нет глобальной инфраструктуры, с помощью которой научные организации, производственные площадки и лечебные учреждения могли бы быстро обмениваться данными, наработками и готовыми продуктами, координировать свою деятельность, вырабатывать общие стандарты.
Проблемы производства
Производить клеточные и другие продукты для регенеративной медицины сложно, особенно в больших масштабах. Существует разрыв между наукой и производством: ученые могут найти новые решения, успешно протестировать их на животных, а как провести исследования с участием людей, наладить производство и широко внедрить новый продукт в клиническую практику — не совсем понятно. В этой сфере неприменимы методы хранения и транспортировки, применяемые в классической фармацевтике [91]. Например, срок жизни клеточных продуктов измеряется днями, поэтому их лучше всего производить прямо в клинике, где находится пациент, или где-то совсем поблизости. Векторы для генной терапии сохраняются только при использовании холодовой цепи.
Социально-экономические проблемы
Новое часто вызывает страх и отторжение, особенно когда звучат такие страшные для уха обывателя термины, как «вирусные векторы», «генная инженерия», «клонирование». Даже если не принимать в расчет предрассудки, с применением методов регенеративной медицины есть целый ряд морально-этических вопросов. Второй значимый момент — это высокая стоимость продуктов из-за сложности, дороговизны производства и персонализированного характера.
Проблемы регулирования
Законодательства разных стран, касающиеся инновационных технологий в медицине, не проработаны до конца. Зачастую совершенно непонятно, как вписать новую категорию продуктов в сложную нормативную базу, и какие пути регулирования будут оптимальны в конкретном случае.
Законодатели стараются идти врачам и пациентам навстречу. Например, в 2023 году в России был принят Федеральный закон от 04.08.2023 N 466-ФЗ «О внесении изменений в статью 4 Федерального закона „Об обращении лекарственных средств“ и Федеральный закон „О биомедицинских клеточных продуктах“». Теперь не нужно регистрировать биомедицинские клеточные продукты, которые изготовлены индивидуально для пациента в той же клинике, где их планируется применять. Но законодательство нуждается в дальнейшем совершенствовании [92].
Подводя итог, можно сказать, что регенеративная медицина — по сути своей направление довольно старое, у нее богатая история. Но современные технологии вдохнули в нее новую жизнь, произвели революцию и превратили в одну из самых молодых, бурно развивающихся наук. Помимо того, что мы перечислили в этом материале, есть еще много потенциальных способов восстанавливать утраченные и пораженные болезнями части тела и органы, их функции. Клеточная и генная терапия, тканевая инженерия, использование секретома, технологии киборгизации, нейрочипы, искусственный интеллект, использование нанороботов и другие новые технологии, — всё это может частично заменить классические подходы к лечению заболеваний уже в обозримом будущем. Об этом и поговорим в следующих материалах спецпроекта.
Литература
- Reddien P.W. (2018). The cellular and molecular basis for planarian regeneration. Cell. 175 (2), 327-345;
- Gilbert S.F. (2000). Regeneration. Developmental Biology. 6th edition;
- Ereskovsky A., Borisenko I.E., Bolshakov F.V. and Lavrov A.I. (2021). Whole-body regeneration in sponges: diversity, fine mechanisms, and future prospects. Genes. 12 (4), 506;
- Невыдуманная басня о слоне, ките и раке: как гиганты животного мира защищаются от онкологических заболеваний;
- Sampogna G., Guraya S.Y. and Forgione A. (2015). Regenerative medicine: historical roots and potential strategies in modern medicine. J Microsc. Ultrastruct.. 3 (3), 101-107;
- Регенерация на кончиках пальцев;
- Marsell R. and Einhorn T.A. (2012). The biology of fracture healing. Injury. 42 (6), 551-555;
- Плеханов А.Н. и Товаршинов А.И. (2020). Регенерация печени: решенные и проблемные вопросы (сообщение 1). Хирургия. Журнал им. Н.И. Пирогова.. 11, 101-106 ;
- «Резервный» механизм восстановления печени;
- Кун Н.А. (1937). Прометей. Легенды и мифы Древней Греции. C 87;
- Riva M.A. et al. (2013). “the city of hepar”: rituals, gastronomy, and politics at the origins of the modern names for the liver. J Hepatol.. 55 (5), 1132-1136;
- Jacques E. and Suuronen E.J. (2020). The progression of regenerative medicine and its impact on therapy translation. Clin. Transl. Sci.. 13 (3), 440-450;
- Tiniakos D.G., Kandilis A. and Geller S.A. (2010). Tityus: a forgotten myth of liver regeneration. Journal of Hepatology. 53 (2), 357-361;
- Kaul H. and Ventikos Y. (2014). On the genealogy of tissue engineering and regenerative medicine. Tissue Eng. Part B Rev.. 21 (2), 203-217;
- Nerlich A.G., Zink A., Szeimies U. and Hagedorn H.G. (2000). Ancient egyptian prosthesis of the big toe. The Lancet. 356 (9248), 2176-2179;
- van Gulik T.M. (2024). The miracle transplantation of a black leg by the surgeon saints cosmas and damian. Hepatobiliary Surg. Nutr.. 13(1);
- Androutsos G., Diamantis A. and Vladimiros L. (2008). The first leg transplant for the treatment of a cancer by saints cosmas and damian. J BUON.. 13 (2), 297-304;
- Campbell M.B. (2023). Artificial men: alchemy, transubstantiation, and the homunculus. Republic of Letters. 1 (2);
- Хлебников Г.В. (2007). Пингри д. от гермеса до джабира и «книги коровы». Социальные и гуманитарные науки. Отечественная и зарубежная литература. Сер. 3, Философия: Реферативный журнал. №4, 127-131;
- Muller-Wille S. (2010). Cell theory, specificity, and reproduction, 1837–1870. Stud. Hist. Philos. Biol. Biomed. Sci.. 41 (3), 225–231;
- Primc D. et al. (2020). The beginnings of kidney transplantation in south-east europe. Acta Clin. Croat. 59 (1), 135-140;
- Barker C.F. and Markmann J.F. (2013). Historical overview of transplantation. Cold Spring Harb Perspect Med. 3 (4), a014977;
- Merrill J.P., Harrison J.H., Murray J. and Guild W.R. (1956). Successful homotransplantation of the kidney in an identical twin. Trans Am. Clin. Climatol. Assoc. 67, 166-173;
- Starzl T.E. (2011). History of clinical transplantation. World J. Surg. 24 (7), 759-782;
- Burke J.F. et al. (1981). Successful use of a physiologically acceptable artificial skin in the treatment of extensive burn injury. Ann. Surg. 194 (4), 413-428;
- Scheller E.L. and Krebsbach P.H. (2009). Gene therapy. J. Dent. Res. 88 (7), 585-596;
- Три поколения лекарств;
- Loi P. et al. (2013). Sheep: the first large animal model in nuclear transfer research. Cell Reprogram. 15 (5), 367-373;
- Atala A. et al. (2006). Tissue-engineered autologous bladders for patients needing cystoplasty. Lancet. 367 (9518), 1241-1246;
- Mendoza-Cerezo L. et al. (2023). Evolution of bioprinting and current applications. Int. J. Bioprint. 9 (4), 742;
- Нобелевская премия по физиологии и медицине (2012): индуцированные стволовые клетки;
- Uygun B.E. et al. (2011). Organ reengineering through development of a transplantable recellularized liver graft using decellularized liver matrix. Nat. Med. 16 (7), 814-820;
- Khoshandam M. et al. (2024). Clinical applications of the crispr/cas9 genome-editing system: delivery options and challenges in precision medicine. Genes & Diseases. 11 (1), 268-282;
- РНК, ножницы, геномы: объявлены лауреаты Нобелевской премии по химии 2020;
- Mao A.S. and Mooney D.J. (2015). Regenerative medicine: current therapies and future directions. Proc. Natl. Acad. Sci. USA. 112 (47), 14452-14459;
- Hacker M.C., Krieghoff J. and Mikos A.G. (2019). Chapter 33 - synthetic polymers. Principles of Reg. Med. (3-d Ed.), 559-590;
- Henderson N.C., Rieder F. and Wynn T.A. (2020). Fibrosis: from mechanisms to medicines. Nature. 587, 555-566;
- Mckimley K.L., Longaker M.T. and Naik S. (2023). Emerging frontiers in regenerative medicine. Science. 380 (6647), 796-798;
- Spuentrup S.S. (2023). Does implementing opt-out solve the organ shortage problem. IFO Working Papers C. 40;
- Murashima-suginami A. et al. (2021). Anti–usag-1 therapy for tooth regeneration through enhanced bmp signaling. Science Advances. 7 (7), eabf1798;
- Клетки, которые лечат людей;
- Hatton I.A. et al. (2023). The human cell count and size distribution. Proc. Natl. Acad. Sci. USA. 120 (39), e2303077120;
- Кем быть? Как гемопоэтическая стволовая клетка выбирает профессию;
- Singh V.K. et al. (2016). Describing the stem cell potency: the various methods of functional assessment and in silico diagnostics. Front. Cell Dev. Biol. 4, 134;
- El-Kadiry A.E., Rafei M. and Shammaa R. (2021). Cell therapy: types, regulation, and clinical benefits. Front. Med. (Lausanne). 8, 756029;
- Mahla R.S. (2016). Stem cells applications in regenerative medicine and disease therapeutics. Int. J. Cell Biol. 2016, 6940283;
- Pessina A. and Gribaldo L. (2006). The key role of adult stem cells: therapeutic perspectives. Curr. Med. Res. Opin. 22 (11), 2287-2300;
- National Research Council (US) and Institute of Medicine (US). (2002). Stem Cells and the Future of Regenerative Medicine. Washington (DC): National Academies Press (US) chapter 2: adult stem cells;
- Karen C.Y and Suguihara C. (2012). Chapter 9 - role of stem cells in neonatal lung injury. Neonat. Quest. and Controversies. 2, 197-215;
- Maraldi T. and Russo V. (2022). Amniotic fluid and placental membranes as sources of stem cells: progress and challenges. Int. J. Mol. Sci. 23 (10), 5362;
- Srivastava M., Ahlawat N. and Srivastava A. (2017). Amniotic fluid stem cells: a new era in regenerative medicine. J. Obstet. Gynaecol. India. 68 (1), 15-19;
- González F., Boué S. and Belmonte J.C.I. (2011). Methods for making induced pluripotent stem cells: reprogramming à la carte. Nat. Rev. Genet. 12, 231–242;
- Abbar A.A. (2020). Induced pluripotent stem cells: reprogramming platforms and applications in cell replacement therapy. Biores Open Access. 9 (1), 121-136; Abbar A.A. (2020). Induced pluripotent stem cells: reprogramming platforms and applications in cell replacement therapy. Biores Open Access. 9 (1), 121-136;
- Matoba S. and Zhang Y. (2019). Somatic cell nuclear transfer reprogramming: mechanisms and applications. Cell Stem Cell. 23 (4), 471-485;
- Kfoury C. (2007). Therapeutic cloning: promises and issues. Mcgill J. Med. 10 (2), 112-120;
- Bordignon V. (2011). 4.36 - animal cloning: state of the art and applications. Comprehensive Biotechnology. 2 (4), 441-456;
- Зоричева А.С. и др. (2024). Опыт производства и клинического применения биомедицинского клеточного продукта изитенс® для восстановления повреждений хрящевой ткани коленного сустава человека. БИОпрепараты. Профилактика, диагностика, лечение. 24 (2), 172-187;
- Эндометрий как альтернативный источник стволовых клеток;
- Тканевая инженерия — окно в современную медицину;
- Искусственные органы и тканевая инженерия;
- Органы из лаборатории;
- Можно ли вылечить рак генной терапией?;
- Как болезни крови генной терапией лечили;
- Генная терапия нейромоторных болезней;
- Свет в конце туннеля: генная терапия болезней зрения;
- СМА: три буквы — три лекарства;
- Тяжелая жизнь без дистрофина: мышечная дистрофия Дюшенна;
- Xu K. et al. (2023). Use of gene therapy for optic nerve protection: current concepts. Front. Neurosci. 17, 1158030;
- Rosenberg J.B. et al. (2017). Gene therapy for metachromatic leukodystrophy. J. Neurosci. Res. 94 (11), 1169–1179;
- Есть ли смысл в антисенсах?;
- Hosseinkhani H., Domb A.J., Sharifzadeh G. and Nahum V. (2023). Gene therapy for regenerative medicine. Pharmaceutics. 15 (3), 856;
- «Спутник V» и не только: сказ об аденовирусных вакцинах;
- Время первых: как аденоассоциированные вирусы стали лучшими в доставке генов in vivo;
- Лентивирусные векторы: как они стали лучшими векторами для терапии ex vivo;
- Mikheev A.A. et al. (2020). Сationic liposomes as delivery systems for nucleic acids. Fine Chemical Technologies. 15 (1), 7-27;
- Ilarduya C.T., Sun Y. and Düzgüneş N. (2010). Gene delivery by lipoplexes and polyplexes. Eur. J. Pharm. Sci. 40 (3), 159-170;
- Lipoplex. ScienceDirect;
- Celec P. and Gardlik R. (2017). Gene therapy using bacterial vectors. Front. Biosci. (Landmark Ed.). 22 (1), 81-95;
- Baban C.K. et al. (2010). Bacteria as vectors for gene therapy of cancer. Bioeng Bugs. 1 (6), 385-394;
- Soofiyani S.R. et al. Gene therapy, early promises, subsequent problems, and recent breakthroughs. Adv. Pharm. Bull.. 3 (2), 249-255;
- Ehnes D., Levy S. and Ruohola-Baker H. (2021). Chapter 36 - epigenetics and regenerative medicine. Medical Epigenetics. 2 (29), 853-872;
- Regenerative Medicine and Epigenetics. BMC Part of Springer Nature;
- Griazeva E.D. et al. (2023). Current approaches to epigenetic therapy. Epigenomes. 7 (4), 23;
- Эпигеном: параллельная реальность внутри клетки;
- Daneshmandi L. et al. (2020). Emergence of the Stem Cell Secretome in Regenerative Engineering. Trends Biotechnol. 38 (12), 1373–1384;
- Забродина Ю.В., Ахмедьянова Г.У. и Хамидуллина З.Г. (2022). Перспективы применения обогащенной тромбоцитами аутоплазмы в репродуктивной медицине. анализ данных литературы. Consilium Medicum. 24 (7), 481-484;
- Cole B.J. et al. (2010). Platelet-rich plasma. Sports Health. 2 (3), 203-210;
- Everts P. et al. (2020). Platelet-rich plasma: new performance understandings and therapeutic considerations in 2020. Int. J. Mol. Sci. 21 (20), 7794;
- Hosseini M.S. et al. (2023). Platelet-rich plasma in regenerative medicine: possible applications in management of burns and post-burn scars: a review. Cell J. (Yakhteh). 25 (5), 281-290;
- Кафедра иммунологии МБФ. РНИМУ им. Н.И. Пирогова;
- Генные и клеточные лекарства: сложное регулирование для сложных продуктов;
- Федеральный закон «О внесении изменений в статью 4 Федерального закона «Об обращении лекарственных средств» и Федеральный закон «О биомедицинских клеточных продуктах» от 04.08.2023 N 466-ФЗ (последняя редакция).






