
SciNat за апрель 2023 #5: как мухи помнят, а иглистые мыши регенерируют — и какие тайны скрывают геномы млекопитающих
30 апреля 2023
SciNat за апрель 2023 #5: как мухи помнят, а иглистые мыши регенерируют — и какие тайны скрывают геномы млекопитающих
- 287
- 0
- 0
Млекопитающие бывают самых разных форм и размеров, а их внешность и разнообразие до сих пор поражают воображение. На обложке последнего номера Science представлены некоторые из наименее известных и наиболее необычных — по часовой стрелке, начиная с верхнего левого угла: фосса, ленивец Гофмана, малый ежовый тернек, два белобрюхих ящера (или белобрюхих панголина) и мадагаскарская руконожка (ай-ай). Секвенирование более 240 геномов млекопитающих в рамках проекта Zoonomia прокладывает новые пути для понимания разнообразия и эволюции млекопитающих и нас самих. Подробнее о проекте Zoonomia читайте в спецвыпуске Science и дайджесте «Биомолекулы». — Zoonomia.
-
Автор
-
Редактор
Из сегодняшнего выпуска дайджеста «Биомолекулы» вы узнаете о том, как иглистые мыши научились заживлять раны, какие механизмы используют мухи для формирования памяти, как у митохондрий образуются кристы и что помогает макрофагам бороться с коронавирусной инфекцией. Также вы найдете результаты исследований ученых, проанализировавших геномы 240 млекопитающих животных.
Биология развития
Иглистые мыши помогли ученым изучить механизм регенерации тканей
У большинства млекопитающих заживление ран сопровождается образованием рубца. Однако для некоторых видов характерна полная регенерация тканей. В числе таких удивительных животных находятся иглистые мыши (Acomys), которые, в отличие от своих сородичей рода Mus (домовых мышей), способны полностью восстанавливать кожу и скелетно-мышечные ткани. Важную роль в регенерационных процессах играет активация митоген-активируемой протеинкиназы ERK, хорошо известной в качестве клеточного регулятора ростовых и пролиферативных процессов. Группе ученых из Германии и Нидерландов удалось установить, что ERK-киназа играет важную роль в регенерации комплекса тканей у иглистых мышей. Подавление активности ERK-киназы привело к смещению ростовых процессов в сторону образования фиброзной (рубцовой) ткани. Использование метода секвенирования РНК одиночных клеток (single-cell RNA sequencing) позволило определить, какие именно типы клеток чувствительны к ERK-зависимым внутриклеточным сигнальным путям, а эксперименты с поочередным нокаутом генов помогли определить другие белки, связанные с активацией ERK-киназы и вовлеченные в процесс регенерации тканей. Полученные данные позволяют лучше понять механизмы заживления повреждений кожи и других тканей. — An ERK-dependent molecular switch antagonizes fibrosis and promotes regeneration in spiny mice (Acomys), «Биомолекула»: «Иглистые мыши и их уникальные способности к регенерации», «Регенерация на кончиках пальцев».
Цитология
Найден еще один белок, отвечающий за форму внутренней мембраны митохондрий
Для правильной работы митохондрий огромную роль играет формирование их внутренней мембраной системы крист, в которых локализованы ферменты электрон-транспортной цепи, обеспечивающие клетку энергией АТФ. Группе американских ученых удалось установить, что кальций-связывающий белок MICU1, наиболее известный своей ролью в регуляции работы митохондриального транспортера ионов кальция (MCU), также способен модулировать архитектуру крист. Ультаструктура митохондрий в клетках мышей с нокаутом по гену MICU1 была в значительной мере дезорганизована, однако это не было связано с функцией MICU1 в регуляции уровня ионов кальция в митохондриях. Используя методы протеомной и клеточной визуализации, авторам удалось установить локализацию MICU1 в участках формирования митохондриальных крист. Для формирования их ультраструктуры необходимо образование белкового комплекса MICOS, для чего требуется обязательное участие белка MICU1. Кроме того, ученым удалось показать, что нарушение структуры крист в отсутствие MICU приводит к запуску апоптотических процессов в митохондриях. В совокупности, полученные данные позволяют предположить, что MICU1 является межмембранным сенсором ионов кальция, который также способен модулировать изменения в строении внутренней мембраны митохондрий. — MICU1 regulates mitochondrial cristae structure and function independently of the mitochondrial Ca2+ uniporter channel, «Биомолекула»: «Тайная жизнь митохондрий».
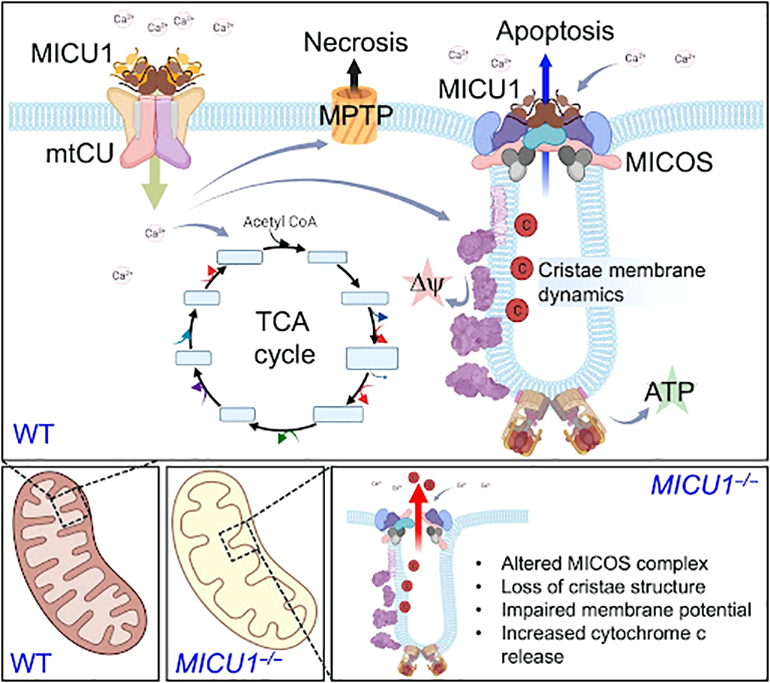
Схематическая модель функции белка MICU1 в регуляции уровня ионов кальция в матриксе митохондрий и формировании ультраструктуры внутренней мембраны.
Иммунология
ACE2 необходим для заражения макрофагов
Макрофаги играют важную роль в защите организма от инфекций, выступая в качестве «первой линии обороны» при заражении человека целым рядом патогенов, в том числе многими вирусами. При этом инфицированные макрофаги, как правило, не дают вирусам завершить свой жизненный цикл и произвести новую генерацию частиц, что в конечном счете вносит свой вклад в предотвращение распространения патогенов. При этом инфицирование макрофагов необходимо еще и потому, что запускает процесс секреции целого коктейля провоспалительных противовирусных цитокинов, которые необходимы для «борьбы» с вирусными частицами в организме. Однако избыточная продукция провоспалительных цитокинов несет серьезную угрозу здоровью и жизни пациента. Патогенез COVID-19, вызванного вирусом SARS-CoV-2, ставший причиной всемирной пандемии, также был связан с гиперпродукцией провоспалительных цитокинов клетками макрофагов, который вызывал развитие тяжелой симптоматики у инфицированных пациентов.
Пандемия COVID-19 сделала ангиотензинпревращающий фермент 2-го типа (ACE2) известным широкой общественности благодаря его ключевой роли в проникновении SARS-CoV-2 в эпителиальные клетки человека. Далеко не все макрофаги, локализованные в легочной ткани, имеют на своей поверхности ACE2, но при этом именно они в первую очередь сталкиваются с коронавирусом, проникающим в организм через дыхательные пути. Австралийские ученые изучили способность первичных макрофагов, лишенных ACE2, взаимодействовать с вирусными частицами SARS-CoV-2, способствовать образованию новых вирусных частиц и вызывать продукцию цитокинов. Оказалось, что даже в отсутствие ACE2 на поверхности макрофагов вирусные частицы все же проникают в клетку, но ни их дальнейшей репликации, ни продукции провоспалительных цитокинов показано не было. В клетках первичных макрофагов, в которых ACE2, напротив, был гиперэкспрессирован, SARS-CoV-2 свободно проникал в клетку, реплицировал свою РНК, а также формировал новые вирусные частицы. Помимо этого, макрофаги с повышенным уровнем ACE2 запускали провоспалительные процессы, используя для этого сигнальный каскад TBK-1-киназы. Полученные данные позволяют лучше понимать роль ACE2 в иммунном ответе клеток макрофагов в отношении SARS-CoV-2. — Macrophage ACE2 is necessary for SARS-CoV-2 replication and subsequent cytokine responses that restrict continued virion release, «Биомолекула»: «Компьютерные технологии против коронавируса: первые результаты», «Под шипами: омиксные технологии помогают понять молекулярные механизмы патогенности SARS-CoV-2 и SARS-CoV», «Новые ущербы от инфекции SARS-CoV-2 за пределами дыхательной системы».
Новый фактор транскрипции определяет судьбу CD8+ Т-клеток кишечника
Во время инфекции популяция антиген-специфичных CD8+ Т-клеток, локализованных в кишечнике, превращается в эффекторные клетки или клетки памяти. При этом дальнейшая судьба Т-клеток памяти, а именно — станут ли они резидентными клетками памяти (TRM) или циркуляторными — зависит от совместной работы целой группы транскрипционных факторов, регулирующих экспрессию генов, определяющих дальнейшую программу поведения клеток иммунной системы. Опубликованная в журнале Science Immunology работа Helm и соавторов посвящена изучению эффекта транскрипционного фактора Bcl11b на дальнейшую дифференцировку Т-клеток.
Изучив влияние инфекционной бактерии Listeria monocytogenes на мышей с условной делецией гена Bcl11b, ученые показали, что в отсутствие этого фактора Т-клетки в бóльшей степени накапливаются в тканях кишечника, становясь TRM-клетками, в то время как количество циркулирующих клеток уменьшается. При этом в TRM клетках наблюдаются значительные изменения в программе транскрипции генов, отвечающих за реализацию иммунного ответа. Помимо влияния на дифференцировку клеток и изменения программы транскрипции генов, в Bcl11b-дефицитных TRM-клетках наблюдался сниженный ответ на заражение L. monocytogenes. Таким образом, ученые сделали вывод, что транскрипционный фактор Bcl11b определяет клональную судьбу CD8+ Т-клеток кишечника. — Bcl11b sustains multipotency and restricts effector programs of intestinal-resident memory CD8+ T cells, «Биоолекула»: «Т-лимфоциты: путешественники и домоседы».
Нейробиология
Механизмы мультисенсорной памяти мух
Изучение механизмов памяти — одно из важнейших и увлекательнейших направлений нейробиологии. Хорошо известно, что получение нескольких стимулов разной модальности (визуальной, обонятельной, зрительной или слуховой) улучшает процесс восприятия информации и способствует лучшему обучению. Однако клеточные и молекулярные механизмы этого процесса изучены недостаточно хорошо. Окрей (Okrey) и коллеги, авторы новой статьи в Nature, использовали в своем исследовании плодовую мушку рода Drosophila. Исследователи использовали Т-образный лабиринт, в котором в качестве стимулов присутствовали разные цвета и запахи. Мух обучали с помощью эти двух типов стимулов, используя в качестве положительного подкрепления сахар. Исследователи показали, что обучение в присутствии двух стимулов вызывало формирование долговременной памяти эффективнее, чем использование только обонятельной информации. За интеграцию обонятельной и визуальной информации у мух отвечают клетки Кеньона, нейроны, локализованные в грибовидных телах Drosophila. При этом мультисенсорное обучение активирует «обонятельные» и «визуальные» аксоны клеток Кеньона, стимулируя высвобождение ими дофамина. Дофамин, в свою очередь, активирует секрецию ГАМК, вызывающей торможение, что позволяет серотонинэргическим нейронам, окружающим клетки Кеньона, осуществить связь между разными по модальности клетками Кеньона. Благодаря этому механизму выяснилось, что в результате обучения цветовой стимул может активировать обонятельные по модальности клетки Кеньона с помощью серотонинэргических нейронов. Открытие данного механизма объясняет, почему мультисенсорное обучение помогает улучшить работу памяти и позволяет одной сенсорной функции восстановить память о мультимодальном опыте. — Multisensory learning binds neurons into a cross-modal memory engram.
Вирусология
Для свиней тоже наступило тяжелое время
Африканская чума свиней (ASF) — смертельно опасное вирусное заболевание, поражающее как диких, так и домашних животных. В последние годы эпидемия ASF стремительно распространяется в странах Юго-Восточной Азии. Специалисты опасаются, что ее последствия будут не только экономическими, но и экологическими: распространение вируса грозит вымиранием многим видам диких свиней. Очередная пандемия заставляет искать все новые способы борьбы со смертельно опасным вирусом, чему и посвящена статья научного журналиста Дэниса Нормиля (Dennis Normile), опубликованная в журнале Science.
Вирус, вызывающий ASF, долгое время считался эндемичным для Африки, пока в конце 1950-х годов первые случаи заражения не были зарегистрированы в странах Западной Европы. Вторая волна распространения вируса и, похоже, гораздо более масштабная, была отмечена, начиная с 2007 года, а в 2018 году первые случаи ASF были подтверждены в Китае. С тех пор специалисты говорят о повсеместном распространении вируса и в странах Юго-Восточной Азии.
На первых порах основным способом борьбы с вирусом было массовое уничтожение свиней, как уже инфицированных, так и тех, которые могли заразиться на территориях, охваченных эпидемией. Однако такая стратегия оказалась экономически, логистически и политически невыгодной, а власти Гонконга были вынуждены признать, что «должны научиться жить с вирусом». Поэтому эпидемиологи предлагают изменить стратегию, направив усилия на изоляцию домашних свиней от любых контактов с их дикими сородичами, а также повысив санитарный контроль. Однако подобный подход не решает проблемы уничтожения вирусом диких свиней, популяции некоторых видов которых значительно сократились с начала распространения эпидемии. Подобные события угрожают балансу многим экосистемам, так как дикие свиньи являются важнейшей частью пищевой цепи в целом ряде регионов Малайзии и Филиппин.
Разработка вакцины стала бы сильным козырем в борьбе с распространением эпидемии, но несмотря на то, что несколько научных групп в настоящее время работает над созданием вакцины от вируса, специалисты сходятся во мнении, что локальные ограничительные меры — пока что единственный эффективный способ предотвратить распространение ASF. — African swine fever settles into Asia.
Генетика
Zoonomia: анализ множества геномов млекопитающих поможет пролить свет на эволюцию человека
Консорциум Zoonomia, объединивший 150 исследователей и 30 исследовательских групп со всего мира, стал продолжением проекта по секвенированию генома человека. Проанализировав более 240 геномов млекопитающих, ученым впервые удалось получить статистически значимые данные о том, как и когда в течение эволюции разошлись генетические последовательности разных видов животных. О целях и перспективах проекта Zoonomia рассказывает статья Макса Козлова (Max Kozlov) в журнале Nature.
Опубликовав данные о 240 геномах млекопитающих в 2020 году, ученые приступили к анализу последовательностей с целью определить их сходства. Сравнив геномы млекопитающих и человека, исследователи определили, что 10,7% последовательностей ДНК идентичны. Эти консервативные участки генома принадлежали регуляторным генам, управляющим экспрессией других генов, на основе которых синтезируются все белки клетки. При этом функции половины из этих консервативных генов ранее не были охарактеризованы.
Исследователям проекта Zoonomia также удалось построить филогенетическое древо, анализ которого позволил установить, когда каждый из видов млекопитающих отделялся от своих предков. Полученные данные подтвердили гипотезу о том, что эволюция млекопитающих началась сильно раньше заката эпохи динозавров, 65 миллионов лет назад, однако вымирание большого количества видов рептилий ускорило этот процесс.
Одной из прикладных задач исследования было также проследить эволюцию разных функций организма, таких как, например, обоняние, что позволило определить целый ряд генов, которые могут быть ассоциированы с наследственными заболеваниями человека.
Авторы Zoonomia считают, что, сделав данные о таком большом количестве геномов доступными для широкой научной аудитории, они таким образом создают фундамент для более масштабных исследований в будущем. Проект Zoonomia тесно связан с другими крупными исследованиями в области секвенирования геномов. Одним из них является амбициозный проект VGP, в рамках которого планируется секвенировать геномы всех 71 000 видов позвоночных животных. — Huge cache of mammal genomes offers fresh insights on human evolution, «Биомолекула»: «Геном человека: как это было и как это будет», «Перевалило за тысячу: третья фаза геномики человека».
Больше деталей о проекте Zoonomia можно найти в апрельском спецвыпуске журнала Science, где опубликованы 11 статей с результатами проекта. — Zoonomia.
«Хороший мальчик» снова помогает людям
В 1925 году ездовая собака по кличке Балто (Balto) попала в заголовки газет по всему миру, когда пес, невзирая на свирепые ветры, бушующую метель и раскалывающийся речной лед, доставил спасительную сыворотку в изолированный город на Аляске, пораженный дифтерией. Исследователи проекта Zoonomia секвенировали геном пса, используя ДНК, взятое с живота чучела собаки, сохранившееся до наших дней. Что же ученые хотели найти в геноме знаменитой ездовой собаки?
Исследователи сравнили геном Балто с более чем 600 геномов волков, койотов и собак разных пород, чтобы понять, какими именно качествами обладали ездовые собаки, которых выбирали заводчики сотню лет назад. Оказалось, что Балто был относительно небольшой собакой, всего 55 см в холке. Однако, в отличие от современных ездовых собак, Балто имел двойной слой шерсти, который, по всей видимости, хорошо защищал его от низких температур Аляски. Используя данные, полученные при анализе ДНК собаки, ученые смогли сделать выводы о том, как выглядел Балто. А сохранившиеся фотографии собаки позволили исследователям сравнить полученные данные с «контролем» на фото и убедиться, что были в своих выводах абсолютно правы. Помимо этого, ученые сделали неутешительный для современных собаководов вывод: собаки того времени были гораздо более беспородными и имели большее генетическое разнообразие аллелей и были устойчивее ко многим болезням по сравнению с современными породистыми сородичами. — Hidden details of world’s most famous sled dog revealed in massive genomics project.

Ездовая собака Балто (Balto) и его хозяин погонщик Гуннар Кассен (Gunnar Kaasen).





