
Весь мир — большая лаборатория: что такое RWD и RWE, и как они помогают контролировать лекарства
23 декабря 2022
Весь мир — большая лаборатория: что такое RWD и RWE, и как они помогают контролировать лекарства
- 2474
- 0
- 2
Клинические исследования помогают получить много важной информации о лекарствах. Но на них свет клином не сошелся. Много ценной информации можно получить и из других источников.
Рисунок в оригинальном разрешении.
иллюстрация Карины Илиопуло
-
Автор
-
Редакторы
-
Рецензент
-
Иллюстратор
В предыдущей статье спецпроекта «Постклиника» мы поговорили о том, как проводятся исследования препаратов после регистрации, что такое фармаконадзор и какие регулирующие органы отвечают за него в разных странах. А теперь поговорим о сфере, которая пока еще только начинает развиваться, как и регулирование в этой области. Ученые могут получать ценную информацию не только из клинических исследований, но и собирать данные из самых разных источников. А анализировать эти данные помогают, в том числе, технологии искусственного интеллекта.
Постклинические исследования
На «Биомолекуле» вышло уже два спецпроекта о судьбах лекарств — в доклинических и в клинических исследованиях. Что же с ними происходит после выпуска на рынок? А также как происходит оформление у регуляторов? С окончанием фазы 3 научные исследования и разработка не заканчиваются. После регистрации и выхода на рынок продолжается сбор данных об эффективности, безопасности, оценка рисков, которые влияют как на судьбу самого лекарства, так и на разработку новых. Этот спецпроект расскажет о четвертой фазе клинических исследований, real-world data, и о том, как регулируются процессы разработки и производства лекарств.
Партнер спецпроекта — аффилированные компании «Филип Моррис Интернэшнл» в России, ФМИ (PMI Affiliates in Russia) — международная компания, занимающаяся разработкой продуктов бездымного табака.
Клинические исследования — основа современной доказательной медицины. Но на них свет клином не сошелся. В предыдущей статье спецпроекта, посвященного постклиническим исследованиям [1], мы рассматривали некоторые их ограничения:
- В исследование можно включить много людей, но их число всегда ограничено и несопоставимо с количеством пациентов, которые получат продукт, когда он появится на рынке. Поэтому исследователь может получить не всю информацию — например, могут не проявить себя редкие нежелательные реакции.
- Участников для клинических исследований отбирают в соответствии с определенными строгими критериями. Всегда есть группы пациентов, которые под эти критерии не подпадают, и таких групп может быть достаточно много.
- Результаты клинических исследований носят статистический характер. На выходе исследователи получают определенные цифры, например, «препарат помог достичь ремиссии у 60% пациентов». На практике же врачи лечат конкретного больного. Даже если препарат хорошо показал себя в исследованиях, именно этому пациенту он может не помочь. И напротив, известны случаи, когда клинические испытания демонстрируют неэффективность препарата, а у отдельных редких пациентов он работает.
- Клинические исследования проводят по протоколам. Дозы, режим введения препарата, контрольные точки — всё строго регламентировано. В «полевых условиях» куда большее влияние имеет человеческий фактор — как со стороны врача, так и со стороны пациента. Например, пациент может применять лекарство не в полном соответствии с тем, как оно было назначено. У пациента могут быть хронические или острые сопутствующие заболевания, не изученные в клинической разработке. А еще больной может применять другие лекарства, взаимодействие с которыми систематически не оценивалось. Подобные факторы могут сильно влиять на получаемый терапевтический эффект.
- В современной медицине большую роль играет экономический фактор. Анализ экономической эффективности лекарств (cost-effectiveness analysis, CEA) возможен практически только в реальных условиях.
- В клинических исследованиях не так часто (хотя сейчас всё чаще) собирают информацию о качестве жизни пациентов, и вообще клинические исследования грешат тем, что собираемая информация интересна в первую очередь врачам и спонсорам исследования. А ведь для пациента его субъективное самочувствие и возможность, например, самостоятельно выйти на улицу гораздо важнее, чем уровень какого-нибудь белка в крови.
- Иногда ситуация развивается настолько быстро, что планировать и проводить клинические исследования попросту нет времени. Весь мир наблюдал наглядный пример во время пандемии COVID-19. Взять хотя бы Россию: отечественную вакцину «Спутник V» было решено зарегистрировать в ускоренном порядке, после II фазы клинических испытаний [2] (а «по правилам» нужно провести три фазы, как мы рассказывали в статье «Путь к тысячам аптек начинается с одной молекулы» [3]). Третья фаза проходила, когда препаратом уже вовсю начали прививать некоторые группы людей.
- Для редких заболеваний исследования «по всем правилам» будут проводиться очень долго, потому что пациентов мало, и течение болезней может быть сложным. Поэтому регуляторы часто регистрируют препараты после небольших, иногда несравнительных исследований с условием продолжать исследования после регистрации. Обычно требуются рандомизированные исследования, но сбор реальных данных применения тоже важен и полезен.
В связи с этим ученым и врачам нужны другие инструменты для решения практических задач. Современные реалии бросают новые вызовы, но и предлагают новые эффективные решения.
За пределами клинических исследований: RWD и RWE
В современной медицине и фармацевтике всё большее значение приобретают такие концепции, как данные реального мира (real-world data, RWD) и построенные на этих данных доказательства (real-world evidence, RWE). Эти понятия наиболее широко применяются в США, и в последнее время ими активно оперирует Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (Food and Drug Administration, FDA) .
С переводом названия FDA на русский язык есть некоторые сложности. В русскоязычных источниках встречаются разные термины. FDA не занимается санитарным надзором, и не только контролирует качество, но и является регистрирующим органом. Поэтому, вероятно, правильнее всего переводить название ведомства как «Управление по продуктам и лекарствам».
На сайте FDA можно найти такие определения:
- REAL WORLD DATA (RWD)
- данные, относящиеся к здоровью пациентов или оказанию медицинской помощи, собираемые из разных источников. В качестве примеров таких источников эксперты FDA приводят электронные медицинские карты; счета, выставленные медучреждениями и аптеками; официальные претензии пациентов; реестры препаратов, медицинской продукции и заболеваний; данные, полученные самими пациентами в домашних условиях, собранные из мобильных устройств и других источников.
- REAL WORLD EVIDENCE (RWE)
- клинические данные об использовании различных препаратов и медицинских изделий, их потенциальных преимуществах и рисках нежелательных эффектов. Эти данные получают путем анализа RWD. RWE могут быть получены из разных исследований и анализов, включая рандомизированные испытания, обсервационные ретроспективные и проспективные исследования.
Важно отметить слово «реальные» в обоих терминах. «Реальность» подразумевает два аспекта:
- Данные получены в реальных условиях применения — в противоположность научному эксперименту, то есть клиническому исследованию, в котором условия устанавливаются исследователем. В этом пункте можно выделить основное преимущество и основной недостаток RWD. С одной стороны, как мы упомянули выше, у ученых есть возможность получить множество ценных данных, недоступных в рамках эксперимента. С другой стороны, встает вопрос качества этих данных. Чтобы оно было достаточно высоким, процесс сбора RWD нужно контролировать и стандартизировать. В настоящее время с этим есть проблемы, и регулирующие органы разных стран активно пытаются их решить.
- Лекарство или медицинское изделие уже допущено на рынок, то есть возможно его применение вне программ клинической разработки.
Другими словами, наличие «реальных» данных в подавляющем большинстве случаев свидетельствует о том, что продукт получил регуляторное одобрение. Одним исключением является ситуация так называемого «сочувственного» применения (compassionate use, expanded access), когда лекарственный препарат еще не зарегистрирован, но есть категория людей, которым не помогли существующие одобренные лекарственные препараты, и их последней надеждой является получение препарата, который еще находится в клинической разработке; в то же время, участвовать в клиническом исследовании такие люди по тем или иным причинам не могут. В подобных случаях также произойдет генерация «реальных» данных.
Внимательный читатель мог заметить два момента. Во-первых, RWD и RWE неразрывно связаны: второе вытекает из первого. Во-вторых, у этих определений есть слабое место — обтекаемость, допускающая определенный люфт в толкованиях. Например, авторы исследования, опубликованного в 2017 году [4], проанализировали профессиональную литературу и нашли в ней разные определения RWD:
- данные, собранные вне рандомизированных контролируемых исследований;
- данные, собранные вне интервенционных или контролируемых исследований;
- данные, полученные вне условий эксперимента;
- другие определения, которыми пользуются некоторые авторы и которые не входят ни в одну из предыдущих категорий.
Более точное определение RWE дает Закон о лекарствах XXI века (21st Century Cures Act), вступивший в силу в США 13 декабря 2016 г [5], [6]:
- RWE
- данные об использовании, потенциальных преимуществах или рисках лекарства, получаемые из источников, отличных от традиционных клинических исследований.
Так какое же место занимают RWD и RWE в современной медицине и фармацевтике? В первую очередь, это не клинические исследования и не альтернатива им, но ценное дополнение. Иногда в качестве синонима RWD употребляют термин big data («большие данные»), но это верно лишь отчасти. Big data включает сложные и неструктурированные данные, в то время как RWD стремятся к структурированности, унификации — и это роднит их сбор и анализ с эпидемиологическими исследованиями.
На вопрос обывателя о том, что же такое RWD, проще всего ответить на конкретных примерах. Этим и займемся — перечислим источники, из которых собирают такие данные.
Откуда дровишки данные?
К основным источникам, из которых можно получить RWD, можно отнести (список не исчерпывающий) [6]:
- реестры пациентов;
- базы данных медорганизаций, и особенно электронные медицинские карты;
- базы данных аптек и компаний, занимающихся медицинским страхованием;
- социальные сети;
- приложения для мобильных телефонов и носимые устройства;
- онлайн-платформы, созданные самими пациентами.
Поговорим о каждом из этих источников подробнее.
«Ой, теперь он и тебя сосчитал!»: реестры пациентов
Реестры пациентов представляют собой организованные системы, предназначенные для сбора, анализа и распространения данных о пациентах, объединенных какой-либо общей характеристикой [7], [8]. Например, это может быть одно и то же заболевание, зачастую редкое, воздействие одинаковых факторов риска. Официальных определений этого термина существует несколько, например:
- Реестр пациентов
- организованная система, которая использует методы наблюдения для сбора единообразных клинических и других данных для оценки определенных исходов в популяции, определяемая конкретным заболеванием, состоянием или воздействием, и которая служит заранее установленной научной, клинической или законодательной цели.
Реестры могут содержать самую разную и зачастую очень обширную информацию: об истории болезни, клинических данных, проводимом лечении, его результатах, образцах биоматериала, хранящегося в патоморфологической лаборатории и пр. [7], [8]. Характер реестра вытекает из целей его создания, причем целей может быть сразу несколько или они могут меняться, дополняться со временем.
Все реестры пациентов можно условно разделить на две группы:
- включающие людей с определенными заболеваниями, патологическими состояниями или группами заболеваний;
- включающие пациентов, принимающих определенные лекарственные препараты, пользующихся определенными продуктами, медицинскими изделиями.
А теперь, чтобы было понятнее, приведем несколько открытых примеров таких реестров:
- Реестр Европейского общества муковисцидоза (European Cystic Fibrosis Society, ECFS) предназначен для сбора данных о муковисцидозе и его лечении. Эта информация помогает в проведении эпидемиологических исследований и повышении эффективности лечения. На данный момент в реестр включены 52 тыс. пациентов из 40 стран-участниц, а также данные за 2008–2020 годы.
- Реестр семейного рака толстой кишки (Colon Cancer Family Registry, Colon CFR) организован шестью научно-исследовательскими институтами из США, Канады и Австралии. Его цель — помочь ученым в исследованиях этиологии, методов лечения и профилактики колоректального рака. В реестр включены данные более чем о 42 тыс. образцов ткани злокачественных опухолей, собранных у членов более чем 15 тыс. семей за 1998–2011 годы.
- Есть свои реестры и в России, например, Российский реестр пациентов с миодистрофией Ландузи—Дежерина — наследственным заболеванием мышц, которое встречается предположительно у одного из 14 тыс. человек. Как указано на официальном сайте реестра, на 2 августа 2022 года в нем было зарегистрировано 260 пациентов. Цель этого проекта — помогать в подтверждении диагноза, готовить пациентов к включению в клинические исследования новых препаратов, обеспечить их информационную поддержку.
Это лишь некоторые примеры из огромного множества. Они показывают, насколько разными бывают реестры пациентов и насколько многообразные задачи они помогают решать. С другими примерами можно ознакомиться на сайте Национальных институтов здравоохранения США (National Institutes of Health, NIH).
Оцифрованная медицина: электронные медицинские карты и другие базы данных медорганизаций
С приходом информационных технологий тонны бумажной медицинской документации стали заменять электронные медицинские карты пациентов. Сейчас они активно внедряются по всему миру. Например, в России в 2007 году те или иные информационные системы использовали только 3,9 % государственных клиник, а в 2021 году — уже до 91 % [9].
Для врача это возможность не тратить время на бесконечную писанину и перелистывание страниц в поисках нужной информации. Пациенту тоже удобно: он может получить информацию о своем здоровье, назначенном лечении и результатах обследования из компьютера или смартфона. А для ученых и систем здравоохранения это отличная возможность получать ценные данные — намного быстрее, чем во время клинических исследований. Например, не нужно тратить время, чтобы набрать пациентов — это может занять до 30% от общей продолжительности клинических испытаний.
В сфере сбора RWD с помощью баз данных медицинских организаций уже запущено несколько крупных проектов.
Электронные медицинские карты для клинических исследований
В январе 2003 года в Европе стартовал проект «Электронные медицинские карты для клинических исследований» (The Electronic Health Records for Clinical Research, EHR4CR) в рамках Инициативы инновационных лекарственных средств Евросоюза (The Innovative Medicines Initiative, IMI). Проект завершился в 2016 году, его основная цель — помочь ученым, которые планируют клиническое исследование, выяснить заранее, осуществимо ли оно, быстро набрать участников, автоматически загрузить данные из электронных медицинских карт, получить информацию о серьезных нежелательных явлениях во время исследования. Одновременно, это ценный источник RWD и для других целей. В 2016 году на основе проекта EHR4CR была создана платформа InSite. Она помогает находить участников для клинических испытаний среди миллионов электронных медицинских карт по всей Европе, при этом сохраняя конфиденциальность пациентов. Впоследствии EHR4CR открыл возможность для запуска еще одного проекта — EHDEN (European Health Data Evidence Network). Его задача — разработать экосистему XXI века для проведения исследований в сфере здравоохранения путем создания унифицированной базы с данными 100 миллионов пациентов по всему Евросоюзу.
European Health Data Evidence Network (EHDEN) —
еще один проект в рамках Инициативы ЕС IMI, стартовавший в ноябре 2018 года. Он представляет собой сеть стандартизированных баз данных на территории Евросоюза. Цель — помочь пациентам, врачам, плательщикам за медицинские услуги и препараты, регулирующим органам и правительствам стран получать достоверную информацию о здоровье и болезнях населения, методах лечения, разработке новых препаратов.
Инициатива «Сентинель» («Наблюдатель»)
В 2008 году, руководствуясь Поправками к Закону о FDA от 2007 г. (FDAAA), эксперты FDA приступили к разработке инициативы «Сентинель» (The Sentinel Initiative). Сначала стартовал пилотный проект Mini-Sentinel, а в 2016 году был объявлен официальный запуск полноценной системы. В настоящее время это одна из крупнейших в мире баз данных, посвященных вопросам безопасности лекарственных препаратов. В составе инфраструктуры The Sentinel Initiative функционируют:
- Sentinel System помогает осуществлять фармаконадзор за уже зарегистрированными лекарствами. Для этого компьютерные программы статистически анализируют электронные медицинские карты.
- Active Risk Identification and Analysis (ARIA) system ищет и анализирует постмаркетинговые риски. Эта система состоит из двух частей: отформатированных медицинских данных в системе Sentinel и компьютерных программ для анализа.
- FDA-Catalyst — база данных, полученных в ходе взаимодействия с пациентами и поставщиками медицинских услуг. Она дополняет базу Sentinel.
Полезные данные от страховщиков и аптек
Когда люди покупают лекарства и пользуются услугами медицинского страхования, аптеки и страховые компании собирают свои базы данных. Например, важно вести учет выставленных счетов и оплат, оказанных услуг и реализованной продукции. Также многие организации собирают претензии покупателей и пациентов. Эта информация полезна и для научных исследований. Она позволяет оценивать не только клинические данные, но и экономические факторы, например, как много денег разные группы населения тратят на лечение, насколько доступны те или иные лекарства, насколько экономически целесообразно их применение.
Таких баз данных очень много, особенно в США. Например, вышеупомянутая инициатива Sentinel предусматривает в том числе сбор данных о страховых претензиях.
«Слежка» в социальных сетях
В социальных сетях можно найти обсуждения на любые темы — в том числе касающиеся здоровья, болезней и медицины. Для исследователей это кладезь полезной информации. Люди рассказывают о своих заболеваниях и симптомах, лечении, нежелательных лекарственных реакциях, оставляют отзывы о врачах, клиниках, препаратах и медицинских процедурах.
Еще в 2008 году ученые опубликовали исследование, которое показало, что социальные сети и блоги можно эффективно использовать, чтобы получить информацию от пациентов о сахарном диабете и его лечении. Причем в интернете, где люди не ограничены во времени и свободе выражать свои мысли, зачастую можно прочитать много такого, о чем не пишут в научной литературе. Этими возможностями соцсетей сегодня пользуются не только ученые и представители государственных организаций, но и клиники, фармкомпании [10–12].
В настоящее время существуют сайты, созданные специально для того, чтобы на них пациенты могли рассказывать свои истории и делиться мнениями [10]. Один из самых крупных и известных проектов — PatientsLikeMe. В нем зарегистрировано более 350 тысяч участников, и они обсуждают более 2500 заболеваний. Пациенты рассказывают на сайте более чем о 110 тысячах нежелательных реакций на тысячи разных лекарственных препаратов. Конечно же, эта информация представляет большую ценность для регулирующих организаций. В 2015 году PatientsLikeMe и FDA подписали соглашение о сотрудничестве в области исследований.
Не менее важны и «обычные» социальные сети. В то время как для большинства людей это средство общения и способ приятно провести время, для ученых они стали самым настоящим полигоном для исследовательской работы. Тут всё серьезно: в 2013 году Ассоциация британской фармацевтической отрасли (The Association of the British Pharmaceutical Industry, ABPI) опубликовала на своем сайте Руководство по работе с информацией о нежелательных реакциях на лекарственные препараты и жалобами пациентов в цифровых медиа.
Цифровые технологии «присматривают» за пациентами
В наше время совершенно обыденными стали такие гаджеты, как смарт-часы, смарт-браслеты, смарт-очки и прочие устройства. Да и мобильный телефон вмещает в себя целый компьютер со множеством приложений, некоторые из которых могут генерировать данные, касающиеся здоровья. Принято считать, что подобные носимые устройства — нечто ультрасовременное, появившееся совсем недавно. Но на самом деле концепция таких девайсов зародилась еще в 1955 году — ее придумали американские математики Эдвард Торп и Клод Шеннон (рис. 1), в 1966 году создавшие в домашней лаборатории аналоговое устройство размером с пачку сигарет. Предназначением девайса был прогноз результатов игры в рулетку, и шансы выигрыша повышались на 44% [13]. Впрочем, создать надежный алгоритм обыгрывания рулетки не удалось до сих пор — иначе все казино уже давно бы закрылись. Но усилия Торпа и Шеннона не пропали впустую. Прошло несколько десятилетий, и развитие интернета, искусственного интеллекта и больших данных позволили создать множество гаджетов, полезных в разных сферах жизни, включая здравоохранение [14]. О подобных «носимых технологиях» мы уже писали в статьях «„Большой брат следит за тобой“, или Как развитие технологий меняет нашу жизнь» [15], «Мобильные технологии для жизни и спорта» [16] и других.

Рисунок 1. Эдвард Торп и Клод Шеннон — создатели первого аналогового носимого устройства для клиентов казино. Окончательно «обыграть рулетку» с помощью их девайса так и не удалось, но позже, с развитием цифровых технологий, идея двух ученых получила вторую жизнь во многих сферах жизни.
Самый распространенный тип носимых устройств — мобильные телефоны: сегодня они есть почти у всех людей. Многие пользуются приложениями для контроля пройденного за день расстояния, подсчета калорий в рационе и пр. Существуют специальные приложения для людей с определенными заболеваниями. Обширен и рынок более специализированных девайсов. Так, в 2019 году эксперты оценивали объем мирового рынка носимых устройств в $32,63 млрд. Ожидается, что с 2020 по 2027 год он вырастет на 15,9%. На рис. 2 представлена инфографика с основными типами приложений для контроля состояния здоровья, которые используют современные люди.
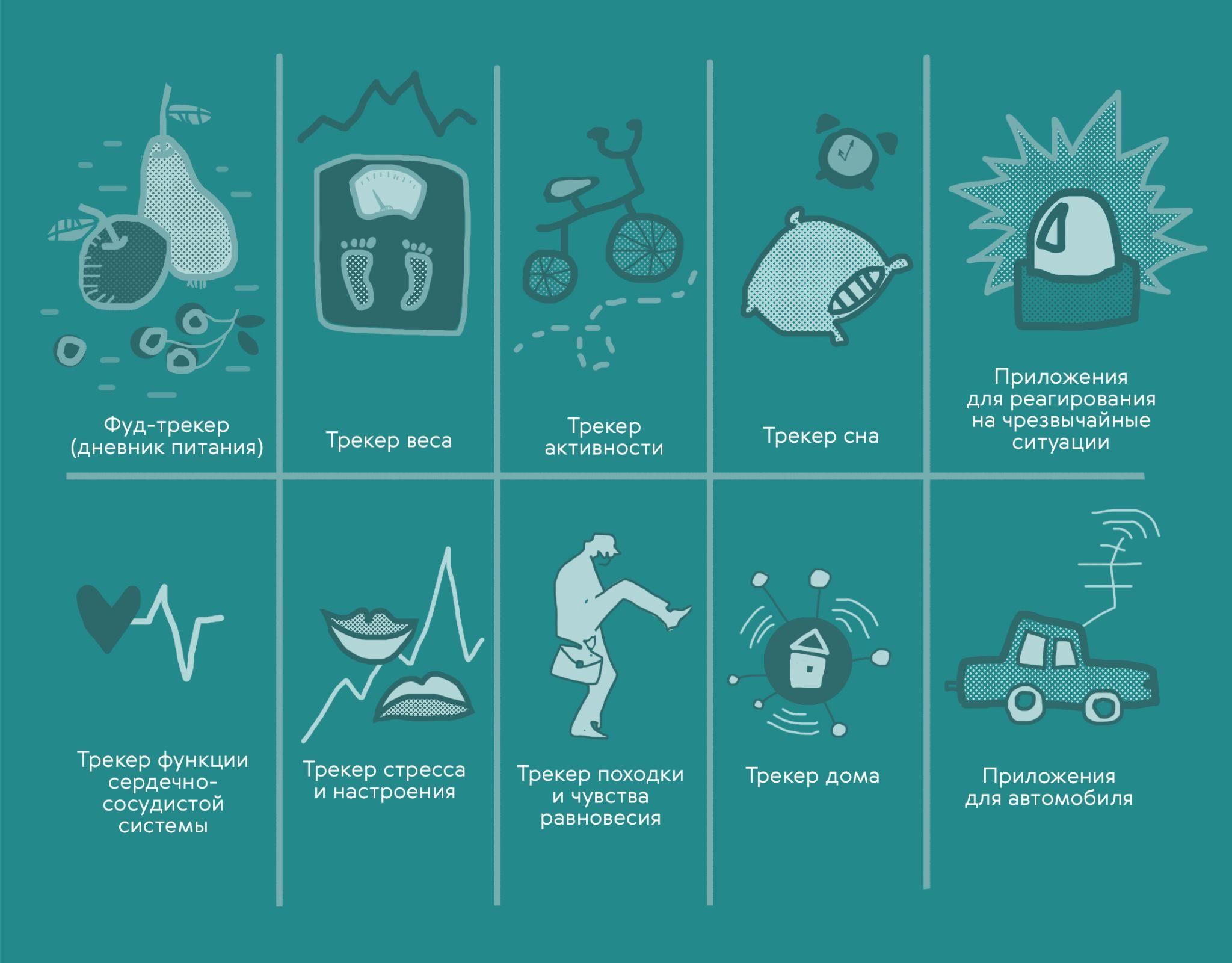
Рисунок 2. Наиболее популярные приложения для здоровья, которыми пользуются люди, по данным за 2019 год.
иллюстрация Карины Илиопуло по Smart Insights
В первую очередь, эти приложения предназначены для того, чтобы отдельно взятому человеку было удобно следить за своим здоровьем. Но с помощью них можно составлять и большие базы данных, полезные для исследовательских целей.
Помимо популярных приложений, существуют специализированные устройства. Они полезны в клинической практике, и их можно применять во время исследований. Например, исследование, опубликованное в 2018 году, описывает преимущества систем непрерывного мониторинга уровня глюкозы в крови пациентов, страдающих сахарным диабетом [17]. Традиционно у таких людей измеряют уровень гликированного гемоглобина раз в несколько месяцев, во время плановых посещений врача, но это не позволяет точно судить о частоте эпизодов гипогликемии (сниженного уровня глюкозы в крови) и гипергликемии (когда уровень глюкозы повышается выше нормальных значений). А ведь это сильно влияет на прогноз.
Системы непрерывного мониторинга уровня глюкозы помогают пациентам мгновенно регистрировать колебания сахара в крови и сразу же принимать меры, а врачам предоставляют еженедельные подробные отчеты о том, в течение какого времени уровень глюкозы у диабетика сохраняется в пределах нормы и как часто «скачет». Это помогает более точно контролировать течение заболевания, эффективность лечения.
В настоящее время носимые устройства уже довольно активно применяются в клинических исследованиях. Ученые решают, какие показатели нужно оценить, подбирают соответствующие девайсы и раздают пациентам, а потом оценивают результаты. Со сбором RWD дело обстоит хуже. В научной литературе есть лишь единичные упоминания. Тут много проблем, связанных и с вопросами качества и конфиденциальности данных, обработкой и хранением информации. Ведь чтобы сохранить все данные, полученные от пациентов, нужны очень мощные компьютеры, работать с которыми должны специалисты: многие клиники попросту не располагают такими ресурсами. В этой сфере есть огромный потенциал, и в будущем его еще предстоит раскрыть [18].
Когда пациенты — сами себе исследователи
На Западе есть такое понятие, как исследовательские сети, созданные пациентами (patient-powered research networks, PPRN). Этим термином обозначают онлайн-платформы, которые создали и которыми управляют сами пациенты; лица, представляющие их интересы (например, ассоциации пациентов, группы по защите интересов); родственники и ухаживающий персонал; врачи; исследователи.
PPRN могут собирать и систематизировать данные, касающиеся как одного определенного, так и разных заболеваний. На таких площадках пациенты могут делиться опытом, рассказывать о течении заболевания, эффективности и побочных эффектах препаратов, оставлять отзывы. Одну из самых больших и популярных PPRN мы уже рассматривали выше — это PatientsLikeMe. Некоторые другие примеры:
- PCORnet — платформа, созданная в США Исследовательским институтом результатов, ориентированных на пациента (Patient-Centered Outcomes Research Institute, PCORI). Эта организация финансирует и поддерживает около 30 сетей PPRN, посвященных различным заболеваниям.
- Accelerated Cure Project — платформа, предназначенная для обмена информацией между 3000 пациентами. Ученым эти данные помогают ускорить исследования, посвященные рассеянному склерозу.
Один из примеров PPRN вспомнит практически каждый человек, переживший разгар пандемии COVID-19. Многие состояли в телеграм-чатах, посвященных этой инфекции, где люди рассказывали о своих симптомах, лечении, опыте вакцинации.
Почему RWD/RWE стали особенно актуальны именно сейчас?
Этому поспособствовало развитие технологий. Раньше, после того как новый лекарственный препарат попадал на рынок, собирать информацию о нем было намного сложнее. Это требовало много времени, труда и финансовых вложений, но часто всё равно не помогало находить ответы на некоторые важные вопросы.
Современные технологии открыли массу новых возможностей. Интернет, мощные компьютеры, мобильные и носимые устройства, искусственный интеллект, нейросети и data science — всё это помогает намного быстрее и эффективнее собирать и обрабатывать информацию. RWD и RWE становятся важным игроком, и это наглядно показывает кейс с препаратом Програф 2021 года.
Проблемы RWD/RWE
Конечно же, RWD и RWE неидеальны, и у них есть существенные недостатки, ограничивающие применение:
- Источники реальных данных невозможно строго контролировать: из-за их большого количества и разнородности, а также из-за специфики некоторых источников.
- На входе данные реального мира неоднородны, и это обуславливает целый пласт проблем с их сбором, обработкой и анализом.
- Существует проблема стандартизации данных: между отдельными клиниками, практиками внутри одного региона, между регионами и странами.
- Многие источники изначально не служат для того, чтобы предоставлять данные для исследований. У них есть свои цели — например, у баз данных страховых компаний.
- Неполные данные. Например, в источнике может быть указано, что пациент прошел некое исследование, но его результаты не описаны.
- Предвзятость людей, которые получают и интерпретируют данные.
- Противоречивость данных из разных источников.
- Отдельную проблему, как мы упоминали выше, составляет вопрос конфиденциальности данных пациентов. Например, в США действует Закон о возможности переноса и подотчетности медицинского страхования от 1996 г. (Health Insurance Portability and Accountability Act, HIPAA), на территории Европейского Союза — Общий регламент по защите данных (General Data Protection Regulation, GDPR).
Одной из самых больших проблем является качество больших данных, собранных в «полевых условиях». Именно это направление является одним из приоритетных в работе регуляторов по всему миру. В этой сфере (да и везде — будем честными) действует концепция garbage in, garbage out (GIGO). Она гласит, что «мусорные» (бессмысленные или ошибочные) данные на входе порождают такие же «мусорные» данные на выходе. В случае с RWD это очень актуально, потому что информация собирается самая разная. При этом источники данных не всегда бывают качественными — ведь тут нет такого контроля, как в рандомизированных контролируемых исследованиях. Любые данные, которые собираются ретроспективно, подвержены манипуляциям и искажениям, поэтому доверие к ним изначально меньше.
Как регулирующие органы в разных странах решают эти проблемы?
Основные инициативы разных стран в области регуляции RWE представлены на рис. 4.
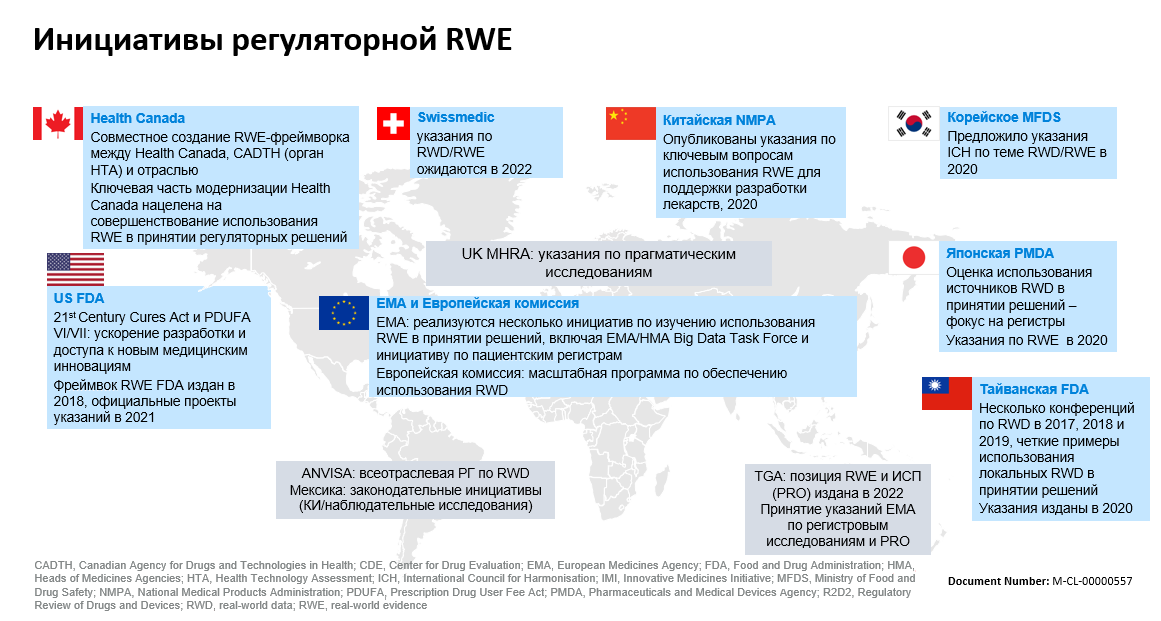
Рисунок 4. Инициативы регуляторной RWE в мире.
презентация рецензента этой статьи Равиля Ниязова
Для примера раскроем подробнее некоторые документы и проекты документов, разработанные в Евросоюзе Руководителями медицинских агентств (Heads of Medicine Agencies, HMA) и EMA:
- Список метаданных для каталогов данных реального мира содержит перечень метаданных, предназначенных для включения в каталог источников информации о существующих базах RWD и исследованиях, проведенных с использованием источников данных. Это должно повысить прозрачность обсервационных исследований, помочь в обнаружении исследований и источников данных, а также повысить способность судить о доказательной ценности обсервационных исследований и источников RWD при их использовании для исследования применения, безопасности и эффективности лекарственных средств.
- Проект Руководства по надлежащей практике использования Каталога метаданных источников RWD преследует две цели. Во-первых, он призван помочь обнаружить источники данных и выделить подходящие для использования в определенных исследовательских целях. Во-вторых, этот документ поможет быстро получать информацию о пригодности источников данных, представленных в протоколе исследования или в отчете об исследовании.
- Структура качества данных для регулирования лекарственных средств в ЕС. Этот документ описывает качество данных, которые важны для принятия нормативных решений, определения параметров и подпараметров данных, а также их важных характеристик и показателей.
В феврале 2022 стартовал проект EMA — Сеть анализа данных и опроса в реальном мире (Data Analysis and Real World Interrogation Network, DARWIN EU). Ожидается, что система будет полностью введена в эксплуатацию в 2024 году. Задача DARWIN EU — предоставлять экспертам (в первую очередь из регулирующих органов ЕС) данные о болезнях, характеристиках популяции, использовании и эффективности лекарственных препаратов со всей территории Евросоюза. Основные функции этой системы:
- создать и расширять каталог источников данных наблюдений для использования в регулировании лекарственных средств;
- представлять источники высококачественных, проверенных реальных данных об использовании, безопасности и эффективности лекарственных средств;
- решать различные задачи путем проведения высококачественных неинтервенционных исследований, включая разработку научных протоколов, изучение соответствующих источников данных, а также интерпретацию и представление результатов исследований.
В США использование доказательств, полученных на основе RWE, регулируется вышеупомянутой секцией 3022 Закона США о методах лечения XXI века. Он напрямую обязывает FDA утвердить программу использования RWE в течение двух лет с момента принятия закона, в сотрудничестве с научными организациями, профессиональным медицинским сообществом, пациентскими организациями и другими заинтересованными участниками отрасли [21]. В свою очередь, эта программа нужна для того, чтобы путем анализа RWE решать следующие задачи:
- поддержка заявлений на использование уже зарегистрированного лекарственного препарата по новым показаниям;
- поддержки или удовлетворения требований о проведении пострегистрационных исследований лекарственного препарата.
Кроме того, согласно этому закону, в течение пяти лет FDA обязана разработать проект руководства, в котором должно быть прописано: при каких условиях можно опираться на RWD; стандарты и методология сбора таких данных.
В декабре 2018 года эксперты FDA разработали и опубликовали еще один документ — «Основы для RWE программы FDA» (Framework for FDA’s Real-World Evidence Program). В нем прописаны ключевые подходы FDA к применению RWD для принятия регуляторных решений. В этом же документе эксперты дают определение RWD и уточняют определение RWE. Также FDA опубликовало некоторые специальные указания:
- Использование данных электронной медицинской карты в клинических исследованиях (Use of Electronic Health Record Data in Clinical Investigations).
- Использование фактических данных для поддержки принятия нормативных решений в отношении медицинских устройств (Use of Real-World Evidence to Support Regulatory Decision-Making for Medical Devices).
- Реальные данные: оценка электронных медицинских карт и данных о медицинских заявлениях для поддержки принятия нормативных решений в отношении лекарственных средств и биологических продуктов (Real-World Data: Assessing Electronic Health Records and Medical Claims Data To Support Regulatory Decision-Making for Drug and Biological Products).
- Стандарты данных для досье/документации лекарств и биологических продуктов, содержащих реальные данные (Data Standards for Drug and Biological Product Submissions Containing Real-World Data).
- Реальные данные: оценка реестров для поддержки принятия нормативных решений в отношении лекарственных средств и биологических продуктов (Real-World Data: Assessing Registries to Support Regulatory Decision-Making for Drug and Biological Products).
- Рекомендации по использованию реальных данных и фактических данных для поддержки принятия нормативных решений в отношении лекарственных средств и биологических продуктов (Considerations for the Use of Real-World Data and Real-World Evidence to Support Regulatory Decision-Making for Drug and Biological Products).
- Подача документов с использованием реальных данных и фактических данных в FDA для лекарственных средств и биологических продуктов (Submitting Documents Using Real-World Data and Real-World Evidence to FDA for Drug and Biological Products).
Ведется работа в этом направлении и в Евразийском экономическом союзе (ЕАЭС). В марте 2022 года Решением Совета ЕЭК № 36 от 17.03.2022 «О внесении изменений в Правила регистрации и экспертизы лекарственных средств для медицинского применения» были утверждены определения RWD и RWE. В конце 2022 года разработана Концепция развития подходов к сбору, анализу и использованию данных реальной клинической практики в государствах — членах Евразийского экономического союза. Также разрабатывается Руководство по общим подходам к получению, анализу и использованию данных реальной клинической практики в жизненном цикле лекарственного препарата.
Большие данные и искусственный интеллект
Собрать данные — это полдела: их ведь еще нужно обработать, проанализировать и сделать определенные полезные выводы (не просто так же их собирали!). В современном мире это становится всё сложнее. Скорость сбора данных во всех сферах, в том числе в медицине, удваивается каждые 40 месяцев [22]. Нас окружают огромные массивы информации, и «выудить» из них необходимые данные порой так же сложно, как отыскать иголку в стоге сена.
В 1990 году впервые был предложен термин «большие данные» (big data). Так было решено обозначить наборы данных, которые настолько велики, что их сложно обрабатывать с помощью обычного программного обеспечения. В 2016 году этот термин получил новую характеристику: большие данные отличаются большим объемом, скоростью накопления и разнообразием, требуют специальных технологий и аналитических методов для преобразования, чтобы их можно было использовать для каких-то полезных целей [22].
При этом большие медицинские данные имеют некоторые особенности, накладывающие определенные условия на работу с ними [23]:
- В этой сфере важную роль играет вопрос конфиденциальности. Доступ к данным пациентов зачастую получить не так-то просто. В противном случае их смогут использовать люди, которыми не всегда движут хорошие намерения.
- Многие медицинские данные собирают с помощью стандартных форм, поэтому зачастую они изначально структурированы.
- Решения, принятые на основе больших данных в медицине, влияют на жизнь и здоровье людей. Поэтому здесь нужна высокая точность, и к формированию любых выводов нужно подходить максимально ответственно.
- Сбор медицинских данных часто бывает сложным и затратным: необходимо задействовать многочисленный персонал, проводить дорогостоящие инструментальные и лабораторные исследования.
- Нередко объем данных, которые удается собрать в медицине, меньше, чем в других сферах, и впоследствии сложно воспроизвести условия, в которых они были получены.
- Спектр заболеваний и условий, способных влиять на здоровье людей, весьма широк. Приходится одновременно учитывать множество разных факторов, понимать, какой вклад вносит каждый из них и как они взаимодействуют между собой.
- Существует ряд причин, по которым данные могут получиться неточными. Например, врач может неправильно измерить определенные показатели во время обследования в силу тех или иных факторов. Пациент может не прийти вовремя на процедуру или забыть принять лекарство в назначенное время.
- На больших данных довольно легко получить ложные корреляции, поэтому необходимо использовать новые статистические инструменты, разработанные специально для больших данных.
Анализировать огромные массивы данных и находить среди них полезную информацию помогают технологии искусственного интеллекта. В настоящее время они применяются на всех этапах разработки и жизненного цикла лекарственных препаратов (рис. 5) [24].
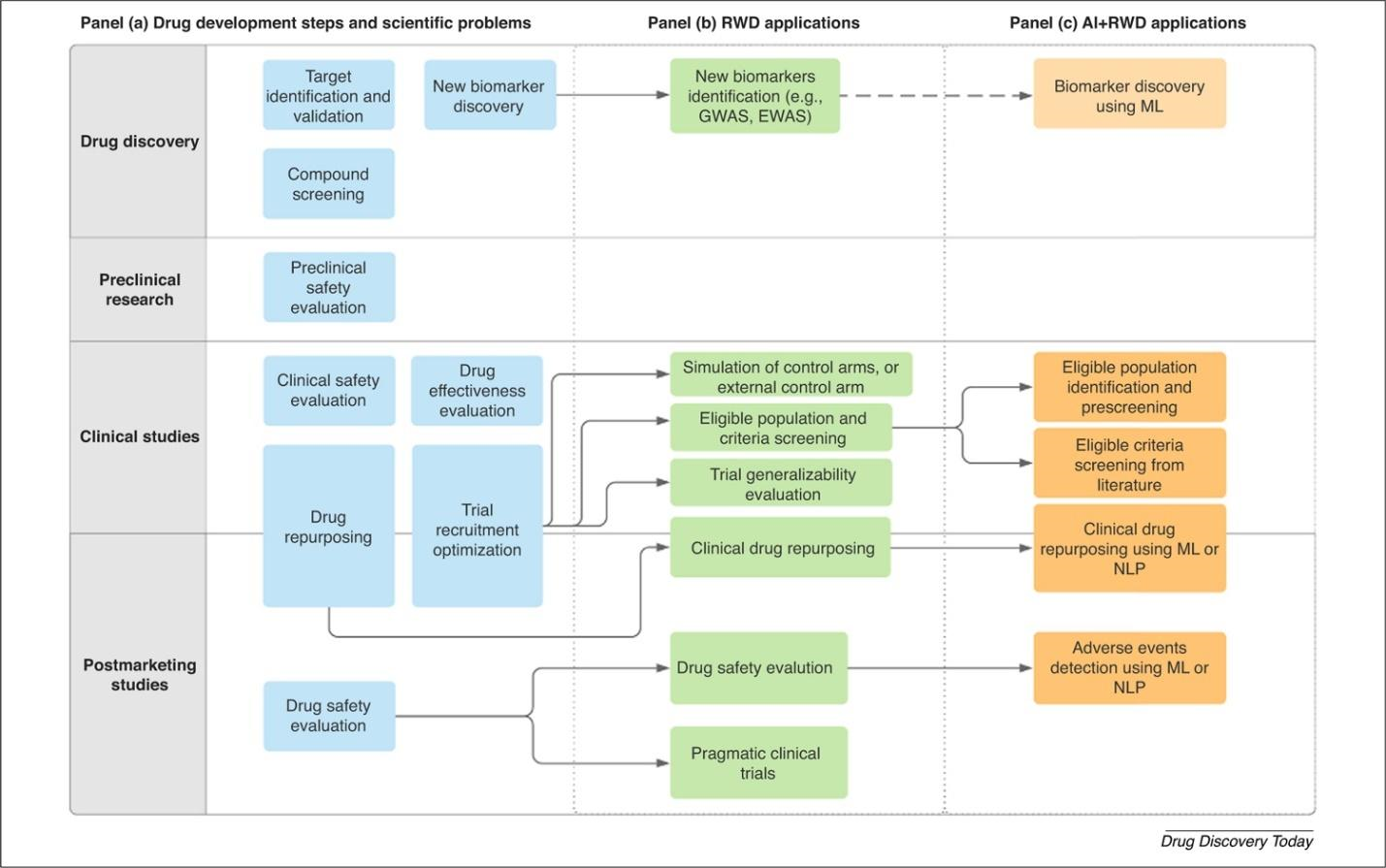
Рисунок 5. Применение искусственного интеллекта и RWD на разных этапах разработки лекарственных препаратов.
Пострегистрационные исследования и анализ RWD
RWD не всегда однородны и хорошо структурированы. Одно дело, когда данные представлены в виде чисел и таблиц, и совсем другое, когда это изображения, либо неструктурированный, а иногда и вообще написанный от руки текст. И, напомним — таких данных много. На то, чтобы их просмотреть и выбрать ценную информацию, у человека ушло бы много лет. А технологии искусственного интеллекта и машинного обучения умеют делать это намного быстрее.
Но тут есть одна загвоздка. Машинное обучение на то так и называется, что, прежде чем что-то анализировать, ему нужно обучиться на доступных примерах. В других сферах проблем с этим не возникает. Скачиваем из интернета тысячи фотографий котиков, «скармливаем» их программе и впоследствии она сможет нам сказать, что изображено на любой картинке: котик или что-то другое. Данные пациентов, например, фотографии гистологических образцов какой-нибудь злокачественной опухоли или скан рецепта, машине «скормить» сложнее. Ведь эта информация конфиденциальна и зачастую не распространяется в открытом доступе. Это существенное ограничение, и еще предстоит придумать, как его преодолеть, не нарушая прав пациентов.
В целом же, возможности современных компьютеров весьма впечатляют. Эксперты считают, что анализ RWD с помощью ИИ поможет не только исследователям, но и врачам, специалистам в сфере здравоохранения. Это то, что может сделать медицину более персонализированной, а значит и более эффективной для каждого отдельно взятого пациента [24], [25]. И тут встает еще одна проблема: для такого грандиозного начинания необходима соответствующая инфраструктура в учреждениях здравоохранения. Нужны мощные компьютеры, соответствующее программное обеспечение, специалисты, которые будут со всем этим работать и предоставлять информацию врачам.
Разработка лекарственных форм
Когда пациент проходит курс лечения, он принимает не просто «голое» химическое соединение, а лекарство в определенной форме. Какая лекарственная форма будет оптимальная в том или ином случае? Как она будет вести себя в организме пациента? Какая будет действовать быстрее и с минимумом нежелательных явлений? Может быть, существующую лекарственную форму стоит заменить на другую, более эффективную/безопасную/удобную? Раньше ответы на эти вопросы приходилось искать методом проб и ошибок. Сейчас всё чаще привлекают ИИ. Современные вычислительные технологии помогают оценивать разные характеристики лекарств, такие как стабильность, растворимость, пористость, подбирать для препаратов оптимальные вспомогательные вещества, их количества.
Экономический вопрос
После того, как фармкомпания разработала и успешно зарегистрировала новый препарат, нужно решить, сколько он будет стоить. Вопрос не такой простой, как может показаться на первый взгляд: нужно окупить вложения в разработку и клинические исследования, а они для новых препаратов измеряются миллиардами долларов. Взять для примера современные таргетные препараты [27] и иммунопрепараты из группы ингибиторов контрольных точек [28]: они стоят существенно дороже по сравнению с классическими химиопрепаратами, и при этом помогают не всем пациентам. Отсюда вытекает еще одна проблема: врачи должны отбирать больных, которым действительно стоит назначить такое лекарство, сопоставив стоимость препарата и ожидания того, насколько он в данном случае сможет продлить жизнь, повысить ее качество. Всеми этими нюансами занимается довольно сложная наука под названием фармакоэкономика — о ней мы писали в статье «Фармакоэкономика: лечить или экономить?» [29]. И в этой сфере в последнее время всё большую роль играет анализ RWD.
Например, RWD в настоящее время всё чаще используются для анализа экономической эффективности (cost-effectiveness analysis, CEA). При этом сравнивают результат применения двух лекарственных препаратов, обладающих разной эффективностью. Показатели, в которых измеряют разницу, называют натуральными единицами. Это может быть выздоровление от заболевания, продолжительность жизни, улучшение каких-либо клинических показателей (например, стабилизация артериального давления). Данные, собранные от десятков и сотен тысяч пациентов на большом промежутке времени, очень удобны для оценки всех этих показателей.
В 2007 году Целевая группа по реальным данным Международного общества фармакоэкономических исследований опубликовала отчет, в котором заявила о целесообразности применения RWD для оценки страховых покрытий и решений о выплатах. В этом отчете эксперты определили RWD как все данные, собранные вне рандомизированных клинических исследований (РКИ), и выделили шесть основных источников, откуда они могут быть получены [30]:
- дополнения к классическим РКИ;
- крупные простые клинические испытания;
- реестры пациентов;
- административные базы данных;
- базы данных медицинских обследований;
- электронные медицинские карты пациентов и их базы.
В первую очередь RWD и RWE полезны для тех, кто непосредственно оплачивает медицинские услуги — страховых компаний, государства. Польза эта может проявляться в разных отношениях: данные реального мира позволяют (рис. 6) [31]:
- Сравнивать эффективность медицинских вмешательств. На эту тему не всегда можно найти клинические исследования, а RWD позволяют получить массу ценной информации. Это помогает судить о том, от каких видов лечения пациенты получат наибольшую пользу.
- Осуществлять мониторинг безопасности. Узнать не только о тех нежелательных эффектах, которые удалось выявить во время трех фаз клинических испытаний, но и о более редких. Причем ситуацию можно отслеживать буквально в режиме реального времени, узнавать о новых сообщениях о нежелательных эффектах препаратов.
- Оценить приверженность. То есть проверить, принимают ли пациенты лекарственные препараты четко в соответствии с назначениями врача, полностью ли проходят курс лечения. Если пациент нарушает назначения, то можно попытаться выяснить, с чем это связано. Например, причиной может стать неудобная лекарственная форма, нежелательные эффекты, высокая стоимость.
- Проанализировать затраты и эффективность использования ресурсов здравоохранения. И в том числе найти пути оптимизации расходов. Например, подобрать для пациента такой препарат, который надолго улучшит его состояние и предотвратит частые обращения за неотложной медицинской помощью. И пусть этот препарат дороже — но он поможет сэкономить в долгосрочной перспективе.
- Узнать о результатах лечения из первых уст (то есть, от самих пациентов). Эта информация может отличаться от полученной во время клинических исследований. Например, участники КИ добросовестно принимают назначенный препарат, потому что у них достаточно высока мотивация, а в реальной жизни рекомендациям врача могут следовать только 30–40% пациентов.
- Развивать персонализированную медицину. На эффективность и риск нежелательных эффектов лекарств влияют многие факторы, и не все их можно учесть в клинических исследованиях. Оценивая большие массивы данных, можно «накопать» много интересных нюансов и назначать лекарства более персонализированно.
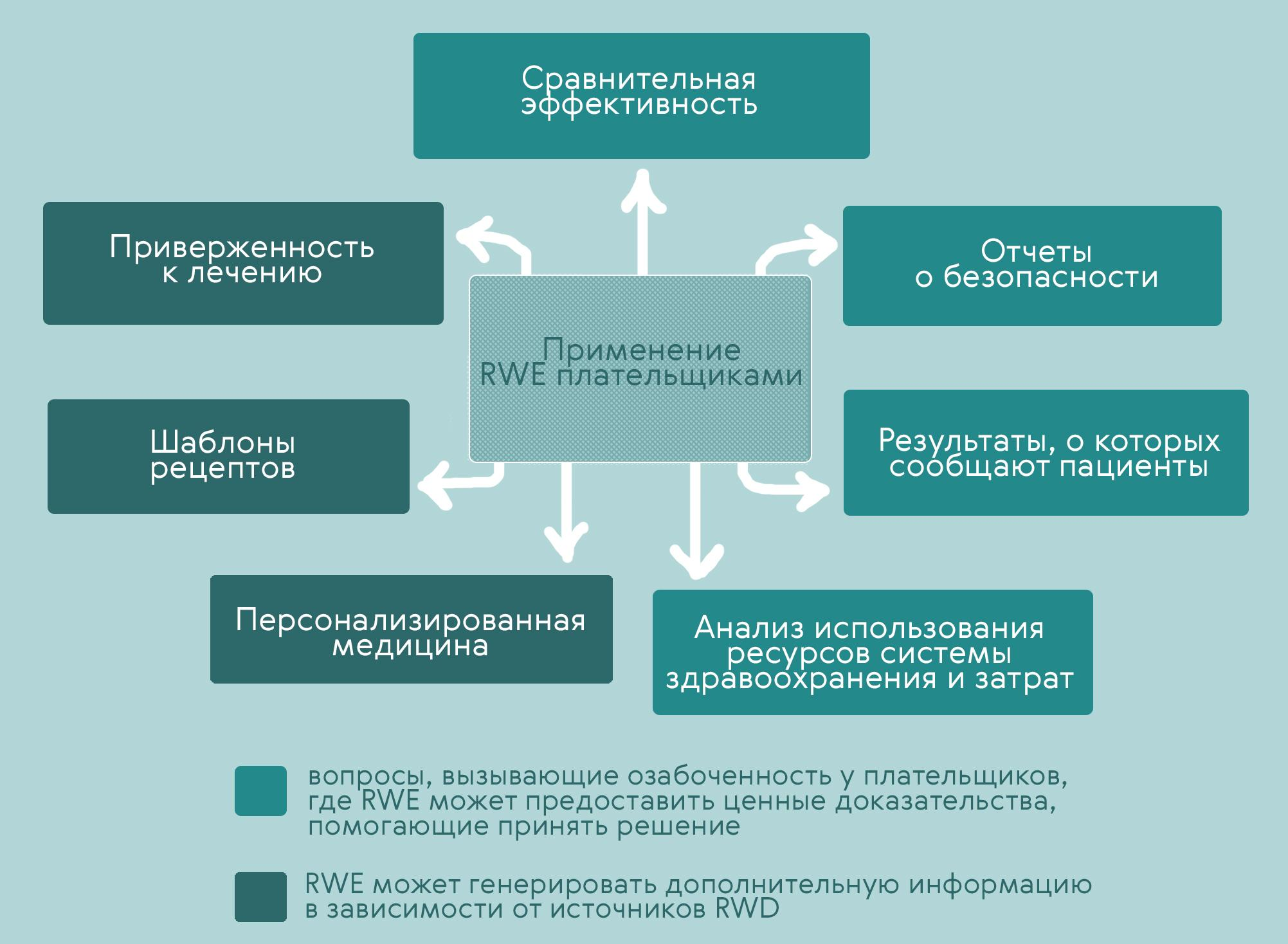
Рисунок 6. Применение RWD и RWE в фармакоэкономике. Полезные данные, которые могут использовать организации, оплачивающие медицинские услуги.
иллюстрация Карины Илиопуло по [31]
Просматривая этот список, можно заметить, что многие пункты на первый взгляд больше касаются медицины, а не экономики. На самом деле, фармакоэкономика — это не о том, как сэкономить на здоровье людей и получить максимальную прибыль от продажи дорогущих лекарств. Глобальная цель — разумное распределение ресурсов: так, чтобы каждый человек мог получить в достаточном объеме именно ту медицинскую помощь, которая ему нужна. Ведь в современном мире наблюдается всё больший разрыв между эффективностью лечения и его стоимостью. Новые препараты всё дороже — и на то есть объективные причины: ведь их разработка обходится в огромные суммы, которые нужно окупать. При этом не каждый новый препарат становится громким прорывом, кардинально меняющим ту или иную сферу медицины. В большинстве случаев речь идет о неких измеримых и не всегда очень больших изменениях в эффективности лечения, качестве и продолжительности жизни пациентов. В исторической перспективе это дает ощутимые результаты: например, за последние десятилетия сильно увеличилась выживаемость среди онкологических больных, врачам удается чаще добиваться ремиссии. Но на коротком отрезке времени есть пациент, есть страховая компания, и им нужно где-то брать деньги на покупку лекарств, оплату медицинских услуг. Им нужно понимать, насколько целесообразны эти затраты — стоит ли овчинка выделки? А фармкомпаниям, в свою очередь, нужно понимать, целесообразны ли затраты на разработку, продвижение тех или иных препаратов. Разобраться в этом и помогает фармакоэкономика, а ей, в свою очередь, большим подспорьем служат RWD и RWE.
Фармакогеномика: новые возможности для персонализированной медицины
Британскому врачу Арчибальду Гарроду, жившему в прошлом столетии, принадлежит такая цитата:
Каждое лекарство является ядом, если принимать его в больших дозах; и у некоторых субъектов доза, безвредная для большинства людей, оказывает токсическое действие, в то время как другие демонстрируют отличную переносимость этого препарата
Можно сказать, что это уникальное наблюдение стало первым шагом к развитию фармакогеномики — науки о связи между наследуемыми признаками людей и реакциями на лекарственные препараты. Тут к месту вспомнить принцип, провозглашенный еще Гиппократом: «лечить не болезнь, а больного». С развитием генетики и молекулярной биологии ученые и врачи нашли в этой фразе еще один, более глубокий смысл. Каждый из нас носит в своих клетках уникальный набор генов, и, хотя в целом мы сильно похожи, иногда генетические варианты заставляют людей по-разному реагировать на введение лекарственных препаратов. Подробнее об этом можно почитать в нашей статье «Фармакогеномика: изучение генов на службе персонализированной медицины» [32]. В настоящее время достижения этой науки уже используются в разработке новых лекарств, при назначении уже существующих и контроле их безопасности.
Так, в инструкциях к 15% препаратов, одобренных FDA и Европейским агентством лекарственных средств (European Medicines Agency, EMA), присутствует информация о фармакогеномике. В 2009 году был создан Консорциум по внедрению клинической фармакогенетики (Clinical Pharmacogenetics Implementation Consortium, CPIC), и он регулярно публикует рекомендации, которые помогают врачам понимать, как использовать эту информацию при назначении лекарств. Этот документ помогает «донести» фармакогенетические знания «от лаборатории до кровати пациента».
В настоящее время врачи всего мира осознали ценность исследования у пациентов вариантов генов, влияющих на эффекты лекарственных препаратов. Сейчас такие данные доступны во многих электронных медицинских картах. И в этой сфере запущены некоторые проекты. Например, в десятках медицинских центров США работает проект Electronic Medical Records and Genomics PGx (eMERGE-PGx), в рамках которого проводится тестирование 9 тысяч пациентов на 84 гена, влияющих на фармакодинамику и фармакокинетику лекарственных препаратов. В Европе в семи медицинских центрах действует консорциум Ubiquitous Pharmacogenomics Consortium (U-PGx) — здесь эксперты внедряют тестирование на 40 таких генов и оценивают его влияние на результаты медикаментозной терапии.
Всё чаще берут на вооружение фармакогеномику и фармкомпании — эти знания можно применить для разработки новых лекарственных препаратов и тем самым сделать инструкции к их применению более персонализированными. Параллельно ученые продолжают открывать новые связи между генетическими вариантами и эффектами лекарств. Эта работа способствует развитию персонализированной медицины — одному из главных трендов современного здравоохранения. А концепция RWD помогает более эффективно собирать и анализировать эти данные.
Подводя итог, повторимся, что RWD и RWE играют всё более значимую роль в разработке новых лекарственных препаратов и фармаконадзоре. Ученые убедились, что «в полях» можно получить много ценной информации, которая существенно дополняет и обогащает данные, добытые из клинических исследований. Несомненно, в будущем это направление продолжит развиваться и будет находить всё большее применение.
Литература
- Доверяй, но проверяй: как контролируют эффективность и безопасность лекарств и других продуктов после регистрации?;
- Результаты 1/2 фаз испытания российской вакцины от COVID-19: разбираем статью в The Lancet;
- Путь к тысячам аптек начинается с одной молекулы;
- Amr Makady, Anthonius de Boer, Hans Hillege, Olaf Klungel, Wim Goettsch. (2017). What Is Real-World Data? A Review of Definitions Based on Literature and Stakeholder Interviews. Value in Health. 20, 858-865;
- Madison Milne-Ives, Michelle Helena van Velthoven, Edward Meinert. (2020). Mobile apps for real-world evidence in health care. Journal of the American Medical Informatics Association. 27, 976-980;
- Simon Dagenais, Leo Russo, Ann Madsen, Jen Webster, Lauren Becnel. (2022). Use of Real‐World Evidence to Drive Drug Development Strategy and Inform Clinical Trial Design. Clin Pharma and Therapeutics. 111, 77-89;
- Workman T. Engaging Patients in Information Sharing and Data Collection: The Role of Patient-Powered Registries and Research Networks [Internet]. Rockville (MD): Agency for Healthcare Research and Quality (US), 2013.;
- Gliklich R. Leavy M., Dreyer N. Registries for Evaluating Patient Outcomes: A User’s Guide [Internet]. 4th edition. Rockville (MD): Agency for Healthcare Research and Quality (US), 2020;
- A. V. Gusev, B. V. Zingerman, D. S. Tyufilin, V. V. Zinchenko. (2022). Electronic medical records as a source of real-world clinical data. MyRWD. 2, 8-20;
- Rachel RJ Kalf, Amr Makady, Renske MT ten Ham, Kim Meijboom, Wim G Goettsch, IMI-GetReal Workpackage 1. (2018). Use of Social Media in the Assessment of Relative Effectiveness: Explorative Review With Examples From Oncology. JMIR Cancer. 4, e11;
- Jackie M. Street, Annette J. Braunack-Mayer, Karen Facey, Richard E. Ashcroft, Janet E. Hiller. (2008). Virtual community consultation? Using the literature and weblogs to link community perspectives and health technology assessment. Health Expect. 11, 189-200;
- Gregory E. Powell, Harry A. Seifert, Tjark Reblin, Phil J. Burstein, James Blowers, et. al.. (2016). Social Media Listening for Routine Post-Marketing Safety Surveillance. Drug Saf. 39, 443-454;
- E.O. Thorp. (). The invention of the first wearable computer. Digest of Papers. Second International Symposium on Wearable Computers (Cat. No.98EX215);
- Lin Lu, Jiayao Zhang, Yi Xie, Fei Gao, Song Xu, et. al.. (2020). Wearable Health Devices in Health Care: Narrative Systematic Review. JMIR Mhealth Uhealth. 8, e18907;
- «Большой брат следит за тобой», или Как развитие технологий меняет нашу жизнь;
- Мобильные технологии для жизни и спорта;
- Beyond A1C Writing Group. (2018). Need for Regulatory Change to Incorporate Beyond A1C Glycemic Metrics. Diabetes Care. 41, e92-e94;
- Editorial. (2019). Getting real with wearable data. Nat Biotechnol. 37, 331-331;
- Angela van der Plas, Meagan Antunes, Alba Romero-Kauss, Matthew Hankins, Annie Heremans. (2022). Ischemic Heart Disease and Chronic Obstructive Pulmonary Disease Hospitalizations in Japan Before and After the Introduction of a Heated Tobacco Product. Front. Public Health. 10;
- PMI Science (2022). Количество госпитализаций, связанных с ХОБЛ и ИБС, начало снижаться после выпуска нагреваемых табачных продуктов на рынок Японии. Scientific Update, 16.;
- M. A. Borzova, А. S. Kolbin. (2021). Applying real-world data to support regulatory decision — making in the United States. GCP. 20, 64-69;
- Mary Mallappallil, Jacob Sabu, Angelika Gruessner, Moro Salifu. (2020). A review of big data and medical research. SAGE Open Medicine. 8, 205031212093483;
- Choong Ho Lee, Hyung-Jin Yoon. (2017). Medical big data: promise and challenges. Kidney Res Clin Pract.. 36, 3-11;
- Zhaoyi Chen, Xiong Liu, William Hogan, Elizabeth Shenkman, Jiang Bian. (2021). Applications of artificial intelligence in drug development using real-world data. Drug Discovery Today. 26, 1256-1264;
- A. Damiani, C. Masciocchi, J. Lenkowicz, N. D. Capocchiano, L. Boldrini, et. al.. (2021). Building an Artificial Intelligence Laboratory Based on Real World Data: The Experience of Gemelli Generator. Front. Comput. Sci.. 3;
- Debleena Paul, Gaurav Sanap, Snehal Shenoy, Dnyaneshwar Kalyane, Kiran Kalia, Rakesh K. Tekade. (2021). Artificial intelligence in drug discovery and development. Drug Discovery Today. 26, 80-93;
- Таргетная терапия — прицельный удар по болезни;
- Иммунитет без тормозов: Нобелевская премия за антитела против рака (2018);
- Фармакоэкономика: лечить или экономить?;
- Z. Kevin Lu, Xiaomo Xiong, Taiying Lee, Jun Wu, Jing Yuan, Bin Jiang. (2021). Big Data and Real-World Data based Cost-Effectiveness Studies and Decision-making Models: A Systematic Review and Analysis. Front. Pharmacol.. 12;
- Melissa H. Roberts, Gary T. Ferguson. (2021). Real-World Evidence: Bridging Gaps in Evidence to Guide Payer Decisions. PharmacoEconomics Open. 5, 3-11;
- Фармакогеномика: изучение генов на службе персонализированной медицины.






