Внутренне-неупорядоченные белки — «темная материя» белкового мира
26 апреля 2022
Внутренне-неупорядоченные белки — «темная материя» белкового мира
- 1422
- 0
- 7
Внутренне-неупорядоченные белки не имеют жесткой трехмерной структуры, но зато могут принимать множество конформаций, обеспечивающих выполнение разных функций. Такие белки часто отвечают за «принятие решений» в процессе развития клеток, причем переходы между конформациями носят случайный характер. Изучение внутренне-неупорядоченных белков открывает новые страницы истории о роли случайности в биологии.
Рисунок в оригинальном разрешении.
коллаж на основе [1]
-
Автор
-
Редакторы
Белки в живых клетках играют множество ролей: катализируют химические реакции, поддерживают структуру клетки, осуществляют транспорт, распознают и передают сигналы, и так далее. Большинство из них имеют постоянную трехмерную структуру, которая и определяет их функции. Большинство, да не все: у некоторых фиксированное строение отсутствует (а точнее, оно постоянно меняется); их даже называют «внутренне-неупорядоченными белками». Оказывается, это не баг, а фича: благодаря своей пластичности такие белки могут взаимодействовать со множеством молекул-партнеров, оказываясь в ключевых точках важнейших процессов. Недавно гуру по недоупорядоченным белкам Владимир Уверский выпустил обзор, суммирующий их свойства и роль в клетке — и «Биомолекула» делится некоторыми его положениями.
Биология в Московском физтехе
XXI век называют «веком живых систем», изучение которых возможно только на стыке наук — математики, физики, химии и биологии. «Биомолекула» представляет серию материалов о том, как занимаются биологией в Московском физико-техническом институте (МФТИ).
С момента «изобретения» Лайнусом Полингом структуры альфа-спирали и последующей расшифровки трехмерных структур простых глобулярных белков в биологии прочно укрепилась парадигма «структура определяет функцию», а также начала развиваться самостоятельная дисциплина — структурная биология [2–4]. Усилия структурных биологов привели к расшифровке огромного количества (уже около 190 тысяч) трехмерных структур белков. Однако для еще большей массы белков строение неизвестно, и есть среди них группа молекул, которые и вовсе не имеют жесткой трехмерной структуры. Такие молекулы называют внутренне-неупорядоченными белками — и «Биомолекула» уже знакомила своих читателей с ними под именем недоупорядоченных [5], [6].
Особенно приложился к этой парадигме американский биохимик Кристиан Анфинсен, чьи работы заложили фундамент в представление о том, что аминокислотная последовательность белка полностью и однозначно (!) определяет его структуру. В 1972 году Анфинсен получил Нобелевскую премию по химии «за работы по рибонуклеазе, в особенности за связь между ее последовательностью и биологически активной структурой». Вместе с ним лауреатами стали Станфорд Мур и Уильям Стайн — «за вклад в понимание связи между химической структурой и катализом активного центра рибонуклеазы A». Помимо предмета данной статьи, парадоксальное нарушение этой догмы Анфинсена не так уж редко наблюдается в белковой вселенной: «Одна последовательность — одна структура: был ли Анфинсен неправ?» [7].
Международная группа ученых под руководством Владимира Уверского, научного сотрудника Лаборатории старения и возрастных нейродегенеративных заболеваний МФТИ и профессора Университета Южной Флориды (США) подготовила обзор, в котором авторы предложили рассматривать внутренне-неупорядоченные белки как сложные динамические системы [1]. Владимир Уверский — ведущий специалист в области изучения внутренне-неупорядоченных белков и белкового фолдинга.
Белковая вселенная
Совокупность всех белков живых организмов можно изобразить «белковой вселенной», причем эксперименты по моделированию ее эволюции показывают, что, подобно физическому аналогу, белковая вселенная также расширяется. Это происходит за счет возникновения новых белков — в результате дупликации генов и их последующей независимой эволюции. Та часть белков, для которых неизвестно трехмерное строение, представляет собой «темную материю». Продолжая аналогию с физикой, эта часть белковой вселенной не может быть исследована классическими методами структурной биологии. Однако ее представители играют огромную роль в функционировании живого и зачастую вовлечены в патогенез различных заболеваний.
Внутренне-неупорядоченные белки
Внутренне-неупорядоченные белки (англ. Intrinsically disordered proteins) не имеют жесткой структуры в физиологических условиях, не могут быть рассмотрены в рамках классической парадигмы «структура определяет функцию» и требуют особых исследовательских подходов. Их конформационную подвижность можно рассматривать как совокупность движений на разных уровнях: от колебаний отдельных связей между атомами до движения крупных частей молекулы:
- колебания связей происходят очень быстро (фемтосекунды: 10−15 с);
- движения функциональных групп — медленнее (наносекунды: 10−9 с);
- перемещения отдельных частей молекулы — еще медленнее: микро- (10−6 с) и миллисекунды (10−3 с).
Эту «матрешечную» вложенность биофизики называют «иерархией времен» (рис. 1а). Внутренне-неупорядоченные белки вместо одной функциональной структуры имеют несколько (или даже много), существуя в форме конформационных ансамблей. Говоря физическим языком, гиперповерхность потенциальной энергии этих белков имеет несколько энергетических минимумов (рис. 1в), что отличает их от нормально свернутых белков, имеющих лишь один энергетический минимум (рис. 1г). Разные конформации внутренне-неупорядоченных белков могут взаимодействовать с разными молекулами-партнерами и исполнять разные функции. Это свойство позволяет им служить «переключателями» метаболизма и других физиологических процессов клетки, всегда находясь в центре событий. Внутренне-неупорядоченные белки вовлечены в регуляцию экспрессии генов, передачи сигналов, клеточного деления и др. Нарушения их работы могут привести к диабету, онкологическим и нейродегенеративным заболеваниям [8].
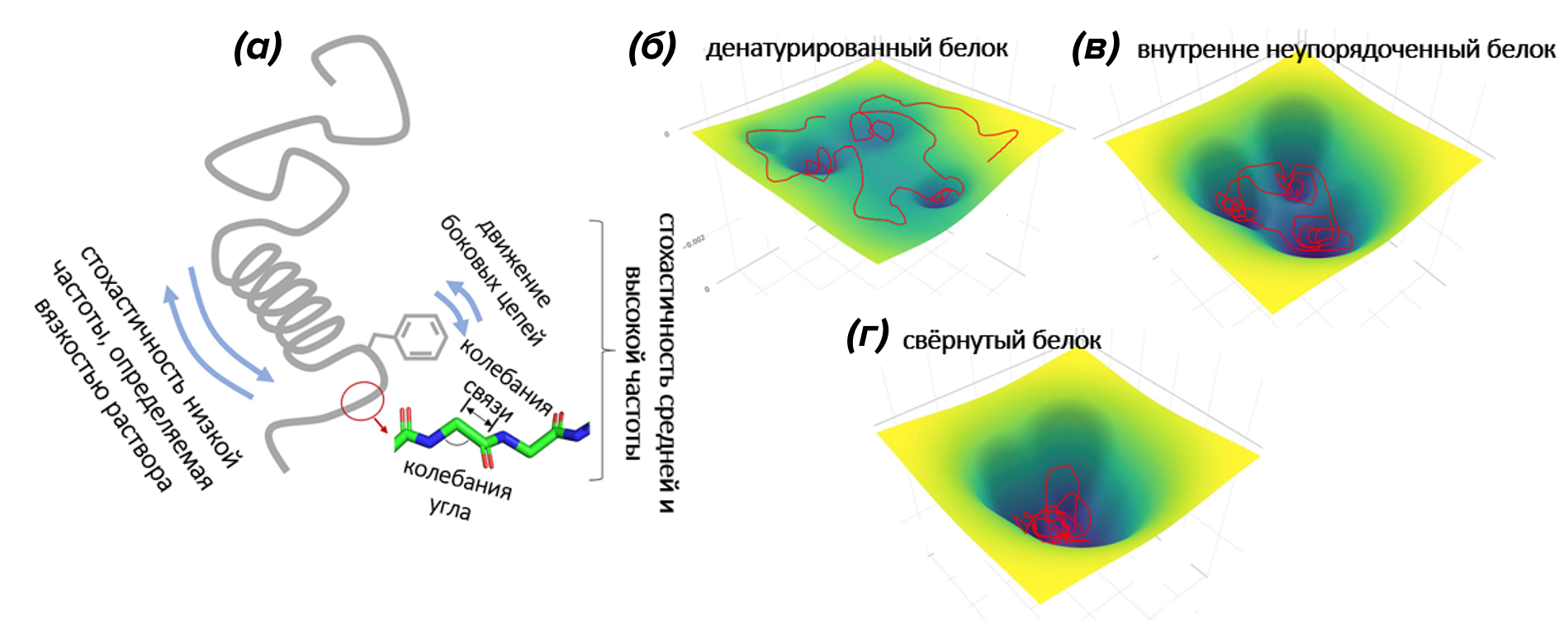
Рисунок 1. Внутренне-неупорядоченные белки.
(а) — «иерархия времен» в конформационной динамике белковой молекулы: быстрые движения представлены колебаниями связей между атомами, средние — боковых групп, медленные — движением отдельных доменов молекулы. Это движения «вложены» друг в друга наподобие матрешки.
(б—г) — схемы гиперповерхностей потенциальной энергии различных белковых молекул;
(б) — денатурированный — «развернутый», нефункциональный белок;
(в) — внутренне-неупорядоченный белок;
(г) — «хорошо» свернутый функциональный белок.
Стохастические системы: роль случайности в биологии
Так же как в физике долгое время главенствовала классическая механика, описывающая поведение тел по строго определенным (детерминистским) законам, в биологии так же главенствует детерминистская парадигма. Однако при изучении биологических процессов на молекулярном уровне невозможно не принимать во внимание стохастические (случайные) процессы. Для внутренне-неупорядоченных белков недавно было открыто явление конформационного шума, при котором молекула принимает разные функциональные конформации просто случайно [9]. Кажется, что молекулярный шум не должен отражаться на макроскопическом функционировании клетки. Однако было показано, что радикальные изменения фенотипа, которые происходят при дифференцировке клеток или злокачественной трансформации также на уровне одной клетки имеют стохастический характер [10]. Внутренне-неупорядоченные белки являются основными кандидатами на роль «исполнителей», связывающих молекулярный шум и стохастичность на клеточном уровне (рис. 2).
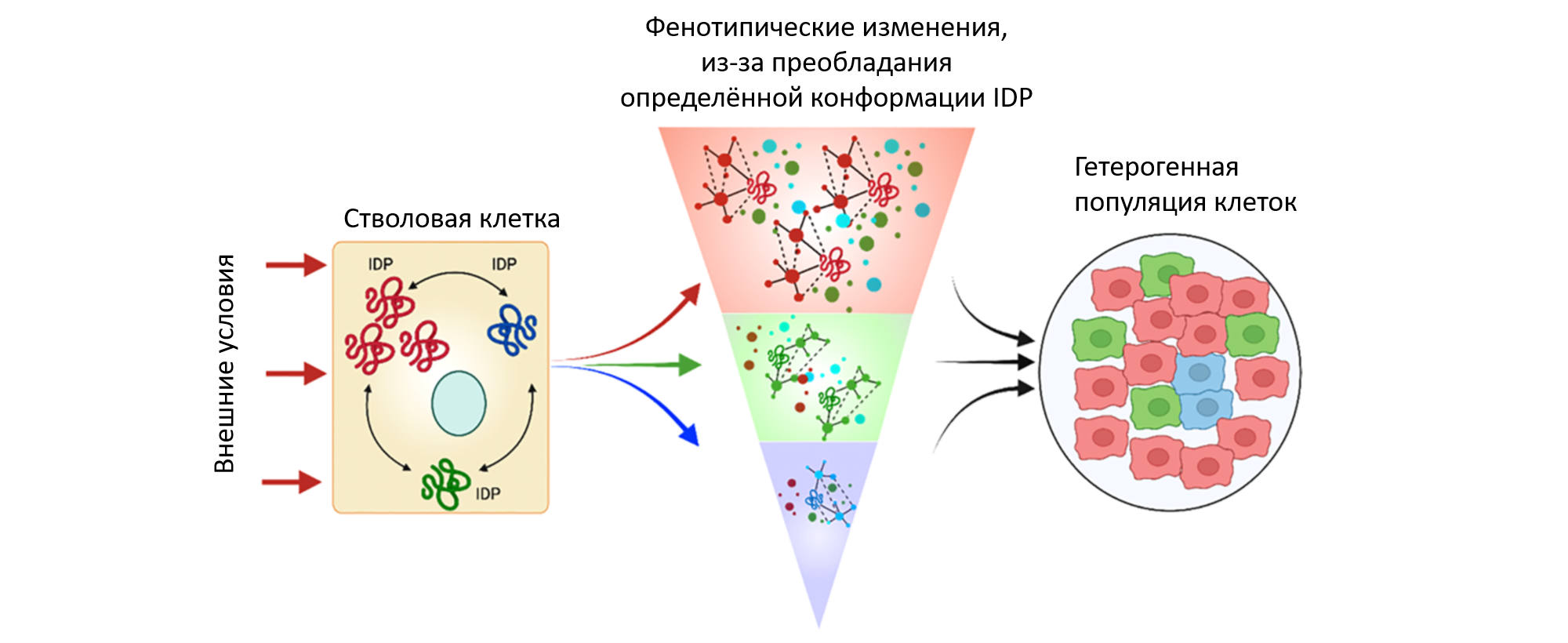
Рисунок 2. Влияние внутренне-неупорядоченного белка (IDP) на «принятие решений» стволовой клеткой в процессе дифференцировки. Различные конформации IDP показаны красным, зеленым и синим. В процессе дифференцировки преобладающая конформация IDP приводит к развитию соответствующего фенотипа. В результате из одной стволовой клетки возникает гетерогенная (содержащая различные клетки) популяция клеток.
Динамические системы: грань между порядком и хаосом
В теории динамических систем аттрактором называют состояние, к которому стремится система из различных начальных состояний. Стабильное фенотипическое состояние клетки может быть рассмотрено как аттрактор,
В математическом моделировании сложных систем известен так называемый «странный аттрактор». Впервые этот термин был предложен Лоренцем для описания погодных явлений (конвекции в атмосфере). «Странность» этого аттрактора состоит в том, что небольшие изменения исходных значений приводят к радикальным отличиям в результате (феномен, известный как «эффект бабочки»). Конформационная динамика внутренне-неупорядоченных белков удивительным образом напоминает динамику аттрактора Лоренца (рис. 3). Исследователи пока размышляют о возможностях моделирования поведения таких белков с использованием странного аттрактора.
Поведение внутренне-неупорядоченных белков может быть также „разложено на множители“ детерминистской и стохастической компоненты. Такой подход оказывается весьма полезным для моделирования динамики данных белков и предсказания возможных воздействий на них, что важно для разработки лекарств,
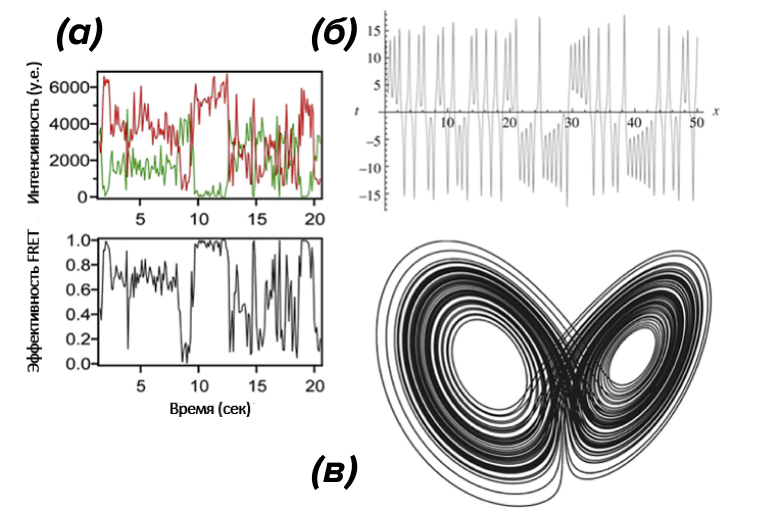
Рисунок 3. Сравнение динамического поведения внутренне-неупорядоченных белков и аттрактора Лоренца. (а) — конформационная динамика внутренне-неупорядоченного белка. (б) — динамика аттрактора Лоренца. (в) — фазовая диаграмма для аттрактора Лоренца, описывающая хаотичное поведение системы.
Роль внутренне-неупорядоченных белков на заре эволюции живого
Внутренне-неупорядоченные белки обладают уникальным свойством формировать так называемые немембранные органеллы — обогащенные белком «сгустки», в которых молекулы расположены гораздо более тесно, чем в окружающем растворе. Такие структуры очень похожи на коацерваты, предложенные в 1922 году для описания ранних этапов биологической эволюции советским ученым Александром Опариным [11]. На заре эволюции живого такие немембранные органеллы могли служить своеобразными микрореакторами для ускорения химических реакций до появления клеток и органелл в привычном виде [12].
Внутренне-неупорядоченные белки обеспечивают разделение фаз жидкость—жидкость, благодаря чему образуются немембранные органеллы [13]. Немембранные органеллы (например, ядрышко в ядре) широко представлены во всех современных организмах; они имеют множество важных функций — от клеточного ответа на стресс [14] до регуляции транскрипции [15] и других сложных биологических процессов. Также предполагают важность стохастического поведения внутренне-неупорядоченных белков в развитии многоклеточности [16].
Внутренне-неупорядоченные белки и наследование приобретенных признаков
Несмотря на важность разоблачения ламарковской теории наследования приобретенных признаков открытием хромосомной теории наследственности, появляется всё больше данных о наличии нехромосомной наследственности. Один важный пример — наследование эпигенетических модификаций [17]. Также хорошо известны прионы — инфекционные носители белковой природы, своеобразные «конформационные диссиденты» [18]. Прионы при попадании в клетку вызывают переход в «свою» конформацию других конформационных форм этого белка. Для первых открытых прионов было обнаружено образование амилоидов (длинных нитей неправильно свернутых белков) из физиологически активного белка [19]. Тем не менее, на данный момент известно прионовое поведение для значительно большего количества белков, что может иметь не только негативные, но и полезные последствия (например, участие приона в наследовании активного хроматина у дрожжей) [17]. Многие из таких не образующих амилоиды прионов являются внутренне-неупорядоченными белками. Они обладают способностью передавать свое «конформационное состояние» на протяжении многих поколений дочерних клеток [20].
Внутренне-неупорядоченные белки — важные компоненты «темной материи» белкового мира — представляют собой сложные динамические системы, требующие развития новых для классической биологии методов и подходов в изучении. Тем не менее, именно эти макромолекулы, не поддающиеся изучению классическими методами структурной биологии, часто играют ключевую роль в «принятии решений» на клеточном уровне.
Понимание функционирования внутренне-неупорядоченных белков и их физиологического значения с использованием новых экспериментальных и вычислительных моделей позволит достичь принципиально нового уровня понимания функционирования и эволюции живого, а также сделать существенный шаг вперед в направлении лечения многих заболеваний,
Литература
- Prakash Kulkarni, Supriyo Bhattacharya, Srisairam Achuthan, Amita Behal, Mohit Kumar Jolly, et. al.. (2022). Intrinsically Disordered Proteins: Critical Components of the Wetware. Chem. Rev.. 122, 6614-6633;
- На заре молекулярной графики;
- Одна последовательность — одна структура: был ли Анфинсен неправ?;
- 12 методов в картинках: структурная биология;
- Недоупорядоченные белки;
- За пределами порядка;
- Одна последовательность — одна структура: был ли Анфинсен неправ?;
- Vivek Kulkarni, Prakash Kulkarni. (2019). Intrinsically disordered proteins and phenotypic switching: Implications in cancer. Progress in Molecular Biology and Translational Science. 63-84;
- Ucheor B. Choi, James J. McCann, Keith R. Weninger, Mark E. Bowen. (2011). Beyond the Random Coil: Stochastic Conformational Switching in Intrinsically Disordered Proteins. Structure. 19, 566-576;
- Ben D. MacArthur, Colin P. Please, Richard O. C. Oreffo. (2008). Stochasticity and the Molecular Mechanisms of Induced Pluripotency. PLoS ONE. 3, e3086;
- Oparin A. I. The Origin of Life. Dover Publications: Mineola,NY, 1938. — 270 p.;
- Laurent Jaeken. (2017). The neglected functions of intrinsically disordered proteins and the origin of life. Progress in Biophysics and Molecular Biology. 126, 31-46;
- Разделяй и властвуй: роль разделения фаз в жизни клетки;
- Claire L. Riggs, Nancy Kedersha, Pavel Ivanov, Paul Anderson. (2020). Mammalian stress granules and P bodies at a glance. Journal of Cell Science. 133;
- Sarah L Shammas. (2017). Mechanistic roles of protein disorder within transcription. Current Opinion in Structural Biology. 42, 155-161;
- Karl J Niklas, A Keith Dunker, Inmaculada Yruela. (2018). The evolutionary origins of cell type diversification and the role of intrinsically disordered proteins. Journal of Experimental Botany. 69, 1437-1446;
- Наследование и эпигеном;
- Прионы: исследования таинственных молекул продолжаются;
- Прионные и неприонные амилоиды: определяет ли конформация разницу в инфекционности?;
- Sohini Chakrabortee, James S. Byers, Sandra Jones, David M. Garcia, Bhupinder Bhullar, et. al.. (2016). Intrinsically Disordered Proteins Drive Emergence and Inheritance of Biological Traits. Cell. 167, 369-381.e12.