-
Результатом совместной работы ученых из Германии, России и Англии стало открытие нового типа коллагена в микроволокнах скелета глубоководной морской губки, структурно отличающегося от коллагена человека или других высших животных. Благодаря этому коллагену, скелет губки приобретает уникальные механические качества.
-
Лишь десять лет назад всего двух пальцев было достаточно, чтобы сосчитать отсеквенированные человеческие геномы. В прошлом году для этого нужны были уже пальцы двух рук. Однако сейчас уже непонятно, найдётся ли нужное количество пальцев в роте солдат, чтобы продолжать вести такой подсчёт. Исследовательский консорциум «1000 геномов» сообщает о завершении «пилотной» фазы проекта, в которой получено 179 полных генетических последовательностей, ещё для почти 700 индивидуумов «прочли» только кодирующие участки ДНК, а для двух групп родители–ребёнок (получается, ещё шесть геномов) секвенирование выполнили с особенной тщательностью, чтобы изучить скорость возникновения мутаций. Персональная генетическая медицина всё продолжает приближаться.
-
Существуют не только заболевания, всерьёз угрожающие жизни, но и болезни, наносящие урон скорее имиджу человека, нежели его здоровью. К числу таких недугов относится витилиго — «загадочная болезнь», при которой поверхность кожи покрывают белые (лишённые пигментации) пятна, со временем увеличивающиеся и сливающиеся между собой. О природе этого явления известно очень мало, — в основном, только то, что оно имеет отношение к аутоиммунным процессам. Международный консорциум учёных провёл крупномасштабное генетическое сканирование, которое выявило несколько генов, с неправильной работой которых может быть связано развитие болезни. Правда, это пока лишь первый шаг — о лечении и даже о точных молекулярных и клеточных механизмах исследователи пока сказать ничего не могут.
-
Природа является наиболее талантливым химиком — в естественных источниках обнаруживаются вещества, обладающие фантастическим спектром уникальных активностей, многие из которых человечество не отказалось бы поставить себе на службу. Однако природные соединения и устроены намного сложнее, чем может создать современный органический синтез. Нобелевскую премию по химии в 2010 году дали за разработку методик палладиевого катализа, позволяющих очень точно (с минимумом побочных продуктов) «сшивать» атомы углерода, что необходимо для конструкции веществ, приближающихся по своему строению и свойствам к природным молекулам.
-
Несмотря на то, что в завещании Нобеля номинация называется «по физиологии и медицине», большинство премий последних лет (если не десятков лет!) было посвящено скорее молекулярной биологии, чем медицине как таковой. Конечно, первая непосредственно связана со второй, но всё-таки от описания молекулярного механизма до лечения дорога неблизкая. Тем приятнее узнать, что в 2010 году премия вручена британцу Роберту Эдвардсу именно за медицинские достижения, причём настолько неоспоримые, что можно без преувеличения сказать: самим фактом своего существования этим достижениям (или самому Эдвардсу?) обязаны около четырёх миллионов человек.
-
Антителá, служащие одним из главных «посланников» иммунитета, отличаются высочайшей избирательностью и эффективностью действия, прицельно синтезируясь в организме в ответ на появление потенциально опасных антигенов практически любой химической или биологической природы. Фантастическая гибкость антител давно используется человеком в своих целях, однако их стабильность вне организма оставляет желать много лучшего, а значит, и для хранения они пригодны плохо; кроме того, антитела дóроги. Современная синтетическая химия на стыке с науками о материалах изобрела молекулярный импринтинг, позволяющий полимеризовать довольно простую органику в «умные» полимеры, «натасканные» на определённые молекулы. Теперь же показано, что внутри организма наночастицы из такого «пластика» могут работать подобно настоящим антителам.
-
Не часто бывает, чтобы научное открытие, даже опубликованное на страницах самого престижного научного издания, мгновенно облетело весь мир, запестрев даже на страницах бульварных газет. Однако именно эта судьба постигла последнюю работу одиозного молекулярного биолога, основателя института имени себя, «современного Джеймса Уотсона» — словом, Дж. Крейга Вентера. В институте «его имени» (JCVI) собрали, модифицировали и имплантировали синтезированный «с нуля» геном в бактериальную «оболочку», получив в результате «рабочий» микроорганизм Mycoplasma mycoides. Мы приводим высказывания восьми учёных по этому поводу, собранные и опубликованные журналом Nature.
-
Способность вирусов меняться и вырабатывать резистентность к лекарствам стала притчей во языцех. Так, несколько лет назад «сдалось» очередное популярное лекарство «Тамифлю»: большинство сезонных штаммов гриппа на Земле вдруг приобрели мутацию His274→Tyr274 в белке нейраминидазе, на блокирование которой и направлен препарат. Что самое интересное, эту мутацию, придающую устойчивость к лекарству, знали и раньше, однако считалось, что такая нейраминидаза сама по себе «дефектна», и вирус-мутант не может эффективно размножаться. Американские учёные установили, что «костылём», компенсирующим дефект от этой мутации, стала другая мутация, восстанавливающая активность нейраминидазы. Открытие этого эволюционного приспособления поможет предсказать появление резистентности и в других штаммах вирусов.
-
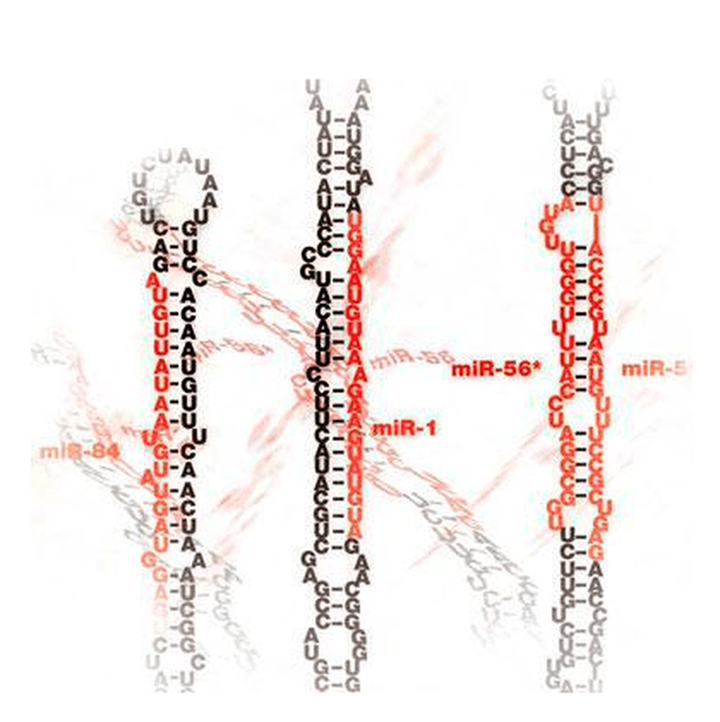
Ещё двадцать лет назад молекулярная биология не знала такого удивительного феномена, как РНК-интерференция. Сегодня же у учёных не вызывает сомнения, что это явление принимает участие в широчайшем спектре физиологических процессов у всех живых существ, а её молекулярные посредники — короткие РНК — по разнообразию и специфичности не уступают антителам крови. У простейших РНК-интерференция обеспечивает иммунитет, в частности — защиту от вирусов. У более развитых организмов этот механизм включается в борьбу не только (и не столько) с внешними, но и с внутригеномными паразитами, а также становится важнейшим регулятором активности генов. На сегодняшний день идентифицированы уже тысячи коротких регуляторных РНК, а механизм РНК-интерференции изучен очень подробно, однако бесспорно и то, что мы наблюдаем пока только верхушку этого айсберга.


- Лента
- Спецпроекты
- ▶Подкаст
-
Конкурс
- О конкурсе «Био/мол/текст»
- «Био/мол/текст»-2025/2026
- «Био/мол/текст»-2024/2025
- «Био/мол/текст»-2023/2024
- «Био/мол/текст»-2022/2023
- «Био/мол/текст»-2021/2022
- «Био/мол/текст»-2020/2021
- «Био/мол/текст»-2019
- «Био/мол/текст»-2018
- «Био/мол/текст»-2017
- «Био/мол/текст»-2016
- «Био/мол/текст»-2015
- «Био/мол/текст»-2014
- «Био/мол/текст»-2013
- «Био/мол/текст»-2012
- «Био/мол/текст»-2011
- Объявления
- Авторы
- Партнеры
- Поддержать
Публикации
—
Темы
—
Авторы
—
Комментарии
—
Поиск не дал результатов
По вашему запросу ничего не найдено
- Медицина
- SARS-CoV-2
- «Биомолекула» — Forbes
- Аллергия
- Антибиотики
- Атеросклероз
- Аутоиммунитет
- Боль
- ВИЧ/СПИД
- Вакцины
- Вирус Зика
- Вирус Эбола
- Генная терапия
- Грипп
- Депрессия
- Дерматология
- Диагностика
- Здравоохранение
- Нейродегенерация
- Никотин
- Онкология
- Персонализированная медицина
- Питание
- Сон
- Стволовые клетки
- Фармакология
- Эпилепсия
- Биология
- «Сухая» биология
- Антропология
- Бионика
- Биофизика
- Вирусология
- Вопросы пола
- ГМО
- Генетика
- Иммунология
- Микробиология
- Нейробиология
- Носимые технологии
- Психогенетика
- Синтетическая биология
- Старение
- Структурная биология
- Цитология
- Эволюционная биология
- Экология
- Эмбриология
- Эпигенетика
- Этология
- Биомолекулы
- GPCR
- АФК
- Амилоиды
- Биомембраны
- Гормоны растений
- ДНК
- Ионные каналы
- МГЭ
- Матрикс
- Нейромедиаторы
- РНК
- Рецепторы
- Хроматин