
Антибиотики, структура генома и CRISPR: чем занимается в Сколтехе лаборатория Северинова
02 сентября 2019
Антибиотики, структура генома и CRISPR: чем занимается в Сколтехе лаборатория Северинова
- 3593
- 5
- 13
Константин Северинов с удовлетворением взирает на ключевые слова, описывающие его лабораторию в Сколтехе
иллюстрация Елены Беловой
-
Автор
-
Редакторы
-
Иллюстратор
Темы
Вот Сколковский институт науки и технологий. А это Центр наук о жизни в Сколковском институте науки и технологий. А вот лаборатория изучения метаболизма прокариот Центра наук о жизни в Сколковском институте науки и технологий. А здесь ключевые слова лаборатории изучения метаболизма прокариот Центра наук о жизни в Сколковском институте науки и технологий: Genome mining, метод Topo-Seq, CRISPR, ДНК-гираза, метод HI-C, микроцины, гонка вооружений фагов и бактерий — и это лишь малая часть. В статье читатель узнает подробности внутренней жизни лаборатории и ее исследовательской работы.
Центр наук о жизни Сколтеха

В статьях нового спецпроекта мы рассказываем об истории создании Центра наук о жизни Сколтеха и о том, как в нем устроено обучение в магистратуре и аспирантуре. Об этом авторы «Биомолекулы» говорят не только с сотрудниками, но и учащимися Центра. Отдельные статьи посвящены двум исследовательским группам Центра наук о жизни: лаборатории под руководством профессора Константина Северинова и лаборатории под руководством профессора Михаила Гельфанда.
Партнер спецпроекта — Центр наук о жизни Сколковского института науки и технологий (Сколтеха), где ведутся исследования по биомедицине, биоинформатике и биотехнологиям. Также в этом году Центр наук о жизни выступает партнером конкурса «био/мол/текст»-2019.
Надо только любить то, что ты делаешь, и очень много работать.
Константин Северинов
Английский язык докладов, но не международная конференция. Речь об учебе, но не защита выпускников. Передовые исследования, но не научные статьи. Это студенты, уже получившие степень магистра, рассказывают о планируемых темах кандидатских диссертаций, среди которых: «Характеристика компонентов комплекса теломеразы в семействе крестоцветных», «Взаимодействие Clostridium difficile и бактериофага при использовании фаговой терапии» и «Оффтаргетная деградация клеточных РНК, вызванная нуклеазой CRISPR-Cas13a».
Руководитель лаборатории в довольно непринужденной манере критикует работы студентов, бегло выявляя слабые места и внося необходимые правки. Сразу бросается в глаза расслабленная атмосфера, совсем не похожая на предзащиты и аналогичные собрания в университете. Такой необычный для вуза и «классической академии» стиль напоминает скорее работу команды доктора Хауса.
Что же это? Это lab meeting исследовательской группы Константина Северинова из Центра наук о жизни (Center of Life Sciences, CLS) Сколтеха, посвященный будущим аспирантским работам.
Предыдущие статьи о центре наук о жизни:
- «Биологический наукоград: как работает центр наук о жизни Сколтеха» [2];
- «Науки о жизни: магистерская программа Сколтеха по биотехнологии» [3].
Карьерный путь Северинова весьма извилист (см. врезку выше). Вот так рассказывает о нем Анна Лопатина, бывшая аспирантка лаборатории Северинова в ИМГ, которая сейчас работает постдоком в лаборатории Ротема Сорека в Институте Вейцмана в Израиле:
Я была студенткой микробиологии почв и делала диплом по почвенным бактериофагам. К пятому курсу стало понятно (из статей и по слухам), что Константин — самый сильный ученый в стране, у которого можно было бы продолжить изучать фагов. Я ему написала, и он взял меня в аспирантуру в ИМГ. Это был 2008 год, он сравнительно недавно вернулся в Россию. Первые несколько лет аспирантуры я занималась микробным разнообразием снега Антарктики и ездила туда два раза в экспедицию, а потом уже переключилась на термальные источники с их фагами и криспрами (я была в числе тех, кто положил начало изучению всех этих направлений в лабе). В то время были еще на подъеме темы микроцинов, полимеразы бактериофагов и даже уже начинались криспры. Со временем стало всё больше защитных систем микроорганизмов типа криспров и BREX (об этом читайте ниже — прим. автора). В 2015–2016 годах половина аспирантов той первой волны разъехалась, и в лабе появилось огромное количество уже сколтеховских студентов.
Система BREX у бактерий, которую изучают в лаборатории Северинова, действует аналогично системам рестрикции-модификации и помогает бактериям отличать «своё» от «чужого». Вот только иногда система дает сбой... Что случается после этого — смотрите в комиксе на рис. 1.
CRISPR? Антибиотики? Всё вместе!
Основные направления исследований лаборатории Константина Северинова в Сколтехе — многообразие взаимодействий бактерий и вирусов, а также поиск новых антибиотиков. Объединяет обе темы одно — это способы бактерий защищаться и атаковать.
Взаимодействие вирусов и бактерий
Одна из передовых тем молекулярной биологии — завоевавшие невероятную славу даже за пределами научных кругов CRISPR/Cas-системы [4]. Механизмами их работы с позиций эволюции и экологии — то есть изучением принципов функционирования и влияния CRISPR на микробные сообщества (а не редактированием геномов, как можно было бы подумать), — занимается и лаборатория Северинова.
«Биомолекула» уже неоднократно писала на тему CRISPR-Cas-систем (на сайте им посвящен целый раздел). С историей изучения и основным механизмом читатель может ознакомиться в статье «CRISPR-системы: иммунизация прокариот» [5]. О применении CRISPR в эмбриологии для отслеживания судьбы каждой клетки вы можете узнать из статьи «CRISPR/Cas9 на службе у эмбриологов» [6], а о «вирусном ответе Чемберлену» — из статьи «Анти-CRISPR: ответ вирусов» [7].
На закономерный вопрос об использовании CRISPR-систем в биотехнологии, который так часто звучит в публичных обсуждениях, руководитель лаборатории отвечает без энтузиазма. «Использование [CRISPR-систем] в биотехнологии настолько скучно и неинтересно, что...» — удрученно качает головой Северинов и тут же приводит в пример рестриктазы, которые сорок лет назад произвели бум, как сегодня CRISPR/Cas, однако теперь представляют интерес лишь как инструмент генной инженерии (рис. 2).

Рисунок 2. Когда все вокруг говорят о рестриктазах...
Криспры — это не только ценный мех перспективный инструмент редактирования генома, но еще и «генетическая летопись» каждого штамма бактерий. Спейсеры в CRISPR-кассете (фрагменты геномов фагов и плазмид, помещенные в «геномную библиотеку» хозяина) позволяют судить о «прошлом» бактерии.
Вообще, CRISPR/Cas в природе — отнюдь не «генетические ножницы» на потеху биотехнологам, а система адаптивного иммунитета прокариот, которая «запоминает» агрессора (вирус или чужеродную плазмиду) путем внесения частей генома «пришельца» в специальный генетический локус хозяина — в ту самую «кассету». При следующем контакте бактерия, несущая эти фрагменты (спейсеры) в геноме, способна прицельно внести разрыв в ДНК фага/плазмиды, а значит — нейтрализовать агрессора.
«Набор CRISPR-спейсеров, находящийся в популяции бактерий, позволяет вам судить о прошлых взаимодействиях бактерий с вирусом. Сравнивая такие наборы в различных популяциях одного вида, анализируя состав спейсеров и динамику его изменения можно оценить историю этих популяций», — говорит Северинов в интервью «Биомолекуле».
Системы рестрикции-модификации изучают в лаборатории не как механизм защиты бактерий от вирусов, а с позиций «штурма» вирусом этого бактериального «бастиона». Кроме того, исследуют работу системы защиты-сайленсинга.
Почему же одной из центральных тем лаборатории выбрали именно криспры?
«С точки зрения разнообразия, это наиболее интересная для изучения тема. Вот вы смотрите на housekeeping-гены (гены домашнего хозяйства, то есть ДНК- и РНК-полимеразы, рРНК и прочие) — они всегда одинаковые и скучные. А вот системы защиты по определению очень быстро изменяются за счет «гонки» между вирусом и бактерией, или в общем случае между атакующим и защищающимся. Механизмы этого необычайно интересны», — отвечает Константин Северинов. В случае взаимодействий бактерий с вирусом — это CRISPR, в случае взаимодействия бактерий друг с другом — антибиотики.
Эволюционным гонкам вооружений посвящена статья «Яды — высокоточное оружие: компьютерное исследование природных нейротоксинов» [8].
В 2018 году в широко известном журнале Proceedings of National Academy of Sciences of USA вышла важная статья по этой теме: «Предсказание генов, функционально связанных с CRISPR-Cas-системами, по анализу соседних генов» [9]. В исследовании помимо Северинова участвовал его аспирант Сергей Шмаков (который, кстати, был награжден премией директора Национальных институтов здоровья США за исследования в области новых CRISPR-Cas-систем), а также известный биоинформатик и эволюционист Евгенией Кунин. В публикации описана компьютерная стратегия идентификации и оценки значимости белков, связанных с CRISPR-Cas-системами. Исследователи ввели специальный показатель — CRISPRicity (дословно — «CRISPRичность»), определяющий «силу» связи CRISPR с белок-кодирующими генами архей и бактерий из секвенированных геномов и представляющий собой отношение частоты встречаемости гена в связке с CRISPR к общей частоте встречаемости гена. Гены с этим показателем оценивали аналогично Сas-генам, ранее не относящимся к функционированию CRISPR-Cas системы, а кодируемые ими белки проверяли анализом доменной структуры и коэволюционным анализом. В результате было найдено 79 новых белок-кодирующих генов, вовлеченных в функционирование CRISPR-Cas .
Подробнее о параметре CRISPRicity и об упомянутой работе рассказывает статья «Новые друзья CRISPR/CAS» [23]. — Ред.
Как же стало возможно предсказывать новые гены в системе адаптивного иммунитета прокариот? У бактерий и архей функционально связанные гены собраны в опероны — группы сонаправленных, сотранскрибируемых и сотранслируемых генов. Последовательности оперонов, участвующих в одних и тех же метаболических путях, у разных видов могут перекрываться. Авторы выделили гены, располагающиеся вблизи CRISPR-локуса, cas1-генов или эффекторного комплекса — бóльшая их часть была описана впервые. Их назвали CRISPR-связанными генами.
В заключение авторы изучили коэволюцию CRISPR-связанных генов с CRISPR-локусом, построили филогенетические деревья и сравнили их с деревьями cas-генов и деревьями 16S рРНК (в качестве контроля). Интересно, что эволюционные расстояния между генами cas10 (большой субъединицы эффекторного комплекса систем II типа) и аналогичные расстояния между генами corA (ионного канала, кодируемого системами подтипа III-B) демонстрируют корреляцию, чего не скажешь про связь любого из этих генов с 16S РНК. Иными словами, гены внутри CRISPR-Сas-локуса коэволюционируют, тогда как сам локус передается в основном горизонтальным переносом генов — одним из ключевых путей микробной эволюции [10].
Горизонтальный перенос генов характерен не только для CRISPR-систем, но и для генов антибиотиков, служащих бактериям оружием и средством общения с себе подобными. Об этом расскажет следующая глава.
Поиск антибиотиков
Вторая важная тема исследовательской группы Северинова — антибиотики, а именно бактериоцины. Это вещества, вырабатываемые бактериями для борьбы с себе подобными. Как и у любого оружия, мишени их действия в бактериальной клетке чрезвычайно разнообразны (рис. 3). Особенно важны среди них для нашего сегодняшнего рассказа микроцины. Это короткие пептиды, которые приобретают специфические свойства (например, способность подавлять рост других бактерий) только после посттрасляционной модификации .
Узнать больше о посттрасляционных модификациях читатель может из статьи «SUMO: японская борьба или уникальная посттрансляционная модификация?» [11].
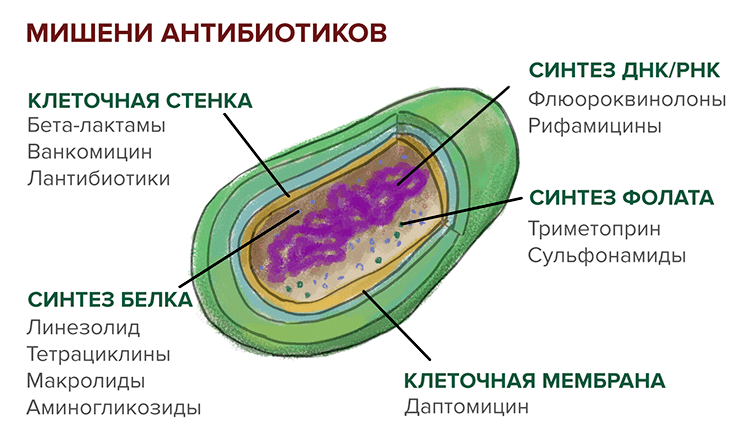
Рисунок 3. Различные группы антибиотиков и мишени их действия в бактериальной клетке. Вкратце о механизмах действия антибиотиков: блокирование синтеза клеточной стенки ведет к невозможности делиться и часто к гибели бактерии; остановка синтеза белка оставляет бактерию без молекулярных машин, выполняющих практически все функции; встраивание антибиотиков в мембрану влечет за собой нарушение ее проницаемости и гибель от осмотического стресса; фолат — кофактор многих ферментов, поэтому ингибирование его синтеза останавливает синтез ДНК/РНК и белков; блокирование синтеза нуклеиновых кислот приводит как к прекращению синтеза белка, так и к невозможности деления. (Среди микроцинов, о которых идет речь в тексте, есть соединения с разными механизмами действия, поэтому они не вынесены в отдельную группу на рисунке.)
иллюстрация Елены Беловой
Все важные химические модификации микроцинов закодированы в геноме неразрывно с «базовой» аминокислотной последовательностью самого антибиотика: в последовательности ДНК непосредственно за гéном пептида располагаются гены ферментов, которые его модифицируют. Такой кластер легко найти в геноме при помощи методов биоинформатики (рис. 4). По нему часто можно сказать, какой пептид получится в результате, поскольку функции большинства ферментов-модификаторов известны, как и последовательность аминокислот пептида.
Изучение микроцинов можно назвать энзимологией вторичных метаболитов бактерий. Мы изучаем посттрансляционные модификации, которые и делают вещество антибиотиком из, казалось бы, простого пептида.
В своей недавней статье в Nature Chemical Biology (одном из наиболее высокорейтинговых и уважаемых зарубежных журналов) сотрудники лаборатории задались целью найти новый антибиотик как раз с помощью биоинформатического «геномного поиска» (Genome mining; см. врезку ниже для объяснения этого алгоритма) [12]. В качестве «наживки» для поискового алгоритма использовали известный у E. coli микроцин B17 (MccB17) — сильный ингибитор ДНК-гиразы (о которой ниже речь пойдет отдельно), кодируемый кластером mcbABCDEFG. Этот «невод» принес гомологичные белки в геноме бактерии Klebsiella pneumoniae подвида ozaenae, организованные в очень похожий кластер (см. врезку и рис. 4).
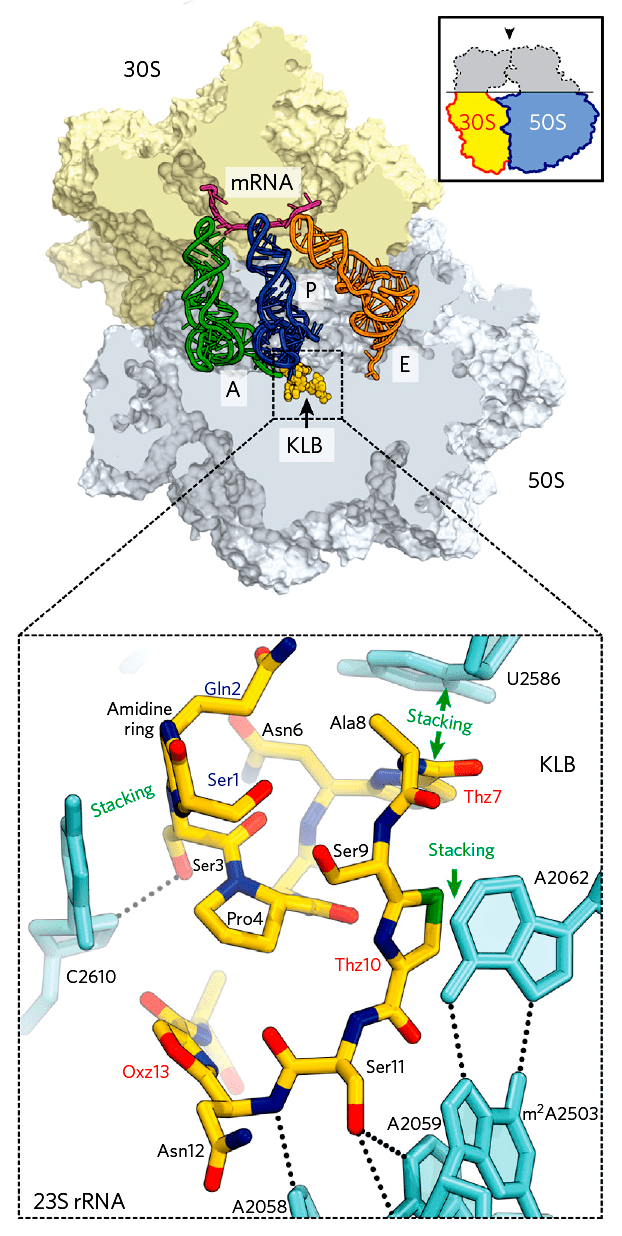
Рисунок 5. Структура клебсазолицина в комплексе с 70S рибосомой и молекулами тРНК подтвердила, что найденный микроцин действительно блокирует синтез белка, и показала, как он это делает. KLB — клебсазолицин; сайты: А — аминоацильный, Р — транспептидазный, Е — выхода готового пептида; врезка сверху — план рибосомы в данной проекции; снизу — приближение, на котором видно, как клебсазолицин (показан желтым) блокирует выход синтезированного пептида из туннеля выхода.
Последовательность предшественника предсказанного микроцина KlpA не была похожа на известные ранее микроцины, а значит, зрелый KlpA должен был иметь необычную структуру и функциональные характеристики. Найденный микроцин решили назвать клебсазолицином (KLB, рис. 5) — по роду бактерии, в которой он синтезируется.
Так был найден новый антибиотик. Но самое интересное — механизм его действия.
Чтобы удостовериться, является ли клебсазолицин ингибитором трансляции, исследователи использовали in vitro систему синтеза люциферазы. Эта система подразумевает наличие в пробирке всех реагентов реакции окисления люциферина, кроме люциферазы (то есть сам люциферин, АТФ и кислород), а также рибосом и мРНК гена люциферазы. В данном случае в пробирку также добавляли ингибитор трансляции. Когда ингибитор работает, трансляция подавляется, и свечение пропадает. Так и случилось в присутствии клебсазолицина, а значит, он блокирует именно работу рибосомы.
Чтобы разобраться в механизме этого ингибирования, исследователи из Сколтеха объединили усилия с коллегами из Чикаго, специализирующимися на структурных исследованиях рибосомы. Группа под руководством Ю.С. Поликанова из Университета Иллинойса закристаллизовала рибосомы Thermus thermophilus в присутствии KLB, мРНК и тРНК в А-, Р- и Е-сайтах и установила 3D-структуру комплекса с разрешением 2,7 Å, опираясь на уже известную модель рибосомы этой бактерии. Оказалось, что клебсазолицин закрывает туннель выхода растущего пептида в большой субъединице (рис. 5). В статье авторы также сравнили расположение клебсазолицина с другими рибосомными антибиотиками, а именно эритромицином и хинупристином.
В работе участвовали исследовательские группы разных вузов и институтов: Политехнического университета и Института ядерной физики (Санкт-Петербург), Института антимикробной химиотерапии (Смоленск), Сколтеха, Института биологии гена РАН, МГУ (факультетов: химического, биоинженерии и биоинформатики, а также Института Белозерского) (Москва), Университета Иллинойса и Института Ваксмана (США).
Пока медведь не проснется
Есть и другая, не менее захватывающая работа, в которой поучаствовала лаборатория Северинова [14]. В коллаборацию вошли семь российских и три зарубежных научных организации, из которых ведущая — Институт биоорганической химии (ИБХ). Помимо этого, один из авторов — Сидни Олтмен, входящий в международный консультативный совет ИБХ, Нобелевский лауреат, получивший премию за исследования каталитической активности РНК. Посвящена работа изучению микробиоты сибирского бурого медведя (Ursus arctos collaris) .
Бурый медведь — один из постоянных героев «Биомолекулы». Об этой совместной статье Сколтеха и ИБХ мы уже писали: «Кто живет во рту у медведя» [24]. Но это еще не всё! Ранее также речь шла про сезонные изменения в микробиоме кишечника всё того же бурого медведя. Узнать подробности читатель может в статье «Бурый медведь: сонный метагеном» [25].
Цель исследования была всё та же: найти новые микроцины, потенциально применимые в медицине. Ученые исследовали микрофлору ротовой полости медведя на предмет наличия в ней продуцентов антибиотиков против известного патогена человека — золотистого стафилококка Staphylococcus aureus [15]. Сразу после поимки у медведя брали образцы слюны, которые анализировали на новой ультравысокопроизводительной микрожидкостной платформе.
Хотя секвенирование нового поколения [16] и перевернуло наши представления о микробных сообществах, этого всё еще недостаточно, чтобы описать их жизнь во всех деталях. В частности, культивирование многих микроорганизмов — до сих пор нерешенная задача. В рамках новой микрожидкостной технологии, разработанной в Институте биоорганической химии, отдельные бактериальные клетки культивировали прямо внутри капель двойной водно-масляной эмульсии (вода в масле в воде). Этот метод позволяет выращивать клоны индивидуальных бактерий, выбирать потенциального продуцента антибиотика, чтобы затем исследовать механизм устойчивости к собственным метаболитам и оценить его роль в целом микробиоме.
В результате совместного культивирования стафилококка и бактерий из слюны бурого медведя в эмульсионных каплях и анализа флуоресцентного сигнала (в клетках S. aureus синтезировался GFP) проточной цитометрией исследователи выделили три вида, успешно подавляющие рост патогенной бактерии: Enterococcus casseliflavus, Weissella confusa и Bacillus pumilus. Все они обладали антимикробной активностью в отношении стафилококка, но подробно изучили лишь B. pumilus, у которой нашли новый биосинтетический путь синтеза антибиотика амикумацина.
Эта работа, как и в случае с клебсазолицином, была выполнена в коллаборации, в которую вошли: Институт биоорганической химии и Институт биологии гена РАН, Сколтех, химфак МГУ (Москва), Институт химической биологии и фундаментальной медицины (Новосибирск) и Институт микробиологии Ваксмана (США).
Эволюционное путешествие гиразы и структура генома
Об еще одной интересной теме лаборатории Константина Северинова в CLS «Биомолекула» поговорила с Дмитрием Суторминым, который сейчас работает над кандидатской, посвященной роли топоизомераз в организации генома бактерий.
Топоизомеразы — ферменты, «расплетающие» сверхспирализованные участки ДНК. Изучение их различий у видов, живущих в разных температурных оптимумах, могут пролить свет на механизм их эволюции.
«Основным объектом является Escherichia coli, — говорит Дмитрий Сутормин. — Но мне хотелось бы посмотреть, что имеется у Bacillus subtilis (сенной палочки) — бактерии с более низким температурным оптимумом и совершенно другой физиологией (кишечная палочка — грамотрицательная, сенная — грамположительная). И хотелось бы залезть в какую-то экзотику, посмотреть гипертермофильных бактерий, таких как Thermus thermophilus, с температурным оптимумом 65–70 °C».
Гипертермофильные виды интересны с позиции изучения стабилизации их генома, так как при этих температурах ДНК уже просто «плавится» (то есть самопроизвольно расплетается). Тема, которой занимается Дима, — ДНК-гиразы (подкласс топоизомераз, вносящих отрицательные супервитки в ДНК (то есть увеличивающих период спирали ДНК, а вместе с ним и количество нуклеотидов на виток)) [17].
У T. thermophilus есть гираза (рис. 6), что странно, ведь при высоких температурах дуплекс ДНК теряет стабильность, и отрицательная суперспирализация не только не выгодна, но даже опасна. В чем же тут дело?
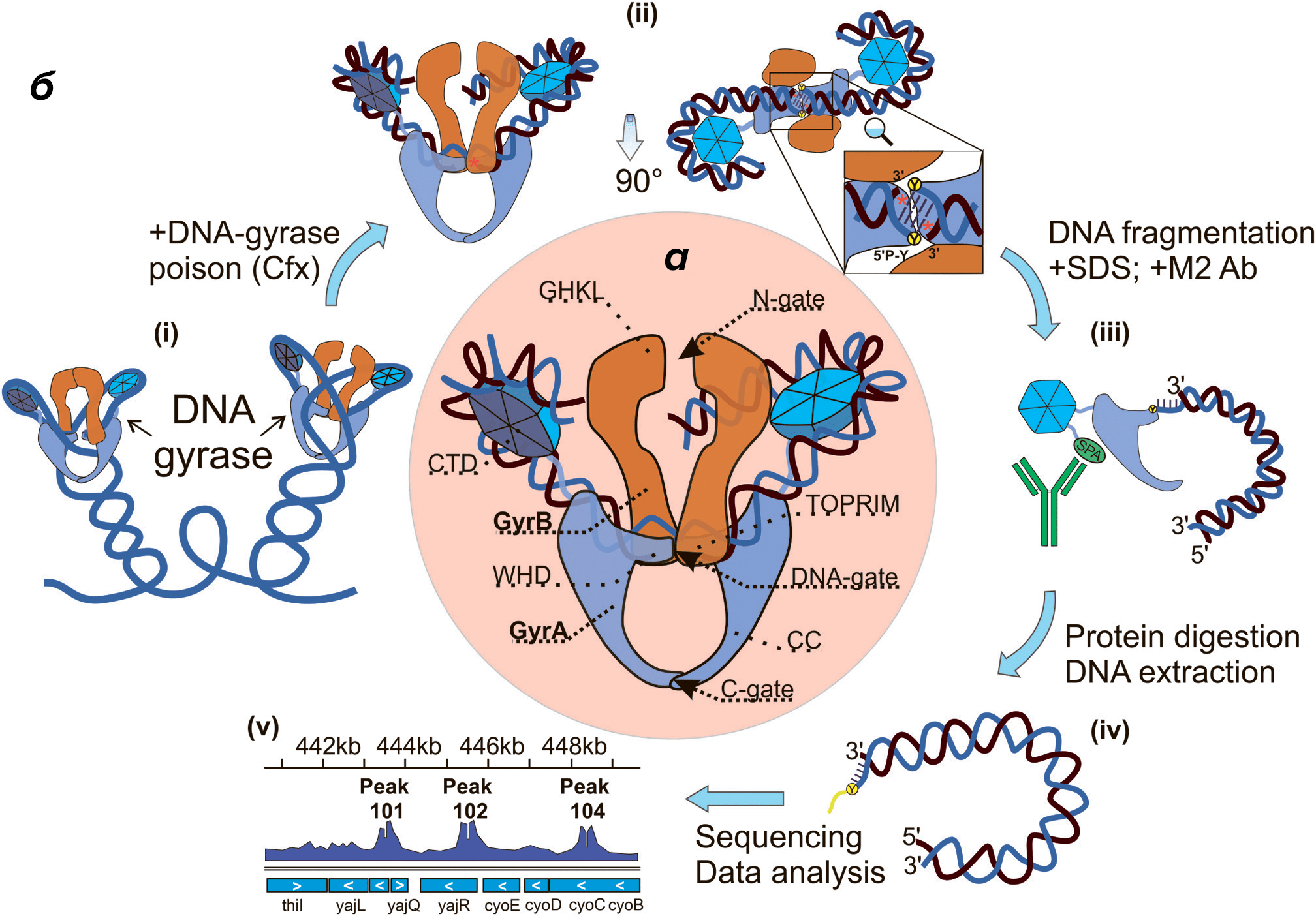
Рисунок 6. Строение ДНК-гиразы (в центре, а) и схема метода Topo-Seq (вокруг, б). Показаны домены белка, который является гетеротетрамером и имеет несколько сайтов «пропускания» ДНК (ворот), и кратко изображена методика иммобилизации ДНК, связанной с гиразами, ее очистки и секвенирования.
Цель метода Topo-Seq — найти сайты связывания гираз в геноме. Вначале бактерии культивируют в среде, содержащей ингибитор гиразы (в работе использовали три различных антибиотика: ципрофлоксацин, оксолиновую кислоту или уже знакомый нам микроцин В17). Эти вещества блокируют лигазную активность гиразы, что приводит к появлению двуцепочечных разрывов ДНК (ведь фермент режет ДНК в процессе катализа). После этого раствор обрабатывают ультразвуком, дробя ДНК на фрагменты длиной 200–700 п.н. Гираза в течение этих операций всё еще находится в комплексе с ДНК. После «дробления» ДНК проводят иммунопреципитацию, то есть обрабатывают смесь антителами против тэга, слитого с CTD-доменом гиразы, и выделяют комплексы «антитело—гираза—ДНК». Затем ДНК очищают от белков и полученные фрагменты секвенируют.
У читателя мог возникнуть резонный вопрос: «Как конец фрагмента ДНК, полученный при работе гиразы, отличают от полученного разрушением геномной ДНК ультразвуком?» Вся «соль» метода в том, что гираза всегда режет ДНК с образованием «липких» концов длиной четыре нуклеотида, а ультразвук дает в первом приближении случайную смесь разрывов. Выступающие 5′-концы «фиксируют» тирозином, который связывается с фосфатом и предотвращает возможное лигирование. На финальной стадии с помощью секвенирования можно точно установить, где именно гираза внесла разрыв.
Тем не менее, по-видимому, существует какая-то система регуляции, не позволяющая ДНК экстремофила T. thermophilus распадаться. «Также хотелось посмотреть что-то совсем экзотическое», — говорит Дима. И очень скоро такая возможность появилась: аспирантка лаборатории Юлия Гордеева незадолго до того привезла от коллабораторов культуру архей Haloarcula hispanica и методики работы с ними. «И мне очень повезло, — продолжает Дима. — Оказалось, у этой археи тоже есть гираза. Лишь у группы эуархей есть этот фермент, ген которого, вероятно, был захвачен горизонтальным переносом».
Интересно было бы оценить эволюционный тренд гиразы и ее представленность в разных группах.
Гираза есть у растений, а у животных и грибов отсутствует, и считается, что она хлоропластного происхождения, хотя ее ген из генома хлоропластов уже «перебрался» в ядерный. Показано, что гены работают, гираза синтезируется, и белок идет либо в хлоропласты, либо в митохондрии (каждый паралог имеет свой сигнал импорта и направляется в соответствующую органеллу). «Есть также занимательная тенденция размеров митохондриальных геномов: у животных он небольшой (16 т.п.н. у человека), тогда как у растений (например, у резуховидки Таля) геном составляет несколько сотен т.п.н., и он даже крупнее хлоропластного, — продолжает Дима. — И закрадывается мысль, что в случае животных митохондриальные геномы постепенно теряли гены, всё уменьшаясь в размерах. Тогда как в случае с растениями общий предок захватил хлоропласты, пришли новые молекулярные машины, которые начали обслуживать также и митохондрии, что предотвратило уменьшение их генома» (рис. 7). Разбираться с ролью ДНК-гиразы в развитии и физиологии растений будет Александр Полховский, свежепоступивший в аспирантуру Сколтеха.
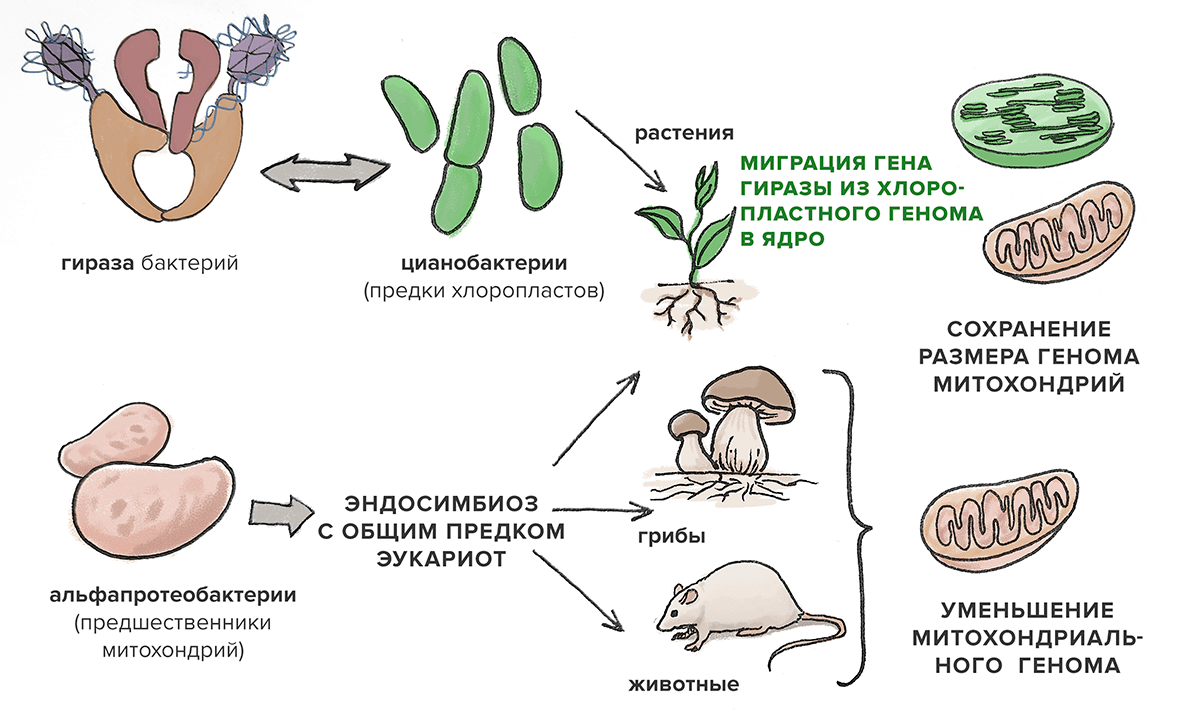
Рисунок 7. Эволюционное путешествие генов гираз и их влияние на сохранение размера митохондриального генома у растений.
иллюстрация Елены Беловой
Помимо изучения гираз, интересы Дмитрия распространяются и на топоизомеразы животных. Он планирует изучить топоизомеразу II дрозофилы и ее вовлеченность в тонкие механизмы работы геномных инсуляторов, и будет проводить исследования совместно с поступившей в этом году в аспирантуру Сколтеха Софьей Камалян, для которой эта тема станет кандидатской работой. Сейчас модель разработана только для клеток человека, и ребята собираются расширить ее для другого модельного объекта.
Как и все студенты CLS, Дима ездил набираться опыта в зарубежные лаборатории. «В прошлом году я ездил в МТИ к Майку Лаубу, корифею метода бактериального HI-C» . Стажировка длилась три месяца. Дима учил их методу Topo-Seq, они учили Диму HI-C в приложении к кишечной палочке. В 2019 году Дима планирует поехать туда еще раз.
Метод HI-C необходим для изучения структуры генома [18]. Сначала клетки фиксируют формальдегидом или его аналогом, что приводит к «остекленению» всех ее компонентов. ДНК сшивается с белками, эти белки — с соседними белками и структурами, и всё из динамичной структуры превращается в статичный скелет. Далее клетки фрагментируются ультразвуком. После этого разделяют большие комплексы белков, несущие на себе фрагменты ДНК из разных частей ядра, и с помощью высокопроизводительного секвенирования анализируют, где эти фрагменты расположены в геноме. В финале исследователи получают карту контактов, которая дает частоту и вероятность взаимодействия некоторого участка генома с любым другим участком. По этим картам можно построить модель того, как геном свернут внутри клетки. Помимо изучения взаимодействия разных частей генома друг с другом, можно изучать и взаимодействие белков (например гираз) и генома и определять контакты, ими вызванные. Подробнее о трехмерной структуре генома можно прочесть в статье «Организовать геном: запутанная история» [19].
Рабочие будни
У лабораторий Константина Северинова в России и за рубежом немного разные направленности работы. Лаборатории отличаются также и по составу персонала. Если в США это профессиональные ученые, то в России — больше студенты и аспиранты. «Одни вещи лучше делать в Штатах, другие — в Политехе (Санкт-Петербург), потому что там есть уникальное аналитическое оборудование. Есть лаборатория в Институте молекулярной генетики, где есть доступ к радиоактивности. Есть лаборатория в Институте биологии гена, там удобно характеризовать малые молекулы и работать с термофилами. И есть Сколтех, где... есть прекрасные сотрудники и исключительные возможности по академической мобильности студентов и аспирантов», — смеясь, говорит руководитель лаборатории.
Надо любить то, что ты делаешь, и очень много работать. Я так уже 15 лет существую, не знаю, вроде уже привык.
В лаборатории Северинова в Сколтехе (рис. 8), помимо 13 сотрудников, на данный момент работают 15 магистров и 14 аспирантов. Среди них есть и выпускники Сколтеха, и внешние студенты (пришедшие из других российских вузов и иногда даже из других стран). Из магистров далеко не все остаются в аспирантуре. Причина тому — высокий конкурс. Сейчас на курсе 44 магистра, в аспирантуре — всего 15 мест, на которые претендуют как выпускники Сколтеха, так и внешние кандидаты. К сегодняшнему дню в лаборатории уже защитили степень PhD 11 аспирантов.

Рисунок 8. Небольшая часть группы Северинова после защиты дипломов вместе с председателем комитета Дмитрием Потеряевым (МБЦ «Генериум»). Слева направо: Иван Федоров, Антон Шкарута, Чакон Мачадо Лаура, Дмитрий Потеряев, Константин Северинов, Алена Дробязко, Полина Музюкина, Екатерина Савицкая, Ноэми Марко.
«Лаборатория Северинова в Сколтехе отличается от академических лабораторий, — рассказывает Екатерина Савицкая, старший научный сотрудник этой лаборатории. — Здесь значительную часть коллектива составляют студенты и аспиранты. Соответственно, и работа у нас не только исследовательская, но и педагогическая. Студенту, как и любому молодому специалисту, мало иметь знания, нужно еще и приобретать опыт практической лабораторной работы. Часто это происходит болезненно, через неудачи и трудности, практически всегда долго, в течение нескольких лет. Только энтузиазм может помочь пройти этот путь до положительного результата в виде публикаций и защиты диссертации. У работы много сторон: это и чтение/анализ научной литературы по теме, и планирование экспериментов, и их выполнение (что вообще ближе всего к высокой кулинарии), и умение провести анализ и сделать выводы, оформить результаты. Все это делается в команде и требует очень высоких коммуникативных навыков. Как правило, успешная работа возможна только при развитой коммуникабельности и очень высокой стрессоустойчивости. В молекулярной биологии, если эксперименты не получаются, то это скорее норма, надо просто читать, думать и пробовать разные способы решения задачи. И не унывать».
Слова Черчилля о том, что “успех — это умение двигаться от одной неудачи к другой без потери энтузиазма”, — это как раз про успех в молекулярной биологии!
Публикации в международных рецензируемых журналах — обязательное требование к работе ученого. Даже магистерские работы иногда приводят к публикациям первым автором. Лаборатория Константина Северинова довольно продуктивна в плане публикации статей: в год выходит минимум 12–15 работ в высокорейтинговых зарубежных журналах, например, в Nature Chemical Biology [12], PNAS [9], mBio [20], Chemical science [21], Molecular microbiology [22]. «Я их как детей — всех люблю, — отвечает Константин Северинов на вопрос о своих статьях. — Я могу рассказать про любую, чем она хороша, но выделить какую-то одну не могу». Ну а редакция «Биомолекулы» выделила — о них вы можете узнать из предыдущей главы.
«Публикации — это, конечно, хорошо, но как обстоят дела с “горизонтальным переносом информации” в научной среде этой лаборатории?» — спросите вы. Большой плюс обучения в Сколтехе для студентов — непосредственное общение с ведущими зарубежными учеными и участие в конференциях. Например, на сентябрьскую конференцию по CRISPR в Германии едет сразу десять человек из лаборатории, что показывает как высокий уровень мотивации, так и большие возможности для учащихся в Сколтехе. Возможности находить успешные коллаборации — это большая сила в научном мире. А «большая сила — это большая ответственность». Поэтому в лаборатории тщательно относятся к подбору новых сотрудников. При наборе новых студентов в лабораторию решение, останется ли новый сотрудник работать дальше или нет, принимается спустя некоторое время по результатам его работы.
Международные коллаборации с ведущими вузами США, Великобритании, Франции, Италии, Голландии, Японии, Израиля и других стран — одна из важных особенностей лабораторий в Центре наук о жизни (подробнее об этом мы писали в предыдущих статьях цикла о Сколтехе). Половина магистрантов второго года уезжает на стажировку за границу в рамках Academic Mobility. Студенты Константина Северинова, например, ездят в Ратгерский университет и Национальный центр биотехнологической информации в США, Институт Пастера и Лабораторию инженерных систем и биологических исследований и процессов во Франции, Университет Бен-Гуриона в Израиле, Делфтский технологический институт в Голландии.
«Наука не может быть внутри отдельной страны, поэтому и международное сотрудничество — это всего лишь что-то само собой разумеющееся, — рассказывает Екатерина Савицкая. — К сожалению, в России пока не очень большое научное сообщество (хотя оно и растет), всё еще немного замкнутое, все так или иначе друг друга знают, поэтому для общения и реального обмена опытом здесь просто пока недостаточно места. Международное общение и сотрудничество необходимо, как воздух. В Сколтехе для этого особенно удачное место, потому что институт международный, и внутренний официальный язык — английский. Для ученого полезно внутри лаборатории пользоваться английском языком, в дальнейшем проще общаться с иностранными коллегами, выступать на конференциях и писать статьи. Так же в принципе устроены ведущие лаборатории в Германии, Франции и т.п., где национальные языки уходят на второй план в работе».
Дмитрий Травин, о работе с микроцинами которого шла речь выше, занимается РИПами (RiPP — ribosomally synthesized posttranslationally modified peptide). RiPPs — в основном бактериальные микроцины, хотя они известны и у грибов, и у растений. Дима дважды ездил в Великобританию, учился методам кристаллографии в центре Джона Иннеса — одном из лучших центров в мире, специализирующемся на изучении вторичного метаболизма, и оборудованном всем необходимым для эффективного скрининга этих соединений. В будущем Дима планирует ехать во Францию, к коллабораторам из Парижского университета, которые занимаются клубеньковыми бактериями Rhizobium, фиксирующими азот в корнях бобовых растений. Антибиотик фазолицин, с которым сейчас работает Дмитрий, продуцируется одним из видов этих бактерий. Что интересно, действует он на бактерии, родственные виду-продуценту. Антимикробную активность показали против родов Rhizobium, Sinorhizobium (Ensifer) и Azorhizobium. Этот феномен можно объяснить жесткой конкуренцией видов за одну экологическую нишу. А применить можно, например, в сельском хозяйстве, подавляя рост патогенных бактерий и не влияя на рост симбионтов за счет высокой специфичности. Буквально в июле 2019 года вышел препринт статьи, рассказывающий об этом открытии, а сама статья только что была принята в Nature Communications.
Получилось довольно выгодное сотрудничество. Французы научили Диму работать с ризобиями, предоставили панель из нескольких десятков штаммов для проведения тестов. В свою очередь российская лаборатория исследует физиологию этих бактерий, механизм их конкуренции в почве с другими видами и взаимодействие с растениями: транспорт, проникновение в клетку и многое другое. Весной 2019 года прошла первая в мире специализированная конференция, посвященная исключительно RiPPs.
«Это наглядно показывает важность коллаборации в сообществе: если ты не умеешь что-то делать хорошо, то надо не учиться, а найти того, кто умеет. Это резко ускоряет процесс и позволяет достичь хороших результатов за очень короткое время», — комментирует Дмитрий.
Заключение
Исследовательская группа Константина Северинова — яркий пример хорошо организованной команды, причем не только из состоявшихся исследователей, но и подрастающих ученых. Когда-то Константин Северинов после окончания учебы в России уехал работать в США. Но вслед за этим он вернулся и стал сторонником возвращения «утекших мозгов» обратно. «Российская наука не умерла, а переехала за рубеж, ее нужно не воскрешать, а возвращать», — говорил он в интервью «Российской газете» в далеком 2007 году. Теперь же он сам принимает участие в создании нового поколения ученых, интегрированных в мировую научную среду.
Костя был популярен с первых дней своего возвращения в Россию — его подход отличался от того, как делали науку в большинстве мест в России. Это было очень заразительно, и хотелось все делать, как он: и думать, и эксперименты планировать, и успевать всё так же. Бывают же Учителя в жизни каждого человека — и, мне кажется, Костя в жизни своих студентов и есть такой человек.
В последней статье цикла публикаций о Центре наук о жизни Сколтеха мы расскажем о другой интересной исследовательской группе, которой руководит Михаил Гельфанд.
Литература
- Julia Gordeeva, Natalya Morozova, Nicolas Sierro, Artem Isaev, Tomas Sinkunas, Ksenia Tsvetkova et al. (2018). BREX system of Escherichia coli distinguishes self from non-self by methylation of a specific DNA site. Nucleic Acids Research. 47, 253–265;
- Биологический наукоград: как работает Центр наук о жизни Сколтеха;
- Науки о жизни: магистерская программа Сколтеха по биотехнологии;
- Просто о сложном: CRISPR/Cas;
- CRISPR-системы: иммунизация прокариот;
- CRISPR/Cas9 на службе у эмбриологов;
- Анти-CRISPR: ответ вирусов;
- Яды — высокоточное оружие: компьютерное исследование природных нейротоксинов;
- Sergey A. Shmakov, Kira S. Makarova, Yuri I. Wolf, Konstantin V. Severinov, Eugene V. Koonin. (2018). Systematic prediction of genes functionally linked to CRISPR-Cas systems by gene neighborhood analysis. Proc Natl Acad Sci USA. 115, E5307-E5316;
- Эволюция между молотом и наковальней, или Как микробиология спасла эволюцию от поглощения молекулярной биологией;
- SUMO: японская борьба или уникальная посттрансляционная модификация?;
- Mikhail Metelev, Ilya A Osterman, Dmitry Ghilarov, Nelli F Khabibullina, Alexander Yakimov, et. al.. (2017). Klebsazolicin inhibits 70S ribosome by obstructing the peptide exit tunnel. Nat Chem Biol. 13, 1129-1136;
- Zhu S. and Zheng G. (2018). Transcription-factor centric genome mining strategy for discovery of diverse unprecedented RiPP gene clusters. BioRxiv;
- Stanislav S. Terekhov, Ivan V. Smirnov, Maja V. Malakhova, Andrei E. Samoilov, Alexander I. Manolov, et. al.. (2018). Ultrahigh-throughput functional profiling of microbiota communities. Proc Natl Acad Sci USA. 115, 9551-9556;
- А кто живет у вас во рту?;
- 12 методов в картинках: секвенирование нуклеиновых кислот;
- Dmitry Sutormin, Natalia Rubanova, Maria Logacheva, Dmitry Ghilarov, Konstantin Severinov. (2019). Single-nucleotide-resolution mapping of DNA gyrase cleavage sites across the Escherichia coli genome. Nucleic Acids Research. 47, 1373-1388;
- Новый взгляд на геном: не просто цепочка генов, а трехмерная сеть, интегрирующая функциональные домены ядра;
- Организовать геном: запутанная история гипотез и экспериментов;
- Inna Zukher, Michael Pavlov, Darya Tsibulskaya, Alexey Kulikovsky, Tatyana Zyubko, et. al.. (2019). Reiterative Synthesis by the Ribosome and Recognition of the N-Terminal Formyl Group by Biosynthetic Machinery Contribute to Evolutionary Conservation of the Length of Antibiotic Microcin C Peptide Precursor. mBio. 10;
- Shi-Hui Dong, Alexey Kulikovsky, Inna Zukher, Paola Estrada, Svetlana Dubiley, et. al.. (2019). Biosynthesis of the RiPP trojan horse nucleotide antibiotic microcin C is directed by the N-formyl of the peptide precursor. Chem. Sci.. 10, 2391-2395;
- Olga Musharova, Vasily Sitnik, Marnix Vlot, Ekaterina Savitskaya, Kirill A. Datsenko, et. al.. (2019). Systematic analysis of Type I‐E Escherichia coli CRISPR‐Cas PAM sequences ability to promote interference and primed adaptation. Mol Microbiol;
- Новые друзья CRISPR/CAS;
- Кто живет во рту у медведя;
- Бурый медведь: сонный метагеном.




















