Геномные технологии в спасении исчезающих видов
10 марта 2020
Геномные технологии в спасении исчезающих видов
- 2026
- 2
- 3
-
Авторы
-
Редакторы
Современные молекулярные технологии, особенно геномика, уже играют важную роль в охране биоразнообразия. Нельзя сбрасывать со счетов и синтетическую биологию, благодаря которой однажды мы сможем трансформировать не только отдельные организмы, но и целые популяции и экосистемы, и даже «воскрешать» вымершие виды. В этой статье мы продолжим знакомство с актуальным и перспективным применением молекулярных технологий в спасении вымирающих видов.
Одна из острых проблем, обсуждающихся в мировом научном сообществе, — начинающееся сейчас, по оценкам множества исследователей, шестое глобальное массовое вымирание [1], [2]. Согласно данным Международного союза охраны природы, 27% видов живых организмов находятся под угрозой вымирания, в том числе 40% амфибий, 33% коралловых полипов, 25% млекопитающих. Результаты международной программы ООН «Оценка экосистем на пороге тысячелетия» показали, что каждый день исчезает до 24 видов [3], а специалисты секретариата конвенции ООН по биоразнообразию указывают еще более настораживающую цифру — до 150 видов в день [4]. Темпы вымирания в настоящее время уже превысили фоновый уровень по разным источникам от 100 до 1000 раз, и продолжают нарастать (по прогнозам они могут вырасти до 10 000 раз) [4–6]!
За фоновый уровень принимаются недавние в геологическом масштабе времени темпы вымирания, существовавшие непосредственно перед усилением человеческой деятельности. Его первые оценки были палеонтологическими: ископаемая летопись говорит, что среднее время существования вида — 1–10 млн лет. Взяв наименьшую цифру, Пимм с соавторами предложили принимать за отправной уровень вымирание одного вида на миллион в год [7]. Это была одна из ранних, довольно грубых, оценок фонового уровня вымирания, которая затем совершенствовалась. Сейчас для более обстоятельного определения этого показателя используются молекулярно-филогенетические данные, согласно которым, он составляет примерно 0,1 вымирание на миллион видов в год [6].
За последние 600 миллионов лет истории планеты выделяют пять глобальных массовых вымираний. Пожалуй, самое известное из них и одновременно самое недавнее произошло на границе мелового и палеогенового периодов — около 66 млн лет назад, — и привело к исчезновению, в частности, динозавров, а после крупнейшего глобального вымирания, произошедшего на границе пермского и триасового периодов около 252 млн лет назад, выжили только около 5% видов [8]. Однако текущее глобальное массовое вымирание отличается от всех предыдущих тем, что оно вызвано деятельностью только одного вида — нашего. По этой причине некоторые исследователи окрестили его падением «человеческого метеора» [9]. Если оно продолжит развертываться в том же темпе, будущие поколения столкнутся с проблемами выживания на пустеющей планете с существенно обедненным биоразнообразием и коллапсом экосистем. В связи с этим, новые разработки в области геномных технологий начинают активно использоваться в природоохранной биологии, и уже помогли спасти ряд видов, находившихся на грани вымирания. В этой статье мы расскажем как об уже реализованных проектах, так и о перспективах ближайшего будущего.
Геномные исследования в восстановлении численности вымирающих видов
Геномные исследования широко используются для разработки программ по восстановлению популяций крайне малочисленных видов. Рассмотрим пару ярких примеров таких проектов.
Красноногий ибис, Nipponia nippon
Когда-то красноногий ибис Nipponia nippon (рис. 1) был широко распространен на Дальнем Востоке России, в Японии и Китае. Однако к 1981 году из-за разрушения естественных местообитаний, использования пестицидов и охоты в дикой природе осталось всего семь особей этого вида (две пары с птенцами)! Их чудом обнаружили в китайской провинции Шэньси после того, как вид практически признали вымершим. Место, где нашли птиц, стало первой станцией охраны ибисов в Китае. Позже были открыты еще пять центров разведения этого вида, и уже в 2018 году численность его в Китае выросла до 2500 особей. В 1999-м ибисов завезли в центр по разведению в Японии, и практически сразу же там появился на свет первый птенец. К 2018 году численность красноногих ибисов в Стране восходящего солнца уже составляла около 500. В Южную Корею пару ибисов привезли в 2008 году; в 2018 году их численность возросла до 308.

Рисунок 1. Красноногий, или японский, ибис (парк птиц «Чимелонг» в Гуанчжоу)
В восстановлении популяций ибисов в этих странах важную роль играли и продолжают играть генетические исследования. В начале программы по разведению в Китае из-за близкородственного скрещивания (ведь все современные красноногие ибисы являются потомками четырех особей) около 10% птенцов рождались с отклонениями в развитии: деформированными когтями, которые не позволяли им цепляться за ветви; и аномалиями строения крыльев, которые не давали им летать. Учет генетических данных при составлении программ разведения ибисов (введение так называемого генетического менеджмента) позволил существенно сократить частоту отклонений в развитии и оздоровить популяции этих птиц. Как отмечает Фенг Шенггуо, профессор Колледжа наук о жизни в Чжэцзянском университете, после этого только два ибиса из 286 (за период с 2008 по 2018 годы) родились с аномалиями.
В настоящее время для разработки протоколов «генетического менеджмента» популяций ибисов используются геномные технологии. Полногеномное секвенирование дает информацию об SNP (однонуклеотидных полиморфизмах) и STR-маркерах (коротких тандемных повторах, состоящих из одной или более (обычно до шести) пар нуклеотидов (общей длинной около 100 пар нуклеотидов), непосредственно примыкающих друг к другу, количество которых в конкретном локусе различается у особей одного вида). Они позволяют изучать генетическую структуру популяций, родственные связей между особями в них, идентифицировать отдельных особей, а также надежно определять их пол (по морфологическим признакам у красноногого ибиса это затруднительно). Это используется, во-первых, для оптимизации программ разведения (минимизации близкородственного скрещивания), а во-вторых, для реинтродукции ибисов в дикую природу с максимально возможным генетическим разнообразием, потому что это является залогом их выживания [10].
Флоридская пума, Puma concolor coryi
Еще одна удивительная история спасения связана с флоридской пумой Puma concolor coryi (рис. 2а,б). Этот подвид выручили благодаря экстренным (можно сказать — отчаянным) действиям, направленным на увеличение его генофонда, — скрещиванию с другим подвидом пумы из Техаса — Puma concolor stanleyana [11]. В середине 1990-х осталось всего лишь 26 особей флоридской пумы, и все они были в удручающем состоянии. Многие из пум имели искривленные хвосты, завихрения шерсти на спине, пониженный иммунитет и страдали от повышенного количества паразитов (рис. 2б). Популяция испытывала инбредную депрессию — снижение жизнеспособности из-за низкого генетического разнообразия и близкородственного скрещивания. Для спасения флоридских пум восемь самок техасского кугуара привезли во Флориду. Пять из них скрестились с флоридскими пумами и дали потомство. Затем самок кугуара возвратили домой, а популяция флоридских пум быстро восстановилась — в течение следующих 12 лет родились 424 котенка. Если ранее численность этих больших кошек снижалась на 5% в год, то после этого мероприятия она стала расти со скоростью около 4% в год. Более того, неприятные признаки инбридинга полностью исчезли. Единственным минусом, который заметили ученые, оказался более сложный характер новых, «генетически обогащенных», поколений.
Синтетическая биология в спасении видов от исчезновения
Еще одно многообещающее, но требующее исключительной осторожности в применении направление в охране природы — синтетическая природоохранная биология. Синтетическая биология вообще — молодое междисциплинарное направление на стыке биотехнологии, генетики, геномики и инженерии, призванное проектировать и синтезировать генетический материал для создания новых функций живых клеток и организмов, а в перспективе — целых видов и экосистем [12], [13].
Однако синтетическая биология может как решить многие проблемы сохранения биоразнообразия, так и нанести биосфере непоправимый вред, поэтому перспективы ее применения и связанные риски горячо обсуждаются в научной литературе [14]. В техническом докладе Международного союза охраны природы, вышедшем в мае 2019 года [15], выделены два основных направления применения синтетической биологии в охране природы: адаптация организмов к неблагоприятным факторам (заболеваниям, ацидификации океана, колебаниям климата и т.п.) и устранение процессов, сокращающих биоразнообразие (инвазивные виды, торговля дикими животными и т.п.). Некоторые примеры уже реализующихся и потенциально возможных проектов в этих областях рассмотрим далее.
Изменение климата и инфекционные (особенно грибковые) заболевания [16–18] усугубляют вред антропогенных воздействий — разрушения местообитаний, распространения инвазивных видов и переэксплуатации в результате охоты и рыболовства. Всё это приводит к сокращению численности и обеднению генофондов популяций, а это делает их еще более уязвимыми. Синтетическая биология в состоянии привить определенным видам устойчивость к заболеваниям, которые, в противном случае, истребят их [15].
Американский каштан (Castanea dentata) и патогенный грибок
Пионерный проект, задействовавший синтетическую биологию в природоохранных целях, — спасение американского каштана Castanea dentata (рис. 3). Когда-то это дерево было распространено в американских лесах, предоставляя дом для множества видов животных, а его орехи служили для пропитания людей и использовались в медицине (рис. 3а–в) [19]. Однако в XIX веке в США был занесен патогенный грибок [20], который практически истребил американские каштаны (рис. 3д). Без срочного серьезного вмешательства это дерево вымерло бы окончательно, и традиционная селекция для выработки иммунитета к грибку не помогла бы — слишком невелики скорость и эффективность. Исследователям из Колледжа наук об окружающей среде и лесоводстве (Нью-Йорк) удалось «привить» американским каштанам устойчивость к грибку с помощью внедрения гена оксалатоксидазы пшеницы.
Оксалатоксидаза — фермент, деградирующий щавелевую кислоту, которая как раз выделяется грибком при разрушении тканей растения (рис. 3ж) [21]. Поскольку этот фермент не имеет фунгицидного действия, вероятность появления резистентности у грибков существенно снижается. Многочисленные тесты показали, что полученные трансгенные растения не представляют угрозу для многих других организмов, включая микоризные грибки (взаимодействующие с корневой системой растения) и головастиков (которые питаются листовым опадом) [22], [23], а питательные свойства их орехов эквивалентны природным каштанам [15].
Хитридиомикоз у амфибий
Всё чаще природоохранная биология сталкивается с вызовами, которые крайне сложно решить консервативными методами с учетом дефицита времени; по этой причине всё больше специалистов называют синтетическую биологию средством разрешения подобных проблем. Одна из таких проблем — широко распространившиеся хитридиомикозы — грибковые инфекции, которые некоторые исследователи считают самой большой опасностью для биоразнообразия за всю историю науки [24]. Они уже привели к вымиранию в дикой природе около 90 видов амфибий [25] и сокращению численности еще 124 видов более чем на 90% (рис. 4а) [26]. Например, в горной области Панамы вымерли или резко сократились в численности 41% видов амфибий, когда на их территорию был занесен грибок Batrachochytrium dendrobatidis [27]. Родственник этого грибка, B. salamandrivorans, привел к вымиранию бельгийской популяции огненной саламандры (Salamandra salamandra), а популяция этого вида в Голландии сократилась на 99,9% буквально за считанные годы (рис. 4б–д) [28]. Сейчас основной метод борьбы с грибками в природе — фунгициды, которые при этом наносят вред экосистемам; другие методы пока оказываются недостаточно эффективными. В связи с этим, Реид Харрис и Луис Роллинс-Смит [15] предложили две возможные стратегии со стороны синтетической биологии:
- Генетическая модификация грибков, которая сделает их авирулентными (не способными поражать амфибий) и распространение этой модификации в их природных популяциях с помощью генного привода.
- Модификация видов амфибий, подверженных заболеванию, — например, внедрение генов антимикробных пептидов [29], которые защищают устойчивые виды амфибий от грибков [30], или модификация бактерий кожного микробиома амфибий, которая усилила бы их защитное действие (они выделяют антимикробные пептиды, в том числе против хитридиомицетов).
Обесцвечивание и вымирание кораллов
Другое применение синтетической биологии — помощь в адаптации видов к изменениям климата в случае, когда это становится вопросом их выживания. Одна из особенно острых проблем в этом отношении — вымирание кораллов [31], [32]. Так, около 50% кораллов Большого Барьерного рифа Австралии исчезло всего за два года (2016-й и 2017-й). Множество авторов [33–35] рассматривают синтетическую биологию как средство для искусственной адаптации кораллов к стрессовым факторам. Одна группа сосредоточила свое внимание на симбионтах кораллов — динофлагеллятах-зооксантеллах рода Symbiodinium [34]. Их потеря из-за разнообразных стрессовых факторов (в частности, потепления) вызывает обесцвечивание и гибель кораллов [32]. Ученые отмечают, что устойчивость полипов к обесцвечиванию тесно связана с генетическими особенностями этих динофлагеллят (в частности, со спецификой генов антиоксидантной системы), и стремятся определить генетические основы этой устойчивости. Их конечной целью является создание устойчивых к стрессовым факторам зооксантелл методами генной инженерии [36], чтобы защитить кораллы от обесцвечивания. Но почему бы просто не заселить кораллы уже существующими в природе устойчивыми представителями этого рода? Проблема в том, что многие виды кораллов образуют симбиоз только с определенными, специфичными для них представителями Symbiodinium. Поэтому многие исследователи видят выход именно в использовании экологической биоинженерии (environmental bioengineering) для модификации этих динофлагеллят и восстановления здоровья морских экосистем.
Возможность использования такого радикального подхода к решению экологических проблем поднимает множество теоретических и этических вопросов. Действительно, введение генетически модифицированных коралловых полипов или их симбионтов в естественные экосистемы может сохранить рифы. Но при этом нельзя не принимать во внимание риск непредвиденных и нежелательных экологических последствий. Ведь организмы с новыми свойствами могут получить конкурентное превосходство над их родственниками и даже стать инвазивными. По этой причине группа исследователей под руководством Мэделин ван Оппен указывает на необходимость не только создания устойчивых разновидностей ключевых организмов рифовых сообществ, но и всестороннего анализа возможных экологических последствий [33]. Они не исключают, что генная модификация кораллов может быть оправдана в случае критической ситуации в будущем, но на данный момент предлагают менее радикальный подход.
Авторы называют его управляемой человеком эволюцией (human-assisted evolution). Суть этой методики заключается в ускорении процессов, протекающих естественным образом в природе (мутационного процесса, естественного отбора, акклиматизации, изменений в сообществе симбиотических микроорганизмов). Основные составляющие этого процесса — выведение устойчивых кораллов путем селекции, лабораторная эволюция упомянутых выше симбионтов — зооксантелл, — активная модификация микробиома кораллов, стимуляция акклиматизации кораллов. Последняя, кстати, пока изучена слабо, но представляет особую надежду: в некоторых акваториях Индо-Тихоокеанского региона среди подверженных обесцвечиванию кораллов появились более устойчивые к колебанию температур формы. Группа ван Оппен также создала межвидовые гибриды Acropora loripes — Acropora tenuis, некоторые из которых отличаются выносливостью к повышенной температуре и кислотности воды.
Возрождение вымерших видов
Наверное, самые амбициозные проекты, направленные на преумножение биоразнообразия, связаны с возвращением к жизни вымерших видов. Эти исследования выделяются в отдельное направление — de-extinction [37]. Появились проекты, стремящиеся возвратить к жизни мамонта, странствующего голубя и ряд других вымерших животных — это уже не выглядит фантастикой (кстати, о некоторых из них мы уже писали [37]). Более традиционные подходы здесь можно разделить на две группы:
- Обратное скрещивание и селекция, направленная на закрепление признаков, присутствовавших у вымершего вида или подвида.
- Клонирование (перенос ядерного материала из взрослой клетки вымершего вида (например, сохранившейся в условиях вечной мерзлоты или в биобанке) в неоплодотворенную яйцеклетку близкого существующего вида).
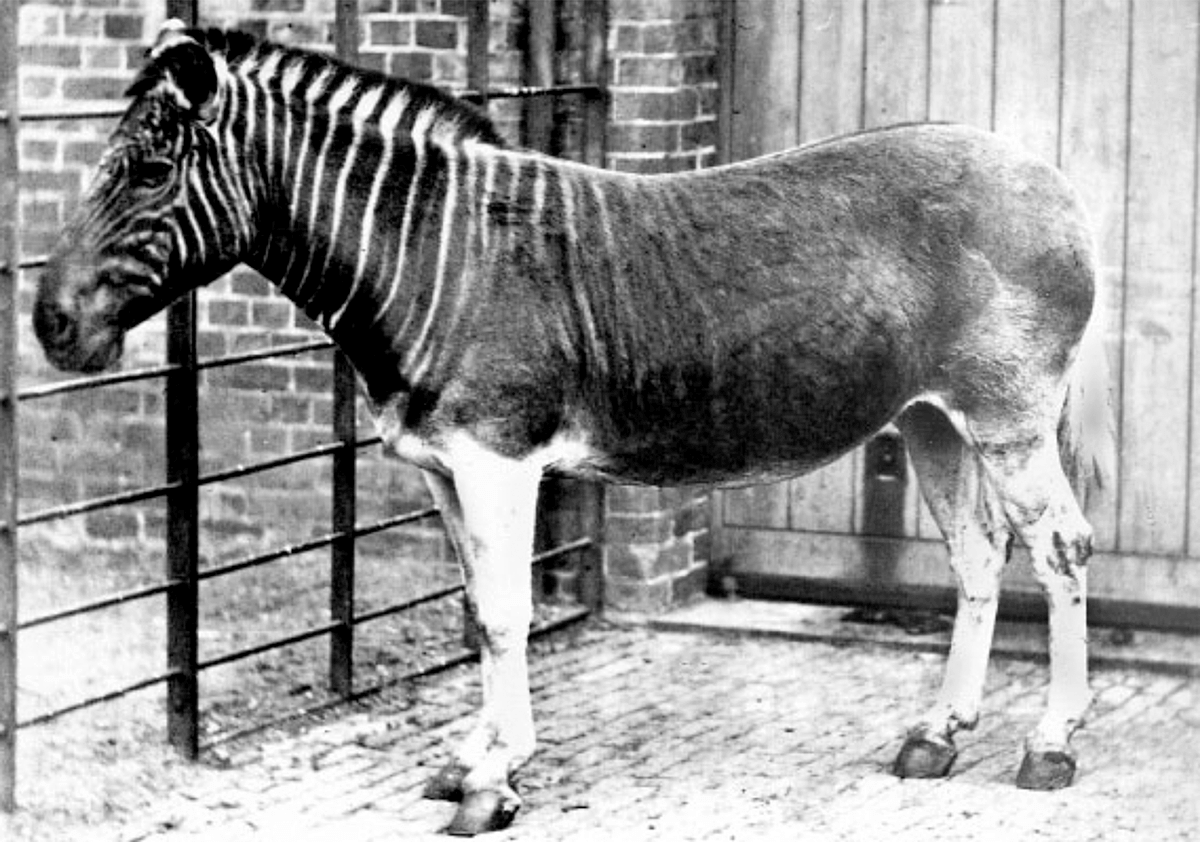
В первом случае получается организм, который выглядит подобно представителям вымершего вида или подвида, однако его генотип и, соответственно, роль в экосистемах отличаются. Выводить такие организмы очень долго, но действенность этого подхода уже продемонстрирована в случае с кваггой — вымершим подвидом зебры (рис. 5).
Когда-то стада квагг населяли просторы Южной Африки, но, как и другие копытные, они стали объектом интенсивной охоты. В результате бездумного истребления местными жителями, считавшими, что квагги конкурируют с их домашним скотом за пропитание, они полностью исчезли. Последняя квагга умерла в Амстердамском зоопарке 12 августа 1883 года. В 1987 году был запущен «Проект Квагга», который стремится исправить эту ошибку путем выведения популяции зебр, внешне идентичных кваггам, путем селекции из оставшегося подвида зебры. В результате уже выведены особи, очень напоминающие вымерших квагг (рис. 5б).
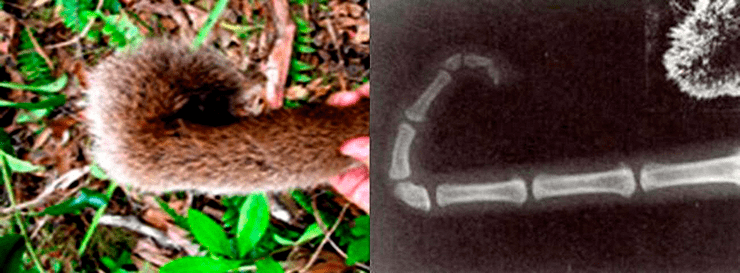
Что касается второго подхода, связанного с клонированием [38], то он возможен только для недавно вымерших видов из-за высокой скорости разрушения ДНК. Более того, у видов-кандидатов на «воскрешение» должен существовать современный родственник, подходящий на роль суррогатного родителя. Нельзя также не принимать во внимание, что часто межвидовое клонирование приводит к рождению нездоровых детенышей с многочисленными врожденными аномалиями и сокращенной продолжительностью жизни, а также представляет угрозу для суррогатной матери. Тем не менее эта технология продолжает совершенствоваться. Один из пока немногих проектов относительно успешного межвидового клонирования, который дает надежду на развитие «природоохранного клонирования», был реализован в Иране (Royan Institute). Там клонировали исфаханского муфлона (Ovis orientalis isphahanica), находящегося на грани вымирания из-за охоты (рис. 6). Материалом для клонирования послужили фибробласты муфлона из криобанка, ядра которых пересадили в яйцеклетки домашней овцы (Ovis aries). В результате у овец родились два детеныша муфлона, которые, к сожалению, вскоре погибли [39].

Рисунок 6. Детеныш исфаханского муфлона (Ovis orientalis isphahanica), родившийся у домашней овцы в результате четырехлетнего проекта по клонированию с переносом ядер соматических клеток (фибробластов) муфлона из криобанка в Научно-исследовательском институте «Ройан» (в переводе с персидского «ройан» означает «эмбрион»).
Существует инициатива возвратить практически вымерший сейчас северный подвид белого носорога (Ceratotherium simum cottoni) (рис. 7), представленный всего двумя не способными к деторождению самками (последний самец умер в марте 2018 года). В качестве реципиента для клонирования предлагается южный подвид, представленный примерно 21 000 особями. Однако на данный момент полученные эмбрионы доживали только до ранней стадии эмбрионального развития [40].

Рисунок 7. Северный белый носорог (Ceratotherium sinum cottoni)
Для эффективного применения методов синтетической биологии для возрождения вымерших таксонов требуется преодолеть множество технических проблем. Несмотря на то, что геном ряда вымерших видов (например, одного из видов моа, Anomalopteryx didiformis — крупных нелетающих птиц, населявших Новую Зеландию и истребленных аборигенами около 700 лет назад (рис. 8) [41]) секвенирован (т.е. определена последовательность нуклеотидов в геноме), точность и полнота этого секвенирования еще далеки от необходимого уровня [42], а также нет представлений о геномной архитектуре многих сложных особенностей, необходимых для выживания видов [41].
Борьба с инвазивными организмами
Второе, чем может помочь синтетическая биология в охране природы, — устранение факторов, непосредственно снижающих биоразнообразие. В частности, это борьба с инвазивными видами (чужеродными для определенных местообитаний, занесенными человеком и угрожающими биоразнообразию). Один из таких проектов — спасение эндемичных (то есть встречающихся на ограниченной территории) птиц на Гавайях (рис. 9). Основной причиной их вымирания стали птичья малярия и оспа, которые переносятся комарами, завезенными на остров человеком в XIX и начале XX веках. В результате уже исчезли более чем 24 вида гавайских цветочниц и целое семейство Mohoidae (гавайские медососы) (рис. 9а) [43], [44].
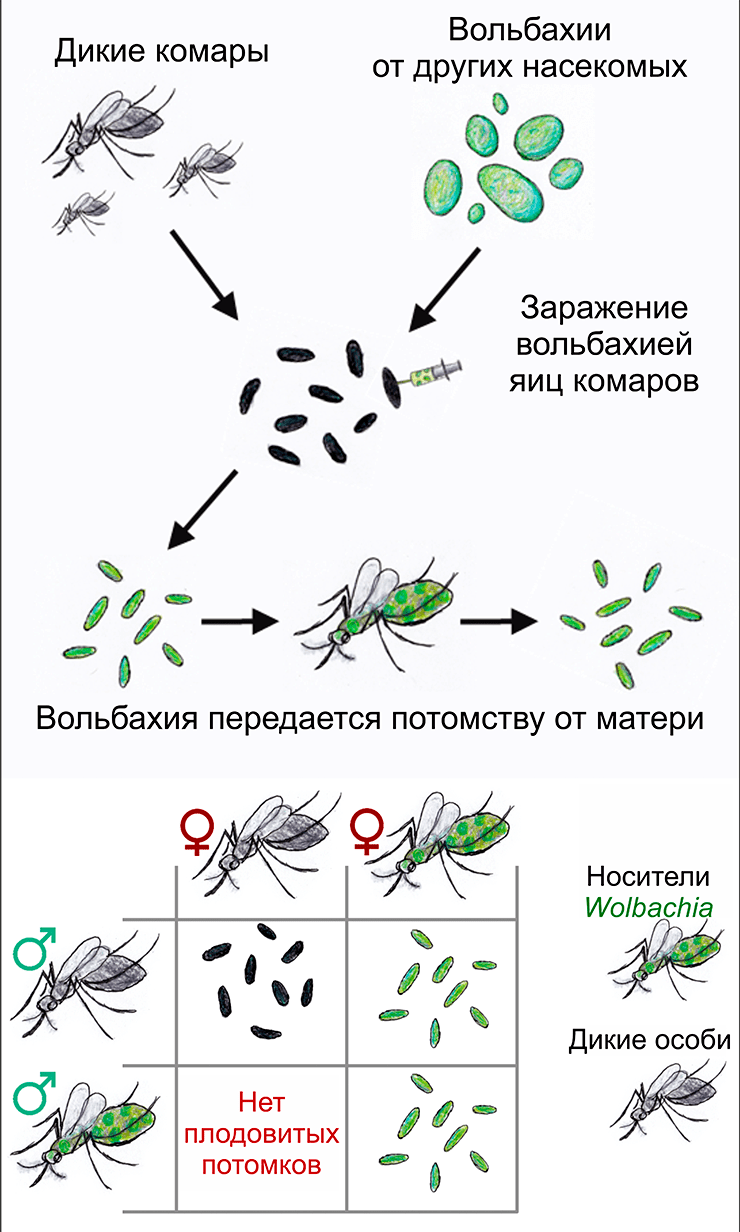
Для борьбы с дальнейшим вымиранием разрабатывается технология, основанная на одном интересном явлении. Существуют бактерии вольбахии (Wolbachia), встречающиеся у 50% видов членистоногих (в том числе и насекомых). При этом самцы комаров — носители этой бактерии — могут давать потомство только с самками-носителями того же штамма вольбахии (рис. 9в). Ученые предлагают массово выпустить самцов с новым штаммом вольбахии на Гавайях, так как их скрещивание с местными самками (у которых этой вольбахии нет) должно привести к сокращению численности, или даже полному исчезновению комаров на данной территории [45–47].
Еще одна, более радикальная, технология, которая в будущем может поставить под контроль инвазивные виды в природе, основана на мутагенной цепной реакции [48]. В частности, сейчас ведут разработки мутагенной цепной реакции для подавления популяций малярийных комаров (комплекса Anopheles gambiae) [49]. Более того, в недавно опубликованной статье в Nature ученые из Калифорнийского университета в Сан Диего впервые продемонстрировали возможность проведения мутагенной цепной реакции у млекопитающих [50].
Как мутагенная цепная реакция, так и использование вольбахии относятся к так называемым генным приводам (gene drives). Они позволяют распространять определенные генетические варианты в целых популяциях организмов, даже если последние снижают их жизнеспособность [51]. Технология с использованием вольбахии уже используется для контроля популяций желтолихорадочного комара Aedes aegypti — переносчика вируса Зика [52], вирусов лихорадки денге, желтой лихорадки [53] и других заболеваний. Однако внедрение в практику генных приводов на основе эндонуклеаз, по оценкам специалистов [15], не ожидается по крайней мере в течение ближайших 10 лет, несмотря на то, что лабораторные исследования ведутся активно. Сложность здесь в том, что необходимо тщательно оценить безопасность этого подхода и разработать стратегии контроля распространения таких «приводов».
Промышленная синтетическая биология для снижения нагрузки на окружающую среду
Еще один путь, которым синтетическая биология может существенно снизить эксплуатацию биоразнообразия, — разработка синтетических аналогов природным продуктам: например, это синтетический сквален или новая альтернатива крови мечехвоста [15]. Остановимся на последнем примере подробнее.
Амебоциты крови мечехвостов способны выявлять мельчайшие количества эндотоксинов грамотрицательных бактерий. Именно по этой причине лизат амебоцитов мечехвоста вошел в практику для регистрации бактериального загрязнения медикаментов — его уже десятки лет используют в производстве вакцин и инъекционных препаратов. Однако ценой этому стало катастрофическое сокращение популяций мечехвостов, а вслед за ними и ряда водоплавающих птиц, которые питаются их яйцами. В конце 1990-х разработали альтернативный метод определения эндотоксинов на основе рекомбинантного [54] фактора С мечехвостов — фермента, который участвует в распознавании эндотоксинов. Оказалось, что этот тест имеет не меньшую, а в ряде случаев даже бóльшую эффективность по сравнению с использованием лизата амебоцитов мечехвостов. Распространение этого протокола по расчетам должно сократить использование крови мечехвостов на 90% [15].
Еще одно важное применение синтетической биологии в экологии — разработка новых технологий биоремедиации [55]. На ежегодном международном конкурсе по биоинженерии iGEM , где команды со всего мира представляют свои проекты в области синтетической биологии, экологические проекты выделены в отдельную категорию. Многие из них связаны именно с биоремедиацией. Например, один из лучших проектов 2019 года в этой группе посвящен разработке новых штаммов зеленой водоросли хламидомонады Chlamydomonas reinhardtii [56], которые смогут в специальных биореакторах перерабатывать отходы из полиэтилентерефталатного (ПЭТ) пластика, в том числе очищать воду от загрязнения микропластиком этого состава. Для того чтобы хламидомонады получили такую полезную способность, в их геном внедрили гены двух ферментов (ПЭТазы и МЭТазы), изначально обнаруженных у бактерии Ideonella sakaiensis. Они участвуют в деградации ПЭТ-пластика до терефталевой кислоты и этиленгликоля.
Недавно мы писали о российских участниках этого конкурса, представивших там свою систему диагностики болезни Лайма: «LymeExpress — студенты в борьбе с клещевыми инфекциями» [57]. — Ред.
«Генетическое спасение» как новый инструмент природоохранной биологии
Геномные технологии и синтетическая биология трансформируют разнообразные области медицины и индустрии, развиваясь с огромной скоростью [58]. Исследователи учатся менять генетическую информацию живых организмов темпами, немыслимыми еще несколько лет назад [48]. Значение геномных технологий для решения одной из первостепенных проблем — сохранения биоразнообразия — также начинает играть всё бóльшую роль как напрямую, так и косвенно.
Их прямое использование для спасения отдельных популяций и целых видов от вымирания связано с развитием концепции так называемого генетического спасения (genetic rescue), которая горячо обсуждается в научном сообществе в последние годы. Можно выделить три уровня этого процесса.
Первый связан с получением информации о генетической структуре популяций вымирающих видов и использованием ее для разработки природоохранных мероприятий. Он не предполагает применения генноинженерных методов и «редактирование» геномов диких организмов. «Генетическое спасение» этого уровня начинает все больше входить в практику, и ряд подобных проектов уже дал свои плоды. Они, как правило, предполагают увеличение генофонда малочисленных, изолированных популяций, которые испытывают инбредную депрессию, путем введения в них особей из других популяций (так называемая генетическая транслокация). Выше мы уже приводили пример такого «спасения» флоридской пумы, а другой пример — подъем численности одной из популяций горного кускуса (Burramys parvus) в Австралии [59]. Раньше подобные манипуляции считались крайне нежелательными из-за возможности аутбредной депрессии и ряда других негативных эффектов. Теперь же оказалось, что их вероятность часто не настолько велика, как риск исчезновения небольших популяций из-за инбридинга. Введение активного генетического менеджмента в природоохранные программы может спасти тысячи малочисленных популяций, и многие авторы ратуют за распространение этой практики [60]. В настоящее время инбридинг упоминается только примерно в 7% проектов по поддержке вымирающих видов в США, Австралии и Европе, несмотря на то, что именно потеря генетического разнообразия в первую очередь и приводит к вымиранию [60]. Недаром из 156 случаев «генетического спасения» 93% привели к успеху. Проблема в том, что в большинстве стран охранный статус гибридов не определен, и подобные проекты часто отклоняются чиновниками. Так был отклонен план по восстановлению одного из подвидов темной приморской овсянки Ammodramus maritimus nigrescens, который предполагал скрещивание последних пяти оставшихся самцов этого таксона с самками другого подвида. В результате подвид вымер в 1986 году [59].
Второй уровень «генетического спасения» предполагает использование генной инженерии для того, чтобы привить видам, находящимся на грани вымирания, устойчивость к заболеваниям или ускоренно адаптировать их к стрессовым факторам. Впервые этот подход применили к американскому каштану Castanea dentata, о чем уже было сказано выше. Сегодня модифицированные каштаны с устойчивостью к грибку получают разрешение на свободную посадку в естественных условиях в США. Если процедура пройдет успешно, американский каштан станет первым видом, спасенным от вымирания методами генной инженерии.
Спасение популяций или видов живых организмов путем внесения в их геном адаптивных аллелей получило название «облегченной адаптации» (facilitated adaptation) [61]. Ряд исследователей предлагает использовать этот подход для решения других острых проблем, таких как вымирание амфибий от хитридиомикоза [15], гавайских птиц от птичьей малярии [62] и кораллов от обесцвечивания [33]. Менее радикальный подход, который не предполагает непосредственную генетическую модификацию организмов, — управляемая эволюция — сейчас используется для выведения устойчивых к климатическим изменениям кораллов [63].
Третий уровень «генетического спасения» — восстановление вымерших видов методами генной инженерии и клонирования. Как обсуждалось выше, эти меры наиболее дискуссионны. Многие исследователи считают более целесообразным сосредоточиться на спасении еще сохранившихся видов, которые вымирают каждый день. Пока ни один проект в области de-extinction не был полноценно реализован [37], но несколько (по странствующему голубю, шерстистому мамонту и вересковому тетереву) находятся на стадии лабораторных исследований. Так, команда Джорджа Чёрча экспериментирует с культурами клеток (фибробластов) слонов, делая их более «мамонтоподобными» с помощью CRISPR [65]. В них уже были «встроены» мутации, отвечающие за развитие волосяного покрова, особенности гемоглобина мамонтов и некоторые климатические адаптации (в частности, определенные изменения в ионных каналах). В рамках проекта по странствующему голубю совершенствуется применение методов генной инженерии к птицам. Был получен голубь, названный Апсу (Apsu), некоторые репродуктивные клетки которого несли ген Cas9. Это первый шаг на пути к эффективной генной инженерии у голубей.
Даже консервативные расчеты показывают, что 15–40% видов живых организмов могут исчезнуть к 2050 году в результате разрушения их местообитаний, изменения климата и других последствий человеческой деятельности [61]. Такие катастрофические темпы потери биоразнообразия толкают ученых на рассмотрение в том числе довольно радикальных мер по его сохранению, например, с использованием генноинженерных методов. Придерживаться главенствовавшего прежде в охране природы принципа невмешательства сейчас, по мнению многих исследователей, может быть опаснее, чем принятие подобных активных, пусть даже и инвазивных, действий. Человечество, хочет оно того или нет, издревле непреднамеренно влияет и продолжит влиять на ход эволюции. Это и стало одной из причин современного кризиса биоразнообразия. Возможно, сейчас мы столкнулись с необходимостью начать намеренно влиять на него положительно? Биотехнологии дают реальную надежду на спасение ряда таксонов, и в будущем число подобных примеров будет только расширяться. Поможет ли эта область решить многие проблемы в охране природы, или только приумножит их, будет зависеть от обдуманности и добросовестности наших решений.
Литература
- Gerardo Ceballos, Paul R. Ehrlich, Anthony D. Barnosky, Andrés García, Robert M. Pringle, Todd M. Palmer. (2015). Accelerated modern human–induced species losses: Entering the sixth mass extinction. Sci. Adv.. 1, e1400253;
- Элизабет Колберт: «Шестое вымирание. Неестественная история». Рецензия;
- Millennium Ecosystem Assessment. Ecosystems and human well-being: synthesis. Washington, DC: Island Press, 2005. — 137 p.;
- Djoghliaf A. (2007). Message on the occasion of the International day for biological diversity. Convention on biological diversity;
- Gerardo Ceballos, Paul R. Ehrlich. (2018). The misunderstood sixth mass extinction. Science. 360, 1080.2-1081;
- Jurriaan M. De Vos, Lucas N. Joppa, John L. Gittleman, Patrick R. Stephens, Stuart L. Pimm. (2015). Estimating the normal background rate of species extinction. Conservation Biology. 29, 452-462;
- S. L. Pimm, G. J. Russell, J. L. Gittleman, T. M. Brooks. (1995). The Future of Biodiversity. Science. 269, 347-350;
- Michael J. Benton, Richard J. Twitchett. (2003). How to kill (almost) all life: the end-Permian extinction event. Trends in Ecology & Evolution. 18, 358-365;
- Picard K. (2016). Biodiversity and ethics: do we have a responsibility to preserve? Journal of Science & Health at The University of Alabama. 43–44;
- Shengbin Li, Bo Li, Cheng Cheng, Zijun Xiong, Qingbo Liu, et. al.. (2014). Genomic signatures of near-extinction and rebirth of the crested ibis and other endangered bird species. Genome Biol. 15;
- W. E. Johnson, D. P. Onorato, M. E. Roelke, E. D. Land, M. Cunningham, et. al.. (2010). Genetic Restoration of the Florida Panther. Science. 329, 1641-1645;
- Balmer A. and Martin P. Synthetic biology. Social and ethical challenges. Institute for Science and Society, University of Nottingham, 2008. — 36 p.;
- Синтетическая биология: от наблюдения к вмешательству;
- Antoinette J. Piaggio, Gernot Segelbacher, Philip J. Seddon, Luke Alphey, Elizabeth L. Bennett, et. al.. (2017). Is It Time for Synthetic Biodiversity Conservation?. Trends in Ecology & Evolution. 32, 97-107;
- Genetic frontiers for conservation: an assessment of synthetic biology and biodiversity conservation / ed. by Redford K.H., Brooks T.M., Macfarlane N.B.W. and Adams J.S. Gland, Switzerland: IUCN, 2019. — 166 p.;
- Arturo Casadevall. (2017). Don't Forget the Fungi When Considering Global Catastrophic Biorisks. Health Security. 15, 341-342;
- Fausto Almeida, Marcio L. Rodrigues, Carolina Coelho. (2019). The Still Underestimated Problem of Fungal Diseases Worldwide. Front. Microbiol.. 10;
- Anastasia P. Litvintseva, Mary E. Brandt, Rajal K. Mody, Shawn R. Lockhart. (2015). Investigating Fungal Outbreaks in the 21st Century. PLoS Pathog. 11, e1004804;
- Douglass F. Jacobs, Harmony J. Dalgleish, C. Dana Nelson. (2013). A conceptual framework for restoration of threatened plants: the effective model of American chestnut (Castanea dentata) reintroduction. New Phytol. 197, 378-393;
- Sandra L. Anagnostakis. (1987). Chestnut Blight: The Classical Problem of an Introduced Pathogen. Mycologia. 79, 23-37;
- Bo Zhang, Allison D. Oakes, Andrew E. Newhouse, Kathleen M. Baier, Charles A. Maynard, William A. Powell. (2013). A threshold level of oxalate oxidase transgene expression reduces Cryphonectria parasitica-induced necrosis in a transgenic American chestnut (Castanea dentata) leaf bioassay. Transgenic Res. 22, 973-982;
- Harrison B. Goldspiel, Andrew E. Newhouse, William A. Powell, James P. Gibbs. (2019). Effects of transgenic American chestnut leaf litter on growth and survival of wood frog larvae. Restor Ecol. 27, 371-378;
- Andrew E. Newhouse, Allison D. Oakes, Hannah C. Pilkey, Hannah E. Roden, Thomas R. Horton, William A. Powell. (2018). Transgenic American Chestnuts Do Not Inhibit Germination of Native Seeds or Colonization of Mycorrhizal Fungi. Front. Plant Sci.. 9;
- D. B. Wake, V. T. Vredenburg. (2008). Are we in the midst of the sixth mass extinction? A view from the world of amphibians. Proceedings of the National Academy of Sciences. 105, 11466-11473;
- Выжить среди этой смертной любви;
- Greshko M. (2019). Amphibian 'apocalypse' caused by most destructive pathogen ever. National Geographic;
- A. J. Crawford, K. R. Lips, E. Bermingham. (2010). Epidemic disease decimates amphibian abundance, species diversity, and evolutionary history in the highlands of central Panama. Proceedings of the National Academy of Sciences. 107, 13777-13782;
- Erik Stokstad. (2017). A deadly salamander disease just got a lot scarier. Science;
- Антимикробные пептиды — возможная альтернатива традиционным антибиотикам;
- Maureen Banach, Eva-Stina Edholm, Jacques Robert. (2017). Exploring the functions of nonclassical MHC class Ib genes in Xenopus laevis by the CRISPR/Cas9 system. Developmental Biology. 426, 261-269;
- Это страшное слово «дефаунизация»;
- Как предсказать будущее кораллового рифа?;
- Madeleine J. H. van Oppen, James K. Oliver, Hollie M. Putnam, Ruth D. Gates. (2015). Building coral reef resilience through assisted evolution. Proc Natl Acad Sci USA. 112, 2307-2313;
- Rachel A. Levin, Christian R. Voolstra, Shobhit Agrawal, Peter D. Steinberg, David J. Suggett, Madeleine J. H. van Oppen. (2017). Engineering Strategies to Decode and Enhance the Genomes of Coral Symbionts. Front. Microbiol.. 8;
- Phillip A. Cleves, Marie E. Strader, Line K. Bay, John R. Pringle, Mikhail V. Matz. (2018). CRISPR/Cas9-mediated genome editing in a reef-building coral. Proc Natl Acad Sci USA. 115, 5235-5240;
- Биотехнология. Генная инженерия;
- Чудесное воскрешение;
- Клонирование. Просто о сложном;
- M. Hajian, S. M. Hosseini, M. Forouzanfar, P. Abedi, S. Ostadhosseini, et. al.. (2011). “Conservation cloning” of vulnerable Esfahan mouflon (Ovis orientalis isphahanica): in vitro and in vivo studies. Eur J Wildl Res. 57, 959-969;
- Thomas B. Hildebrandt, Robert Hermes, Silvia Colleoni, Sebastian Diecke, Susanne Holtze, et. al.. (2018). Embryos and embryonic stem cells from the white rhinoceros. Nat Commun. 9;
- Alison Cloutier, Timothy B. Sackton, Phil Grayson, Scott V. Edwards, Allan J. Baker First nuclear genome assembly of an extinct moa species, the little bush moa (Anomalopteryx didiformis) — Cold Spring Harbor Laboratory;
- 12 методов в картинках: секвенирование нуклеиновых кислот;
- Pyle R.L. and Pyle P. The birds of the Hawaiian islands. B.P. Bishop Museum, Honolulu, HI, 2017;
- Robert C. Fleischer, Helen F. James, Storrs L. Olson. (2008). Convergent Evolution of Hawaiian and Australo-Pacific Honeyeaters from Distant Songbird Ancestors. Current Biology. 18, 1927-1931;
- S. Zabalou, M. Riegler, M. Theodorakopoulou, C. Stauffer, C. Savakis, K. Bourtzis. (2004). Wolbachia-induced cytoplasmic incompatibility as a means for insect pest population control. Proceedings of the National Academy of Sciences. 101, 15042-15045;
- Célestine M. Atyame, Pierrick Labbé, Cyrille Lebon, Mylène Weill, Riccardo Moretti, et. al.. (2016). Comparison of Irradiation and Wolbachia Based Approaches for Sterile-Male Strategies Targeting Aedes albopictus. PLoS ONE. 11, e0146834;
- James W. Mains, Corey L. Brelsfoard, Robert I. Rose, Stephen L. Dobson. (2016). Female Adult Aedes albopictus Suppression by Wolbachia-Infected Male Mosquitoes. Sci Rep. 6;
- Мутагенная цепная реакция: редактирование геномов на грани фантастики;
- Austin Burt, Mamadou Coulibaly, Andrea Crisanti, Abdoulaye Diabate, Jonathan K. Kayondo. (2018). Gene drive to reduce malaria transmission in sub-Saharan Africa. Journal of Responsible Innovation. 5, S66-S80;
- Hannah A. Grunwald, Valentino M. Gantz, Gunnar Poplawski, Xiang-Ru S. Xu, Ethan Bier, Kimberly L. Cooper. (2019). Super-Mendelian inheritance mediated by CRISPR–Cas9 in the female mouse germline. Nature. 566, 105-109;
- Philip T. Leftwich, Matthew P. Edgington, Tim Harvey-Samuel, Leonela Z. Carabajal Paladino, Victoria C. Norman, Luke Alphey. (2018). Recent advances in threshold-dependent gene drives for mosquitoes. Biochemical Society Transactions. 46, 1203-1212;
- Вирус Зика — глобальная угроза?;
- Мир до и после изобретения вакцин;
- Великий рекомбинатор;
- Бактерии-нефтедеструкторы для биоремедиации супесчаных почв Воронежской области;
- МикроРНК впервые обнаружены в одноклеточном организме;
- LymeExpress — студенты в борьбе с клещевыми инфекциями;
- Нанопоровое секвенирование: на пороге третьей геномной революции;
- Sierra M. Love Stowell, Cheryl A. Pinzone, Andrew P. Martin. (2017). Overcoming barriers to active interventions for genetic diversity. Biodivers Conserv. 26, 1753-1765;
- Katherine Ralls, Jonathan D. Ballou, Michele R. Dudash, Mark D. B. Eldridge, Charles B. Fenster, et. al.. (2018). Call for a Paradigm Shift in the Genetic Management of Fragmented Populations. CONSERVATION LETTERS. 11, e12412;
- Michael A. Thomas, Gary W. Roemer, C. Josh Donlan, Brett G. Dickson, Marjorie Matocq, Jason Malaney. (2013). Ecology: Gene tweaking for conservation. Nature. 501, 485-486;
- Michael D. Samuel, Wei Liao, Carter T. Atkinson, Dennis A. LaPointe. (2020). Facilitated adaptation for conservation – Can gene editing save Hawaii's endangered birds from climate driven avian malaria?. Biological Conservation. 241, 108390;
- Warren Cornwall. (2019). Researchers embrace a radical idea: engineering coral to cope with climate change. Science;
- Matthew J. Gray, James P. Lewis, Priya Nanjappa, Blake Klocke, Frank Pasmans, et. al.. (2015). Batrachochytrium salamandrivorans: The North American Response and a Call for Action. PLoS Pathog. 11, e1005251;
- Просто о сложном: CRISPR/Cas.