LymeExpress — студенты в борьбе с клещевыми инфекциями
15 октября 2019
LymeExpress — студенты в борьбе с клещевыми инфекциями
- 893
- 0
- 4
CRISPR/Cas ловит возбудителей клещевых инфекций
иллюстрация Анны Вахрушевой
-
Авторы
-
Редакторы
Темы
Статья на конкурс «био/мол/текст»: Наверняка многих из вас когда-нибудь кусали клещи. Однако далеко не все знают, что на первый взгляд такое незначительное событие может привести к серьезным проблемам на всю оставшуюся жизнь. Вдохновленная идеей предотвращения этой напасти, группа московских студентов представит свой проект на престижном международном конкурсе по генетическим технологиям iGEM 31 октября — 4 ноября 2019 года в Бостоне. Эта статья расскажет вам о конкурсе iGEM, клещевых инфекциях, основных современных способах борьбы с ними, а также причем здесь вообще нашумевший CRISPR/Cas. Особое внимание уделено разрабатываемому детектору боррелиоза на основе системы CRISPR/Cas — LymeExpress.
Конкурс «био/мол/текст»-2019
Эта работа опубликована в номинации «Своя работа» конкурса «био/мол/текст»-2019.

Генеральный спонсор конкурса и партнер номинации «Сколтех» — Центр наук о жизни Сколтеха.

Партнер номинации — Российский научный фонд.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий выступила компания BioVitrum.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Про конкурс
Вот уже более 16 лет студенты и школьники со всего мира съезжаются на конференцию в Бостоне в конце октября. Это не обычный съезд заинтересованных в науке молодых ученых, а настоящий нон-стоп, включающий в себя и обмен идеями и опытом, и интересные презентации, и доклады о результатах проделанной работы, и стендовую сессию, и даже тестирование новых девайсов! Конференция в Бостоне — это венчающая торт вишенка, последний этап ежегодного конкурса по генетическим технологиям iGEM.
Конкурс предполагает выполнение проекта — воплощения идеи — на протяжении десяти месяцев и удовлетворение определенным критериям. Интересно, что у каждой команды есть шанс получить медаль — важно лишь справиться с поставленными участникам задачами. Особое место занимает работа с общественностью (human practices), также важным критерием хорошего проекта является создание и добавление в библиотеку конкурса стандартных биологических элементов (biobricks). Эти «биологические кирпичики» представляют собой плазмиды, несущие разнообразные генетические конструкции. Все вместе они составляют библиотеку, которая пополняется каждый год, пересматривается ответственными специалистами и рассылается участникам конкурса. iGEM — это креативное научное пространство для решения насущных проблем с помощью современных технологий, построения глобального сообщества с общими целями, установления универсальных стандартов генетических технологий. В целом можно сказать, что этот конкурс продвигает в жизнь идеи биохакинга — только не того, который связан с ЗОЖ и долголетием, а того, который иначе можно назвать «молекулярная биология своими руками» [1].
Команды разделены тематически и соревнуются в следующих треках: диагностика, энергетика, терапевтическое направление, пищевая биотехнология и др. Общее количество участников — свыше шести тысяч. В этом году в конкурсе зарегистрировано 345 команд, среди которых 107 команд из Китая, 59 из США, 82 из Европы и лишь одна из России. К сожалению, iGEM пока недостаточно популярен у нас на Родине.
Для успешного участия в конкурсе команда должна обладать рядом компетенций — тут нужны и «мокрые» биологи, и биоинформатики, и физические химики, и специалисты в области моделирования, и менеджеры, которые смогут грамотно организовать и скоординировать работу по разным направлениям. Необходимы и дизайнеры, и ответственные за SMM и PR, и те, кто будет искать финансирование и ходить на деловые встречи.
В этом году на базе биологического факультета МГУ сформировалась команда студентов под руководством ведущего научного сотрудника кафедры биоинженерии А.К. Шайтана для участия в конкурсе iGEM.
В состав команды от России входят студенты и аспиранты биологического, химического и экономического факультетов МГУ, факультета биологической и медицинской физики МФТИ и даже школьник из СУНЦ МГУ. Руководят командой к.ф.-м.н. А.К. Шайтан (в.н.с. каф. биоинженерии биологического факультета МГУ) и к.б.н. Д.С. Карпов (Институт молекулярной биологии им. В.А. Энгельгардта); инструкторы — к.б.н. Г.С. Глухов, к.ф.-м.н. Г.А. Армеев, к.б.н. Е.В. Мариловцева (каф. биоинженерии биологического факультета МГУ). Консультантами команды являются декан биологического факультета МГУ, академик РАН М.П. Кирпичников, зав. кафедрой эпидемиологии и доказательной медицины Сеченовского университета, академик РАН Н.И. Брико, д.б.н. профессор В.М. Студитский, д.б.н. профессор О.С. Соколова и др.
Выбор темы оказался совсем не прост — мы рассматривали множество вариантов: системы для переработки лабораторного пластика, системы для детекции трихомониаза и лактофагов, речь заходила даже о средствах против старения, но остановиться в конце концов было решено на диагностическом биосенсоре возбудителей болезни Лайма в клещах (рис. 1). Эту болезнь вызывают бактерии Borrelia spp., передающиеся иксодовыми клещами. Ежегодно в мире регистрируют более 500 тыс. случаев заражения болезнью Лайма, что делает ее самой распространенной болезнью, передаваемой клещами и кровососками в Северном полушарии. В структуре заболеваемости населения России на протяжении последнего десятилетия ежегодно более 50% занимают инфекции, передающиеся клещами, а каждый ребенок знает, насколько опасен клещевой вирусный энцефалит. Однако, несмотря на высокую опасность большинства клещевых инфекций, в свободном доступе имеется только вакцина от клещевого энцефалита. Отсутствие на рынке вакцин от других заболеваний можно объяснить как физической невозможностью их создания на данный момент, так и банальным отсутствием коммерческой выгоды от их производства и распространения. И хотя болезнь Лайма обычно не летальна, осложнения, характерные для хронической формы течения болезни, могут существенно сократить продолжительность жизни и снизить ее качество.
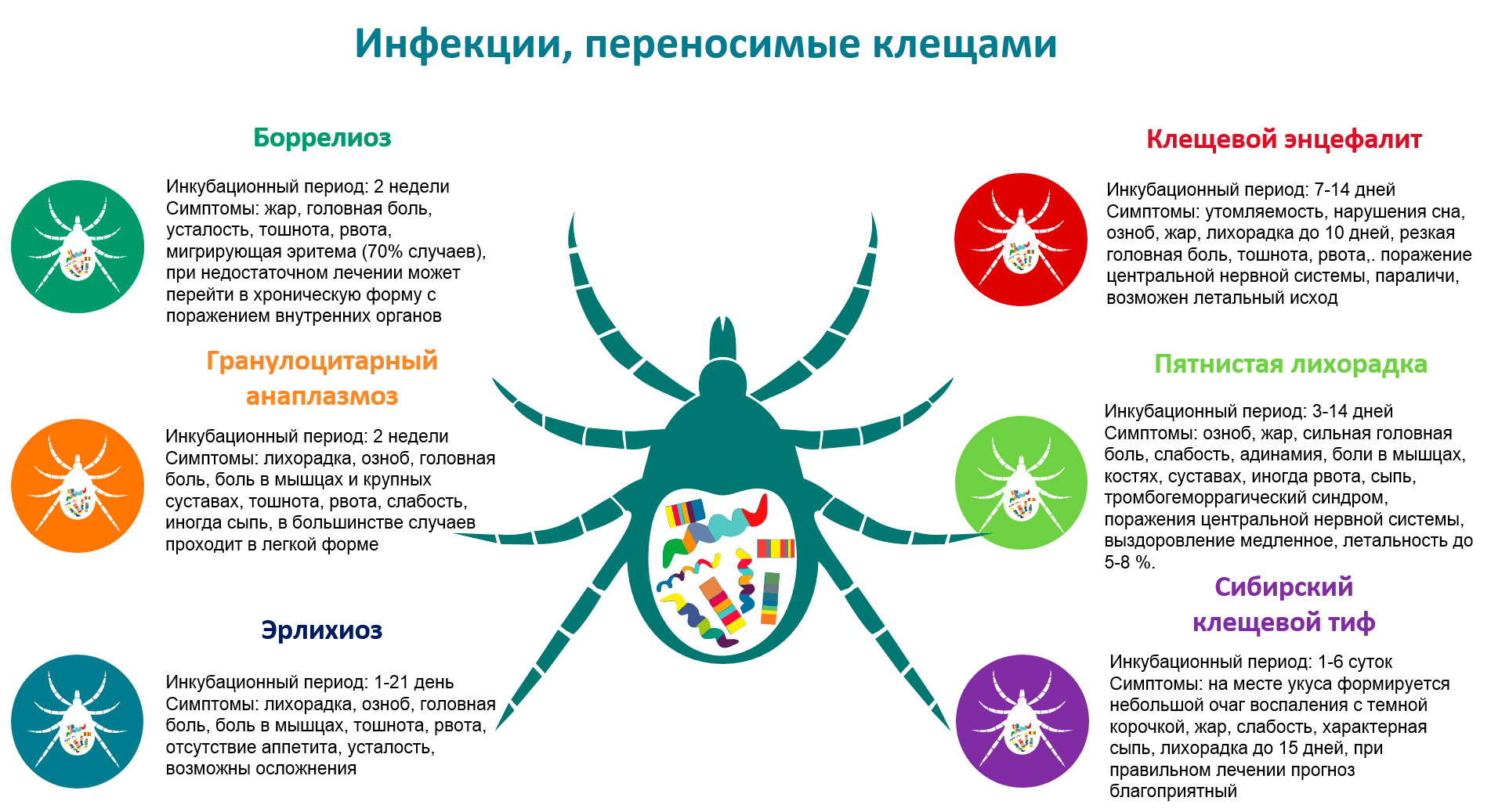
Рисунок 1. Разнообразие клещевых инфекций
При этом первый и самый заметный симптом — красная мигрирующая эритема — проявляется лишь в 70% случаев, что оставляет 30% укушенных с ложным чувством безопасности. Стандартные способы диагностики — ПЦР-анализ клеща и серологические методы — обладают рядом недостатков. Для проведения ПЦР требуется сложное, чаще всего стационарное оборудование. Серологические же анализы характеризуются крайне высокой долей ложноотрицательных результатов, по крайней мере, на ранней стадии развития инфекции вследствие особенностей ее протекания: первые несколько недель боррелии сконцентрированы под кожей и практически не обнаруживаются в крови. Наша задача — разработать простой и компактный переносной сенсор для быстрой детекции возбудителей болезни Лайма в клещах, который можно использовать не только для экспресс-диагностики в медицинских учреждениях, но даже самостоятельно в полевых условиях. Особенно полезной данная разработка может оказаться для жителей отдаленных регионов, в которых бывают сложности с доступностью диагностического оборудования. В перспективе LymeExpress сможет составить конкуренцию существующим методам как по точности диагностики, так и по стоимости. И мы каждый день приближаемся к поставленной цели!
Принцип работы биосенсора кратко можно описать следующим образом: после гомогенизации клещ обрабатывается лизирующим раствором, разрушающим бактериальные клетки, высвобождая их ДНК. Полученный биоматериал добавляется в чип, в котором уже находится молекулярная система детекции. В результате химической реакции, обусловленной наличием ДНК боррелий (о ней будет подробно рассказано ниже), раствор меняет цвет, что и детектирует фотометр, все детали и корпус которого напечатаны на 3D принтере.
Про биосенсоры и CRISPR/Cas
Результатом более миллиона лет коэволюции прокариот и вредоносных фагов стало разнообразие защитных механизмов от проникновения вирусов внутрь бактериальных клеток и встраивания чужеродной генетической информации в геном. На сегодня известно несколько уровней защиты: начиная от самых простых, таких как подавление адсорбции бактериофагов к поверхности клеток, и заканчивая хитроумными молекулярными системами [2]. Одним из последних открытий в области бактериальной защиты от мобильных генетических элементов стало обнаружение в геномах бактерий коротких палиндромных повторов, регулярно расположенных группами (clustered regularly interspaced short palindromic repeats, CRISPR), и CRISPR-ассоциированных белков (CRISPR-associated protein, Cas-белки). Эта система является аналогом адаптивного иммунитета эукариот: она способна запоминать вредителя и при повторной встрече быстро активировать защитный механизм, уничтожающий патогена [3].
Устройство системы CRISPR/Cas
Локусы CRISPR представляют собой чередование уникальных участков (спейсеров) и повторяющихся последовательностей (повторов). Роль повторов структурная и состоит в обеспечении взаимодействия двух частей системы — продуктов локусов CRISPR и Cas-белков [4]. Спейсеры — участки ДНК-фагов или других мобильных генетических элементов; именно спейсеры играют роль в узнавании Cas-белком мишени. Продукты транскрипции CRISPR-локуса носят название pre-crRNA. Процессируясь, pre-crRNA созревает и превращается в конечный продукт — CRISPR RNA, или crRNA (гидовая РНК, или РНК-гид). Именно эта РНК формирует вместе с Cas-белком каталитически активный комплекс, способный разрезать нуклеиновые кислоты в тех местах, на которые «указывает» crRNA [5].
Нужно отметить, что бактериальные системы защиты эволюционируют достаточно быстро, чтобы быть способными отвечать на столь же стремительно развивающиеся механизмы атаки (узнать о разнообразии систем CRISPR/Cas можно в статье Елизаветы Мининой «Разнообразие и эволюция систем CRISPR/Cas» [6]). Сегодня активно ведутся исследования эволюции системы CRISPR. Одним из ведущих ученых в этой области является Константин Северинов — доктор биологических наук, директор Центра наук о жизни Сколтеха, заведующий несколькими лабораториями в США и России. Исследованиям в Сколтехе под руководством Северинова посвящена недавняя статья на «Биомолекуле» — «Антибиотики, структура генома и CRISPR: чем занимается в Сколтехе лаборатория Северинова» [7].
Классификация CRISPR-систем основана на различиях в Cas-белках. На сегодня выделяют шесть (I–VI) типов систем, каждая из которых использует собственный тип Cas-белка. Системы I и III типов используют мультибелковые эффекторные комплексы, а в состав системы II типа входит состоящая из единственной субъединицы ДНК-эндонуклеаза Cas9 [8]. Cas9 состоит из двух доменов (RuvC и HNH), каждый из которых при активации разрезает цепь ДНК. Этот процесс опосредует дополнительная малая некодирующая РНК, которая называется транс-активирующей crRNA (trans-activating crRNA, tracrRNA). tracrRNA комплементарно связывается с crRNA, в результате чего формируется уникальная гибридная структура из двух молекул РНК, которая указывает Cas9 вносить разрыв в участок ДНК, содержащий комплементарную crRNA последовательность из 20 нуклеотидов. Но не любая комплементарная цепь будет разрезана: еще одним обязательным условием является присутствие короткой последовательности (protospacer adjacent motif, PAM) рядом с 20 таргетными нуклеотидами. Таким образом, при выполнении двух обязательных условий (наличие PAM и комплементарность 20 нуклеотидов цепи ДНК crRNA) эндонуклеаза Cas9 вносит двухцепочечный разрыв в молекулу ДНК.
Как работает CRISPR/Cas?
Работа адаптивного иммунитета бактерий состоит из трех этапов: адаптация, экспрессия и интерференция (рис. 2). Подробный механизм функционирования этой системы уже не раз становился темой статей на «Биомолекуле», поэтому здесь мы приведем лишь краткий обзор основных этапов работы на примере системы CRISPR/Cas II типа (если вам интересно рассмотреть процесс в деталях и узнать об особенностях функционирования системы, обратитесь к следующим обзорам «Биомолекулы»: «Просто о сложном: CRISPR/Cas» [9], «Как CRISPR/Cas работает не по специальности» [10] и «Как избежать случайных связей: инструкция от Cas12b» [11]).
На первом этапе происходит встраивание нового спейсера в CRISPR-локус. Для системы II типа наличие PAM критически важно: только последовательность, находящаяся рядом с PAM (называемая протоспейсером), может быть встроена специальными белками Cas1 и Cas2 в CRISPR-локус. На втором этапе происходит транскрипция с CRISPR-локуса, после чего полученный длинный первичный транскрипт (pre-crRNA) процессируется (созревает). В системах II типа с pre-crRNA связывается tracrRNA, затем в присутствии белка Cas9 РНКаза III разрезает цепи на участке внутри повторов. В итоге из одного первичного транскрипта получается несколько crRNA. В состав созревшей crRNA входит один спейсер и один повтор; при этом повтор разделен на две части: первые восемь нуклеотидов находятся на 5′-конце, а оставшийся участок на 3′. На последнем этапе происходит интерференция: цепь, внедряющаяся в эффекторный комплекс, разрезается [9].
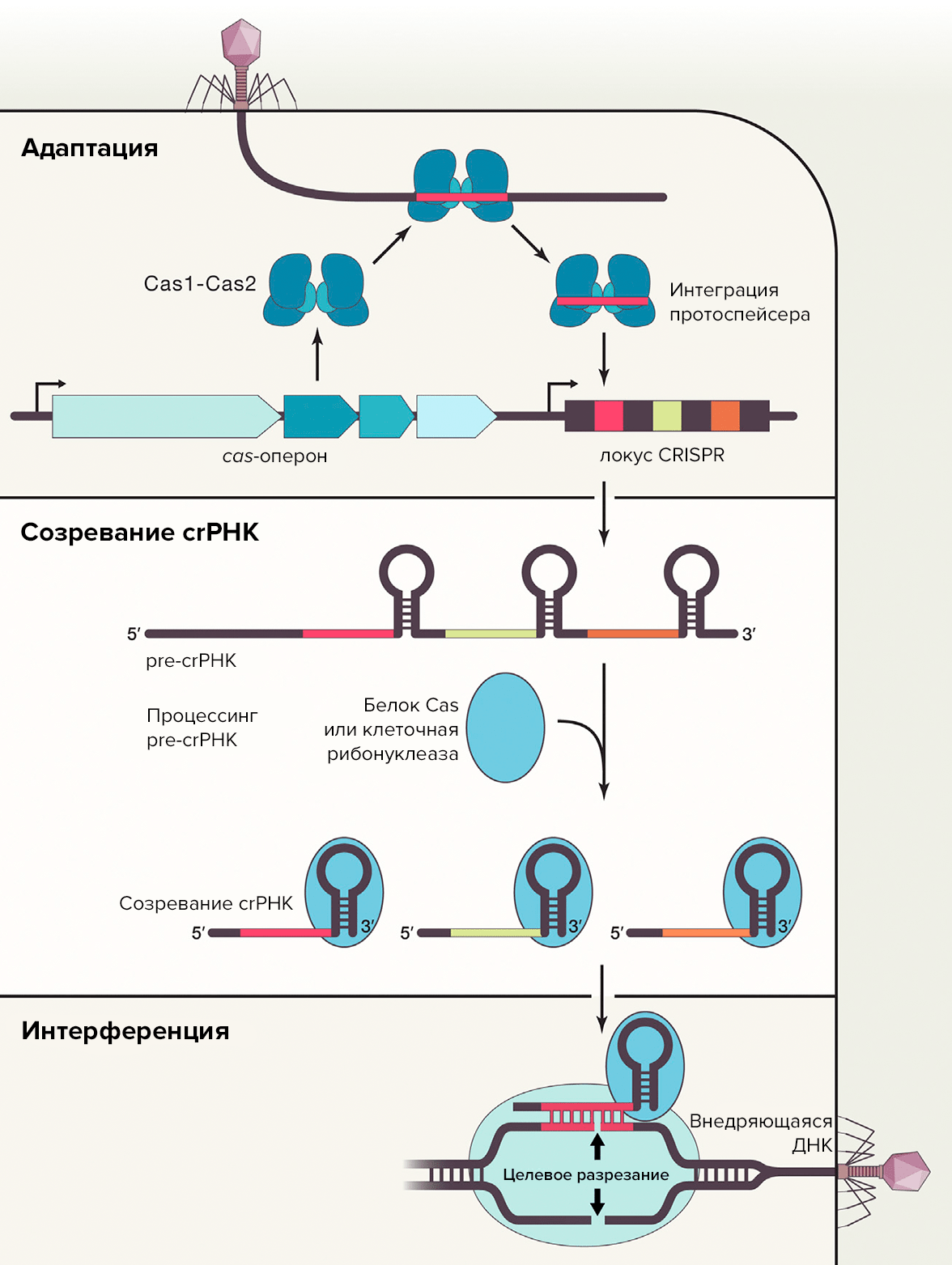
Рисунок 2. Схема работы системы CRISPR/Cas. Три стадии: адаптация, созревание (процессинг) и интерференция.
Применение технологии CRISPR/Cas
Исследователи в лабораториях с большим энтузиазмом пытаются адаптировать системы CRISPR/Cas для редактирования генома [12], [13]. Их можно использовать как для исправления мутаций в молекуле, так и для встраивания новых участков [5]. Этот мощный инструмент внесения правок в геном может стать частью терапии против ВИЧ [14], [15] и миодистрофии Дюшенна [16]. Генетическое редактирование с помощью CRISPR/Cas уже было успешно применено в терапии таких генетических заболеваний, как лейкемия и гемофилия [17], [18], и в биотехнологии: удалось создать сорт картофеля, устойчивого к вирусам и холодам [19].
В результате работы CRISPR/Cas-системы II типа образуется сайт-специфичный двухцепочечный разрыв (ДР) с «тупыми» концами. Этот разрыв может быть устранен при реализации одного из двух путей репарации: негомологичного соединения концов (nonhomologous end joining) или репарации ДР, основанной на гомологичной рекомбинации (homology directed repair). Результатом первого пути становятся короткие вставки и/или делеции, также называемые инделами (что все же лучше, чем нарушение целостности цепи). Второй путь, более благоприятный для клетки, позволяет полностью восстановить исходную цепь ДНК, не изменяя последовательность цепи. Для осуществления этого способа необходимо наличие «шаблона» (фрагмента ДНК), по которому будет восстанавливаться нарушенная цепь. Этот шаблон на первом этапе репарации выступает в качестве «заплатки», поэтому обязательным критерием для такого участка ДНК является наличие последовательностей, идентичных (гомологичных) последовательностям, находящимся непосредственно рядом с разрывом. С помощью специального комплекса ферментов эта цепь встает на место повреждения, и целостность ДНК восстанавливается. А дальше самое интересное! Источником такой «заплатки» может служить цепь ДНК гомологичной хромосомы или специально спроектированная молекула. Такая молекула, помимо гомологичных участков, будет содержать вставку, какую пожелает экспериментатор.
Одним из самых нашумевших исследований по применению CRISPR/Cas стала работа китайского исследователя Хэ Цзянькуя, который вопреки закону отважился провести эксперимент с человеческими эмбрионами, за что поплатился своей карьерой и свободой (он был арестован и лишен права продолжать свою научную деятельность). Его замысел состоял в придании человеку на стадии эмбриона устойчивости к ВИЧ (вирусу иммунодефицита человека) за счет внесения небольшой делеции в ген CCR5. Продуктом этого гена является рецептор на поверхности лейкоцитов, который позволяет проникать вирусам иммунодефицита внутрь клеток иммунной системы и поражать их. Нарушение структуры этого рецептора позволяет сделать организм устойчивым к ВИЧ. Именно этот эксперимент и провел Хэ Цзянькуй, в результате чего на свет появились две близняшки (к счастью, абсолютно здоровые) [20].
Таким образом, эксперимент китайского исследователя не привел к фатальным последствиям, и история для первых в мире людей, «спроектированных» исследователями, закончилась хорошо. Так почему же до сих пор технологии CRISPR/Cas не нашли широкого применения в редактировании человеческих эмбрионов? Несмотря на большое количество исследований, посвященных CRISPR/Cas, и успешные результаты многочисленных экспериментов с клеточными культурами и модельными животными, есть и серьезные проблемы: высокая вероятность off-target-эффекта, преобладание нежелательного пути репарации, иммунный ответ на чужеродный Cas-белок, трудности с проектированием мишени для эффекторного белка, а также проблемы с доставкой системы к целевым клеткам. По этой совокупности причин применять эту технологию для редактирования геномов человека пока что нельзя [21].
Не только редактирование генома: для чего еще используют CRISPR/Cas?
Пока мечты о редактировании человеческого генома с помощью CRISPR/Cas остаются только мечтами, исследователи не перестают находить альтернативные применения этой технологии. Например, сегодня известно несколько способов использования этой системы в качестве биосенсора для детекции нуклеиновых кислот (успешно была обнаружена ДНК опасных вирусов Зика [35] и Денге с невероятно низкой концентрацией) [22].
Биосенсоры: базовые концепции
Биосенсоры обычно состоят из трех частей: биорецептора, передатчика и преобразователя сигнала (рис. 3). Когда аналит взаимодействует с рецептором, возникает сигнал [23]. Главное преимущество биосенсоров по сравнению с другими тест-системами — их невероятная чувствительность: существует прототип биосенсора для регистрации микроРНК в невероятно низких концентрациях — 7,5 аттомоль (7,5×10-18 моль) [23]. Кроме того, биосенсоры дешевы, пригодны к повторному использованию и компактны (что позволяет проводить тестирование вне лаборатории) [23].
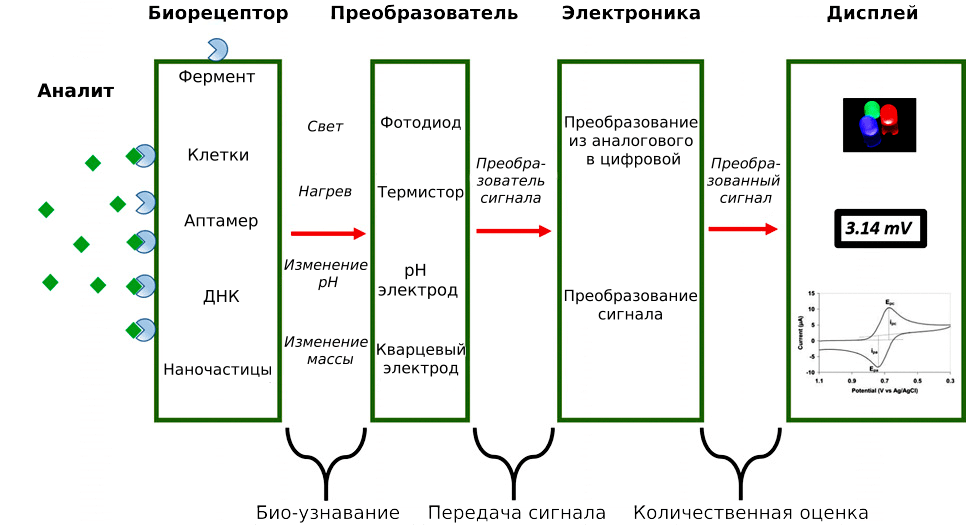
Рисунок 3. Общая схема работы биосенсора
Биосенсоры могут быть использованы для решения широкого круга задач: начиная от экологического мониторинга и тестирования безопасности еды, заканчивая поиском новых лекарств и детекцией патогенов (рис. 4). Именно последняя проблема все чаще решается при помощи биосенсоров: уже созданы электрохимический иммуносенсор для детекции сальмонеллы в пищевых продуктах [24], сенсор для детекции вирусов в воде [25] и устройство для детекции грибковых инфекций растений [26].
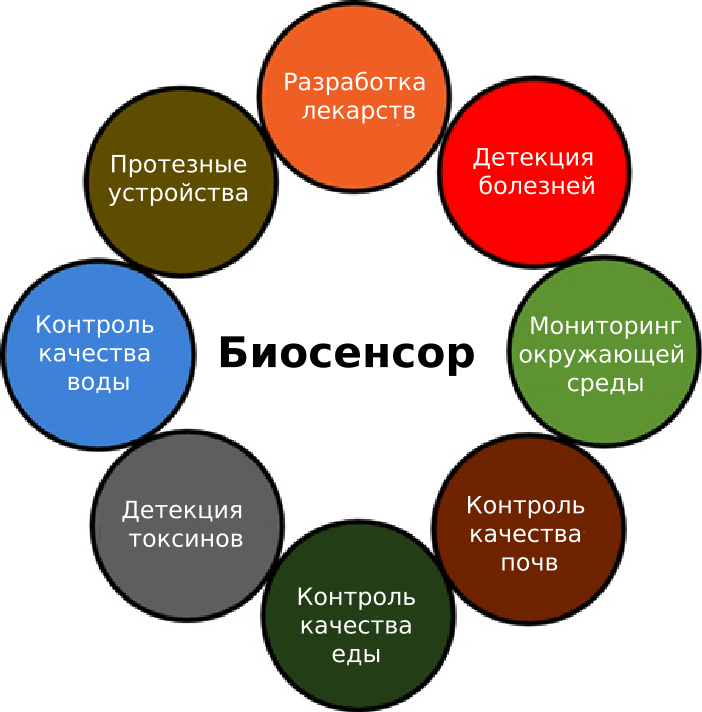
Рисунок 4. Области применения биосенсоров
Биосенсоры на основе CRISPR/Cas
Находить, но не резать? Да-да, система может быть полезна не только для создания идеального человека, но и для постановки точного диагноза. Далее рассмотрим методы детекции нуклеиновых кислот на основе CRISPR/Cas.
SHERLOCK
SHERLOCK (Specific High sensitivity Enzymatic Reporter unLOCKing) — метод, который полностью оправдывает свое имя и продолжает набирать все большую популярность. В основе метода лежит работа системы Cas13a, обнаруженной в бактериях рода Leptotrichia. Изюминки метода:
- способность распознавать РНК;
- коллатеральная РНКазная активность (может разрезать любую РНК в пробе, с которой встретится после связывания с мишенью).
Так, в пробу, предположительно содержащую РНК-мишень и обогащенную на этапе изотермической амплификации, добавляют сигнальную систему — другую РНК, связанную с флуорофором и подавляющим его свечение гасителем. При взаимодействии с мишенью Cas13a приобретает коллатеральную активность и начинает резать все подряд, а значит, разрезает и цепь РНК, связывающую флуоресцентную метку с гасителем. В результате освободившаяся метка дает сигнал, который можно достоверно интерпретировать (рис. 5) [27]. Детекция ДНК с помощью SHERLOCK также возможна — необходима лишь одна дополнительная стадия транскрипции, что принципиально не меняет схему эксперимента.
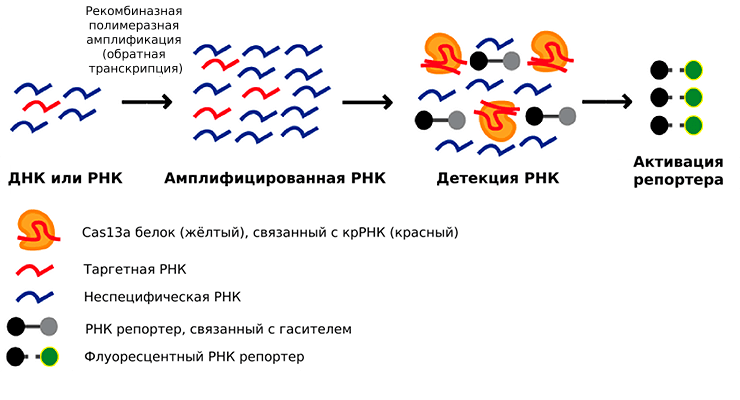
Рисунок 5. Схема метода SHERLOCK
А в прошлом году создатели метода представили SHERLOCK версии 2.0. Его уже применяют в виде тест-полосок на вирусы Зика и Денге, упоминавшиеся ранее, а также для обнаружения мутаций в образцах жидкой биопсии больных немелкоклеточным раком легких. По словам производителей, в ближайшее время тест-полоски планируют сделать доступными для широкого использования [28], [29].
DETECTR
Другим популярным методом детекции нуклеиновых кислот является DETECTR (DNA Endonuclease Targeted CRISPR Trans Reporter). Он работает по схожему принципу, однако тут используется белок Cas12a из бактерий рода Acidaminococcus. Система Cas12a способна к неспецифическому разрезанию одноцепочечной ДНК после взаимодействия с мишенью, поэтому в данном методе флуорофор и гаситель связаны одноцепочечной ДНК. Данная система, как и SHERLOCK, может применяться для детекции как ДНК, так и РНК (при добавлении стадии обратной транскрипции) [30].
Все вышеперечисленные методы детекции обладают поразительной гибкостью и чувствительностью, достигающей аттомолярных значений (10−18 моль) [31], что очень близко к чувствительности ПЦР (10−18 — 10−21 моль) [32]. С их помощью при относительно небольших изменениях в последовательности гидовой РНК (спейсер + гидовая РНК) можно производить детекцию практически любой последовательности нуклеиновых кислот определенной длины, что делает CRISPR/Cas одним из лучших инструментов для детекции и экспресс-тестов на данный момент.
Усовершенствование существующих подходов происходит постоянно. Стоит отметить, что заметная часть подобных разработок начинается в рамках международного конкурса iGEM.
TU Delft
Команда TU Delft занималась детекцией антибиотикорезистентных бактериальных патогенов коров для предоставления качественного лечения больным животным и борьбы с неправильным использованием антибиотиков. Главным отличием от SHERLOCK было использование альтернативной сигнальной системы, представленной смесью длинных отрицательно заряженных цепей РНК и положительно заряженных молекул спермина. Электростатические взаимодействия между ними приводили к формированию специфических комплексов (коацерватов) и помутнению раствора. После обнаружения рибонуклеопротеином (РНП) мишени Cas13a за счет приобретения коллатеральной РНКазной активности разрезает РНК в составе коацерватов, что приводит к их разрушению. Раствор становится прозрачным! Что и говорит о наличии целевой нуклеиновой кислоты в пробе. Cхематично проект изображен на рисунке 6.
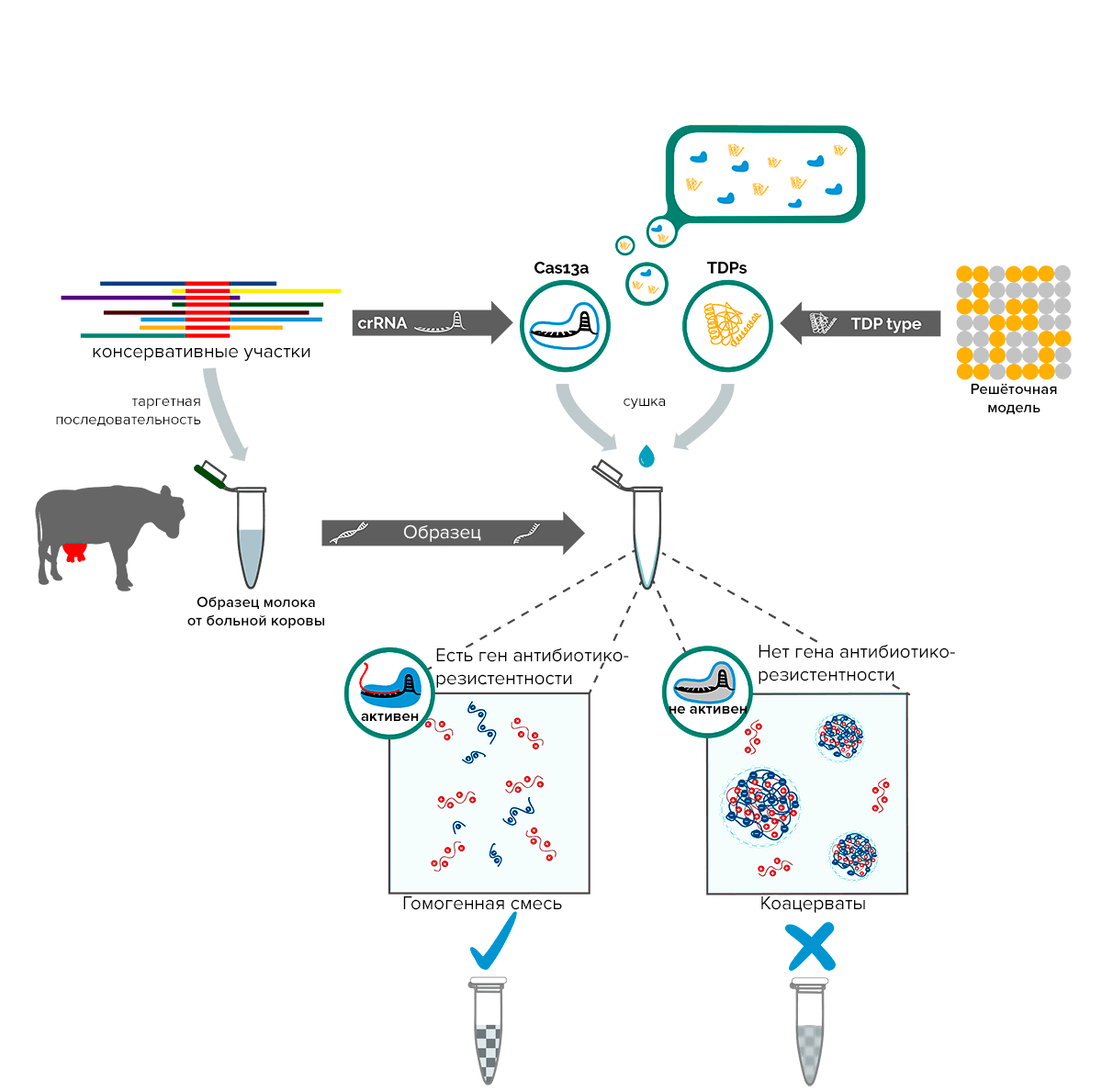
Рисунок 6. Схематичное описание проекта команды TU Delft 2017
Еще одним новшеством, привнесенным командой, был способ консервации РНП. Для сохранения активности белка при высушивании они предложили использовать особые белки тихоходок — Tardigrade-specific intrinsically Disordered Proteins (TDPs), которые предохраняли комплексы от пагубного влияния.
Peking 2015
Однако использование методов детекции нуклеиновых кислот на iGEM началось еще до анонсирования метода SHERLOCK. В 2015 году команда iGEM из Пекина представила принципиально новый механизм детекции возбудителя туберкулеза с помощью систем CRISPR/Cas. В отличие от появившегося спустя два года SHERLOCK’а, данный метод вообще не подразумевал разрезание молекул каких-либо нуклеиновых кислот. В его основе лежало использование неспособного к нуклеазной активности мутантного белка — dCas9 (dead Cas9). Подобный dead-вариант белка можно получить внесением в ген Cas9 мутаций по двум сайтам, что приводит к утрате ДНКазной активности, но не мешает связыванию с интересующим участком нуклеиновой кислоты. Помимо dead-мутации, к белку пришили одну из двух не функциональных по-отдельности субъединиц фермента люциферазы (сплит-фермента). Таким образом, два РНП, включающих в себя dCas9 с соответствующей субъединицей люциферазы, при обнаружении мишени связываются с ней в определенных местах. Это приводит к пространственному сближению двух субъединиц и их взаимодействию с восстановлением активности фермента. Схематичное изображение конструкции представлено на рисунке 7. После сборки люцифераза окисляет субстрат — люциферин, предварительно добавленный в пробу. В результате реакции испускается свет (биолюминесценция), что можно обнаружить при помощи специального оборудования — флуориметра.
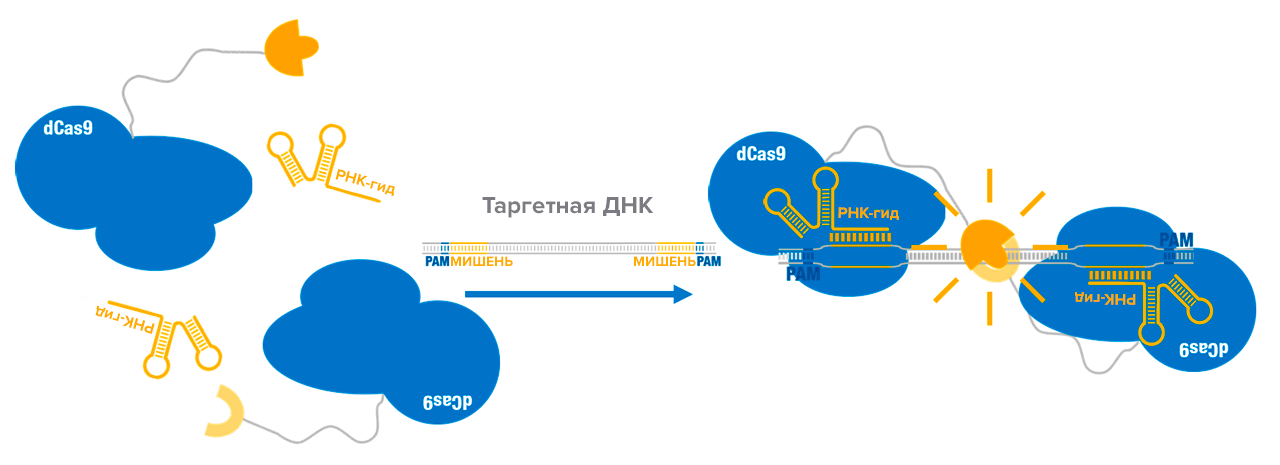
Рисунок 7. Схематичное изображение молекулярной системы проекта пекинской команды 2015
UiOslo_Norway 2018
Разработки пекинцев вдохновили другие команды: например, норвежцы UiOslo_Norway в 2018 году представили похожий проект под названием Canditect. Он посвящен обнаружению Candida albicans — возбудителя грибковых инфекций человека. Команда предприняла попытку усовершенствовать проект коллег из Пекина, изменив сплит-фермент, то есть источник сигнала. Они планировали детектировать изменение окраски субстрата в результате реакции гидролиза нитроцефина бета-лактамазой (рис. 8). Подход команды не требовал специального оборудования — изменение цвета с желтого на красный заметно человеческому глазу.
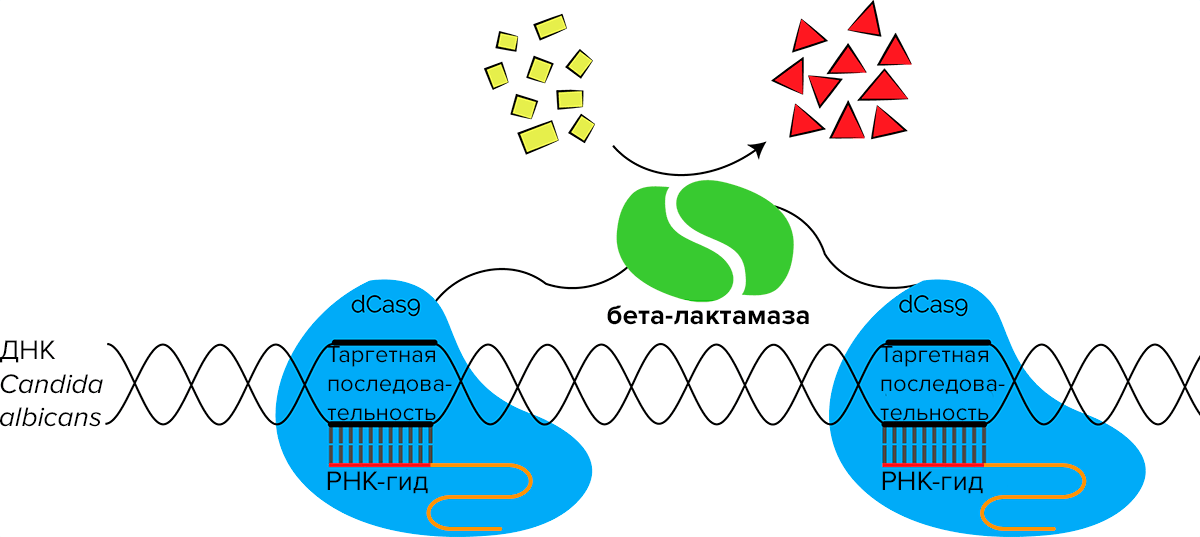
Рисунок 8. Схема молекулярной системы, предложенная командой UiOslo_Norway 2018
Несмотря на то, что команда удостоилась награды за лучший проект в области диагностики и была номинирована на приз за лучшую презентацию, довести работу хотя бы до стадии работающей экспериментальной системы in vitro им так и не удалось. Проблемы возникли с наработкой токсичных для клетки dCas-белков.
Наш проект — LymeExpress
Загоревшись идеей создать собственную тест-систему на основе CRISPR/Cas и изучив существующее многообразие способов, мы остановились вот на какой молекулярной системе.
В нашей работе используются два dCas9-белка, сшитых с частями сплит-варианта бета-лактамазы. Они узнают специфичные для боррелий последовательности ДНК, находящиеся на оптимальном расстоянии друг от друга — это приводит к объединению фрагментов бета-лактамазы. Собранный фермент гидролизует нитроцефин, сдвигая максимум его поглощения. В результате это изменение детектируется лучевым фотометром на светодиодах (рис. 9), который способен измерять интенсивность поглощения изучаемого раствора или интенсивность флуоресценции на заранее определенных длинах волн.
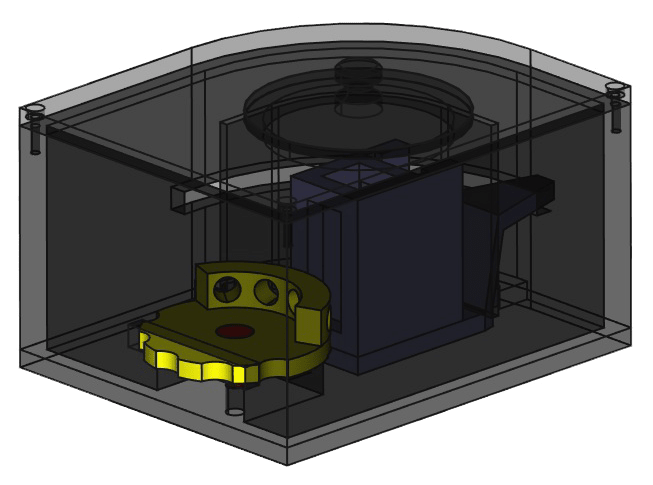
Рисунок 9. Модель фотометра
На первом этапе для реализации задуманного мы получили плазмиды, несущие конструкции dCas9-белков, слитых с доменами сплит-бета-лактамазы, и гены dCas9-белков из Streptococcus pyogenes и Staphylococcus aureus. Также мы подобрали оптимальный протокол для выделения геномной ДНК из грамотрицательных бактерий, представителей клещевого микробиома.
В ходе работы над LymeExpress мы решили опробовать разные эффекторные CRISPR/Cas-системы (из разных организмов) для достижения более высокой специфичности связывания РНП с мишенью. А для амплификации целевой ДНК мы будем использовать LAMP (loop-mediated isothermal amplification) [33]. Это значительно быстрее обычной ПЦР, не требует чередования высоких температур, проба становится устойчивее к загрязнению, а что самое главное, LAMP можно без проблем применять в полевых условиях. Стоит отметить, что LAMP нашла применение и в качестве самостоятельного метода детекции [34]. Казалось бы, зачем в таком случае вообще необходима детекция с помощью CRISPR/Cas-систем? Дело в том, что специфичность распознавания мишени Cas-белками значительно выше, чем у праймеров, используемых в ПЦР-методах. В таком случае вероятность того, что LymeExpress даст ложноположительный результат, крайне мала. Следствием комбинирования в LymeExpress чувствительности LAMP и специфичности систем CRISPR/Cas является значительное увеличение точности детекции по сравнению с точностью этих методов по-отдельности.
Особенно хочется отметить тот факт, что благодаря высокой гибкости детекторов на основе CRISPR/Cas-систем в будущем мы без особых проблем сможем адаптировать LymeExpress и для других клещевых инфекций.
Заключение
Над проблемой универсального метода экспресс-диагностики работают ученые по всему миру. Многие годы исследований потребуются для того, чтобы создать идеально работающие детекторы. Однако системы CRISPR/Cas существенно приблизили человечество к решению этой проблемы. Количество известных систем CRISPR/Cas постоянно растет, методики совершенствуются, и это лишь вопрос времени, когда научное сообщество добьется идеала. Существование iGEM и подобных мероприятий значительно ускоряет прогресс и делает поиск решений еще увлекательнее. Продвигая идею свободных научных знаний и общемировой кооперации, они строят каркас международного научного сообщества, совместно трудящегося над многообразием задач.
Работа выполняется при поддержке: биологического факультета МГУ, МФТИ, компаний Helicon, «Нанолек», «Евроген», QIAGEN, SkyGen, IDT, NEB, Chroma Technology, Twist Bioscience.
Литература
- Биохакеры: молекулярная биология в стиле «сделай сам»;
- Frank Hille, Hagen Richter, Shi Pey Wong, Majda Bratovič, Sarah Ressel, Emmanuelle Charpentier. (2018). The Biology of CRISPR-Cas: Backward and Forward. Cell. 172, 1239-1259;
- CRISPR-системы: иммунизация прокариот;
- Erik J. Sontheimer, Rodolphe Barrangou. (2015). The Bacterial Origins of the CRISPR Genome-Editing Revolution. Human Gene Therapy. 26, 413-424;
- Fuguo Jiang, Jennifer A. Doudna. (2017). CRISPR–Cas9 Structures and Mechanisms. Annu. Rev. Biophys.. 46, 505-529;
- Разнообразие и эволюция систем CRISPR/Cas;
- Антибиотики, структура генома и CRISPR: чем занимается в Сколтехе лаборатория Северинова;
- Kira S. Makarova, Daniel H. Haft, Rodolphe Barrangou, Stan J. J. Brouns, Emmanuelle Charpentier, et. al.. (2011). Evolution and classification of the CRISPR–Cas systems. Nat Rev Microbiol. 9, 467-477;
- Просто о сложном: CRISPR/Cas;
- Как CRISPR/Cas работает не по специальности;
- Как избежать случайных связей: инструкция от Cas12b;
- А не замахнуться ли нам на... изменение генома?;
- Мутагенная цепная реакция: редактирование геномов на грани фантастики;
- Битва века: CRISPR vs ВИЧ;
- CRISPR/Cas9 как помощник в борьбе с ВИЧ;
- Вылечить миодистрофию Дюшенна: конкуренция групп, единство методик;
- Adrián Montaño, Maribel Forero-Castro, Jesús-María Hernández-Rivas, Ignacio García-Tuñón, Rocío Benito. (2018). Targeted genome editing in acute lymphoblastic leukemia: a review. BMC Biotechnol. 18;
- Tsukasa Ohmori, Yasumitsu Nagao, Hiroaki Mizukami, Asuka Sakata, Shin-ichi Muramatsu, et. al.. (2017). CRISPR/Cas9-mediated genome editing via postnatal administration of AAV vector cures haemophilia B mice. Sci Rep. 7;
- Amir Hameed, Muhammad Aamer Mehmood, Muhammad Shahid, Shabih Fatma, Aysha Khan, Sumbal Ali. (2019). Prospects for potato genome editing to engineer resistance against viruses and cold-induced sweetening. GM Crops & Food. 1-21;
- Изменение генома и... мировой науки?;
- Majid Mojarrad, Saeed Bozorg Qomi, Amir Asghari. (2019). An Overview Of The Crispr-Based Genomic- And Epigenome-Editing System: Function, Applications, And Challenges. Adv Biomed Res. 8, 49;
- SHERLOCK — молекулярный сыщик спешит на помощь!;
- N. Bhalla, P. Jolly, N. Formisano, P. Estrela. (2016). Introduction to biosensors. Essays In Biochemistry. 60, 1-8;
- Airis Maria Araújo Melo, Dalila L. Alexandre, Roselayne F. Furtado, Maria F. Borges, Evânia Altina T. Figueiredo, et. al.. (2016). Electrochemical immunosensors for Salmonella detection in food. Appl Microbiol Biotechnol. 100, 5301-5312;
- Zeynep Altintas, Micah Gittens, Jack Pocock, Ibtisam E. Tothill. (2015). Biosensors for waterborne viruses: Detection and removal. Biochimie. 115, 144-154;
- Monalisa Ray, Asit Ray, Swagatika Dash, Abtar Mishra, K. Gopinath Achary, et. al.. (2017). Fungal disease detection in plants: Traditional assays, novel diagnostic techniques and biosensors. Biosensors and Bioelectronics. 87, 708-723;
- Jonathan S. Gootenberg, Omar O. Abudayyeh, Jeong Wook Lee, Patrick Essletzbichler, Aaron J. Dy, et. al.. (2017). Nucleic acid detection with CRISPR-Cas13a/C2c2. Science. 356, 438-442;
- Jonathan S. Gootenberg, Omar O. Abudayyeh, Max J. Kellner, Julia Joung, James J. Collins, Feng Zhang. (2018). Multiplexed and portable nucleic acid detection platform with Cas13, Cas12a, and Csm6. Science. 360, 439-444;
- Prabhune M. (2019). SHERLOCK CRISPR Kit: The Next Generation of Diagnostics. Synthego;
- Janice S. Chen, Enbo Ma, Lucas B. Harrington, Maria Da Costa, Xinran Tian, et. al.. (2018). CRISPR-Cas12a target binding unleashes indiscriminate single-stranded DNase activity. Science. 360, 436-439;
- Клещенко Е. (2018). CRISPR: битва титанов и новая надежда. «Химия и жизнь». 7;
- Gronowski A. (2018). Who or what is SHERLOCK? EJIFCC. 3, 201–204;
- Поиск иголки в стоге сена за 10 минут — подсвети себе LAMPой;
- Клещенко Е. (2018). Анализ ДНК определяет вид комара в полевых условиях. PCR;
- Вирус Зика — глобальная угроза?.