Голодные химеры: направленный протеолиз в качестве лекарства
23 июля 2021
Голодные химеры: направленный протеолиз в качестве лекарства
- 1938
- 0
- 6
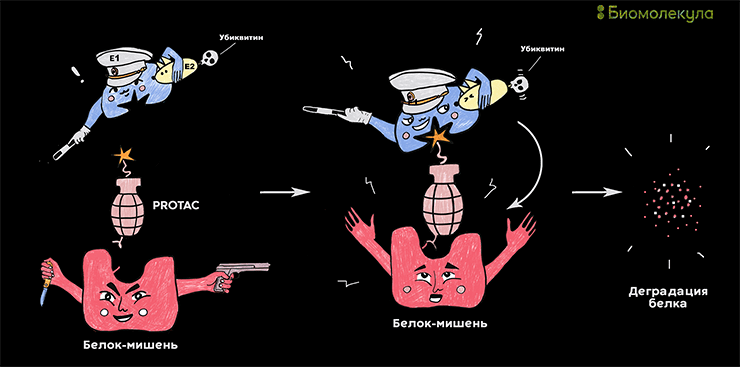
Молекула PROTAC одновременно связывает мишень и убиквитинлигазу, которая помечает ее для деградации в протеасоме. Рисунок в полном размере.
иллюстрация Ирины Ефремовой
-
Автор
-
Редакторы
-
Иллюстратор
Темы
Большинство таргетных препаратов направлено на предотвращение работы белка-мишени путем ингибирования. Новый класс препаратов работает совершенно по другому принципу: он использует клеточную систему деградации белка для того, чтобы уничтожить мишень. PROTAC — протеолиз-таргетированная химера — как мостик связывает белок-мишень с убиквитинлигазой, которая метит его для деградации. Этот класс препаратов открывает новые принципы работы лекарств и мишени, доселе неизвестные. В этой статье спецпроекта о современных лекарствах рассказывается история создания PROTAC’ов и их современное состояние.
Современные лекарства
Спецпроект о современных лекарствах, истории их создания, методах разработки и тенденциях развития.

Партнер спецпроекта — компания Cytiva — образовалась в результате продажи подразделения GE Healthcare Biopharma корпорации Danaher Corporation. Cytiva — глобальный поставщик технологий и услуг, которые продвигают и ускоряют разработку и производство терапевтических средств. У компании богатое наследие, насчитывающее сотни лет. Клиенты Cytiva проводят мероприятия по спасению жизни, начиная от фундаментальных биологических исследований и заканчивая разработкой инновационных вакцин, биологических препаратов и новейших клеточных и генных терапий. Задача компании — предоставить инструменты и услуги, которые им необходимы, чтобы они работали лучше, быстрее и безопаснее, что приведет к лучшим результатам для пациентов.
В 1970-х годах в изучении онкологических заболеваний произошел переворот. В 1970 году Питер Фогт и Питер Дюсберг обнаружили трансформирующий фактор вируса саркомы Рауса [1], позже названный v-src. В 1976 году Гарольд Вармус и Майкл Бишоп обнаружили, что в клетках человека есть аналог вирусного src, клеточный ген с-src, который, как оказалось позже, кодирует тирозинкиназу. В последующие годы были идентифицированы и другие онкогены и опухолевые супрессоры: гены, которые контролируют опухолевую трансформацию и прогрессию.
Теперь у исследователей-онкологов появились мишени для направленной терапии и надежда, что можно отойти от токсичных препаратов, которые были единственным доступным средством химиотерапии (в рамка нашего спецпроекта выходила статья о поиске мишеней [2]). В 1980-х годах были предприняты первые попытки ингибировать продукты онкогенов с помощью мышиных антител [3], но такие препараты оказались малоэффективными и вызывали иммунную реакцию. В начале 1990-х случился прорыв [4]: практически одновременно были созданы и одобрены первый киназный ингибитор — иматиниб («Гливек») [5] — и первое антитело — трастузумаб («Герцептин»).
За этим последовал бум ингибиторов киназ и терапевтических антител, в результате которого создали препараты против множества релевантных киназ и поверхностных белков. Однако многие из идентифицированных онкогенов не являются киназами, или даже не обладают ферментативной активностью. Поэтому у них просто нет активного центра, который можно заблокировать низкомолекулярным веществом. Для того чтобы на них воздействовать, приходится использовать сравнительно большие молекулы — ингибиторы белок-белковых взаимодействий (PPI inhibitors), — часто требующие многих сложных методов для подтверждения правильного связывания с мишенью (рентгеноструктурного анализа комплекса, ЯМР и других [6]). Иногда такие мишени оказывались undruggable, то есть не поддающимися воздействию лекарствами.
Но в 2001 году вышла статья, в которой исследователи предложили радикально иную идею воздействия на мишени в клетках [7]. Что если попробовать использовать системы самой клетки для деградации белка , лишь направляя их на нужный белок? Что если для того, чтобы ингибировать мишень независимо от ее природы, нужно лишь связывание с препаратом? Этой идеей был PROTAC (proteolysis targeting chimera, протеолиз-таргетированная химера). Он использует собственную систему белковой деградации клетки — протеасому, увеличивая скорость распада белка-мишени. Для этого молекула одновременно связывает мишень и убиквитинлигазу, которая помечает этот белок для деградации в протеасоме.
Жизнь белков внутри клетки сложна и сурова. Как быть, если тебе вручили «черную метку»? На «Биомолекуле» уже немало было сказано про природу этой метки (белка убиквитина): «Вездесущий убиквитин» [8], «“Вездесущий убиквитин” возвращается» [9]; а недавно вышел обзор про протеостаз, передающий весь масштаб жизни и смерти белков: «Война и мир: как устроить белковую жизнь?» [10].
Протеасома
Протеасомную систему деградации открыли в 1970-х годах в лабораториях Аврама Гершко в Хайфе и Ирвина Роуза в Филадельфии. До этих исследований считалось, что белки могут деградировать только неспецифично в лизосомах, без затрат АТФ, несмотря на ряд работ (например Симпсона в 1953-м [11]), показывающих энергозависимую деградацию белков внутри клетки. Гершко и его аспирант Аарон Чехановер обнаружили, что деградация белков осуществляется двумя белковыми комплексами, один из которых деградирует белки (протеасома), а второй помечает их специальными метками, позже идентифицированными как полимеры белка убиквитина [8], направляя их на деградацию. В результате работ этой группы, лаборатории Александра Варшавского и ряда других в 1980-х была полностью идентифицирована система протеасомной деградации.
Ключевой частью системы протеасомы выступают ферменты, помечающие белки полиубиквитином. Существуют три группы ферментов, участвующие в этом процессе. E1-ферменты активируют убиквитин и переносят его на убиквитинконъюгирующий фермент E2. Наиболее многочисленны белки E3, которые обеспечивают специфичное связывание комплекса E2 с мишенью для деградации и переносят на нее убиквитиновую метку. Именно их разнообразие позволяет очень точно регулировать время полужизни каждого белка в клетке (рис. 1) [12].
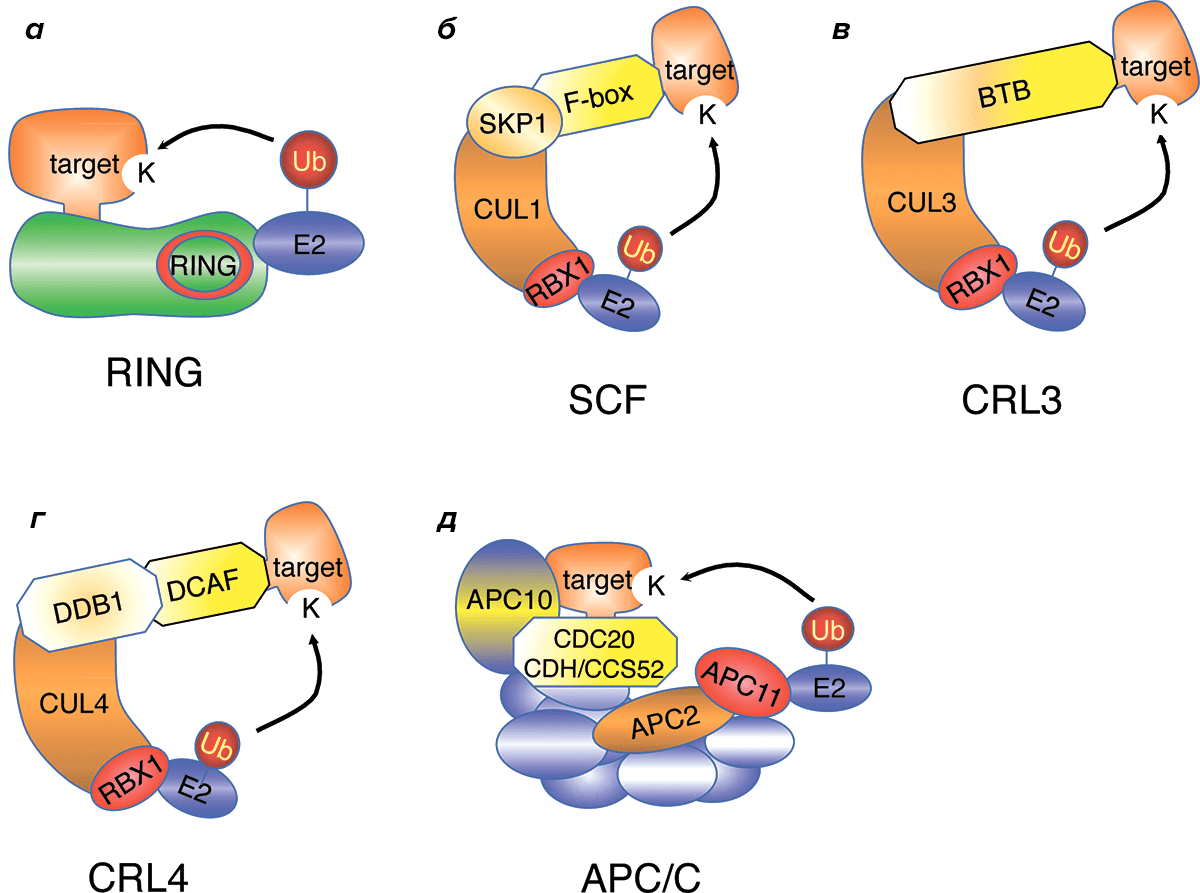
Рисунок 1. Разные классы убиквитинлигаз, вовлеченные в регуляцию клеточного цикла. Мономерные RING-лигазы (а) напрямую связывают убиквитинконъюгирующий фермент E2 и мишень, в то время как SCF/CRL1, CRL3, и CRL4 (б–г) состоят из комплекса скаффолдных белков и RING-белка RBX1. APC/C (д) является огромным мультимерным комплексом, в который входят активирующие белки WD40, RING-доменный белок APC11 и другие.
История PROTAC
В 2001 году группы Реймонда Дешейза и Крейга Крюза придумали, как «натравить» систему протеасомной деградации на новые субстраты. Для этого они создали химерный пептид, состоящий из двух частей:
- Дегрон — участок белка, опознающийся убиквитинлигазой SCFβ-TRCP.
- Овалицин — малая молекула, связывающаяся с выбранной исследователями мишенью для деградации: метиониновой аминопептидазой MetAP-2.
Получившаяся молекула работала как мостик, который связывал убиквитинлигазу E3 с ее новой мишенью. Исследователи увидели, что молекула не только физически сближает SCFβ-TRCP с новой мишенью, но и обеспечивает ее полиубиквитинилирование, а затем деградацию. Две особенности получившейся молекулы особо ценны:
- быстрая деградация долгоживущего белка;
- использование новой убиквитинлигазы, которая обычно не связана с мишенью.
Статья с описанием работы вышла в PNAS в 2001 году [7], и получившийся класс молекул окрестили PROTAC — proteolysis targeting chimera, или протеолиз-таргетированная химера. Авторы сразу предположили, что PROTAC можно использовать для терапии заболеваний, деградируя белки, участвующие в патогенезе, а также что можно деградировать белки только в определенных клетках и тканях, направляя к ним убиквитинлигазы, которые не синтезируются во всем организме. Однако они также отметили большое ограничение получившейся молекулы — пептидная конструкция не проникает в клетки сама собой.
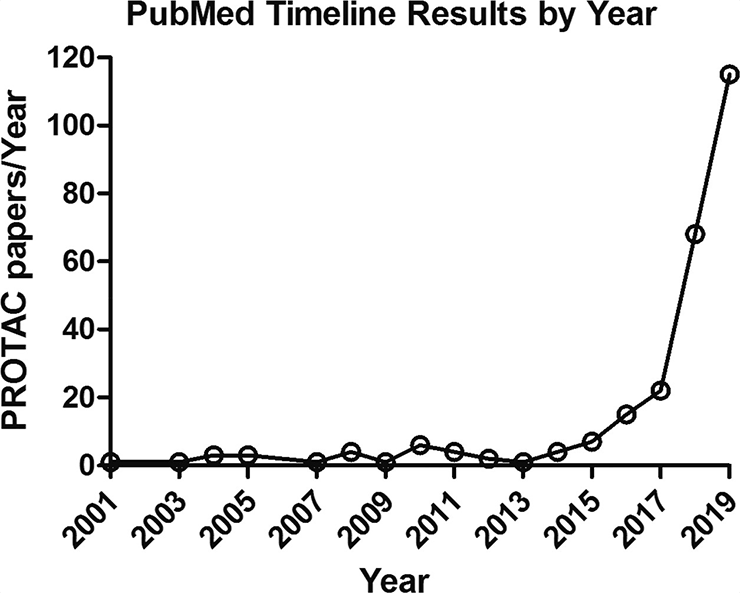
Рисунок 2. Динамика публикаций о PROTAC в Pubmed
Интерес к PROTAC был довольно скромным до 2015 года (рис. 2), однако затем область взорвалась десятками и сотнями статей [13]. Но для этого надо было решить проблему с доставкой в клетку и найти больше молекул, которые могут связывать E3-лигазы. Первый PROTAC, который мог проходить в клетку, был сделан той же парой Дешейза и Крюза, которые использовали пептид из транскрипционного фактора HIF-1α, субстрата E3-убиквитинлигазы VHL, помеченный поли-D-аргинином для проникновения в клетку. Полученный пептид мог направлять андрогеновый рецептор и белок FKBP12 на деградацию.
В лаборатории Крюза решили отойти от использования пептидов, и к 2008 году им удалось создать малую молекулу, которая позволяла деградировать андрогеновый рецептор [14]. Для этого они использовали селективный модулятор андрогеновых рецепторов (SARM), который эффективно связывался с рецептором. Второй частью молекулы был нутлин-3 — вещество, которое разрывало связь p53 c его убиквитинлигазой MDM2, связываясь с последней (рис. 3). Две части соединили ПЭГ-линкером, и получившаяся молекула работала внутри клетки, хотя и с не очень высокой активностью.

Рисунок 3. Первый низкомолекулярный PROTAC. Молекула состоит из двух частей: нутлин-3 связывает E3-убиквитинлигазу MDM2, SARM связывает мишень — андрогеновый рецептор. Сближение двух белков катализирует перенос убиквитина на мишень и ее последующую деградацию.
Вторым классом E3-лигаз, для которого были найдены низкомолекулярные ингибиторы, стали белки ингибиторы апоптоза IAP и XIAP, у которых также есть убиквитинлигазная активность. Ингибиторы этих белков разрабатывались как антиапоптотические белки, однако их конъюгация с мишенями позволила получить эффективные деградирующие химеры (названные SNIPER [15]).
В 2010 году вышла статья, на первый взгляд не связанная с PROTAC [16]. Японская группа Хироси Ханда раскрыла давнюю загадку токсичности талидомида. Это лекарство, которое прописывали от ряда болезней и симптомов, включая токсикоз беременных, вызывало тяжелые эффекты у плода — дети умирали или рождались с множеством тяжелых дефектов, в том числе и без конечностей . Талидомид получил вторую жизнь как лекарство от множественной миеломы и проказы, со строгим контролем побочных эффектов. Как оказалось, он связывает E3-убиквитинлигазу цереблон (cereblon, CRBN), ингибируя ее активность, что приводит к дезорганизации в сигнальных путях BMP и FGF8, участвующих в развитии конечностей у эмбрионов. Талидомид пережил третье перерождение, теперь как часть PROTAC, которая может привлечь цереблон к мишени.
Мы писали о талидомидовой трагедии в статье «С миру по нитке: как соединились компоненты клинического исследования» [17].
Коммерциализация и начало клинических испытаний
Молекулы, связывающие убиквитинлигазу VHL, также находились в разработке, и в 2012 году в лаборатории Крюза создали первую малую молекулу, которая могла связывать VHL. В том же 2012 году Крюз основал Arvinas — первую компанию, которая планировала использовать PROTAC в клинике.
Вещества, привлекающие E3-лигазы VHL и CRBN, стали самыми популярными платформами для разработки низкомолекулярных PROTAC. В течение нескольких лет, начиная с 2015 года, были получены PROTAC против эстрогенового рецептора, BCR-ABL, Brd4, разнообразных рецепторных тирозинкиназ и множества других онкологических мишеней. К 2021 году количество описанных PROTAC-молекул увеличилось до 1600, а число мишеней — до 100.
В 2015 году были основаны две другие компании, решившие сделать ставку на использование PROTAC: Kymera Therapeutics и C4 Therapeutics. Рост числа, разнообразия и активности PROTAC привлек внимание крупных фармацевтических компаний: Arvinas заключил партнерские соглашения с Merck и Genentech, C4 — с Roche, а Kymera — с Sanofi.
В 2019 году Arvinas начала первые клинические испытания PROTAC-молекулы ARV110, направленной против того же андрогенового рецептора, в том числе и с мутациями, устойчивыми к имеющимся ингибиторам этого рецептора (например энзалутамиду). Для того чтобы PROTAC достигли клиники, пришлось решить множество проблем с биодоступностью, стабильностью и другими параметрами. Огромные молекулы PROTAC нарушали множество устоявшихся правил медицинской химии (такие как правило пяти Липинского), вначале вызывая ужас технологов и сомнения в том, что эти молекулы могут реально работать в организме. Однако все эти проблемы были решены, и к концу 2021 года количество клинических испытаний PROTAC должно увеличиться до 15 [18].
Среди мишеней PROTAC множество популярных онкологических мишеней: упомянутый выше эстрогеновый и андрогеновый рецепторы; эпигенетические белки BRD4 и BRD9, которые считывают гистоновые метки [19]; транскрипционный фактор STAT3 и другие. Один из клинических кандидатов — DT2216, деградирующий антиапоптотический белок Bcl-xL, — иллюстрирует сильные стороны PROTAC по сравнению с обычными ингибиторами: в свое время разработка ингибиторов Bcl-xL приостановилась из-за того, что тромбоциты гибнут при инактивации Bcl-xL. Решение, ставшее возможным с использованием подхода PROTAC, основано на том, что DT2216 таргетирует этот белок к убиквитинлигазе VHL, которая не производится в тромбоцитах.
У молекул PROTAC обнаружились и неожиданные преимущества — они оказались гораздо активнее, чем простые ингибиторы тех же молекул, работая скорее как катализаторы деградации: после того, как мишень деградировала в протеасоме, PROTAC освобождается для нового раунда связывания. Еще одно преимущество — PROTAС, убирая сам белок (а не только его активность), часто влияют на неферментативные функции своих мишеней, например, на стабилизацию комплексов, в которые они входят. Так, опухолевые линии, не чувствительные к ингибиторам BRD9, оказались очень чувствительными к его деградации.
Кроме онкологических, PROTAC разрабатываются и для других заболеваний. В Kymera сосредоточены на мишенях, важных не только для опухолей, но и для иммунной системы, таких как IRAK4 и вышеупомянутый STAT3. У Arvinas есть ряд молекул, направленных на нейродегенеративные заболевания — в разработке находятся молекулы, деградирующие хантингтин, ɑ-синуклеин и тау-белок. В 2019 году вышло несколько работ, показывающих эффективность тау-направленных PROTAC на животных моделях болезни Альцгеймера [20].
К сожалению, первые результаты клинических испытаний ARV110 немного охладили энтузиазм по поводу PROTAC: несмотря на очень впечатляющие результаты в мышиной модели, лишь у двоих из 22 пациентов наблюдалось значительное сокращение объема опухоли, и у части пациентов — отсутствие дальнейшего прогрессирования заболевания. Однако больше половины пациентов (которые прошли множество предыдущих линий терапии) продолжают получать терапию, и окончательные результаты испытания еще не представлены. Другой претензией скептиков PROTAC является то, что для большинства мишеней, против которых показана активность, уже имеются обычные ингибиторы. Пока обещания найти PROTAC для белков, недоступных для «обычных» ингибиторов, остаются невыполненными.
Другие бифункциональные молекулы
Способность молекул PROTAC привлекать к мишени белок, который ранее с ней не связывался, вызвала интерес — можно ли нацеливать другие ферменты на белки-мишени. Прежде всего были получены молекулы, направляющие мишени на другие пути деградации.
Lysosomal-targeting chimera (LYTAC) и MoDE-A являются модифицированными антителами, которые связывают мишень вне клетки и затем поглощаются эндоцитозом, связываясь с рецепторами (CI-M6PR и ASGPR) через линкерную молекулу. Поглощенный таким образом комплекс из антитела и белка-мишени направляется в лизосому.
MADTAC-молекулы (macroautophagy degradation targeting chimeras, химера для направленной деградации макроаутофагией) используют еще один путь для деградации — аутофагию [21], [22]: ATTEC-молекулы (autophagosome-tethering compound, соединение, связывающее аутофагосомы) связывают мишень с LC3, компонентом мембраны аутофагосомы, в то время как AUTAC (autophagy-targeting chimera, химера для направленной аутофагии) направляют мишень в аутофагосому с помощью гуаниновой метки по неизвестному механизму [23]. AUTAC-молекулы могут помечать даже целые органеллы (например поврежденные митохондрии) для деградации (рис. 4).
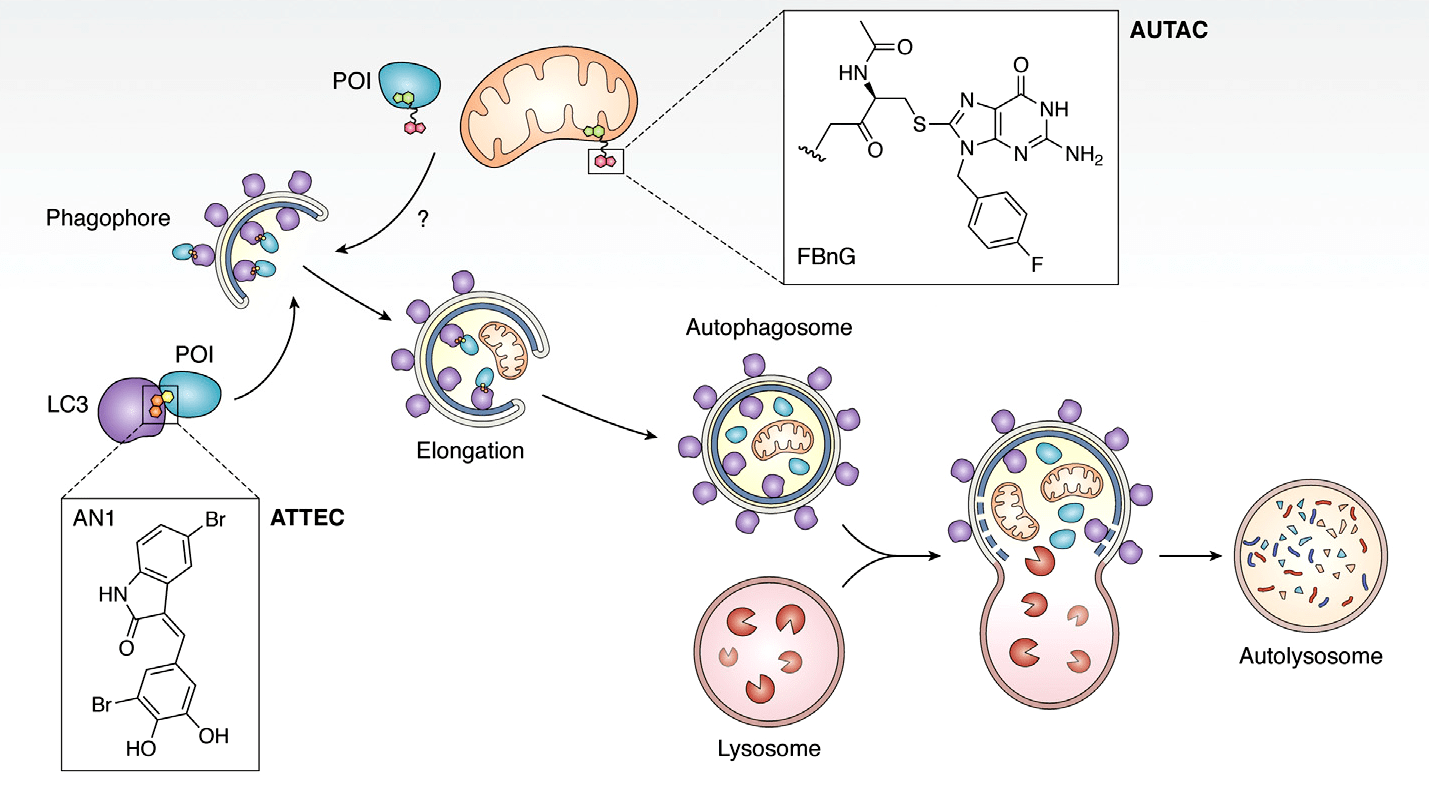
Рисунок 4. Механизмы действия MADTAC (macroautophagy degradation targeting chimeras). ATTEC связывает белок-мишень и компонент аутофагосомы LC3. AUTAC-молекулы содержат гуаниновую метку, которая помечает мишень (в том числе целые органеллы) для включения в аутофагосому.
В 2019 году исследователи из Genentech сделали бифункциональную молекулу, привлекающую фосфатазу к мишени. Получившийся класс назвали PhoRC [24]. Обратный процесс позволяет направить киназы для фосфорилирования новых мишеней (эти вещества названы PHIC [25]). РНК-связывающие лиганды можно совместить с молекулой, привлекающей РНКазу L, получив RIBOTAC [26], [27]. Многие из этих молекул выглядят скорее как научные игрушки, чем клинические кандидаты, но и сами PROTAC вначале не казались похожими на реальные лекарственные молекулы.
Заключение
PROTAC представляет собой одну из удивительных историй успеха современной фармакологии. Всего за 20 лет эти вещества прошли от первоначальной идеи до множества реальных клинических кандидатов. PROTAC создал новую парадигму в медицинской химии, открыв новые принципы воздействия на мишень и существенно расширив горизонты возможного для низкомолекулярных соединений, связанные не только с ингибированием ферментов. И хотя нельзя предсказать, насколько эти молекулы будут клинически эффективны, в ближайшие годы их явно ждет большое будущее.
Литература
- Klaus Bister. (2015). Discovery of oncogenes: The advent of molecular cancer research. Proc Natl Acad Sci USA. 112, 15259-15260;
- Поиск лекарственных мишеней;
- Краткая история открытия и применения антител;
- Три поколения лекарств;
- Таргетная терапия — прицельный удар по болезни;
- 12 методов в картинках: структурная биология;
- K. M. Sakamoto, K. B. Kim, A. Kumagai, F. Mercurio, C. M. Crews, R. J. Deshaies. (2001). Protacs: Chimeric molecules that target proteins to the Skp1-Cullin-F box complex for ubiquitination and degradation. Proceedings of the National Academy of Sciences. 98, 8554-8559;
- Вездесущий убиквитин;
- «Вездесущий убиквитин» возвращается;
- Война и мир: как устроить белковую жизнь?;
- Melvin V. Simpson. (1953). THE RELEASE OF LABELED AMINO ACIDS FROM THE PROTEINS OF RAT LIVER SLICES. Journal of Biological Chemistry. 201, 143-154;
- Pascal Genschik, Katia Marrocco, Lien Bach, Sandra Noir, Marie-Claire Criqui. (2014). Selective protein degradation: a rheostat to modulate cell-cycle phase transitions. Journal of Experimental Botany. 65, 2603-2615;
- Hongying Gao, Xiuyun Sun, Yu Rao. (2020). PROTAC Technology: Opportunities and Challenges. ACS Med. Chem. Lett.. 11, 237-240;
- Ashley R. Schneekloth, Mathieu Pucheault, Hyun Seop Tae, Craig M. Crews. (2008). Targeted intracellular protein degradation induced by a small molecule: En route to chemical proteomics. Bioorganic & Medicinal Chemistry Letters. 18, 5904-5908;
- Mikihiko Naito, Nobumichi Ohoka, Norihito Shibata. (2019). SNIPERs—Hijacking IAP activity to induce protein degradation. Drug Discovery Today: Technologies. 31, 35-42;
- T. Ito, H. Ando, T. Suzuki, T. Ogura, K. Hotta, et. al.. (2010). Identification of a Primary Target of Thalidomide Teratogenicity. Science. 327, 1345-1350;
- С миру по нитке: как соединились компоненты клинического исследования;
- Asher Mullard. (2021). Targeted protein degraders crowd into the clinic. Nat Rev Drug Discov. 20, 247-250;
- Молекулы и эпигеном ;
- Weijin Wang, Qiuzhi Zhou, Tao Jiang, Shihong Li, Jinwang Ye, et. al.. (2021). A novel small-molecule PROTAC selectively promotes tau clearance to improve cognitive functions in Alzheimer-like models. Theranostics. 11, 5279-5295;
- Аутофагия, протофагия и остальные;
- Нобелевская премия по медицине и физиологии 2016: за самоедство;
- Shanique B. Alabi, Craig M. Crews. (2021). Major advances in targeted protein degradation: PROTACs, LYTACs, and MADTACs. Journal of Biological Chemistry. 296, 100647;
- Sayumi Yamazoe, Jeffrey Tom, Yue Fu, Wenqiong Wu, Liang Zeng, et. al.. (2020). Heterobifunctional Molecules Induce Dephosphorylation of Kinases–A Proof of Concept Study. J. Med. Chem.. 63, 2807-2813;
- Sachini U. Siriwardena, Dhanushka N. P. Munkanatta Godage, Veronika M. Shoba, Sophia Lai, Mengchao Shi, et. al.. (2020). Phosphorylation-Inducing Chimeric Small Molecules. J. Am. Chem. Soc.. 142, 14052-14057;
- Hafeez S. Haniff, Yuquan Tong, Xiaohui Liu, Jonathan L. Chen, Blessy M. Suresh, et. al.. (2020). Targeting the SARS-CoV-2 RNA Genome with Small Molecule Binders and Ribonuclease Targeting Chimera (RIBOTAC) Degraders. ACS Cent. Sci.. 6, 1713-1721;
- Sourav K. Dey, Samie R. Jaffrey. (2019). RIBOTACs: Small Molecules Target RNA for Degradation. Cell Chemical Biology. 26, 1047-1049.