Война и мир: как устроить белковую жизнь?
22 января 2021
Война и мир: как устроить белковую жизнь?
- 2748
- 0
- 10
Белки — крайне могущественные биомолекулы, способные принести много пользы живому организму. Но ввиду своих конструктивных особенностей, они требуют над собой тщательного контроля и оперативной помощи в случае неблагоприятных условий.
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: В статье рассказ пойдет о проблемах, которые испытывают белки в живом организме, и о том, как работает система противостояния этим проблемам. Мы рассмотрим значительное клеточное явление — сеть протеостаза. Это множество компонентов, которые непрерывно поддерживают сложное белковое сообщество. Нарушение протеостаза приводит к различным тяжелым, часто неизлечимым заболеваниям. Рассмотрение этой глубокой многогранной темы вряд ли удастся уместить в один дождливый вечер. Вместе с тем, заинтересованным пытливым умам стоит дочитать эту сагу до конца. Помимо самогó протеостаза, статья опишет многие нетривиальные фишки, принятые на вооружение клетками для изящного осуществления и регулирования биохимических процессов.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2020/2021.

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Белки удивительны и по-настоящему незаменимы. Их по праву можно назвать рабочими лошадками клетки. Ни ДНК, ни липиды, ни полисахариды не сравнятся с белками по количеству возложенных на них функций.
Белки-ферменты обеспечивают протекание жизненно важных химических превращений, например расщепления сложных молекул на более простые или, наоборот, синтеза сложных из простых. Регуляторные и сигнальные белки (например гормоны или цитокины) налаживают связь между клеточными компонентами, отдельными клетками, тканями и органами. Транспортные белки переносят разнообразные вещества: например, гемоглобин разносит кислород по организму, а ионные помпы и каналы поддерживают солевой баланс клеток. Структурные белки действуют как своего рода арматура, задают форму клеток, обеспечивают их движение, организуют внутриклеточное пространство, а также играют важные роли и вне клеток, становясь компонентами межклеточного вещества. Белки-рецепторы работают как радиопередатчики, распознавая определенные молекулы. Это лишь отдельные примеры многочисленных функций, которые выполняют белки.
Громадный функционал доступен белкам благодаря их особому принципу строения. Это биополимеры, собранные из 20 основных (канонических) аминокислот, кодируемых генетическим кодом. Все аминокислоты имеют в своем составе ɑ-аминогруппу, карбоксильную группу и различные боковые радикалы, которые определяют уникальные химические свойства каждой конкретной аминокислоты (рис. 1). ɑ-аминогруппа одной аминокислоты может соединяться с карбоксильной группой другой аминокислоты, образуя пептидную связь — базовую в структуре любого белка.
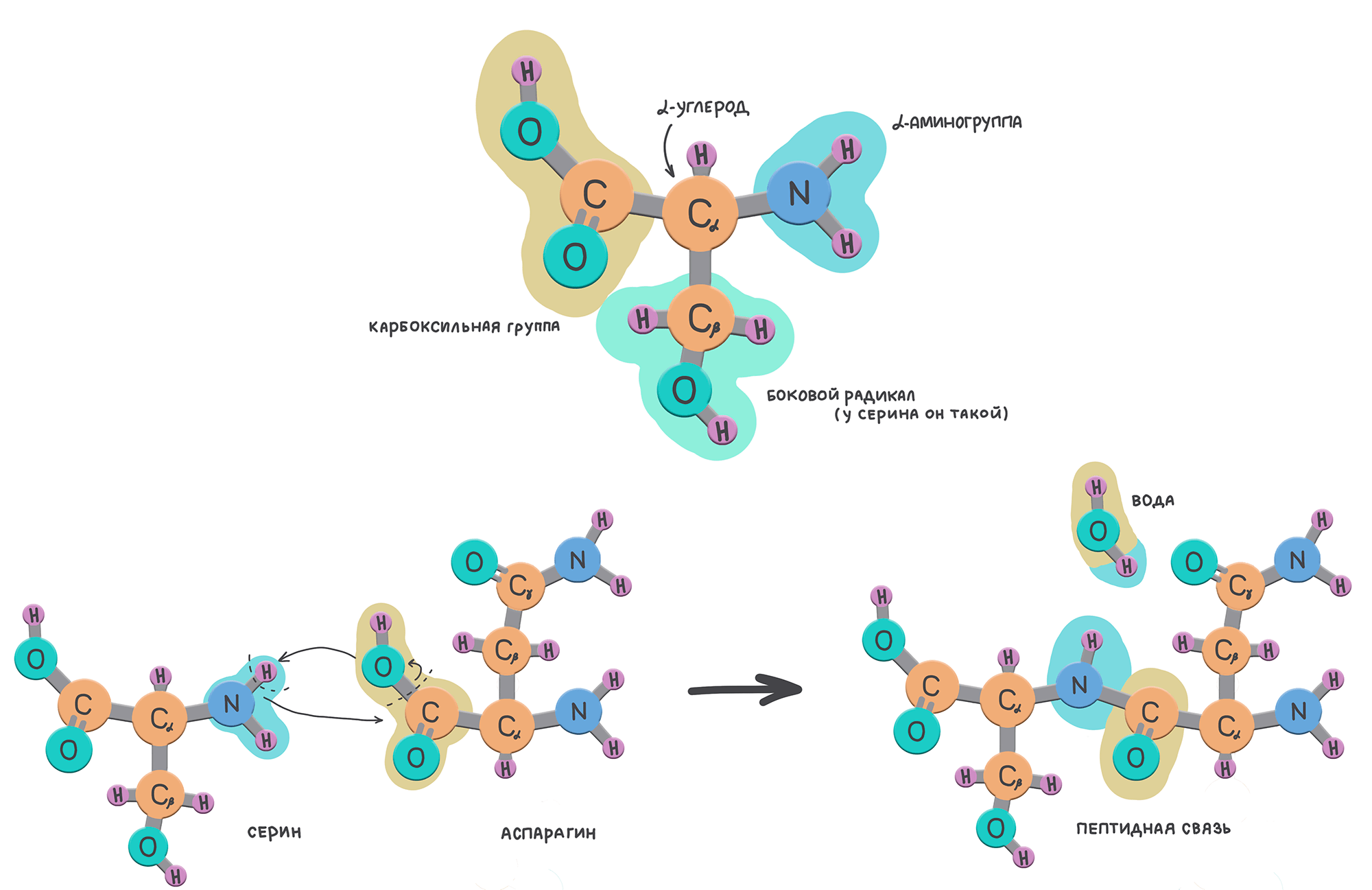
Рисунок 1. Все аминокислоты содержат карбоксильную группу и аминогруппу. Друг от друга они отличаются боковыми радикалами, которые могут быть заряженными, полярными или гидрофобными, а также содержать особые функциональные группы.
рисунок автора статьи
Разные комбинации из сотен аминокислот, связанных друг за другом в уникальном порядке, позволяют построить огромное множество белков с различными свойствами. То белковое разнообразие, которое может производить клетка, называют термином «протеом». По оценкам ученых, благодаря использованию большого числа генов и многочисленных модификаций РНК, человеческая клетка способна выдать около 100 тысяч разновидностей белков. А если учесть химические модификации уже синтезированных белков, то эта цифра увеличится до миллионов.
Но если посмотреть на картинки, то можно заметить, что белки — это не просто аминокислотные цепочки, а какие-то причудливые крупные молекулы с определенной 3D-структурой. Так оно и есть: для выполнения своих функций белки должны сворачиваться в сложные трехмерные формы (нативные конформации) или даже объединяться с другими белками в мультибелковые комплексы (рис. 2) [1]. Такая непростая структура итоговых молекул поддерживается множеством взаимодействий между разными участками аминокислотных цепей [2].
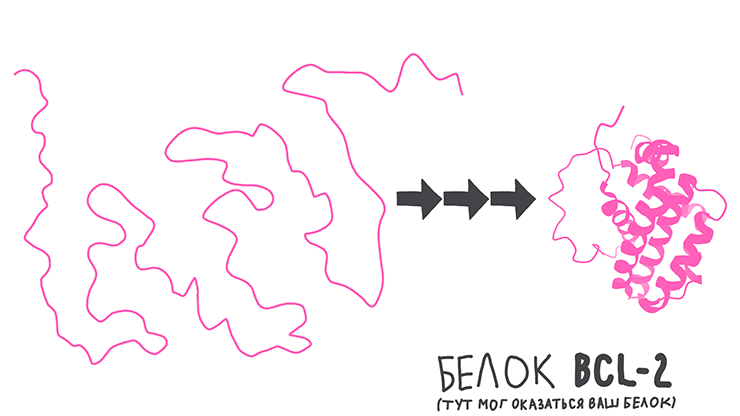
Рисунок 2. Чтобы образовать рабочий белок, в большинстве случаев аминокислотные цепочки должны сворачиваться в определенные структуры
рисунок автора статьи
Допустим, белки свернулись в свою нативную конформацию. На этом можно заканчивать? Нет, жизнь не была бы так сложна, если бы на молекулярном уровне было всё так просто. Для выполнения своих функций структура белка должна обладать некоторой гибкостью, способностью изменяться. К тому же свернутые белки могут взять и развернуться. Это происходит спонтанно или под действием определенных факторов, например температуры, состава среды, взаимодействий с другими молекулами.
И как вишенка на белковом торте, существует класс функционально неупорядоченных белков [3]. Для них отсутствие относительно постоянной пространственной структуры — это не баг, а фича. Эта повышенная пластичность наделяет такие белки выдающейся многофункциональностью. Почему как вишенка? Да потому, что для большинства белков такая роскошь неприемлема. Излишняя неструктурированность или неправильное сворачивание могут быть действительно вредными для клетки. Сейчас разберемся, почему.
Зачастую неправильная структура ведет к тому, что белок неправильно выполняет свои функции или неадекватно отвечает на регулирующие его работу сигналы. Также при неправильных конформациях у белков часто открываются «уязвимые места» — гидрофобные области (рис. 3). Эти зоны очень плохо взаимодействуют с окружающим водным раствором, поэтому обычно они вынуждены прятаться внутри белка, избегая контакта с водой.
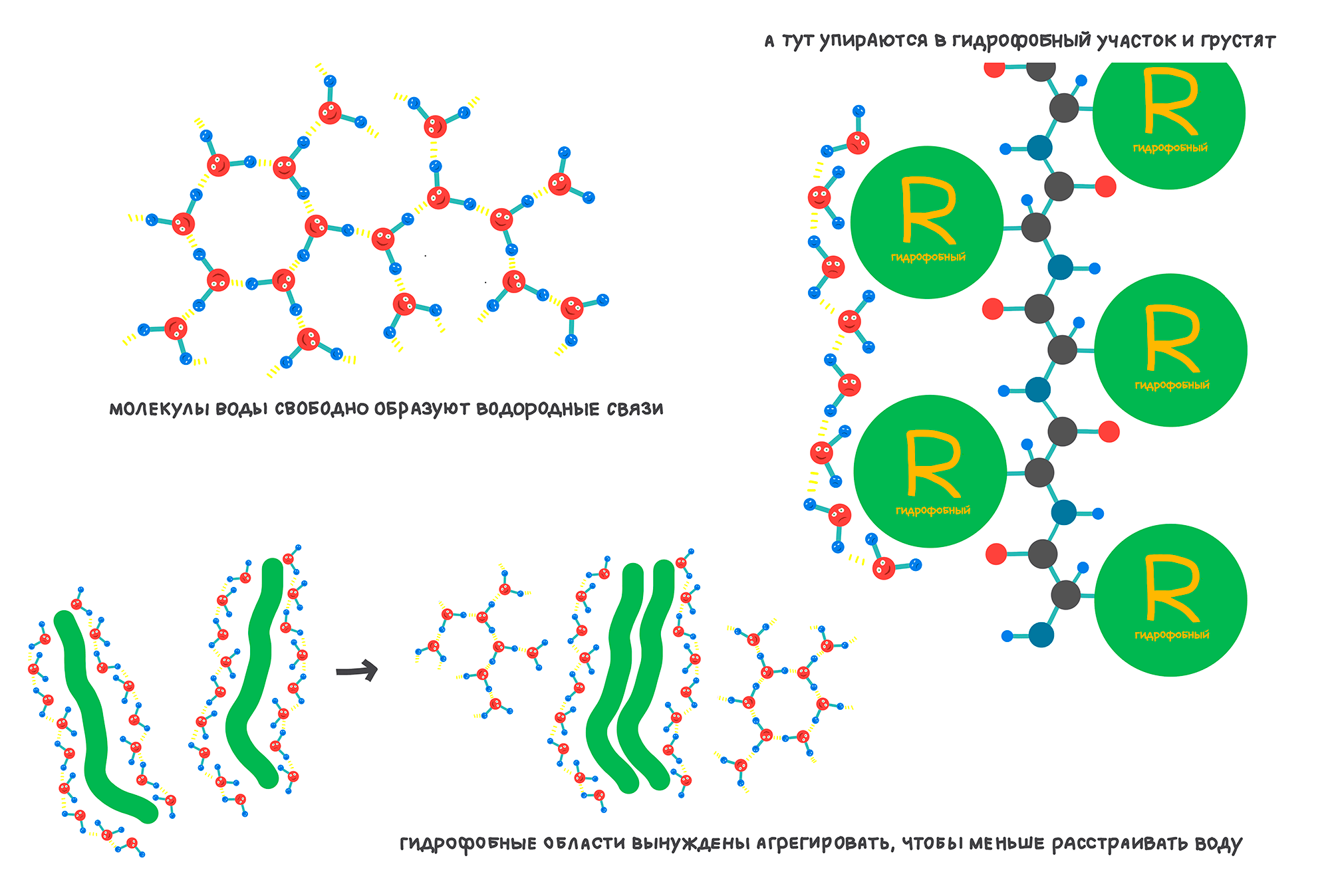
Рисунок 3. Гидрофобный эффект. Так уж устроено, что материя стремится к состоянию с минимальной свободной энергией. Энергия химических связей в молекуле воды распределена неравномерно, она сконцентрирована на кислороде (таким образом, молекула полярна). Благодаря этому молекулы воды образуют между собой сеть водородных связей, снижая свободную энергию системы. 9 из 20 канонических аминокислот имеют в своем составе неполярные гидрофобные радикалы, поэтому они не образуют водородных связей с водой. Участки с большим содержанием таких аминокислот в белке составляют гидрофобные области. Если ввести эти недружелюбные к воде области в водный раствор, это приведет к искажению сети водородных связей. Гидрофобные участки в данном случае выступают в роли физической преграды, мешающей полярным молекулам свободно связываться друг с другом. Это событие неблагоприятно с точки зрения свободной энергии в системе [4]. Агрегируя вместе, неполярные участки уменьшают площадь поверхности, подверженной воздействию воды, и сводят к минимуму ее разрушительный эффект. Подробнее о гидрофобном эффекте можно прочесть в статье «Физическая водобоязнь» [165].
рисунок автора статьи
Однако если что-то мешает белкам правильно свернуться, обнаженные гидрофобные области на разных белках начинают вступать друг с другом в контакт по принципу «подобное с подобным». Таким образом, они укрывают друг друга от недружелюбной окружающей среды [5], [6]. Такое слипание белков (агрегация) ведет к образованию неких структур разной степени упорядоченности: почти неструктурированных аморфных агрегатов, олигомеров и нитчатых амилоидов (рис. 4) [7].
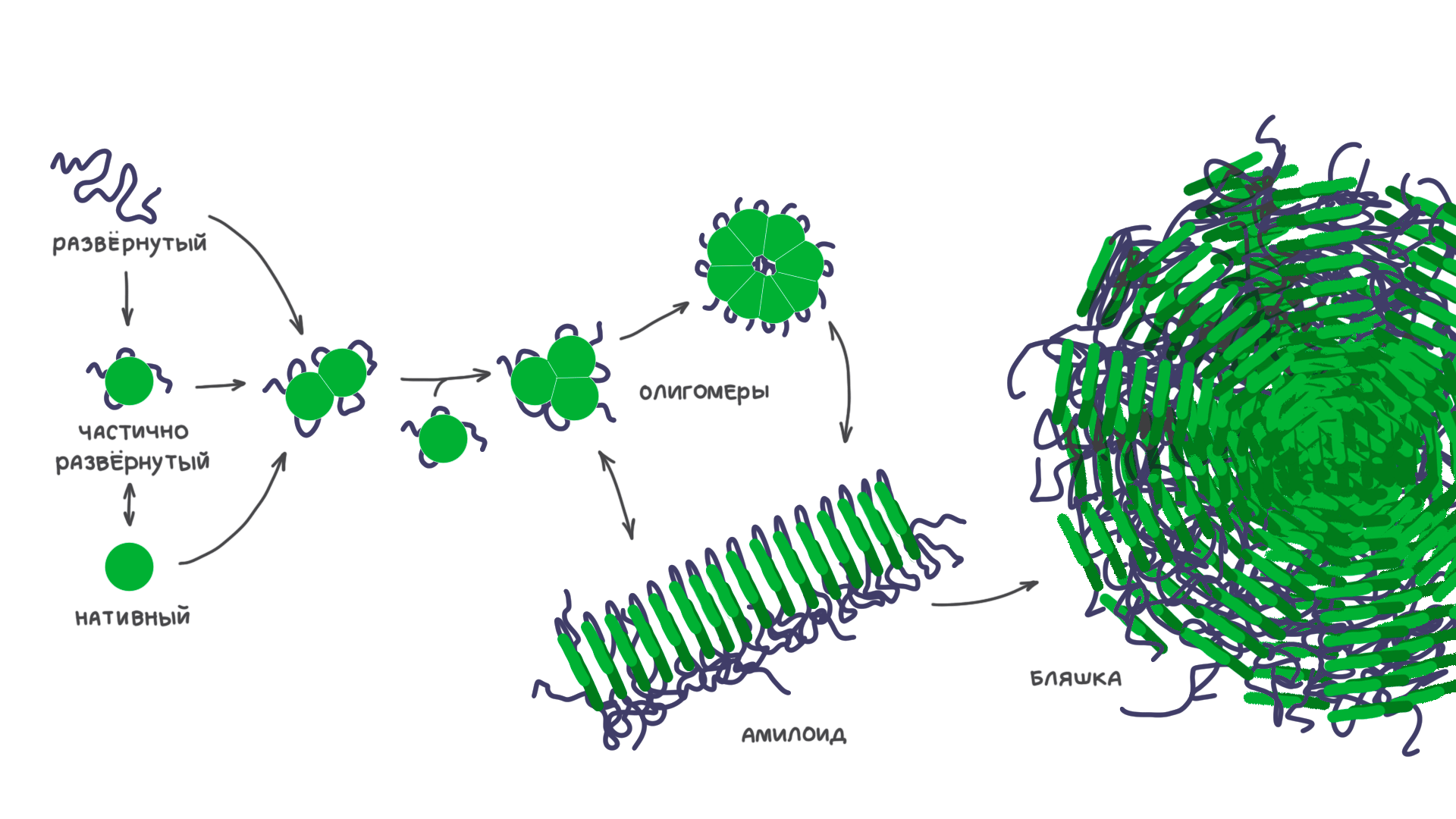
Рисунок 4. Белковые состояния очень динамичны. Если белок теряет значительную часть нативной структуры, то он может начать образовывать различные сложные агрегаты.
[8], рисунок адаптирован
Как разъяренные бунтовщики, белковые агрегаты могут вредить по-разному. Выявлено большое разнообразие биохимических, физиологических и цитологических нарушений, которые происходят в результате неправильных взаимодействий белковых агрегатов с клеточными компонентами, включая другие белки, белковые рецепторы, РНК, небольшие органические молекулы и даже липидные мембраны. Эти взаимодействия ведут к сбоям в работе клетки, что в конечном итоге может приводить к тяжелым заболеваниям [9]. Окончательно все механизмы токсичности белковых агрегатов еще предстоит выяснить.
Особенно человечество беспокоят белковые агрегации в нервных клетках, поскольку они сопровождают некоторые нейродегенеративные заболевания — болезни Альцгеймера, Паркинсона и Хантингтона [10–12]. Также белковые агрегации связаны с цитотоксичностью и процессами старения [13].
Передовое общество
Мирная стабильная белковая жизнь именуется научным термином «протеостаз». Мы знаем, что несанкционированные белковые агрегаты — это опасные и недопустимые образования. Для этого в клетке есть своя «белковая полиция» — сеть протеостаза (proteostasis network, PN), которая контролирует жизнь белков, противодействует возникновениям белковых агрегатов, ну а если агрегат уже назрел, то компоненты PN пытаются оперативно его разогнать. Некоторые авторы также называют эту сеть «системой контроля качества белка» [166].
Чтобы понять, насколько сильно клетка дорожит протеостазом, можно оценить объем инвестиций, который вкладывается в его поддержание. Так, по современным оценкам, PN содержит около 2000 факторов, действующих совместно для поддержания белкового порядка [14]. Это внушительные показатели!
Такое большое число компонентов объясняется сложностью эукариотических протеомов, включающих широчайший ассортимент белков. В динамичной клеточной среде эти белки постоянно сталкиваются с проблемами, связанными с их структурой. На ее стабильность влияет много факторов: посттрансляционные модификации (фосфорилирование, ацетилирование и т.д.), изменения физиологии клеток, перемены в составе и концентрациях низкомолекулярных компонентов и пр. [15]. Более того, 20–30% всех белков в наших клетках — те самые функционально неупорядоченные. Они могут принимать определенные трехмерные конформации только после связывания со своими партнерами. Такие белки нуждаются в помощи, чтобы избежать неправильных взаимодействий и агрегации [16]. Эти соображения помогают понять, почему клетки инвестируют в обширную сеть протеостаза, ведь она поддерживает целостность протеома и обеспечивает адаптацию к изменениям в окружающей среде.
В соответствии с жизненным циклом белка, можно выделить те задачи, которые должна выполнять сеть протеостаза:
- регулировать уровни производства белков;
- строго контролировать процесс укладки белка в нативную конформацию;
- обеспечивать поддержку на протяжении срока службы белка;
- контролировать численность и локализацию белков;
- оперативно утилизировать неправильно свернутые белки и токсичные агрегаты.
Всю сеть протеостаза можно условно поделить на три ветви: отдел контроля синтеза белка и поддержания конформации; отдел деградации и агрегации; а также сигнальная группа.
Производство белков жестко регулируется
Повторим центральную догму молекулярной биологии. Аминокислотные последовательности белков закодированы в ДНК. Эта информация передается на РНК в ходе процесса транскрипции в ядре. Затем эта РНК становится матрицей для сборки аминокислотной цепочки будущего белка. Этот процесс называется трансляцией, он происходит на рибосомах в цитоплазме или на мембране эндоплазматического ретикулума (ЭПР).
Производство каждого белка жестко регламентировано и регулируется с учетом окружающих условий и потребностей в этом конкретном белке. Однако общие уровни синтеза белка должны быть дополнительно скорректированы с учетом способности белков принимать нативную конформацию. Ведь если условия неблагоприятны, то высокие темпы синтеза приведут к накоплению развернутых или неправильно свернутых белков, что вызовет повсеместную агрегацию и токсичность. Поэтому эволюцией выработаны механизмы регуляции общих темпов синтеза белка. В клетке есть несколько сигнальных систем, которые контролируют конформационную обстановку (с ними мы познакомимся позже). В результате их работы, помимо прочего, изменяются общие темпы трансляции. Обычно это опосредуется через активацию/деактивацию ключевого фактора запуска трансляции — eIF2α. Эта довольно «топорная» и неселективная мера в действительности очень важна при белковом стрессе. Общее ингибирование трансляции хоть и частично, но увеличивает способность поддерживать белковую стабильность и имеет решающее значение для снятия перегрузки с PN после конформационного стресса [17].
Фолдинг
В аминокислотной последовательности эволюцией заложен путь, согласно которому линейный полипептид должен свернуться в свою нативную конформацию. Пептид прячет углеводородные группы гидрофобных аминокислот и формирует стабилизирующие внутримолекулярные взаимодействия. Таким образом, говоря языком термодинамики, аминокислотная цепочка пытается достичь состояния с низкой свободной энергией. Процесс сборки белка в свою трехмерную структуру называется фолдингом (от англ. folding — «складывание») [1]. Реакции фолдинга невероятно сложны. Это объясняется тем астрономически большим числом конформаций, которые потенциально может принять белковая цепь. Процесс фолдинга почти полностью обеспечивается слабыми нековалентными взаимодействиями [2], [18], [19].
Заложенный путь сворачивания нужен для того, чтобы аминокислотная цепь не перебирала все возможные состояния сворачивания, и процесс фолдинга не занимал большого количества времени (это называют парадоксом Левинталя). Полипептиды приходят к своей нативной структуре, формируя локальные и дальние контакты между аминокислотными остатками, тем самым постепенно сужая пространство доступных конформаций [20].
Процесс фолдинга можно визуализировать на энергетической диаграмме как путь к самой глубокой «ямке», соответствующей минимуму энергии (рис. 5). При этом аминокислотная цепь преодолевает путь из промежуточных «ямок», перепрыгивая через «кочки» (кинетические барьеры). Иногда это бывает довольно трудно, из-за чего она может некоторое время оставаться в промежуточных «ямах», то есть в частично сложенных состояниях. Долго оставаться в таком положении не очень хорошо, ведь частично сложенные белковые цепи склонны к агрегации.
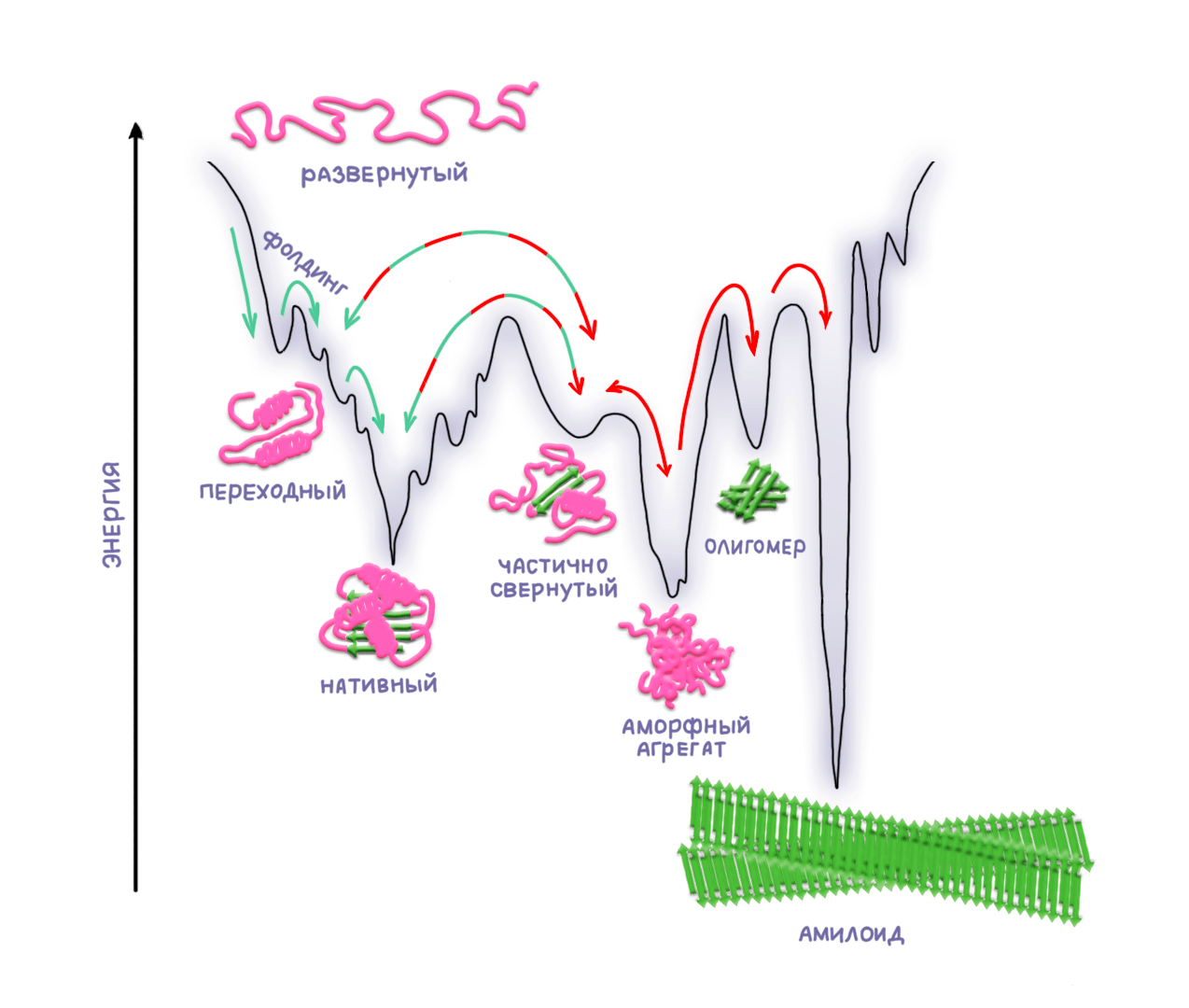
Рисунок 5. Развернутый полипептид обладает избыточной энергией. По ходу фолдинга энергия молекулы снижается за счет налаживания внутримолекулярных взаимодействий. Белок стремится принять нативную конформацию, которая соответствует локальному минимуму энергии. Однако есть сопоставимые по энергии состояния, например аморфные агрегаты и амилоиды [21].
[22], рисунок адаптирован
Процесс фолдинга затрудняется многими факторами.
Во-первых, насыщенностью клеточной среды, так как в таких условиях макромолекулярные взаимодействия усиливаются, что ставит белки в очень неудобное положение для фолдинга [23].
Во-вторых, поскольку на рибосоме полипептид собирается постепенно, закодированная информация о пути сворачивания также становится доступной только по частям, а не вся сразу (рис. 6). Этот фактор особенно важен ввиду того, что скорость трансляции меньше скорости фолдинга белка. Из-за неполноты информации на некоторых этапах сворачивания у полипептида появляется возможность принять частично неправильную структуру или уйти с верного пути сборки до завершения синтеза [24].
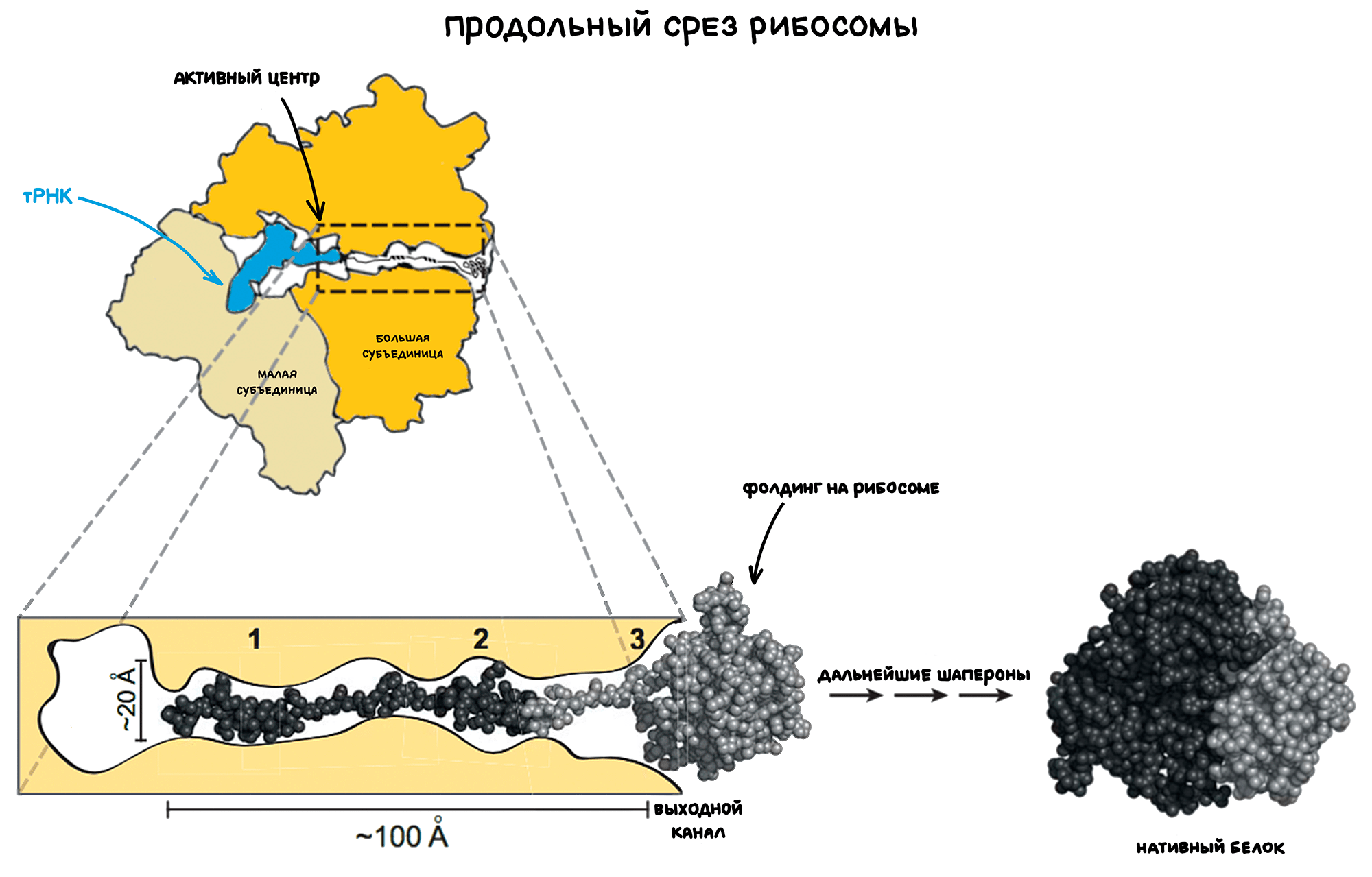
Рисунок 6. Рибосома и ее выходной канал в увеличении. Часть полипептида еще не вышла из канала, следовательно, закодированная в нем информация о пути фолдинга пока не доступна.
[24], рисунок адаптирован
В-третьих, само трансляционное окружение мешает фолдингу. Например, для большинства белков основная часть выходного канала рибосомы слишком узка, чтобы обеспечить формирование пространственной структуры [25]. Таким образом, зарождающиеся аминокислотные цепи крупных белков должны сначала выйти из рибосомы, прежде чем они смогут правильно сложиться [26], [27]. Это подвергает их риску неправильной укладки и вредных взаимодействий.
В-четвертых, трансляция обычно протекает в форме «полисомы», когда много рибосом работают на одной молекуле мРНК. Такое тесное сближение рибосом может негативно сказываться на фолдинге. Чтобы облегчить жизнь свежим аминокислотным цепям, рибосомы выстраиваются вдоль молекулы мРНК ступенчато по спирали. Благодаря такому расположению сайты выхода полипептидов находятся на максимальном расстоянии друг от друга, что снижает риск вредных взаимодействий [28].
Молекулярные шапероны — центральные организаторы протеостаза
И вот, наконец, мы добрались до самых известных действующих лиц сети протеостаза — молекулярных шаперонов. Они были созданы эволюцией, чтобы преодолевать описанные выше проблемы с укладкой белка. Молекулярный шаперон — это белок, который помогает другим белкам принимать их нативную конформацию, параллельно защищая их «ахилесовы пятки» от неправильных взаимодействий и агрегации (рис. 7). Повышенная выработка шаперонов наблюдается в тканях, подвергающихся воздействию различных неблагоприятных факторов (тепло, тяжелые металлы, нехватка кислорода, повышенная кислотность и др.). Это адаптивный ответ, повышающий выживаемость клеток.
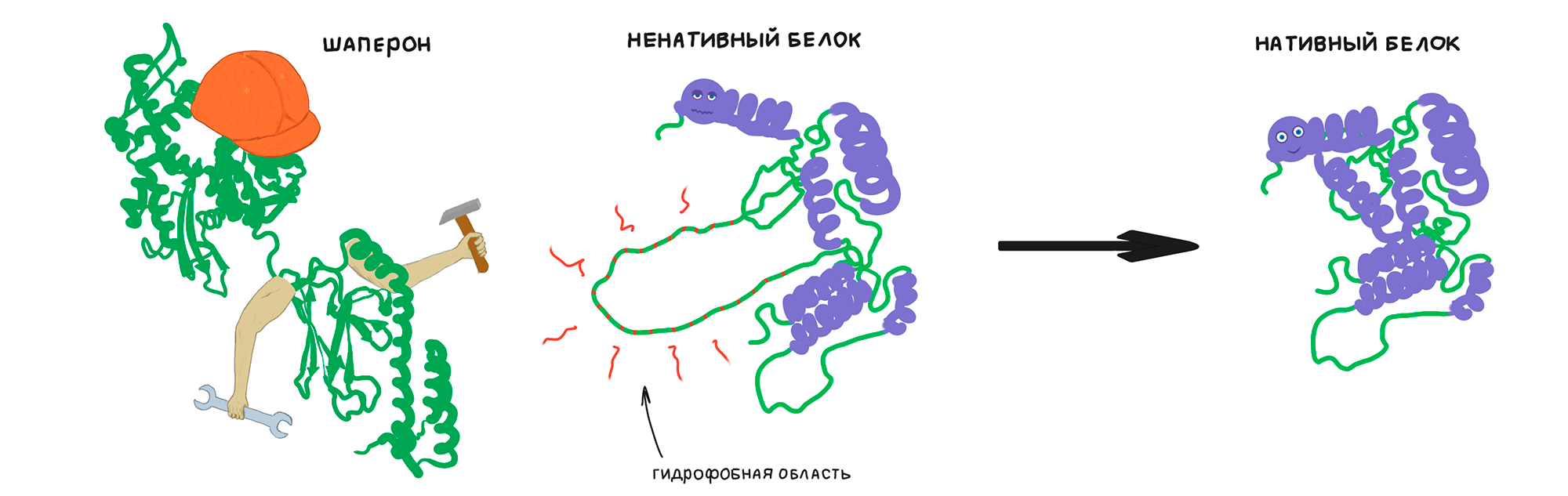
Рисунок 7. Шаперон может помочь исправить изъян в пространственной структуре ненативного белка
рисунок автора статьи
В клетках есть несколько различных по структуре классов шаперонов. Многие из них активируются в условиях белкового стресса, вызванного повышением температуры, поэтому эти шапероны известны как белки теплового шока (Heat shock protein, Hsp). Для удобства, ученые классифицировали их в соответствии с примерной средней молекулярной массой (Hsp40, Hsp60, Hsp70, Hsp90, Hsp100 и малые sHsp). Эти ребята возложили на себя обязанности по поддержанию протеома, включая фолдинг синтезированных белков, рефолдинг развернутых белков, помощь в сборке мультибелковых комплексов, трафик белков и помощь в их деградации.
Шапероны, работающие с самым свежим белком
Разные шапероны могут работать с белком на разных этапах его жизни (рис. 8). В начале синтеза первых 35–40 аминокислот зарождающиеся цепи выходят из рибосомного туннеля. На этой стадии с будущим белком начинает взаимодействовать первый уровень шаперонов [29]. К нему относят «комплекс, связанный с рибосомой» (RAC), контролирующий ранние стадии фолдинга во время трансляции, и «комплекс, связанный с формирующейся цепью» (NAC), который действует ниже по цепи синтезируемого белка [30]. Они взаимодействуют с открытыми гидрофобными последовательностями возникающей цепи и предотвращают преждевременный неправильный фолдинг. Таким образом эти комплексы поддерживают полипептид до тех пор, пока не появятся достаточные структурные элементы для протекания продуктивного фолдинга.
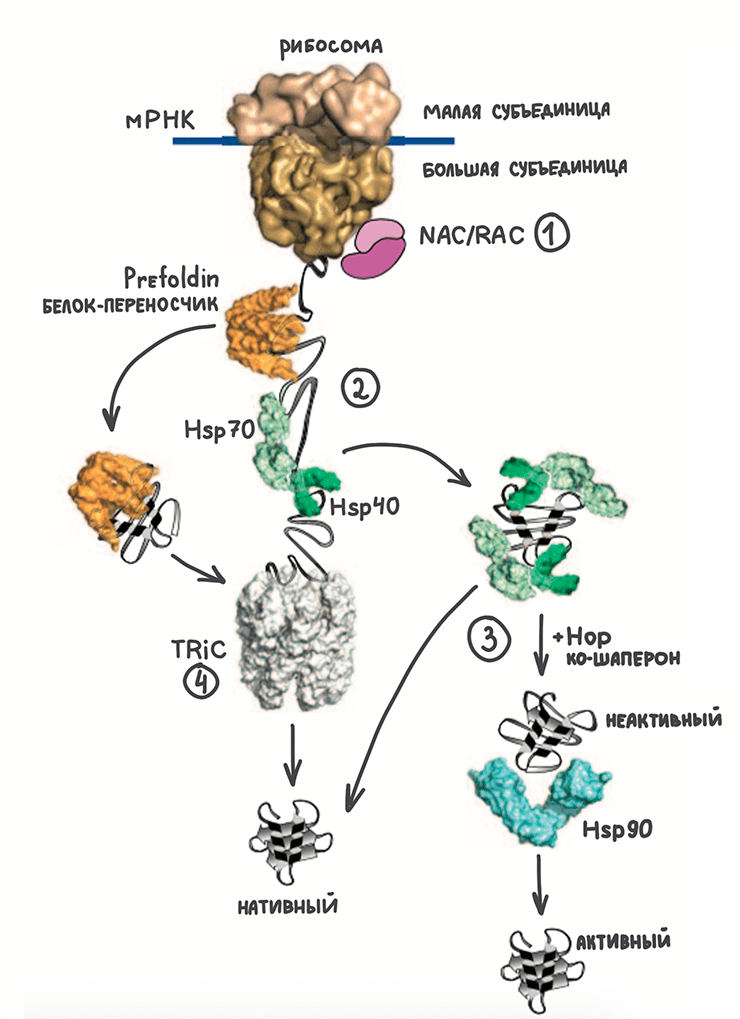
Рисунок 8. Шаперонный путь в цитозоле. Об основных этапах будет рассказано далее. Выходящую из рибосомы аминокислотную цепочку помогают складывать комплексы NAC и RAC (1). Около 30% белков после полного выхода из рибосомы связываются с Hsp70 (2). Из них около 2/3 молекул складывается в рабочую конформацию или передается на Hsp90 в неактивной форме (3). Оставшиеся белки загружаются в комплекс TRiC (4).
[24], рисунок адаптирован
Вниз по шаперонному течению
Многим простым белкам для достижения своей нативной укладки такой помощи уже будет вполне достаточно. Однако в клетках есть белки со сложной организацией доменов, которые нуждаются в дополнительных классах шаперонов. Такие белки до или после полного выхода из рибосомы начинают взаимодействовать с АТФ-зависимыми шаперонами класса Hsp70.
Шапероны Hsp70 состоят из трех основных доменов: субстрат-связывающего, крышки и регуляторного (рис. 9) [31]. Структура связывающего домена построена из β-сэндвича, внутрь которого помещается аминокислотная цепочка недоструктурированного белка-клиента. Удержание происходит из-за сродства β-сэндвича к нейтральным гидрофобным аминокислотным остаткам. Желобок получается достаточно длинный, чтобы взаимодействовать с участками размером до семи аминокислот. Домен-крышка закрывает β-сэндвич, таким образом помогая удерживать субстрат внутри.
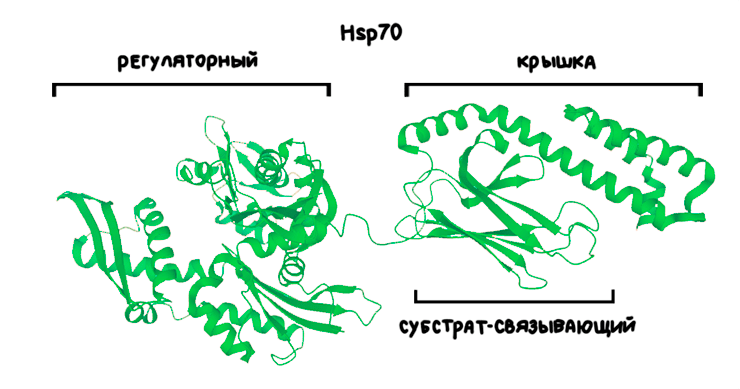
Рисунок 9. Структура молекулярного шаперона Hsp70 (DnaK) из бактерий Escherichia coli
[32], рисунок адаптирован
Регуляторный домен связывает АТФ (аденозинтрифосфат) и гидролизует его до АДФ (аденозиндифосфата). Обмен АТФ и АДФ влияет на конформацию двух других доменов, что контролирует их работу. Этот процесс называется АТФ-зависимой регуляцией. В итоге, когда регуляторный домен связан с АТФ, крышка открыта, а белки-клиенты связываются и высвобождаются относительно быстро. Когда же он связан с АДФ, крышка закрыта, а белки-клиенты крепко удерживаются в β-сэндвиче [33].
Такие циклы связывания-высвобождения во многих случаях будут энергетически смещать субстрат к более простым конформациям — по сравнению с теми, что были до взаимодействия с шапероном. Затем, после высвобождения, субстрат может повторно включиться в процесс фолдинга или начать взаимодействовать с нужным партнером. Молекулы, которым для сворачивания требуется побольше времени, будут повторно связываться с Hsp70, что поможет защитить их от агрегации. Повторное связывание может также привести к структурной перестройке и, возможно, устранению кинетических барьеров в процессе фолдинга [34].
Белки Hsp70 при поиске субстрата полагаются на помощников — кошаперонов класса Hsp40, которые сначала связываются с открытыми гидрофобными участками на ненативных белках и затем привлекают к этому месту Hsp70 [35]. Помимо этого, с Hsp70 может взаимодействовать множество других кошаперонов, например Hsp110 и sHsp. Все они наделяют систему Hsp70 широкими функциональными возможностями, позволяя участвовать не только в первоначальном сворачивании зарождающихся цепей, но и в поддержании белковой конформации, борьбе с агрегатами и нацеливании белков на деградацию [36–38].
В действительности, текущие знания о механизме работы Hsp70 сильно ограничены. Из-за сложности работы с не полностью свернутыми белками существует сравнительно мало структурных данных о характере взаимодействия Hsp70 со своими клиентами. Помимо этого, большая часть современного понимания работы Hsp70 основана на моделях с очищенными компонентами, изолированными от остального клеточного содержимого, в том числе от партнерских шаперонов. Таким образом, существует настоятельная необходимость в дальнейшем углублении знаний о работе Hsp70.
Самых непослушных — в клетку! Для перевоспитания
Однако в клетке есть белки, которым и такой заботы недостаточно. Таких товарищей всего около 10% протеома, но среди них есть очень важные белки, сталкивающиеся с высокими энергетическими барьерами при сворачивании. Например, это компоненты клеточного скелета — актины и тубулины, а также регуляторы клеточного цикла, такие как Cdc20 и p53 [39–42]. Подобные белки не могут достигнуть своих функциональных состояний на Hsp70 и после нескольких циклов на нем они переносятся в специальные бочкообразные супершапероны — шаперонины.
К шаперонинам относятся такие громадины как бактериальные GroEL/GroES, Hsp60 в митохондриях и TRiC (CCT) в цитозоле эукариот. Размеры этих комплексов действительно внушительные ~800–1000 кДа (для сравнения, в среднем белки весят 50–100 кДа). Все они немного отличаются по структуре друг от друга, но при этом поразительно похожи по общей сути. Это мультимерные (состоящие из большого числа простых мономеров) цилиндрические комплексы, похожие на большие бочки (рис. 10). Такая замысловатая структура полностью определяется принципом их работы — временной изоляции отдельных белков внутри полости шаперонина, чтобы они могли складываться, не поддаваясь агрегации [43], [44].

Рисунок 10. Структура шаперонина TRiC в открытом состоянии (два рисунка справа). Разные цвета показывают 16 отдельных мономеров. Слева показана структура такого мономера.
[45], рисунок адаптирован
После обнаружения потенциального клиента, шаперонины как бы проглатывают его внутрь себя и АТФ-зависимо закрывают внутреннюю полость (рис. 11). Внутри у шаперонинов, как в норвежской тюрьме, налажена благоприятная среда для перевоспитания. Внутренняя стенка высокогидрофильная, с определенным расположением положительно и отрицательно заряженных групп [46–48]. Пептид чувствует себя внутри бочки безопасно, что позволяет ему, никого не стесняясь, принять свою функциональную конформацию. Вполне возможно, что шаперонин в ходе работы изменяет положение своих стенок, тем самым как бы сминая белковую молекулу внутри и способствуя более продуктивному фолдингу. В конце «бочка» открывается, и окончательно свернутый белок выходит на свободу.
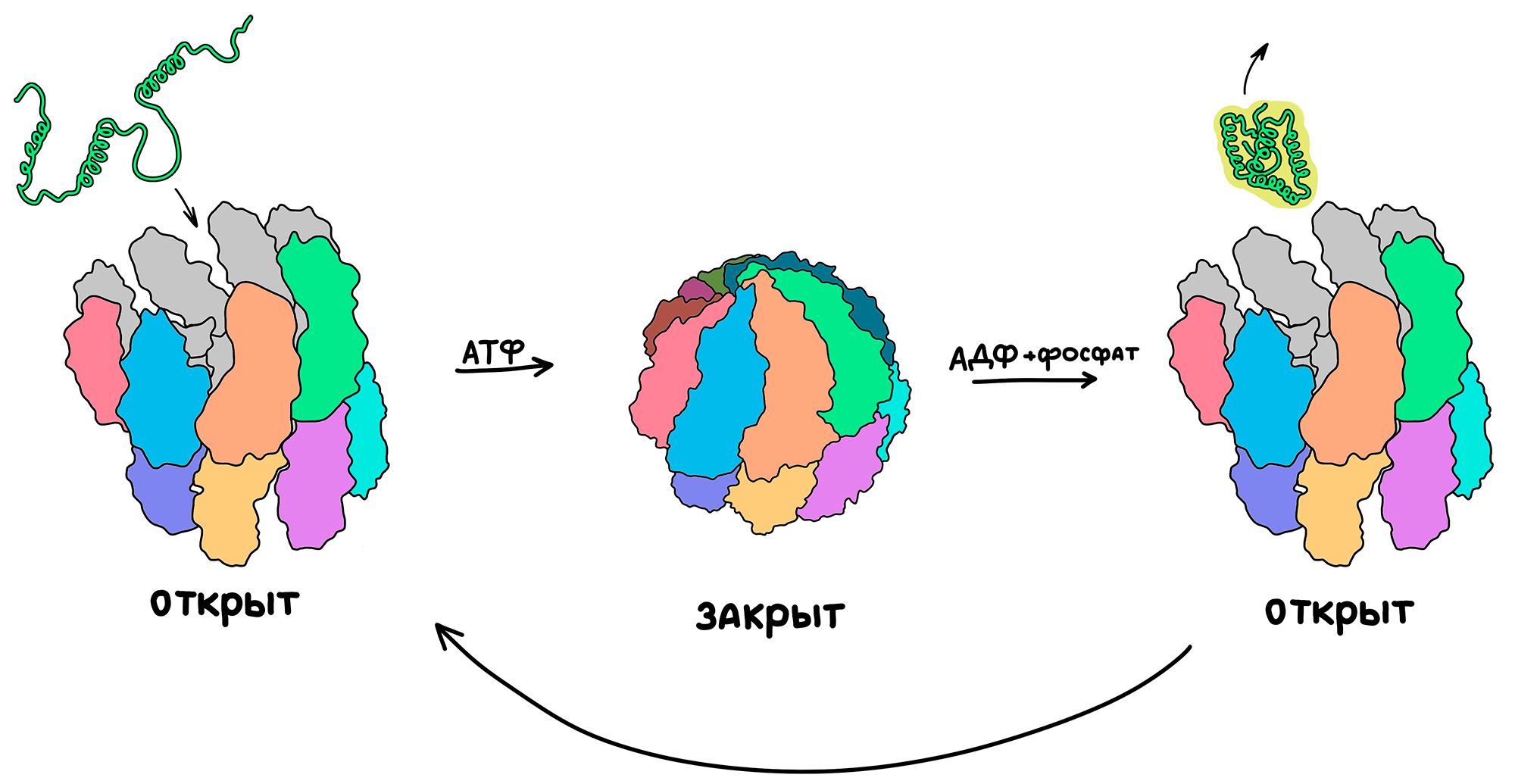
Рисунок 11. Рабочий цикл шаперонина TRiC начинается с узнавания недоструктурированного белка. Затем этот белок «проглатывается» во внутреннюю полость, которая закрывается механизмом, напоминающим диафрагму камеры или радужку глаза [49]. После структурных преобразований белка-клиента шаперонин открывается, высвобождая готовый белок.
рисунок автора статьи
Включая в себя развернутый белок, по одной молекуле за раз, шаперонины помогают избегать нарушения свертывания путем агрегации [50]. Кроме того, особое расположение аминокислотных радикалов на внутренней поверхности шаперонина направляет пептид на правильный путь фолдинга и значительно ускоряет этот процесс [51].
Многие исследователи отмечают влияние шаперонинов на развитие некоторых патологических состояний. Например, известно, что TRiC предотвращает накопление токсичных агрегатов полиглутаминового хантингтина, белка болезни Хантингтона [52–54]. Поэтому нарушения в работе TRiC способствуют прогрессированию заболевания. Также мутации в некоторых субъединицах комплекса TRiC связаны с сенсорной нейропатией [55], [56]. Подобные данные накоплены и для митохондриального Hsp60. Мутации в кодирующих этот комплекс генах могут вызывать нарушения миелинизации нервных волокон и нейродегенеративные состояния [57], [58]. Постепенное расширение перечня патологических процессов, в которых задействованы шаперонины, подчеркивает их глобальное значение в поддержании протеома и правильной клеточной физиологии.
Шаперонины — современная и перспективная область исследований, где предстоит еще много чего изучить. Например, многие теории и модели разработаны для бактериальных GroEL/GroES, однако они неприменимы к эукариотическому TRiC ввиду некоторых структурных различий. К тому же, тонкости механизма, по которому шаперонины внутри себя способствуют фолдингу пептида, тоже пока плохо понятны. Полагаю, можно в скором времени ожидать ответы на эти важные вопросы, так как внимание ученых эти шапероны-левиафаны уже точно привлекли.
Hsp90 — эволюционный конденсатор
Ниже по течению от Hsp70 действует еще одна система шаперонов — Hsp90. Это большие белки, живущие почти в каждом компартменте эукариотических клеток [59]. Хотя, кристаллические структуры Hsp90 уже давно получены, подробный механизм их работы окончательно не выяснен (рис. 12) [60].
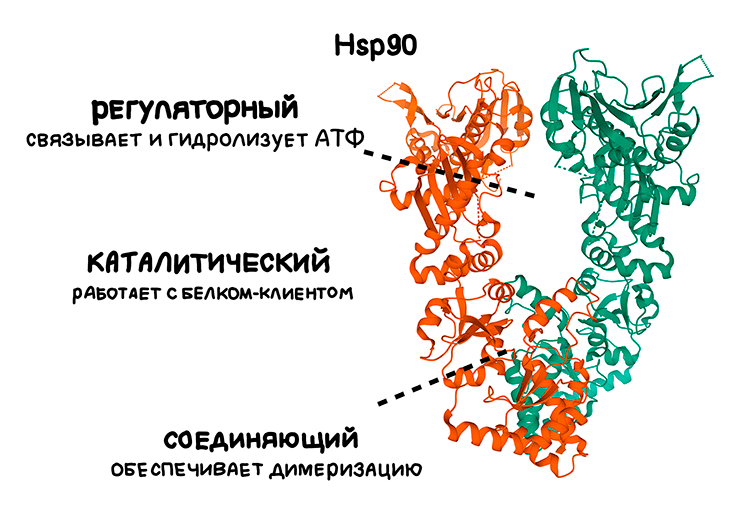
Рисунок 12. Структура Hsp90. Это семейство шаперонов функционирует в форме димера — комплекса из двух субъединиц (показаны разными цветами). Субъединицы удерживаются вместе благодаря «соединяющим» доменам. На другом конце каждого мономера расположен регуляторный домен, который обеспечивает замыкание димера в кольцо для удержания белка-клиента во время работы над ним.
[61], рисунок адаптирован
Hsp90 выделяются своими уникальными функциями. Хоть для фолдинга большинства обычных белков Hsp90 не требуются, они невероятно важны в качестве шаперонов для сигнальных белков-переключателей, характеризующихся конформационной нестабильностью. Посредством слабых взаимодействий Hsp90 сохраняют эти нестабильные сигнальные белки готовыми к активации. Благодаря многочисленным взаимодействиям Hsp90 обеспечивает правильное протекание различных клеточных процессов, таких как регуляция клеточного цикла и апоптоз (программируемая клеточная гибель), поддержание теломер, везикулярный транспорт, врожденный иммунитет, целевая деградация белка и т.д. (рис. 13). Поражает то, что Hsp90 способен точно взаимодействовать с таким широким ассортиментом белков-партнеров. По этой причине Hsp90 иногда называют одним из самых «липких» белков в клетке.
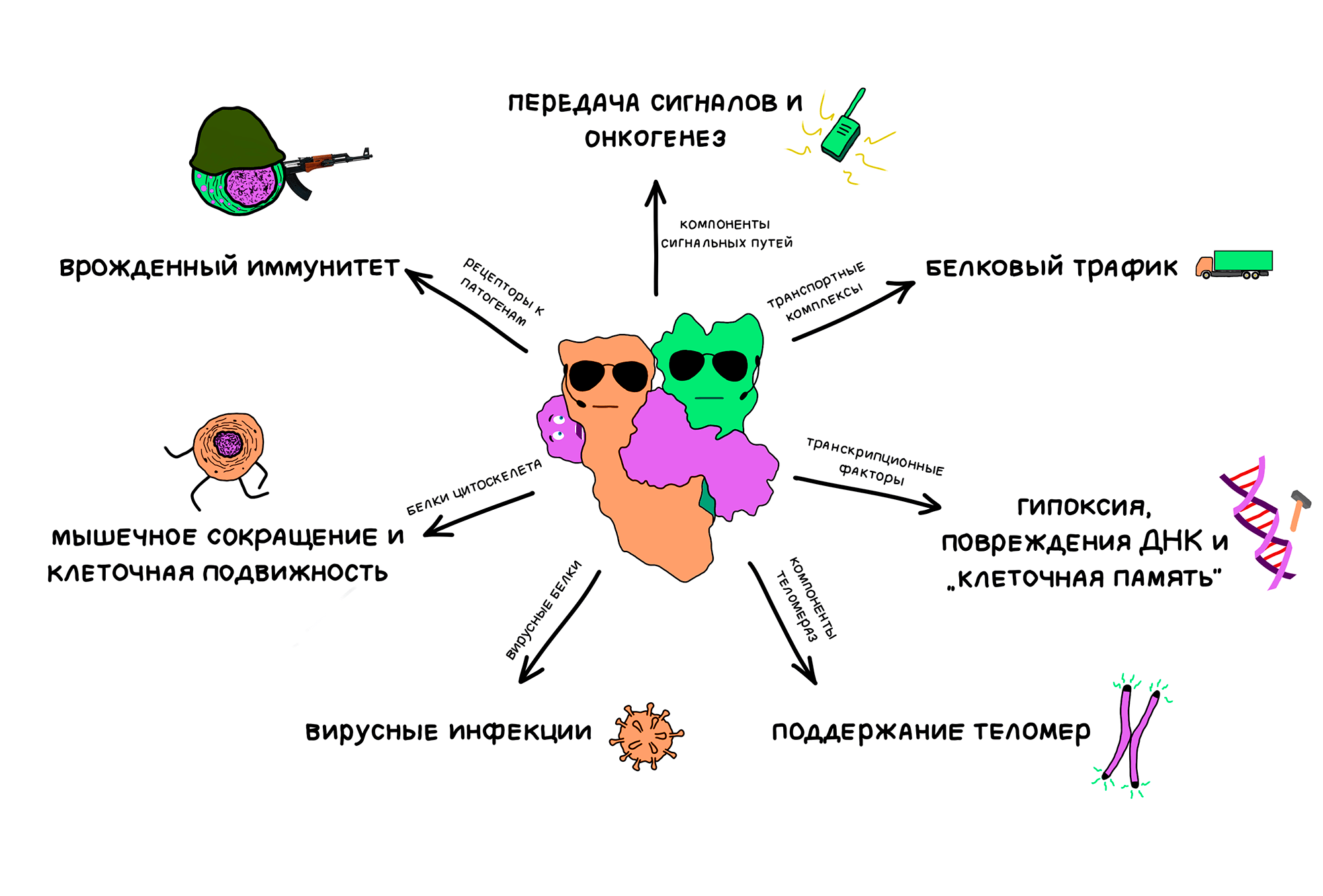
Рисунок 13. Благодаря широкому разнообразию белков-клиентов, шапероны Hsp90 могут влиять на множество клеточных процессов
рисунок автора статьи
Примечательно, что эволюционное развитие клеточных сигнальных путей во многом могло быть обязано белкам системы Hsp90 [62]. Теория эволюции гласит, что материалом для эволюции являются мутации. Ученые полагают, что белки Hsp90 способны сглаживать структурные эффекты мутаций и тем самым защищать мутантные белки от деградации. Таким образом, Hsp90 могут позволить наследственным изменениям существовать в природе, находясь в молчащем состоянии [63–65]. Hsp90 балансируют проявления этих изменений, способствуя накоплению мутаций в нейтральных условиях среды. Когда этот баланс нарушается, генетические изменения начинают проявляться, и естественный отбор может привести к распространению и закреплению новых признаков.
Особенно интересна роль Hsp90 при изменениях, связанных с процессами онкогенеза (образования опухолевых клеток). На молекулярном уровне повышенная активность шаперонов Hsp90 может помогать опухолевым клеткам взламывать свою внутреннюю сигнальную систему и, таким образом, избегать гибели-апоптоза [66]. Это облегчает их выживание и рост, делая их неподвластными нормальному контролю и устойчивыми к защитным механизмам хозяина [67]. Тем не менее ввиду своей функции, Hsp90 играет более сложную роль в онкогенезе, чем просто ингибирование апоптоза.
По мере изучения Hsp90, возрастал интерес к фармакологическому воздействию на функции этих шаперонов с целью лечения рака [68], [69]. Несколько низкомолекулярных препаратов, нацеленных на Hsp90, были идентифицированы как потенциальные противораковые агенты. Интерес к Hsp90 как к противоопухолевой мишени сохраняется и по сей день [70], однако опыт последних десятилетий говорит, что модуляторы Hsp90 вряд ли окажутся полезными в качестве первичных лекарств. Скорее они будут актуальны в качестве усилителей эффекта других терапевтических воздействий.
Малые белки теплового шока в поддержании большого протеома
Многие белки нуждаются в конформационной поддержке на протяжении всего срока их работы, ведь в клетке им приходится не сладко. Белки часто работают на пороге стабильности, и их состояние может быть поставлено под сомнение в условиях стресса. Кроме того, как уже говорилось ранее, многие белки (особенно сигнальные) содержат по своей природе неструктурированные области, важные для их функции.
Такая белковая динамичность вынуждает клетку содержать сеть поддерживающих шаперонов. Помимо уже рассмотренных Hsp70 и Hsp90, важную роль здесь играют так называемые малые белки теплового шока (small heat shock proteins, sHsp). Это широко распространенные и разнообразные белки, часто формирующие крупные олигомерные сборки [71]. Мономеры в них связываются нековалентными взаимодействиями. Количество мономеров в конечном олигомере бывает разным, в среднем 12–24 (рис. 14).
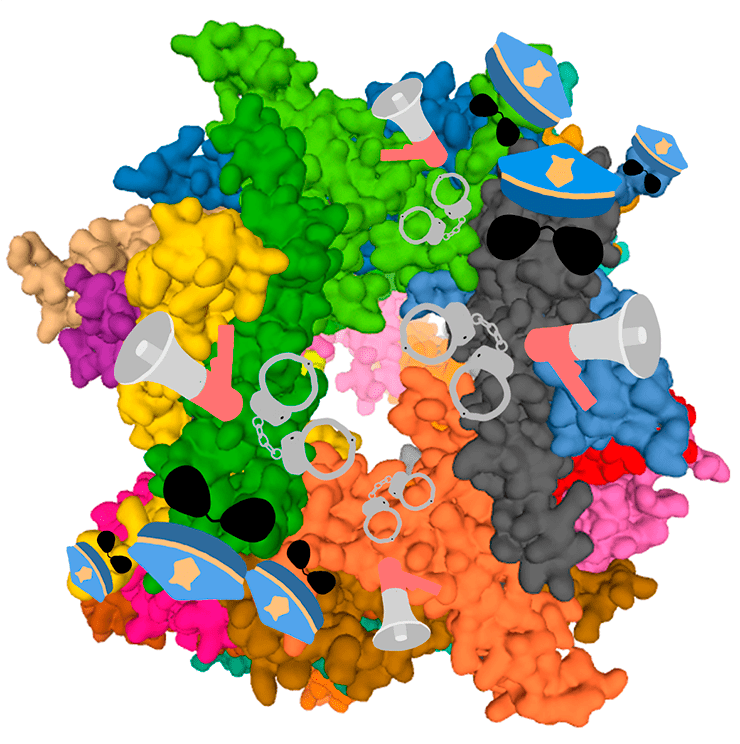
Рисунок 14. Художественное изображение олигомерного комплекса, составленного из 24 мономерных белков семейства sHsp
рисунок автора статьи
Еще одно свойство — неумение связывать и гидролизовать AТФ, но зато они могут узнавать и захватывать ненативные белки. «Подозреваемых» задерживают до тех пор, пока их не возьмут на себя АТФ-зависимые шапероны, вроде Hsp70 и Hsp90. Таким образом, sHsp создают и стабилизируют резервуар неправильно свернутых белков для последующего рефолдинга.
Предполагается, что образование мультимерных комплексов играет регуляторную роль [72]. В зависимости от условий, какие-то компоненты уходят из комплекса, какие-то приходят. Такие перестановки позволяют настраивать связывающие способности всего комплекса.
При остром стрессе, например воздействии тепла, 10–30% цитозольных белков становятся потенциальными клиентами sHsp, что указывает на важность их роли в клетке [73]. Особенно значимы sHsp в те моменты, когда сеть протеостаза перегружена и не успевает оперативно обрабатывать все расхлябанные белки. Они начинают агрегировать, и с этими сборками связываются sHsp, что помогает последующей обработке ненативных белков [74], [75].
Малые белки теплового шока очень разнообразны: каждый член семейства обладает уникальными свойствами [76]. Благодаря этому, sHsp задействованы во множестве клеточных процессов, а различные мутации в этих белках коррелируют с развитием ряда врожденных заболеваний, например катаракты, различных типов миопатии и некоторых нейродегенеративных нарушений.
Утилизация путем деградации
Жизнь белков в клетке полна интриг. Как бы сеть протеостаза ни старалась, всё равно белки время от времени теряют свою нативную конформацию. Грустно об этом говорить, но после неудачных попыток рефолдинга этих белков может возникнуть необходимость в их утилизации. Такие бракованные белки подвергаются деградации в основном по двум механизмам: через убиквитин-протеасомную систему (UPS) или аутофагию.
Убиквитин-протеасомная система устроена остроумно [77]. Ее работу можно условно поделить на две части. Первая заключается в том, чтобы неправильно сложенный белок пометить специальной «черной меткой». Вторая часть обеспечивает химическое разрезание помеченного белка.
Удивительный убиквитин
В качестве «черной метки» выступает по-настоящему удивительный белок убиквитин (от англ. ubiquitous — «вездесущий») [78], [79]. Ученые долго не могли выявить его функцию, пока в 1980 г. не было объявлено о его роли в качестве «черной метки».
Присоединение убиквитина к белку-мишени называется убиквитинилированием [80]. Это довольно сложный биохимический процесс, осуществляемый комплексом из трех ферментов — белков Е1, Е2 и Е3, которые работают циклично друг за другом (рис. 15) [81]. Е1 активирует убиквитин, проводя химические модификации. Затем он передает его в руки E2, который выступает в качестве своеобразного «держателя» для фермента убиквитинлигазы — E3. Последняя катализирует образование ковалентной химической связи убиквитина с белком-мишенью.
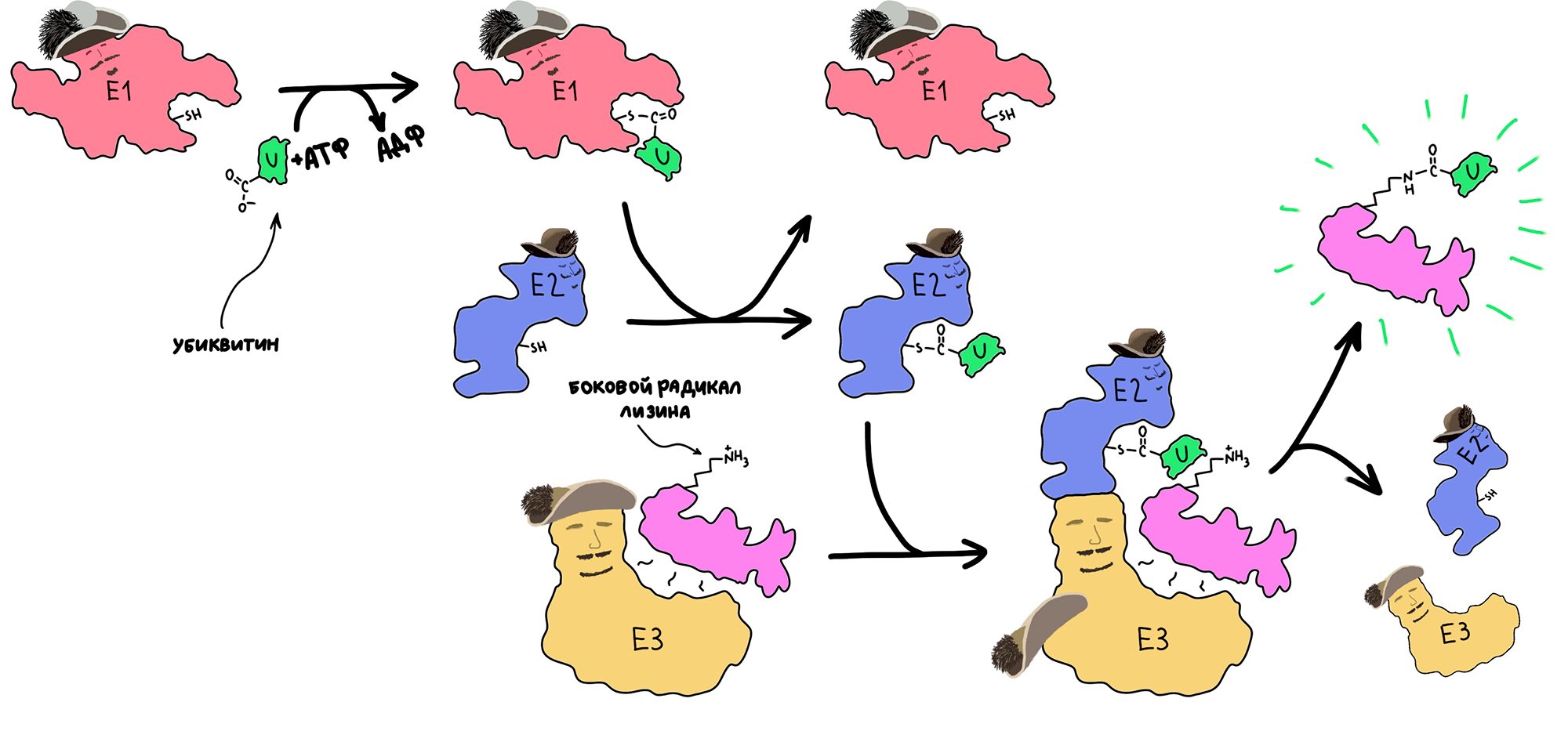
Рисунок 15. Присоединение убиквитина осуществляют три фермента
рисунок автора статьи
Казалось бы, зачем такая сложность? Во-первых, такая каскадная система позволяет тонко регулировать убиквитинилирование сразу на нескольких стадиях. Во-вторых, использование нескольких белков открывает пространство для эволюционного творчества. Так, на фоне консервативных Е1 и Е2, убиквитинлигазы Е3 очень вариативны, что обеспечивает широкую адаптацию под самые различные белки-мишени.
Интересно то, что убиквитин присоединяется к мишени посредством особой изопептидной связи. Она похожа на пептидную, которой соединяются аминокислоты в белках. Только в данном случае С-концевой глицин убиквитина присоединяется не к ɑ-аминогруппе, а к боковой цепи лизина белка-мишени, благодаря присутствию у лизина дополнительной аминогруппы.
Присоединять убиквитин к белку-мишени через остаток лизина — это канонический вариант. На самом деле, присоединение может происходить и по другим аминокислотам (серин, треонин, цистеин), а также через свободную аминогруппу на N-конце белка [82].
При всем при этом, убиквитинилирование с целью деградации белка должно произойти многократно с образованием длинной цепочки из последовательно соединенных убиквитинов (рис. 16). Такой процесс называется полиубиквитинилированием. Тут аналогично, Е3 присоединяет С-концевой глицин следующего убиквитина к лизину предыдущего убиквитина. Поэтому на самом деле, именно цепочка из убиквитинов и есть та самая «черная метка».
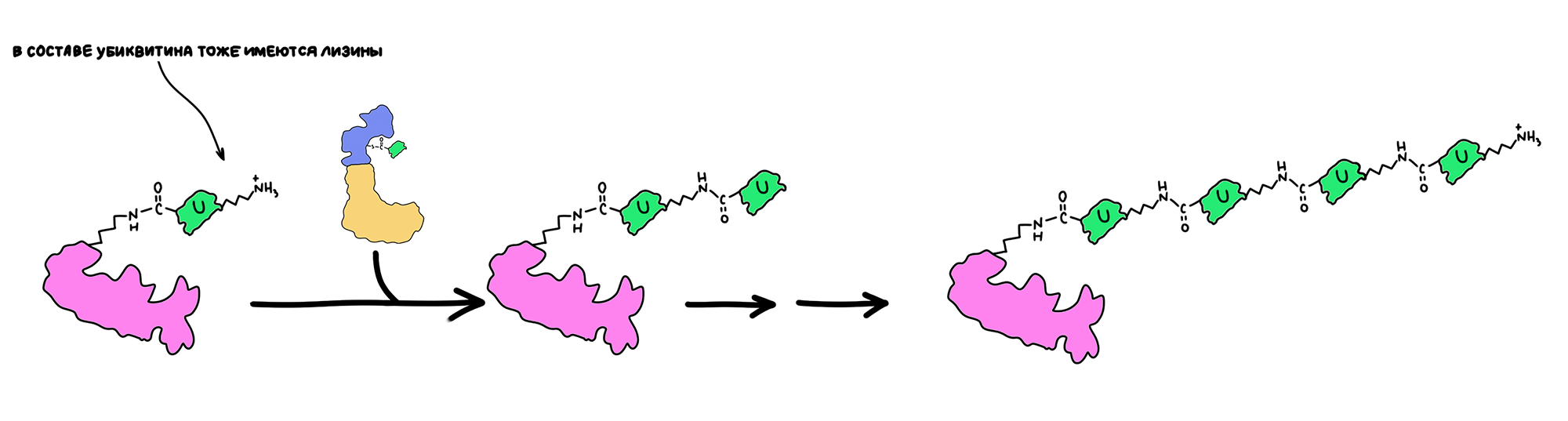
Рисунок 16. Благодаря наличию в составе убиквитина остатков аминокислоты лизина появляется возможность многократного убиквитинилирования. Последовательное присоединение убиквитинов друг за другом наращивает полиубиквитиновую цепочку.
рисунок автора статьи
Интересно, что, поскольку доступных лизинов на убиквитине аж семь, то и наращивать полиубиквитиновую цепочку можно различным образом. Благодаря горячему интересу ученых, было показано, что по-разному собранные полиубиквитиновые метки выполняют различные «мирные задачи», не связанные с утилизацией. Это свойство убиквитина позволяет ему быть мощным молекулярным инструментом модификации белков [83]. Сейчас в этом направлении активно ведутся исследования. Однако в контексте нынешней статьи мы рассматриваем работу убиквитина лишь в качестве «черной метки». Вполне логично, что убиквитинилирование синхронизировано с сетью протеостаза. Известно, что системы шаперонов Hsp70 и Hsp90 тесно вовлечены в эти процессы (рис. 17) [84].
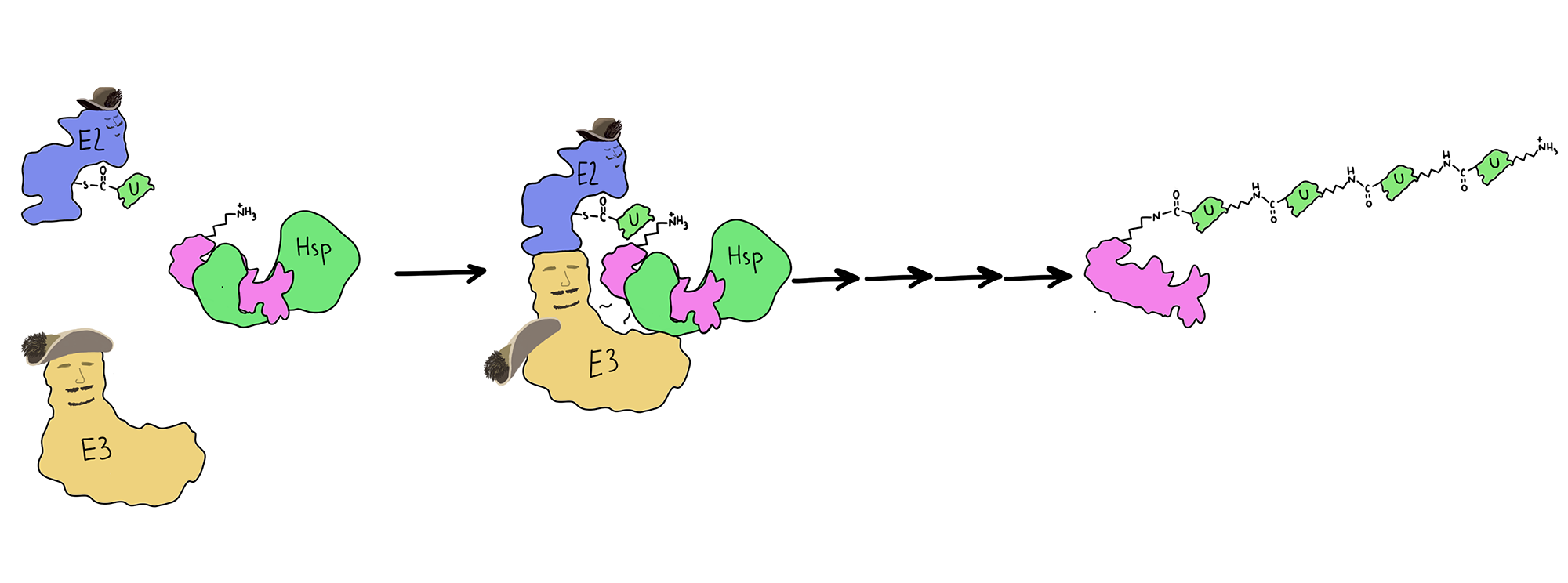
Рисунок 17. В случае неудачи при обработке клиента, шаперон может обратиться за помощью к ферментам убиквитинилирования, которые любезно навесят полиубиквитиновую цепь на неправильный белок
рисунок автора статьи
Белковый шредер
Минимум четыре убиквитина, последовательно связанные через лизин-48, распознаются грозой всех неправильных белков — протеасомой. Это еще одна бочкообразная участница сети протеостаза (рис. 18). Размер ее значительно больше, чем у шаперонов — около 2000 кДа. Соответственно размеру, протеасома обладает внушительной сложностью строения.
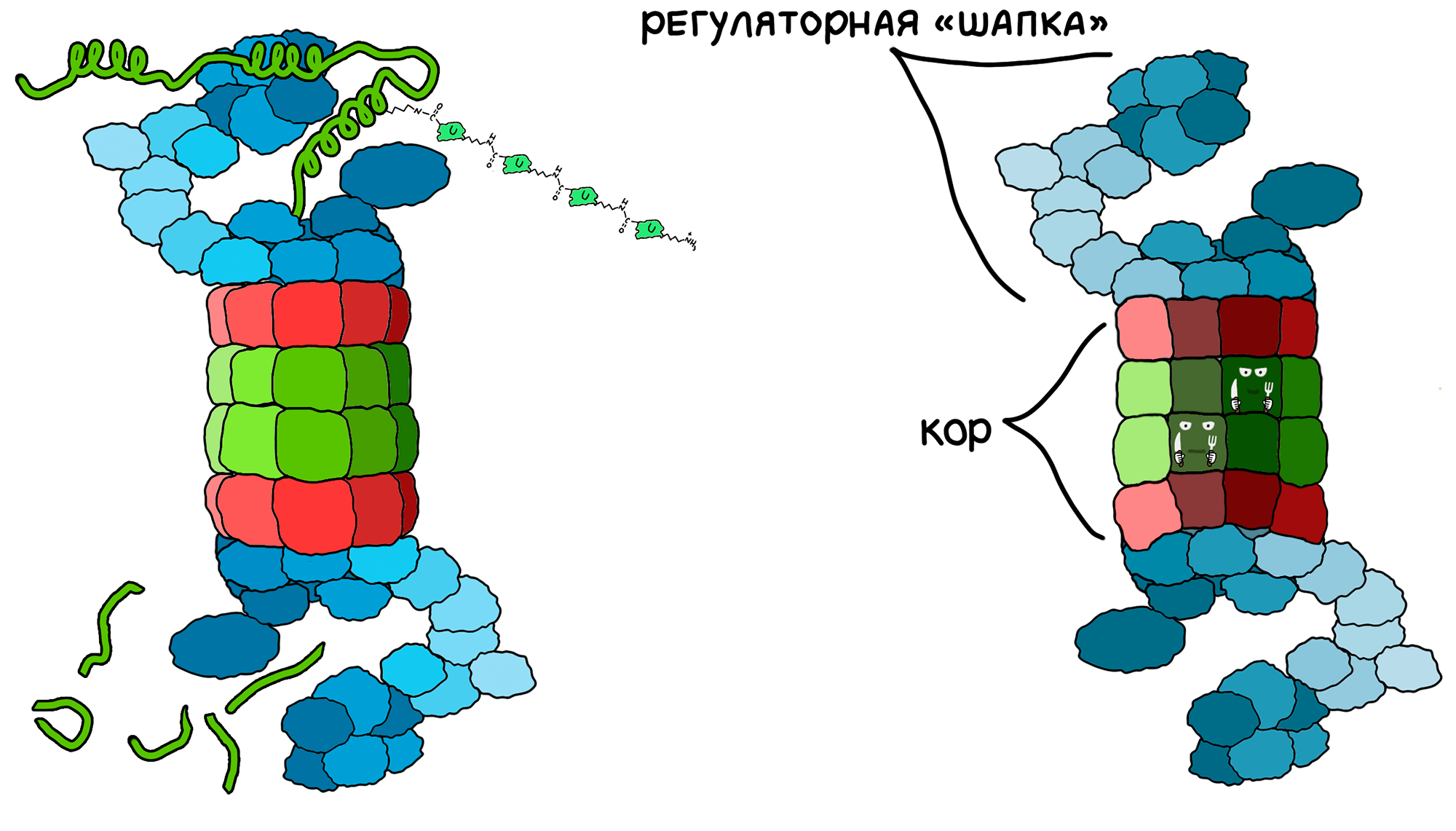
Рисунок 18. Протеасома — «белковый шредер» из множества субъединиц. Центральная часть (кор) цилиндрическая, на ее внутренних стенках располагаются активные сайты. Белок-жертва в линейной форме протаскивается через полость кора, а активные сайты разрезают пептидные связи, в результате чего белок разбирается на короткие фрагменты.
рисунок автора статьи
Ее структуру составляет центральная кольцевая субъединица (кор) и две шапки по краям. Шапки представляют собой мультибелковые комплексы, контролирующие работу протеасомы [85]. После узнавания на шапке, белок-жертва АТФ-зависимо разворачивается специальным молекулярным моторчиком. Примерно тут же с жертвы снимается полиубиквитиновая метка [86]. Не уничтожать же понапрасну убиквитин!
После всех этих подготовительных этапов белок-жертва направляется в полость кора. Коровые субъединицы очень разнообразны, в сумме они составляют полый цилиндр, составленный из четырех колец, каждое из которых содержит по семь субъединиц.
Развернутые белковые жертвы попадают внутрь коровой частицы протеасомы через канал, работающий как затвор на фотоаппарате [87]. Этот канал специально узок, чтобы позволять проходить только развернутым линеаризованным полипептидам.
Кульминация в устройстве протеасомы — центральная протеолитическая камера, образованная субъединицами внутренних колец [88]. В составе каждого из них есть протеолитические субъединицы, чьи рабочие домены направлены внутрь полости. Эти субъединицы осуществляют протеолиз — разрезание белков на мелкие пептиды посредством разрыва пептидных связей (рис. 19). Центральная камера эффективно улавливает белки до тех пор, пока они не укоротятся до пептидов длиной около 7–9 аминокислот [89].
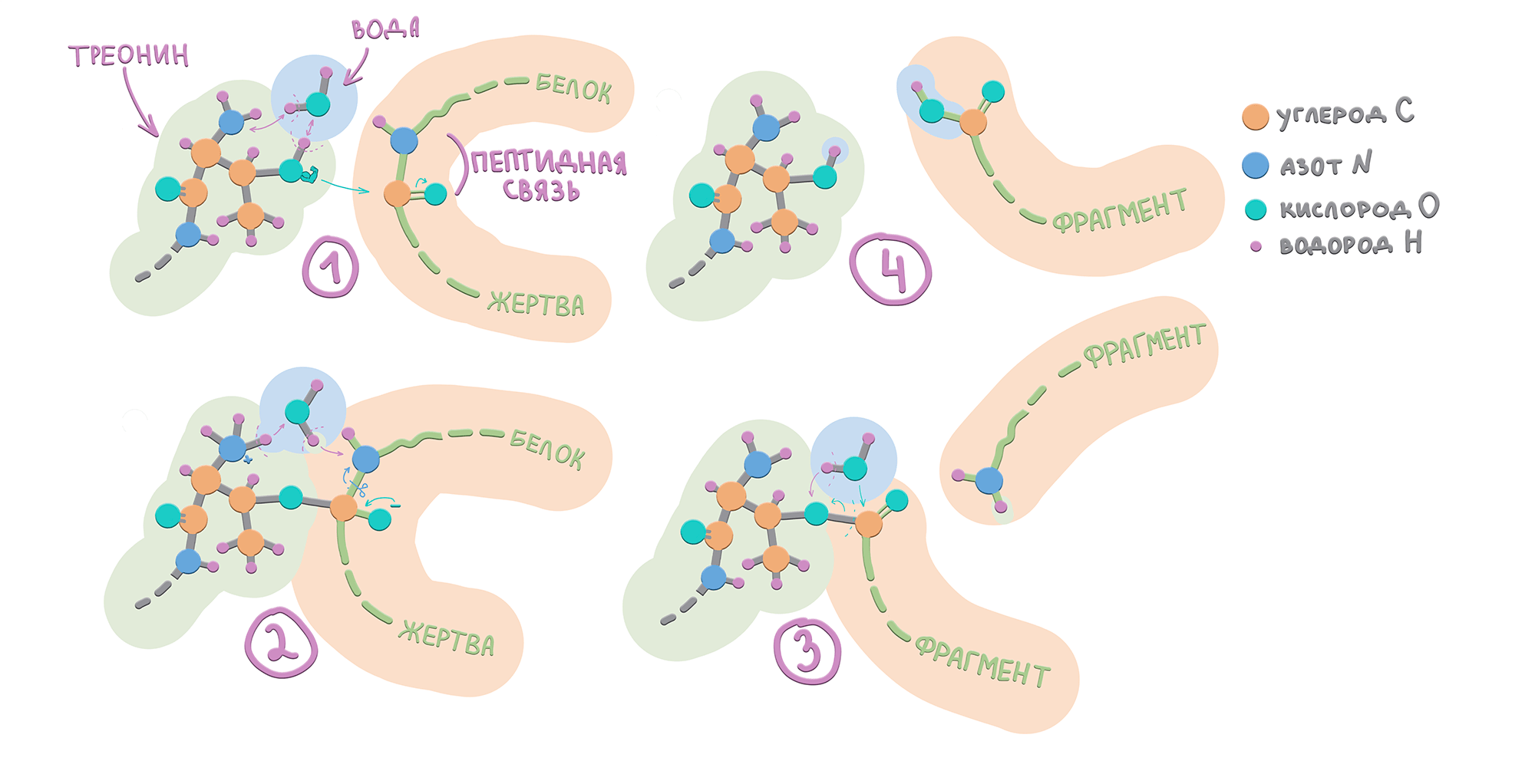
Рисунок 19. В активном сайте протеасомы содержится N-концевой остаток аминокислоты треонина [90], боковая цепь которой содержит гидроксильную группу (-OH), чей атом кислорода жаждет с кем-нибудь поделиться электронами. Этот кислород производит атаку — насильно делится электронной парой с атомом углерода в пептидной связи с образованием новой химической связи (1). Эта атака вынуждает углерод порвать связь с азотом, иначе электронов будет слишком много (2). Таким образом пептидная связь разрывается, и один фрагмент высвобождается (3). Второй фрагмент связан через кислород с треонином. Затем приходит вода и помогает отсоединить углерод от треонина, восстанавливается карбоксильная группа на фрагменте и освобождается активный центр протеасомы (4). Цикл может повторяться много раз.
рисунок автора статьи
Протеасома — невероятно важный белковый шредер. Несколько десятилетий интенсивных исследований выявили фундаментальную значимость протеасом практически для каждого клеточного процесса [91]. Ее работа влияет на клеточный цикл, рост и дифференцировку клеток, транскрипцию генов, передачу сигналов и апоптоз. Неправильное функционирование протеасом приводит к тому, что протеолитическая активность снижается и накапливаются поврежденные и неправильно свернутые белки. Поэтому предполагается, что снижение активности протеасом может быть центральным фактором при старении и возникновении множества заболеваний: сердечно-сосудистых, аутоиммунных и особенно нейродегенеративных [92], [93].
Протеасома также вносит незаменимый вклад в систему адаптивного иммунитета, отвечая за генерацию пептидов для главного комплекса гистосовместимости I (MHC I). Таким образом, нарушение активности протеасом будет влиять на работу иммунной системы [94]. Помимо угрозы жизненно важным функциям цитозольных процессов и органелл, накапливающиеся отходы также будут препятствовать круговороту аминокислот и убиквитинов, которые необходимы для жизнедеятельности клеток. Некоторые, но не все из этих последствий могут быть смягчены компенсаторными действиями других частей сети протеостаза.
Молекулярная «пищеварительная система»
Главный партнер в нелегком деле утилизации белковых отходов — система аутофагии [95]. Это сложный многогранный процесс, в ходе которого различные клеточные компоненты из цитоплазмы тем или иным образом отправляются на переваривание внутрь лизосом. Лизосомы представляют собой мембранные пузырьки с агрессивным кислым содержимым, которое химически разрушает то, что попадает внутрь. Таким образом, лизосомы по своей сути очень напоминают желудок, только на клеточном уровне. Внутри лизосом находится множество гидролитических ферментов-разрушителей, включая различные протеазы, режущие пептидные связи в белках.
Мы помним, что протеасомы отвечают за деградацию отдельных белков. Аутофагия же предпочтительна для расщепления крупных цитоплазматических компонентов, которые зачастую попросту не помещаются в протеасому. Это могут быть белковые агрегаты, целые органеллы, липидные капли и даже бактерии. Клетки реализуют аутофагию по разным механизмам, отличающимся друг от друга способом доставки жертв в лизосому [96].
Наиболее характерной формой аутофагии является макроаутофагия (в литературе ее часто называют просто аутофагией). Ее отличительная черта — постепенное поглощение клеточного материала мембранной структурой (фагофором), которая затем, замыкаясь, образует аутофагосому (рис. 20) [97]. Зрелые аутофагосомы транспортируются в области, где находится много лизосом. В конечном итоге аутофагосомы сливаются с лизосомами, что приводит к расщеплению содержащихся внутри компонентов на мономерные составляющие.
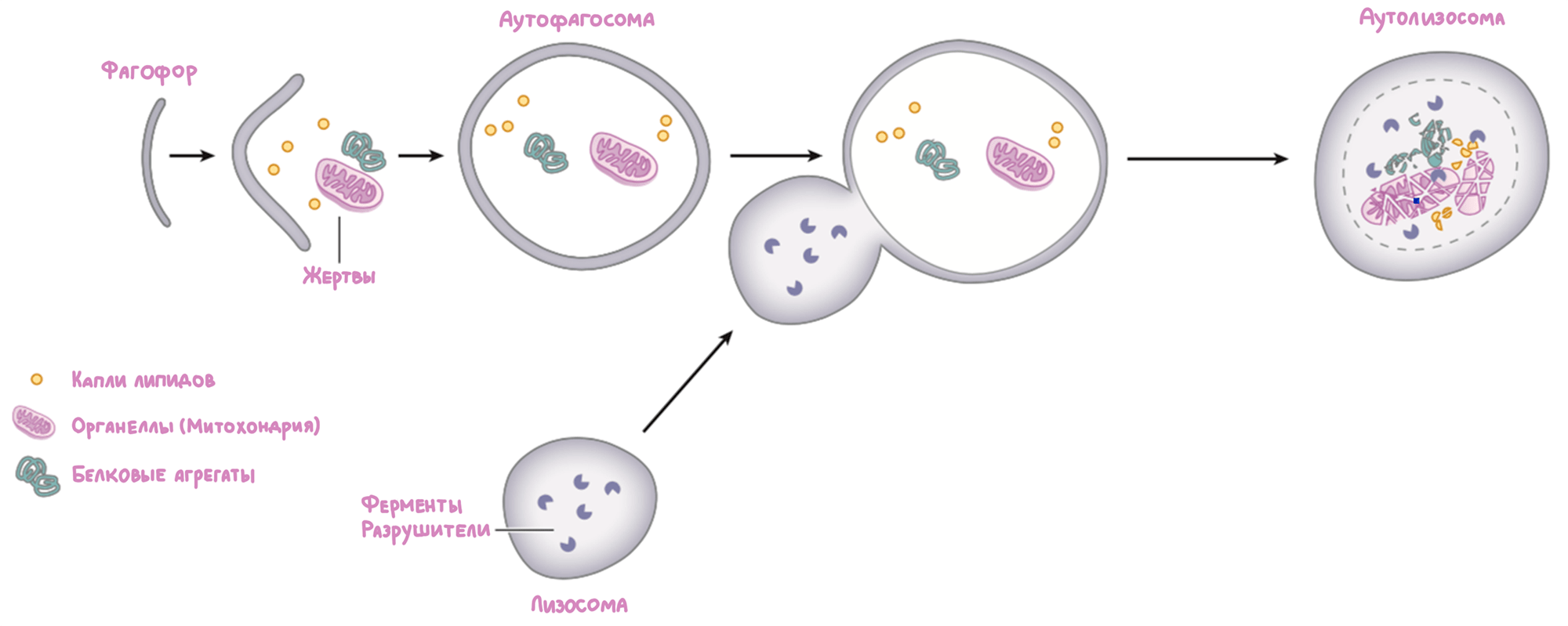
Рисунок 20. Макроаутофагия
[91], рисунок адаптирован
Так макроаутофагия обеспечивает клетку строительными материалами во время дефицита питательных веществ, а также устраняет нежелательное клеточное содержимое.
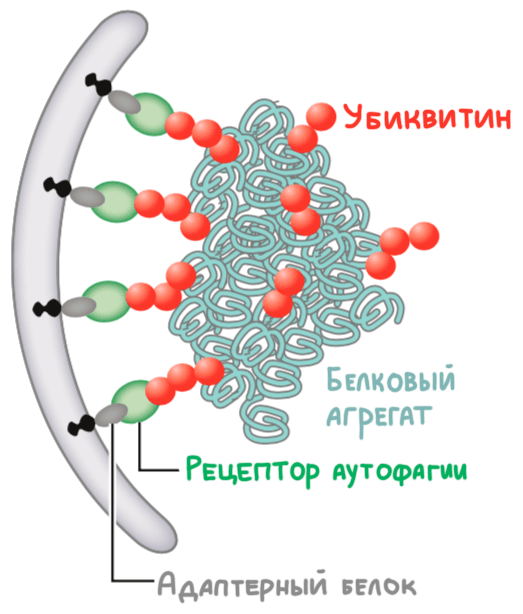
Рисунок 21. Селективная макроаутофагия обеспечивается рецепторами аутофагии — особыми белками, которые узнают полиубиквитинилированные мишени и способствуют их поглощению фагофором
[91], рисунок адаптирован
Считается, что при недостатке питательных веществ или факторов роста аутофагия неселективна и, грубо говоря, направлена на деградацию любого цитозольного белка и других макромолекул, лишь бы обеспечить клетку питательными веществами. Тем не менее макроаутофагия также может избирательно утилизировать клеточные структуры, в том числе испорченные протеасомы и белковые агрегаты. Тогда такой процесс называют селективной макроаутофагией. В этом контексте она функционирует как важный защитный механизм, который может активироваться с помощью различных сигналов стресса [98]. Основными игроками тут являются белки-рецепторы макроаутофагии. Они специфично распознают жертву и крепко «привязывают» ее к зарождающемуся фагофору (рис. 21). В клетках человека неплохо изучен белковый рецептор макроаутофагии секвестосома-1 (SQSTM1), распознающая полиубиквитинированные белки и их агрегаты [99]. Критическая роль рецепторов макроаутофагии подчеркивается в недавних исследованиях. Было обнаружено большое число их мутантных форм при некоторых нейродегенеративных заболеваниях [100], [101].
LAMPовая аутофагия
В искусство тонкого поддержания протеома большой вклад вносит шаперон-опосредованная аутофагия (CMA). Этот тип селективной аутофагии белков до сих пор идентифицируют только в клетках млекопитающих [102]. Чтобы шаперон-опосредованная аутофагия заработала, цитозольный белок-мишень должен содержать особую пептидную последовательность из пяти аминокислот — мотив KFERQ. Анализ показывает, что его содержат около 30% растворимых цитозольных белков.
«Обнажение» мотива обычно происходит при частичном разворачивании белка, диссоциации белковых комплексов или высвобождении белка из клеточных мембран. Он узнается белком HSPA8, представителем семейства Hsp70. HSPA8 связывает жертву и направляет ее к лизосоме.
Необычно то, как белок-жертва попадает внутрь лизосомы. Это происходит при участии особых белков LAMP-2A, которые пронизывают мембрану лизосомы и вместе могут формировать сквозной канал (рис. 22).
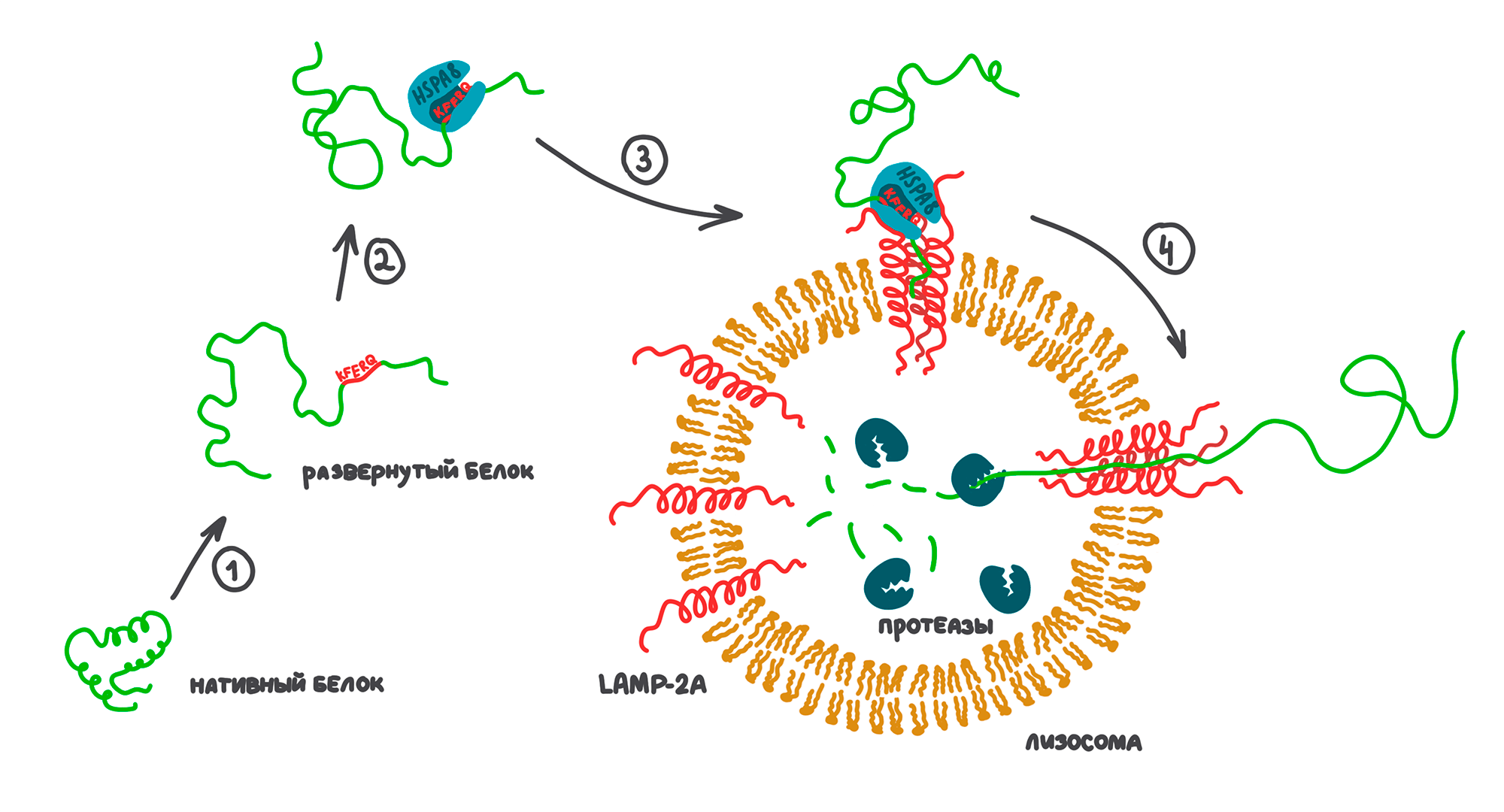
Рисунок 22. Шаперон-опосредованная аутофагия. Когда белок теряет нативную конформацию, содержащаяся в нем аминокислотная последовательность KFERQ становится видимой (1). Эту последовательность узнает белок HSPA8 (2). Связав клиента, HSPA8 тащит его к лизосоме. В мембрану лизосомы встроены белки LAMP-2A. Приход HSPA8 с клиентом приводит к объединению трех отдельных LAMP-2A в тройной комплекс (3). В середине этого комплекса формируется канал, через который развернутый белок протаскивается в полость лизосомы (4). В лизосоме этот белок расщепляется протеазами.
рисунок автора статьи
Преимущество СМА — лучшая селективность в отношении растворимых цитозольных белков. Это позволяет расщеплять неважные в данный момент белки и направлять их аминокислоты для синтеза жизненно необходимых компонентов [103]. Другая важная функция CMA — контроль качества белка посредством избирательной деградации. CMA активируется в ответ на стрессовые факторы, которые вызывают разворачивание белка [104–106].
«Эй, гражданина, ты туда не ходи, ты сюда ходи!»
Описанные выше системы контроля качества белка очень эффективны в поддержании клеточного протеостаза в естественных условиях. Однако при определенных патологических состояниях, например в результате генетических мутаций, могут накапливаться неправильно свернутые белки.
В таком случае, даже самые отчаянные попытки предотвратить, перестроить или разрушить бракованные белки могут потерпеть неудачу. Тогда, в качестве последней защитной меры, клетка идет на компромисс, позволяя неправильно свернутым белкам делать то, что они так хотят — агрегировать. Однако происходит это под чутким контролем самой клетки, в результате чего получаются менее токсичные агрегаты [107].
Агрегация также изолирует потенциально опасные ненужные белки, так что в этом аспекте она является защитной и облегчает последующие действия по контролю протеостаза [108]. При делении клеток такие агрегаты асимметрично распределяются в одну из дочерних клеток, в результате чего другая дочерняя клетка освобождается от накопленного балласта [109], [110].
Открытие и изучение этих агрегатов стало возможным благодаря развитию технологии визуализации живых клеток [111]. Она позволила отслеживать крупные молекулы в пространстве и времени в их естественной клеточной среде. При грамотном подходе, такой метод дает много информации о динамике и стадиях биологических процессов. Для визуализации используются хорошо видимые светящиеся флуоресцентные белки, которые сшивают с интересующим белком при помощи генной инженерии. Благодаря пришитому ярлыку, с помощью флуоресцентного микроскопа можно следить за белком внутри клетки [112], [113]. Далее открывается пространство для научного творчества. Исследователь может всячески воздействовать на клетку (например, вызывать накопление неправильно свернутых белков), а затем анализировать изменение свойств меченого объекта. Можно распознать изменение уровня синтеза белка по уровню флуоресценции или смену локализации белка, например, переброску из цитозоля в ядро. Также можно учитывать растворимость или взаимодействие с внутриклеточной средой.
В самом конце XX века в клетках млекопитающих идентифицировали агресомы [114]. Это нерастворимые белковые агрегаты, образующиеся путем АТФ-зависимой транспортировки белков вдоль микротрубочек в область микротрубочкового организатора. В перемещении участвуют моторные белки динеины. Образование агресомы происходит с участием особого белка виментина, из которого формируется своеобразная клетка, заковывающая ядро из агрегированного белка (рис 23).
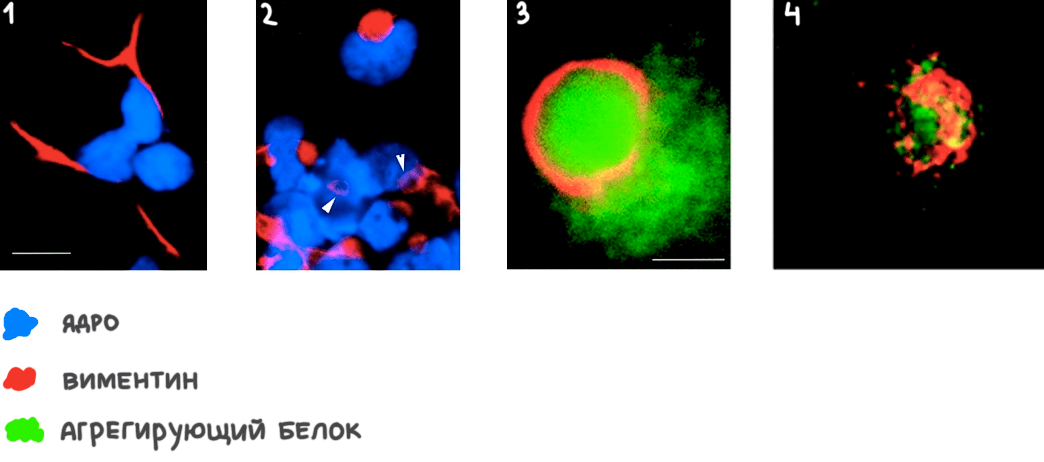
Рисунок 23. Фотографии клеток, полученные с помощью флуоресцентного микроскопа. Ядра окрашиваются бибензимидом — флуоресцентным красителем, который связывается с ДНК. Виментин окрашен с помощью флуоресцентно меченных антител. Агрегирующий белок был сшит в одну молекулу с зеленым флуоресцирующим белком (GFP). На фото (1) можно наблюдать ядро и организацию виментина. Фото (2) отражает перестройку сетей виментина в кольцевые и сферические формы в ответ на агрегацию белка. Фото (3) и (4) показывают совместную локализацию виментина и белковых агрегатов.
[114], рисунок адаптирован
Для отправки в агресомы белки могут быть помечены полиубиквитином. Также ненативные белки могут быть напрямую нацелены на агресому через кошаперон BAG3, который переносит их с Hsp70 прямиком на динеин [115].
Агресома накапливает и задерживает в себе потенциально цитотоксичные молекулы и в конечном итоге нацеливается на аутофагическую деградацию. Однако некоторые патологические белки, такие как ɑ-синуклеин (болезнь Паркинсона), очень плохо разлагаются. Это приводит к тому, что агресомы образуют тельца включения (при болезни Паркинсона их называют тельцами Леви), которые ведут к нарушению работы клетки.
С 2008 года описано еще несколько типов агрегатных структур в клетках млекопитающих и дрожжей S. cerevisiae (одного из важнейших модельных организмов в современной биологии [116]). К ним относятся цитозольные (CytoQ), эндоплазматические (Q-bodies), митохондриальные (IMiQ) и даже ядерные субкомпартменты (INQ) [117–120]. Формирование этих белковых агрегатов зависит от нескольких компонентов сети протеостаза, включая шапероны [121], [122].
Недавние исследования на культурах клеток млекопитающих раскрывают неожиданную протеостазную значимость таких удивительных компонентов как ядрышки [123]. Ядрышки — это немембранные структуры внутри ядра, которые обособляются от жидкой среды ядра благодаря фазовому разделению [124], [125]. В этом смысле они схожи с каплями масла, плавающими в супе. Только вот состоят ядрышки не из масла, а из белков и РНК, и выполняют очень важную функцию — производство рибосом. И вот оказывается, жидкий периферический слой ядрышек (гранулярный компонент) служит в качестве депо для неправильно свернутых белков в условиях клеточного стресса. Эта нетривиальная роль ядрышек особенно важна ввиду того, что ядерный протеом обогащен белками, содержащими неструктурированные домены [126].
В итоге, текущие успехи в области белковых агрегатов убедительно доказали, что агрегация белка в клетке не случайна и иногда хорошо контролируется. Постепенное изучение пространственного протеостаза заставляет по-новому взглянуть на то, как клетка управляет различными видами неправильно свернутых белков. Однако, несмотря на неоспоримые достижения, молекулярные детали всех этих процессов пока что носят статус «всё сложно».
«Полундра! Свистать всех наверх!»
Условия существования клеток бывают изменчивы, как погода. Для того чтобы грамотно реагировать на эти катаклизмы, клетки организовали многочисленные сигнальные пути. Благодаря им, появляется возможность регулировать внутриклеточные биохимические процессы, приспосабливаясь к окружающей обстановке: влиять на экспрессию генов, увеличивать или уменьшать продукцию необходимых компонентов, модулировать активность ферментов и т.д.
Такой принцип работает и в сети протеостаза. При благоприятных конформационных условиях необходимость в контроле качества белка снижается, соответственно сеть протеостаза может отдохнуть. Напротив, в условиях конформационного стресса возникает нужда в быстрой мобилизации многих компонентов сети. Специально для этого в клеточной программе прописан путь стресс-ответной реакции на несвернутые белки (unfolded protein response, UPR).
Ассортимент реализующих стресс-реакцию компонентов определяется местом, в котором она развивается. Например, в цитоплазме UPR главным образом протекает через белок Hsf1. Когда в белковой жизни все спокойно, Hsf1 находится в спящем состоянии из-за связывания с шаперонами [127]. При конформационном стрессе шапероны идут на работу с ненативными белками и освобождают Hsf1, позволяя ему начать свою работу (рис. 24). Свободный Hsf1 идет в ядро и стимулирует работу широкого спектра генов, кодирующих компоненты сети протеостаза. В результате увеличивается количество шаперонов, участников протеасомных путей и т.д. Когда ситуация стабилизируется, Hsf1 снова «засыпает» в объятиях шаперонов [128].
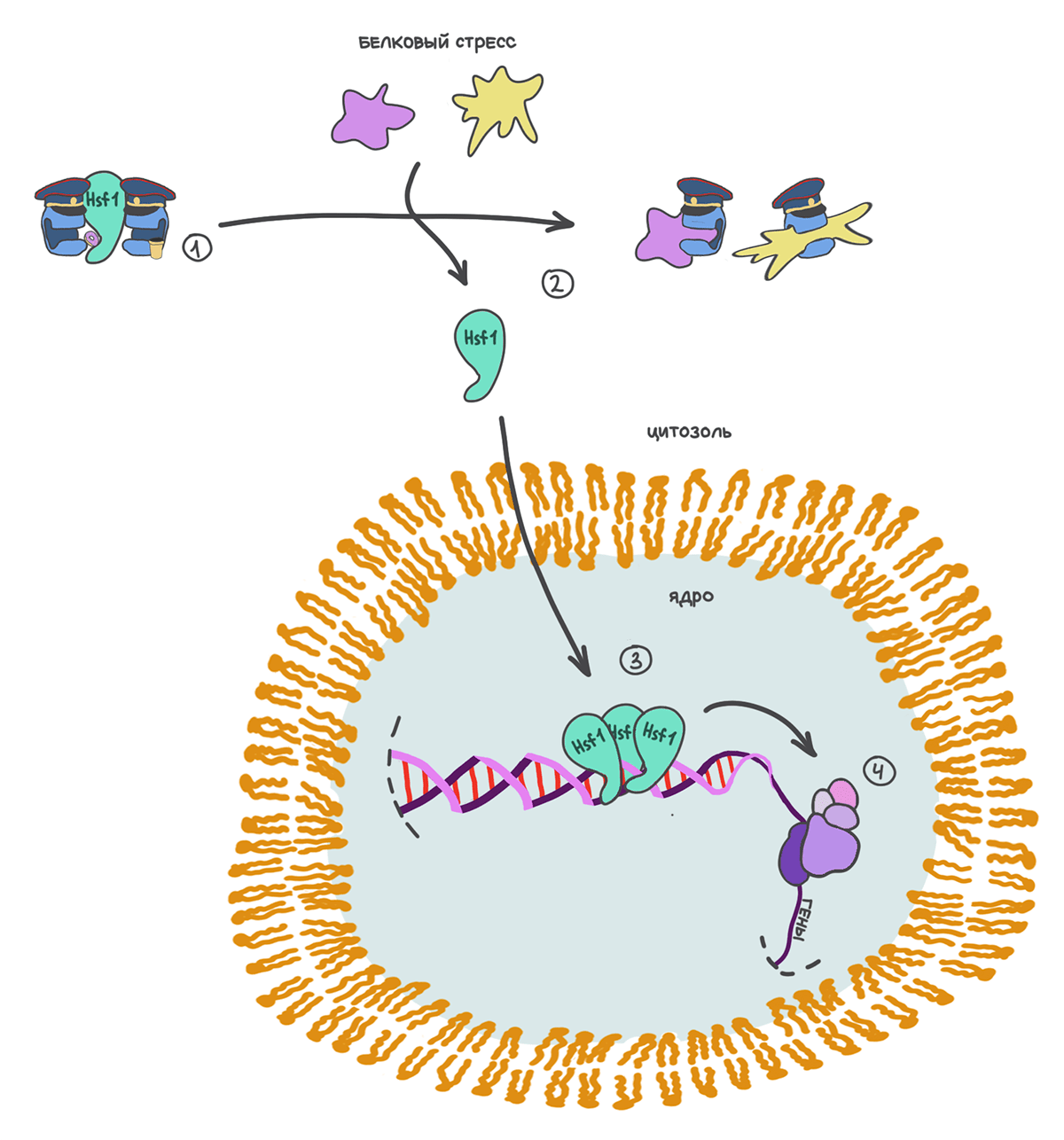
Рисунок 24. Hsf1 в покое и на работе. При благоприятных условиях Hsf1 находится в неактивном состоянии в компании шаперонов (1). Когда случается белковый стресс, шапероны мобилизуются на обработку ненативных белков (2), а освободившийся Hsf1 проникает в ядро и там связывается с определенными участками на ДНК (3). Таким образом, он работает в качестве транскрипционного фактора, стимулируя транскрипцию генов, важных для PN (4).
рисунок автора статьи
Похожие процессы происходят при UPR в эндоплазматическом ретикулуме (UPRER) и митохондриях (UPRmt). И хотя сами компоненты стресс-ответа в разных местах отличаются, цели этих реакций схожи: повышение качества компонентов сети протеостаза и уменьшение количества бракованных белков.
То, как протекает стресс-ответ на развернутые белки в ЭПР, очень хорошо изучено [129], [130]. Он состоит, по крайней мере, из трех ветвей, которые регулируют работу многочисленных генов, тем самым поддерживая протеостаз или, в крайнем случае, активируя апоптоз. Эта часть сигнальной системы очень важна ввиду того, что подавляющее большинство белков, которые клетка экспортирует наружу или выводит на клеточную поверхность, сначала попадают в ЭПР. Здесь они принимают рабочую конформацию и всячески модифицируются. Кроме того, ЭПР обширен, что позволяет ему взаимодействовать с другими мембранными структурами клетки [131]. Таким образом, ЭПР имеет хорошие возможности для определения клеточных возмущений и корректировки сигнальных путей.
Митохондриальный ответ на развернутые белки (UPRmt) был описан гораздо позже, и многие нюансы тут пока не ясны [132].
Длительный стресс
После восстановления протеостаза сигнальные UPR-пути подавляются, чтобы клетки могли должным образом реагировать на будущий стресс. Поэтому пути реагирования разработаны так, чтобы временно активироваться до нужной величины, соответствующей уровню нарушений и позволяющей эффективно восстановить протеостаз. Но сигнальная система может сбиться под действием длительного стресса или частых активаций в течение долгого времени. Исследования обращают внимание на непредсказуемость длительной активации белкового стресса [133].
При старении или некоторых заболеваниях UPR успешно активируется, но очиститься от неправильно свернутых и агрегированных белков у клеток не получается. Стрессовая сигнализация продолжает бить тревогу, и из-за этого «шума» клетки становятся менее чувствительными к дополнительным стрессорам. Кроме того, долговременное воздействие белкового стресса может пагубно сказываться на самой работе UPR [134], [135].
Воздействия, усиливающие стресс-ответные реакции, могут иметь прикладное терапевтическое значение, благодаря уменьшению клеточных повреждений, накапливающихся при старении и конформационных заболеваниях [136]. Однако чтобы использовать такой подход, нам необходимо научиться предсказывать пока мало понятные последствия длительной активации стресс-ответных реакций.
Более серьезно о токсичности агрегатов
Различные состояния белков сосуществуют в сложном равновесии (рис. 26). Склонение чаши весов в такой системе будет определяться многими параметрами, например аминокислотной последовательностью конкретного белка, взаимодействиями с молекулярными шаперонами, процессами деградации и другими механизмами управления белковой жизнью.
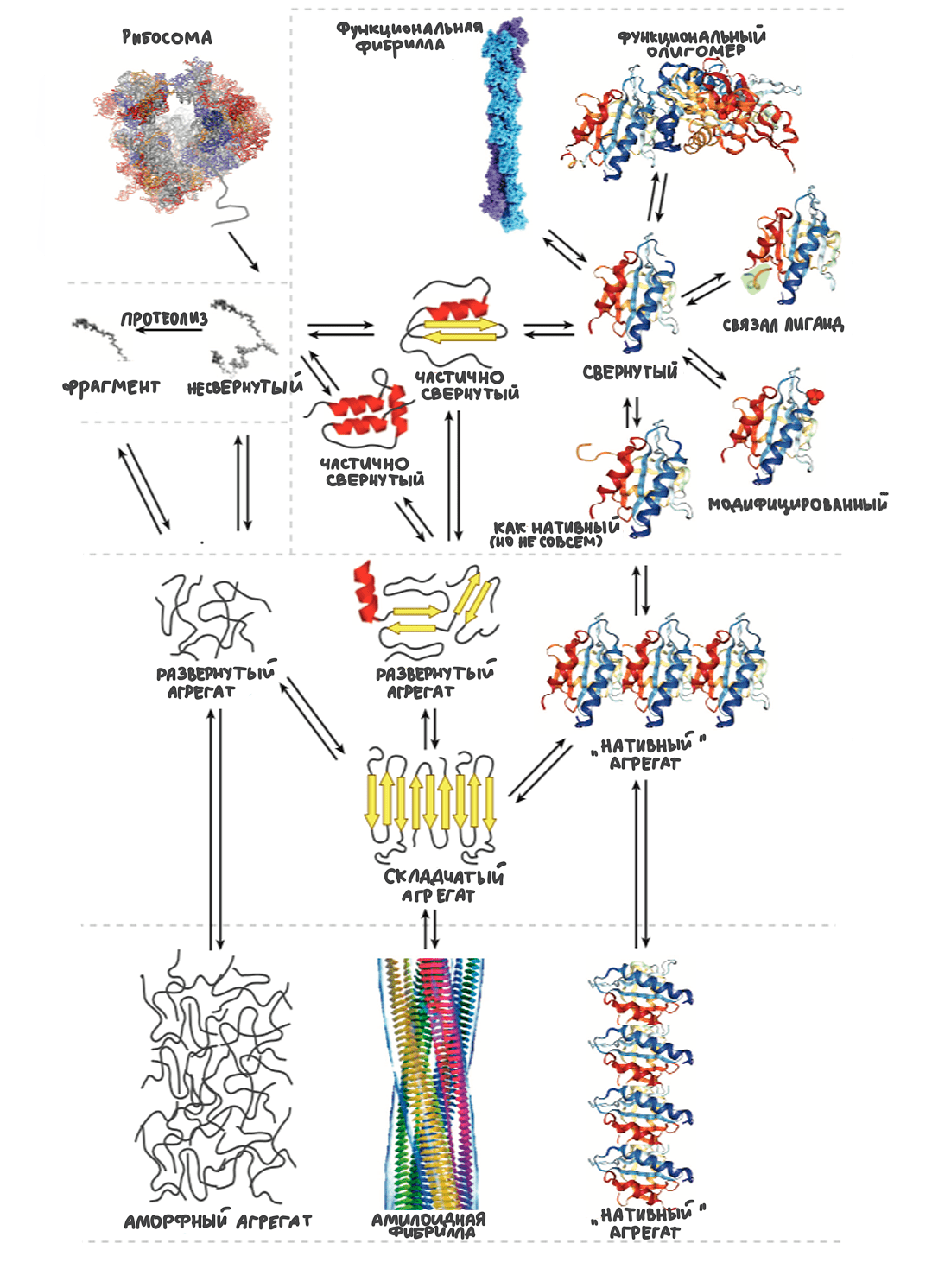
Рисунок 25. Многообразие функциональных форм белков и их агрегатов
[5], рисунок адаптирован
Хотя белки и их биологическая среда совместно эволюционировали, чтобы поддерживать здоровое состояние, всё же белки не утратили свою конформационную хрупкость. Поэтому они сохраняют способность терять нативную структуру и собираться в трудноизлечимые агрегаты, в том числе прочные нитевидные амилоиды. Мы помним, что энергетически это очень выгодно для белка, но физиологически очень неприятно для клетки.
С химической точки зрения для поддержания стабильных растворенных белков важно не превышать их предельную концентрацию. Иначе процесс агрегации и образования амилоидов усиливается [137]. Ученые продолжают идентифицировать наиболее склонные к агрегации белки, чьи клеточные концентрации высоки по сравнению с их растворимостью. Такие белки называют «перенасыщенными». Оказалось, что они активно участвуют в патологической агрегации во время стресса и старения, и чрезмерно представлены в биохимических процессах, связанных с нейродегенерацией. Так, агрегация перенасыщенных белков приводит к образованию нерастворимых отложений при болезнях Альцгеймера, Паркинсона, Хантингтона и боковом амиотрофическом склерозе (ALS) [138–140].
К перенасыщенным относят много РНК-связывающих белков, которые содержат неструктурированные и слабоструктурированные последовательности. Такие белки часто способны подвергаться фазовым переходам жидкость-жидкость, благодаря чему образуют каплеобразные скопления в цитозоле и ядре [125]. Клетке нужны такие белки для метаболизма РНК, биогенеза рибосом, передачи сигналов и других процессов [141]. Тем не менее их динамическое поведение очень чувствительно к изменениям физико-химической среды клеток.
Во время агрегации сначала появляются белковые скопления из относительно небольшого числа молекул, которые сохраняют структурную память о своих здоровых состояниях. Эти ранние агрегаты довольно нестабильны, поскольку успевают наладиться только слабые межмолекулярные взаимодействия.
Однако по мере усугубления ситуации такие агрегаты могут подвергаться внутренней перестройке с образованием более стабильных скоплений. При этом получаются пластинчатые структуры, поддерживаемые большим числом взаимодействий. Эти структурированные олигомеры могут расти дальше за счет самоассоциации или за счет добавления мономеров, часто с дальнейшими структурными перестройками. В итоге могут образоваться четкие фибриллы с пластинчатой структурой, похожие на стопки монет.
На сегодняшний день отмечено около 40 белков, склонных к формированию крупных агрегатов при различных заболеваниях человека [5]. Некоторые белки (например α-синуклеин, хантингтин, тау-белок) внутренне неупорядочены. Другим уязвимым белкам (например актину, фибронектину и лактоферрину) свойственна четкая нативная структура. По факту, между патологическими белками нет очевидного сходства в последовательности, структуре или функции.
Бывает и так, что неупорядоченные или нативные агрегаты разрастаются без каких-либо серьезных преобразований и, в конце концов, просто дают большие аморфные отложения, сохраняющие структуру исходных олигомеров. Такие образования, включая амилоидные, аморфные или нативные агрегаты, накапливаются при определенных патологических состояниях. Если они располагаются в центральной нервной системе, то это ассоциируется с нейродегенеративными состояниями, например болезнями Альцгеймера и Паркинсона. В других тканях наблюдаются многочисленные амилоидозы и дистрофии. Больше половины таких заболеваний носит случайный характер, хотя встречаются и наследственные формы, например болезнь Хантингтона. Данные заболевания имеют относительно поздний возраст начала, что позволяет предположить, что агрегации белков происходят в основном из-за прогрессирующей потери регуляторного контроля с возрастом.
Примечательно, что наличие крупных агрегатов не всегда соотносится с тяжестью заболевания [142]. Исследования последних лет показали, что наиболее токсичными белковыми агрегатами могут быть растворимые олигомеры и мелкие нерастворимые скопления [143]. Опасность таких агрегатов состоит в том, что они активно выставляют наружу гидрофобные остатки и химически активные участки. Это сильно повышает их способность вступать во взаимодействия с другими белками, особенно с компонентами сети протеостаза (рис. 26) [144–147]. Точная природа наиболее токсичных агрегатов остается горячим предметом изучения.
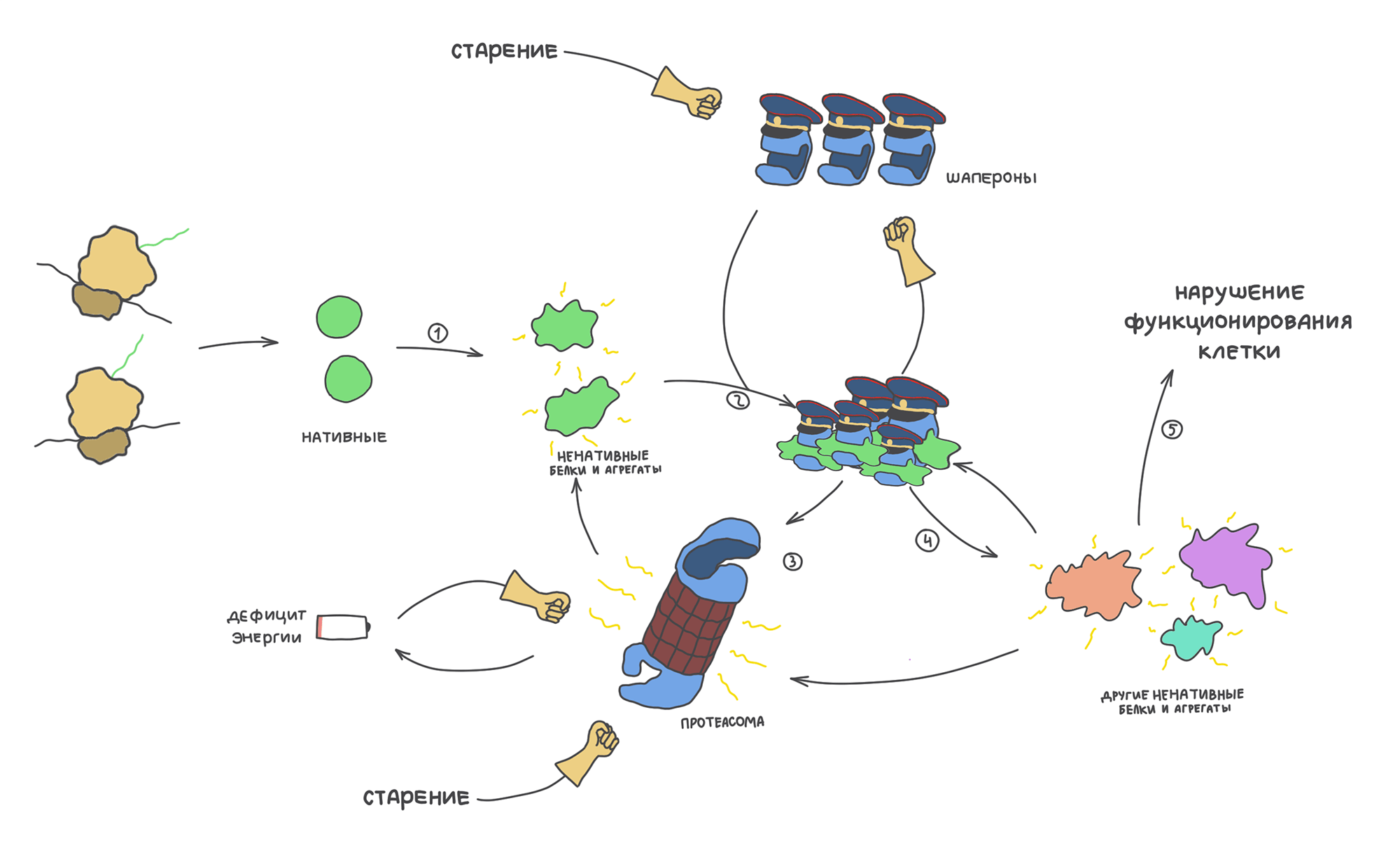
Рисунок 26. Порочные круги протеостаза. Ненативный белок может накапливаться по разным причинам (1). В ответ на это происходит мобилизация сети протеостаза, которая пытается защитить клетку (2). Но если ненативный белок всё равно будет появляться, то со временем сеть протеостаза может ослабнуть. Сократится число свободных шаперонов, переполнятся протеасомы (3) и т.д. Кроме того, на стабильности PN могут негативно сказаться многие факторы, например старение или дефицит энергии. Ослабление PN будет способствовать накоплению уже других ненативных белков и агрегатов (4), что в конечном итоге скажется на функционировании клетки (5).
рисунок автора статьи
Удивительно, но во многих случаях крупные амилоиды, наоборот, могут оказывать защитное действие, изолируя внутри себя более опасные олигомеры и уменьшая площадь их открытой токсичной поверхности [148]. С другой стороны, в них могут изолироваться и важные компоненты сети протеостаза, взаимодействующие с растворимыми олигомерами перед их попаданием в амилоид. Это может негативно сказаться на функционировании клетки [149].
В целом, на сегодняшний день принято считать, что агрегация играет двойную роль, сочетая защитные и токсические эффекты. Это сильно усложняет ситуацию.
Старение — это, несомненно, основной фактор риска практически всех заболеваний, связанных с отложением белка. С возрастом количество шаперонов снижается, потому что они выключаются из игры нарастающим числом белковых агрегатов. К тому же и экспрессия шаперонов, по-видимому, снижается с возрастом.
При старении снижается и активность UPS, возможно, из-за уменьшения количества активных протеасом, дефектов в системе нацеливания белков на деградацию и накопления сшитых белков, которые трудно переваривать [150].
Как только сеть протеостаза нарушается, агрегаты получают способность распространяться не только за счет их роста, но также за счет вторичных процессов, таких как фрагментация фибрилл и вторичное зародышеобразование. Более того, теперь ясно, что агрегаты могут распространяться от клетки к клетке в пределах одной и той же ткани, способствуя развитию патологических процессов [151].
Шаперонотерапия
И тут возникает логичный вопрос: если предполагается, что многие заболевания связаны с ухудшением белкового контроля, то почему бы не попытаться как-то использовать наши знания о сети протеостаза для борьбы с болезнями? Действительно, часто так бывает, что естественным результатом фундаментальных исследований становятся различные терапевтические техники и фармакологические препараты. И есть основания полагать, что эта тенденция не оставит в стороне сеть протеостаза.
Одна из терапевтических стратегий связана с шаперонами. В главе про сигнальные пути протеостаза ключевой фигурой был белок Hsf1 — фактор, регулирующий активность генов большинства шаперонов. На моделях болезней Хантингтона, Альцгеймера и Паркинсона было показано, как при накоплении патологического белка активировались некоторые посредники, которые запускали существенную деградацию Hsf1 [152–154]. Такой эффект угнетал сеть протеостаза и способствовал прогрессии заболевания. Фармакологическая инактивация этих посредников позволила противостоять деградации Hsf1 и вызвать пониженное накопление агрегатов.
Существуют и иные подходы, позволяющие влиять на количество шаперонов конкретных семейств. Это важно ввиду того, что разные классы шаперонов могут обладать различными ролями в клетке, взаимодействовать с отдельными наборами партнеров и активировать разные сигнальные пути. Пока все эти аспекты изучены недостаточно хорошо, но уже понятно, что при некоторых состояниях разные классы шаперонов могут помогать, а могут, напротив, лишь усугублять ситуацию. Например, АТФ-зависимые шапероны могут разбирать амилоиды, генерируя много маленьких кусочков, которые могут стать новыми центрами агрегации. К тому же, наборы шаперонов в нормальных условиях и условиях стресса могут значительно различаться, что вынуждает нас использовать более тонкие способы настройки. При переходе от нормальных условий к стрессовым состав шаперонов меняется, что приводит к устойчивым изменениям в белковой жизни и может стабилизировать патологическое состояние.
Несмотря на многочисленные сложности, остается надежда на то, что управление шаперонной активностью позволит облегчать болезненные состояния. В частности, усиление работы системы шаперонов Hsp70 показало положительный эффект сразу на нескольких моделях амилоидных заболеваний [155–157].
На активность шаперонных систем можно повлиять количественно и качественно. Первый подход заключается в изменении активности генов, что приводит к увеличению или уменьшению синтеза определенных шаперонов в клетке [158–160]. Второй подход основан на способности некоторых молекул взаимодействовать с белками-шаперонами, усиливая или ослабляя их работу [161]. Научное сообщество понимает, что при этом имеется много важных неизученных факторов, поэтому вводить в клинику модуляторы шаперонной активности пока никто не торопится.
Можно попробовать зайти со стороны убиквитин-протеасомной системы, так как уже была показана связь между ослаблением UPS и нейродегенеративными заболеваниями. При этом возможны несколько подходов. При некоторых заболеваниях агрегация убиквитинилированных белков приводит к изоляции большого числа убиквитинов, что истощает запас свободных убиквитинов. В таких случаях можно повышать синтез определенных партнеров убиквитинов, которые помогут им находиться в свободном состоянии и будут способствовать восстановлению пула убиквитинов. Весьма перспективным на данный момент считается терапевтическое воздействие на работу убиквитинлигаз. Аналогично тут можно воздействовать количественно, стимулируя их синтез, что, как ожидается, приведет к более активному убиквитинилированию патологических белков.
Качественный подход состоит в модуляции активности уже имеющихся убиквитинлигаз. В настоящий момент изучаются молекулы для нацеленного протеолиза — PROTAC [162]. По задумке, эти молекулы одной стороной взаимодействуют с определенной убиквитинлигазой, а другой — с белком-мишенью (рис. 27). Таким образом, PROTAC становится центром встречи убиквитинлигазы и ее клиента, что обеспечивает эффективную деградацию интересующего нас белка. В настоящий момент разрабатываются различные молекулы для направленного протеолиза белков, участвующих в разных патологических состояниях, включая амилоидозы, нейродегенеративные заболевания и даже рак. Научное сообщество возлагает большие надежды на эту изящную технологию.
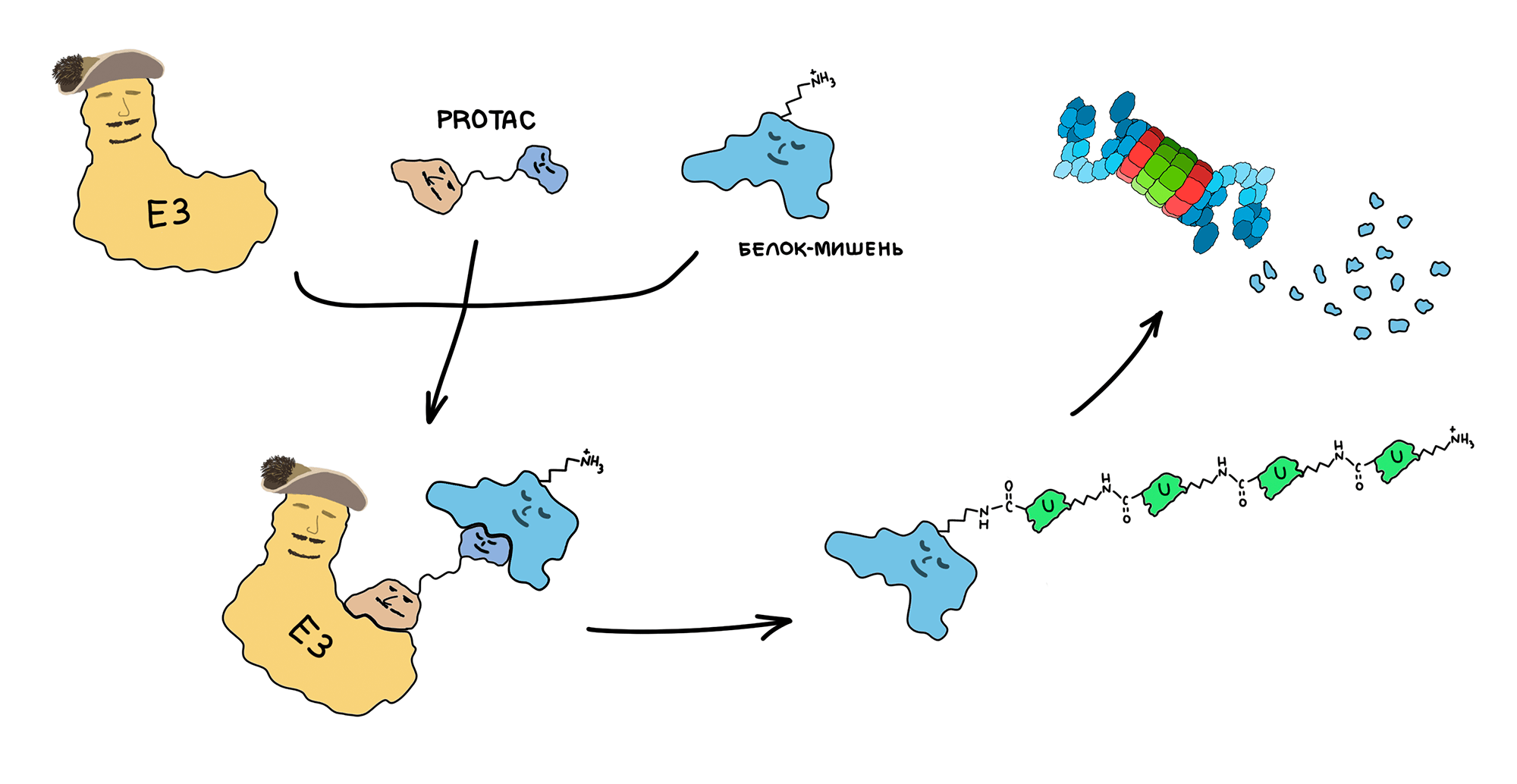
Рисунок 27. PROTAC представляет собой химеру из двух частей. Одна часть способна связываться с белком-мишенью, а вторая — с убиквитинлигазой. Введение такой молекулы в клетку должно способствовать активному убиквитинилированию и последующей деградации белка-мишени.
рисунок автора статьи
В контексте нейродегенеративных заболеваний перспективным также считается воздействие на систему аутофагии, поскольку часто этот отдел сети протеостаза ослаблен [163], [164]. Однако разработка методов модуляции аутофагии достаточно сложна, так как ей командуют сигнальные пути, ответственные также за управление запасами энергии и ответы на ростовые факторы. Дисбаланс сигналов в данной системе может значительно усугубить клеточную ситуацию. Несмотря на сложности, продолжаются поиски химических усилителей аутофагии. Несомненно, исследования механизмов различных типов аутофагии, особенно опосредованной шаперонами, позволят лучше понять возможности для терапевтического вмешательства.
Финальный аккорд
В данном обзоре нашли отражение современные научные знания об устройстве сети протеостаза с описанием ключевых этапов и важнейших компонентов. На самом деле, по-настоящему целостную картину сформировать пока невозможно ввиду ограниченности накопленных знаний. PN активно исследовалась на модельных организмах, вроде бактерий, дрожжей или червей. Многие же нюансы сети протеостаза человека пока остаются тайными. Кроме того, актуальна проблема переноса накопленных знаний с уровня клетки на масштаб целого многоклеточного организма.
Таким образом, ученым предстоит еще долгая работа по изучению PN и белковой жизни в целом. Исследования поддерживаются надеждой на рациональное использование этих знаний в терапевтических и профилактических целях.
Особенно актуально изучение протеостаза в контексте стремления человечества к увеличению продолжительности и качества жизни. Безусловно, живя дольше, мы будем постоянно сталкиваться с новыми трудностями. Патологические состояния, связанные с ослаблением PN, часто сопровождают старение, наряду с возрастной онкологией, сердечно-сосудистыми заболеваниями, диабетом и т.д. В этом контексте, изучение протеостаза буквально прокладывает дорогу в будущее.
Знания о сети протеостаза важны и с фундаментальной стороны. Белковая жизнь — это очень значимая часть клеточной физиологии, поэтому для полного понимания устройства жизни нам необходимо учитывать ее вклад. Дальнейшее изучение аспектов протеостаза будет способствовать развитию таких областей науки, как биохимия, молекулярная биология, биоинженерия, биотехнология и др. Наглядный пример — технология PROTAC, которая уже применяется в науке как инструмент «нокдауна» белков для изучения их функций.
Ценность исследований сети протеостаза и аспектов белковой жизни была отмечена множеством престижных научных наград. В доказательство приведу лауреатов актуальной «Премии за прорыв в области наук о жизни» (Breakthrough Prize in Life Sciences):
- Александр Варшавский (2014 г., исследование роли убиквитинилирования для деградации белков);
- Джон Харди (2016 г., связь агрегации бета-амилоида с патогенезом болезни Альцгеймера);
- Ёсинори Осуми (2017 г., исследования механизмов аутофагии);
- Питер Уолтер и Кадзутоси Мори (2018 г., изучение реакции на развернутые белки);
- Дон В. Кливленд (2018 г., патогенез и терапия наследственного ALS);
- Франц-Ульрих Хартль и Артур Хорвич (2020 г., исследования работы и функций шаперонов);
- Вирджиния Ман-Йи Ли (2020 г., белковая агрегация при ALS, лобно-височной деменции и болезни Паркинсона);
- Ричард Дж. Юл (2021 г., контроль качества митохондрий при болезни Паркинсона).
Я перечислил ученых, в недавнее время внесших значимый вклад в понимание аспектов протеостаза. Это бурно развивающееся направление исследований действительно может еще преподнести много нового и интересного.
Белки — это удивительные молекулы. Их свойства поражают разнообразием, а их возможности порой заставляют восхищаться. Жизнь белков по-настоящему драматична, полна интриг и неожиданностей. И очень важно то, что клетки научились этим балом управлять. Так из сложности родилась могущественная система белков, во многом обеспечившая величие жизни на Земле.
Литература
- Проблема фолдинга белка;
- Роль слабых взаимодействий в биополимерах;
- Недоупорядоченные белки;
- Todd P. Silverstein. (1998). The Real Reason Why Oil and Water Don't Mix. J. Chem. Educ.. 75, 116;
- Fabrizio Chiti, Christopher M. Dobson. (2017). Protein Misfolding, Amyloid Formation, and Human Disease: A Summary of Progress Over the Last Decade. Annu. Rev. Biochem.. 86, 27-68;
- Timo Eichner, Arnout P. Kalverda, Gary S. Thompson, Steve W. Homans, Sheena E. Radford. (2011). Conformational Conversion during Amyloid Formation at Atomic Resolution. Molecular Cell. 41, 161-172;
- Cox D.L. and Nelson M.M. Lehninger principles of biochemistry. NY: W.H. Freeman, 2013. — 143 p.;
- Matthew G. Iadanza, Matthew P. Jackson, Eric W. Hewitt, Neil A. Ranson, Sheena E. Radford. (2018). A new era for understanding amyloid structures and disease. Nat Rev Mol Cell Biol. 19, 755-773;
- Parvez Alam, Khursheed Siddiqi, Sumit Kumar Chturvedi, Rizwan Hasan Khan. (2017). Protein aggregation: From background to inhibition strategies. International Journal of Biological Macromolecules. 103, 208-219;
- На руинах памяти: настоящее и будущее болезни Альцгеймера;
- Болезнь Альцгеймера: ген, от которого я без ума;
- Болезнь Паркинсона: что изучать? как изучать?;
- Sian-Yang Ow, Dave E. Dunstan. (2014). A brief overview of amyloids and Alzheimer's disease. Protein Science. 23, 1315-1331;
- Andrew D. Rouillard, Gregory W. Gundersen, Nicolas F. Fernandez, Zichen Wang, Caroline D. Monteiro, et. al.. (2016). The harmonizome: a collection of processed datasets gathered to serve and mine knowledge about genes and proteins. Database. 2016, baw100;
- Evan T. Powers, Richard I. Morimoto, Andrew Dillin, Jeffery W. Kelly, William E. Balch. (2009). Biological and Chemical Approaches to Diseases of Proteostasis Deficiency. Annu. Rev. Biochem.. 78, 959-991;
- Tanya Vavouri, Jennifer I. Semple, Rosa Garcia-Verdugo, Ben Lehner. (2009). Intrinsic Protein Disorder and Interaction Promiscuity Are Widely Associated with Dosage Sensitivity. Cell. 138, 198-208;
- R. C. Taylor, A. Dillin. (2011). Aging as an Event of Proteostasis Collapse. Cold Spring Harbor Perspectives in Biology. 3, a004440-a004440;
- Christopher M. Dobson, Andrej Šali, Martin Karplus. (1998). Protein Folding: A Perspective from Theory and Experiment. Angewandte Chemie International Edition. 37, 868-893;
- Alice I Bartlett, Sheena E Radford. (2009). An expanding arsenal of experimental methods yields an explosion of insights into protein folding mechanisms. Nat Struct Mol Biol. 16, 582-588;
- Aaron R Dinner, Andrej Šali, Lorna J Smith, Christopher M Dobson, Martin Karplus. (2000). Understanding protein folding via free-energy surfaces from theory and experiment. Trends in Biochemical Sciences. 25, 331-339;
- Прионные и неприонные амилоиды: определяет ли конформация разницу в инфекционности?;
- F. Ulrich Hartl, Andreas Bracher, Manajit Hayer-Hartl. (2011). Molecular chaperones in protein folding and proteostasis. Nature. 475, 324-332;
- R. John Ellis, Allen P. Minton. (2006). Protein aggregation in crowded environments. Biological Chemistry. 387;
- David Balchin, Manajit Hayer-Hartl, F. Ulrich Hartl. (2016). In vivo aspects of protein folding and quality control. Science. 353, aac4354;
- Daniel N Wilson, Roland Beckmann. (2011). The ribosomal tunnel as a functional environment for nascent polypeptide folding and translational stalling. Current Opinion in Structural Biology. 21, 274-282;
- C. Eichmann, S. Preissler, R. Riek, E. Deuerling. (2010). Cotranslational structure acquisition of nascent polypeptides monitored by NMR spectroscopy. Proceedings of the National Academy of Sciences. 107, 9111-9116;
- Adrian H Elcock. (2006). Molecular Simulations of Cotranslational Protein Folding: Fragment Stabilities, Folding Cooperativity, and Trapping in the Ribosome. PLoS Comput Biol. 2, e98;
- Florian Brandt, Stephanie A. Etchells, Julio O. Ortiz, Adrian H. Elcock, F. Ulrich Hartl, Wolfgang Baumeister. (2009). The Native 3D Organization of Bacterial Polysomes. Cell. 136, 261-271;
- Günter Kramer, Daniel Boehringer, Nenad Ban, Bernd Bukau. (2009). The ribosome as a platform for co-translational processing, folding and targeting of newly synthesized proteins. Nat Struct Mol Biol. 16, 589-597;
- Steffen Preissler, Elke Deuerling. (2012). Ribosome-associated chaperones as key players in proteostasis. Trends in Biochemical Sciences. 37, 274-283;
- Matthias P. Mayer. (2010). Gymnastics of Molecular Chaperones. Molecular Cell. 39, 321-331;
- E. B. Bertelsen, L. Chang, J. E. Gestwicki, E. R. P. Zuiderweg. (2009). Solution conformation of wild-type E. coli Hsp70 (DnaK) chaperone complexed with ADP and substrate. Proceedings of the National Academy of Sciences. 106, 8471-8476;
- Eugenia M. Clerico, Joseph M. Tilitsky, Wenli Meng, Lila M. Gierasch. (2015). How Hsp70 Molecular Machines Interact with Their Substrates to Mediate Diverse Physiological Functions. Journal of Molecular Biology. 427, 1575-1588;
- Sandeep K Sharma, Paolo De Los Rios, Philipp Christen, Ariel Lustig, Pierre Goloubinoff. (2010). The kinetic parameters and energy cost of the Hsp70 chaperone as a polypeptide unfoldase. Nat Chem Biol. 6, 914-920;
- Harm H. Kampinga, Elizabeth A. Craig. (2010). The HSP70 chaperone machinery: J proteins as drivers of functional specificity. Nat Rev Mol Cell Biol. 11, 579-592;
- Alireza Mashaghi, Sergey Bezrukavnikov, David P. Minde, Anne S. Wentink, Roman Kityk, et. al.. (2016). Alternative modes of client binding enable functional plasticity of Hsp70. Nature. 539, 448-451;
- Heike Rampelt, Janine Kirstein-Miles, Nadinath B Nillegoda, Kang Chi, Sebastian R Scholz, et. al.. (2012). Metazoan Hsp70 machines use Hsp110 to power protein disaggregation. The EMBO Journal. 31, 4221-4235;
- Nadja Kettern, Michael Dreiseidler, Riga Tawo, Jörg Höhfeld. (2010). Chaperone-assisted degradation: multiple paths to destruction. Biological Chemistry. 391, 481-489;
- Michael B. Yaffe, George W. Farr, David Miklos, Arthur L. Horwich, Mona L. Sternlicht, Himan Sternlicht. (1992). TCP1 complex is a molecular chaperone in tubulin biogenesis. Nature. 358, 245-248;
- D. B. Vinh, D. G. Drubin. (1994). A yeast TCP-1-like protein is required for actin function in vivo.. Proceedings of the National Academy of Sciences. 91, 9116-9120;
- Alain Camasses, Aliona Bogdanova, Andrej Shevchenko, Wolfgang Zachariae. (2003). The CCT Chaperonin Promotes Activation of the Anaphase-Promoting Complex through the Generation of Functional Cdc20. Molecular Cell. 12, 87-100;
- Antonio Garcia Trinidad, Patricia A.J. Muller, Jorge Cuellar, Marta Klejnot, Max Nobis, et. al.. (2013). Interaction of p53 with the CCT Complex Promotes Protein Folding and Wild-Type p53 Activity. Molecular Cell. 50, 805-817;
- Tom Lopez, Kevin Dalton, Judith Frydman. (2015). The Mechanism and Function of Group II Chaperonins. Journal of Molecular Biology. 427, 2919-2930;
- Manajit Hayer-Hartl, Andreas Bracher, F. Ulrich Hartl. (2016). The GroEL–GroES Chaperonin Machine: A Nano-Cage for Protein Folding. Trends in Biochemical Sciences. 41, 62-76;
- Daniel Gestaut, Soung Hun Roh, Boxue Ma, Grigore Pintilie, Lukasz A. Joachimiak, et. al.. (2019). The Chaperonin TRiC/CCT Associates with Prefoldin through a Conserved Electrostatic Interface Essential for Cellular Proteostasis. Cell. 177, 751-765.e15;
- F Ulrich Hartl, Manajit Hayer-Hartl. (2009). Converging concepts of protein folding in vitro and in vivo. Nat Struct Mol Biol. 16, 574-581;
- Arthur L. Horwich, Wayne A. Fenton. (2009). Chaperonin-mediated protein folding: using a central cavity to kinetically assist polypeptide chain folding. Quart. Rev. Biophys.. 42, 83-116;
- Daniel Gestaut, Antonio Limatola, Lukasz Joachimiak, Judith Frydman. (2019). The ATP-powered gymnastics of TRiC/CCT: an asymmetric protein folding machine with a symmetric origin story. Current Opinion in Structural Biology. 55, 50-58;
- Канал эукариотического шаперонина открывается подобно диафрагме фотоаппарата;
- Achim Brinker, Guenther Pfeifer, Michael J. Kerner, Dean J. Naylor, F.Ulrich Hartl, Manajit Hayer-Hartl. (2001). Dual Function of Protein Confinement in Chaperonin-Assisted Protein Folding. Cell. 107, 223-233;
- Kausik Chakraborty, Manal Chatila, Jyoti Sinha, Qiaoyun Shi, Bernhard C. Poschner, et. al.. (2010). Chaperonin-Catalyzed Rescue of Kinetically Trapped States in Protein Folding. Cell. 142, 112-122;
- Как спасти Тринадцатую? (Перспективы лечения болезни Хантингтона);
- Akira Kitamura, Hiroshi Kubota, Chan-Gi Pack, Gen Matsumoto, Shoshiro Hirayama, et. al.. (2006). Cytosolic chaperonin prevents polyglutamine toxicity with altering the aggregation state. Nat Cell Biol. 8, 1163-1169;
- Stephen Tam, Ron Geller, Christoph Spiess, Judith Frydman. (2006). The chaperonin TRiC controls polyglutamine aggregation and toxicity through subunit-specific interactions. Nat Cell Biol. 8, 1155-1162;
- H. Chiang, Terlecky, C. Plant, J. Dice. (1989). A role for a 70-kilodalton heat shock protein in lysosomal degradation of intracellular proteins. Science. 246, 382-385;
- A. M. Cuervo, J. F. Dice. (1996). A Receptor for the Selective Uptake and Degradation of Proteins by Lysosomes. Science. 273, 501-503;
- Jens Jacob Hansen, Alexandra Dürr, Isabelle Cournu-Rebeix, Costa Georgopoulos, Debbie Ang, et. al.. (2002). Hereditary Spastic Paraplegia SPG13 Is Associated with a Mutation in the Gene Encoding the Mitochondrial Chaperonin Hsp60. The American Journal of Human Genetics. 70, 1328-1332;
- Daniella Magen, Costa Georgopoulos, Peter Bross, Debbie Ang, Yardena Segev, et. al.. (2008). Mitochondrial Hsp60 Chaperonopathy Causes an Autosomal-Recessive Neurodegenerative Disorder Linked to Brain Hypomyelination and Leukodystrophy. The American Journal of Human Genetics. 83, 30-42;
- Mikko Taipale, Daniel F. Jarosz, Susan Lindquist. (2010). HSP90 at the hub of protein homeostasis: emerging mechanistic insights. Nat Rev Mol Cell Biol. 11, 515-528;
- C. Prodromou. (2000). The ATPase cycle of Hsp90 drives a molecular clamp' via transient dimerization of the N-terminal domains. The EMBO Journal. 19, 4383-4392;
- D. Eric Dollins, Joshua J. Warren, Robert M. Immormino, Daniel T. Gewirth. (2007). Structures of GRP94-Nucleotide Complexes Reveal Mechanistic Differences between the hsp90 Chaperones. Molecular Cell. 28, 41-56;
- Suzanne L. Rutherford, Susan Lindquist. (1998). Hsp90 as a capacitor for morphological evolution. Nature. 396, 336-342;
- L. E. Cowen. (2005). Hsp90 Potentiates the Rapid Evolution of New Traits: Drug Resistance in Diverse Fungi. Science. 309, 2185-2189;
- Christine Queitsch, Todd A. Sangster, Susan Lindquist. (2002). Hsp90 as a capacitor of phenotypic variation. Nature. 417, 618-624;
- Patricia L Yeyati, Ruth M Bancewicz, John Maule, Veronica van Heyningen. (2007). Hsp90 Selectively Modulates Phenotype in Vertebrate Development. PLoS Genet. 3, e43;
- Luke Whitesell, Susan L. Lindquist. (2005). HSP90 and the chaperoning of cancer. Nat Rev Cancer. 5, 761-772;
- Marja Jäättelä. (1999). Escaping Cell Death: Survival Proteins in Cancer. Experimental Cell Research. 248, 30-43;
- Brian W Dymock, Martin J Drysdale, Edward McDonald, Paul Workman. (2004). Inhibitors of HSP90 and other chaperones for the treatment of cancer. Expert Opinion on Therapeutic Patents. 14, 837-847;
- Len Neckers. (2007). Heat shock protein 90: The cancer chaperone. J Biosci. 32, 517-530;
- Yiming Xu, Dewang Jing, Dong Zhao, Yongji Wu, Lu Xing, et. al.. (2020). New modification strategy of matrine as Hsp90 inhibitors based on its specific L conformation for cancer treatment. Bioorganic & Medicinal Chemistry. 28, 115305;
- Martin Haslbeck, Titus Franzmann, Daniel Weinfurtner, Johannes Buchner. (2005). Some like it hot: the structure and function of small heat-shock proteins. Nat Struct Mol Biol. 12, 842-846;
- Jack M. Webster, April L. Darling, Vladimir N. Uversky, Laura J. Blair. (2019). Small Heat Shock Proteins, Big Impact on Protein Aggregation in Neurodegenerative Disease. Front. Pharmacol.. 10;
- Evgeny V. Mymrikov, Marina Daake, Bettina Richter, Martin Haslbeck, Johannes Buchner. (2017). The Chaperone Activity and Substrate Spectrum of Human Small Heat Shock Proteins. J. Biol. Chem.. 292, 672-684;
- Nadinath B. Nillegoda, Bernd Bukau. (2015). Metazoan Hsp70-based protein disaggregases: emergence and mechanisms. Front. Mol. Biosci.. 2;
- Szymon Żwirowski, Agnieszka Kłosowska, Igor Obuchowski, Nadinath B Nillegoda, Artur Piróg, et. al.. (2017). Hsp70 displaces small heat shock proteins from aggregates to initiate protein refolding. EMBO J. 36, 783-796;
- Evgeny V. Mymrikov, Alim S. Seit-Nebi, Nikolai B. Gusev. (2011). Large Potentials of Small Heat Shock Proteins. Physiological Reviews. 91, 1123-1159;
- Alexander Varshavsky. (2012). The Ubiquitin System, an Immense Realm. Annu. Rev. Biochem.. 81, 167-176;
- Вездесущий убиквитин;
- «Вездесущий убиквитин» возвращается;
- Cecile M. Pickart. (2001). Mechanisms Underlying Ubiquitination. Annu. Rev. Biochem.. 70, 503-533;
- David Komander, Michael Rape. (2012). The Ubiquitin Code. Annu. Rev. Biochem.. 81, 203-229;
- Gary S. McDowell, Anna Philpott. (2013). Non-canonical ubiquitylation: Mechanisms and consequences. The International Journal of Biochemistry & Cell Biology. 45, 1833-1842;
- W. Li, Y. Ye. (2008). Polyubiquitin chains: functions, structures, and mechanisms. Cell. Mol. Life Sci.. 65, 2397-2406;
- Claudia Esser, Simon Alberti, Jörg Höhfeld. (2004). Cooperation of molecular chaperones with the ubiquitin/proteasome system. Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1695, 171-188;
- Yuanchen Dong, Shuwen Zhang, Zhaolong Wu, Xuemei Li, Wei Li Wang, et. al.. (2019). Cryo-EM structures and dynamics of substrate-engaged human 26S proteasome. Nature. 565, 49-55;
- R. Verma. (2002). Role of Rpn11 Metalloprotease in Deubiquitination and Degradation by the 26S Proteasome. Science. 298, 611-615;
- Michael Groll, Michael H. Glickman, Daniel Finley, Monica Bajorek, Alwin Köhler, et. al.. (2000). . Nat. Struct Biol.. 7, 1062-1067;
- D. Voges, P. Zwickl, W. Baumeister. (1999). The 26S Proteasome: A Molecular Machine Designed for Controlled Proteolysis. Annu. Rev. Biochem.. 68, 1015-1068;
- Alexei F. Kisselev, Tatos N. Akopian, Kee Min Woo, Alfred L. Goldberg. (1999). The Sizes of Peptides Generated from Protein by Mammalian 26 and 20 S Proteasomes. J. Biol. Chem.. 274, 3363-3371;
- E Seemuller, A Lupas, D Stock, J Lowe, R Huber, W Baumeister. (1995). Proteasome from Thermoplasma acidophilum: a threonine protease. Science. 268, 579-582;
- Ivan Dikic. (2017). Proteasomal and Autophagic Degradation Systems. Annu. Rev. Biochem.. 86, 193-224;
- David Vilchez, Isabel Saez, Andrew Dillin. (2014). The role of protein clearance mechanisms in organismal ageing and age-related diseases. Nat Commun. 5;
- Burkhardt Dahlmann. (2007). Role of proteasomes in disease. BMC Biochem. 8, S3;
- Nathalie Vigneron, Benoît Van den Eynde. (2014). Proteasome Subtypes and Regulators in the Processing of Antigenic Peptides Presented by Class I Molecules of the Major Histocompatibility Complex. Biomolecules. 4, 994-1025;
- Нобелевская премия по медицине и физиологии 2016: за самоедство;
- Ana Maria Cuervo. (2004). Autophagy: Many paths to the same end. Mol Cell Biochem. 263, 55-72;
- Christopher A. Lamb, Tamotsu Yoshimori, Sharon A. Tooze. (2013). The autophagosome: origins unknown, biogenesis complex. Nat Rev Mol Cell Biol. 14, 759-774;
- Gabriele Zaffagnini, Sascha Martens. (2016). Mechanisms of Selective Autophagy. Journal of Molecular Biology. 428, 1714-1724;
- M. Lamar Seibenhener, Jeganathan Ramesh Babu, Thangiah Geetha, Hing C. Wong, N. Rama Krishna, Marie W. Wooten. (2004). Sequestosome 1/p62 Is a Polyubiquitin Chain Binding Protein Involved in Ubiquitin Proteasome Degradation. MCB. 24, 8055-8068;
- Veronika Majcher, Alice Goode, Victoria James, Robert Layfield. (2015). Autophagy receptor defects and ALS-FTLD. Molecular and Cellular Neuroscience. 66, 43-52;
- Alice Goode, Kevin Butler, Jed Long, James Cavey, Daniel Scott, et. al.. (2016). Defective recognition of LC3B by mutant SQSTM1/p62 implicates impairment of autophagy as a pathogenic mechanism in ALS-FTLD. Autophagy. 12, 1094-1104;
- Susmita Kaushik, Ana Maria Cuervo. (2012). Chaperone-mediated autophagy: a unique way to enter the lysosome world. Trends in Cell Biology. 22, 407-417;
- Ana Maria Cuervo, Amparo Palmer, A. Jennifer Rivett, Erwin Knecht. (1995). Degradation of Proteasomes by Lysosomes in Rat Liver. Eur J Biochem. 227, 792-800;
- Patrick F. Finn, J. Fred Dice. (2005). Ketone Bodies Stimulate Chaperone-mediatedAutophagy. Journal of Biological Chemistry. 280, 25864-25870;
- Roberta Kiffin, Christopher Christian, Erwin Knecht, Ana Maria Cuervo. (2004). Activation of Chaperone-mediated Autophagy during Oxidative Stress. MBoC. 15, 4829-4840;
- Ana Maria Cuervo, Heinz Hildebrand, Ernst M. Bomhard, J. Fred Dice. (1999). Direct lysosomal uptake of α2-microglobulin contributes to chemically induced nephropathy. Kidney International. 55, 529-545;
- Emily Mitchell Sontag, Rahul S. Samant, Judith Frydman. (2017). Mechanisms and Functions of Spatial Protein Quality Control. Annu. Rev. Biochem.. 86, 97-122;
- P. M. Douglas, S. Treusch, H.-Y. Ren, R. Halfmann, M. L. Duennwald, et. al.. (2008). Chaperone-dependent amyloid assembly protects cells from prion toxicity. Proceedings of the National Academy of Sciences. 105, 7206-7211;
- María A Rujano, Floris Bosveld, Florian A Salomons, Freark Dijk, Maria A.W.H van Waarde, et. al.. (2006). Polarised Asymmetric Inheritance of Accumulated Protein Damage in Higher Eukaryotes. PLoS Biol. 4, e417;
- Thomas Nyström, Beidong Liu. (2014). Protein quality control in time and space - links to cellular aging. FEMS Yeast Res. 14, 40-48;
- J. Lippincott-Schwartz. (2003). Development and Use of Fluorescent Protein Markers in Living Cells. Science. 300, 87-91;
- Флуоресцентные репортеры и их молекулярные репортажи;
- 12 методов в картинках: микроскопия;
- Jennifer A. Johnston, Cristina L. Ward, Ron R. Kopito. (1998). Aggresomes: A Cellular Response to Misfolded Proteins. Journal of Cell Biology. 143, 1883-1898;
- Martin Gamerdinger, A Murat Kaya, Uwe Wolfrum, Albrecht M Clement, Christian Behl. (2011). BAG3 mediates chaperone‐based aggresome‐targeting and selective autophagy of misfolded proteins. EMBO Rep. 12, 149-156;
- Модельные организмы: грибы;
- Daniel Kaganovich, Ron Kopito, Judith Frydman. (2008). Misfolded proteins partition between two distinct quality control compartments. Nature. 454, 1088-1095;
- Stéphanie Escusa-Toret, Willianne I. M. Vonk, Judith Frydman. (2013). Spatial sequestration of misfolded proteins by a dynamic chaperone pathway enhances cellular fitness during stress. Nat Cell Biol. 15, 1231-1243;
- Stephanie BM Miller, Chi‐Ting Ho, Juliane Winkler, Maria Khokhrina, Annett Neuner, et. al.. (2015). Compartment‐specific aggregases direct distinct nuclear and cytoplasmic aggregate deposition. EMBO J. 34, 778-797;
- Michael Bruderek, Witold Jaworek, Anne Wilkening, Cornelia Rüb, Giovanna Cenini, et. al.. (2018). IMiQ: a novel protein quality control compartment protecting mitochondrial functional integrity. MBoC. 29, 256-269;
- Liliana Malinovska, Sonja Kroschwald, Matthias C. Munder, Doris Richter, Simon Alberti. (2012). Molecular chaperones and stress-inducible protein-sorting factors coordinate the spatiotemporal distribution of protein aggregates. MBoC. 23, 3041-3056;
- Katie J. Wolfe, Hong Yu Ren, Philipp Trepte, Douglas M. Cyr. (2013). The Hsp70/90 cochaperone, Sti1, suppresses proteotoxicity by regulating spatial quality control of amyloid-like proteins. MBoC. 24, 3588-3602;
- F. Frottin, F. Schueder, S. Tiwary, R. Gupta, R. Körner, et. al.. (2019). The nucleolus functions as a phase-separated protein quality control compartment. Science. 365, 342-347;
- Marina Feric, Nilesh Vaidya, Tyler S. Harmon, Diana M. Mitrea, Lian Zhu, et. al.. (2016). Coexisting Liquid Phases Underlie Nucleolar Subcompartments. Cell. 165, 1686-1697;
- Разделяй и властвуй: роль разделения фаз в жизни клетки;
- Jens S. Andersen, Yun W. Lam, Anthony K. L. Leung, Shao-En Ong, Carol E. Lyon, et. al.. (2005). Nucleolar proteome dynamics. Nature. 433, 77-83;
- Xu Zheng, Joanna Krakowiak, Nikit Patel, Ali Beyzavi, Jideofor Ezike, et. al.. (2016). Dynamic control of Hsf1 during heat shock by a chaperone switch and phosphorylation. eLife. 5;
- Malin Åkerfelt, Richard I. Morimoto, Lea Sistonen. (2010). Heat shock factors: integrators of cell stress, development and lifespan. Nat Rev Mol Cell Biol. 11, 545-555;
- P. Walter, D. Ron. (2011). The Unfolded Protein Response: From Stress Pathway to Homeostatic Regulation. Science. 334, 1081-1086;
- Ashley E. Frakes, Andrew Dillin. (2017). The UPR ER : Sensor and Coordinator of Organismal Homeostasis. Molecular Cell. 66, 761-771;
- D. Thomas Rutkowski, Ramanujan S. Hegde. (2010). Regulation of basal cellular physiology by the homeostatic unfolded protein response. Journal of Cell Biology. 189, 783-794;
- C. M. Haynes, D. Ron. (2010). The mitochondrial UPR - protecting organelle protein homeostasis. Journal of Cell Science. 123, 3849-3855;
- Lilian T. Lamech, Cole M. Haynes. (2015). The unpredictability of prolonged activation of stress response pathways. Journal of Cell Biology. 209, 781-787;
- M. L. Duennwald, S. Lindquist. (2008). Impaired ERAD and ER stress are early and specific events in polyglutamine toxicity. Genes & Development. 22, 3308-3319;
- Julia Leitman, F. Ulrich Hartl, Gerardo Z. Lederkremer. (2013). Soluble forms of polyQ-expanded huntingtin rather than large aggregates cause endoplasmic reticulum stress. Nat Commun. 4;
- Barbara Calamini, Maria Catarina Silva, Franck Madoux, Darren M Hutt, Shilpi Khanna, et. al.. (2012). Small-molecule proteostasis regulators for protein conformational diseases. Nat Chem Biol. 8, 185-196;
- Prajwal Ciryam, Gian Gaetano Tartaglia, Richard I. Morimoto, Christopher M. Dobson, Michele Vendruscolo. (2013). Widespread Aggregation and Neurodegenerative Diseases Are Associated with Supersaturated Proteins. Cell Reports. 5, 781-790;
- Rishika Kundra, Prajwal Ciryam, Richard I. Morimoto, Christopher M. Dobson, Michele Vendruscolo. (2017). Protein homeostasis of a metastable subproteome associated with Alzheimer’s disease. Proc Natl Acad Sci USA. 114, E5703-E5711;
- Prajwal Ciryam, Rishika Kundra, Richard I. Morimoto, Christopher M. Dobson, Michele Vendruscolo. (2015). Supersaturation is a major driving force for protein aggregation in neurodegenerative diseases. Trends in Pharmacological Sciences. 36, 72-77;
- Prajwal Ciryam, Isabella A. Lambert-Smith, Daniel M. Bean, Rosie Freer, Fernando Cid, et. al.. (2017). Spinal motor neuron protein supersaturation patterns are associated with inclusion body formation in ALS. Proc Natl Acad Sci USA. 114, E3935-E3943;
- Salman F. Banani, Hyun O. Lee, Anthony A. Hyman, Michael K. Rosen. (2017). Biomolecular condensates: organizers of cellular biochemistry. Nat Rev Mol Cell Biol. 18, 285-298;
- R. Kayed. (2003). Common Structure of Soluble Amyloid Oligomers Implies Common Mechanism of Pathogenesis. Science. 300, 486-489;
- Альцгеймеровский нейротоксин: ядовиты не только фибриллы;
- Heidi Olzscha, Sonya M. Schermann, Andreas C. Woerner, Stefan Pinkert, Michael H. Hecht, et. al.. (2011). Amyloid-like Aggregates Sequester Numerous Metastable Proteins with Essential Cellular Functions. Cell. 144, 67-78;
- B. Winner, R. Jappelli, S. K. Maji, P. A. Desplats, L. Boyer, et. al.. (2011). In vivo demonstration that -synuclein oligomers are toxic. Proceedings of the National Academy of Sciences. 108, 4194-4199;
- Sae-Hun Park, Yury Kukushkin, Rajat Gupta, Taotao Chen, Ayano Konagai, et. al.. (2013). PolyQ Proteins Interfere with Nuclear Degradation of Cytosolic Proteins by Sequestering the Sis1p Chaperone. Cell. 154, 134-145;
- A. C. Woerner, F. Frottin, D. Hornburg, L. R. Feng, F. Meissner, et. al.. (2016). Cytoplasmic protein aggregates interfere with nucleocytoplasmic transport of protein and RNA. Science. 351, 173-176;
- Montserrat Arrasate, Siddhartha Mitra, Erik S. Schweitzer, Mark R. Segal, Steven Finkbeiner. (2004). Inclusion body formation reduces levels of mutant huntingtin and the risk of neuronal death. Nature. 431, 805-810;
- Mark S. Hipp, Sae-Hun Park, F. Ulrich Hartl. (2014). Proteostasis impairment in protein-misfolding and -aggregation diseases. Trends in Cell Biology. 24, 506-514;
- Chris McKinnon, Sarah J. Tabrizi. (2014). The Ubiquitin-Proteasome System in Neurodegeneration. Antioxidants & Redox Signaling. 21, 2302-2321;
- Johannes Brettschneider, Kelly Del Tredici, Virginia M.-Y. Lee, John Q. Trojanowski. (2015). Spreading of pathology in neurodegenerative diseases: a focus on human studies. Nat Rev Neurosci. 16, 109-120;
- Rocio Gomez-Pastor, Eileen T. Burchfiel, Daniel W. Neef, Alex M. Jaeger, Elisa Cabiscol, et. al.. (2017). Abnormal degradation of the neuronal stress-protective transcription factor HSF1 in Huntington’s disease. Nat Commun. 8;
- Yu-Qing Jiang, Xiu-Li Wang, Xue-Hong Cao, Zeng-You Ye, Li Li, Wen-Qing Cai. (2013). Increased heat shock transcription factor 1 in the cerebellum reverses the deficiency of Purkinje cells in Alzheimer's disease. Brain Research. 1519, 105-111;
- Eunhee Kim, Bin Wang, Namratha Sastry, Eliezer Masliah, Peter T. Nelson, et. al.. (2016). NEDD4-mediated HSF1 degradation underlies α-synucleinopathy. Hum. Mol. Genet.. 25, 211-222;
- Yuan Sun, Jiang‑Rong Zhang, Shuyan Chen. (2017). Suppression of Alzheimer's disease‑related phenotypes by the heat shock protein 70 inducer, geranylgeranylacetone, in APP/PS1 transgenic mice via the ERK/p38 MAPK signaling pathway. Exp Ther Med;
- I. V. Guzhova, V. F. Lazarev, A. V. Kaznacheeva, M. V. Ippolitova, V. I. Muronetz, et. al.. (2011). Novel mechanism of Hsp70 chaperone-mediated prevention of polyglutamine aggregates in a cellular model of huntington disease. Human Molecular Genetics. 20, 3953-3963;
- Nadinath B. Nillegoda, Anne S. Wentink, Bernd Bukau. (2018). Protein Disaggregation in Multicellular Organisms. Trends in Biochemical Sciences. 43, 285-300;
- Qi Chen, Marguerite Prior, Richard Dargusch, Amanda Roberts, Roland Riek, et. al.. (2011). A Novel Neurotrophic Drug for Cognitive Enhancement and Alzheimer's Disease. PLoS ONE. 6, e27865;
- Siyoung Lee, Bo-Ryoung Choi, Jisung Kim, Frank M. LaFerla, Jung Han Yoon Park, et. al.. (2018). Sulforaphane Upregulates the Heat Shock Protein Co-Chaperone CHIP and Clears Amyloid-β and Tau in a Mouse Model of Alzheimer's Disease. Mol. Nutr. Food Res.. 62, 1800240;
- Ari M. Chow, Derek W. F. Tang, Asad Hanif, Ian R. Brown. (2013). Induction of heat shock proteins in cerebral cortical cultures by celastrol. Cell Stress and Chaperones. 18, 155-160;
- Tony Taldone, Stefan O. Ochiana, Pallav D. Patel, Gabriela Chiosis. (2014). Selective targeting of the stress chaperome as a therapeutic strategy. Trends in Pharmacological Sciences. 35, 592-603;
- Xiuyun Sun, Hongying Gao, Yiqing Yang, Ming He, Yue Wu, et. al.. (2019). PROTACs: great opportunities for academia and industry. Sig Transduct Target Ther. 4;
- Tim E. Moors, Jeroen J. M. Hoozemans, Angela Ingrassia, Tommaso Beccari, Lucilla Parnetti, et. al.. (2017). Therapeutic potential of autophagy-enhancing agents in Parkinson’s disease. Mol Neurodegeneration. 12;
- Tânia R. Soares, Sara D. Reis, Brígida R. Pinho, Michael R. Duchen, Jorge M.A. Oliveira. (2019). Targeting the proteostasis network in Huntington’s disease. Ageing Research Reviews. 49, 92-103;
- Физическая водобоязнь;
- Aaron Ciechanover, Yong Tae Kwon. (2017). Protein Quality Control by Molecular Chaperones in Neurodegeneration. Front. Neurosci.. 11.