Ибупрофен: расширение горизонтов применения — от стандарта к инновациям
21 декабря 2023
Ибупрофен: расширение горизонтов применения — от стандарта к инновациям
- 9985
- 1
- 5
В последнее время ибупрофен привлекает внимание медицинского сообщества, поскольку накопленные за многие годы использования в клинической практике наблюдения дают основания для расширения списка показаний применения этого лекарственного средства. Самым интересным является тот факт, что ибупрофен может быть полезен даже при таких тяжелых состояниях, как онкологические и нейродегенеративные заболевания.
Рисунок в полном размере.
рисунок авторов
-
Авторы
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Ибупрофен, относящийся к классу производных пропионовой кислоты, занимает почетное место среди наиболее широко распространенных и доступных без рецепта медикаментов, обладающих анальгезирующим и жаропонижающим действием. Он признан экспертами самым безопасным из нестероидных противовоспалительных средств (НПВС). В данной статье мы расскажем об основных фармакологических и терапевтических характеристиках ибупрофена, а также оценим его побочные эффекты при приеме с другими лекарственными и пищевыми продуктами. Особое внимание мы уделим потенциальному применению ибупрофена в случаях, вовсе не предусмотренных инструкцией.
Конкурс «Био/Мол/Текст»-2023/2024
 Эта статья участвовала в конкурсе «Био/Мол/Текст»-2023/2024 в номинации «Своя работа» и будет опубликована в журнале «Химия и жизнь».
Эта статья участвовала в конкурсе «Био/Мол/Текст»-2023/2024 в номинации «Своя работа» и будет опубликована в журнале «Химия и жизнь».

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.
Партнер номинации — компания «Хеликон».

«Книжный» спонсор конкурса — «Альпина нон-фикшн».
Похмелье как путь к изобретению ибупрофена
Ибупрофен как препарат имеет интересную историю создания. Путь к его изобретению начался с исследования в одной из лабораторий Boots Pure Drug Company Ltd группы фенилпропионовых кислот в 1957 году Стюартом Адамсом и Джоном Николсоном (рис. 1, слева) [1]. В 1962 году они успешно синтезировали 2-(4-изобутилфенил)-пропионовую кислоту, ныне известную как ибупрофен, и зарегистрировали ее под названием «Бруфен» в Британском патентном бюро (рис. 1, справа) [2]. Этот медикамент был первоначально предназначен для лечения ревматоидного артрита; прием осуществлялся под наблюдением врача. В США он появился под торговым названием «Мотрин» в 1974 году.

Рисунок 1. История ибупрофена. Слева — создатели препарата Стюарт Адамс (1923–2019) и Джон Николсон (1925–1983). Справа — реклама препарата Brufen (1969 г.).
Интересно, что в те времена исследователи тестировали разработанные соединения не только на лабораторных животных, но и на своем собственном организме — так поступил и Стюарт Адамс. Однажды он должен был выступать с речью, но накануне был на дружеской вечеринке, и утром его мучило похмелье и ужасная головная боль. Он решил принять 600 мг созданного им и его коллегами вещества. Очень скоро похмелье прошло, а головная боль утихла — новое средство оказалось невероятно эффективным.
Важным моментом в истории ибупрофена стал 1983 г., когда в Великобритании он стал доступным без рецепта под названием «Нурофен». В 1985 г. компания Boots была удостоена Королевской награды за научные и технические достижения в разработке препарата. Благодаря своей работе Адамс и Николсон вошли в Национальный зал славы (National Inventors Hall of Fame) изобретателей 2020 года.
Ибупрофен быстро завоевал популярность благодаря своей эффективности и хорошей переносимости. Сегодня он используется в более чем 120 странах мира как средство для облегчения боли и снижения лихорадки. Для детей существует специальная суспензия «Нурофен для детей», что позволяет его применять с 6 месяцев. Годовое производство ибупрофена составляет около 20 000 тонн, что подчеркивает его важность и широкое распространение в медицинской практике [3], [4].
Отметим, что с момента открытия ибупрофена организация исследований лекарственных препаратов сильно изменилась: новые лекарственные средства проходят жесткий отбор во имя безопасности пациентов. Подробнее обо всем этом можно прочитать в спецпроектах «Биомолекулы» про доклинические, клинические и постклинические испытания современных лекарств (например, в статье «И царствуют, и правят: как регуляторы следят за допуском лекарств на рынок» [5]).
Как работает ибупрофен?
Ибупрофен (DrugBank DB01050) представляет собой один из наиболее распространенных и широко используемых без рецепта медикаментов, принадлежащих к классу нестероидных противовоспалительных средств (НПВС). Термин «нестероидные» подчеркивает основное отличие данных препаратов от глюкокортикоидов, которые являются производными наших собственных стероидных гормонов, что, с одной стороны, делает их более эффективными; с другой же — природное действие стероидных гормонов не ограничивается противовоспалительными эффектами, поэтому их синтетические производные оказывают влияние на множество метаболических путей нашего организма, что выливается в обширный список возможных побочных эффектов.
Ибупрофен — это лекарство, которое заслужило широкое признание благодаря своей способности снижать болевые ощущения, уменьшать воспаление и понижать температуру тела. Этот препарат действует путем неселективного ингибирования синтеза веществ, называемых простагландинами. Простагландины играют важную роль в возникновении болевых ощущений, воспалительных процессах и регуляции температуры тела. Хотя сами по себе простагландины не являются медиаторами боли, они повышают чувствительность болевых рецепторов к таким медиаторам, как гистамин и брадикинин. Важными ферментами в процессе биосинтеза простагландинов являются циклооксигеназы, а именно циклооксигеназа-1 (ЦОГ-1) и циклооксигеназа-2 (ЦОГ-2). ЦОГ-1 постоянно присутствует в тканях и поддерживает базовый уровень простагландинов. ЦОГ-2, напротив, синтезируется в ответ на различные сигналы, такие как цитокины и факторы роста [6]. Ибупрофен снижает активность циклооксигеназ, тем самым уменьшая синтез простагландинов. Этот процесс, в свою очередь, снимает воспаление, боль и высокую температуру (рис. 2).
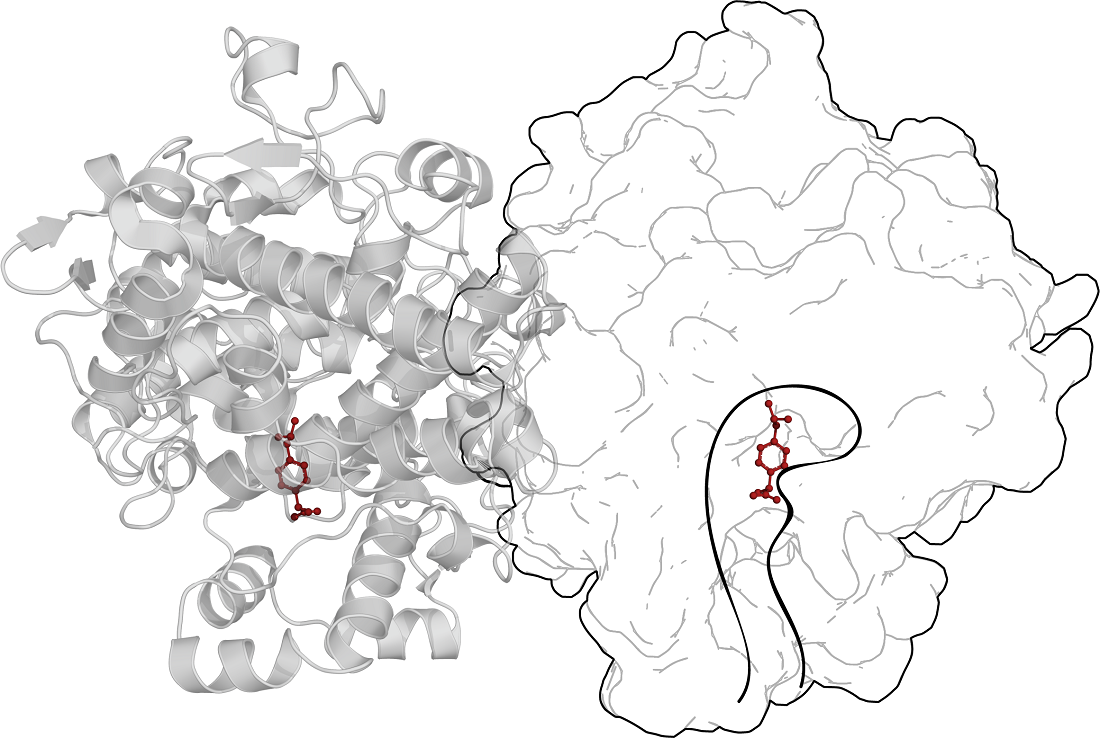
Рисунок 2. Трехмерная структура димерной формы циклооксигеназы-1 в комплексе с ибупрофеном. Один из мономеров представлен в виде контура поверхности с выделенным сайтом связывания и каналом доступа к нему.
рисунок авторов
Отметим, что подвержен воздействию ибупрофена также тромбоксан (один из важных продуктов метаболизма ненасыщенной жирной арахидоновой кислоты), представляющий собой один из простагладинов, регулирующих кровообращение и остановку кровотечения. В частности, тромбоксан А2 (TXA2) производится в клетках, таких как тромбоциты и эндотелий кровеносных сосудов. Его главная функция — стимулировать агрегацию (слипание) тромбоцитов и сокращение сосудов, что способствует образованию тромбов (сгустков крови) и сужению сосудов [7], [8]. Однако отметим, что антикоагулянтное действие ибупрофена на тромбоксан и тромбообразование не столь значительны по сравнению с его противовоспалительным и анальгетическим действием.
Хотя противовоспалительные свойства ибупрофена могут быть менее выраженными по сравнению с некоторыми другими НПВС (индометацин, мефенамовая кислота), он проявляет высокую эффективность в облегчении боли и снижении температуры тела. Механизм его действия и фармакологические характеристики хорошо изучены и подтверждены клиническими исследованиями [9]. Наряду с другими лекарствами, ибупрофен включен в список наиболее важных лекарственных средств Всемирной организации здравоохранения и в перечень жизненно важных лекарственных средств, утвержденный распоряжением Правительства Российской Федерации от 30 декабря 2009 года № 2135-р.
Клиническая фармакология ибупрофена
Ибупрофен доступен в виде таблеток с дозировкой от 200 до 400 мг, а также в виде сиропа и свечей для детей. Самая частая схема использования ибупрофена — прием 200–400 мг три раза в день. Этот препарат практически нерастворим в воде, однако хорошо всасывается в желудочно-кишечном тракте при пероральном приеме. Максимальные концентрации ибупрофена в крови обычно достигаются через 1–2 часа после приема. Препарат полностью выводится из организма в течение 24 часов после приема последней дозы. Ибупрофен более чем на 99% связывается с белками плазмы, активно метаболизируется в печени, поэтому в неизмененном виде практически не выводится [10].
Когда назначают ибупрофен? Перечислим наиболее распространенные виды патологий, где ибупрофен отлично справляется [11]:
- Облегчение боли. Ибупрофен широко используется для уменьшения легких и умеренных болей, снижения температуры тела и лечения дисменореи (маточная боль в сроки, близкие к менструации). Он также может применяться в сочетании с опиоидными анальгетиками для облегчения боли различной интенсивности, включая острую боль, лихорадку и головную боль напряжения [10].
- Зубная боль. Ибупрофен применяется для лечения острой и хронической орофациальной боли (симптомокомплекс болевых ощущений, сосредоточенных в области лица и полости рта), включая зубную боль [12].
- Ревматоидный артрит и остеоартрит. Ибупрофен часто используется для симптоматического лечения воспалительных заболеваний суставов, таких как ревматоидный и остеоартрит [13], [14].
- Кистозный фиброз (КФ) или муковисцидоз (МВ) — это генетическое заболевание, которое влияет на легкие и другие органы, вызывая образование густой слизи, что затрудняет дыхание и может привести к воспалению и инфекциям. Ибупрофен способен снизить воспаление и ограничить приток полиморфноядерных клеток в легкие, что может уменьшить воспалительные процессы и секрецию густой слизи. Это может улучшить функцию легких и облегчить дыхание у пациентов с кистозным фиброзом [15], [16]. Кроме того, показана антибактериальная активность ибупрофена против Pseudomonas aeruginosa и Burkholderia — основных патогенных бактерий в легких пациентов с МВ [17].
- Открытый артериальный проток (ОАП) — это состояние, при котором артериальный проток, который обычно должен закрыться после рождения, остается открытым у новорожденных. Это приводит к аномальному кровообращению между аортой и легочной артерией, что может вызвать серьезные проблемы с сердечной функцией и переносом кислорода. Ибупрофен исследовался как один из вариантов лечения ОАП. Дело в том, что простагландины «поддерживают» артериальный проток открытым, а ингибирование их синтеза ибупрофеном способствует закрытию этого протока [18], [19].
- Ортостатическая гипотензия. Ибупрофен может быть использован для коррекции ортостатической гипотензии — нарушения регуляции артериального давления на фоне различных состояний, которое может вызывать головокружение, слабость и даже потерю сознания при быстром изменении положения тела. Ибупрофен может помочь увеличить объем циркулирующей крови и поддерживать более стабильное кровяное давление при переходе от положения лежа к сидячему или стоячему. Этот эффект связан с его способностью задерживать натрий и противодействовать действию диуретиков [10], [20].
Плюсы и минусы приема ибупрофена
Ибупрофен, по сравнению с другими НПВС, обладает рядом выдающихся преимуществ, что делает его привлекательным выбором при лечении болевых состояний и воспалительных процессов:
- Отсутствие образования токсических метаболитов. Важным преимуществом ибупрофена является то, что он не образует токсических метаболитов в организме (по сравнению с парацетамолом, например). Это делает его менее токсичным при случайной или преднамеренной передозировке по сравнению с некоторыми другими препаратами.
- Большой терапевтический индекс. Ибупрофен безопасен и эффективен в широком диапазоне доз — то есть обладает высоким терапевтическим индексом (вчетверо превосходящим этот показатель у парацетамола).
- Хорошая переносимость у взрослых и детей. Ибупрофен обычно легче переносится взрослыми и считается безопасным для детей. Это делает его популярным выбором для лечения боли и воспаления у пациентов разных возрастных групп.
- Отсутствие синдрома Рея — тяжелого и редкого медицинского состояния (с летальностью до 80%), которое обычно затрагивает детей и подростков. Синдром характеризуется острой энцефалопатией (поражением головного мозга) и жировой дегенерацией печени. Важной мерой профилактики синдрома Рея является избегание применения аспириновых продуктов, что связано с увеличением риска развития синдрома. При этом применение ибупрофена не связано с развитием этого синдрома, и поэтому таким больным его рекомендуется использовать в качестве жаропонижающего и болеутоляющего средства.
- Противовоспалительное действие. В отличие от парацетамола, ибупрофен обладает выраженными противовоспалительными свойствами, что делает его эффективным при лечении воспалительных состояний (например, воспаление суставов, воспаление мягких тканей при травмах).
- Применение у младенцев и недоношенных детей. Ибупрофен всё чаще используется для лечения младенцев и недоношенных детей при медицинском наблюдении, что подчеркивает его безопасность и эффективность в педиатрии.
Тем не менее, чтобы избежать возможных побочных эффектов и осложнений, рекомендуется применять ибупрофен в соответствии с медицинскими рекомендациями. Важно осознавать, что ибупрофен оказывает воздействие на биохимические процессы в организме, в частности, на синтез медиаторов воспаления, влияющих не только на процесс воспаления, но и на функции тромбоцитов. Ибупрофен может воздействовать на систему свертывания крови и даже влиять на продолжительность беременности и родов [10]. Следует обратить внимание на симптомы передозировки, которые могут проявиться при употреблении ибупрофена в количестве, превышающем 99 мг/кг массы тела (около 35 таблеток по 200 мг для среднего человека). Среди наиболее распространенных проявлений передозировки следует выделить боли в животе, тошноту, рвоту, вялость, головокружение, сонливость, головную боль и бессонницу. Кроме того, передозировка может привести к потере сознания, появлению шума в ушах, судорогам. Случаи, когда передозировка ибупрофеном приводит к нарушению функций печени, почечной недостаточности, одышке, угнетению дыхания, острой почечной недостаточности, отмечаются редко, и они в основном связаны с пациентами детского возраста [21–23].
Еще одним побочным эффектом приема ибупрофена является изъязвление желудочно-кишечного тракта. Механизм развития эрозивно-язвенных изменений связывают с блокадой ЦОГ-1, что приводит к последующему существенному снижению выработки эндогенных простагландинов — важнейших элементов естественной гастропротективной системы. Вероятность такого исхода растет при неконтролируемом приеме ибупрофена и нарушении рекомендованной схемы приема препарата. Наглядным примером является прием большой дозы ибупрофена 38-летней домохозяйкой из Китая: женщина приняла 48 капсул ибупрофена. Общее количество препарата составило более 14 000 мг, что превышает рекомендованную дозу более чем в 35 раз. Позднее у женщины была диагностирована язвенная болезнь желудка, но благодаря помощи медиков и поддержке семьи пациентка поправилась через два месяца [24].
В 2016 г. в журнале British Medical Journal было опубликовано большое исследование, посвященное риску развития сердечной недостаточности у возрастных пациентов, принимавших НПВС непрерывно в течение двух недель. Риск госпитализации по поводу сердечной недостаточности у таких пациентов возрастал на 19% [25]. Несмотря на резонанс, который работа получила в прессе, специалисты утверждают, что о рисках для пациентов с сердечно-сосудистыми заболеваниями при приеме НПВС известно давно. Тем не менее, прием обезболивающего от случая к случаю вряд ли приведет к серьезным последствиям.
Отметим, что использование минимальной эффективной концентрации лекарственного средства в течение как можно более короткого времени является золотым правилом при использовании любого препарата.
Что будет, если принимать ибупрофен с другими лекарствами?
При одновременном приеме ибупрофена с другими лекарственными препаратами может возникать риск взаимодействия, влияющего на эффективность и безопасность лечения. Опишем более подробно некоторые основные риски взаимодействия ибупрофена с другими лекарствами:
- Ацетилсалициловая кислота (аспирин) и парацетамол. Одновременное употребление ибупрофена и аспирина может увеличить риск язвенных поражений желудка и кишечника, а также кровотечений [26–28]. При этом при совместном употреблении парацетамола с ибупрофеном не было выявлено заметных отрицательных побочных эффектов [29], [30].
- Препараты, влияющие на кровоточивость. Ибупрофен также может усилить эффекты антикоагулянтов (например, варфарина) и антиагрегантов (например, тиклопидина), что может увеличить риск кровотечений, что опасно, например, при беременности [31], [32].
- Препараты для снижения артериального давления (антигипертензивные средства). Ибупрофен может снижать эффективность некоторых антигипертензивных препаратов (бета- и альфа-адреноблокаторы, диуретики, ингибиторы ангиотензин-превращающего фермента), что может привести к повышению артериального давления [33].
- Препараты для лечения диабета. Ибупрофен не противопоказан при диабете, однако он может повлиять на уровень сахара в крови, поэтому пациентам с диабетом следует тщательно контролировать уровень глюкозы при приеме ибупрофена [34].
- Лекарства, влияющие на почки. Ибупрофен может ухудшить функцию почек, поэтому при одновременном приеме с другими лекарствами, влияющими на почечную функцию, может возникнуть риск осложнений [35].
- Антидепрессанты. Ибупрофен может влиять на уровень серотонина, а, следовательно, и на эффективность антидепрессантов на основе ингибиторов обратного захвата серотонина (флуоксетин, циталопрам, сертралин) [36], [37].
Как некоторые продукты питания могут влиять на действие ибупрофена
Продукты питания могут влиять на действие ибупрофена, ускоряя или замедляя его усвоение и влияя на возможность нежелательных побочных эффектов. Ибупрофен можно принимать как с пищей, так и натощак. Однако стоит отметить, что употребление ибупрофена с пищей часто сопровождается уменьшением риска раздражения слизистой оболочки желудка. Чтобы смягчить воздействие на желудок, рекомендуется принимать ибупрофен с молоком или молочными продуктами [38]. Следует учитывать, что употребление жирных блюд в сочетании с ибупрофеном может замедлить его усвоение в организме. Это может привести к тому, что действие препарата начнется несколько позже, чем при его приеме на голодный желудок. Однако данное воздействие также может снизить вероятность раздражения слизистой оболочки желудка и уменьшить риск нежелательных побочных эффектов. Употребление алкоголя в сочетании с ибупрофеном, напротив, может увеличить риск развития побочных эффектов со стороны желудочно-кишечного тракта [39]. Отметим также, что одновременное употребление кофеина с ибупрофеном может усилить анальгетический эффект препарата, однако эта реакция варьируется от человека к человеку [40]. Некоторые диетические добавки могут быть опасными при совмещении с ибупрофеном. К таким добавкам относят гинкго, чеснок, имбирь, чернику, женьшень и куркуму, которые могут предотвратить агрегацию тромбоцитов; или добавки, увеличивающие риск кровотечения и степень разжижения крови (ромашка, конский каштан, пажитник и красный клевер, тамаринд) [41].
Новые сферы применения ибупрофена
То, что лекарственные препараты тщательно изучаются перед внедрением в медицинскую практику, знают все, но мало кто задумывается о том, что препарат не пропадает из поля зрения исследователей после его одобрения к использованию. Исследователи бережно собирают данные о применении препарата у разных групп пациентов, обращают внимание на его эффекты по отношению к различным хроническим заболеваниям, для которых данное лекарство не является «целевым». Многолетняя практика использования ибупрофена позволила накопить большой объем подобной информации. «Биомолекула» уже разбирала подробности таких исследований в статье «Весь мир — большая лаборатория: что такое RWD и RWE, и как они помогают контролировать лекарства» [42]. Заинтересовавшись новыми данными, ученые стали активно искать механизмы, которые задействованы в реализации новых эффектов ибупрофена (рис. 3).
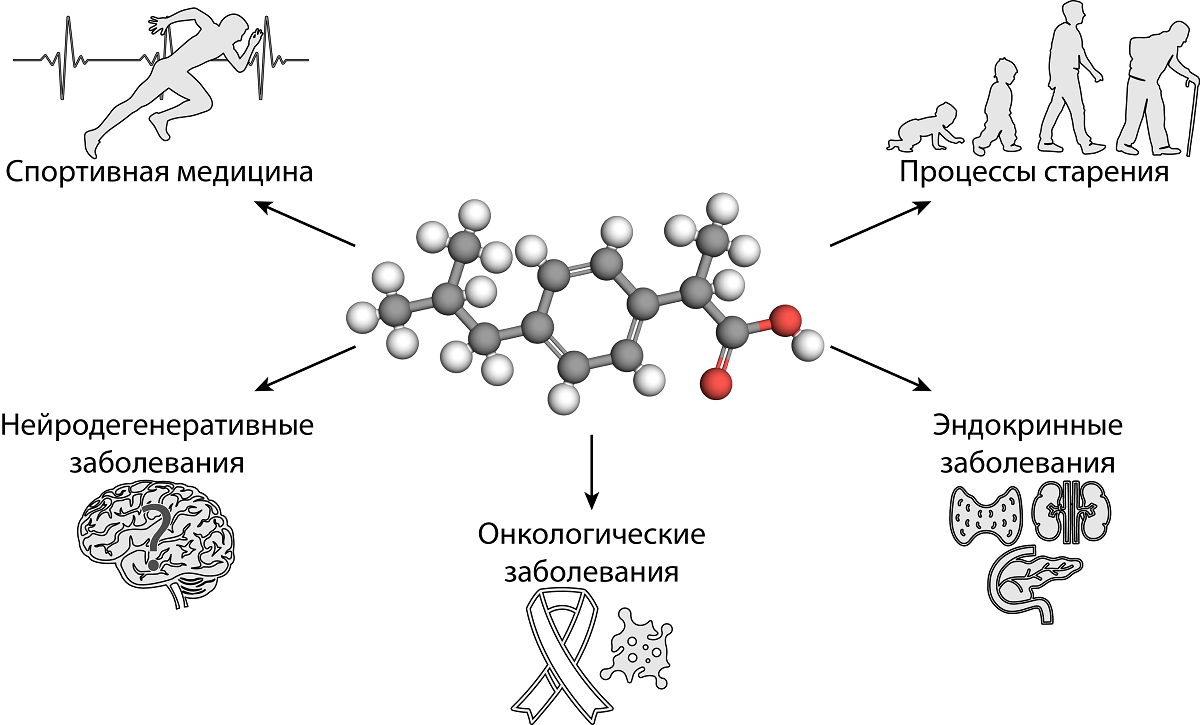
Рисунок 3. Схематичное представление новых возможных сфер применения ибупрофена.
рисунок авторов
Самым простым объяснением является противовоспалительное действие препарата, поскольку воспалительные процессы играют важную роль в патогенезе многих заболеваний, включая онкологические и нейродегенеративные. Тем не менее, были также выявлены и другие потенциальные механизмы, обусловливающие полезные свойства ибупрофена при таких состояниях, как онкологические, эндокринные, нейродегенеративные заболевания, старение, интенсивная физическая нагрузка. Конечно, хронические заболевания требуют длительного приема ибупрофена, что заставляет задуматься о безопасности такого использования. Несмотря на имеющийся опыт применения ибупрофена длительными курсами у пациентов с ревматоидным артритом, каждый такой случай должен быть исследован отдельно для разработки обоснованных, а главное — безопасных врачебных рекомендаций.
Онкология. Положительные эффекты ибупрофена были выявлены у пациентов, страдающих онкологическими заболеваниями. Исследователи показали, что НПВС (в первую очередь ибупрофен и аспирин) существенно снижают риск развития рака толстой кишки, молочной железы, легких и предстательной железы. При этом отмечается, что ибупрофен оказывает более сильное противораковое действие, чем аспирин — особенно против рака молочной железы и легких [43]. Интересно, что прием ибупрофена может быть использован как мера профилактики развития рака у курильщиков. Клиническое исследование, посвященное связи рака легких и приема НПВС, включало более 5000 человек. Согласно его данным, регулярный прием ибупрофена снижает риск развития рака легких на 48% [44].
Исследуя молекулярные механизмы противоопухолевых эффектов ибупрофена, ученые обнаружили его новые биологические функции. Например, ибупрофен может влиять на степень метилирования и ацетилирования гистонов — белков, участвующих в упаковке ДНК и регулирующих считывание генетической информации. Эта способность ибупрофена позволяет регулировать экспрессию генов, с одной стороны связанных с воспалением, а с другой — задействованных в развитии онкологии [45]. Кроме in vitro данных, ученым удалось получить данные на животных моделях об увеличении выживаемости и снижении роста и метастазирования опухоли на фоне приема ибупрофена [45]. В другом исследовании было показано, что ибупрофен значительно стимулирует эффективность TRAIL-лиганда суперсемейства факторов некроза опухоли, запускающего гибель клеток человеческого рака толстой кишки HCT116 [46]. Еще одним механизмом противоопухолевого действия ибупрофена, обнаруженным в in vitro исследованиях, является его способность усиливать иммунитет против опухолей. Полученные результаты, по мнению самих исследователей, дают надежду на повышение эффективности противоопухолевой иммунотерапии при включении ибупрофена в курс лечения [47].
Эти и другие эпигенетические модификации мы обсуждали в статье «Молекулы и эпигеном» [48] спецпроекта по Эпигенетике.
Еще один возможный механизм эффективности ибупрофена в описанных случаях связывают с вариацией его форм [49]. В отличие от многих других лекарств, ибупрофен представляет собой рацемическую смесь R- и S-энантиомеров. Антивоспалительным действием обладает лишь форма S, однако тело человека может «конвертировать» R-форму в S благодаря процессу, известному как хиральная инверсия. В случае поражения простаты в раковых клетках обнаруживают повышенное содержание некоторых форм рацемазы AMACR, которая отвечает за эту инверсию. Считается, что данные формы AMCAR усиливают пролиферацию (деление) клеток опухоли, но связь между уровнем AMCAR и поведением раковых клеток пока изучена не до конца. Предполагается, что если этот энзим «занять» превращением R-ибупрофена в S-ибупрофен, у него не останется ресурсов и возможностей «помогать» раковым клеткам делиться. В результате распространение рака заметно замедляется [49], [50].
Эти результаты открывают новые перспективы для использования ибупрофена в качестве инструмента в лечении раковых заболеваний и могут потенциально привести к разработке новых и совершенствованию уже имеющихся терапевтических подходов [47].
Омолаживающее действие ибупрофена. Была обнаружена способность ибупрофена увеличивать продолжительность жизни. Так, было показано, что ибупрофен продлевает жизнь дрожжей (Saccharomyces cerevisiae), нематод (Caenorhabditis elegans) и дрозофил (Drosophila melanogaster) в среднем на 15%. Интересно, что данный эффект можно наблюдать на эукариотических организмах, согласно научной классификации относящихся в случае нематод и дрозофил к разным типам, а в случае дрожжей — к разным царствам. Такой широкий охват видов дает надежду на возможность получения такого эффекта и у млекопитающих. Предполагается, что ибупрофен дестабилизирует работу специфических транспортных белков пермеаз Tat2p (permease Tat2p), что замедляет усвоение аминокислоты триптофана, участвующей в синтезе белков. Это приводит к увеличению репликативной продолжительности жизни. Исследователи также отмечают влияние ибупрофена на течение клеточного цикла, а именно — на удлинение G1-фазы цикла, в которой происходит синтез мРНК и белков для образования ДНК [51].
Спортивная медицина. Статистика говорит о том, что до 75% бегунов на длинные дистанции во время соревнований принимают НПВС. Их используют в качестве противовоспалительных и обезболивающих средств. Исследование эффектов ибупрофена при приеме его спортсменами при марафонских забегах показали, что прием ибупрофена позволил снизить мышечную усталость и окислительный стресс, провоцируемый интенсивной физической нагрузкой [52]. В то же время, некоторые исследования говорят о частом развитии при приеме НПВС во время интенсивной физической нагрузки таких осложнений, как тошнота, рвота, боль в животе, диарея.
Эндокринные заболевания. По данным клинических исследований, прием ибупрофена оказывает лечебный эффект при поликистозе яичников у женщин — заболевании, связанном с повышением уровня тестостерона. Предположительно, уровень этого гормона стимулируют провоспалительные вещества-регуляторы, уровень которых, а соответственно и уровень тестостерона, можно снизить с помощью ибупрофена. На практике исследователи действительно видят связь между приемом ибупрофена и снижением уровня тестостерона у женщин с данным заболеванием, но точный механизм наблюдаемых эффектов ибупрофена требует дальнейшего изучения [53].
Нейродегенеративные заболевания. Касательно нейродегенеративных заболеваний известно, что ибупрофен снижает риск развития болезни Альцгеймера [54], [55] при длительном приеме у возрастных пациентов. По некоторым данным, прием ибупрофена в течение 5 лет снижает риск развития болезни Альцгеймера более чем на 40%, и чем дольше пациент использует ибупрофен, тем ниже риск деменции. Подобные наблюдения были сделаны для некоторых, но не для всех НПВС, из чего можно предположить, что наблюдаемый профилактический эффект обусловлен не только противовоспалительным действием препаратов.
Результаты наших исследований показывают, что одним из альтернативных механизмов действия, который может быть реализован для ибупрофена, является его способность менять свойства сывороточного альбумина, отвечающего за транспорт бета-амилоидного пептида (амилоида), накопление которого в центральной нервной системе (ЦНС) пациента считается одной из основных причин нарушения работы мозга и развития деменции. Известно, что сывороточный альбумин (ЧСА) способствует выведению амилоида из ЦНС [56], [57]. Ибупрофен усиливает их взаимодействие: в результате способность альбумина «выводить» амилоид из ЦНС пациента повышается, что должно препятствовать развитию заболевания [58]. Нами было показано, что ибупрофен не просто увеличивает силу связывания амилоида с альбумином, но и помогает альбумину блокировать образование фибрилл амилоида (длинных тяжей, из которых впоследствии формируются отложения амилоида в головном мозге) (рис. 4). Такой механизм может быть реализован in vivo, поскольку сывороточный альбумин присутствует и в цереброспинальной жидкости, и в межклеточном пространстве головного мозга.
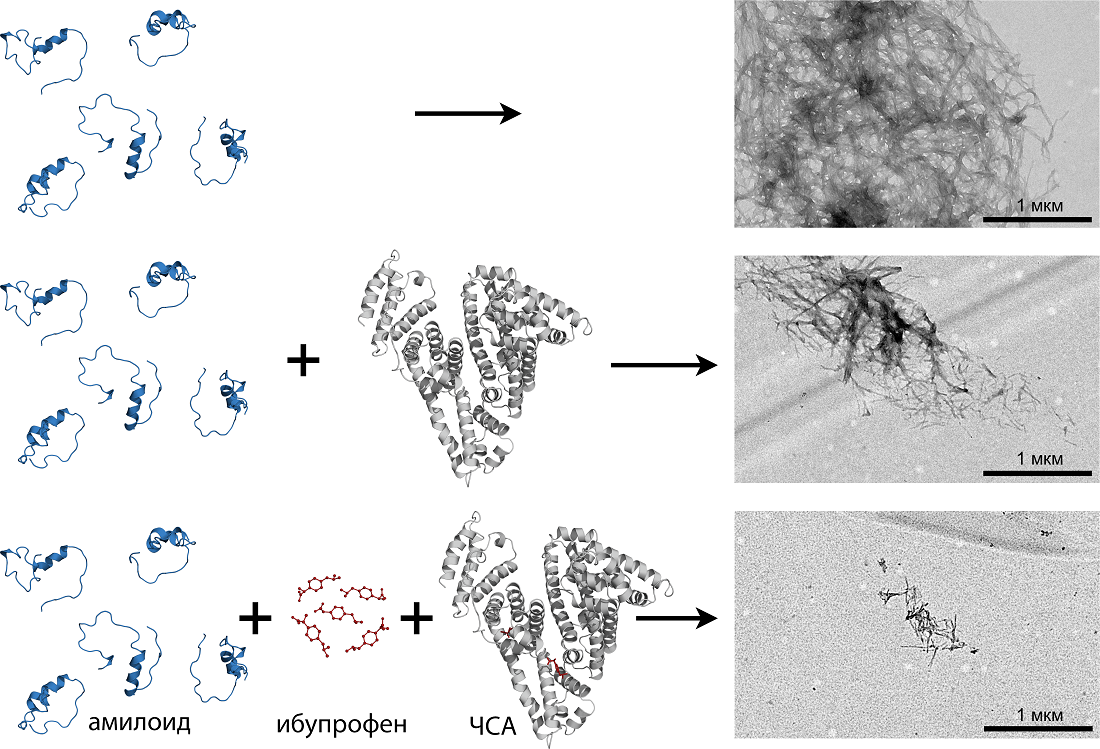
Рисунок 4. Влияние альбумина (ЧСА) и ибупрофена на фибриллообразование бета-амилоидного пептида. На верхней панели приведена электронная микрофотография амилоидных фибрилл, на средней панели — фибриллы в присутствии 2 мкМ ЧСА, нижняя панель — 2 мкМ ЧСА и 20 мкМ ибупрофена.
рисунок авторов с использованием микрофотографий из [58]
По некоторым данным, сам ибупрофен также может препятствовать формированию отложений амилоида [59], снижать его продукцию [60], [61] и обладает нейропротекторной активностью [62], в том числе за счет противодействия свободным радикалам, разрушающим нейроны головного мозга.
Нейропротекторный эффект ибупрофена по мнению некоторых исследователей также позволяет снизить риск развития другого нейродегенеративного заболевания — болезни Паркинсона. Впервые защитные свойства ибупрофена по отношению к дофаминергическим нейронам были обнаружены еще в 2000 г. в экспериментах in vitro [63]. Исследователи обнаружили, что ибупрофен защищает нейроны от токсического действия глутамата [64] — нейромедиатора, участвующего в патогенезе болезни Паркинсона. Позднее эти данные удалось подтвердить и на животных моделях болезни Паркинсона [65]. В эпидемиологических исследованиях было установлено, что у пациентов, принимавших ибупрофен дважды или более раз в неделю, болезнь Паркинсона развивалась на 38% реже, чем у тех, кто регулярно принимал аспирин, ацетаминофен или другие НПВС. В то же время, результаты другого исследования показали, что у пациентов с наследственной предрасположенностью к болезни Паркинсона или генетическими формами данного заболевания риск развития заболевания можно снизить с помощью приема НПВС, в том числе аспирина и ибупрофена [66].
Несмотря на оптимистичные результаты, ученые говорят о необходимости проведения дополнительных исследований, которые помогут понять механизм действия ибупрофена на развитие болезни Паркинсона, а также подобрать оптимальную схему лечения, минимизируя побочные эффекты. Это представляется разумным в свете появления исследований с противоположными данными, говорящими об отсутствии эффекта ибупрофена и других НПВС на развитие болезни Паркинсона [67].
Заключение
С открытия ибупрофена прошло чуть более 60 лет, и на сегодняшний день он является самым популярным безрецептурным НПВС. Препарат можно принимать в дозах выше рекомендуемых без каких-либо серьезных побочных эффектов и, что важно, без необратимых влияний на печень, как это случается при приеме парацетамола и диклофенака. На сегодняшний день написаны несколько книг, посвященных его применению и использованию [68], [69]; с 2002 г. проводятся ежегодные Международные конференции по его применению в педиатрии. Исследователи всё чаще отмечают, что будущее за модернизацией лекарственных форм, доз и способов применения ибупрофена. Многие научные работы посвящены разработкам форм ибупрофена с быстро наступающим эффектом или пролонгированным действием, что может повысить его эффективность и упростить способ приема.
Кроме того, в настоящее время ибупрофен становится препаратом потенциального применения при ряде состояний, не упомянутых в инструкции. Растет количество данных о возможной роли ибупрофена как профилактического средства для предупреждения болезней Альцгеймера и Паркинсона, для лечения онкологических заболеваний, например, колоректального рака. Однако для использования ибупрофена как инновационного препарата в перечисленных случаях необходимы глубокие фундаментальные и более длительные клинические исследования.
Финансирование: исследование влияния ибупрофена на взаимодействие бета-амилоидного пептида с альбумином выполнено за счет гранта Российского научного фонда № 20-74-10072 (Литус Е.А., Институт биологического приборостроения РАН — обособленное подразделение ФИЦ ПНЦБИ РАН).
Литература
- Stewart S. Adams. (1992). The Propionic Acids: A Personal Perspective. The Journal of Clinical Pharma. 32, 317-323;
- Adams S.S., McCullough K.F., Nicholson J.S. (1969). The pharmacological properties of ibuprofen, an anti-inflammatory, analgesic and antipyretic agent. Arch. Int. Pharmacodyn. Ther. 178, 115–129;
- Gayle M. Halford, Marie Lordkipanidzé, Steve P. Watson. (2012). 50th anniversary of the discovery of ibuprofen: an interview with Dr Stewart Adams. Platelets. 23, 415-422;
- K. D. Rainsford. (2013). Ibuprofen: from invention to an OTC therapeutic mainstay. International Journal of Clinical Practice. 67, 9-20;
- И царствуют, и правят: как регуляторы следят за допуском лекарств на рынок;
- N A Mohammed. (2004). Distribution of constitutive (COX-1) and inducible (COX-2) cyclooxygenase in postviral human liver cirrhosis: a possible role for COX-2 in the pathogenesis of liver cirrhosis. Journal of Clinical Pathology. 57, 350-354;
- Как работает свертывание крови?;
- Последний путь тромбоцита;
- K. D. Rainsford. (2009). Ibuprofen: pharmacology, efficacy and safety. Inflammopharmacol. 17, 275-342;
- Rabia Bushra, Nousheen Aslam. (2010). An Overview of Clinical Pharmacology of Ibuprofen. Oman Med J. 25, 155-161;
- H. Potthast, J.B. Dressman, H.E. Junginger, K.K. Midha, H. Oeser, et. al.. (2005). Biowaiver Monographs for Immediate Release Solid Oral Dosage Forms: Ibuprofen**This paper reflects the scientific opinion of the authors and not the policies of regulating agencies.. Journal of Pharmaceutical Sciences. 94, 2121-2131;
- PAUL A. MOORE, ELLIOT V. HERSH. (2001). Celecoxib and rofecoxib. The Journal of the American Dental Association. 132, 451-456;
- Tan S.C. (1999). Ibuprofen stereochemistry: double-the-trouble? Enantiomer. 4, 195–203;
- Hiroyuki Ikuta, Atsushi Kawase, Masahiro Iwaki. (2017). Stereoselective Pharmacokinetics and Chiral Inversion of Ibuprofen in Adjuvant-induced Arthritic Rats. Drug Metab Dispos. 45, 316-324;
- Michael W. Konstan, Jeanne E. Krenicky, Marcie R. Finney, H. Lester Kirchner, Kathleen A. Hilliard, et. al.. (2003). Effect of Ibuprofen on Neutrophil Migration in Vivo in Cystic Fibrosis and Healthy Subjects. J Pharmacol Exp Ther. 306, 1086-1091;
- Larry C. Lands, Ruth Milner, André M. Cantin, David Manson, Mary Corey. (2007). High-Dose Ibuprofen in Cystic Fibrosis: Canadian Safety and Effectiveness Trial. The Journal of Pediatrics. 151, 249-254;
- Parth N. Shah, Kimberly R. Marshall-Batty, Justin A. Smolen, Jasur A. Tagaev, Qingquan Chen, et. al.. (2018). Antimicrobial Activity of Ibuprofen against Cystic Fibrosis-Associated Gram-Negative Pathogens. Antimicrob Agents Chemother. 62;
- Pramod Kumar Sharma, Santosh Kumar Garg, Anil Narang. (2003). Pharmacokinetics of Oral Ibuprofen in Premature Infants. The Journal of Clinical Pharma. 43, 968-973;
- Jean-Bernard Gouyon, Yves Kibleur. (2010). Efficacy and tolerability of enteral formulations of ibuprofen in the treatment of patent ductus arteriosus in preterm infants. Clinical Therapeutics. 32, 1740-1748;
- Edward T. Zawada. (1982). Renal consequences of nonsteroidal antiinflammatory drugs. Postgraduate Medicine. 71, 223-230;
- Alan H Hall, Susan C Smolinske, Frances L Conrad, Kathleen M Wruk, Kenneth W Kulig, et. al.. (1986). Ibuprofen overdose: 126 cases. Annals of Emergency Medicine. 15, 1308-1313;
- André Farkouh, Margit Hemetsberger, Christian R. Noe, Christoph Baumgärtel. (2022). Interpreting the Benefit and Risk Data in Between-Drug Comparisons: Illustration of the Challenges Using the Example of Mefenamic Acid versus Ibuprofen. Pharmaceutics. 14, 2240;
- Volans G., Monaghan J., Colbridge M. (2003). Ibuprofen overdose. Int. J. Clin. Pract. Suppl. 135, 54–60;
- Zhang Meijuan, Penglong Yu, Jie Yuan, Tao Yu, Dan SUN. (2023). Stomach ulcer caused by mistakenly oral medication of 14,400 mg ibuprofen: A case report. Medicine. 102, e33812;
- Andrea Arfè, Lorenza Scotti, Cristina Varas-Lorenzo, Federica Nicotra, Antonella Zambon, et. al.. (2016). Non-steroidal anti-inflammatory drugs and risk of heart failure in four European countries: nested case-control study. BMJ. i4857;
- Grant W. Reed, Mouin S. Abdallah, Mingyuan Shao, Kathy Wolski, Lisa Wisniewski, et. al.. (2018). Effect of Aspirin Coadministration on the Safety of Celecoxib, Naproxen, or Ibuprofen. Journal of the American College of Cardiology. 71, 1741-1751;
- Aamir A. Cheema. (2004). Should People on Aspirin Avoid Ibuprofen?. Cardiology in Review. 12, 174-176;
- Salim M. A. Bastaki, Ireneusz T. Padol, Naheed Amir, Richard H. Hunt. (2018). Effect of Aspirin and ibuprofen either alone or in combination on gastric mucosa and bleeding time and on serum prostaglandin E2 and thromboxane A2 levels in the anaesthetized rats in vivo. Mol Cell Biochem. 438, 25-34;
- Hartley C. Atkinson, Ioana Stanescu, Chris Frampton, Isam I. Salem, Charles P. H. Beasley, Richard Robson. (2015). Pharmacokinetics and Bioavailability of a Fixed-Dose Combination of Ibuprofen and Paracetamol after Intravenous and Oral Administration. Clin Drug Investig. 35, 625-632;
- Niccolò Parri, Davide Silvagni, Alberto Chiarugi, Elisabetta Cortis, Antonio D’Avino, et. al.. (2023). Paracetamol and ibuprofen combination for the management of acute mild-to-moderate pain in children: expert consensus using the Nominal Group Technique (NGT). Ital J Pediatr. 49;
- Lorenzo Villa Zapata, Philip D. Hansten, Jennifer Panic, John R. Horn, Richard D. Boyce, et. al.. (2020). Risk of Bleeding with Exposure to Warfarin and Nonsteroidal Anti-Inflammatory Drugs: A Systematic Review and Meta-Analysis. Thromb Haemost. 120, 1066-1074;
- E. Ericsson, M. Brattwall, S. Lundeberg. (2015). Swedish guidelines for the treatment of pain in tonsil surgery in pediatric patients up to 18 years. International Journal of Pediatric Otorhinolaryngology. 79, 443-450;
- Salort-Llorca C., Mínguez-Serra M.P., Silvestre-Donat F.J. (2008). Interactions between ibuprofen and antihypertensive drugs: incidence and clinical relevance in dental practice. Med. Oral Patol. Oral Cir. Bucal. 13, 717–721;
- Chun Zhou, Qimeng Wu, Ziliang Ye, Yuanyuan Zhang, Yanjun Zhang, et. al.. (2022). Regular use of ibuprofen or paracetamol and incident type 2 diabetes: A prospective cohort study in the UK Biobank. Diabetes & Metabolism. 48, 101388;
- Jessica Leete, Carolyn Wang, Francisco J. López-Hernández, Anita T. Layton. (2022). Determining risk factors for triple whammy acute kidney injury. Mathematical Biosciences. 347, 108809;
- Sefi Kronenberg. (2011). Anti-inflammatory drugs as moderators of antidepressant effects, especially those of the selective serotonin-reuptake inhibitor class. Expert Review of Clinical Pharmacology. 4, 575-578;
- Ole Köhler, Liselotte Petersen, Ole Mors, Christiane Gasse. (2015). Inflammation and depression: combined use of selective serotonin reuptake inhibitors and NSAIDs or paracetamol and psychiatric outcomes. Brain and Behavior. 5;
- Samantha M. Bennett, Lisa Zhou, John E. Hayes. (2012). Using Milk Fat to Reduce the Irritation and Bitter Taste of Ibuprofen. Chem. Percept.. 5, 231-236;
- Minjeong Kim, Eugenia Jin Lee, Kyung-Min Lim. (2021). Ibuprofen Increases the Hepatotoxicity of Ethanol through Potentiating Oxidative Stress. Biomolecules & Therapeutics. 29, 205-210;
- Sheena Derry, Philip J Wiffen, R Andrew Moore. (2015). Single dose oral ibuprofen plus caffeine for acute postoperative pain in adults. Cochrane Database of Systematic Reviews. 2019;
- W. Abebe. (2002). Herbal medication: potential for adverse interactions with analgesic drugs. J Clin Pharm Ther. 27, 391-401;
- Весь мир — большая лаборатория: что такое RWD и RWE, и как они помогают контролировать лекарства;
- Harris R.E. (2005). Aspirin, ibuprofen, and other non-steroidal anti-inflammatory drugs in cancer prevention: a critical review of non-selective COX-2 blockade (review). Oncol. Rep. 13, 559–583;
- Marisa A. Bittoni, David P. Carbone, Randall E. Harris. (2017). Ibuprofen and fatal lung cancer: A brief report of the prospective results from the Third National Health and Nutrition Examination Survey (NHANES III). Molecular and Clinical Oncology. 6, 917-920;
- Wenzhi Shen, Xiaoyuan Zhang, Renle Du, Wenjuan Gao, Juan Wang, et. al.. (2020). Ibuprofen mediates histone modification to diminish cancer cell stemness properties via a COX2-dependent manner. Br J Cancer. 123, 730-741;
- MOMOKO TODO, MANO HORINAKA, MITSUHIRO TOMOSUGI, RYOICHI TANAKA, HARUNA IKAWA, et. al.. (2013). Ibuprofen enhances TRAIL-induced apoptosis through DR5 upregulation. Oncology Reports. 30, 2379-2384;
- Xingchun Gao, Na Guo, Hao Xu, Tao Pan, Hong lei, et. al.. (2020). Ibuprofen induces ferroptosis of glioblastoma cells via downregulation of nuclear factor erythroid 2-related factor 2 signaling pathway. Anti-Cancer Drugs. 31, 27-34;
- Молекулы и эпигеном ;
- Qu X. et al. (2013). Hydrolysis of ibuprofenoyl-CoA and other 2-APA-CoA esters by human acyl-CoA thioesterases-1 and —2 and their possible role in the chiral inversion of profens. Biochem. Pharmacol., 1621–1625;
- Matthew D. Lloyd, Maksims Yevglevskis, Guat Ling Lee, Pauline J. Wood, Michael D. Threadgill, Timothy J. Woodman. (2013). α-Methylacyl-CoA racemase (AMACR): Metabolic enzyme, drug metabolizer and cancer marker P504S. Progress in Lipid Research. 52, 220-230;
- Chong He, Scott K. Tsuchiyama, Quynh T. Nguyen, Ekaterina N. Plyusnina, Samuel R. Terrill, et. al.. (2014). Enhanced Longevity by Ibuprofen, Conserved in Multiple Species, Occurs in Yeast through Inhibition of Tryptophan Import. PLoS Genet. 10, e1004860;
- Raphael Fabricio de Souza, Dihogo Gama de Matos, Jymmys Lopes dos Santos, Clésio Andrade Lima, Alexandre Reis Pires Ferreira, et. al.. (2022). Effects of ibuprofen during 42-km trail running on oxidative stress, muscle fatigue, muscle damage and performance: a randomized controlled trial. Research in Sports Medicine. 1-11;
- Beata Banaszewska, Katarzyna Ozegowska, Martyna Polska, Leszek Pawelczyk, R Jeffrey Chang, Antoni J Duleba. (2022). Ibuprofen Reduces Testosterone Level in Women With Polycystic Ovary Syndrome. Journal of the Endocrine Society. 6;
- Альбумин VS Альцгеймер;
- На руинах памяти: настоящее и будущее болезни Альцгеймера;
- Альбумин VS Альцгеймер;
- Шевелёва М.П. (2023). Роль человеческого сывороточного альбумина в профилактике и лечении болезни Альцгеймера. Журнал общей биологии. 84, 83;
- Ekaterina A. Litus, Alexey S. Kazakov, Evgenia I. Deryusheva, Ekaterina L. Nemashkalova, Marina P. Shevelyova, et. al.. (2022). Ibuprofen Favors Binding of Amyloid-β Peptide to Its Depot, Serum Albumin. IJMS. 23, 6168;
- Ji-Kyung Choi, Bruce G. Jenkins, Isabel Carreras, Sukru Kaymakcalan, Kerry Cormier, et. al.. (2010). Anti-inflammatory treatment in AD mice protects against neuronal pathology. Experimental Neurology. 223, 377-384;
- Qiao Yan, Jianhua Zhang, Hantao Liu, Safura Babu-Khan, Robert Vassar, et. al.. (2003). Anti-Inflammatory Drug Therapy Alters β-Amyloid Processing and Deposition in an Animal Model of Alzheimer's Disease. J. Neurosci.. 23, 7504-7509;
- Sascha Weggen, Jason L. Eriksen, Pritam Das, Sarah A. Sagi, Rong Wang, et. al.. (2001). A subset of NSAIDs lower amyloidogenic Aβ42 independently of cyclooxygenase activity. Nature. 414, 212-216;
- Dokmeci D. (2004). Ibuprofen and Alzheimer’s disease. Folia Med. (Plovdiv). 46, 5–10;
- Diana Casper, Uma Yaparpalvi, Nicole Rempel, Peter Werner. (2000). Ibuprofen protects dopaminergic neurons against glutamate toxicity in vitro. Neuroscience Letters. 289, 201-204;
- Очень нервное возбуждение;
- Emilce Carrasco, Diana Casper, Peter Werner. (2005). Dopaminergic neurotoxicity by 6-OHDA and MPP+: Differential requirement for neuronal cyclooxygenase activity. J. Neurosci. Res.. 81, 121-131;
- Marta San Luciano, Caroline M. Tanner, Cheryl Meng, Connie Marras, Samuel M. Goldman, et. al.. (2020). Nonsteroidal
Anti‐inflammatory Use andLRRK2 Parkinson's Disease Penetrance. Movement Disorders. 35, 1755-1764; - Brage Brakedal, Charalampos Tzoulis, Ole-Bjørn Tysnes, Kristoffer Haugarvoll. (2021). NSAID use is not associated with Parkinson’s disease incidence: A Norwegian Prescription Database study. PLoS ONE. 16, e0256602;
- Ngo V.T.H., Bajaj T. Ibuprofen. StatPearls, 2023;
- Ershad M., Ameer M.A., Vearrier D. Ibuprofen Toxicity. StatPearls, 2023.