
И царствуют, и правят: как регуляторы следят за допуском лекарств на рынок
29 июля 2022
И царствуют, и правят: как регуляторы следят за допуском лекарств на рынок
- 1547
- 1
- 4
Регуляторы строго регламентируют как разработку и исследования лекарств, так и их пострегистрационную жизнь.
Рисунок в оригинальном разрешении.
иллюстрация Карины Илиопуло
-
Автор
-
Редакторы
-
Рецензент
-
Иллюстратор
Регулирование в области лекарственных препаратов — довольно новое явление в медицине. Тем не менее, оно уже успело обрасти историями успехов и провалов, а также множеством руководств и правил. В первой статье нового спецпроекта «Биомолекулы» в сотрудничестве с ФМИ мы вспомним историю лекарств и их изучения в рамках доклинических и клинических исследований, в особенности в контексте пострегистрационного надзора, а также разберемся, что у регуляторов работает хорошо, а что — не очень.
Постклинические исследования
На «Биомолекуле» вышло уже два спецпроекта о судьбах лекарств — в доклинических и в клинических исследованиях. Что же с ними происходит после выпуска на рынок? А также как происходит оформление у регуляторов? С окончанием фазы 3 научные исследования и разработка не заканчиваются. После регистрации и выхода на рынок продолжается сбор данных об эффективности, безопасности, оценка рисков, которые влияют как на судьбу самого лекарства, так и на разработку новых. Этот спецпроект расскажет о четвертой фазе клинических исследований, real-world data, и о том, как регулируются процессы разработки и производства лекарств.
«Откуда мы знаем, что ковидные вакцины безопасны?». Статьями с подобными заголовками совсем недавно пестрели многие медиа. Действительно, откуда мы это знаем и почему доверяем лекарствам, которые были одобрены специальными организациями?
Работа фармацевтического рынка (и рынка потребительских товаров в целом) у некоторых вызывает недоверие, но на самом деле фармотрасль— одна из самых строго регулируемых в мире. Она стоит на трех китах: качество, безопасность и эффективность. Сотни руководств по доклиническим и клиническим исследованиям ограничивают попадание к пациенту опасных, неработающих или низкокачественных лекарств [1]. Часто вывод препарата на рынок занимает многие годы [2], но бывают и ситуации, когда это происходит быстрее.
В этой статье мы поговорим о том, как регуляторы вроде FDA (United States Food and Drug Administration) и EMA (European Medicine Agency) стоят на службе здоровья и безопасности потребителя. Сразу отметим, что речь в основном пойдет о разработке и регистрации новых лекарств и продуктов, содержащих инновационные, ранее не применявшиеся действующие вещества или использующие новые технологии. Но сразу отметим, что некоторые из регуляторов контролируют также пищевые продукты, косметические средства, табачные изделия и многие другие товары, попадающие к потребителю.
В этом контексте особенно важно подчеркнуть новизну, ибо, если говорить про лекарства, правила для не новых дженериков и биоаналогов во многом будут другими.
Эта публикация открывает наш новый цикл «Постклинические исследования», логически продолжающий спецпроекты «Будущее доклинических исследований» и «Клинические исследования», к которым мы отсылаем читателей, желающих разобраться, какой путь проделывают лекарства от идеи до аптечной полки. Ну а в этом спецпроекте мы сосредоточимся на правилах регистрации, а также на приключениях лекарств уже после выпуска на рынок.
Невероятно краткая история медицины
Человечество много раз оступалось и падало на пути к безопасным лекарствам, сначала случайно найденным в природе, а теперь в основном синтезируемым намеренно. В наши дни, чтобы избежать прошлых ошибок, действует множество регламентов и руководств, а результаты разработки новых продуктов перед выводом на рынок проверяют специальные организации.
Почему в первую очередь мы говорим о природных соединениях? Они веками были основным источником лекарств для человека. Помогала древним «исследователям» в поиске нужных веществ в основном удача. Природные вещества также лежали в основе получения многих других — полусинтетических — молекул: противоопухолевых препаратов (паклитаксел и камптотецин), иммунодепрессантов (циклоспорины и рапамицин) и лекарств для снижения уровня холестерина (ловастатин и мевастатин) [3]. Только в XIX веке ситуация стала меняться. За последние полтора века пришло понимание, что растения эволюционировали не для того, чтобы их метаболитами лечился человек, и стало возможно прицельно искать молекулы, которые бы могли оказывать желаемое действие, а еще позже — и создавать такие соединения синтетически.
Строгость регулирования разработки и вывода лекарств на рынок — еще более новая вещь. Еще в середине прошлого века эти процессы выглядели гораздо проще. Однако давайте сначала разберемся, какие препараты и как использовали люди раньше и что побудило их взяться за жесткое регулирование того, что попадает в наш организм с полок аптек или от врача.
Одна из самых древних лекарственных практик, дошедших до нас, — это традиционная китайская медицина. Только ее письменным источникам больше двух тысяч лет, и ее положения зафиксированы в таких источниках, как «Обсуждение болезней от холода» (Shanghan Lun, создана до 220 г. н.э.), «Книга желтого императора о внутреннем» (Huangdi Neijing, точная датировка неизвестна, но скорее всего, около I века до н.э.) и «Фармакопея Шэнь Нуна» (Shennong Ben Cao Jing, примерно II век до н.э.—II век н.э.). Например, одна из легенд рассказывает, как этот император несколько раз подряд жестоко избивал змею, но каждый раз она возвращалась к нему здоровой. И тогда император подсмотрел, что раненая змея излечивалась, поедая один из видов женьшеня Panax notoginseng. До сих пор его используют для лечения внешних повреждений в составе популярного «лекарства» Yunnan Baiyao. Активное использование возродил Мао Цзэдун в 1950-х годах, поскольку европейских лекарств и обученных по западным методикам врачей в Китае не хватало, а великому вождю надо было срочно заняться «импортозамещением». Стоит отметить, что, хотя у китайской медицины до сих пор много последователей, она считается альтернативным методом лечения, поскольку эффективность и безопасность используемых ей средств не доказана современными методами.
Широко известно в наши дни и другое древнее и бездоказательное направление — аюрведические методы лечения, записанные в «Ведах». Возраст этой индийской народной медицины оценивают в 3000–5000 лет.
В отличие от аюрведы и китайской медицины, другие системы лечения канули в Лету. Например, в египетском папирусе Эберса (рис. 1) [5], датируемом примерно 1500 г. до н.э., почти 900 рецептов лекарств от гинекологических заболеваний (им посвящен и папирус Кахун примерно 1800 г. до н.э.), болезней глаз и кожи, а также внутренних болезней. В их состав входили, например, ладан, касторовое масло, фенхель, алоэ и чеснок. Но разговор о том, почему сегодня нет последователей «волшебного лекарства фараона», — это уже совсем другая тема.

Рисунок 1. Папирус Эберса, около 1500 г. до н.э., один из самых ранних источников медицинских записей.
У древних греков тоже был неплохой арсенал лечебных средств, отчасти позаимствованных у других народов. Но, пожалуй, главное их достижение состоит в том, что они перестали искать в возникновении болезней мистические причины. Хотя, конечно, не обошлось и без красивой легенды об Асклепии. Греческий бог врачевания, возможно, стал одним из первых, кого задокументированно обвинили в «Игре в /верховного/ Бога». Сегодня это популярный у некоторых аргумент против новых медицинских вмешательств типа генетического редактирования. Зевс поразил его молнией именно за невероятные медицинские умения, которые якобы возвращали мертвых к жизни, а такой властью мог обладать только глава пантеона. Тем не менее, дочери Асклепия, Панацея и Гигиея (именно отсюда пошли всем известные сегодня слова) продолжили дело отца (рис. 2).

Рисунок 2. Древнегреческий бог врачевания Асклепий и его дочь Гигиея.
С греками связан и главный вклад раннего христианства в развитие медицины — это сохранение и перевод греческих трудов. (Стоит отметить и арабскую медицину, в особенности знаменитого Авиценну и его медицинскую энциклопедию IX–X века, и Разеса, врача, описавшего корь и оспу [6], [7].) Так накопленные знания дождались эпохи Возрождения, когда интерес к человеку, а вместе с тем и к его здоровью, возрос. Именно Ренессанс помог сформировать постулаты научной мысли, которые нашли отражение в подходах к лечению болезней [8].
Первой характеристикой лекарств, которая подверглась формальному регулированию, стало качество. Самые базовые руководства по качеству продуктов появились еще до Ренессанса. Например, в Британии в XIV веке вышли постановления для аптекарей, запрещавшие смешивание товаров разного качества и цены, намеренное ухудшение качества товара или фальсификацию веса путем смачивания, а в XV веке Общество врачей и хирургов Лондона назначило двух аптекарей для инспекции магазинов своих коллег. Нарушителей доставляли к мэру и олдерменам лондонского Сити.
Публикации Лондонской фармакопеи в 1618 году предшествовали акты и постановления времен Генриха VIII и Елизаветы I о качестве аптечных препаратов и штрафах за нарушение правил, обнаруженных ревизорами [4].
А что же дальше? На самом деле, выбор терапий в конце XVIII — начале XIX века всё так же был крайне ограничен. На лечение и поиск лекарств всё еще оказывало сильное влияние наследие алхимиков с их методами дистилляции, сублимации, обжига и воздействия кислотами и щелочами. Первое чистое соединение из растения выделил немецкий аптекарь Фридрих Вильгельм Сертюрнер, которому нужно было определить, настоящий или поддельный опиум ему доставили. В результате манипуляций с сырьем и опытов на собаках он получил чистые кристаллы морфия.
С развитием экспериментальных методов химикам удавалось выделять и очищать всё больше веществ из природного сырья. Такие соединения работали лучше, чем растительные экстракты, но и нежелательные лекарственные реакции (adverse event, AE) у них могли проявляться сильнее. А какова была эффективность и безопасность конкретного вещества, зависело от интуиции и удачи химика, который его выделял [9].
Появление новых терапий, которые на практике отнюдь не всегда оказывались безопасны и эффективны, привело к пониманию, что прежде чем давать что-то пациенту, вещество неплохо было бы систематически изучить. Так, например, в 1799 году в журнале Medical and Physical Journal появилась статья, призывающая создать общественный совет врачей для изучения, анализа и одобрения всех лекарств до того, как препарат начнет продаваться, а его реклама появится в прессе [4].
На рубеже XIX–XX веков уже появилась возможность создавать полностью синтетические молекулы с помощью органического синтеза. С обнаружением новых структур и развитием молекулярного моделирования, комбинаторной химии, фаговых и клеточных дисплеев и автоматизированного высокопроизводительного скрининга человек, наконец, стал меньше зависеть от природных веществ [3], [9].
Иногда отдельные соединения проверяли особо дотошно (по меркам своего времени). Одним из громких примеров изучения свойств препарата стало создание комитета для изучения безопасности хлороформа после его открытия в 1847 г., по инициативе Королевского медицинского и хирургического общества в 1864 г. В 1925 г. в Соединенном Королевстве был принят «Закон о терапевтических веществах», в рамках которого вводились более строгие правила по производству, инспекции и маркировке [4].
Весь XX век фармкомпании выделяли из растений и тканей или биологических жидкостей животных и синтезировали огромное количество соединений в надежде найти нужное. В первой половине века появилась одна из самых влиятельных организаций по надзору за лекарственными средствами — FDA (подробнее о ее истории рассказано во врезке). Однако, несмотря на некоторые законодательные требования, пока не случилась реальная трагедия, четких согласованных руководств по контролю качества, эффективности и безопасности для лекарств всё еще не было. И вот в 1961 году катастрофа с талидомидом переворачивает устои регулирования лекарств в Европе, а потом и в США (рис. 3).
Препарат оказался тератогенным, и тысячи детей, чьи матери принимали его во время беременности, родились с мальформациями. Подробнее о талидомидовой трагедии написано в статье «От живого к неживому» [10].
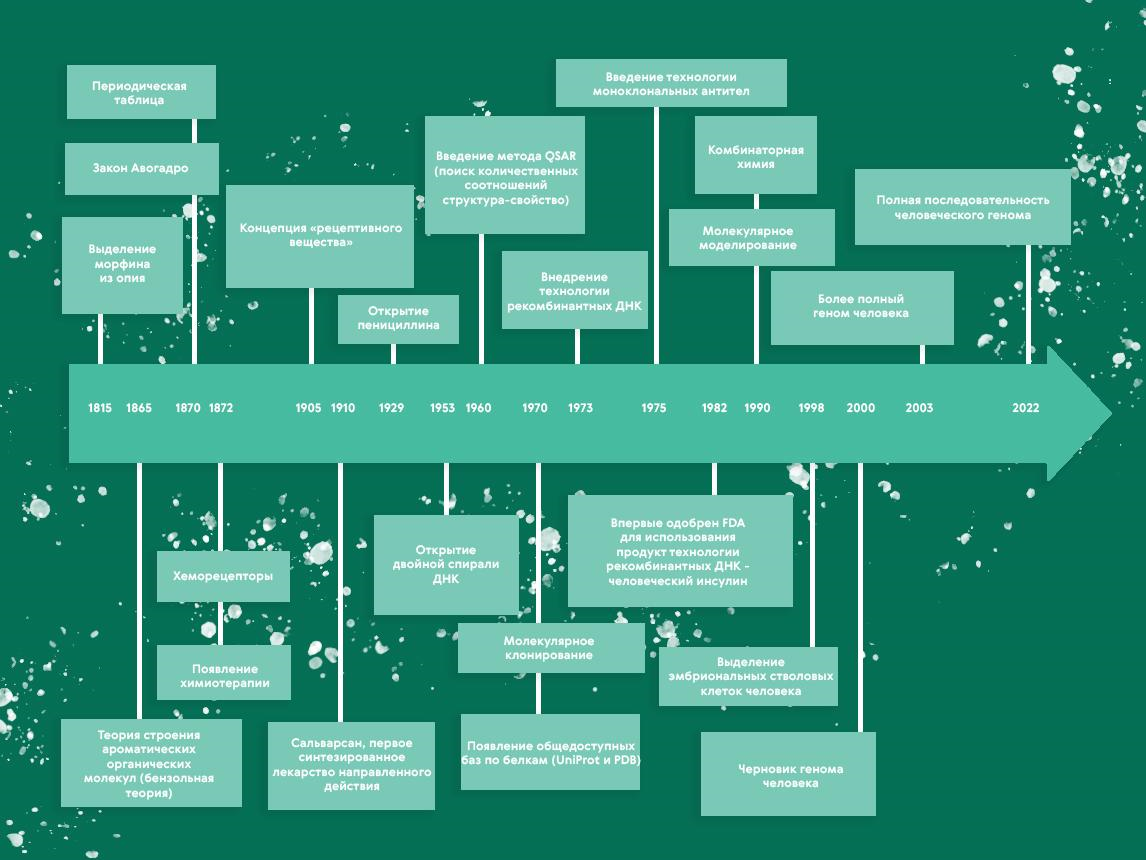
Рисунок 3. Важные события в истории открытия лекарств с 19 века.
иллюстрация Карины Илиопуло по [3]
Наконец, в Европе на излете прошлого века фармаконадзор начинает обретать новые очертания. В науке же сначала фокус был больше на поиске новых молекул. Сейчас, с развитием автоматизированных параллельных и комбинаторных методов синтеза, получить множество новых соединений, подходящих под конкретную мишень в организме, — не проблема [11], [12]. На это нацелено, например, моделирование лекарств de novo, когда структура молекулы «создается» под определенную задачу с помощью методов компьютерного моделирования [13], [14]. Становится важнее выбрать из них нетоксичное, достаточно селективное и выполняющее искомую функцию лучше всего. Этой проверке посвящены доклинические и клинические исследования [10], [15], [16].
Сегодня регуляторных агентств множество, но наиболее известные из них — уже упоминавшиеся FDA в США, EMA в Евросоюзе, а также:
- MHRA (Medicines & Healthcare products) в Соединенном Королевстве;
- HPRA (Health Products Regulatory Authority) в Ирландии;
- ANMAT (National Administration of Drugs, Foods and Medical Devices) в Аргентине;
- PMDA (Pharmaceuticals and Medical Devices Agency) в Японии;
- Health Canada в Канаде;
- TGA (Therapeutic Goods Administration) в Австралии;
- Swissmedic (Swiss Agency for Therapeutic Products) в Швейцарии;
- CDSCO (Central Drugs Standard Control Organization), Индия;
- HSA (Health Sciences Authority), Сингапур;
- NPMA (National Medical Products Administration) в Китае;
- Anvisa (Brazilian Health State Agency) в Бразилии;
- В России эта роль возложена на Минздрав, Росздравнадзор и Минпромторг (мы нанесли их все на рис. 5).
Эти органы решают, можно ли выпустить новый медицинский продукт (лекарство, медицинское изделие и т.д.) на рынок, проверяя документацию по качеству, безопасности и эффективности, предоставляемую разработчиком или спонсором (так в фармотрасли принято называть организацию, проводящую и финансирующую проведение исследований), и оценивая баланс пользы и риска. В таблице 1 представлены некоторые характеристики этих организаций (правда, за 2015–2016 годы, до пандемии).
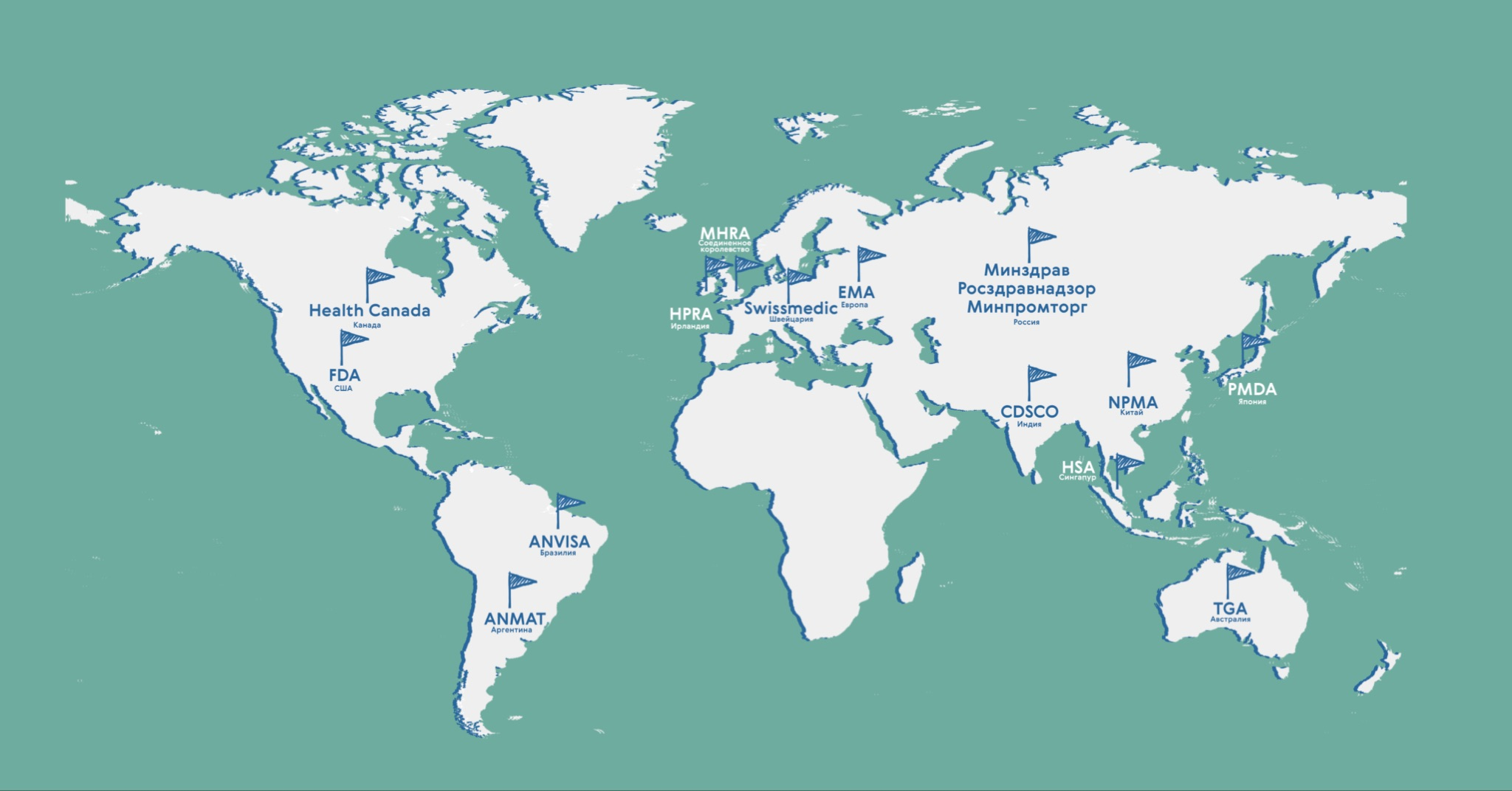
Рисунок 5. Избранные мировые организации по регулированию лекарственных средств.
иллюстрация Карины Илиопуло по [3]
| Название регулятора | Количество технических наблюдателей на 2016 г. | Количество заявок NDA для новых лекарств на 2015/2016 гг. | Количество одобренных заявок на 2015/2016 гг. |
|---|---|---|---|
| EMA, Европа | ~4500 | 61/68 | 39/27 |
| FDA, США | ~2000 | 35/41 | 45/22 |
| PMDA, Япония | ~560 | 127/NA | 42/48 |
| NPMA, Китай | ~120 | NA | 72/31 |
| MHRA, Соединенное Королевство | NA | NA | 146/NA |
| Health Canada, Канада | ~1570 | 27/25 | 20/27 |
| Swissmedic, Швейцария | ~60 | 295 | 27/42 |
| CDSCO, Индия | ~130 | NA | 17/22 |
| HSA, Сингапур | ~300 | NA | 61/72 |
| TGA, Австралия | NA | 43 | 27/NA |
Кроме того, важную роль на международной арене играют и руководства >ICH — Международного совета по гармонизации технических требований к лекарствам для медицинского применения со множеством участников и наблюдателей как со стороны регуляторов, так и регулируемой отрасли. Например, членами, непосредственно занимающимися составлением руководств, являются Европейская комиссия, FDA, MHRA, PMDA, European Federation of Pharmaceutical Industries and Associations, Japan Pharmaceutical Manufacturers Association, Pharmaceutical Research and Manufacturers of America; а постоянными наблюдателями — ВОЗ и International Federation of Pharmaceutical Manufacturers & Associations (на сайте ICH приведен полный список). Руководящий комитет ICH создает рабочие группы экспертов для обсуждения возможностей для гармонизации требований к методам контроля качества, планирования, проведения и оценки доклинических и клинических исследований, а также фармаконадзорной деятельности [4]. Сами по себе документы ICH носят рекомендательный характер, но становятся обязательными при внедрении их соответствующими регуляторными органами в собственную работу [4].
Исследования препаратов и их регулирование
Прежде чем углубиться в то, как работают организации, отвечающие за регулирование лекарств, давайте вспомним, что же такое доклиническая и клиническая разработка новых лекарств и по каким стандартам она проводится. Напомним, что «Биомолекула» уже подробно писала об этом в специализированных спецпроектах: «Будущее доклинических исследований» (также в сотрудничестве с ФМИ) и «Клинические исследования». Всё рассказанное ниже собрано в инфографике на примере одобрения лекарства в FDA (рис. 6).
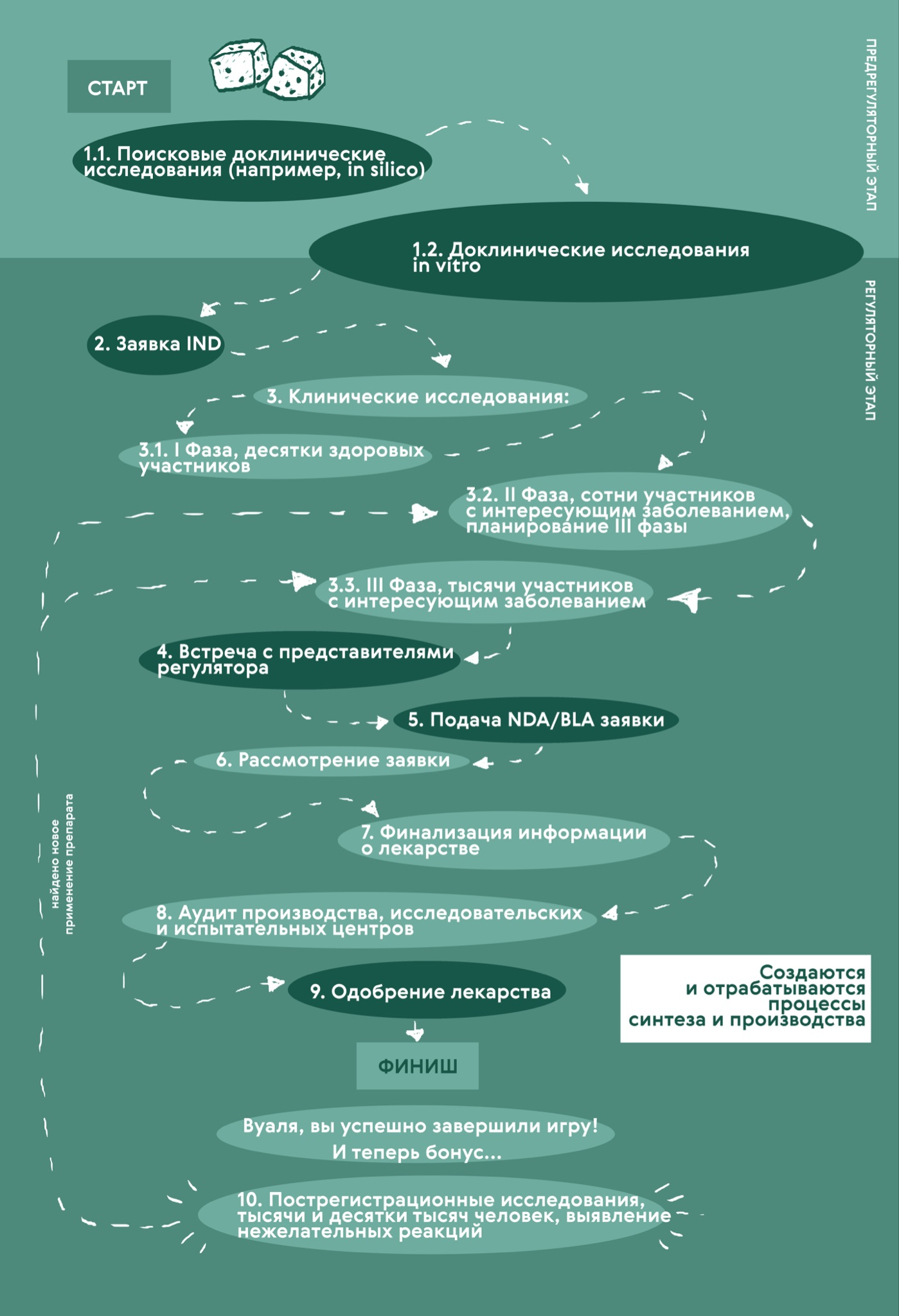
Рисунок 6. Стадии одобрения лекарства в FDA. Сначала проводят доклинические исследования, и после изучения лекарства на животных подают заявку IND в FDA. Затем наступает черед клинических испытаний. I фаза собирает нескольких десятков здоровых добровольцев; затем во II фазе лекарство тестируют уже на пациентах с целевым заболеванием, чтобы получить первые подтверждения — а лечит ли лекарство? Кроме того, здесь же подбирают дозу и начинают отслеживать менее распространенные нежелательные реакции. После этого спонсоры и исследователи встречаются с представителями FDA для обсуждения полученных результатов и планирования III фазы (встреча часто проходит также и после III фазы). В ней уже проводится более широкомасштабное изучение, а самих клинических исследований этой фазы в обычных условиях нужно как минимум два. Далее следует подача NDA/BLA (подробнее в тексте), а FDA в некоторых случаях назначает заседание экспертного комитета Advisory Committee с публичными слушаниями и тайным голосованием. После этого финализируется информация о лекарстве и зачастую происходит аудит производства и исследовательских и испытательных центров. Подробности в тексте.
иллюстрация Карины Илиопуло по данным FDA
Стоит отметить, что в реальности такое четкое деление клинических исследований на фазы, как на рисунке, не всегда присутствует. Нередки отклонения от этой схемы, когда фазы объединяются, переходят одна в другую или вовсе пропускаются. Решение принимают разработчики, часто с помощью регуляторов, и главный критерий для него — научная обоснованность выбранного пути разработки. По этой причине некоторые руководства уже отходят от привычного всем деления на номерные фазы. Например, в руководстве ICH-E8(R1) General considerations for clinical studies предлагают новое деление на этапы проверки лекарства, которые описывают именно их назначение. Так, предложенных этапов четыре: фармакологическая (human pharmacology), поисковая (exploratory), подтверждающая (confirmatory) и пострегистрационная (post-approval) фазы.
Доклинические испытания
Доклинические (неклинические) исследования — первая стадия изучения, которую проводят in silico (с помощью различных компьютерных программ), in vitro («в стекле», на клеточных культурах) и in vivo (на нескольких видах животных) [10], [15], [19]. После перехода на регуляторную стадию разработки, то есть с началом подготовки к клиническим исследованиям, доклинические исследования безопасности должны проводиться по стандартам Надлежащей лабораторной практики GLP (Good Laboratory Practice), описанным в OECD Principles on Good Laboratory Practice. Исследования эффективности обычно проводятся без строгого соблюдения GLP, так как стандартизировать их достаточно сложно. Помимо безопасности лекарства, на этом этапе изучают его фармакодинамику и начинают изучать фармакокинетику. Важно отметить, что доклинические исследования регламентированы научными указаниями и руководствами различных регуляторов, а также ICH и ВОЗ, то есть не ограничиваются только стандартами GLP. Для перехода к изучению лекарства на людях эти данные предоставляют на утверждение в регуляторный орган. В США это Investigational New Drug application (IND), в Европе — Clinical Trial Application (CTA, или заявление на клиническое исследование) [10], [20].
Основная цель доклинического регулирования — максимальное снижение рисков при попадании нового продукта в клинические исследования, хотя ряд исследований, например, канцерогенности, завершается только к моменту подачи заявления на получение разрешения на продажу. Cоблюдение GLP-стандарта обеспечивает «уверенность в качестве, целостности данных и возможность реконструировать действия, выполняемые при проведении доклинических исследований безопасности», и это позволяет гармонизировать процедуры испытаний для взаимного принятия результатов доклинических исследований безопасности странами — участницами OECD (Организации экономического сотрудничества и развития). Россия, к сожалению, к ним не относится. Подробнее о стандарте GLP читайте в статье «От живого к неживому» [10].
Клинические испытания
Далее начинаются уже непосредственно клинические испытания с участием добровольцев, число которых увеличивается по мере изучения препарата (как мы уже писали, в статье будем придерживаться классического деления на нумерованные фазы, но главные их различия не в нумерации, а в цели [20]):
- I фазу проводят с участием небольшого количества здоровых добровольцев, и терапевтической цели у нее нет: здесь обычно исследуют безопасность, фармакодинамику и фармакокинетику лекарства. Впрочем, если лекарство предназначено для людей с тяжелыми заболеваниями, то пациентов могут включить и в первую фазу.
- Исследования II фазы обычно включают большее количество людей, и это уже всегда пациенты с интересующим исследователей заболеванием. Здесь ищут первые данные по эффективности препарата, а также собирают информацию, необходимую для планирования исследований III фазы (например, определение оптимальных доз, частоты дозирования, путей введения). Перед началом III фазы исследователи и спонсоры могут организовать встречу с регулятором (например, FDA или EMA) для обсуждения возможности перехода к III фазе исследования и ее оптимального дизайна. Подобные встречи могут проходить и на других этапах проверки препарата.
- После того, как с главными вопросами безопасности разобрались в первых двух фазах, наступает время III фазы — самой важной для подтверждения эффективности препарата и установления частоты AE. К сожалению, не только сами болезни, но и нежелательные реакции на терапию — тоже глобальная проблема здравоохранения. В развитых странах на связанные с ними проблемы тратятся миллиарды долларов, и только в США ежегодно регистрируют более двух миллионов случаев ущерба для здоровья, госпитализаций и смертей ежегодно [23].
На этом этапе проверки группа добровольцев с изучаемым заболеванием уже разнообразнее и больше. Обычно это 300–3000 человек, но в некоторых случаях бывает и еще больше [20]. Данные, полученные в III фазе, считаются достаточными для выпуска препарата на рынок, поскольку регуляторные органы соблюдают баланс между чрезмерной задержкой доступа к лекарству, которое может спасти многие жизни, из-за слишком дотошной проверки, и получением информации о возможных редких AE. Разработчики могут встретиться с представителями регулятора, а затем подают пакет документов, называемых «досье для одобрения лекарства» (в случае FDA — NDA, new drug application: для низкомолекулярных соединений — или BLA, biologics license application: для биопрепаратов). Если всё в порядке, регуляторный орган проверяет заявку, финализирует информацию о лекарстве для пользователей и врачей и проводит инспекцию производственных помещений, исследовательских и испытательных центров.
Один из самых известных стандартов проведения КИ — руководство ICH по надлежащей клинической практике GCP (Good Clinical Practice), появившееся в 1996 году. EMA, FDA, Росздравнадзор и другие регуляторные органы следят за его исполнением путем проведения инспекций. Стоит отметить, что отличие Росздравнадзора от FDA и EMA — в том, что их проверка фокусируется не на непосредственном контроле за проведением конкретного КИ, а именно на соответствии деятельности заявителя ГОСТам. Росздравнадзор применяет Правила надлежащей клинической практики Евразийского Экономического Союза, разработанные на основании GCP, и российское законодательство.
GCP — это крайне многогранный документ. Он задает стандарт и по процессуальным, и по этическим вопросам (например, в нем говорится, что самое главное при проведении КИ — права, безопасность, информированность и благополучие его участников) [16].
Производство препарата, который собираются проверять в клинических исследованиях, также строго регулируется — с помощью GMP (надлежащей производственной практики). Это процессуальный стандарт по производству, распространению и поставке лекарств. Помимо этого, есть и множество узкопрофильных руководств по качеству, регламентирующих, например, валидацию процесса производства или разработку препаратов с модифицированным высвобождением. К разработке этих жестких правил привели события, о которых уже шла речь выше: например, отравления эликсиром сульфаниламида. Первые же гайды ВОЗ по надлежащей практике производства появились в 1969 году.
GMP задает минимальный стандарт для производителя, соответствие которому критически необходимо для получения регистрационного удостоверения. Лекарства производителя, работающего по GMP, должны быть последовательно высокого качества, подходить для использования по назначению и соответствовать требованиям регистрационного удостоверения или разрешения на КИ.
Cтоит отметить, что в США I фазу всё же можно проводить и не по стандартам GMP.
В GMP входит очень широкий список требований: например, весь процесс производства, техническое оснащение, персонал, принимающий в этом участие, или качество сырья [24]. Контроль качества активных ингредиентов осуществляется путем тестирования проб продукции. Это довольно дотошная проверка, в которую зачастую входит реальная инспекция производства. Несоблюдение стандарта ведет к отклонению заявки.
Надзор за этическим проведением клинических исследований и защита прав участвующих добровольцев возложены на плечи Независимых этических комитетов (IEC в Европе; в США это Institutional Review Boards, IRB). В случае исследований III фазы за ходом КИ также часто следят Советы по мониторингу данных и безопасности (Data and Safety Monitoring Boards, DSMB), проверяя через равные промежутки времени исследование на соответствие нормам по безопасности, эффективности и этическим стандартам [20].
Кстати, стоит отметить, что отдельные участники получают дополнительную медицинскую поддержку [25]. Так, пациенты, участвующие в КИ, могут получить хорошо себя зарекомендовавший препарат и после завершения исследований — в рамках расширенного доступа, в то время, пока препарат проходит регистрацию. Например, на этой странице можно посмотреть позицию Novartis на этот счет.
Следить за проведением клинических исследований удобнее всего через ClinicalTrials.gov. Это открытая база клинических испытаний, запущенная в 2000 году Национальной медицинской библиотекой (National Library of Medicine) под эгидой Национальных институтов здравоохранения (National Institutes of Health, NIH) [23]. На момент написания статьи в базе более 418 300 КИ. Регистрация клинического исследования на ClinicalTrials.gov до его начала обязательна, если его результаты будут предоставляться в FDA в составе досье на одобрение соответствующего продукта или медицинского изделия для последующей продажи в США. Тем не менее, многие спонсоры со всего мира добровольно регистрируют там свои исследования (как клинические, так и наблюдательные), поскольку такая регистрация стала практически общемировым стандартом. Обязательна также публикация результатов исследований в течение полугода после их окончания (подробнее о прозрачности ниже). В Евросоюзе действует аналогичное требование в отношении регистрации исследований, проводимых на людях, но уже на соответствующем европейском портале.
Итак, препарат одобряется (если одобряется) регуляторным органом после завершения III фазы, но исследования чаще всего на этом не заканчиваются.
Пострегистрационные исследования
Пострегистрационные исследования — важная часть проверки лекарств, но часто на них обращают меньше внимания, чем на предшествующие этапы. Сразу отметим, что подробно речь о пострегистрационных исследованиях пойдет во второй статье спецпроекта, а здесь мы только обрисуем их в общих чертах. Стоит сказать, что существует разница между IV фазой КИ и пострегистрационными исследованиями, хотя в некоторых источниках авторы используют их как синонимы. Исследования IV фазы — это категория пострегистрационных исследований, несущая фармаконадзорную функцию в отношении лекарства, одобренного для конкретной цели в конкретных дозировках. Пострегистрационные исследования же могут предусматривать более всестороннее изучение потенциала терапии и, например, поиск новых показаний или новых методов применения (в этом случае такие пострегистрационные исследования относят к III или даже II фазе) [28]. С другой стороны, сам фармаконадзор не ограничивается только исследованиями. Его методы включают гораздо больше инструментов, поэтому понятия «пострегистрационные исследования» и «фармаконадзор» не тождественны.
Фармаконадзор, согласно определению ВОЗ, — это «наука и действия, связанные с обнаружением, оценкой̆, пониманием и предотвращением неблагоприятных реакций или каких-либо других проблем, связанных с лекарствами/вакцинами».
Обычно пострегистрационные исследования подразумевают множество участников, и их задача в первую очередь — собрать больше информации о безопасности (например, можно выявить менее распространенные AE), эффективности или оптимальном использовании. Тот или иной эффект лекарства может быть обнаружен только годы спустя после прекращения лечения. Вовсе не обязательно он будет негативным: в долгосрочной перспективе могут обнаружиться и «плюшки» — например, legacy-effect, как было показано для лечения сахарного диабета или гипертензии, когда частичный эффект лечения сохраняется на многие годы даже после его прекращения (это явления даже называют «метаболической памятью») [29–32].
Итак, как же «работает» эта стадия? Регуляторный орган (например, FDA) может потребовать у разработчика выполнения определенных обязанностей на пострегистрационном этапе — PMC (postmarketing commitments) или PMR (postmarketing requirements) в качестве одного из условий одобрения лекарства для дополнительной оценки безопасности [33]. Так, большинство из 343 терапевтических средств, получивших первоначальное одобрение FDA в период с 2009 по 2018 годы, было одобрены как минимум с одним PMC или PMR [34]. Также у FDA есть открытая база данных по этой информации.
Разговоры о необходимости пострегистрационных исследований начались еще в 1980-х, и сейчас накопилось немало данных для оценки того, как же их проводят [35]. Например, информацию о пострегистрационных исследованиях для лекарств, одобренных FDA и EMA с 2005 по 2010 гг., можно посмотреть в этой статье [36]. Среди примеров подобных качественных долгосрочных наблюдений можно упомянуть обзоры по ингибиторам HMG-CoA-редуктазы, или статинам, которые совсем недавно вызывали неподдельный интерес врачей и общественности [37].
Если же взять более насущный пример, то многие регуляторы ускоренно одобрили несколько вакцин против COVID-19 на основе данных, полученных в предварительных исследованиях, а дальше был инициирован мониторинг безопасности для отслеживания потенциальных, менее распространенных AE [33]. Вакцины обычно одобряются регуляторами вместе с требованием о проведении различных пострегистрационных мероприятий для дополнительной оценки безопасности.
Для AE, возникающих на пострегистрационном этапе, у FDA есть базы данных Adverse Reporting System и Sentinel System. Как врачи, так и пациенты могут сигнализировать об AE и оставлять сообщения в специальных системах: в США это MedWatch и целая плеяда других (VAERS для вакцин; BEST для биопрепаратов и другие [38]), в Соединенном Королевстве — так называемая система Желтых карточек (Yellow Card scheme), в Евросоюзе у каждой страны есть своя подобная система, интегрированная с EudraVigilance [39].
Стоит отметить, что правила пострегистрационного контроля отличаются в разных странах и по размеру выборки, и по продолжительности проведения наблюдений [40]. Но один из важнейших документов именно для этого этапа наблюдений, на который ориентируются многие организации, — это руководства ICH по фармаконадзору семейства E2 (ICH E2A — E2E).
В США сегодня примерно каждый пятый препарат получает предупреждение о серьезных нежелательных реакциях (black box warnings, «предупреждения в черной рамке») после выхода на рынок, и примерно 4% лекарств выводят из продажи по соображениям безопасности после изучения данных пострегистрационных исследований. Однако, согласно данным литературы, менее половины таких пострегистрационных исследований, запрошенных FDA, фактически завершены или хотя бы начаты спонсорами [20]. Вопросов о качестве исследований тоже много. Иногда размер выборки просто не позволяет сделать однозначных выводов о безопасности препарата [23]. Регуляторов же обвиняют в нежелании или неготовности выводить лекарство с рынка, коль скоро оно было на него допущено [41].
Количество информации, которое нужно рассмотреть регуляторной организации по итогам всех стадий исследований нового препарата, очень велико и измеряется сотнями тысяч страниц. Чтобы составить представление об этом объеме данных, можно посмотреть какой-нибудь экспертный отчет FDA (например, по Сацитузумаб говитекану, или Trodelvy — препарату для терапии метастатического трижды негативного рака молочной железы и рака мочевого пузыря, одобренного в 2020 году FDA и в 2021 году для применения в ЕС).
Регулирование медицинских изделий устроено во многом менее строго, чем для лекарств, и поэтому важность пострегистрационных исследований в выявлении AE для девайсов гораздо выше [42]. Стоит отметить, что регулирование и/или контроль от специальных организаций, пусть и иначе регламентированный, — удел отнюдь не только лекарств или медицинских изделий. Ему подвергаются, например, пищевые продукты, косметические средства и табачные изделия. Больше информации можно найти на специализированных страничках регуляторных организаций (вот, например, информация по пищевым — от FDA; для EC — и косметическим — от FDA; для EC — продуктам).
FDA vs. EMA: регулирование лекарственных препаратов
Регулирование лекарств в США и Европе аналогичны в базовых вещах. Стандарты качества, безопасности и эффективности, как и доказательности, у регуляторов одинаковы. Они придерживаются схожих методов оценки новых лекарств, рассматривают одинаковую доказательную базу качества, безопасности и эффективности и имеют общие конечные цели. У обеих организаций есть способы повышения соотношения пользы и риска лекарств RMI (вмешательств по минимизации риска, Risk Minimization Interventions; например, по быстрому реагированию на проблемы, если те возникают, или методы отбора участников таким образом, чтобы конкретно для них повысить пользу от терапии и минимизировать риски) и рекомендации по управлению терапевтическим риском [44]. Производители лекарств подают в целом одинаковый пакет информации в FDA и EMA для одобрения лекарства (в этом и состоит цель таких организаций, как ICH [39]). К тому же сейчас эти агентства всё теснее взаимодействуют между собой, и новые руководства подвергаются общему обсуждению.
Во многом решения этих регуляторных органов также совпадают. Например, при оценке первоначальных заявок за 2014-2016 годы их решения пересекались на 91%, а при рассмотрении повторно поданных заявок — на 98% [45].
Тем не менее, из-за культурных и исторических особенностей у них есть и различия, в основном по процедурам принятия решений и организации процессов рассмотрения. FDA было создано как централизованная организация по защите прав потребителей. В то же время основная роль EMA — интеграция регуляторных процессов в государствах — членах ЕС (сейчас их 27) — и еще нескольких странах Европейской экономической зоны (Норвегия, Исландия, Лихтенштейн) при сохранении некой автономии отдельных государств. Из-за этого возникли и стандартные «пугалки», что американская организация работает крайне медленно, а для европейцев главное — коммерческий интерес [46].
Главная особенность в работе агентств — унификация. В США большинство лекарств и биопрепаратов обязательно должны пройти проверку в FDA. В Евросоюзе процессы одобрения строго разделены по уровням. В EMA обязаны подаваться разработчики лишь выделенных категорий, например, биотехнологических продуктов или лекарств от определенных заболеваний (списки есть на сайте EMA, статье 3 Регламента EC № 726/2004 и приложение I к документу). Однако в добровольном порядке в EMA могут подаваться любые другие продукты. В частности, с 1995 г., когда была запущена централизованная процедура, все новые лекарства проходят через EMA, хотя и не все из них входят в обязательную категорию. Таким же образом обстоят дела и с дженериками (или воспроизведенными лекарствами — такой термин используется в законодательстве). Наконец, все биоаналоги идут через EMA. Отдельные государства — члены ЕС обычно регистрируют некоторые воспроизведенные лекарства, некоторые гибриды и все препараты наследия (например, старые препараты, появившиеся до появления на свет современных гайдлайнов). В этом случае разработчик может подать заявку на одобрение лекарств в одной стране или нескольких странах ЕС и затем получить разрешение на продажу и в других странах ЕС в рамках процедур взаимного признания [10].
То есть препараты, похожие на одобренное лекарство, содержащие то же действующее вещество, но отличающееся, например, по действию, показаниям или лекарственной форме.
В FDA не так давно начали использовать специальную систему BRF (benefit—risk framework), качественную систему анализа пользы и риска. Ее цель — «повысить ясность и последовательность в донесении аргументов, лежащих в основе решений регуляторных органов». Это должно помочь прояснить различные факторы, влияющие на решение FDA об одобрении или отклонении заявок, что, конечно, поможет исследователям и спонсорам [47].
EMA же, напротив, довольно давно пытается внедрить количественный анализ. Пример успешного применения такого подхода, который помог принять решение в неоднозначном контексте множества «за» и «против», — это одобрение EMA белимумаба (Benlysta), первого препарата от системной красной волчанки [48] за 56 лет (на тот момент, в 2011) с применением методологий Benefit—Risk Methodology Project и IMI-PROTECT. Для принятия решения EMA собрала отдельную конференцию, где выслушала мнения от различных экспертов [47].
Как считают, FDA тоже бы не помешало активнее внедрить этот подход на постоянной основе — это может облегчить процесс принятия решений в сложной ситуации, когда трудно подвести общий знаменатель рисков и пользы [47].
Проблемы сегодняшней регуляторики
Работа регуляторных органов постоянно подвергается критике. Обычно больше всех достается FDA. Споры вокруг его решений очень противоречивы и иногда носят конспирологический характер. То их обвиняют в слишком расслабленном, то в слишком строгом подходе. Иногда даже звучат прямые обвинения в зависимости от отрасли. Давайте разберемся, какие проблемы действительно существуют, какие находятся в процессе решения, а какие — скорее умозрительные заключения без веских оснований [18], [49].
Начнем с довольно общих проблем. Без сомнения, регуляторные органы в своих решениях опираются на данные доклинических и клинических исследований, а также производства и контроля, и придерживаются принципов доказательной медицины. Тем не менее, КИ тоже могут дать ошибочный результат. Например, дизайн эксперимента может быть неверен, или данные интерпретированы неправильно или предвзято — даже несмотря на неоднократные проверки со стороны регулирующего органа и согласования дизайна исследования. Эта проблема существует в научном обществе в целом и может отражаться и на работе регуляторных органов. Для снижения вероятности ошибок, связанных с проведением одного исследования, FDA требует для регистрации обычных лекарств (под обычными понимаются не прорывные, не для редких заболеваний и не для тяжелых неизлечимых заболеваний) два исследования III фазы, где конечной точкой будет эффективность. К тому же, в последнее время регуляторы в духе байесовского подхода не склонны рассматривать результат одного клинического исследования как истину в последней инстанции, а анализируют всю совокупность данных.
Другая важная претензия к регуляторным органам — их опосредованное вовлечение в формирование цены на лекарство. Например, некоторые считают, что требования регуляторов слишком высокие и негибкие, и именно они увеличивают стоимость R&D (исследований и разработок). Сами КИ могут продолжаться десятилетиями, требуя всё больше и больше вложений от спонсора. В итоге это отражается на цене конечного продукта, и пациенты в итоге не могут получить нужное лечение вовремя из-за его недоступности или дороговизны.
Оправдана ли такая критика? Что ж, всё зависит от точки зрения. Действительно, проведение КИ по всем правилам — вещь очень дорогая. Затраты на R&D растут экспоненциально в течение последних четырех десятилетий [1]. Но стоит ли рисковать такой системой и вместо этого получить непроверенное, неэффективное и небезопасное лекарство с недоказанным балансом риска и пользы? Снижение стандартов проверки невыгодно в первую очередь самим пациентам. Кроме того, ценообразование на лекарства зависит уж точно не только от R&D. Большую роль играют рыночные законы, и стоимость зависит и от баланса спроса и предложения. Это показали недавние примеры с Sovaldi от гепатита C и «самым дорогим в мире» лекарством Zolgensma — от спинально-мышечной атрофии. Про оба этих случая «Биомолекула» уже писала [50], [51].
Изменить ситуацию могли бы более быстрый выход на рынок дженериков, me-too препаратов и прочих дешевых лекарств для формирования рынка с более низкими ценами (здесь в ситуацию вмешивается патентное право — от момента подачи патента проходит около 20 лет, в течение которых заявитель имеет эксклюзивное право продавать продукт — иначе в разработку вкладываться будет невыгодно). Кроме того, часть затрат на проведение КИ могла бы быть сокращена без ущерба для научной ценности и пациентов, о чем пишут, например, участники Инициативы по преобразованию клинических испытаний (Clinical Trials Transformation Initiative), цель которой — улучшить проведение КИ к 2030 году.
Созвучная проблема, которую озвучивают критики, — это проблема «осторожного регулятора», замедление выхода на рынок препаратов из-за неэффективных правил, требующих больших затрат, а затем долгих дотошных проверок регулирующими организациями. В итоге, лекарство может стать доступным намного позже, чем могло бы было быть в другой ситуации, а время при лечении — крайне важный фактор. К сожалению, проверки имеют тенденцию становиться всё более дотошными после каждого трагического случая вроде талидомида, о котором уже шла речь, или рофекоксиба (Vioxx; Merck), который отозвали из-за повышенного риска сердечного приступа и инсульта в 2004 году. Сейчас считается, что лучше перестраховаться и затянуть проверку, чем выпустить недопроверенный продукт на рынок. Тем не менее, пациенты со своей стороны нередко активно выступают и требуют предоставить им доступ к лекарствам как можно быстрее (как, например, было в случае СПИД/ВИЧ в США в 1980-х, подробнее в статьях об активизме пациентов [52], [53]). Более того, сегодня представители ассоциаций пациентов и медицинских работников входят в состав принимающих решения комиссий и комитетов таких регуляторов, как FDA и EMA. Это призвано приблизить регулярные решения к реальной клинической практике и насущным проблемам самих пациентов. Регуляторные органы же со своей стороны работают над программами ускоренного одобрения лекарств (см. врез) [1].
Еще одна претензия — прозрачность. На самом деле, большое количество данных можно найти в открытом доступе, и уровень прозрачности на уровне II/III фаз КИ довольно высок.
О ресурсе ClinicalTrials.gov уже шла речь выше: там выложены данные по различным КИ. Обычно на публикацию данных у фармкомпаний уходит примерно год после одобрения FDA. Согласно исследованиям, через 13 месяцев после одобрения FDA в среднем 96% испытаний с участием добровольцев, страдающих изучаемой болезнью, были в разной форме опубликованы. Однако найти данные о проверках, не связанных с испытаниями на пациентах (например, на здоровых добровольцах), значительно сложнее, и прозрачность здесь гораздо хуже. Из-за этого получается, что публично раскрывают данные о всех испытаниях только для примерно половины одобренных FDA лекарств. I фаза исторически представляла меньший интерес для регуляторных органов, а кроме того, обычно трудно подвести какие-то итоги, кроме общих данных о безопасности, из-за маленькой выборки и не такого строгого надзора. Тем не менее, раскрытие этих данных тоже было бы полезно: это и успокоит общественность, не скрывают ли от нее что-нибудь страшное, и ускорит принятие официальных решений по вопросам безопасности лекарства. Стоит отметить, что в США относятся к этой проблеме очень серьезно и собираются законодательно ужесточить ответственность за задержку публикации данных. А в отношении принятия решения о допуске на рынок у FDA стоит поучиться регуляторным агентствам всех стран: например, они выкладывают на YouTube заседания Advisory Committee.
Согласно Регламенту № 536/2014 Европейского парламента и Совета от 16.04.2014 г., вступившему в силу в январе 2022 года, база данных ЕС должна быть публичной. EMA публиковало данные по КИ из модулей 2.5, 2.7 и 5.3 общего технического документа КИ. Однако сейчас публикация была частично приостановлена из-за брексита (штаб-квартиру агентства пришлось переносить из Лондона в Амстердам, в результате чего возникли некоторые кадровые проблемы), а затем и из-за пандемии COVID-19. Для данных по терапиям, связанным с SARS-CoV-2, организация придерживается чрезвычайной прозрачности. Если же вы ищете данные о клинических исследованиях или о работе конкретных компаний в целом, то часто их можно найти в открытом доступе на сайте, как, например, у Merck & Co. (MSD), Novartis или Sanofi.
Кроме этого, не прекращаются дебаты и связи интересов компаний и исходов научных исследований и одобрения лекарств. Такое предвзятое отношение — конфликт интересов — гипотетически может повлиять на решения организаций и процесс одобрения препарата. Согласно EMA, три из пяти КИ спонсируются фармпромышленностью, и было показано, что такое финансирование значительно увеличивает шансы на получение результатов, благоприятных для спонсора. На практике же часто требуют раскрытия интересов компаний, несмотря на частые заявления ученых, что их взаимодействие с ними никак не влияет на результаты [57]. Сейчас требования к прозрачности активно продвигаются в правилах FDA, NIH и прочих организаций: например, Фонда Гейтсов, ВОЗ и Wellcome Trust [58]. Во время пандемии COVID-19 все производители вакцин против SARS-CoV-2 из ЕС и США публиковали протоколы исследований, чтобы поднять доверие к своим продуктам. ЕМА даже опубликовало отчеты о клинических исследованиях этих вакцин — а это совсем подробный документ, содержащий индивидуальные (но обезличенные) данные пациентов.
Будущее регуляторики
Мы только что очертили круг проблем, которые, скорее всего, будут решаться регуляторными органами в ближайшее время. Например, у EMA в стратегии к 2025 году выделены приоритетные области, требующие изменения в самое ближайшее время. Среди них упоминают наличие и доступность лекарств; проблемы устойчивости поставок; цифровую трансформацию и антибиотикорезистентность.
Сейчас в FDA также обсуждают, что некоторые функции оценки препарата частично, а то и полностью, можно будет возложить на ИИ: предсказание токсичности, фармакометрический и статистический анализ, обработку поступающих данных о AE, например, вакцин [59]. Это может и улучшить, и ускорить работу организаций.
Действительно, разработка антибиотиков остается одной из приоритетных областей c точки зрения общества (и «Биомолекула» писала об этом немало). FDA, EMA и PMDA заявляли об объединении усилий по борьбе с антибиотикорезистентностью. Регуляторы создают свои программы по стимуляции вывода на рынок новых подобных продуктов, а в NIH даже объявили конкурс с призом в 20 миллионов долларов на создание методов лабораторной диагностики, которые помогают обнаружить устойчивые к антибиотикам бактерии.
Однако, несмотря на усилия, в реальности большинство разрабатываемых антибиотиков — не новые препараты, а производные старых, которые не позволяют кардинально решить проблему. Для новых же антибиотиков вроде теиксобактина всё равно путь на рынок очень долог, и даже в случае успеха непривлекателен для бизнеса: новый антибиотик используют редко, только когда привычные способы борьбы с бактериями не сработали [60].
Однако будущее может подкинуть и больше задач. Вопрос, который уже встает перед регуляторными органами: что делать с персонализированной терапией и уникальными новыми препаратами? Ведь именно в этом направлении двигаются многие направления медицины. Если по лекарствам, которые нужны многим пациентам, можно набрать статистику и оценить эффективность, то что делать с препаратом, предназначенным для одного конкретного пациента? Будет ли влиять срочность ситуации на скорость одобрения? И каковы минимальные стандарты безопасности? Нужно ли будет учитывать мнение пациентов и их семей (например, по длине эксперимента): ведь они уже не просто добровольцы в КИ, а в чем-то «соавторы» исследования. Сейчас у некоторых регуляторных органов есть программы для сверхредких и серьезных заболеваний. Возможно, в будущем на их основе будут разработаны и рекомендации для персонализированного лечения [61].
Еще одна спорная область — это участие клинически здоровых пациентов в КИ профилактических препаратов. Польза от таких исследований в перспективе велика, особенно если представить, что так можно разработать «таблетку» по предотвращению болезни Альцгеймера [62]. Однако сначала требуется разработать надежные методики для выявления именно тех добровольцев, кому участие в подобных исследованиях действительно принесет пользу. Да и в целом, такой подход порождает массу социальных и этических вопросов. Как повлияет участие в таких КИ на здоровье и психологическое состояние добровольцев? Как исследователям эффективнее донести до участников информацию? Да и в целом, как регулятор должен оценивать эффективность лечения? Эти проблемы остаются малоизученными [62–64].
Во второй статье цикла мы поговорим непосредственно о пострегистрационных исследованиях, которых немного коснулись в этой статье, и разберем самые яркие истории успехов и провалов этой стадии клинических исследований.
Литература
- Jacoline C Bouvy, Marc A Koopmanschap, Huub Schellekens. (2012). Value for money of drug regulation. Expert Review of Pharmacoeconomics & Outcomes Research. 12, 247-249;
- J C Bouvy, M A Koopmanschap, R R Shah, H Schellekens. (2012). The Cost-Effectiveness of Drug Regulation: The Example of Thorough QT/QTc Studies. Clin Pharmacol Ther. 91, 281-288;
- Ana Sofia Pina, Abid Hussain, Ana Cecília A. Roque. (2010). An Historical Overview of Drug Discovery. Ligand-Macromolecular Interactions in Drug Discovery. 3-12;
- John P. Griffin, John Posner, Geoffrey R. Barker The Textbook of Pharmaceutical Medicine — Blackwell Publishing Ltd., 2013;
- Khaled W. Displacement estimation analyses for reconstructive ultrasound elastography using finite-amplitude deformations. VDM Verlag, 2008. — 208 p.;
- Корь: война с детской чумой продолжается;
- Оспа — забытая победа (небольшой эпидемиологический детектив);
- Rick Ng. Drugs: From Discovery to Approval (Second Edition).John Wiley & Sons, Inc., 2009. — 480 p.;
- Graham L Patrick. (2013). History of Drug Discovery. eLS;
- От живого к неживому. Доклинические исследования сегодня и завтра;
- Автоматизация разработки лекарств;
- Автоматизация омиксных технологий;
- Драг-дизайн: как в современном мире создаются новые лекарства;
- Виртуальные тропы реальных лекарств;
- Лекарство в пробирке: доклинические исследования in vitro;
- С миру по нитке: как соединились компоненты клинического исследования;
- Лидия Канг, Нэйт Педерсен: «История шарлатанства. Краткий обзор худших способов лечения с древности до наших дней». Рецензия;
- Raymond L. Woosley. (2013). One Hundred Years of Drug Regulation: Where Do We Go from Here?. Annu. Rev. Pharmacol. Toxicol.. 53, 255-273;
- Залог успеха — большие данные в умелых руках;
- Craig A. Umscheid, David J. Margolis, Craig E. Grossman. (2011). Key Concepts of Clinical Trials: A Narrative Review. Postgraduate Medicine. 123, 194-204;
- Путь к тысячам аптек начинается с одной молекулы;
- R.R. Niyazov, Center for Scientific Advice LLC, A.N. Vasiliev, E.V. Gavrishina, M.A. Dranitsyna, et. al.. (2018). Issues of recognition of GLP-status of domestic test facilities and trials abroad. RJ. 6-11;
- Xinji Zhang, Yuan Zhang, Xiaofei Ye, Xiaojing Guo, Tianyi Zhang, Jia He. (2016). Overview of phase IV clinical trials for postmarket drug safety surveillance: a status report from the ClinicalTrials.gov registry. BMJ Open. 6, e010643;
- CatarinaP Reis, BrunoG Gouveia, Patrícia Rijo, TâniaS Gonçalo. (2015). Good manufacturing practices for medicinal products for human use. J Pharm Bioall Sci. 7, 87;
- Hae Lin Cho, Marion Danis, Christine Grady. (2018). Post-trial responsibilities beyond post-trial access. The Lancet. 391, 1478-1479;
- Pavel Vasilyev, Alexander Petrenko, Veronika Tayukina. (2021). Soviet pharmaceutical regulation (1918–1990). CMAJ. 193, E1893-E1895;
- Клинические исследования в России — истории успеха;
- Gerfried K.H. Nell. (2018). Phase IV Studies and Lifecycle Management. Pharmaceutical Medicine and Translational Clinical Research. 383-391;
- Rebecca Llewellyn-Bennett, Louise Bowman, Richard Bulbulia. (2016). Post-trial follow-up methodology in large randomized controlled trials: a systematic review protocol. Syst Rev. 5;
- John Chalmers, Mark E. Cooper. (2008). UKPDS and the Legacy Effect. N Engl J Med. 359, 1618-1620;
- Giovanna Gallo, Allegra Battistoni, Roberta Coluccia, Giuliano Tocci, Massimo Volpe. (2019). Legacy Effect in the Treatment of Hypertension: Persistent Cardiovascular Protection after Conclusion of Randomized Clinical Trials in Hypertension. Curr Hypertens Rep. 21;
- Rachel G. Miller, Trevor J. Orchard. (2020). Understanding Metabolic Memory: A Tale of Two Studies. Diabetes. 69, 291-299;
- Osman Moneer, ChangWon C. Lee, Jerry Avorn, Aaron S. Kesselheim. (2021). Characteristics of Postmarketing Studies for Vaccines Approved by the US Food and Drug Administration, 2006-2020. JAMA Netw Open. 4, e218530;
- Joshua J Skydel, Audrey D Zhang, Sanket S Dhruva, Joseph S Ross, Joshua D Wallach. (2021). US Food and Drug Administration utilization of postmarketing requirements and postmarketing commitments, 2009–2018. Clinical Trials. 18, 488-499;
- Stanley A. Edlavitch. (1988). Postmarketing Surveillance Methodologies. Drug Intelligence & Clinical Pharmacy. 22, 68-78;
- Jean-David Zeitoun, Joseph S Ross, Ignacio Atal, Alexandre Vivot, Nicholas S Downing, et. al.. (2017). Postmarketing studies for novel drugs approved by both the FDA and EMA between 2005 and 2010: a cross-sectional study. BMJ Open. 7, e018587;
- Frances B. Garfield, J. Jaime Caro. (1999). Postmarketing Studies: Benefits and Risks. Value in Health. 2, 295-307;
- Scott Gottlieb. (2021). Evaluating Postmarket Vaccine Safety—Time to Consolidate This Mission at a Single Agency. JAMA Health Forum. 2, e211236;
- Jean-David Zeitoun, Joseph S Ross, Ignacio Atal, Alexandre Vivot, Nicholas S Downing, et. al.. (2017). Postmarketing studies for novel drugs approved by both the FDA and EMA between 2005 and 2010: a cross-sectional study. BMJ Open. 7, e018587;
- Arshadul Haque, Sajjan Daniel, Tricia Maxwell, Mariette Boerstoel. (2017). Postmarketing Surveillance Studies—An Industry Perspective on Changing Global Requirements and Implications. Clinical Therapeutics. 39, 675-685;
- MATTHEW HERDER. (2019). Pharmaceutical Drugs of Uncertain Value, Lifecycle Regulation at the US Food and Drug Administration, and Institutional Incumbency. Milbank Quarterly. 97, 820-857;
- Emily Jane Woo. (2014). Postmarketing safety of biologics and biological devices. The Spine Journal. 14, 560-565;
- Rolf Weitkunat, Peter N. Lee, Gizelle Baker, Zheng Sponsiello-Wang, Angela M. González-Zuloeta Ladd, Frank Lüdicke. (2015). A novel approach to assess the population health impact of introducing a Modified Risk Tobacco Product. Regulatory Toxicology and Pharmacology. 72, 87-93;
- Lenhangmbong Nkeng, Anne-Marie Cloutier, Camille Craig, Jacques Lelorier, Yola Moride. (2012). Impact of Regulatory Guidances and Drug Regulation on Risk Minimization Interventions in Drug Safety. Drug Safety. 35, 535-546;
- Mwango Kashoki, Zahra Hanaizi, Stella Yordanova, Richard Veselý, Christelle Bouygues, et. al.. (2020). A Comparison of
EMA andFDA Decisions for New Drug Marketing Applications 2014–2016: Concordance, Discordance, and Why. Clin. Pharmacol. Ther.. 107, 195-202; - Gail A. Van Norman. (2016). Drugs and Devices. JACC: Basic to Translational Science. 1, 399-412;
- Aris Angelis, Lawrence D. Phillips. (2021). Advancing structured decision‐making in drug regulation at the FDA and EMA. Br J Clin Pharmacol. 87, 395-405;
- Впервые за полвека появилось новое лекарство от волчанки;
- Jitendra Ganju. (2020). Improving the Standards of Reporting of Clinical Trial Data. Ther Innov Regul Sci. 54, 717-722;
- Гепатит C: решенная проблема?;
- Самое дорогостоящее лекарство в мире;
- Пациентский активизм и борьба с хроническими заболеваниями;
- Связанные одной лентой;
- Rick A. Vreman, Inkatuuli Heikkinen, Ad Schuurman, Claudine Sapede, Jordi Llinares Garcia, et. al.. (2019). Unmet Medical Need: An Introduction to Definitions and Stakeholder Perceptions. Value in Health. 22, 1275-1282;
- Thomas J Hwang, Joseph S Ross, Kerstin N Vokinger, Aaron S Kesselheim. (2020). Association between FDA and EMA expedited approval programs and therapeutic value of new medicines: retrospective cohort study. BMJ. m3434;
- Ниязов Р.Р., Васильев А.Н., Гавришина Е.В., Драницына М.А., Куличев Д.А. (2018). Проблемы прорывной терапии и ускоренной регистрации в России и ЕАЭС. Remedium. 11, 6–20;
- Joel Lexchin, Orla O'Donovan. (2010). Prohibiting or ‘managing’ conflict of interest? A review of policies and procedures in three European drug regulation agencies. Social Science & Medicine. 70, 643-647;
- Jennifer E Miller, Marc Wilenzick, Nolan Ritcey, Joseph S Ross, Michelle M Mello. (2017). Measuring clinical trial transparency: an empirical analysis of newly approved drugs and large pharmaceutical companies. BMJ Open. 7, e017917;
- Qi Liu, Hao Zhu, Chao Liu, Daphney Jean, Shiew‐Mei Huang, et. al.. (2020). Application of Machine Learning in Drug Development and Regulation: Current Status and Future Potential. Clin. Pharmacol. Ther.. 107, 726-729;
- Abhishek Iyer, Annemieke Madder, Ishwar Singh. (2019). Teixobactins: a new class of 21st century antibiotics to combat multidrug-resistant bacterial pathogens. Future Microbiology. 14, 457-460;
- Janet Woodcock, Peter Marks. (2019). Drug Regulation in the Era of Individualized Therapies. N Engl J Med. 381, 1678-1680;
- Michael S. Rafii, Paul S. Aisen. (2019). Alzheimer’s Disease Clinical Trials: Moving Toward Successful Prevention. CNS Drugs. 33, 99-106;
- Erika Mosor, Michaela Stoffer‐Marx, Günter Steiner, Karim Raza, Rebecca J. Stack, et. al.. (2020). I Would Never Take Preventive Medication! Perspectives and Information Needs of People Who Underwent Predictive Tests for Rheumatoid Arthritis. Arthritis Care Res. 72, 360-368;
- Caroline Ollivier-Yaniv. (2018). Recruitment and Engagement in Preventive Clinical Trials: Interdependencies and Mediation. JAIDS Journal of Acquired Immune Deficiency Syndromes. 79, S3-S7.






