Калиевые каналы как перспективное средство для генной терапии эпилепсии
02 августа 2021
Калиевые каналы как перспективное средство для генной терапии эпилепсии
- 3377
- 0
- 9
Недавно был впервые запатентован генетически модифицированный калиевый канал как средство лечения эпилепсии в тяжелых случаях вместо хирургии
рисунок автора статьи
-
Автор
-
Редакторы
Темы
Статья на конкурс «Био/Мол/Текст»: Приобретенной или наследуемой эпилепсией поражены миллионы людей. Болезнь приблизительно в 30% случаев оказывается фармакорезистентной — она демонстрирует устойчивость ко всем применяемым лекарствам, — и этот процент не снижается с 1950-х годов. Сегодня фармакорезистентную эпилепсию лечат радикальными хирургическим методами, что, однако, помимо тяжелых последствий, не дает гарантии излечения или того, что болезнь не вернется вновь. Недавно передовые биомедицинские лаборатории начали разработку генетической терапии пораженных тканей мозга для локального снижения возбудимости нейронов и нейтрализации эпилептического очага. Наиболее многообещающим средством и мишенью для генной терапии признаются калиевые каналы — благодаря своим выдающимся способностям возвращать нейрон в неактивное состояние и регулировать частоту электрических разрядов. Несмотря на то, что текущие исследования пока находятся на стадии доказательства концепции и доклинических испытаний, уже сейчас продемонстрировано значительное облегчение и даже излечение фармакорезистентной эпилепсии в модельных условиях.
Конкурс «Био/Мол/Текст»-2021/2022
Эта работа опубликована в номинации «Своя работа» конкурса «Био/Мол/Текст»-2021/2022.

Партнер номинации — компания Cytiva.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Генеральный партнер конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Возбуждение и торможение в нервной системе
Эпилепсия может принимать разные формы в зависимости от причины, области поражения и стадии заболевания. Инсульты, травмы, гипоксия, врожденные генетические мутации при неблагоприятных условиях вызывают сильные изменения в собственной возбудимости нейронов и межнейронных взаимодействиях, что в дальнейшем может приводить к проявлению патологической судорожной активности. Обычно эпилепсию характеризуют как раз по повторяющимся судорогам разной интенсивности и частоты [1]. Это состояние очень опасно и часто требует серьезного ухода, поскольку сопровождается полной или частичной потерей сознания, при которой больной не только затрудняется вспомнить произошедшее, но и может нанести себе травмы или даже представлять угрозу для окружающих — например, управляя транспортным средством.
Эпилепсия может быть фокальной (судороги возникают из определенного участка мозга и развиваются локально) или генерализованной (широко вовлечены многие отделы мозга). Наиболее частая фокальная эпилепсия характеризуется степенью тяжести в соответствии с тем, насколько малой областью ограничиваются судороги, как широко они распространяются и имеют ли тенденцию к дальнейшей генерализации. Для прогноза очень важно, насколько четко локализован и очерчен очаг судорог, является ли он дискретным или же рассеянным, внедряется ли в жизненно важные области мозга, что может в дальнейшем перечеркнуть даже потенциальную возможность хирургического удаления фокуса эпилепсии [2].
В целом, головной мозг состоит из двух самых многочисленных типов нейронов: возбуждающих и тормозных. К возбуждающим нейронам, например, относятся все пирамидные нейроны, составляющие до 80% нейронов коры больших полушарий головного мозга (рис. 1). Возбуждающие нейроны выделяют из окончаний своих длинных отростков — аксонов — химические медиаторные вещества, стимулирующие окружающие нейроны или другие отделы мозга. В свою очередь, тормозные интернейроны выделяют медиаторы, подавляющие активность других нейронов, тем самым регулируя активность нейронной сети в целом. При эпилептических судорогах электрические разряды нейронов периодически выходят из-под контроля, что сопровождается взрывным нарушением баланса возбуждения и торможения в нервной системе. Современные антиэпилептические лекарства стараются либо подавить механизмы возбуждения, либо, наоборот, усилить торможение в центральной нервной системе [3]. Однако их действие сопровождается сильными побочными эффектами при системном введении и не избирательно по отношению к очагу судорожной активности. Необходимо вылечить строго определенные нейроны, а вместо этого серьезному фармакологическому воздействию подвергается весь организм [2].
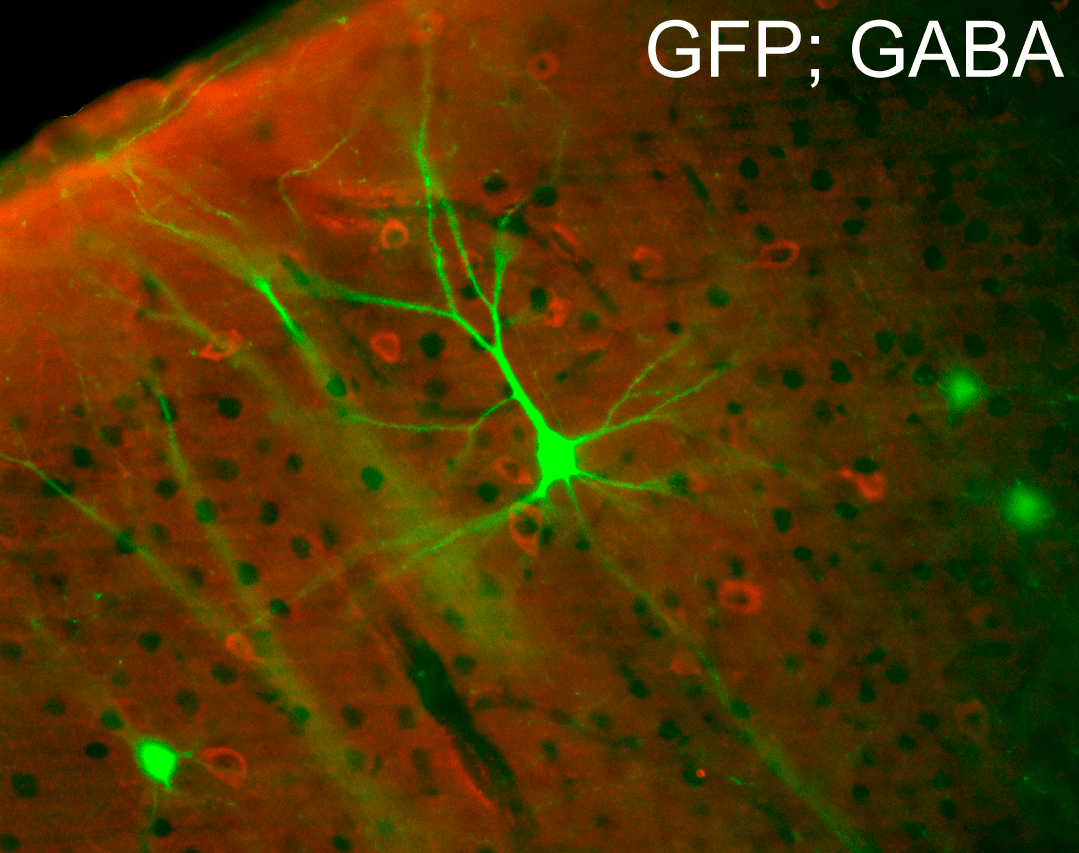
Рисунок 1. Основные нейроны головного мозга: крупные возбуждающие глутаматэргические нейроны неокортекса (возбуждающий медиатор — глутамат [4]) — окрашены зеленым при помощи зеленого флуоресцентного белка GFP — и относительно мелкие тормозные интернейроны, выделяющие тормозный медиатор γ-аминомасляную кислоту — GABA [5] (окрашены красным). Иммуноцитохимия, эпифлуоресцентная микроскопия. Мы также предлагаем любознательному читателю погрузиться в загадочный мир нейромедиаторов на «Биомолекуле».
Восстановление баланса в нервной системе через снижение активности нейронов в очаге эпилепсии
Подход генной терапии [6] к излечению эпилепсии предполагает использование специальных векторов экспрессии для помещения в нейроны и активацию дополнительных генов, кодирующих, например, дополнительные тормозные каналы или какие-нибудь другие белки, регулирующие возбудимость клетки. Структура используемых векторов практически не отличается от таковой у Sputnik V (популярной современной вакцины против COVID-19 [7]), — это аденовирусная [8] или лентивирусная оболочка, лишенная патогенной вирусной ДНК (поэтому векторы не способны размножаться и вызывать вирусное заболевание). Но эта оболочка заполняется специально сконструированной плазмидной ДНК, экспрессирующей терапевтические гены при попадании в нейрон. У антиэпилептических векторов имеются два важных отличия от антиковидной вакцины:
- Необходимость введения непосредственно в мозг в область очага судорог, поскольку вирусоподобные частицы не способны самостоятельно проникать через гематоэнцефалический барьер.
- Использование клеточноспецифических промоторов — дополнительных регуляторных последовательностей ДНК, которые запускают экспрессию терапевтических генов только при попадании в определенный тип нейрона.
На сегодняшний день мишенью генной терапии выбирают возбуждающие глутаматэргические нейроны для подавления их неконтролируемой активности при судорогах, поэтому обычно используют промотор CaMKII, гарантирующий экспрессию генов вектора в возбуждающих нейронах с избирательностью до 95%. Технология введения генов, подобно шприцу, позволяет вводить любые гены в нейроны выбранной зоны мозга. Однако остается открытым вопрос, подключение какого именно дополнительного гена способно компенсировать сверхактивное состояние возбуждающих нейронов во время судорог. Иными словами, синтез каких именно функциональных белков способен остановить эпилепсию и предотвратить неконтролируемые скачки электрической активности в нервной системе, страдающей от эпилептической патологии?
Новейшие исследования на экспериментальных моделях эпилепсии грызунов уверенно подтверждают необходимость использования добавочных калиевых каналов, напрямую помещаемых в нейрон. Также, кроме самих каналов, для компенсации эпилепсии возможно применение ионных транспортеров на основе трансмембранного калиевого градиента или же регуляторных факторов, опосредованно мобилизующих внутренние калиевые каналы нейрона [9].
Калиевые каналы обеспечивают фундаментальный механизм контроля собственной возбудимости нейрона
В геноме млекопитающих различные субъединицы калиевых каналов кодируются ~90 генами. Кроме того, посттранскипционные модификации увеличивают разнообразие, поскольку даже в одном нейроне могут сосуществовать варианты альтернативного сплайсинга, которые определяют функциональные особенности работающего канала. Также, каналы могут состоять из нескольких субъединиц, состав которых может варьировать. В целом, калиевые каналы разделяют на четыре семейства:
- Каналыутечки (tandem pore domain, TWIK/TRAAK/TREK/TASK).
- Каналы входящего выпрямляющего тока (Kir1–6, обычно активируются G-белками).
- Кальций-зависимые каналы (BK, SK, IK и т.п.).
- Потенциал-чувствительные каналы (Kv1–12).
Наружное пространство вокруг нейрона обогащено ионами калия, а потенциал реверсии калиевого тока значительно ниже значения потенциала покоя нейрона, и, тем более, значений потенциала во время генерации электрической активности . Поэтому открытие калиевых каналов снижает собственную возбудимость нейрона и возвращает потенциал после генерации разрядов к своему нижнему значению покоя или еще ниже, вызывая следовую гиперполяризацию (состояние с пониженной вероятностью генерации электрических разрядов). Кроме того, калиевые каналы регулируют потенциал покоя, ограничивают частоту и длительность отдельных потенциалов действия, а также вносят вклад в рефрактерный период нейрона [9].
О путешествиях ионов сквозь мембрану нейронов и мембранных потенциалах подробнее можно прочитать в статьях: «Формирование мембранного потенциала покоя» [10] и «Метроном: как руководить разрядами?» [11].
Важные функциональные особенности калиевых каналов определяют их не только как помощников, поддерживающих физиологические параметры электрической активности, но и как жизненно необходимых игроков, без которых невозможен устойчивый баланс возбуждения и торможения в центральной нервной системе. Например, экспериментальное выключение каналов BK-типа токсином яда скорпиона — ибериотоксином — приводит к неконтролируемой эскалации синаптической передачи между возбуждающими глутаматэргическими пирамидными нейронами коры больших полушарий (рис. 2) [12]. Кроме того, возбуждающие глутаматэргические нейроны неоднородны и различаются по нативно синтезируемым типам калиевых каналов, из-за чего даже у нейронов, перемешанных в пределах одного слоя, может значительно различаться уязвимость для судорожной активности [13].
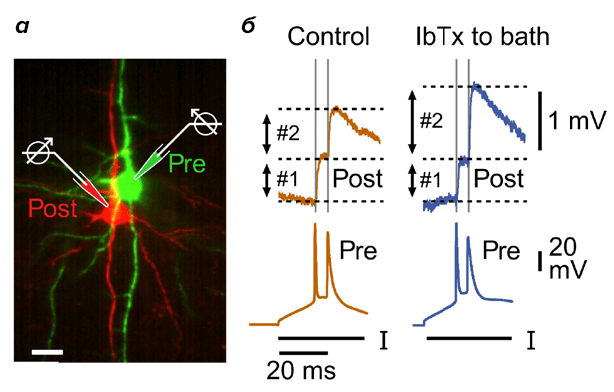
Рисунок 2. Активация калиевых BK-каналов регулирует синаптическую передачу сигнала с одного нейрона на другой, ограничивая выброс возбуждающего медиторного вещества. а — Экспериментальная регистрация пары синаптически связанных нейронов пятого слоя неокортекса с помощью двойного пэтч-клампа и двух микропипеток, содержащих красный и зеленый красители. Линейка — 20 мкм. б — Типичная регистрация постсинаптических потенциалов (верхние записи) в ответ на пары потенциалов действия в пресинаптическом нейроне (нижние записи). Аппликация ибериотоксина (IbTx, блокатор BK-каналов) вызывает эскалацию постсинаптического ответа на второй потенциал действия, что имитирует физиологические нарушения при потере функции BK канала при врожденной эпилепсии (верхняя синяя запись).
Калиевые каналы впервые заинтересовали исследователей лаборатории клеточной нейробиологии обучения ИВНД и НФ РАН, в которой работает автор этой статьи, поскольку они принимают участие в формировании возбудимости нейрона при обучении наравне с другими каналами, но их роль была практически не исследованной. Кроме того, калиевые каналы во многом определяют кратковременную неассоциативную память нейрона, то есть то, каким образом реакция нейрона будет изменяться в ближайшее время в зависимости от его активности в нейронной сети. В нервной системе роль тормозных калиевых каналов часто недооценивается, поскольку им трудно приписать какую-нибудь простую, интуитивно понятную функцию, в отличие от, например, деполяризующих каналов, открытие которых приводит к возникновению потенциалов действия и далее к передаче электрического сигнала на мышцу и ее сокращению. Тем не менее уже сейчас ясно, что калиевые каналы незримо принимают участие практически в каждом проявлении работы мозга, в каждом его нейроне, и их вклад становится особенно заметен при изучении таких экстремальных состояний, как эпилепсия.
Судорожная активность, вызываемая врожденными патологиями калиевых каналов
Генетический скрининг пациентов с различными формами эпилепсии выявил связь между проявлением заболевания и мутациями потери функции или нарушения проводимости различных калиевых каналов. Независимые исследования выявили эпилептогенные мутации (нелетальные) в кальций-зависимых (BK и KCa4.1), выпрямляющих (Kir4 и Kir6) и потенциал-чувствительных (Kv1, Kv2, Kv3, Kv4, Kv7.2/3, Kv8.2, Kv10 и Kv11.1) каналах. Из всех канальных патологий заметно выделяется нейроспецифический канал Kv7.2/3, мутации которого встречались почти в половине случаев. Обычно эти мутации вызывают эпилепсию в раннем детстве с тяжестью от легкого неонатального синдрома до тяжелых фармакорезистентных энцефалопатий, сопровождающихся интеллектуальной инвалидностью [9]. Для гена Kv7.3 (KCNQ3) даже были определены позиции мутаций, сильнее всего влияющих на прогноз тяжести заболевания.
Очень важные для генезиса врожденной эпилепсии потенциал-чувствительные каналы Kv7.2/3 обеспечивают неинактивируемый калиевый M-ток, который регулирует потенциал покоя нейрона в компартмент-специфической манере. Это означает, что сами каналы Kv7.2/3 локализуются в аксоне нейрона и там активируются (рис. 3). Они оказывают влияние на проведение аксоном электрических разрядов, а также, что более важно, активность этих каналов регулирует число потенциалов действия, генерируемых нейроном в начальном сегменте аксона по принципу «всё или ничего» (в ответ на медленные деполяризационные сигналы, исходящие от дендритов по направлению к соме и аксону нейрона). Если заблокировать Kv7.2/3 высокоселективным блокатором тока этих каналов XE-991, то у нейронов, склонных к внутренней генерации разрядов (intrinsically bursting neurons), включается режим периодической генерации серийных высокочастотных разрядов (~200–300 Гц, рис. 3 [14]).
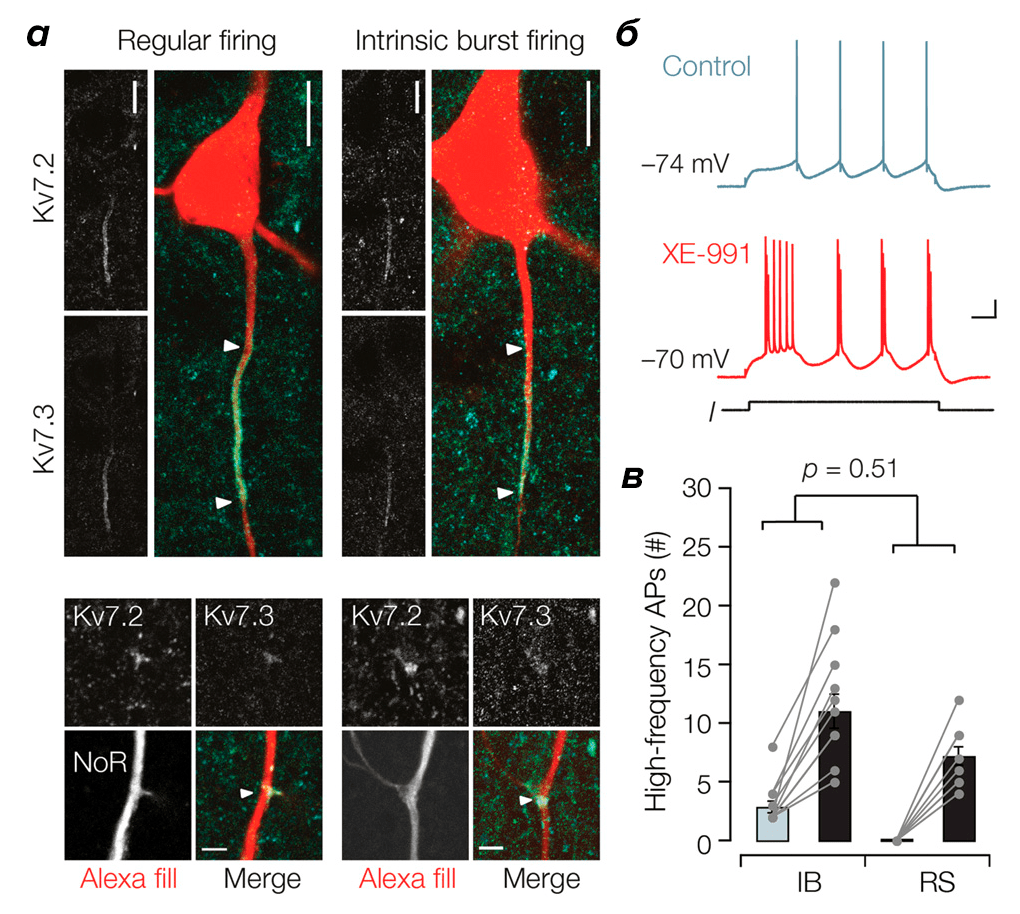
Рисунок 3. Локализация важных эпилептогенных каналов Kv7.2/3 в аксоне возбуждающих пирамидных нейронов, фармакологическая блокада которых вызывает потерю функции, сходную с эпилептогенными мутациями. а — Морфология двух подтипов нейронов (красный цвет) с окраской каналов Kv7.2 и Kv7.3 (зеленый цвет). Справа — начальные сегменты аксонов. Снизу — первые ветвления аксона. Линейки — 10 мкм. б — Аппликация XE-991 — селективного блокатора каналов Kv7.2/3 — вызывает повышение мембранного потенциала и серийный разряд у нейрона (IB, intrinsically bursting), что сходно с судорожными разрядами. Калибровка — 100 мс, 20 мВ. в — Суммарная гистограмма усиления высокочастотной активности двух подтипов нейронов на фоне XE-991 по сравнению с контрольными записями показывает наличие взрывной активности при нарушении функции каналов Kv7.2/3.
Исходя их всего сказанного — при мутациях потери функции каналов Kv7.2/3 теряется функция аксона, восстановление которой и является избирательной целью противоэпилептической терапии. Решение такой проблемы для классической фармакологии даже теоретически невозможно. Генная терапия, наоборот, помимо специфической экспрессии генов в определенном типе нейронов, позволяет направлять вновь синтезированный нейроном калиевый канал в определенные части этого нейрона (например в аксон), используя мотивы внутриклеточного таргетинга. Хотя работы по таргетингу (направлению) калиевых каналов в аксон для терапии эпилепсии пока не ведутся, подобная технология уже разработана и использовалась для генной терапии другого заболевания — дегенеративного поражения сетчатки глаза. На модельной системе лабораторного животного использовали мотив внутриклеточного транспорта, взятый от универсального нейронного белка анкирина G, естественно локализованного в начальном сегменте аксона [15]. Это не только позволило синтезировать чужеродные каналы в аксонах нейронов сетчатки, но и правильно расположить их там, что было видно по флуоресцентной метке под микроскопом.
Современные модели генной терапии эпилепсии
Самые первые попытки генной терапии эпилепсии сейчас кажутся достаточно наивными, или же исследователи ставили себе целью скорее демонстрацию принципа, а не реальное излечение пациентов. На волне возникновения прорывных методов оптогенетики [16], [17], позволяющих оптически стимулировать нейроны мозга, освещая сконструированные генетическими методами светочувствительные каналы светом определенной длины волны, было предложено поместить оптогенетические тормозные каналы в мозг и запускать их при возникновении судорог. Однако такая сложная технология требовала имплантации в мозг световодов, соединенных с внешним источником, и даже удаления части ткани на пути световода, поскольку эпилептический фокус обычно располагается в глубине ткани. Кроме того, поскольку в этих экспериментах для торможения использовались анионные хлорные каналы [18], потенциал реверсии которых близок к потенциалу покоя, дальнейшая проверка метода другими исследователями выявила парадоксальные эффекты, когда оптогенетическая активация хлорных каналов в определенных случаях вызывала не ослабление, а, наоборот, усиление судорог.
Выход был найден при помощи калий-хлорного транспортера KCC2, дополнительный синтез которого в эпилептическом очаге предотвращал парадоксальный проэпилептогенный эффект активации хлорных каналов [19]. Известно, что потенциал реверсии хлорного тока близок к потенциалу покоя нейрона, поэтому даже небольшие сдвиги концентраций хлора во внутриклеточном и внеклеточном пространстве, происходящие при судорогах, способны его инвертировать, и тогда открытие хлорных каналов начинает уже возбуждать нейрон, а не тормозить. Ситуацию спасает усиление функции калий-хлорных транспортеров, которые быстро возвращают ионы хлора к исходным концентрациям, используя как движущую силу более стабильный и негативный градиент ионов калия.
Следующий предложенный подход предполагал объединение генной терапии и фармакологических воздействий — то есть хемогенетики. Для этого ученые сконструировали специальные рецепторы типа DREADD (Designer Receptors Exclusively Activated by Designer Drugs) на основе нативных мускариновых или κ-опиоидных рецепторов. В отличии от своих прототипов, DREADD-рецепторы можно активировать только синтетическим химическим веществом — лигандом, отсутствующим в нервной системе, — вследствие чего происходит открытие выпрямляющих калиевых каналов Kir. То есть с помощью генетической экспрессии создается искусственная фармакологическая мишень на тех нейронах, в которые были помещены DREADD-рецепторы. Однако у такого подхода есть существенный недостаток — он не обеспечивает нейронам обратную связь на возникновение судорог, и, следовательно, потребовалось бы постоянное введение DREADD-лигандов для поддержания терапевтического эффекта.
Другой подход, наоборот, предлагает в нейронах очага эпилепсии увеличить продукцию опиоидного пептида динорфина путем доставки и экспрессии последовательности прединорфина в этих нейронах. Когда нейроны подвергаются судорожной активации, созревший динорфин выбрасывается наружу в межнейронное соединение и активирует опиоидные рецепторы, которые, в свою очередь, открывают тормозные калиевые Kir-каналы. Это обеспечивает механизм обратной связи и позволяет нейронам самим реагировать на свою сверхактивность, выбрасывая дополнительный динорфин в случае необходимости [20].
Генная терапия с использованием потенциал-чувствительных каналов
Дальше всех в генной терапии эпилепсии продвинулись исследователи из UCL (Лондон). Эта группа сначала предложила использовать потенциал-чувствительный калиевый канал Kv1.1, а позже его генно-инженерную модификацию со сниженной инактивацией (для увеличения длительности открытого состояния) с целью улучшения противосудорожного эффекта [21]. При возникновении судорог канал активировался многочисленными потенциалами действия в эпилептическом очаге и обеспечивал дополнительное обратное торможение сверхактивных нейронов. Лентивирусный вектор с модифицированным каналом Kv1.1 протестировали на модели фокальной эпилепсии, вызванной инъекцией в мозг животных столбнячного токсина, необратимо повреждающего нейроны и вызывающего патологическую активность. Инъекция вектора в эпилептический очаг вызывала достоверное снижение интенсивности эпилептических разрядов и стабильную компенсацию судорожной активности (рис. 4). Вдохновленные такими результатами, исследователи из UCL даже запатентовали модифицированный канал Kv1.1 как средство от эпилепсии [22], рассчитывая на скорое внедрение в клинику этого способа лечения.
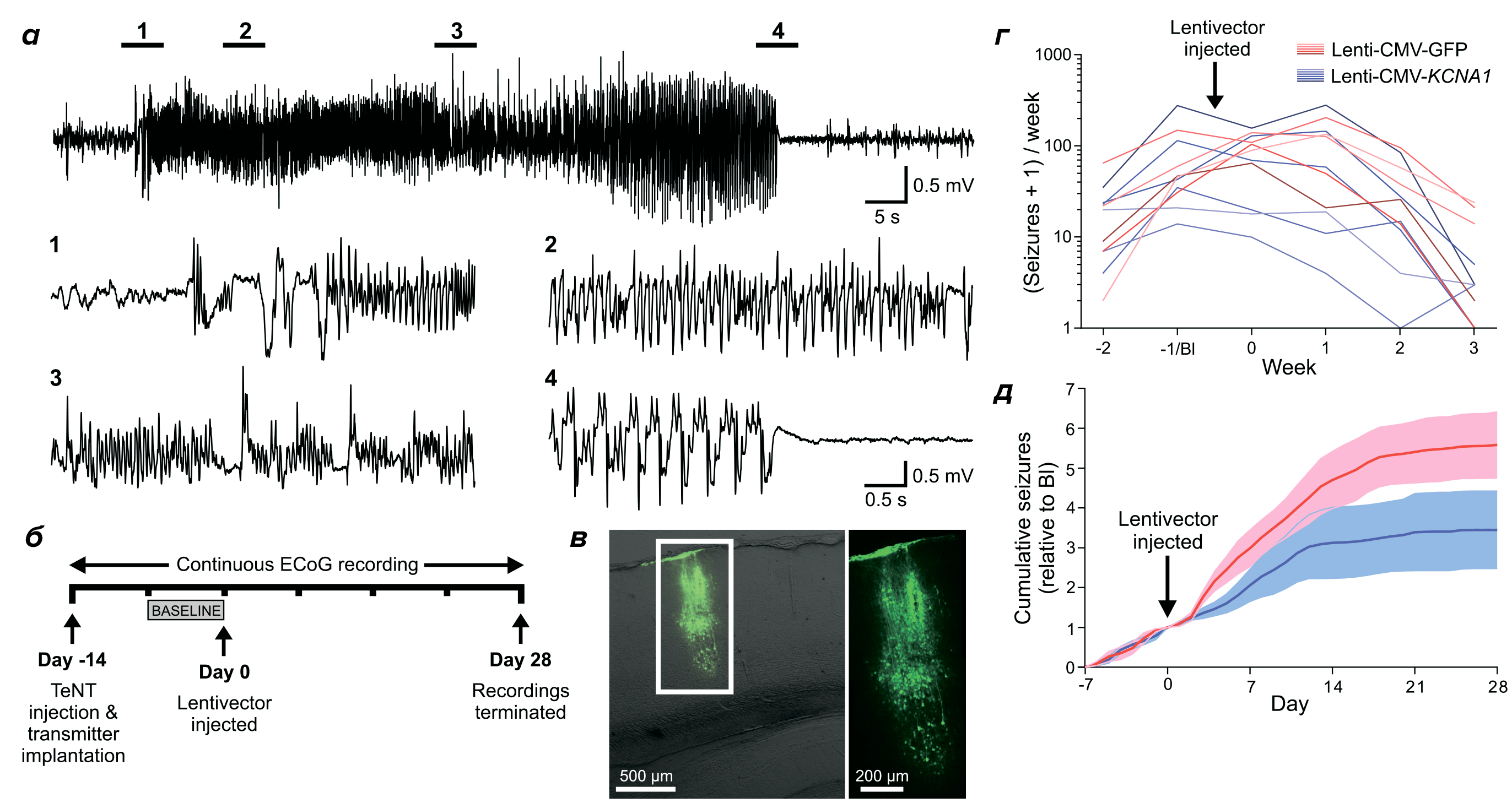
Рисунок 4. Модельное излечение эпилепсии на пораженной токсином столбняка коре больших полушарий грызуна: генная терапия модифицированными каналами Kv1.1 (ген KCNA1). а — Репрезентативные записи судорог в теменной коре через две недели после инъекции столбнячного токсина (TeNT) в первичную зрительную кору (также приведены увеличенные участки 1–4). б — Схема эксперимента с последовательностью экспериментальных воздействий и измерений. в — Внедрение в нейроны вектора Lenti-CMV-KCNA1 ограничивалось небольшой областью ~500–1000 мкм вблизи места инъекции. г — Число судорог у животных, получивших инъекцию Kv1 (KCNA1), достоверно снижается по сравнению с контрольными животными (GFP), что говорит об ослаблении модельной эпилепсии при терапии калиевыми каналами. д — Суммарная гистограмма показывает достоверное снижение судорожной активности у животных, получивших инъекцию Kv1 (KCNA1) (синяя кривая) по сравнению с контрольными животными (красная кривая).
Заключение
Поскольку калиевые каналы чрезвычайно важны для внутреннего ограничения собственной активности и возбудимости, установление контроля над калиевой проводимостью нейрона методами генной терапии имеет громадный потенциал для лечения эпилептических расстройств нервной системы, связанных со сверхвозбудимостью. Для больных фармакорезистентными формами эпилепсии (до 30%), генная терапия остается едва ли не единственной надеждой избавиться от своего заболевания, не прибегая к радикальному хирургическому вмешательству. Генная терапия нацелена, в первую очередь, на сохранение нервной ткани путем снижения возбудимости нейронов в очаге судорог для компенсации их повышенной активности. Вместе с тем, применение генной терапии вызывает необратимые изменения в нейронах, снабженных с помощью векторов экспрессии новыми функциональными каналами. В настоящий момент проводятся доклинические испытания генной терапии эпилепсии калиевыми каналами на модельных животных с целью дополнительного контроля ее эффективности, избирательности и определения возможных побочных эффектов.
Наши исследования поддержаны грантом РНФ 20-15-00408.
Литература
- C. Bernard. (2012). Treating Epilepsy with a Light Potassium Diet. Science Translational Medicine. 4, 161fs40-161fs40;
- Liam Drew. (2018). Gene therapy targets epilepsy. Nature. 564, S10-S11;
- Эпилепсия, методы ее лечения и роль вальпроевой кислоты в терапии заболевания;
- Очень нервное возбуждение;
- Спокоен как GABA;
- Генная терапия: познакомьтесь с лекарствами будущего;
- «Спутник V», «ЭпиВакКорону», «Модерну» делать будем? Ликбез по вакцинам против коронавируса;
- Время первых: как аденоассоциированные вирусы стали лучшими в доставке генов in vivo;
- ES Nikitin, LV Vinogradova. (2021). Potassium channels as prominent targets and tools for the treatment of epilepsy. Expert Opinion on Therapeutic Targets. 25, 223-235;
- Формирование мембранного потенциала покоя;
- Метроном: как руководить разрядами?;
- Matvey V. Roshchin, Mikhail E. Matlashov, Victor N. Ierusalimsky, Pavel M. Balaban, Vsevolod V. Belousov, et. al.. (2018). A BK channel–mediated feedback pathway links single-synapse activity with action potential sharpening in repetitive firing. Sci. Adv.. 4, eaat1357;
- M. V. Roshchin, V. N. Ierusalimsky, P. M. Balaban, E. S. Nikitin. (2020). Ca2+-activated KCa3.1 potassium channels contribute to the slow afterhyperpolarization in L5 neocortical pyramidal neurons. Sci Rep. 10;
- A. Battefeld, B. T. Tran, J. Gavrilis, E. C. Cooper, M. H. P. Kole. (2014). Heteromeric Kv7.2/7.3 Channels Differentially Regulate Action Potential Initiation and Conduction in Neocortical Myelinated Axons. Journal of Neuroscience. 34, 3719-3732;
- Kenneth P. Greenberg, Aaron Pham, Frank S. Werblin. (2011). Differential Targeting of Optical Neuromodulators to Ganglion Cell Soma and Dendrites Allows Dynamic Control of Center-Surround Antagonism. Neuron. 69, 713-720;
- Светлая голова;
- Свет, камера, … нервный импульс!;
- Наука из первых рук: как гомеостаз хлора влияет на возникновение эпилепсии;
- Vincent Magloire, Jonathan Cornford, Andreas Lieb, Dimitri M. Kullmann, Ivan Pavlov. (2019). KCC2 overexpression prevents the paradoxical seizure-promoting action of somatic inhibition. Nat Commun. 10;
- Alexandra S Agostinho, Mario Mietzsch, Luca Zangrandi, Iwona Kmiec, Anna Mutti, et. al.. (2019). Dynorphin‐based “release on demand” gene therapy for drug‐resistant temporal lobe epilepsy. EMBO Mol Med. 11;
- Albert Snowball, Elodie Chabrol, Robert C. Wykes, Tawfeeq Shekh-Ahmad, Jonathan H. Cornford, et. al.. (2019). Epilepsy Gene Therapy Using an Engineered Potassium Channel. J. Neurosci.. 39, 3159-3169;
- Schorge S., Walker M.C., Kullmann D.M., Snowball A., Chabrol E. (2018). Expression vectors comprising engineered genes. WIPO (PCT) patent WO2018229254A1;
- Wei-Chung Allen Lee, Hayden Huang, Guoping Feng, Joshua R Sanes, Emery N Brown, et. al.. (2005). Dynamic Remodeling of Dendritic Arbors in GABAergic Interneurons of Adult Visual Cortex. PLoS Biol. 4, e29.