Осторожно, папарацци! Или как «сфотографировать» GPCR в комплексе с G-белком и лигандом
18 декабря 2025
Осторожно, папарацци! Или как «сфотографировать» GPCR в комплексе с G-белком и лигандом
- 107
- 0
- 2
В объективе науки: активные комплексы GPCR–лиганд–G-белок.
иллюстрация Финочко Юлии
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: «Биомолекула» не раз писала о важности GPCR в нашем организме. Долгое время ученым не удавалось получить активные структуры GPCR в комплексе с G-белком и лигандом — природа тщательно скрывала от исследователей молекулярные механизмы работы этих рецепторов. Однако появление новых технологических подходов позволило преодолеть эту преграду. В этой статье мы расскажем о четырех способах стабилизировать активный комплекс GPCR–лиганд–G-белок. Рассмотренные подходы позволяют раскрыть молекулярные механизмы активации рецепторов и открывают новые пути для рационального дизайна лекарств, помогая фармакологам с хирургической точностью находить новые терапевтические средства.
Конкурс «Био/Мол/Текст»-2025/2026
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2025/2026.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.
Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
GPCR (рецепторы, сопряженные с G-белком) — семиспиральные трансмембранные белки эукариот — крупнейшее и наиболее значимое семейство рецепторов в нашем организме. Их функция — передача сигнала из внешней среды внутрь клетки. В организме человека найдено более 800 типов GPCR [1] — немало, не правда ли? А активировать их может почти что угодно: фотоны света [2], гормоны, ионы, нуклеотиды — продолжайте в меру вашей фантазии! Эдакие «в-каждой-бочке-затычки» участвуют буквально во всех процессах нашей жизнедеятельности и, соответственно, способны повлиять на ход большинства заболеваний [1]. Сейчас около 40% лекарств на рынке [3] работают именно через эти рецепторы, поэтому научный интерес к этим белкам очень высок.
Как следует из названия этих рецепторов, их неотъемлемые сообщники — G-белки. Связываясь с лигандом, GPCR изменяет свою конформацию и этим активирует G-белок (рис. 1). Он состоит из трёх субъединиц: α, β и γ. Gα-субъединица обладает гидролитической активностью, может связывать ГТФ и ГДФ. Когда G-белок неактивен, Gα связана с ГДФ. При активации G-белка она высвобождает ГДФ и связывает ГТФ, после чего G-белок разваливается на две части: Gα- и Gβγ-субъединицы [1], [4]. Существуют разные типы Gα-субъединиц, самые распространенные среди которых — Gs, Gi и Gq. Каждая из них вызывает свой клеточный ответ — например, Gq вызывает повышение концентрации кальция внутри клетки. Субъединицы β и γ тоже могут различаться по структуре и функциям [4].
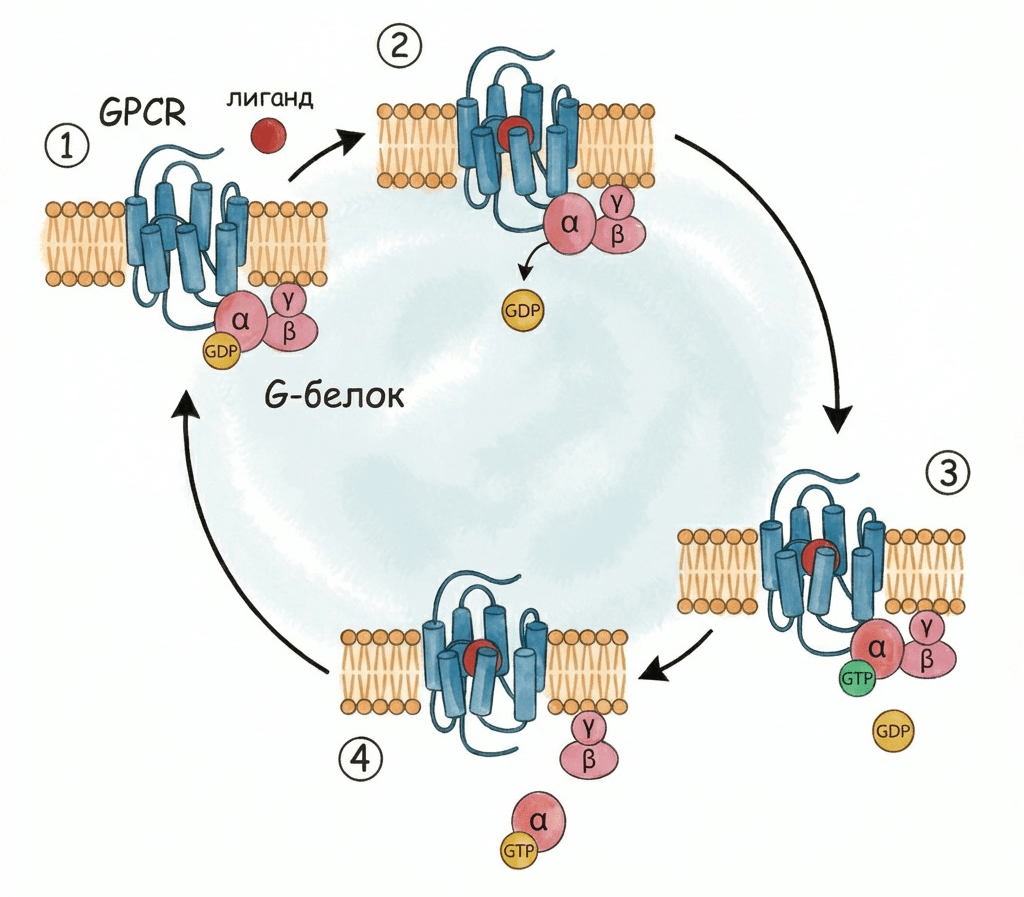
Рисунок 1. Механизм активации GPCR и G-белка. (1) Неактивный GPCR находится в комплексе с гетеротримерным G-белком (α-, β- и γ-субъединицы), где α-субъединица связана с ГДФ. (2) При связывании лиганда GPCR активируется и изменяет конформацию, стимулируя высвобождение ГДФ из активного центра α-субъединицы G-белка. (3) α-Субъединица G-белка связывает ГТФ, что приводит к активации G-белка. (4) Активированный G-белок распадается на Gα- и Gβγ-субъединицы, индуцируя дальнейший каскад внутриклеточных реакций.
рисунок автора по статье «Википедии»
Итак, наша комбинаторика: есть более 800 типов GPCR и несколько десятков комбинаций типов G-субъединиц. Каждый рецептор связывает свой эндогенный (вырабатываемый организмом) лиганд, но ко многим GPCR можно подобрать еще и множество других лигандов — как природных, так и синтетических. Как же узнать, чем обусловливается специфичность множества GPCR к лигандам? И как эти рецепторы «выбирают» свой тип G-белка?
На все эти вопросы ответы дает структурная биология [5] — раздел науки, в котором получают трехмерные «фотографии» белков, вирусов и прочих молекулярных героев. Правда, «сфотографировать» белки на обычную камеру телефона не получится — они слишком маленькие. Для этого ученые придумали специальные методы, например, рентгеновскую кристаллографию.
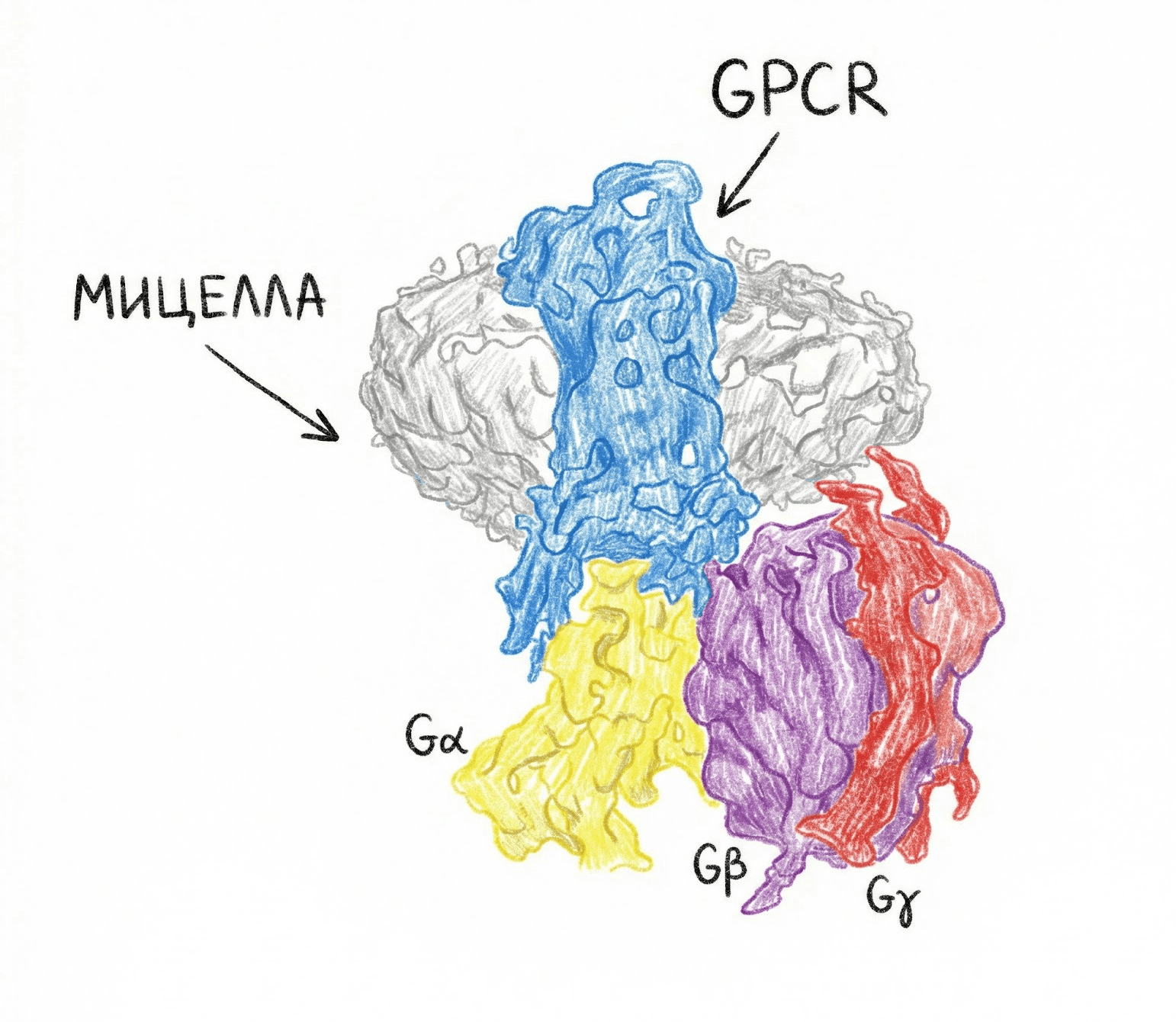
Рисунок 2. GPCR в мицелле.
рисунок автора по [13]
Несмотря на такую богатую историю GPCR в рентгеновской кристаллографии, в последнее время популярность набрал другой метод — криоэлектронная микроскопия (крио-ЭМ). В качестве образца используется несколько микролитров водного раствора целевого белка. Но возникает проблема: для мембранных белков (которыми являются GPCR) нативное окружение — гидрофобная мембрана [12]. В водном растворе они перестают существовать как функциональные молекулы. Выход? Солюбилизация — белки заключают в мицеллы: в сущности, «мыльные пузыри». Снаружи эти пузыри отлично растворяются в воде, а внутри сохраняется гидрофобная среда, где GPCR чувствует себя как рыба в воде (а точнее, рыба в мыле). А вот G-белок — водорастворим, поэтому он красиво «торчит» из мицеллы хвостом (рис. 2) [4].
Предположим, у нас есть раствор, содержащий комплексы GPCR–G-белок в мицеллах. Перед отправкой на крио-ЭМ образец нужно подготовить специальным образом. Подробную схему подготовки образцов на крио-ЭМ можно посмотреть на рис. 3.
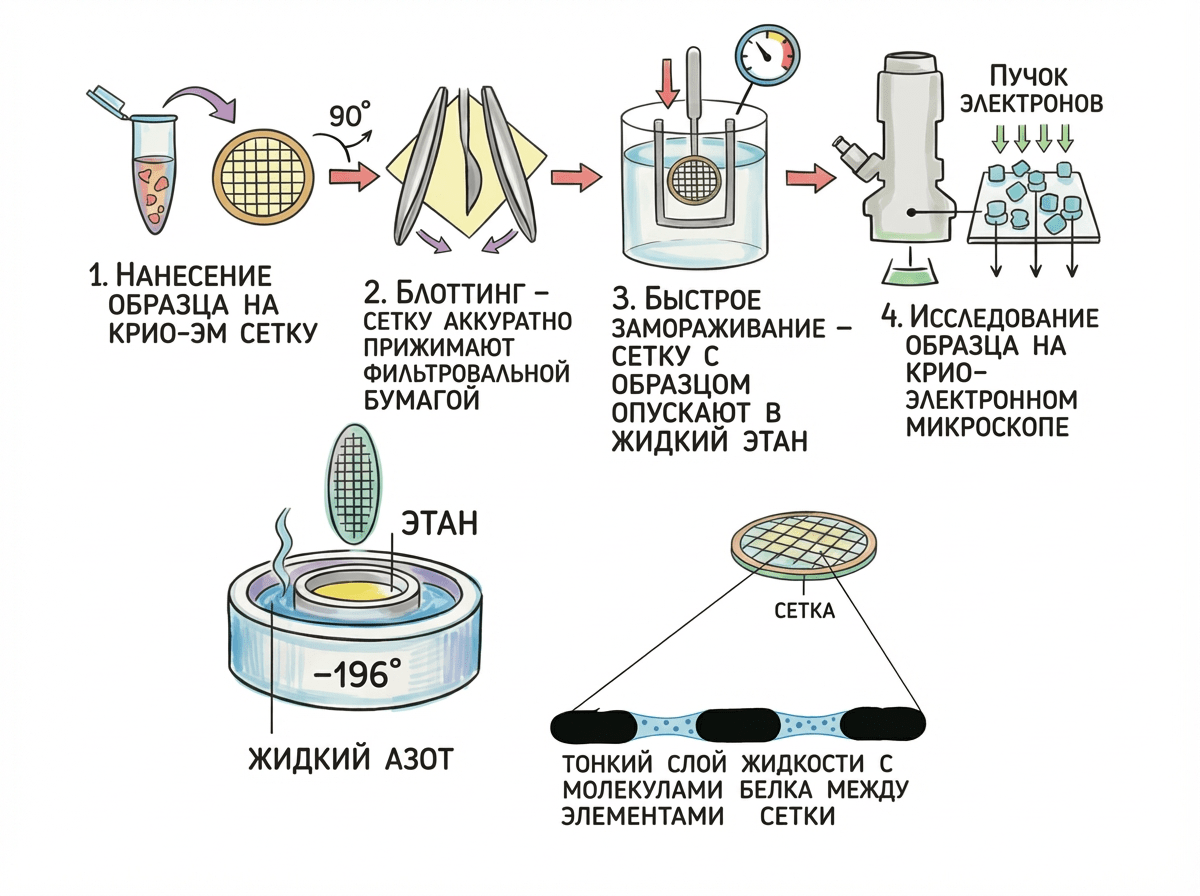
Рисунок 3. Подготовка образцов на Крио-ЭМ. Образец помещают на специальную металлическую сетку и промакивают фильтровальной бумагой. В результате в ячейках сетки остается тонкий слой жидкости с белком. Затем сетка быстро помещается в жидкий этан при температуре −196°C. Образец замораживается так стремительно, что вода в нём не успевает образовать кристаллы. Готовый образец помещается в криоэлектронный микроскоп для сбора данных.
Поздравляем! Образец готов. Его помещают в криоэлектронный микроскоп (стоящий сотни миллионов рублей), где он находится при криогенных температурах. Сквозь замороженный образец пропускаются пучки электронов, и молекулы белка оставляют миллионы маленьких «теней» на детекторе (рис. 3). Компьютеры обрабатывают эти данные, и из множества «теней» восстанавливается трехмерное изображение белка с разрешением всего в несколько ангстремов (Å) — это почти в миллион раз меньше толщины волоса! Поистине чудо науки [4].
Казалось бы, задача решена — мы разобрались, как получить «трехмерные фотографии» комплексов GPCR. Но здесь появляется главный вызов: нам нужно поймать рецептор в активном состоянии, одновременно в комплексе с лигандом и G-белком. Помните, что происходит при активации? GPCR активирует G-белок, и тот разваливается на две части. Комплекс существует считанные доли секунды [16] — ровно столько времени, сколько нужно для того, чтобы ГДФ покинул активный центр в α-субъединице G-белка, а ГТФ занял его место. Этот мимолетный момент нам и нужно зафиксировать.
Как остановить это мгновение? Как надежно привязать G-белок к рецептору? Учёные придумали несколько хитрых способов (рис. 4).
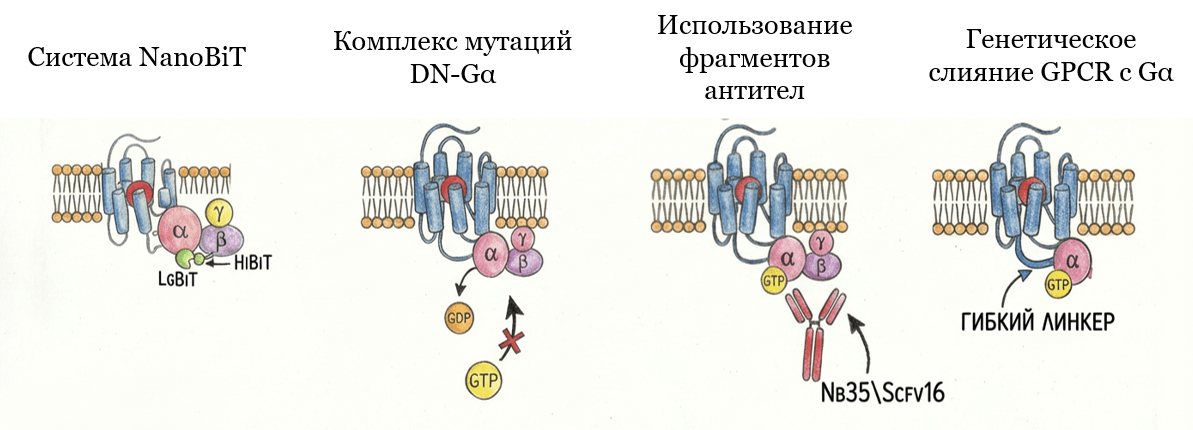
Рисунок 4. Методы стабилизации комплекса GPCR-G-белок: 1) система NanoBiT — стабилизация комплекса за счет системы разделенной люциферазы; 2) комплекс мутаций DN–Gαмутации, стабилизирующие G-белок в состоянии, свободном от нуклеотидов; 3) использование фрагментов антител для стабилизации G-белка; 4) генетическое слияние GPCR c Gα.Каждому из этих методов посвящена отдельная глава в нашей статье.
рисунок автора
Способ первый: NanoBiT
NanoBiT — это система разделенной люциферазы [17]. Люцифераза — фермент, обеспечивающий свечение некоторых живых организмов (к примеру, светлячков) [18]. Хитрость метода NanoBiT заключается в том, чтобы пришить составные части люциферазы к белкам, взаимодействие которых необходимо изучить. Допустим, это белки А и В. Пока А и В не встречаются — ничего не светит. Но как только они взаимодействуют, два фрагмента люциферазы соединяются, восстанавливая ее активность (рис. 5) [17]. Добавляем субстрат — и молекула начинает светиться! Свет — вот свидетельство взаимодействия наших белков А и В. Гениально, правда?
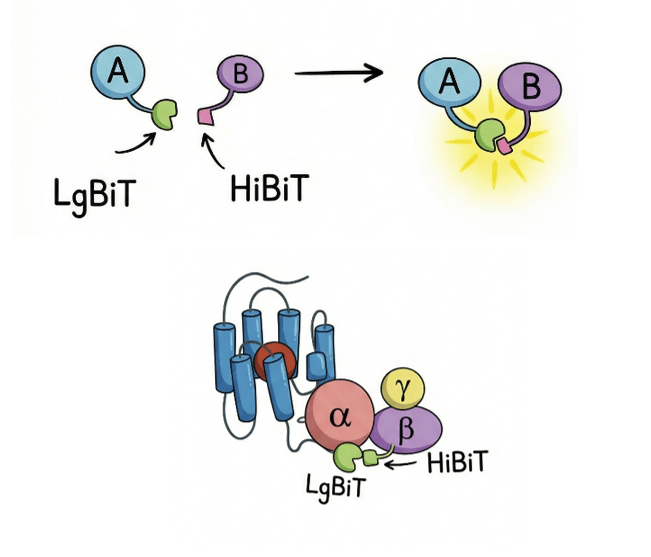
Рисунок 5. Система NanoBiT. На белок А навешивается большой фрагмент люциферазы — LgBiT; на белок B — маленький фрагмент люциферазы, HiBiT (или SmBiT). Взаимодействие А и В приводит к сборке функционального фермента и свечению комплекса. Система NanoBiT применяется для стабилизации комплексов GPCR–G-белок. В этом случае LgBiT навешивается на С-конец GPCR, а HiBiT — на С-конец Gβ-субъединицы.
Структурные биологи быстро поняли, что NanoBiT — это не только датчик, но и отличный способ физически удерживать два белка рядом друг с другом. И они стали применять эту систему для стабилизации GPCR–G-белковых комплексов.
Схема проста: на С-конец GPCR навешивается LgBiT — большой фрагмент люциферазы, а на С-конец Gβ-субъединицы прикрепляется SmBiT — маленький фрагмент (иногда его называют HiBiT) [19]. При взаимодействии GPCR и G-белка комплементарные фрагменты люциферазы соединяются, физически связывая комплекс воедино (рис. 5). Вуаля, сшитая конструкция готова к замораживанию и отправке на микроскоп!
Способ второй: Dominant Negative Gα
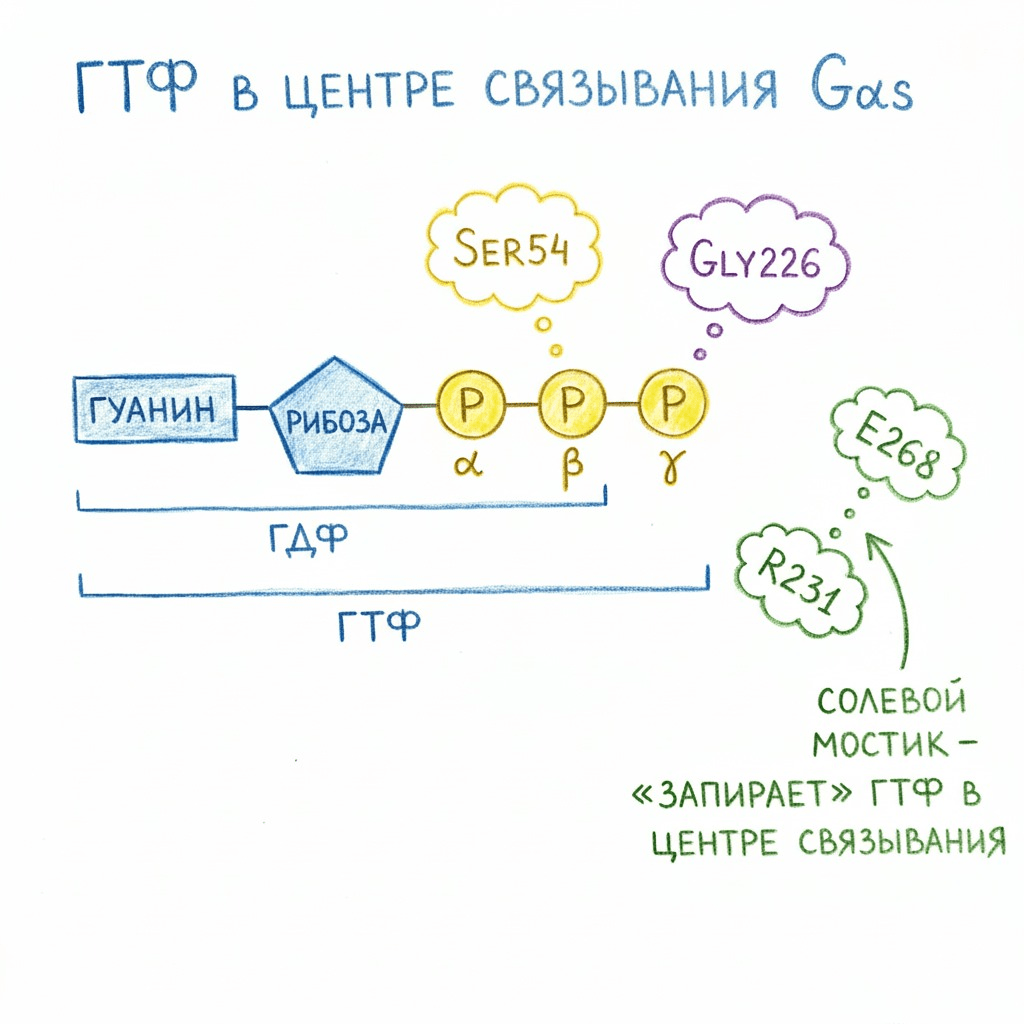
Рисунок 6. Ключевые аминокислоты в Gαs, обеспечивающие стабилизацию ГТФ и ГДФ в активном центре субъединицы. Подробнее см. рис. 8.
рисунок автора по [21–23].
Здесь стратегия несколько отличается от NanoBiT; если первый — физическая «скрепка», то метод, о котором пойдет речь сейчас, — это химическая ловушка. Dominant Negative Gα — это комплекс мутаций, при которых Gα-субъединица не может связывать ни ГДФ, ни ГТФ. В результате G-белок фиксируется в состоянии, свободном от нуклеотидов, и остается привязанным к рецептору [20].
Почему это работает? Во-первых, состояние без нуклеотидов обладает наибольшей аффинностью к рецептору [21] — тут G-белок плотнее всего держится за активированный GPCR. Во-вторых, если белок не может связать ГДФ, он не сможет активироваться и разваливаться. И мы получаем как раз то, что хотели — стабильный комплекс.
Рассмотрим три мутации, обеспечивающие нуклеотид-свободное состояние, на примере Gαs-субъединицы (рис. 6). Первая мутация — G226A. Глицин на позиции 226 взаимодействует с γ-фосфатом ГДФ, удерживая молекулу в центре связывания (рис. 7а). Кроме того, он служит «точкой вращения» при активации G-белка [22]. Если заменить глицин на аланин, то контактов с γ-фосфатом не будет, и вращение станет невозможно. Таким образом, мы получаем G-белок, который не способен активироваться и разваливаться.
Вторая мутация — E268A. Глутаминовая кислота на позиции 268 образует солевой мостик с аргинином на позиции 231. Эти две аминокислоты, взаимодействуя, образуют «закрытые ворота», которые удерживают ГДФ в центре связывания и не дают ей выйти (рис. 7а) [23]. Если нарушить взаимодействие этих двух аминокислот (заменив глутамат на аланин), то ГДФ не будет зафиксирован в активном центре (рис. 7б), сможет из него «уплыть» и не сможет активировать G-белок.
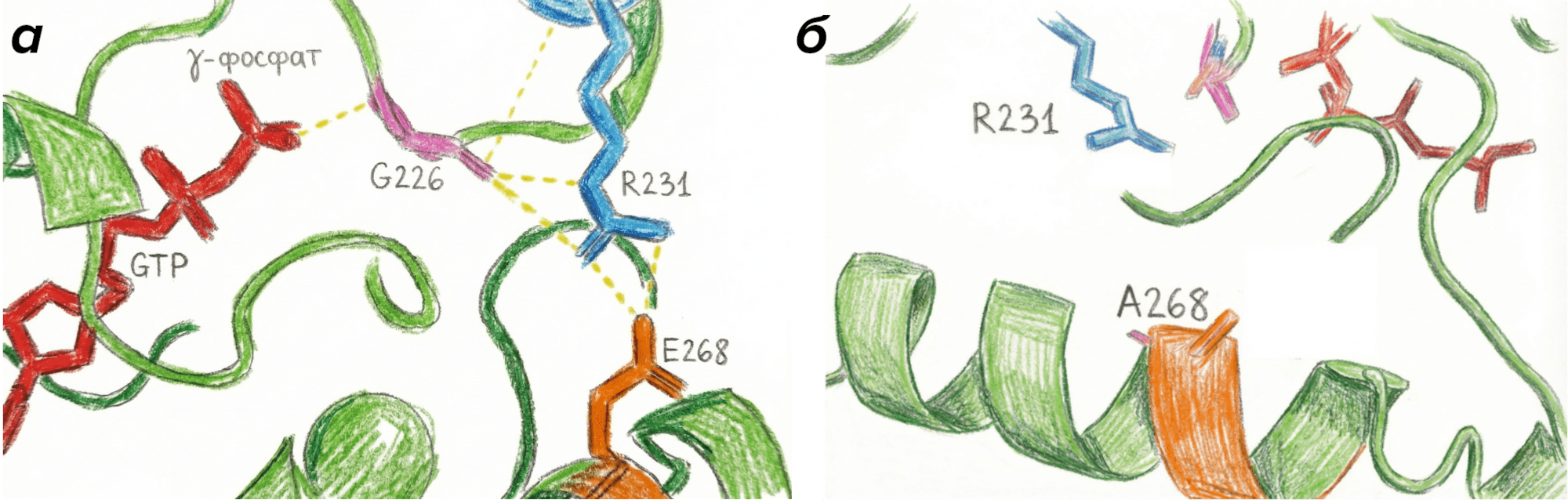
Рисунок 7. Молекулярные взаимодействия, лежащие в основе метода Dominant-negative Gα на примере Gαs-субъединицы. а — Взаимодействие γ-фосфата ГТФ с Gly226; солевой мостик между R231 и E268. Данные взаимодействия необходимы для стабилизации ГТФ в активном центре Gαs-субъединицы; б — Отсутствие взаимодействия аминокислот R231 и E268 при мутации E268A — разрушение солевого мостика, дестабилизация ГТФ в активном центре.
рисунок автора на основе структуры Gαs-субьединицы
Третья мутация — S54N. Серин на позиции 54 взаимодействует с β-фосфатом ГДФ (рис. 6), а значит, участвует в связывании как ГДФ, так и ГТФ [22]. Если убрать это взаимодействие (заменив серин на аспарагин), G-белок не сможет связывать оба нуклеотида. Этой мутацией достигается состояние, свободное от нуклеотидов — как ГДФ, так и ГТФ.
Таким образом, мы разобрали 3 мутации, которые фиксируют Gαs-субъединицу в состоянии, свободном от нуклеотидов. Теперь она не может связать ни ГДФ, ни ГТФ, а значит — крепко держится за наш рецептор! Комплекс стабилизирован, как мы и хотели.
Способ третий: фрагменты антител
Этот метод основан на использовании вариабельной части антител (рис. 8). Каждый вариабельный фрагмент специфично распознает определенные участки на белке, с которым взаимодействует. Такие участки называются эпитопами. В случае GPCR–G-комплексов эпитопы находятся на поверхности, охватывающей кусок Gα и часть Gβ. Поэтому фрагменты антител скрепляют эти две субъединицы, не позволяя им разойтись.
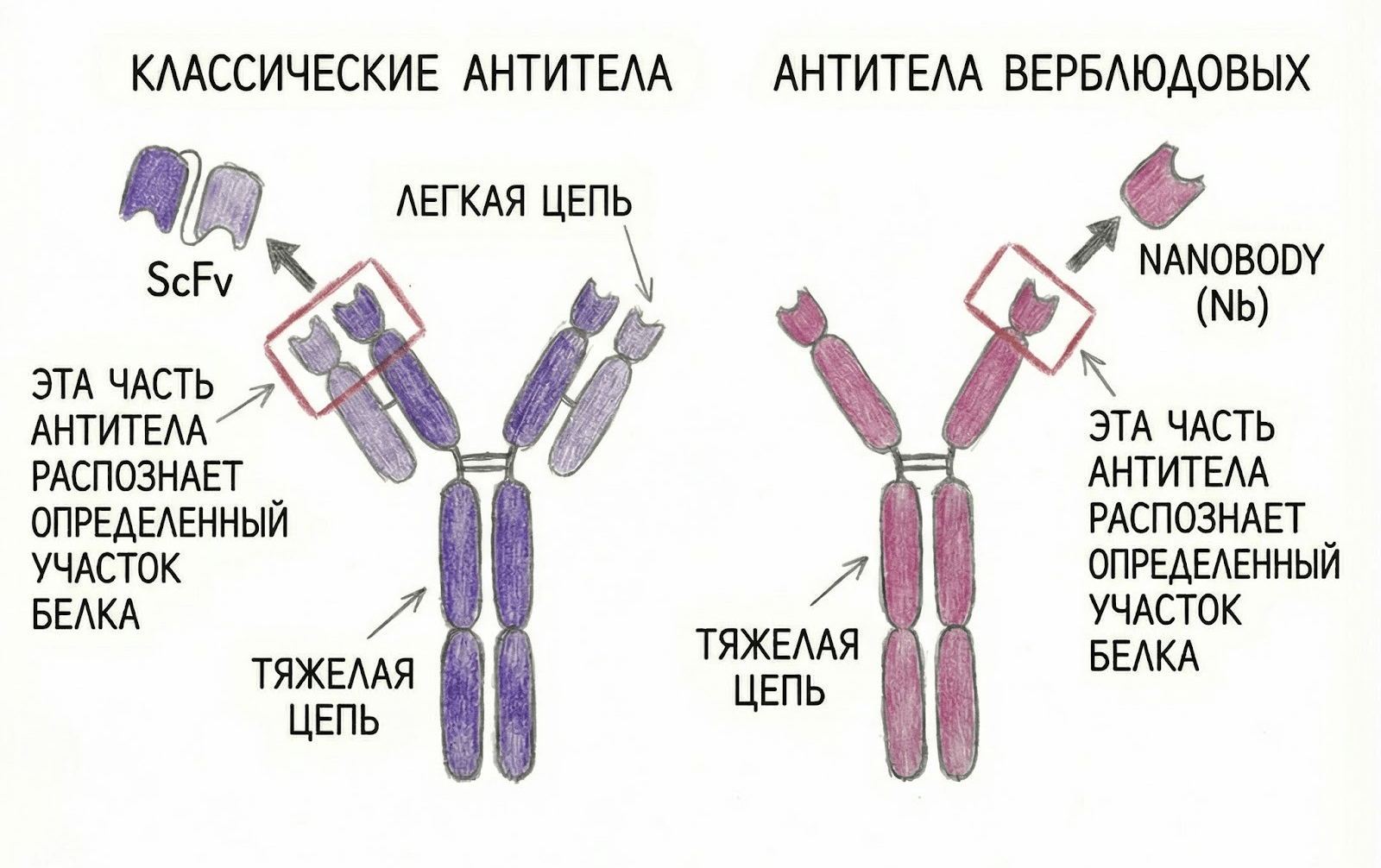
Рисунок 8. Вариабельные фрагменты антител. Помимо структурной биологии, антитела широко применяются в современной медицине и биотехнологии. Подробнее об этом можно почитать в спецпроекте «Биомолекулы» «Терапевтические антитела» (читайте: «Краткая история открытия и применения антител» [24]).
рисунок автора по [25]
Самые известные в области стабилизации GPCR–G-белковых комплексов — Nanobody 35 (Nb35), фрагмент верблюдовых антител; и Single chain variable fragment 16 (scFv16), фрагмент классических антител (рис. 9). Стоит отметить, что антитела в целом широко применяются в структурной биологии для стабилизации белков. Структуры GPCR часто содержат фрагменты антител — эту закономерность легко обнаружить, заглянув на сайт PDB.
Nb35 разработан для Gs-белков, а scFv16 — для Gi-белков. Интересно, что scFv16 узнает короткий участок N-конца Giα-субъединицы. Значит, этот короткий участок можно пришить вместо N-конца любого G-белка, и scFv16 будет работать и на нем!
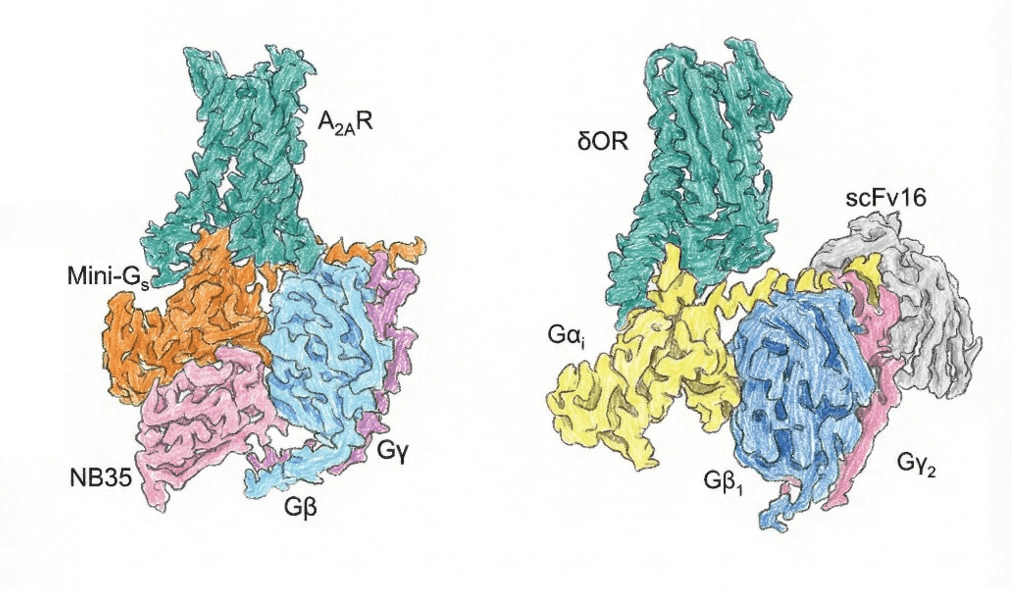
Рисунок 9. Структуры комплексов GPCR–G-белок, полученные с использованием Nb35 и Scfv16. Слева: Аденозиновый рецептор A2A в комплексе с усечённым Gs-белком (mini-Gs), β- и γ-субъединицами, стабилизированный фрагментом антитела Nb35. Справа: δ-опиоидный рецептор δOR в комплексе с Gi-белком, β- и γ-субъединицами, стабилизированный фрагментом антитела ScFv16.
Есть удивительное исследование, в котором ученым удалось использовать два этих антитела одновременно. Таким способом была получена структура mTAAR9 (мышиный рецептор, ассоциированный со следовыми аминами [28], представитель класса GPCR) в комплексе с G-белком и лигандом [29] (рис.10). Это исследование наглядно показывает, что Nb35 И ScFv16 распознают разные участки в G-белке, не мешают друг другу, и их можно использовать совместно для дополнительной стабилизации.
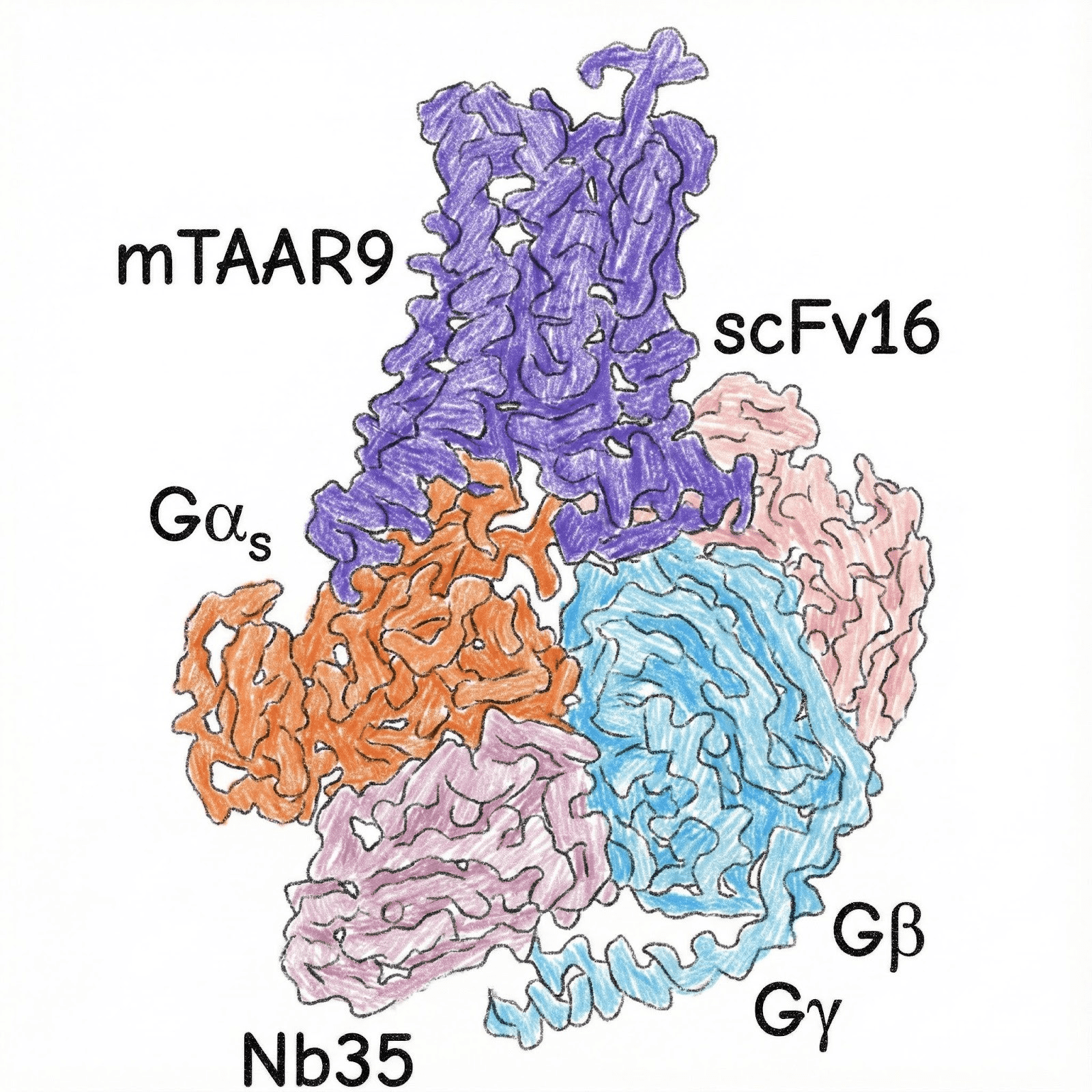
Рисунок 10. Структура комплекса mTAAR9-G-белок с использованием Nb35 и Scfv16 одновременно. TAAR — уникальное семейство рецепторов, связывающих следовые амины [28]. Изначально считалось, что TAAR экспрессируются в обонятельном эпителии, однако вскоре ученые обнаружили их экспрессию практически по всему телу, в частности, в головном мозге. Сейчас эти рецепторы являются перспективными мишенями для терапии психических и нейродегенеративных заболеваний.
Способ четвёртый: генетическое слияние Gα-субъединицы
Ещё один подход — прямое генетическое слияние Gα-субъединицы с рецептором через гибкий линкер. За счет искусственного слияния нуклеотидных последовательностей эти два белка экспрессируются как единая полипептидная цепь. Метод позволяет физически связать две молекулы в одну, предотвращая их разделение. Подход оказался эффективным для решения структур некоторых рецепторов. Например, в исследовании рецептора уротензина II Gαq была пришита к C-концу этого GPCR (рис. 11), что позволило получить высокоразрешенную структуру комплекса [30].
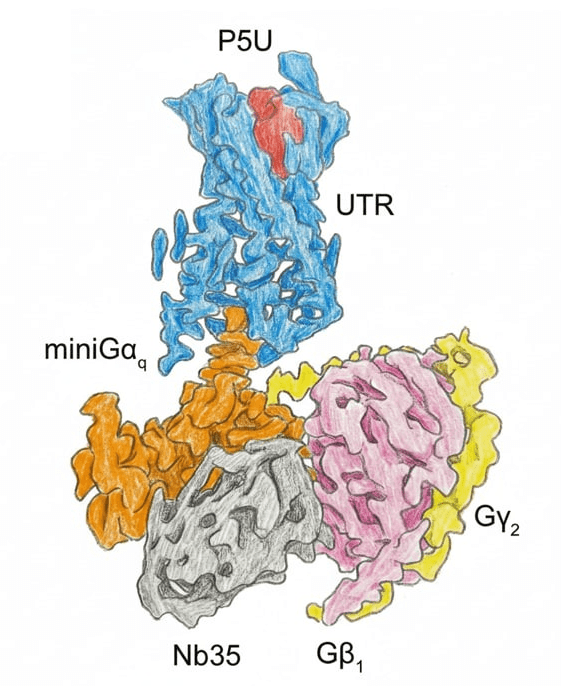
Рисунок 11. Структура рецептора уротензина II в комплексе с G-белком , полученная с помощью генетического слияния Gαq c GPCR. Рецептор уротензина II активируется пептидным гормоном уротензином II, который участвует в регуляции сосудистого тонуса, артериального давления и функции сердца. Данный рецептор является привлекательной мишенью для разработки сердечнососудистых препаратов.
Заключение
Вот так GPCR в комплексе со своим партнером — G-белком — предстают перед нами во всей своей атомной красе благодаря изысканным биохимическим техникам и потрясающей мощности современной электронной микроскопии. Мы видим то, что было главной целью: атомарное разрешение взаимодействия между рецептором, его лигандом и G-белком.
GPCR безусловно прекрасны и удивительны сами по себе, но зачем столько усилий и ухищрений? Напомним, что эти белки вовлечены в развитие многих заболеваний, а это значит, что лиганды, специфичные к этим рецепторам, могут служить терапевтическими средствами. Кроме того, лиганд-связывающие участки GPCR удобно располагаются на поверхности клеток, поэтому нет необходимости решать проблему доставки лекарства через клеточную мембрану. Именно структурная биология позволяет с высокой точностью определить расположение каждой аминокислоты в белке, что в свою очередь определяет форму и заряд лиганд-связывающих областей. Это дает фармакологам возможность проводить рациональный дизайн лекарств in silico — виртуально, на компьютере [31], [32]. Зная структуру рецептора, можно подобрать молекулу лиганда так же точно, как ключ подбирается к замку, минимизируя тем самым побочные эффекты и повышая специфичность действия [4].
Литература
- Rehman S., Rahimi N., Dimri M. Biochemistry, G Protein Coupled Receptors. StatPearls Publishing, 2023;
- Зрительный родопсин — рецептор, реагирующий на свет;
- Javier Sánchez Lorente, Aleksandr V. Sokolov, Gavin Ferguson, Helgi B. Schiöth, Alexander S. Hauser, David E. Gloriam. (2025). GPCR drug discovery: new agents, targets and indications. Nat Rev Drug Discov. 24, 458-479;
- P. A. Khorn, A. P. Luginina, V. A. Pospelov, D. E. Dashevskii, A. N. Khnykin, et. al. (2024). Rational drug design targeting g-protein-coupled receptors: a structural biology perspective. Biohimiâ. 89, 705-725;
- 12 методов в картинках: структурная биология;
- K. Palczewski. (2000). Crystal Structure of Rhodopsin: A G Protein-Coupled Receptor. Science. 289, 739-745;
- Рецепторы в активной форме;
- Новый рубеж: получена пространственная структура β2-адренорецептора;
- Нобелевская премия по химии (2012): за рецепторы наших первого, третьего и четвертого чувств;
- Лаборатория перспективных исследований мембранных белков: от гена к ангстрему;
- Александра Лугинина: «Наука — тоже отчасти искусство!»;
- Липидный фундамент жизни;
- Meng Zhang, Miao Gui, Zi-Fu Wang, Christoph Gorgulla, James J. Yu, et. al. (2021). Cryo-EM structure of an activated GPCR–G protein complex in lipid nanodiscs. Nat Struct Mol Biol. 28, 258-267;
- Крупные подробности микроскопического мира: Нобелевская премия по химии 2017;
- Max E. Wilkinson, Pei-Chun Lin, Clemens Plaschka, Kiyoshi Nagai. (2018). Cryo-EM Studies of Pre-mRNA Splicing: From Sample Preparation to Model Visualization. Annu. Rev. Biophys. 47, 175-199;
- Suchetana Mukhopadhyay, Elliott M. Ross. (1999). Rapid GTP binding and hydrolysis by G q promoted by receptor and GTPase-activating proteins. Proc. Natl. Acad. Sci. U.S.A. 96, 9539-9544;
- Andrew S. Dixon, Marie K. Schwinn, Mary P. Hall, Kris Zimmerman, Paul Otto, et. al. (2016). NanoLuc Complementation Reporter Optimized for Accurate Measurement of Protein Interactions in Cells. ACS Chem. Biol. 11, 400-408;
- Биолюминесценция: возрождение;
- Jia Duan, Dan-dan Shen, X. Edward Zhou, Peng Bi, Qiu-feng Liu, et. al. (2020). Cryo-EM structure of an activated VIP1 receptor-G protein complex revealed by a NanoBiT tethering strategy. Nat Commun. 11;
- Yi-Lynn Liang, Peishen Zhao, Christopher Draper-Joyce, Jo-Anne Baltos, Alisa Glukhova, et. al. (2018). Dominant Negative G Proteins Enhance Formation and Purification of Agonist-GPCR-G Protein Complexes for Structure Determination. ACS Pharmacol. Transl. Sci. 1, 12-20;
- Tilman Flock, Charles N. J. Ravarani, Dawei Sun, A. J. Venkatakrishnan, Melis Kayikci, et. al. (2015). Universal allosteric mechanism for Gα activation by GPCRs. Nature. 524, 173-179;
- E Lee, R Taussig, A G Gilman. (1992). The G226A mutant of Gs alpha highlights the requirement for dissociation of G protein subunits.. Journal of Biological Chemistry. 267, 1212-1218;
- Taroh Iiri, Zvi Farfel, Henry R. Bourne. (1997). Conditional activation defect of a human G sα mutant. Proc. Natl. Acad. Sci. U.S.A. 94, 5656-5661;
- Краткая история открытия и применения антител;
- Rebecca C. Abbott, Ryan S. Cross, Misty R. Jenkins. (2020). Finding the Keys to the CAR: Identifying Novel Target Antigens for T Cell Redirection Immunotherapies. IJMS. 21, 515;
- Maxine Bi, Xudong Wang, Jinan Wang, Jun Xu, Wenkai Sun, et. al. (2025). Structure and function of a near fully-activated intermediate GPCR-Gαβγ complex. Nat Commun. 16;
- Lin Cheng, Zhuang Miao, Sicen Liu, Zhe Li, Hong Fu, et. al. (2024). Cryo-EM structure of small-molecule agonist bound delta opioid receptor-Gi complex enables discovery of biased compound. Nat Commun. 15;
- Рецепторы следовых аминов (TAAR): невидимые дирижеры нашего мозга;
- Lulu Guo, Jie Cheng, Shuo Lian, Qun Liu, Yan Lu, et. al. (2023). Structural basis of amine odorant perception by a mammal olfactory receptor. Nature. 618, 193-200;
- Tianyu Gao, Chongzhao You, Yinglong Cao, Xiaofang Xu, Qingning Yuan, et. al. (2025). Structural insights into hormone recognition and G-protein coupling of the urotensin-II receptor. Journal of Biological Chemistry. 301, 110794;
- Драг-дизайн: как в современном мире создаются новые лекарства;
- Виртуальные тропы реальных лекарств.