
Откуда у людей половые клетки берутся?
02 декабря 2024
Откуда у людей половые клетки берутся?
- 877
- 0
- 3
Происхождение первых клеток зародышевой линии в эмбрионах человека во многом покрыто мраком тайны. Но у ученых есть способ буквально отмотать время назад и посмотреть, что происходило на ранних этапах эмбриогенеза. Помогает в этом изучение мутаций.
иллюстрация Анастасии Самоукиной
-
Автор
-
Редакторы
-
Рецензент
-
Иллюстратор
Каждый человек когда-то был одноклеточным существом, образовавшимся при слиянии материнского ооцита и отцовского сперматозоида. Но в таком состоянии мы находились недолго: очень скоро самая первая клетка делится на две, а их многочисленное потомство впоследствии образует сложный многоклеточный организм. Впрочем, не все «праправнучки» зиготы становятся «кирпичиками» в составе нашего тела. Еще на самых ранних этапах развития эмбриона обособляется привилегированная группа клеток зародышевой линии. Они дают начало половым клеткам и передаются из поколения в поколение — это условно бессмертная часть человека. Но откуда берутся клетки зародышевой линии, на каком этапе эмбриогенеза появляются, и как происходящие при этом процессы могут сказываться на генотипе, здоровье потомства? Этим вопросам было посвящено недавнее исследование американских ученых из Клиники Мэйо и Йельского университета под руководством профессоров Алексея Абызова и Флоры Ваккарино, вышедшее в журнале Nature Communications. Исследователям удалось отследить «родословную» соматических клеток людей вплоть до первых бластомеров родителей и сделать интересные выводы.
Профессор Алексей Абызов, заведующий лабораторией при клинике Мэйо (рис. 1), — частый гость на страницах «Биомолекулы». Его команда периодически делает интересные открытия и делится с нами результатами. Так, в апреле 2021 года мы рассказывали [1], как исследователи под руководством Алексея совершили путешествие во времени и определили, какой вклад вносит потомство каждого из двух бластомеров (первых двух клеток, образующихся после деления оплодотворенной яйцеклетки) в формирование тканей человека. Для этого ученые отслеживали мутации, происходившие в клетках с самых ранних этапов эмбриогенеза.
Сейчас хорошо установлено, что почти каждая новая клетка в организме человека при рождении получает новую мутацию, которая является ее «родинкой». При этом «родинки» передаются клеткам-потомкам. Таким образом, с одной стороны, в организме каждого человека астрономическое число мутаций, и тем не менее мы живем и функционируем достаточно долго. С другой стороны, все эти мутации — громадный архив записей о развитии каждого человека. Пока мы имеем техническую возможность воспользоваться только маленькой его частью.

Рисунок 1. Алексей Абызов (слева) — один из руководителей исследования — выпускник МФТИ; д. ф.-м. н.; с 2014 года руководит научной лабораторией в Клинике Мэйо; ассоциированный профессор в медицинском колледже при этой клинике; приглашенный профессор в Университете Миннесоты и Йельском университете. Справа: лаборатория Алексея в клинике Мэйо.
фото предоставлены лабораторией Абызова
Оказалось, что обычно уже после первого деления всем потомкам одного из бластомеров уготована судьба доминантной линии, которая будет представлена в организме в большинстве, а от второго происходит малочисленная рецессивная линия (рис. 2) [2], [3]. Подобные результаты позже получили и другие команды исследователей, и они также пришли к выводу о том, что деления клеток эмбриона на ранних стадиях развития асимметричны [4].
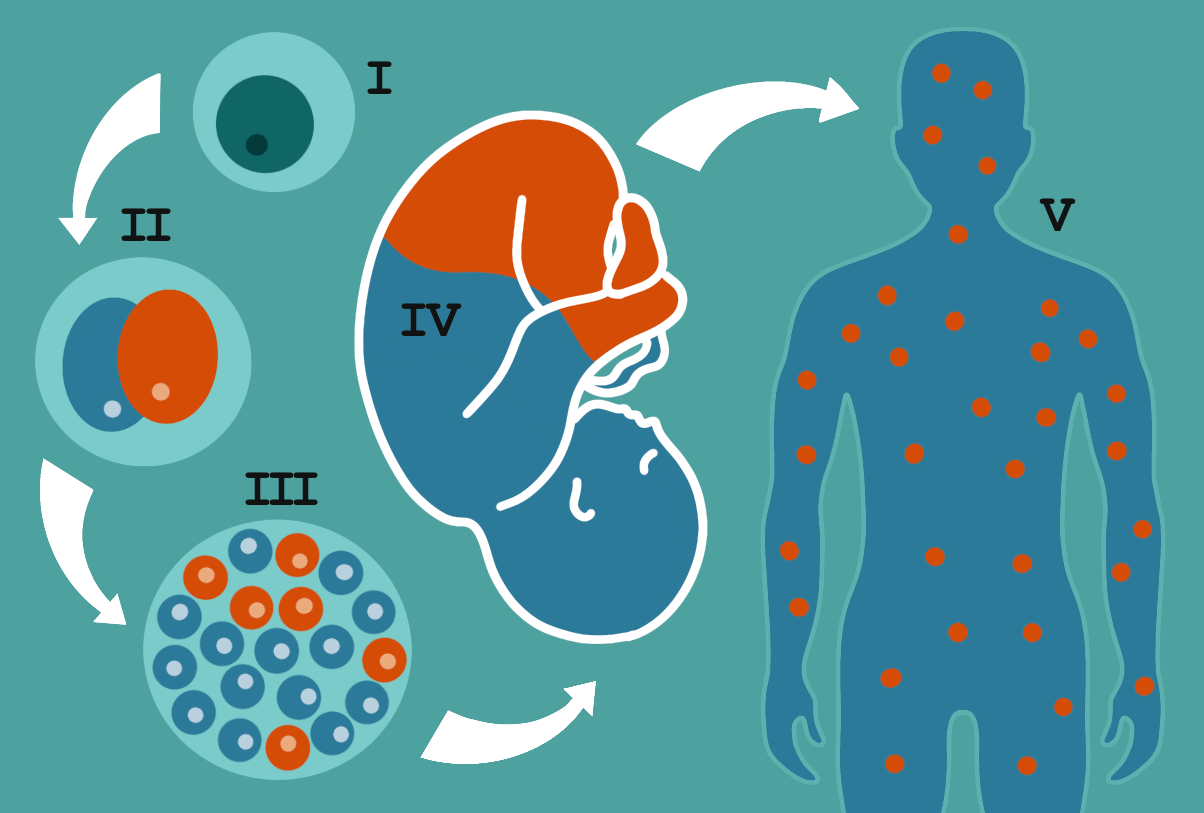
Рисунок 2. Коротко о результатах предыдущего исследования ученых из клиники Мэйо и Йельского университета. Оплодотворенная яйцеклетка (I) на вторые сутки делится на две первые дочерние клетки — бластомеры (II). Один из них становится доминантным, и его потомки затем представлены в большинстве (III), а второй — рецессивным. В дальнейшем организм человека похож на мозаику (IV, V) из доминантной и рецессивной клеточных линий. Например, среди клеток в крови их соотношение может составлять 9:1, а в моче — 8:2–7:3. Впервые о такой «лоскутной» структуре мы писали в публикации «Геномная головоломка: открой в себе мозаика» [5].
иллюстрация Анастасии Самоукиной по [2]
Открытие крайне интересное, но было бы странно, если бы на нем полет исследовательской мысли остановился. Полюбовавшись на элоев и морлоков клеточного мира, ученые поменяли настройки своей «машины времени» и отправились в еще более далекое прошлое — когда первые бластомеры родителей еще только готовились дать начало клеткам зародышевой линии, которые, в свою очередь, потом дали начало всем клеткам организма потомков. Были проанализированы гены детей и мужа одной из участниц предыдущего исследования, а также данные полногеномного секвенирования членов семей с двумя детьми из коллекции Simons Simplex. В итоге удалось понять, от какого из первых бластомеров происходят половые клетки и как события на ранних стадиях эмбриогенеза влияют на генотип потомства [6].
Наследственные, соматические и другие виды мутаций
В статье «Сотни мутаций в мозге, «гены аутизма» и ранняя диагностика болезней: ученые поделились новыми данными» (к слову, это тоже обзор исследования команды Абызова) [7] мы рассказывали, что такое наследственные, соматические, ранние и поздние постзиготные мутации. Коротко напомним:
-
Наследственные мутации есть у родителей, передаются потомкам и присутствуют во всех клетках организма.
-
Соматические мутации возникают во время внутриутробного развития или при жизни, присутствуют только в части клеток организма и не передаются потомству.
-
Ранние постзиготные — возникают на самых ранних этапах эмбриогенеза, начиная с первого деления яйцеклетки. Могут присутствовать в большинстве клеток организма.
-
Поздние постзиготные — возникают на поздних этапах внутриутробного развития.
В связи с новым обзором пришло время ввести еще один термин — «мутации, возникшие de novo». Это изменения в генах, которых нет у родителей, но они есть у детей. К мутациям de novo относят те, что происходят в клетках зародышевой линии родителей (для родителей они являются соматическими, а для потомства становятся наследственными), а также постзиготные (рис. 3) [6], [8].
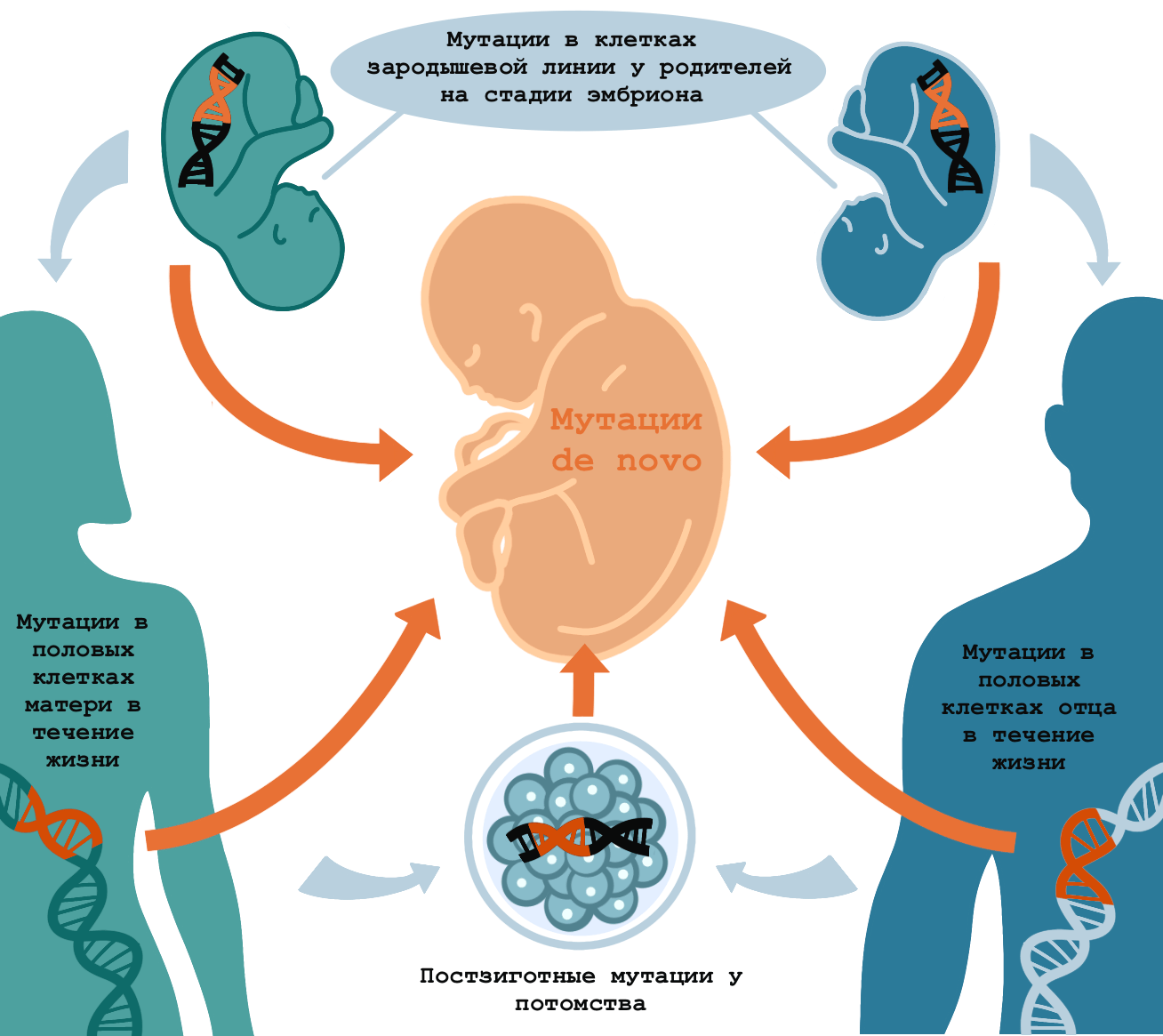
Рисунок 3. Когда могут происходить мутации de novo. Изменения в клетках зародышевой линии у отца и матери еще на стадии эмбрионов, в половых клетках родителей в течение жизни и в клетках эмбрионов потомства, — все такие мутации будут отсутствовать у родителей и присутствовать в клетках тела ребенка. Со следующего поколения они уже будут считаться наследственными.
иллюстрация Анастасии Самоукиной по [9]
Мутации de novo — палка о двух концах. С одной стороны, благодаря им дети отличаются от родителей — это важный механизм изменчивости и двигатель эволюции. Если новый вариант гена оказывается полезным или по крайней мере нейтральным, он имеет все шансы закрепиться в популяции.
Но у докинзовского слепого часовщика нет цели совершенствовать людей и других живых существ. Случайные изменения могут затронуть важные гены, и это грозит врожденными заболеваниями. Довольно распространенный пример генетических нарушений, возникающих de novo, — трисомия 21-й хромосомы, более известная как синдром Дауна. В целом практически все заболевания, связанные с анеуплоидиями, — результат хромосомных нарушений, возникших de novo [8–10].
В последние годы стало известно, что мутации de novo являются причиной нарушения развития нервной системы и таких заболеваний как шизофрения, умственная отсталость, аутизм. Также эти мутации ответственны за такие редкие генетические заболевания как синдромы Кабуки, Шинцеля — Гидиона, Беринга — Опица, Барайтцера — Винтера, Коффина — Сириса [10].
Главный вывод из большинства исследований, проведенных на эту тему: мутации de novo в организме отдельно взятого человека — сложная совокупность генетических изменений, которые возникают в результате различных биологических процессов, а их эффекты проявляются в развитии и дальнейшей жизни. Мутации de novo бывают полезными, нейтральными и вредоносными, некоторые приводят к тяжелым заболеваниям [9].
Тема с мутациями, возникающими de novo, интересна сама по себе. Но в данном случае это лишь предыстория к главной теме этой статьи.
Охота за первыми зародышевыми клетками
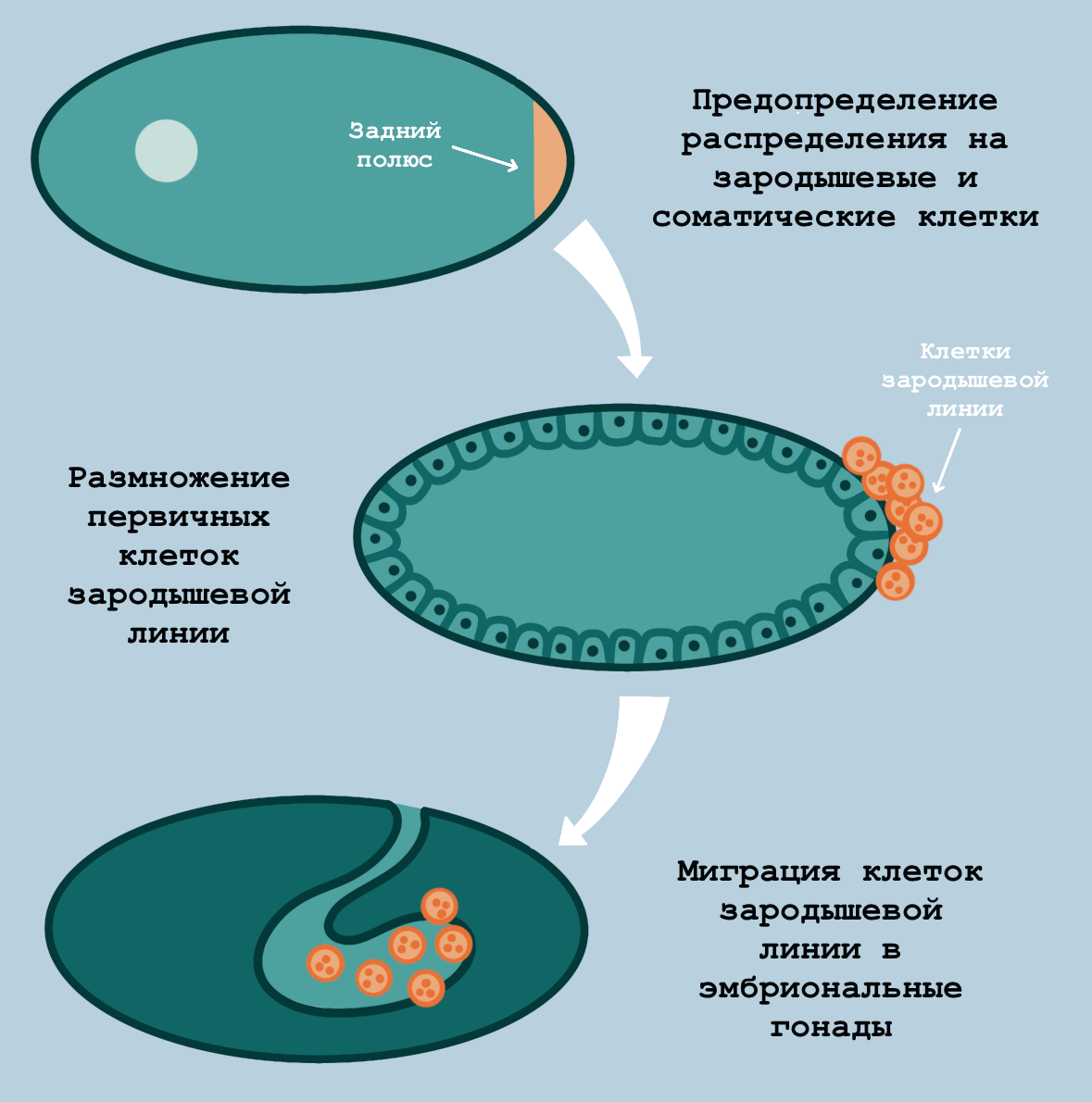
Рисунок 5. Образование первичных зародышевых клеток в зародыше дрозофилы. В ооците уже заранее «размечен» участок цитоплазмы, который достанется клеткам зародышевой линии (на рисунке он находится у заднего полюса клетки и обозначен гранулами красного цвета) — это так называемая зародышевая плазма.
иллюстрация Анастасии Самоукиной по [20]
Авторы нового исследования [6] решили проанализировать мутации, чтобы разобраться, откуда берутся первые клетки зародышевой линии и являются ли они поликлональными или моноклональными, то есть происходят ли от одной клетки-предшественницы или от нескольких разных. Согласно современным данным, первичные зародышевые клетки в эмбрионе человека можно обнаружить со второй недели с момента оплодотворения, на стадии гаструлы [6]. Откуда они берутся изначально, и где находятся их предшественники, пока еще не до конца понятно.
Клетки зародышевой линии появляются в эмбрионах животных по-разному. Например, у мух дрозофил [15], рыбок данио-рерио [16] и некоторых других модельных организмов (кстати, у нас на сайте есть целый посвященный им спецпроект) наблюдается так называемая преформация. Оплодотворенный ооцит назначает своих прямых наследников еще до того, как начинает делиться. Некоторые клетки получают «билет» в следующие поколения в виде определенных молекул РНК и белков и становятся зародышевыми (рис. 5) [17–19].
У человека и других млекопитающих все происходит немного сложнее. Сначала все клетки эмбриона являются плюрипотентными — они умеют превращаться в любой тип клеток, кроме плаценты и желточного мешка. Затем в результате инициации некоторые из них становятся зародышевыми. Это происходит на стадии бластоцисты (на 7–8 день после оплодотворения), когда зародыш состоит из эпибласта, гипобласта и трофобласта [17], [21], [22].
О том, на что способны плюрипотентные клетки, и какие еще «универсальные» клетки есть у человека, можно почитать в материалах «Ствол и ветки: стволовые клетки» [23], «Не можешь излечить — восстанови! Как появилась регенеративная медицина и какие у нее возможности сегодня» [24] и «Такие разные стволовые клетки» [25].
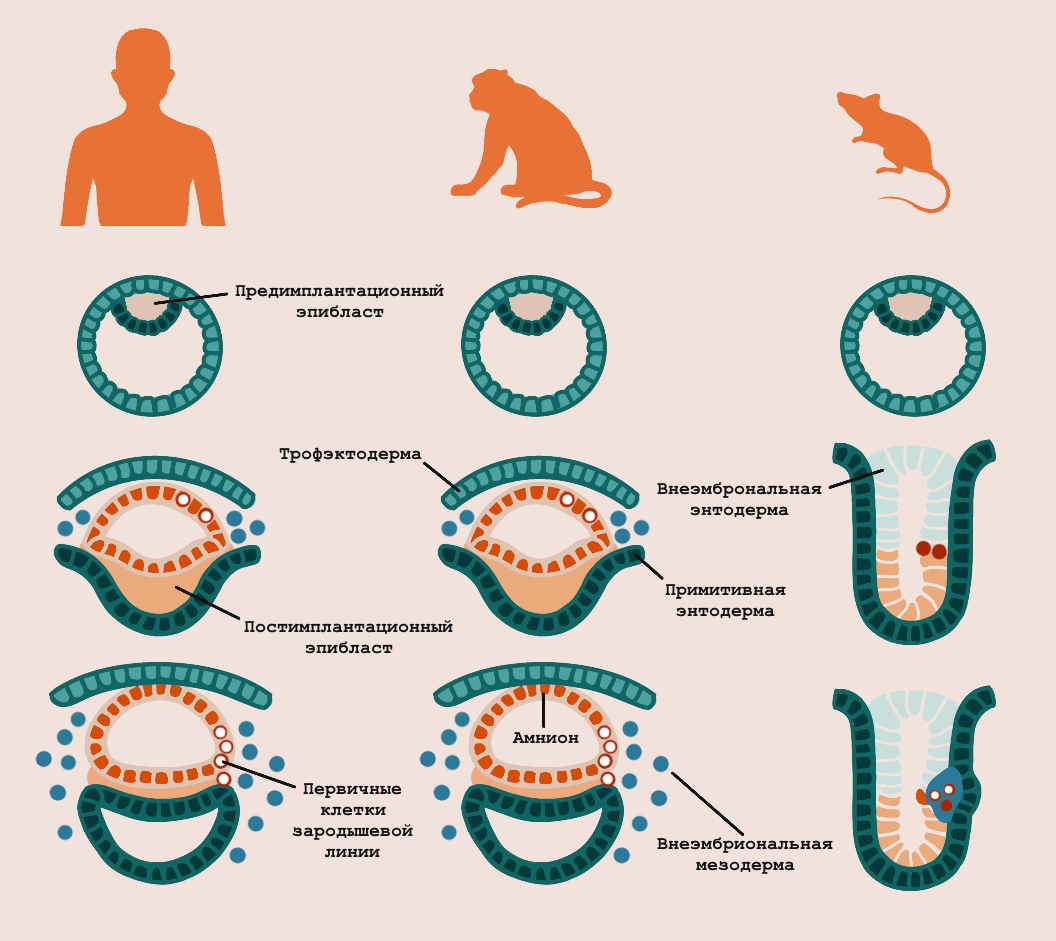
Рисунок 6. Откуда в эмбрионах млекопитающих берутся первичные клетки зародышевых линий. Люди, яванские макаки и мыши.
иллюстрация Анастасии Самоукиной по [17]
Известно, что у разных животных первичные клетки зародышевой линии появляются в различных местах. Например, у мышей и свиней их источником служит структура, которая называется задним проксимальным эпибластом. У яванских макак эти клетки изначально появляются в зародышевой оболочке — амнионе. Где зародышевые клетки возникают у эмбрионов людей — пока предмет дискуссий (рис 6). Возможно, таких мест сразу несколько [17], [26].
Ученые из клиники Мэйо и Йельского университета решили копнуть еще глубже и проследить «родословную» первичных клеток зародышевой линии до первых бластомеров. А помогла им в этом методика, которую они разработали в ходе предыдущих исследований.
Секреты бластомера №1, бластомера №2 и их потомства
Чтобы разобраться в происхождении клеток зародышевой линии, проще всего было бы изучить эмбрионы на разных стадиях развития. Но с такими исследованиями все сложно из-за этических вопросов. Животные модели не очень подходят из-за различий между видами. К тому же, когда в эмбрионе появляются первые клетки зародышевой линии, он пока еще настолько мал, что исследовать его весьма затруднительно.
На момент начала исследования у команды Алексея Абызова уже был готов инструмент для изучения «родословных» клеток в организме человека. Идея этого подхода довольно проста: чем чаще определенная мутация встречается в клетках тела, тем на более ранней стадии развития организма она возникла. Таким образом, мутации можно использовать как маркеры для отслеживания происхождения клеток, в том числе зародышевых. А все клетки тела ребенка — это наследницы половых клеток родителей. Таким образом, можно изучить постзиготные мутации у родителей, а потом проверить, как они передались детям. Это и поможет понять, откуда у родителей, пока они еще сами были эмбрионами, появились первичные клетки зародышевой линии [4].
Как мы отметили выше, во время предыдущего исследования ученые провели у нескольких людей генетическое тестирование соматических клеток, чтобы проследить их происхождение до первых бластомеров. Одной из участниц была женщина, которую обозначили как NC0. В новом исследовании провели генетические анализы у ее мужа и двоих детей (их обозначили как NC0-1 и NC0-2) [2], [3].
Было обнаружено, что ребенок NC0-1 получил от матери две мутации, возникшие у нее как ранние постзиготические, а ребенок NC0-2 — семь таких мутаций. Все эти мутации присутствовали в 100% клеток крови детей. Причем эти мутации происходили из разных материнских бластомеров: 2 — из доминантного, а 7 — из рецессивного. То есть в образовании клеток зародышевой линии матери поучаствовали обе самые первые клетки, из которых когда-то развился ее эмбрион. Ее зародышевая линия поликлональна.
Эти соображения подтверждаются расчетами. Всего у матери было обнаружено 5 ранних постзиготных мутаций в доминантной линии и 12 — в рецессивной. В диплоидных клетках эти мутации разбросаны по отдельным копиям в парах гомологичных хромосом. В гаплоидную половую клетку случайным образом попадает около половины мутаций, потому что она получает только половину набора хромосом. И они передаются детям. Таким образом, ребенок получает только половину ранних постзиготных мутаций только из доминантной или только из рецессивной линии. Так и вышло в данном случае: NC0-1 получил 2 мутации из 5, а NC0-2 — 7 из 12 (рис. 7).
Далее ученые решили проверить, выявит ли эти генетические изменения секвенирование трио. В зависимости от строгости фильтрации, анализ выявлял у детей только от 1 до 4 из 9 материнских ранних постзиготических мутаций.
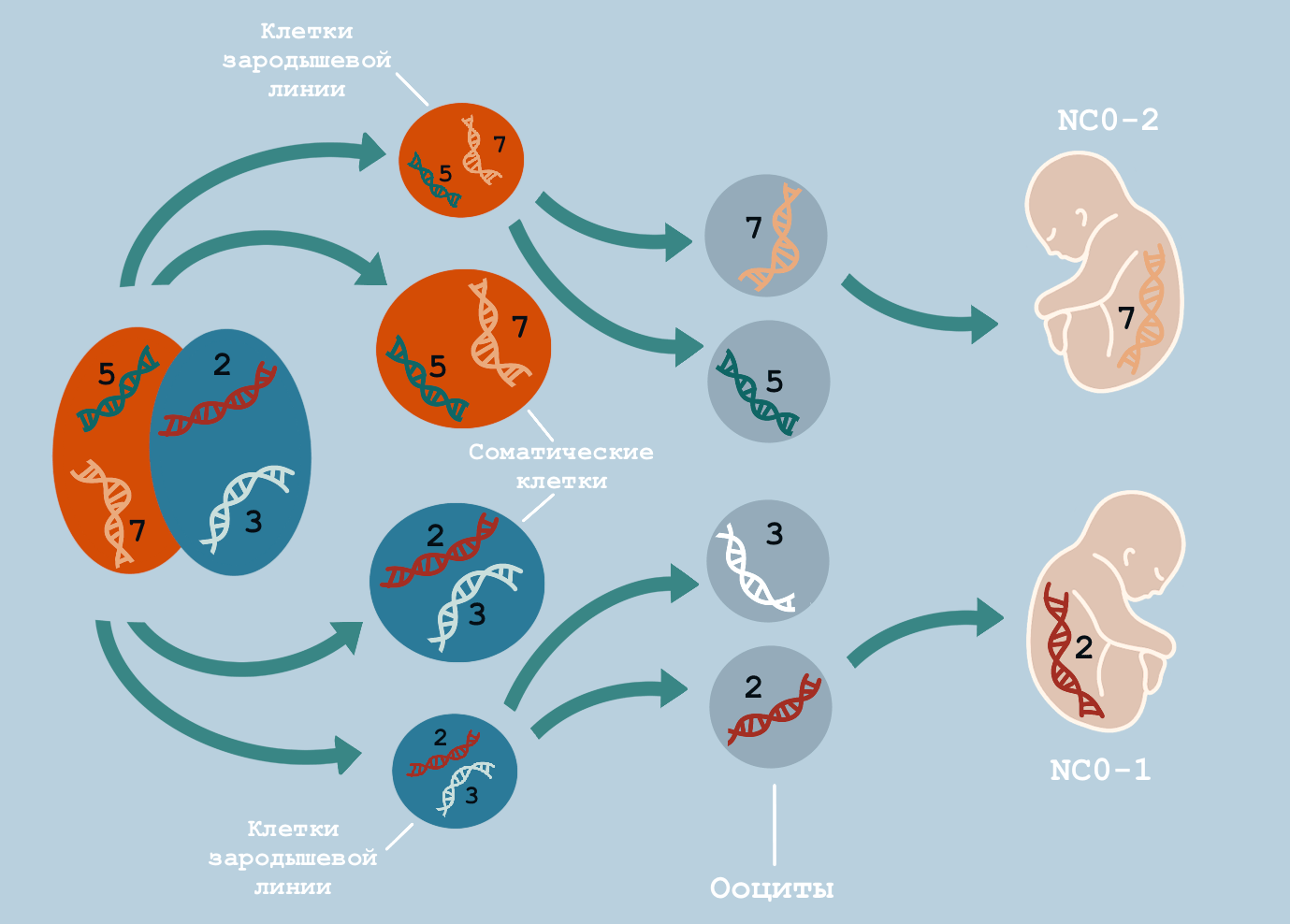
Рисунок 7. Предположительное происхождение мутаций у детей NC0. Всего у NC0 изначально было 17 ранних постзиготных мутаций: 5 сохранились в доминантной клеточной линии и 12 — в рецессивной. Когда образовались гаплоидные ооциты, в каждом осталось примерно по половине мутаций из исходных диплоидных клеток. Такую «половинку» и получил каждый из двух детей — один из доминантной линии, а другой и рецессивной.
иллюстрация Анастасии Самоукиной
Но можно ли вообще говорить о доминантной и рецессивной линиях, когда речь идет о зародышевых клетках? Это в теле преобладают потомки одного из бластомеров — в крови таких клеток около 90%, в моче 70–80%. А как насчет зародышевой линии? В большинстве ли они там?
Разобраться в этом помог анализ данных, которые получила другая группа ученых в 2018 году в рамках проекта deCODE. Авторы того исследования проанализировали множество семей и пришли к выводу о том, что существует две, а в некоторых случаях даже три линии зародышевых клеток. Исследователи под руководством Алексея Абызова взяли самые распространенные мутации, которые передавались от родителей детям в шести семьях с 17, 10, 9, 9, 9 и 9 детьми, и проанализировали их с помощью своей методики. Используя мутации как маркеры, они проверили, насколько потомки каждого из двух первых бластомеров родителей представлены в их собственном теле и у их детей (а значит, и в зародышевых линиях).
Анализ соматических клеток показал ту же картину, что ранее обнаружилась у NC0 и других участников предыдущих исследований. Соматические потомки одного из первых бластомеров у всех были в явном большинстве. А вот с зародышевыми клетками в теле детей ситуация оказалась совсем другой. Соотношение, как видно из Таблицы 1, приближается к 50/50%.
Число детей в семье |
Родитель |
Доля доминантных клеток в крови родителя |
Количество детей, у которых представлены клетки-потомки доминантной и рецессивной линий родителей |
|
|---|---|---|---|---|
|
доминантные |
рецессивные |
|||
|
17 |
Отец |
93% |
8 |
9 |
|
Мать |
94% |
6 |
11 |
|
|
10 |
Мать |
72% |
5 |
5 |
|
9 |
Отец |
82% |
7 |
2 |
|
9 |
Отец |
88% |
2 |
7 |
|
9 |
Отец |
73% |
5 |
4 |
|
9 |
Отец |
71% |
3 |
6 |
|
Семья NC0 (2) |
Мать |
91% |
1 |
1 |
|
Все семьи |
Все родители |
- |
37 |
45 |
Чтобы перепроверить полученные результаты на более крупной выборке семей, исследователи использовали коллекцию Simons Simplex, включающую результаты полногеномного секвенирования 7736 образцов крови из 1934 семей, в каждой из которых есть мать, отец, здоровый ребенок и ребенок с расстройством аутистического спектра.
Работая с Simons Simplex, ученые проанализировали все семьи из коллекции и в 40 из них обнаружили ранние постзиготные мутации у родителей. Эти мутации стали маркерами доминантной линии. Было подсчитано, как распределяются три исхода: мутация передалась обоим детям, только одному ребенку или не передалась никому. Далее исследователи проверили, какой из четырех схем соответствует полученное распределение:
-
Частота ранних постзиготных мутаций в клетках зародышевой линии такая же, как в крови, то есть присутствуют доминантная линия (в большинстве) и рецессивная (в меньшинстве).
-
Распределение составляет 50/50%, то есть обе линии вносят в половые клетки одинаковый вклад, и среди них нет доминантной и рецессивной.
-
Половые клетки происходят только из одной линии, они моноклональные.
-
Частота мутаций распределяется случайным образом.
Оказалось, что ситуация больше всего соответствует варианту №2. Зародышевые клетки происходят минимум из двух линий, им дают начало оба первых бластомеров, и вклад обоих составляет по 50%. Вариант №4 со случайным распределением тоже возможен, но и он говорит о том, что задействованы оба бластомера.
Как объяснить полученные данные?
Результаты этого исследования говорят о том, что распределение клеток зародышевой линии, вероятно, является не таким же случайным, как распределение соматических клеток. Возможно, это происходит под действием каких-то неизвестных факторов — например, играет роль расположение клеток из доминантной и рецессивной линий относительно друг друга. Логично предположить, что первичные клетки зародышевой линии у человека, действительно, возникают сразу в двух местах — в амнионе и эпибласте, и это тоже играет роль.
Авторы исследования полагают, что может существовать некая условная граница между клетками, и она регулируется особыми молекулярными механизмами (рис. 8).
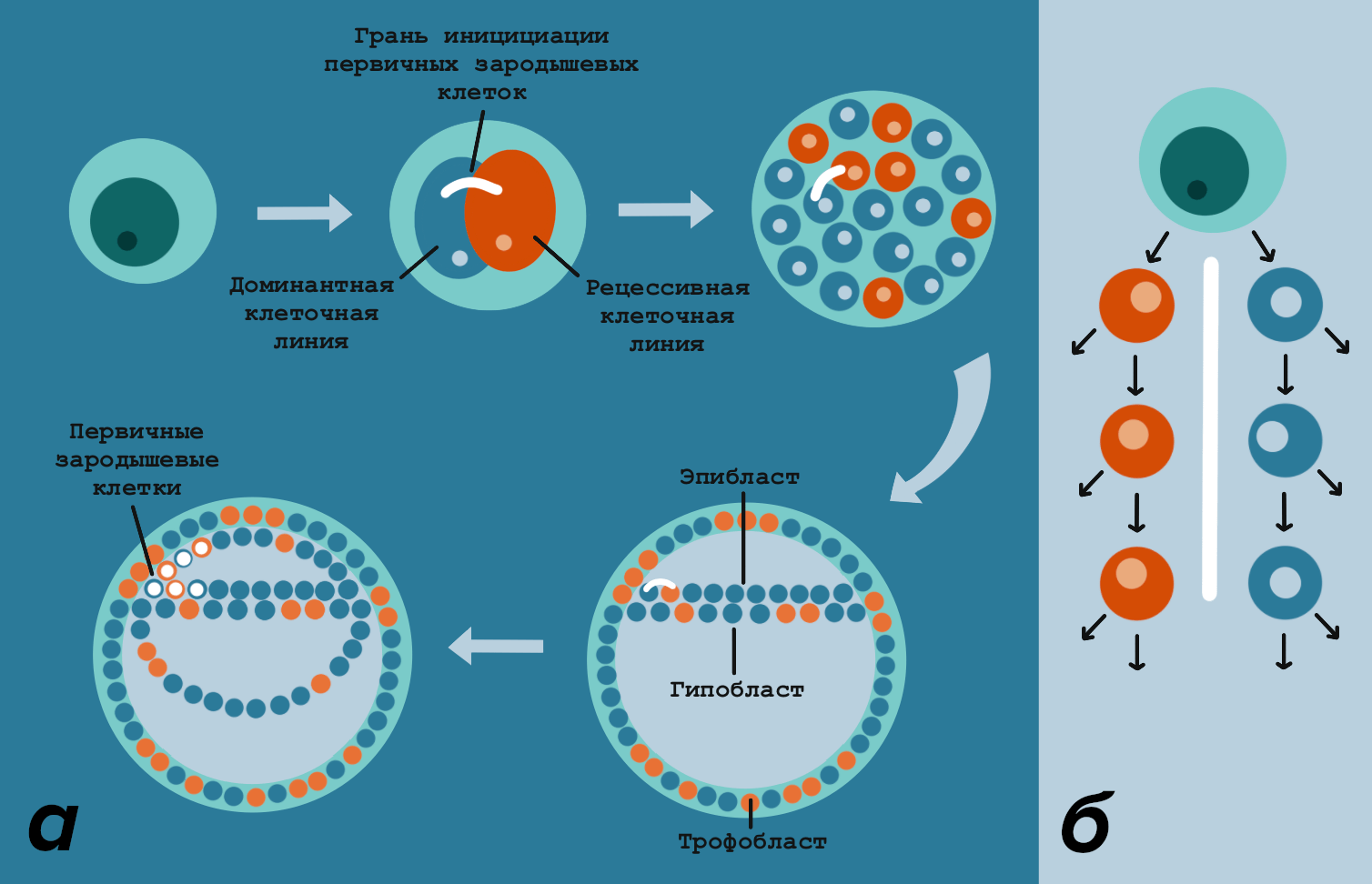
Рисунок 8. Возможное объяснение разного распределения клеток соматической и зародышевой линий. а: Два первых бластомера устанавливают некую условную грань, и она сохраняется, возможно, за счет асимметричного деления бластомеров. После того как появляется эпибласт, эта грань инициирует образование первых клеток зародышевой линии. В нее попадает одинаковое количество клеток из рецессивной и доминантной линий. б: первые бластомеры могут делиться асимметрично: только один из них остается на условной грани. В процессе делений только одна из дочерних клеток сохраняет свойства материнской, за счет этого обеспечивается асимметрия и сохраняется та самая условная грань.
иллюстрация Анастасии Самоукиной по [6]
Считается, что зародышевая линия формируется исключительно из внутреннего слоя эмбриона. Наша работа не опровергает эту парадигму, но допускает, что часть зародышевых клеток может происходить из внешнего слоя. Таким образом, помимо описанной в нашей работе гипотезы о грани, возможен иной, чрезвычайно стройный природный механизм сохранения симметрии бластомеров в зародышевой линии. Его суть заключается в следующем: симметрия первых двух бластомеров нарушается при разделении на внутренний и внешний слои — каждый из бластомеров преимущественно вносит вклад в один из этих слоев, — после чего симметрия восстанавливается в зародышевой линии путем дифференцировки равного количества клеток из каждого слоя.
Это исследование в очередной раз показало, что анализ мутаций — эффективный способ изучать развитие организма человека на разных этапах. Ранние постзиготные мутации — уникальное явление. Возникая фактически как соматические, они становятся для следующего поколения наследственными и являются одним из двигателей эволюции.
Несмотря на то, что исследование по большей части носило фундаментальный характер, его результаты могут быть полезны в практической медицине. Вот что об этом говорит Алексей:
Болезнетворные мутации в организме родителей могут слабо проявляться из-за их низкой частоты, когда они находятся в рецессивной линии. Тем не менее, такие мутации будут наследоваться с высокой вероятностью — так же, как и мутации из доминантной линии. Поэтому поиск болезнетворных наследственных мутаций, передающихся от родителей к детям, не должен ограничиваться только высокочастотными мутациями в организме родителей.
Также авторы отмечают, что более крупные исследования мутаций в соматических и зародышевых клетках у родителей в многодетных семьях, вероятно, помогут получить еще больше полезной информации.
Литература
- Путешествие во времени: как судьба первых клеток эмбриона влияет на его дальнейшее развитие и риск заболеваний;
- Liana Fasching, Yeongjun Jang, Simone Tomasi, Jeremy Schreiner, Livia Tomasini, et. al. (2021). Early developmental asymmetries in cell lineage trees in living individuals. Science. 371, 1245-1248;
- Sara Bizzotto, Yanmei Dou, Javier Ganz, Ryan N. Doan, Minseok Kwon, et. al. (2021). Landmarks of human embryonic development inscribed in somatic mutations. Science. 371, 1249-1253;
- Sergi Junyent, Maciej Meglicki, Roman Vetter, Rachel Mandelbaum, Catherine King, et. al. (2024). The first two blastomeres contribute unequally to the human embryo. Cell. 187, 2838-2854.e17;
- Геномная головоломка: открой в себе мозаика;
- Yeongjun Jang, Livia Tomasini, Taejeong Bae, Anna Szekely, Flora M. Vaccarino, Alexej Abyzov. (2024). Transgenerational transmission of post-zygotic mutations suggests symmetric contribution of first two blastomeres to human germline. Nat Commun. 15;
- Сотни мутаций в мозге, «гены аутизма» и ранняя диагностика болезней: ученые поделились новыми данными;
- Rocio Acuna-Hidalgo, Joris A. Veltman, Alexander Hoischen. (2016). New insights into the generation and role of de novo mutations in health and disease. Genome Biol. 17;
- J.M. Goldmann, J.A. Veltman, C. Gilissen. (2019). De Novo Mutations Reflect Development and Aging of the Human Germline. Trends in Genetics. 35, 828-839;
- Joris A. Veltman, Han G. Brunner. (2012). De novo mutations in human genetic disease. Nat Rev Genet. 13, 565-575;
- A. Haworth, H. Savage, N. Lench. (2016). Diagnostic Genomics and Clinical Bioinformatics. Medical and Health Genomics. 37-50;
- The 1000 Genomes Project Consortium, Adam Auton, Gonçalo R. Abecasis, David M. Altshuler, Richard M. Durbin, et. al. (2015). A global reference for human genetic variation. Nature. 526, 68-74;
- Костродымов Н. Н. (2013). Место эволюционной теории пола в решении демографического кризиса. Бюллетень Национального научно-исследовательского института общественного здоровья имени Н. А. Семашко. 2, 141–143;
- Leach M. (2013). Maternal age, the chance for Down syndrome, and prenatal testing. Down Syndrome Prenatal Testing;
- Модельные организмы: дрозофила;
- Модельные организмы: данио рерио;
- Grace V. Hancock, Sissy E. Wamaitha, Lior Peretz, Amander T. Clark. (2021). Mammalian primordial germ cell specification. Development. 148;
- Cassandra G. Extavour, Michael Akam. (2003). Mechanisms of germ cell specification across the metazoans: epigenesis and preformation. Development. 130, 5869-5884;
- Megan M. Colonnetta, Yogesh Goyal, Heath E. Johnson, Sapna Syal, Paul Schedl, Girish Deshpande. (2022). Preformation and epigenesis converge to specify primordial germ cell fate in the early Drosophila embryo. PLoS Genet. 18, e1010002;
- Susan Strome, Ruth Lehmann. (2007). Germ Versus Soma Decisions: Lessons from Flies and Worms. Science. 316, 392-393;
- M. Saitou, M. Yamaji. (2012). Primordial Germ Cells in Mice. Cold Spring Harbor Perspectives in Biology. 4, a008375-a008375;
- Susana M. Chuva de Sousa Lopes, Christine L. Mummery. (2013). Differentiation in Early Development. Handbook of Stem Cells. 139-154;
- Ствол и ветки: стволовые клетки;
- Не можешь излечить — восстанови! Как появилась регенеративная медицина и какие у нее возможности сегодня;
- Такие разные стволовые клетки;
- Toshihiro Kobayashi, M. Azim Surani. (2018). On the origin of the human germline. Development. 145.






