
Сотни мутаций в мозге, «гены аутизма» и ранняя диагностика болезней: ученые поделились новыми данными
16 августа 2022
Сотни мутаций в мозге, «гены аутизма» и ранняя диагностика болезней: ученые поделились новыми данными
- 2885
- 1
- 8
Вот такую немного пугающую картину рисует одна из нейросетей, если попросить ее изобразить «mutations in the brain».
В компьютерах не бывает соматических мутаций, а в клетках человека они происходят постоянно, но искусственному интеллекту пока еще далеко до человеческого мозга.
-
Автор
-
Редакторы
-
Рецензент
-
Иллюстратор
Недавно американские ученые решили разобраться, как соматические мутации влияют на развитие нервно-психических патологий. Для этого они проанализировали образцы мозга 131 умершего человека: 44 со здоровой нервной системой, 19 с синдромом Туретта, 9 с шизофренией и 59 с расстройствами аутистического спектра. Результаты исследования опубликованы в журнале Science. Нам рассказал о них один из руководителей этой работы, постоянный гость на страницах «Биомолекулы» — Алексей Абызов, заведующий лабораторией при клинике Мэйо.
Мутации в клетках человека возникают постоянно, и от этого никуда не деться. Большинство изменений в генах нейтральны — они не приносят ни вреда, ни пользы. В редких случаях они оказываются полезны. А некоторые мутации приводят к серьезным заболеваниям. Самый распространенный пример «генетического заболевания», связанного с соматическими мутациями, — рак. Но существует и много других, причем, науке известны еще далеко не все причинно-следственные связи между генетическими дефектами и болезнями.
Например, не так давно стало понятно, что соматические мутации играют роль в развитии нервно-психических заболеваний. Об этих взаимосвязях пока известно немного, и недавно американские ученые решили разобраться в некоторых нюансах, проанализировав 131 образец ткани головного мозга умерших людей — со здоровой нервной системой, синдромом Туретта, расстройствами аутистического спектра и шизофренией [1]. Было сделано несколько интересных находок, и о них нам рассказал один из руководителей исследования, руководитель научной лаборатории в Клинике Мэйо Алексей Абызов (рис. 1).

Рисунок 1а. Алексей Абызов — один из руководителей исследования — выпускник МФТИ; д. ф.-м. н.; с 2014 года руководит научной лабораторией в Клинике Мэйо; ассоциированный профессор в медицинском колледже при этой клинике; приглашенный профессор в Университете Миннесоты и Йельском университете.
Ранее мы уже публиковали обзоры исследований, которыми руководил Алексей: «Геномная головоломка: открой в себе мозаика» [2], «Как искусственные модели головного мозга и омиксные технологии пригодятся в борьбе с аутизмом» [3] и «Путешествие во времени: как судьба первых клеток эмбриона влияет на его дальнейшее развитие и риск заболеваний» [4]. А еще Алексей участвует в качестве спикера и ментора в школах Future Biotech (летние школы в 2012 и 2013 годах, зимняя школа в 2020 г.).
Рисунок 1б. Лаборатория Алексея Абызова в клинике Мэйо.
фото предоставлены Алексеем Абызовым
Соматические мутации естественным образом возникают в делящихся и постмитотических клетках на протяжении всего развития человека и во время старения, начиная с первого дробления зиготы. Открытым остается вопрос: насколько часты соматические мутации в популяции и являются ли они фактором, способствующим этиологии нервно-психических расстройств?
Исследование показало, что в мозге людей с аутизмом много мутаций, влияющих на работу энхансеров — участков ДНК, которые регулируют транскрипцию генов, и это может играть роль в развитии заболевания. Кроме того, ученые обнаружили, что в некоторых образцах мозга (почти 6%) число мутаций на порядки превосходит все остальные образцы. Это явление называется гипермутабельностью.
Что такое промоторы, энхансеры, сайленсеры, инсуляторы и многие другие шаманские генетические структуры — мы разбирали на страницах спецпроекта «Эпигенетика», например в статье «Ядро и эпигеном» [5].
Мутации в каждом из нас
Соматическими называют такие мутации, которые возникают в отдельных клетках тела и не передаются потомству. Они есть у каждого человека и происходят на протяжении всей жизни — от первых дней существования эмбриона до глубокой старости. Изменения в ДНК могут произойти из-за случайных ошибок при ее удвоении во время деления клетки, спонтанно без деления или под действием каких-либо стрессовых факторов (например, определенных химических соединений, ультрафиолетового излучения, радиации, вирусов) [6].
Характерная особенность соматических мутаций в том, что они присутствуют в клетке, в которой изначально произошло нарушение, и в ее потомках, но не во всем организме. В результате возникает такое явление как мозаицизм: из-за мутаций гены в разных клетках несколько различаются (рис. 2). Соматические мутации встречаются настолько часто, что мозаицизм — это правило, а не исключение. Подробнее об этом можно узнать из нашего обзора одной из более ранних работ Алексея: «Геномная головоломка: открой в себе мозаика» [2].
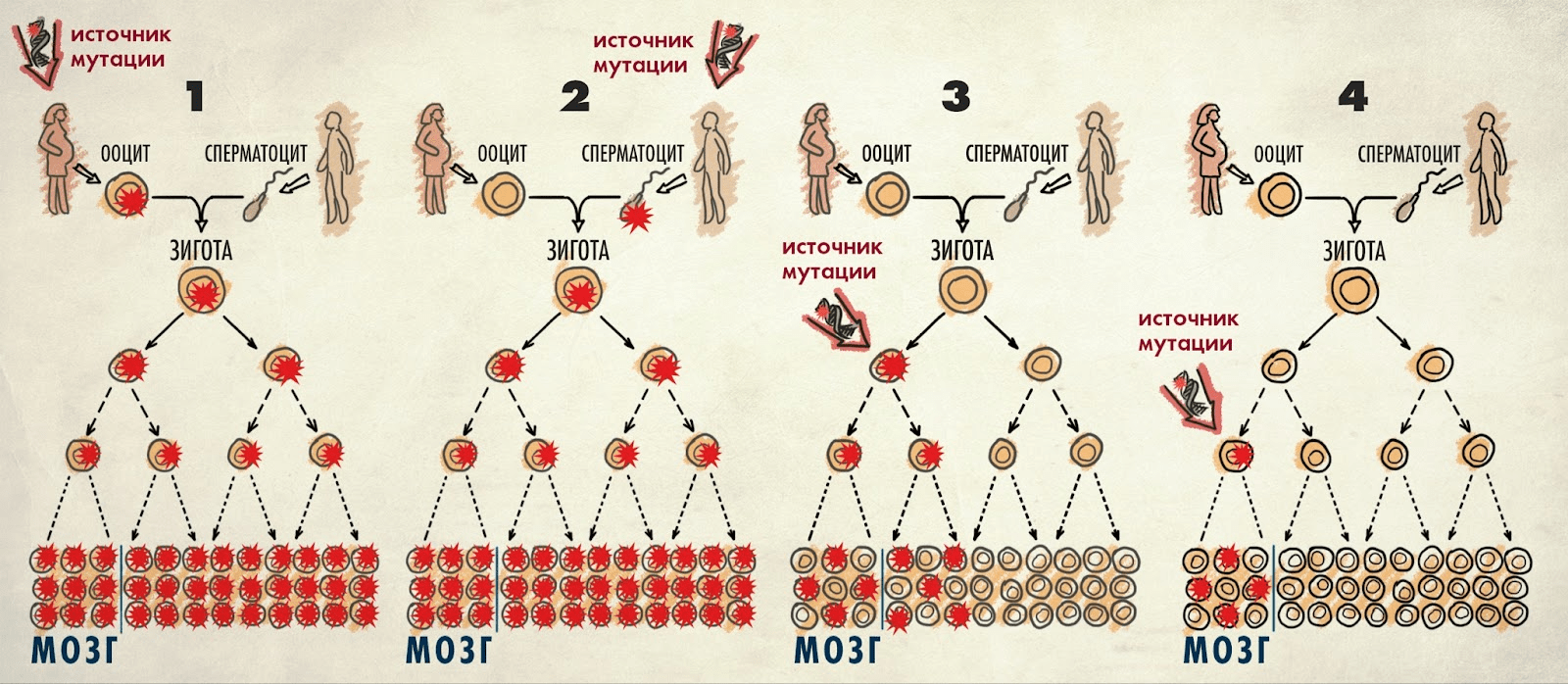
Рисунок 2. Типы мутаций в зависимости от времени возникновения.
1 — Наследственная мутация. В данном случае она присутствует во всех клетках организма матери, в том числе половых, и передается ребенку. У него она тоже будет присутствовать во всех клетках тела.
2 — Мутация, возникшая de novo в процессе гаметогенеза (образования половых клеток), в данном случае у отца. В других клетках тела отца этой мутации нет, но она будет присутствовать во всех клетках ребенка.
3 — Ранняя постзиготная мутация . Ее уже можно считать соматической. На рисунке видно, что эта мутация возникла в одном из бластомеров после первого деления яйцеклетки. Это изменение в ДНК будет присутствовать во многих клетках организма, и его можно обнаружить в большинстве или во всех тканях.
4 — Поздняя постзиготная мутация. Это соматическая мутация, возникшая во время внутриутробного развития; она будет присутствовать только в определенных тканях. Чем позже соматическая мутация возникла во время внутриутробного развития или жизни, тем в меньшем числе клеток она будет представлена.
иллюстрация Елены Беловой по [7]
Типы мутаций, которые выделяют в зависимости от времени возникновения:
— Наследственные — присутствуют во всех клетках тела человека, включая половые, и передаются потомству.
— Соматические — присутствуют в определенный клетках тела (но не в половых) и не передаются по наследству.
— Постзиготные — возникают начиная со стадии зиготы (первой клетки, получившейся в результате оплодотворения) и на протяжении всей жизни. Зигота дает начало как клеткам тела (соматическим), так и половым клеткам (зародышевой линии), поэтому ранние постзиготнгые мутации могут передаваться потомству, то есть фактически со следующего поколения становятся наследственными. В настоящее время считается, что постзиготные мутации являются важным и недооцененным источником изменчивости генома de novo [8], [9].
Часто можно услышать, что мутации возникают, когда клетка делится, ее ДНК удваивается, и в процессе копирования последней возникают «опечатки», которые не успевают исправить естественные системы репарации. Соответственно, чем чаще делится клетка, тем выше вероятность возникновения таких генетических поломок. Алексей рассказал нам, что это не совсем так, и поделился результатами некоторых исследований, которые показали, что мутации возникают и в неделящихся клетках:
В 2021 году в журнале Nature были представлены результаты работы, в ходе которой ученые обнаружили, что мутации в зрелых нейронах накапливаются с постоянной скоростью на протяжении всей жизни без клеточных делений [10]. Это открытие было сделано с помощью нового протокола секвенирования NanoSeq, позволяющего сократить число ошибок при прочтении менее чем до пяти на миллиард оснований.
А ранее, в 2018 году, в Science были опубликованы результаты другого исследования, подтвердившего накопление мутаций в неделящихся клетках. Авторы провели секвенирование ДНК нервных клеток из префронтальной коры и гиппокампа 15 здоровых людей, а также 9 пациентов, страдающих нейродегенеративными заболеваниями из-за нарушения репарации ДНК. В генах этих людей искали соматические однонуклеотидные варианты (sSNV). Эти изменения были обнаружены во всех нейронах. Исследователи пришли к выводу, что sSNV накапливаются с возрастом и распространены при нейродегенеративных заболеваниях. Напомним: результаты этого исследования, как и ранее упомянутого, касаются зрелых нейронов — клеток, которые не делятся [11].
Эффект соматической мутации будет зависеть от того, в каком гене она возникла и насколько важную роль этот ген играет в клетке. Некоторые мутации нейтральны, а некоторые приводят к серьезным заболеваниям. Раньше в качестве «генетического заболевания», связанного с соматическими мутациями, рассматривали только рак, но теперь известно, что изменения в генах в течение жизни приводят и к другим патологиям, в том числе в нервной системе (табл. 1).
| Название заболевания | Гены, в которых присутствует мутация |
|---|---|
| Лиссэнцефалия — аномалия развития, при которой сглаживаются извилины коры больших полушарий [12] | LIS1 [13], [14] |
| Подкорковая ламинарная гетеротопия (синдром «двойной коры») — редкое заболевание, связанное с нарушением миграции нервных клеток. Проявляется в виде эпилепсии, расстройств поведения и сниженного интеллекта [15] | DCX [16] |
| Тяжелая миоклоническая эпилепсия младенчества (Синдром Драве) — эпилептическая энцефалопатия, которая развивается на первом году жизни [17] | SCN1A [18], [19] |
| Гемимегалэнцефалия — нарушение миграции и пролиферации нервных клеток, при котором увеличивается одно из полушарий головного мозга [20] | AKT3, PIK3CA, mTOR [21–23] |
| Спорадическая болезнь Альцгеймера с ранним началом [24] | PSEN1 [25] |
| Спорадическая болезнь Крейтцфельда–Якоба [26] | PRNP [27] |
Известно, что соматические мутации встречаются при эпилепсии [28], расстройствах аутистического спектра [29], умственной отсталости [7]. Однако роль генетических изменений в развитии нервно-психических заболеваний пока изучена слабо. Для этого требуется еще много исследований, и недавно опубликованная работа американских ученых стала очередным шагом на пути к пониманию этого вопроса.
Что сделали Алексей и другие авторы?
Для исследования ученые использовали 131 мозг умерших людей. Из каждого извлекли примерно 1 см3 ткани из 1–2 областей: коры, полосатого тела или гиппокампа. Затем исследователи выделили из материала ДНК и провели ее секвенирование [32] — «прочитали» последовательность генов. Для более высокой точности каждый нуклеотид был в среднем прочитан 200 раз (этот показатель называется глубиной секвенирования).
В каждом образце мозга ученые обнаружили от 20 до 60 соматических мутаций в виде замены одной «буквы» последовательности ДНК. Но в некоторых образцах число мутаций достигало 100 и больше — до 2000. Это явление называется гипермутабельностью . Исследователи перепроверили и убедились: это не полиморфизмы, не ошибки секвенирования, и гипермутабельность в самом деле обусловлена соматическими мутациями.
Кстати, мутагенез может протекать с разной скоростью, и от этого зависит скорость изменения белков в процессе эволюции. Подробности — в статье «У каждого белка свои часы. К вопросу о скорости эволюции белков» [33].
Далее авторы работы отложили в сторону образцы с аномально большим числом мутаций и сравнили оставшиеся. Оказалось, что количество соматических мутаций в случае, когда нет гипермутабельности, не зависит от того, здоров ли человек или болен, от его возраста. Это в очередной раз доказало, что в клетках здоровых людей тоже происходят мутации, и по большей части они возникают на ранних этапах развития организма [2]. Об этом мы рассказывали в обзоре одной из предыдущих работ Алексея — «Путешествие во времени: как судьба первых клеток эмбриона влияет на его дальнейшее развитие и риск заболеваний» [4].
Однако, когда ученые снова рассмотрели образцы с гипермутабельностью, ситуация изменилась. Оказалось, что гипермутабельность более распространена в образцах мозга людей старшего возраста (старше 40 лет) — около 11%, по сравнению с образцами более молодых людей (до 40 лет) — менее 2%.
Когда ученые проанализировали мозг больного шизофренией с самым большим количеством соматических мутаций, то обнаружили в гиппокампе дупликацию (удвоение участка) хромосомы 7 и делецию (утрату участка) хромосомы 10. Это очень интересная находка, потому что такие хромосомные перестройки характерны для опухоли головного мозга — глиобластомы.
Исследователи решили, что эти изменения не связаны с шизофренией. Скорее всего, если бы этот пациент остался жив, через какое-то время врачи диагностировали бы у него опухоль мозга. И это в очередной раз наводит на мысль, что генетическая диагностика способна сильно опередить тот момент, когда в организме уже появится новообразование, и человека начнут беспокоить симптомы. Выявляя онкологические заболевания на генетическом уровне, пока они еще не возникли, теоретически можно проводить профилактику и предотвращать развитие опухолей. Возможно, именно этим и будет заниматься медицина будущего.
Эти генетические изменения оказались не единственной интересной находкой, связанной с онкологическими заболеваниями. Всего исследователи выявили 10 мутаций, которые ранее были обнаружены в образцах злокачественных опухолей и внесены в каталог COSMIC соматических мутаций, связанных с раком (табл. 2).
| Обозначение гена | Частота аллели (VAF) | Гипермутабельность в образце, где обнаружена мутация | Прогноз эффекта мутации (COSMIC) |
|---|---|---|---|
| NRAS | 1,84% | да | Патогенная |
| NRAS | 1,10% | да | Патогенная |
| GBE1 | 1,26% | да | Патогенная |
| TET2 | 1,05% | да | Нейтральная |
| TENM3 | 1,27% | да | Патогенная |
| ENDOU | 1,16% | да | Патогенная |
| IDH2 | 3,55% | да | Патогенная |
| BCORL1 | 2,99% | да | Нейтральная |
| MLLT4 | 0,95% | нет | Патогенная |
| WHSC1 | 2,78% | нет | Патогенная |
Почему у некоторых людей в мозге встречается много мутаций?
Возникает большой соблазн заявить, что именно гипермутабельность «виновата» в заболеваниях головного мозга или, по крайней мере, она вносит заметный вклад. Но это не так: исследователи обнаружили такую аномалию и среди образцов здоровых людей, и среди тех, у кого были диагностированы нервно-психические заболевания.
Вероятно, причины гипермутабельности индивидуальны для каждого человека. Анализ частот мутаций показал, что такая «внутренняя гипермутабельность» не является врожденной, она возникает на определенном этапе жизни.
Почему вообще возникает так много мутаций? Одно из объяснений — за счет глиальных клеток (они играют вспомогательную роль по отношению к нервным). С возрастом их доля по отношению к нейронам увеличивается, потому что они продолжают делиться, и возможно, тут играет роль эффект клонального разрастания — мутации в разросшемся клоне сразу «на виду».
Было обнаружено, что в половине гипермутабельных образцов есть изменения в генах, участвующих в кроветворении во время старения. И это, на первый взгляд, дает повод предположить, что мутации возникли в клетках крови, привели к клональному разрастанию, и были обнаружены в мозге из-за просачивания кровяных клеток в мозг при старении.Но в двух образцах мозга ученые обнаружили гипермутабельность сразу в двух областях мозга, и генетические изменения присутствовали в нервных клетках. А значит, они могли появиться намного раньше, еще в процессе развития организма.
Мутации у людей с нервно-психическими заболеваниями
Только 1% всей ДНК в хромосомах кодирует белки. Остальные 99% — это некодирующие последовательности, которые раньше считали «лишними», «мусорными» [34]. В настоящее время известно, что по крайней мере некоторые из них играют важную роль в функционировании клетки. В «темной материи» генома находятся регуляторные участки (читайте об этом в спецпроекте «Эпигенетика» [5]):
- Промоторы — участки, к которым прикрепляются белки, осуществляющие транскрипцию (перенос генетической информации с ДНК на РНК);
- Энхансеры служат местом прикрепления белков, активирующих транскрипцию — факторов транскрипции;
- Сайленсеры связывают белки, подавляющие транскрипцию;
- Инсуляторы связываются с белками, которые контролируют транскрипцию разными способами. Некоторые из них препятствуют работе энхансеров, другие препятствуют структурным изменениям ДНК, подавляющим активность генов, третьи выполняют сразу обе функции [34].
Среди соматических мутаций, которые обнаружили при исследовании образцов мозга, 2–3% находились в кодирующей последовательности ДНК и 6% предположительно были связаны с участками, отвечающими за регуляцию. В образцах мозга людей с расстройствами аутистического спектра и шизофренией ученые обнаружили шесть вредоносных мутаций в генах, которые, по данным научной литературы, связаны с этими нервно-психическими расстройствами (табл. 3).
| Обозначение гена | Частота аллели (VAF) | Наличие гипермутабельности в образце, где обнаружена мутация | Заболевание, при котором обнаружена мутация* | Заболевание, с которым связана мутация в этом гене, по данным научной литературы* |
|---|---|---|---|---|
| MTOR | 2,63% | да | Расстройства аутистического спектра (РАС) | РАС |
| TTN | 2,09% | нет | РАС | РАС |
| ZNF512 | 4,15% | нет | РАС | РАС |
| PCDH15 | 4,41% | нет | РАС | РАС |
| DNAH3 | 12,09% | нет | РАС | РАС |
| ALMS1 | 4,46% | нет | Шизофрения | Шизофрения |
| * — В предпоследней колонке указаны заболевания людей, в образцах мозга которых обнаружены мутации во время исследования Алексея Абызова. В последней колонке — заболевания, с которыми эти мутации связаны по данным научной литературы. Как видно, данные совпали. | ||||
Расстройства аутистического спектра — современный термин для определения состояний, которые раньше называли аутизмом. Три характерных признака этих заболеваний: неспособность к социальным взаимодействиям, повторяющиеся действия и ограниченный круг интересов. Подробнее читайте в нашей публикации «Расстройство аутистического спектра: “дети дождя”» [29].
Когда ученые решили проверить, какие из обнаруженных мутаций затрагивают энхансеры, находки тоже в основном касались образцов, полученных от людей с расстройствами аутистического спектра. В мозге людей с аутизмом были обнаружены соматические точечные мутации (вызванные заменой отдельных «букв» ДНК), которые создают в энхансерах активно развивающегося мозга последовательности для связывания факторов транскрипции. И это может играть роль в развитии заболевания.
Мы исследовали влияние обнаруженных мутаций на функцию энхансеров, активных в мозге эмбриона человека и в органоидной модели развивающегося мозга человека. Для каждого набора энхансеров анализ когорты РАС выявил избыток (по сравнению с контрольной когортой) соматических мутаций, создающих предполагаемые мотивы связывания фактора транскрипции. Наиболее заметно то, что 16 предполагаемых мотивов связывания для факторов транскрипции MEIS1, MEIS2 и MEIS3 были созданы мутациями в мозге больных РАС, тогда как только четыре таких мутации были обнаружены в нормальном мозге.
Генетика вносит львиную долю в развитие РАС, а в целом причины развития этого заболевания весьма сложны. Если вас все еще пугают рассказы антипрививочников о том, что аутизм вызывает вакцина против кори, вам стоит почитать статью «Корь: война с детской чумой продолжается» [35]. В ней мы разоблачаем распространенный миф, а заодно рассказываем много интересного (и полезного) о кори и вакцинации против нее.
Почему важно изучать изменения в генах?
Словосочетание «персонализированная медицина» появилось не так давно, и в последнее время оно набирает все большую популярность [36]. Это направление в медицине предполагает максимально индивидуальный подход к диагностике и лечению заболеваний. Первыми в полной мере осознали, что «не бывает двух одинаковых больных», онкологи. Каждая злокачественная опухоль уникальна, и эта уникальность обеспечивается сочетанием мутаций в раковых клетках. Если онкологическому больному уже не помогает ни одна схема терапии из стандартных протоколов, то в современных клиниках назначают генетический анализ с применением секвенирования нового поколения (NGS). В лаборатории «читают» ДНК опухолевых клеток и, исходя из уникального набора мутаций, подбирают персонализированное лечение.
Но онкология — лишь одна из сфер медицины. В целом же масштабы соматического мозаицизма, его влияние на биологию и здоровье человека неизвестны. Эти знания могли бы сильно помочь в профилактике, диагностике и лечении многих болезней. Поэтому недавно Национальные институты здравоохранения США (National Institutes of Health, NIH) объявили о старте программы по изучению соматических мутаций в здоровых тканях и органах человека [37].
Как будет выглядеть программа, станет известно примерно через год, когда раздадут гранты по заявкам. Но я думаю, что в конечном счете по своей значимости она будет сравнима с изучением 1000 геномов 10 лет назад [38].
А значит, у нас, видимо, еще будет немало поводов подготовить для вас интересные обзоры научных исследований, посвященных изучению соматических мутаций и практическому применению этих знаний для сохранения и восстановления здоровья людей.
Литература
- Taejeong Bae, Liana Fasching, Yifan Wang, Joo Heon Shin, Milovan Suvakov, et. al.. (2022). Analysis of somatic mutations in 131 human brains reveals aging-associated hypermutability. Science. 377, 511-517;
- Геномная головоломка: открой в себе мозаика;
- Как искусственные модели головного мозга и омиксные технологии пригодятся в борьбе с аутизмом;
- Путешествие во времени: как судьба первых клеток эмбриона влияет на его дальнейшее развитие и риск заболеваний;
- Ядро и эпигеном;
- Miles B., Tadi P. Genetics, Somatic Mutation. Treasure Island (FL): StatPearls Publishing, 2022;
- Annapurna Poduri, Gilad D. Evrony, Xuyu Cai, Christopher A. Walsh. (2013). Somatic Mutation, Genomic Variation, and Neurological Disease. Science. 341;
- Klaasjan G. Ouwens, Rick Jansen, Bas Tolhuis, P. Eline Slagboom, Brenda W.J.H. Penninx, Dorret I. Boomsma. (2018). A characterization of postzygotic mutations identified in monozygotic twins. Human Mutation. 39, 1393-1401;
- Rocio Acuna-Hidalgo, Tan Bo, Michael P. Kwint, Maartje van de Vorst, Michele Pinelli, et. al.. (2015). Post-zygotic Point Mutations Are an Underrecognized Source of De Novo Genomic Variation. The American Journal of Human Genetics. 97, 67-74;
- Federico Abascal, Luke M. R. Harvey, Emily Mitchell, Andrew R. J. Lawson, Stefanie V. Lensing, et. al.. (2021). Somatic mutation landscapes at single-molecule resolution. Nature. 593, 405-410;
- Michael A. Lodato, Rachel E. Rodin, Craig L. Bohrson, Michael E. Coulter, Alison R. Barton, et. al.. (2018). Aging and neurodegeneration are associated with increased mutations in single human neurons. Science. 359, 555-559;
- Falchek S.J. (2018). Пороки развития полушарий головного мозга. Справочник MSD;
- Joseph G Gleeson, Kristina M Allen, Jeremy W Fox, Edward D Lamperti, Samuel Berkovic, et. al.. (1998). doublecortin, a Brain-Specific Gene Mutated in Human X-Linked Lissencephaly and Double Cortex Syndrome, Encodes a Putative Signaling Protein. Cell. 92, 63-72;
- Nadia Bahi-Buisson, Isabelle Souville, Franck J. Fourniol, Aurelie Toussaint, Carolyn A. Moores, et. al.. (2013). New insights into genotype–phenotype correlations for the doublecortin-related lissencephaly spectrum. Brain. 136, 223-244;
- A. M. Teplyshova, V. V. Gaskin, G. V. Kustov, A. A. Gudkova, R. V. Luzin, et. al.. (2017). Subcortical laminar heterotopia 'double cortex syndrome'. Z. nevrol. psikhiatr. im. S.S. Korsakova. 117, 75;
- Joseph G. Gleeson, Sharon Minnerath, Ruben I. Kuzniecky, William B. Dobyns, Ian D. Young, et. al.. (2000). Somatic and Germline Mosaic Mutations in the doublecortin Gene Are Associated with Variable Phenotypes. The American Journal of Human Genetics. 67, 574-581;
- Мухин К.Ю., Пылаева О.А., Миронов М.Б., Долинина А.Ф., Морозов Д.В., Никитина М.А. (2014). Электроэнцефалографические изменения при синдроме Драве. Русский журнал детской неврологии. 9, 6–13;
- Elena Gennaro, Filippo M. Santorelli, Enrico Bertini, Daniela Buti, Roberto Gaggero, et. al.. (2006). Somatic and germline mosaicisms in Severe Myoclonic Epilepsy of Infancy. Biochemical and Biophysical Research Communications. 341, 489-493;
- Lata Vadlamudi, Leanne M. Dibbens, Kate M. Lawrence, Xenia Iona, Jacinta M. McMahon, et. al.. (2010). Timing of De Novo Mutagenesis — A Twin Study of Sodium-Channel Mutations. N Engl J Med. 363, 1335-1340;
- Чадаев В. (2009). Гемимегалэнцефалия. Институт детской неврологии и эпилепсии;
- Annapurna Poduri, Gilad D. Evrony, Xuyu Cai, Princess Christina Elhosary, Rameen Beroukhim, et. al.. (2012). Somatic Activation of AKT3 Causes Hemispheric Developmental Brain Malformations. Neuron. 74, 41-48;
- Jeong Ho Lee, My Huynh, Jennifer L Silhavy, Sangwoo Kim, Tracy Dixon-Salazar, et. al.. (2012). De novo somatic mutations in components of the PI3K-AKT3-mTOR pathway cause hemimegalencephaly. Nat Genet. 44, 941-945;
- Jean-Baptiste Rivière, Finding of Rare Disease Genes (FORGE) Canada Consortium, Ghayda M Mirzaa, Brian J O'Roak, Margaret Beddaoui, et. al.. (2012). De novo germline and postzygotic mutations in AKT3, PIK3R2 and PIK3CA cause a spectrum of related megalencephaly syndromes. Nat Genet. 44, 934-940;
- На руинах памяти: настоящее и будущее болезни Альцгеймера;
- J. A. Beck. (2004). Somatic and germline mosaicism in sporadic early-onset Alzheimer's disease. Human Molecular Genetics. 13, 1219-1224;
- Прионы: исследования таинственных молекул продолжаются;
- A. Alzualde, F. Moreno, P. Martínez-Lage, I. Ferrer, A. Gorostidi, et. al.. (2010). Somatic mosaicism in a case of apparently sporadic Creutzfeldt-Jakob disease carrying a de novo D178N mutation in the PRNP gene. Am. J. Med. Genet.. 153B, 1283-1291;
- Калиевые каналы как перспективное средство для генной терапии эпилепсии;
- Расстройство аутистического спектра: «дети дождя»;
- Twyman R. (2003). Mutation or polymorphism? Wellcome;
- За генный полиморфизм приходится платить;
- 12 методов в картинках: секвенирование нуклеиновых кислот;
- У каждого белка свои часы. К вопросу о скорости эволюции белков;
- What is noncoding DNA? (2014). MedlinePlus;
- Корь: война с детской чумой продолжается;
- От медицины для всех — к медицине для каждого!;
- Somatic Mosaicism Across Human Tissues (SmaHT). (2022). NIH;
- Перевалило за тысячу: третья фаза геномики человека.





