
Тяжелая жизнь без дистрофина: мышечная дистрофия Дюшенна
08 сентября 2023
Тяжелая жизнь без дистрофина: мышечная дистрофия Дюшенна
- 5752
- 0
- 10
Миодистрофия Дюшенна — генетическое заболевание, возникающее при мутациях в единственном гене белка дистрофина. Однако это вызывает целый ряд тяжелых нарушений в работе мышц, разрушает их и лишает заболевших — чаще всего это мальчики — нормального движения, дыхания и даже сердцебиения. Их главная надежда — новые экспериментальные способы лечения, которые вернут им потерянный дистрофин.
Рисунок в оригинальном разрешении.
-
Автор
-
Редакторы
-
Иллюстратор
Миодистрофия Дюшенна — это орфанное (то есть редкое) неизлечимое заболевание мышц, связанное с геном дистрофина DMD. Болеют им почти исключительно мальчики, которые очень быстро теряют мышечную ткань и способность к самостоятельному передвижению. Эта статья из цикла «Орфанные заболевания» — о катастрофических последствиях потери белка-дистрофина для мышц человека и организма в целом и, что немаловажно — о перспективах генной терапии и других методов лечения, которые (надеемся!) в обозримом будущем могут перевести эту болезнь в разряд излечимых.
Орфанные заболевания

Пациенты с орфанными заболеваниями страдают в одиночестве и смятении. Они чувствуют себя изгоями «стандартной» медицины. Мечты о том, что их заболевание «усыновит» какая-нибудь компания, и лекарство, наконец, будет разработано — то, что не дает им впасть в отчаяние.
Материал создан при поддержке компании «Артген биотех», миссия которой — сделать научные открытия и достижения практическими технологиями, создавать и внедрять в жизнь биотехнологические разработки для эффективной борьбы с орфанными и социально значимыми заболеваниями человека. «Артген биотех» разрабатывает и выводит на рынок биомедицинские препараты, вакцины, методы генной терапии, препараты по направлениям регенеративной медицины и клеточных технологий, а также изделия медицинского назначения в областях тканевой инженерии и генетических исследований.
Движение — это жизнь, а его утрата приводит к самым драматическим последствиям. С этим на собственном горьком опыте вынуждены столкнуться мальчики с миодистрофией Дюшенна (Дюшенна—Беккера): с раннего детства они испытывают большие трудности с самостоятельным передвижением.
Проблемы с мышцами постоянно усиливаются и, как правило, приводят к гибели в совсем юном возрасте. Мириться с этим совсем не хочется — поэтому исследователи работают не покладая рук, чтобы лучше понять причины миодистрофии Дюшенна (МДД) и научиться с ней бороться, предложив действенные лекарства.
Однако разработка таких препаратов — сложный процесс, в который, помимо ученых и врачей, включены биотехнологические компании, инвесторы, государство и его чиновники, пациентские сообщества и популяризаторы науки. Возьмем на себя роль популяризаторов: разберем успехи ученых и перспективы их разработок. Эта статья расскажет, для чего в норме нужен белок дистрофин; о последствиях его потери при миодистрофии; о возможности заменить его маленьким, но выполняющим многие необходимые функции фрагментом (мини- или микро-дистрофином); а также о других перспективных подходах к терапии МДД [1].
Миодистрофию Дюшенна можно назвать «частым среди редких» заболеванием. В мире одной из 5–8 тысяч известных орфанных болезней страдает примерно каждый пятый, при этом МДД диагностируют у одного из примерно 250 «орфанных» пациентов. И всё же распространенность миодистрофии Дюшенна намного выше, чем у подавляющего большинства орфанных болезней [2–4].
Вы читаете статью из спецпроекта, рассказывающего о специфике орфанных заболеваний и причинах их выделения в особую группу. Подробно мы рассказывали об этом в первой публикации серии: «Редко, но метко: орфанные заболевания как вызов современной медицине» [5].
Орфанные заболевания часто обладают разрозненной и нетипичной симптоматикой. Затронутые гены могут участвовать в самых разнообразных процессах в организме [5], а значит, может нарушаться работа нервной системы, органов чувств, мышц, почек; затрагиваться иммунная система, состояние костей, самые разные компоненты метаболизма... — причем многое из этого может происходить даже в контексте одного-единственного заболевания. Если болезнь затрагивает периферическую нервную систему, скелетные мышцы или место их контакта, говорят о нервно-мышечных патологиях [3], которые, как правило, приводят к мышечной слабости и атрофии мышц, хотя и разными путями.
- Когда мишенью болезни становятся двигательные (моторные) нейроны, говорят о нейромоторных заболеваниях (см. врезку), в результате которых нервный сигнал до мышц попросту не доходит. В результате человек испытывает трудности с движением, нарастающие вплоть до фатального исхода. Как правило, он связан с нарушениями дыхания и работы сердца — ведь те также зависят от мышц [3].
- Если же мышцы поражаются напрямую, речь идет о миодистрофиях, одной из которых и посвящена эта статья.
По материалам этой статьи мы выпустили вместе с компанией «Артген биотех» ролик про миодистрофию Дюшенна. В нем Елизавета Мусатова, врач-генетик и медицинский директор компании Genetico, рассказывает об этой болезни — посмотрите, прежде чем продолжить чтение!
История изучения миодистрофий
Говоря об истории исследований миодистрофии Дюшенна, мы не можем обойтись одной или парой фамилий и единственной датой (как это часто бывает с орфанными болезнями). Цепочка событий, благодаря которым миодистрофию детально охарактеризовали, растянулась на полтора столетия и связана с целым рядом имен врачей и пациентов [8].
Вероятнее всего, первое упоминание болезни относится к 1830 г. и связано с именем английского хирурга, анатома и физиолога Чарльза Белла. Тот отметил характерные поражения скелетных мышц у 18-летнего пациента, который заболел в возрасте 10 лет; но тогда врач, похоже, не смог верно понять, с чем именно имеет дело. Четыре года спустя итальянец Джованни Семмола рассмотрел случаи двух мальчиков с характерной гипертрофией отдельных мышц. Он уже счел именно ее первичной для развития заболевания. Следом в 1836 г. другой итальянский врач Гаэтано Конте вместе со своим коллегой Л. Джойа опубликовал собственное описание очень похожей миодистрофии. Однако тогда их работа не привлекла особого внимания, поскольку многие их коллеги сочли, что речь просто о новой форме туберкулеза — многоликой инфекции, которая была широко распространена в те времена [9].
А в 1851 г. британец Эдвард Мерион уже очень основательно взялся за изучение этой мышечной патологии [10]. Он детально охарактеризовал симптомы, сделал предположение о наследовании болезни — и даже с помощью микроскопа выяснил, что причина связана с изменениями клеточной мембраны и что первичны именно проблемы с мышцами. Таким образом, именно этого врача можно считать основоположником систематических и признанных медицинским сообществом работ по миодистрофии Дюшенна — и неудивительно, что поначалу болезнь носила именно имя Мериона [9–11].

Рисунок 1. Гийом Бенжамен Арман Дюшенн (1806–1875) — французский врач, невролог, крупный исследователь в области электрофизиологии и «отец электротерапии». Наряду с другими исследователями, внес большой вклад в описание новой формы миодистрофии, которая сейчас носит его имя. Основным научным интересом Дюшенна были медицинские приложения электричества: он действовал электродами на лицевые мышцы живых людей и покойников и описывал их мышечные сокращения.
Сам же Гийом Дюшенн (рис. 1), известный невролог из Франции, описал свой первый клинический случай мышечной дистрофии лишь в 1861 г., но был необычайно плодовит и систематичен. К 1868 г. он представил уже целых 13 известных ему случаев этой болезни и подробно ее охарактеризовал, в том числе с помощью методов гистологии и одного очень необычного подхода — электрической стимуляции нервов и мышц. Помимо исследования миодистрофии, Дюшенн использовал электроды на испытуемых для изучения механики сокращения мимических мышц — их гримасы врач тщательно фиксировал с помощью фотоаппарата. Любопытно, что позднее фото Дюшенна вдохновили самого Чарльза Дарвина, который в свое время рассмотрел проблему эмоций с позиций натуралиста в своей книге «Выражение эмоций у животных и человека» [10], [12]. В итоге лавры достались главным образом именно французу, и сейчас мы знаем эту болезнь как «миодистрофия Дюшенна».
Немецкий врач Петер Эмиль Беккер — новое действующее лицо в этой истории миодистрофии — появился в ней намного позже, в 1955 г., когда описал более мягкую форму той же мышечной дистрофии. Миодистрофия Беккера, как правило, начинается позже, протекает легче и не сильно сокращает продолжительность жизни, при этом очень близка к миодистрофии Дюшенна как по проявлениям, так и по генетической причине. Поэтому иногда говорят не о двух похожих, а об одном заболевании — миодистрофии Дюшенна—Беккера.
Но не только врачи вписали заболевание в историю. Среди тысяч пациентов, которым не посчастливилось родиться с миодистрофией Дюшенна, есть и довольно известные. Скажем, Альфредо Феррари (1932–1956) — сын Энцо Феррари, знаменитого конструктора автомобилей и основателя одной из крупнейших компаний по их производству. Сам Альфредо, несмотря на недуг, тоже был весьма одаренным человеком и разработал новый двигатель для компании отца, но, увы, так и не успел увидеть его в действии, поскольку болезнь забрала его в совсем юные 24 года. Американский рэпер Дариус Вимс прожил всего 27 лет, зато прожил их очень ярко и успел запомниться многим своим музыкальным талантом, а заодно привлечь внимание к миодистрофии Дюшенна, рано лишившей его способности ходить. Документальный фильм 2006 г. «Дариус отправляется на Запад» (Darius Goes West) посвящен путешествию в Лос-Анджелес длиной 7 тысяч километров, благодаря которому музыкант попал на MTV и «прокачал» свое инвалидное кресло.
Другой вдохновляющий пример — Брайсон Фостер, который родился в 2000 г. и получил диагноз «миодистрофия Дюшенна» в пятилетнем возрасте. А в 9 лет он уже впервые принял участие в собрании Ассоциации мышечных дистрофий (Muscular Dystrophy Association) и обратился там к аудитории врачей и исследователей. С тех пор Брайсон стал принимать участие в публичных обсуждениях проблемы миодистрофии Дюшенна, благотворительном сборе средств — и даже работать актером озвучания.
Подводя итог исторической части, стоит упомянуть современное положение миодистрофий Дюшенна и Беккера в Международной классификации болезней (МКБ, ICD). Десятый пересмотр (МКБ-10) присвоил этим тесно связанным болезням общий код — G71.01. Это соответствует секции G (заболевания нервной системы), группе нарушений нервно-мышечных синапсов и мышц (G70-73), а точнее — первично-мышечным расстройствам (G71).
Новый, одиннадцатый пересмотр МКБ (ICD-11) отвел заболеваниям нервной системы раздел 8, где подраздел 8C посвящен первичным нарушениям работы мышц. В нем мы и встретим знакомые нам миодистрофии, на сей раз по отдельности друг от друга с двумя соседними кодами: 8C70.0 — это мышечная дистрофия Беккера, 8C70.1 — мышечная дистрофия Дюшенна.
Кто и как болеет миодистрофией Дюшенна?
Эпидемиология
Данные о распространенности миодистрофии Дюшенна разнятся, но, согласно новым оценкам, в мировом масштабе она составляет 4,8 заболевших на 100 000 популяции. При этом доля людей с более легкой миодистрофией Беккера втрое меньше — 1,6. Это значение отличается также и в разных странах: распространенность этой миодистрофии максимальна в Новом Свете (5,1 человек на 100 000), а в Африке — втрое меньше. Согласно оценке российских ученых, в РФ проживает около 4000 пациентов с диагнозом «миодистрофия Дюшенна» [13], [14].
«Виновником» развития болезни является единственный ген DMD, который кодирует белок дистрофин. DMD локализован на половой X-хромосоме и наследуется по X-сцепленному рецессивному механизму: только от матери, а проявляется у сыновей — ведь у них нет «здоровой» Х-хромосомы, что могла бы функционально компенсировать поломку. В двух из трех случев мутации гена наследуются, но нередко также возникают de novo [13].
Женщины тоже могут иметь «поломку» гена DMD, однако с ними это случается примерно в 10 000 раз реже, чем с мальчиками или мужчинами. К тому же у лиц женского пола болезнь протекает намного легче при похожих симптомах, хотя тяжесть и время манифестации зависят от паттернов инактивации X-хромосомы (лайонизации) — как известно, у женщин с их двумя X-хромосомами одна всегда инактивирована, а вот какая именно — зависит от конкретной клетки [13], [15].
Как правило, миодистрофия Дюшенна проявляется в раннем детском возрасте: средний возраст диагностирования заболевания в семьях без семейного анамнеза — 4 года 10 месяцев [16], [17]. «Красными флажками» для беспокойства родителей оказываются задержка формирования навыков сидеть, вставать на ноги и поддерживать вертикальное положение, затем — трудности при ходьбе, беге и подъеме по лестнице (рис. 2). По мере прогрессирования миодистрофии мышцы маленьких пациентов становятся всё слабее. Обычно уже к 12 годам они прикованы к инвалидному креслу и, как правило, не доживают до своего 20-го дня рождения. Самыми распространенными причинами смерти становятся нарушения дыхания и сердечная недостаточность, вызванная кардиомиопатией [15], [18].
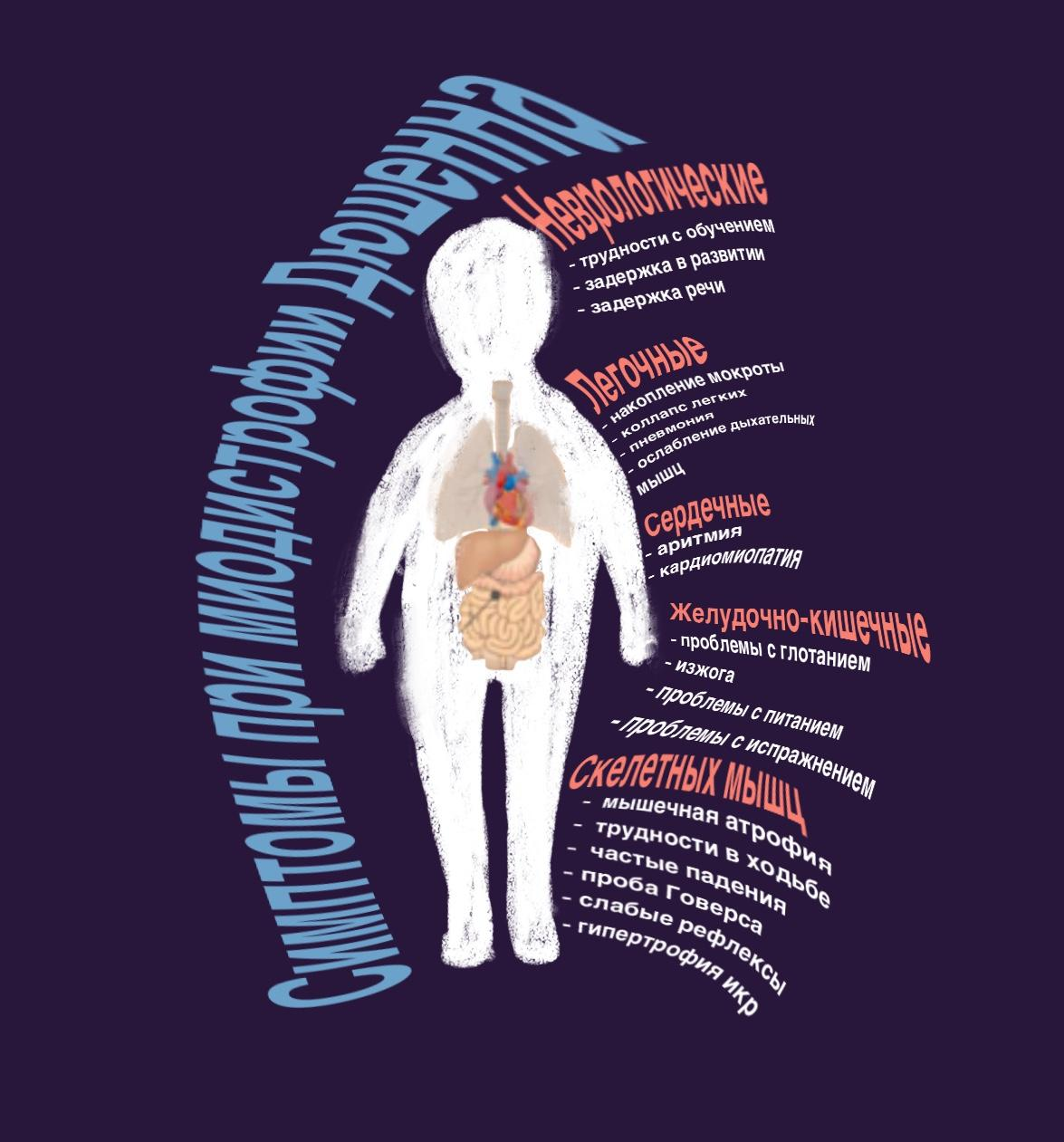
Рисунок 2. Симптомы миодистрофии Дюшенна. По мере прогрессирования заболевания отмечают сначала изменения состояния скелетных мышц, их замещение рубцом и жировой тканью, затем утрату способности к самостоятельному передвижению. На поздних стадиях болезнь нарушает работу сердца и дыхания — именно это чаще всего приводит к летальному исходу.
иллюстрация Валерии Кузык по [19]
Стадии болезни
Болезнь постепенно усиливается, закономерно проходя пять клинических стадий.
На доклинической заметных симптомов еще нет, хотя врач может подметить первые отклонения в речи и движении ребенка.

Рисунок 3. Положительная проба Говерса. Миодистрофия Дюшенна начинает сказываться на движении ребенка с самого раннего возраста. Первыми страдают мышцы ног, затем — таза и туловища. Это приводит к узнаваемым слабости мышц и изменениям манеры ходить — появляется «утиная» (переваливающаяся) походка, ребенок передвигается с широко расставленными ногами или на носочках. Уже в самом начале болезни невролог может отметить симптом Говерса: когда мальчика просят встать из положения лежа на полу, он вынужден при этом опираться руками на колени.
На ранней амбулаторной стадии начинается отставание в психомоторном развитии: ребенок позже начинает держать голову, ходить и бегать, ему трудно подниматься по лестнице. Он то и дело спотыкается и падает, с трудом прыгает. Появляется симптом Говерса, который говорит о слабости мышц таза и бедер (рис. 3).
В это же время его икроножные мышцы начинают выглядеть симметрично «гипертрофированными». Однако на самом деле о росте мышечной массы, увы, речи не идет — мускулы просто постепенно замещаются соединительной и жировой тканью: это называется «псевдогипертрофией». Иногда она также затрагивает дельтовидные и ягодичные мышцы.
От миодистрофии первыми обычно страдают мышцы нижних конечностей (начиная с проксимальной части — той, что ближе к туловищу), мышцы таза, затем скелетные мышцы верхней части тела, после чего — дыхательная мускулатура и сердце.
На поздней амбулаторной стадии проблемы с движением нарастают. Происходят укорочение пяточного сухожилия и разворот таза вперед из-за слабости мышц туловища. Усиливается гиперлордоз (изгиб позвоночника вперед) в области груди и поясницы.
Далее следует ранняя неамбулаторная стадия миодистрофии Дюшенна. Ребенок еще может перемещаться на 10 метров и поддерживать себя в вертикальном положении, однако уже нуждается в инвалидном кресле. Мышцы плечевого пояса теряют силу, появляются характерные «крыловидные лопатки». Ребенок всё меньше двигается и потому теряет подвижность во многих суставах: голеностопных, коленных, тазобедренных, локтевых, а также мелких суставах кисти. Начинаются самые тревожные и опасные проблемы с дыханием и сердечно-сосудистой системой.
На поздней неамбулаторной стадии атрофия мышц приобретает тяжелый характер. Пациент уже не в силах поддерживать позу тела, осложнения становятся всё тяжелее — и на этой стадии могут привести к летальному исходу.
В классическом случае миодистрофия Дюшенна начинается в возрасте 3–5 лет и приводит к потере способности ходить к 11–12 годам. Однако известен и другой, более тяжелый и быстро прогрессирующий вариант миодистрофии Дюшенна. Он начинается в 2–3 года и приводит к тяжелой умственной отсталости; в этом случае МДД можно спутать с детским церебральным параличом. К 6–7 годам ребенок уже не может самостоятельно перемещаться, и в 15–18 лет следует летальный исход. Пациенты с миодистрофией Дюшенна зачастую имеют те или иные психические расстройства (в 24% случаев) и признаки депрессии (32,5%). Тревожность отмечают у всех людей с этим диагнозом, к тому же у них чаще диагностируют шизофрению, эпилепсию и невроз. Возможно, это связано с тем, что ген DMD активен в нервной системе и играет в ее работе существенную, но не вполне ясную роль [19].
Самое тяжелое осложнение МДД — это, конечно, кардиомиопатия (нарушения работы мышц сердца). Она заведомо не связана с развитием ишемии и поначалу вызвана повышением жесткости камер сердца (рестриктивная), затем развивается дилатационная кардиомиопатия (сердце увеличивается в размерах).
Развивается также дыхательная недостаточность: она связана с ограничением способности легких к расширению и сокращению из-за нарушения работы дыхательной мускулатуры; в результате вдох становится всё менее глубоким. На поздних стадиях болезни все пациенты нуждаются в вентиляции легких [20], [21].
Зачастую пациенты гибнут от воспаления легких, начинающегося из-за попадания в легкие посторонних частиц — так называемая аспирационная пневмония. Но летальный исход могут вызвать и острый респираторный дистресс-синдром после нагрузки, и вызванные даже небольшой травмой прекращение дыхания или сердцебиения, и одновременный отказ многих органов [20].
В целом, прогноз заболевания неблагоприятный: оно по-прежнему остается неизлечимым и смертельным. Медианные значения ожидаемой продолжительности жизни пациентов с миодистрофией Дюшенна без использования искусственной вентиляции легких — примерно 14,4–27 лет, а с ней — 21–39,6. В то же время, стоит отметить, что эти значения значительно увеличились в последние десятилетия. Так, в 1980-е гг. до 20-летнего возраста доживали лишь 23,3% пациентов с МДД, в 1990-е годы — уже 54%, а к 2000-м — 59,8% [21], [22].
Диагностика
Как и в случае со многими орфанными болезнями, диагностика миодистрофии Дюшенна довольно запутанна и сложна. Это связано в том числе с отсутствием нужного опыта у врачей «на местах» и сходством симптомов нервно-мышечных заболеваний. «Золотым стандартом» диагностики этой болезни считают генетическое тестирование и биопсию мышц. В последнем случае небольшой кусочек мышечной ткани окрашивают с помощью антител к дистрофину, что помогает обнаружить белок визуально. Если белка почти нет, то диагноз «миодистрофия Дюшенна» достоверно подтверждается. Небольшое же количество дистрофина в мышечной ткани характерно для лиц мужского пола с миодистрофией Беккера или женщин, имеющих мутации DMD. Однако помимо них доступен целый ряд других тестов. Они не всегда указывают на заболевание однозначно, но могут поставить врача на правильный путь и имеют свои преимущества.
Например, биохимический анализ крови ребенка может выявить повышенную активность креатинфосфокиназы (КФК) — фермента, играющего важную роль в метаболизме мышц, — что указывает на их разрушение. Концентрация КФК у пациентов с миодистрофией Дюшенна может быть повышена в 11 или более раз, но любопытно, что на поздних стадиях болезни она возвращается к нормальным или даже пониженным значениям — ведь разрушающихся мышц (как и мышц в целом) становится всё меньше, и КФК выделяться просто не из чего... Но КФК может несколько повышаться и у здоровых людей, так что этот показатель не слишком специфичен [20]. Поэтому исследователи предлагают рассматривать одновременно целую совокупность сывороточных биомаркеров (матриксной металлопротеиназы-9, тканевого ингибитора металлопротеиназы, остеопонтина) [20].
Для диагностики МДД полезны и инструментальные методы (УЗИ, МРТ) — к сожалению, пока их применяют нечасто, несмотря на некоторые преимущества. Опыт показал, что они эффективны у маленьких пациентов, а также неивазивны и потому гораздо лучше переносятся детьми по сравнению с биопсией. МРТ мышц поможет увидеть, насколько их уже заменила жировая ткань, а также заметить характерный для ранних стадий МДД отек.
Другой неинвазивный метод — волновая эластография. Это ультразвуковая визуализация, которая оценивает деформацию и сжимаемость ткани при наложении внешней силы, что позволяет судить об их механической жесткости. При этом по точности эластография превосходит МРТ [20].
И всё же сейчас решающее значение при диагностике миодистрофии Дюшенна имеет именно генетическая диагностика, поскольку она позволяет обнаружить первопричину болезни — мутации в гене DMD. Точность современной генетической диагностики составляет около 95% [13], а стоимость в сравнении с другими орфанными болезнями умеренная. В случае, если мы обратимся в одну из самых крупных сетей лабораторной диагностики в России, цена вопроса составит около 8000 рублей.
Стандартный подход к генетической диагностике миодистрофии Дюшенна (как и Беккера) предполагает выявление первым делом крупных мутаций, а затем — более мелких мутаций с помощью двух или более разных методов. Это могут быть мультиплексная ПЦР [23], мультиплексная амплификация лигированных зондов, сравнительная геномная гибридизация, секвенирование по Сэнгеру на основе ПЦР [24] и т.д.
Развитие NGS [24] резко улучшило качество и скорость секвенирования ДНК и сделало возможным скрининг сразу множества мутаций заболевшего (или бессимптомного носителя) за одну процедуру. Более того, открытие внеклеточной фетальной ДНК в плазме крови беременной женщины открывает возможности в будущем для неинвазивной пренатальной диагностики миодистрофий Дюшенна и Беккера. Профилактика новых случаев миодистрофий возможна благодаря изучению семейной истории и генетического консультирования [25].
Большая потеря большого гена: патогенез миодистрофии Дюшенна
Миодистрофии Дюшенна и Беккера — моногенные заболевания. Все разнообразные патологические изменения при этом вызваны мутациями в единственном гене дистрофина DMD. В случае миодистрофии Дюшенна его белковый продукт не синтезируется вовсе, а при миодистрофии Беккера от дистрофина получается только фрагмент. Этот белок жизненно важен для мышц, а кодирующий его DMD — это очень большой ген с не меньшим значением, поэтому их стоит обсудить в деталях [1].
Что представляет из себя этот «особо важный» мышечный белок? Полноразмерный дистрофин состоит из 3685 аминокислотных остатков (это очень много!), имеет молекулярную массу 427 кДа и включает четыре домена: N-концевой (или актинсвязывающий) домен; состоящий из спектриноподобных повторов, длинный стержневой домен (содержит 24 таких повтора R1—R24 и четыре петли); богатый цистеином домен CR; и уникальный C-концевой домен (рис. 4, 5). Огромен и кодирующий дистрофин ген — подробности во врезке ниже.
Дистрофин выполняет функцию «якорной цепи» (рис. 4). Его N-конец крепится к актиновому цитоскелету внутри клетки, а C-концевая часть — к внеклеточному матриксу («заякориваясь» через трансмембранные белки) [28]. Помимо этих двух «якорей» на концах, дистрофин также взаимодействует с сарколеммой, ионными каналами, белками клеточной сигнализации, скаффолд-белками и даже таким белком, как мю-NO-синтаза (nNOSμ), участвующем в регуляции кровотока в мышцах, их сокращении и метаболизме глюкозы путем местного выделения в окружающие сосуды оксида азота NO — ключевого фактора вазодилатации [27], [29].
Все эти «нанизывающиеся» на дистрофин белки образуют особый дистрофиновый комплекс (dystrophin-associated protein complex, DAPC; также известный как dystrophin glycoprotein complex, DGC), участвующий в целом ряде процессов в клетке — см. рис. 4. DAPC наряду с комплексом интегрина—винкулина—талина формирует костамеры — структурные единицы поперечно-полосатого мышечного волокна. Комплексы DAPC отличаются от клетки к клетке и нередко содержат разные изоформы дистрофина. Более того, отличные друг от друга комплексы можно обнаружить даже в одном и том же миоците. DAPC играют важную роль во внутриклеточной сигнализации и поддержании механических свойств клетки, обеспечивают структуру миоцитов и их способность к сокращению [29].
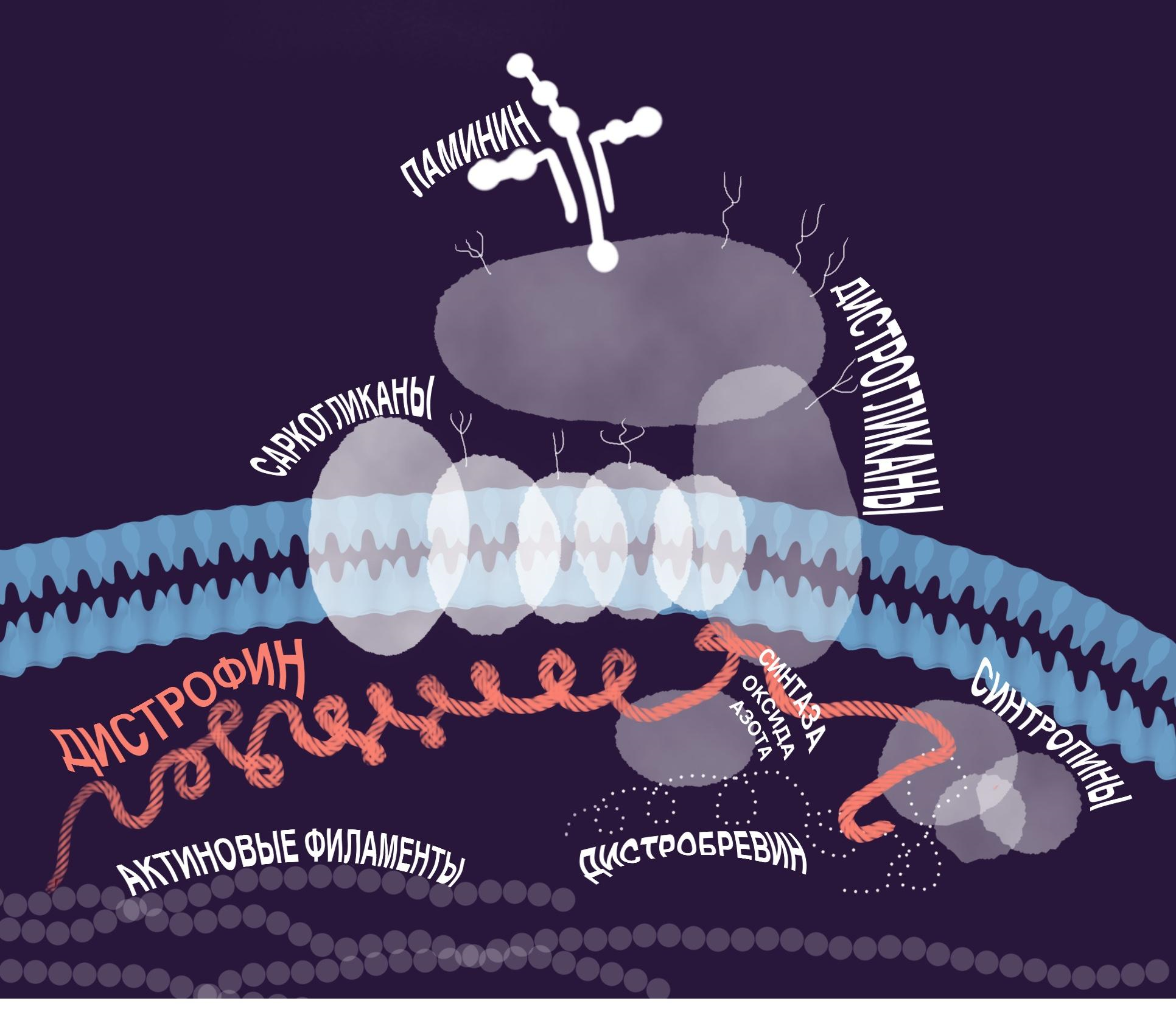
Рисунок 4. Дистрофин — крупный белок, кодируемый огромным геном DMD. Значение дистрофина под стать размеру: он выполняет в клетке множество функций и связывается с многими другими молекулами. Дистрофин подобен якорной цепи, и длина его образована длинным доменом из спектриновых повторов. На каждом конце у «цепи» по «якорю»: N-конец заякорен на актиновый цитоскелет внутри клетки, а C-конец — на трансмембранном комплексе, связывающем всё это с внеклеточным матриксом. Комплекс этот носит название DAPC и имеет большое значение для структуры мышечного волокна, а также регуляции многих процессов в клетке. Стоит ли удивляться, что выпадение ключевого компонента DAPC — дистрофина — нарушает все сложные взаимодействия с его участием? Дестабилизируется и меняется цитоскелет, нарушается работа многих мембранных белков, которые взаимодействуют с этим комплексом, развивается окислительный стресс и патология кальциевой сигнализации. В итоге мышечные клетки всё быстрее погибают и всё хуже восстанавливаются.
Дистрофиновый комплекс DAPC довольно сложен: помимо самого дистрофина, в него входят цитоплазматические белки α1- и β1-синтропины, α-дистробревин и нейрональная NO-синтаза (nNOS); трансмембранные β-дистрогликан, α-, β-, γ- и δ-саркогликаны и саркомпан; а также внеклеточные — α-дистрогликан и ламинин-2. По названиям нетрудно догадаться, что среди них есть гликопротеины, поэтому DAPC также известен как гликопротеиновый комплекс дистрофина.
иллюстрация Валерии Кузык по Exon Skipping и [29].
Потеря или мутации дистрофина из-за МДД серьезно нарушает структуру DAPC: ведь всем этим многочисленным белкам уже не на что «заякориваться». В результате в клетке начинается сразу множество неполадок: разрушается цитоскелет, возникают окислительный стресс и воспаление (из-за изменения работы регуляторных белков), сарколемма теряет стабильность, нарушается кальциевый гомеостаз... — причем все эти процессы усугубляют друг друга и нарастают со временем. Обо всем этом подробнее мы расскажем ниже.
Мутации в дистрофине
Раз ген настолько велик, неудивительно, что в нем может появляться очень много мутаций. Сейчас их известно около 4700, причем они распределены по гену очень неравномерно; чаще всего встречаются немногочисленные мажорные мутации. Это, прежде всего, крупные делеции или дупликации , затрагивающие сразу несколько экзонов. Мутации встречаются по всему гену, но чаще всего в «горячих точках»: на 5’-конце гена (экзоны 2–19) и в N-концевой половине кодирующей стержневой домен области гена (экзоны 44–53).
Однако в 20–30% случаев развитие миодистрофий Дюшенна и Беккера может быть связано и с точечными мутациями, в том числе миссенс- (0,4%), нонсенс- (10,2%) и затрагивающими сайт сплайсинга мутациями (2,8%), а также небольшими инсерциями или делециями (6,9%). Менее 1% пациентов имеют глубокие интронные мутации, сильно влияющие на сплайсинг. При этом спектр мутаций в разных популяциях сильно варьирует в зависимости от этнического происхождения [14].
Не все мутации оказывают одинаковый эффект — разные изменения последовательности гена DMD нарушают структуру белка по-разному и приводят к миодистрофии разной тяжести. Миодистрофия Дюшенна возникает в случае мутаций со сдвигом рамки считывания и появления преждевременного стоп-кодона — такой ген не пригоден для синтеза функционального белка. А вот при миодистрофии Беккера рамка считывания сохраняется, и полученный дистрофин отчасти имеет нормальную структуру и более-менее выполняет свои функции. Именно поэтому такая форма болезни протекает намного легче [26], [28].
Например, у одного из изученных пациентов с миодистрофией Беккера выпала почти половина (46%) последовательности DMD — делеция затронула центральную часть стержневого домена дистрофина (рис. 5). На четвертом десятке лет он страдал от мышечной слабости, но передвигался самостоятельно (хотя и опираясь на трость) даже после 60. В целом, такие пациенты вполне способны ходить в возрасте 30–40 лет. При этом связь тяжести миодистрофии Беккера с тем, какая именно часть гена DMD потеряна, еще не до конца понятна.
Если ген сохранил области, кодирующие наиболее важные для функционирования белка домены 1 и 3–4, но утратил многие из спектриноподобных повторов домена 2, экспрессируемый с него белок называют мини-дистрофином (рис. 5). Если же таких повторов осталось всего несколько (или даже один), то это уже микро-дистрофин. Оба эти белка, связанные с не слишком тяжелым течением миодистрофии Беккера, легли в основу метода генетической терапии миодистрофии Дюшенна — он призван заменить полностью утраченный при МДД в этом случае дистрофин и «превратить» одну миодистрофию в другую (ту, что полегче) [28].

Рисунок 5. Доменная организация полноразмерного, мини- и микро-дистрофина, а также родственного белка утрофина. Выпадение отдельных экзонов гена DMD приводит к синтезу фрагмента белка: как правило, утрачиваются спектриновые повторы, иногда почти все. А еще в клетках синтезируется родственный дистрофину белок утрофин, который мог бы отчасти брать на себя роль утраченного дистрофина. О том, какие надежды возлагают на это исследователи, читайте ближе к концу статьи.
иллюстрация Валерии Кузык по [27]
Итак, к каким же именно молекулярным последствиям приводят мутации дистрофина или даже полная его потеря? В дальнейших подглавах этого раздела мы разберем всё в деталях, но вот основное (рис. 6):

Рисунок 6. Основные механизмы, за счет которых отсутствие единственного белка (дистрофина) вызывает массированную гибель мышечных клеток и другие патологические изменения.
иллюстрация Валерии Кузык по [27]
- Мутации DMD и нарушение его экспрессии приводят к тому, что дистрофин не может нормально связывать микротрубочки. В результате цитоскелет теряет структуру и разрушается.
- Без дистрофина комплекс DAPC теряет нормальную структуру. γ-актин перестает связывать внеклеточный матрикс, из-за чего мембрана мышечных клеток утрачивает стабильность и легко повреждается при сокращении и под действием активных форм кислорода [28].
- Взаимодействия DAPC с целым рядом ключевых игроков кальциевого гомеостаза нарушает его, при этом особое значение имеют саркоплазматический ретикулум и митохондрии.
- Повреждаются нервно-мышечные синапсы, а определенная популяция клеток — сателлитные (стволовые) клетки мышц — дифференцируется аномально. Как итог, мышцы начинают работать всё хуже, падает темп их регенерации, и заболевание начинает затрагивать внутренние органы.
Окислительный стресс и нестабильность сарколеммы
Большое значение для нормальной работы нейронов имеет nNOSμ — специфическая для этих клеток мю-изоформа NO-синтазы. Однако эта изоформа фермента преобладает еще и в мышцах, где нужна для регуляции их кровоснабжения, метаболизма глюкозы и сократительной функции. Среди множества других функций дистрофина есть и обеспечение правильной клеточной локализации nNOSμ: в норме это сарколемма миоцитов скелетных мышц. Чтобы nNOSμ там и оставалась, необходим дистрофин, сохранивший 16-й и 17-й спектриноподобные повторы, куда и крепится фермент . В этом случае при длительном сокращении мышцы nNOSμ имеет возможность выделять в кровеносные сосуды мышц NO — важный медиатор расширения сосудов.
Кстати, для верного расположения этого фермента также требуется и другой белок — α-синтропин.
Однако если дистрофин отсутствует (при МДД) или лишен области R16—R17 (некоторые случаи миодистрофии Беккера), nNOSμ «переезжает» с сарколеммы в саркоплазму. Там фермент теряет стабильность и быстро разрушается, общая активность NO-синтаз в клетке падает, как и способность сосудов мышц к дилатации — это приводит к их ишемическим повреждениям. Помимо этого, саркоплазматическая nNOSμ вызывает взаимное усиление токсических эффектов NO и супероксидов, как следствие — некроз клеток.
Кстати о супероксидах. Их генерирует NADPH-оксидаза 2 (NOX2) — в норме ее продукты нужны нейтрофилам и макрофагам, чтобы убивать микробов. Однако NOX2 — это еще и главный источник свободных радикалов в мышце, и без дистрофина ее работа нарушается в связи с неправильным ростом микротрубочек.
В норме механическое растяжение мышцы активирует NOX2 и усиливает генерацию АФК. Однако при миодистрофии Дюшенна (когда дистрофин отсутствует) этот процесс идет чересчур активно, а аутофагия, наоборот, подавляется, да еще и нарушается образование лизосом [27]. В итоге миоциты повреждаются изнутри, «захламляются» продуктами обмена веществ и вместо нормальной замены новыми путем аутофагии уходят в апоптоз — и это ведет к снижению мышечной массы.
Нарушение кальциевого гомеостаза
Комплекс DAPC взаимодействует с целой плеядой молекул, участвующих в кальциевой сигнализации и регуляции уровня этого иона в клетке. Это активируемые растяжением (механочувствительные) кальциевые каналы, депо-управляемые кальциевые каналы и кальциевая АТФаза плазматической мембраны. Кроме этого, DAPC также связывается с натрий-кальциевым обменником NCX через кальмодулин.
Нарушения структуры дистрофинового комплекса при миодистрофии Дюшенна и тут всё портят. Из-за них поток кальция через ионные каналы и NCX усиливается, а его концентрация в цитоплазме миоцитов растет. Всё это нарушает метаболизм кальция в клетке, причем особую роль в этом играет саркоплазматический ретикулум.
В условиях окислительного стресса и нарушенной клеточной сигнализации — как при МДД — рианодиновые рецепторы нитрозилируются и фосфорилируются, из-за чего кальций «подтекает» из саркоплазматического ретикулума и вызывает повреждения мышцы. Постоянное повышение концентрации Ca2+ в цитоплазме патологически активирует кальций-зависимые ферменты, в том числе фосфолипазу А2 и кальпаины. К тому же митохондрии — важное депо кальция — страдают от «перегрузки» этим ионом. В итоге кальпаины начинают разрушать различные белки, а фосфолипаза A2 расщепляет фосфолипиды митохондрий и других мембранных структур, лишь раскручивая маховик окислительного стресса и увеличивая разрушения.
В норме митохондрии способны временно хранить в себе избыток кальция, поступающего из саркоплазматического ретикулума. Однако возможности этих маленьких органелл не безграничны. При «кальциевом аврале» повышается проницаемость их внутренней мембраны: образуются поры, из-за которых эти органеллы деполяризуются и всё хуже синтезируют АТФ. В итоге из-за повреждения мембраны и патологической активности ионных каналов кальций «хлещет» и из самих митохондрий. Работает принцип «порочного круга»: попавший из них в цитоплазму кальций еще больше угнетает состояние этих органелл. Миоциты, в которых это происходит, ожидает апоптоз, что для пациента означает нарушение работы мышц и внутренних органов [27].
Нарушения работы нервно-мышечных синапсов
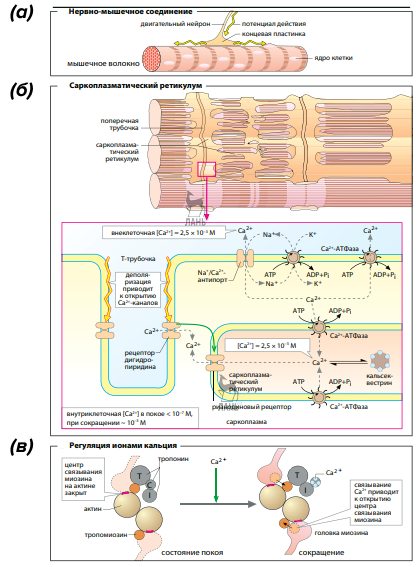
Рисунок 7. Напоминаем вместе с «Наглядной биохимией» молекулярные основы мышечного сокращения в норме.
(а) Для того, чтобы мышечное волокно (миоцит) начало сокращаться, оно должно получить соответствующий «приказ» от нервной клетки, а точнее — от двигательного нейрона. Для этого служит нервно-мышечный синапс, который образован этими двумя клетками и «упакован» снаружи шванновской клеткой.
(б) Такой синапс использует нейромедиатор ацетилхолин, диффундирующий через синаптическую щель и связываемый ацетилхолиновыми рецепторами никотинового типа на плазматической мембране мышечной клетки (сарколемме). Это активирует трансмембранные ионные каналы, которые впускают в клетку ионы натрия — т.е. создают потенциал действия на сарколемме. Контактирующий с миоцитом кончик нейрона — концевая пластинка — распространяет потенциал действия во всех направлениях, тем самым стимулируя мышечные волокна. Их сократительному аппарату нужно всего несколько миллисекунд, чтобы запустить сокращение мышцы.
Поступивший в нервно-мышечный синапс потенциал действия вызывает увеличение концентрации ионов кальция в цитоплазме мышечных клеток (саркоплазме). В покое она содержит очень мало ионов кальция (10-7 моль/л), при этом в саркоплазматическом ретикулуме миоцитов (специфичной для них форме ЭПР) их в 10 000 раз больше. Саркоплазматический ретикулум — это большая разветвленная органелла, которая окружает миофибриллы мышечных волокон, большие запасы ионов кальция в которой создает специальная АТФаза SERCA. Также саркоплазматический ретикулум содержит белок кальсеквестрин, связывающий за счет отрицательно заряженных остатков аминокислот по несколько ионов кальция разом.
Передачу потенциала действия на саркоплазматический ретикулум обеспечивают поперечные трубочки (Т-трубочки), которые открываются во внеклеточное пространство и соединяют его с этой органеллой. Изменение мембранного потенциала запускает кальциевые каналы Т-трубочек (а именно, их дигидропиридиновые рецепторы, DHPR), которые, в свою очередь, активируют рианодиновые рецепторы саркоплазматического ретикулума (RyR). RyR — это тоже кальциевые каналы, которые запускает механический контакт с DHPR или связывание кальция либо каких-то вторичных мессенджеров. Ионы кальция покидают саркоплазматический ретикулум и переходят в саркоплазму, где их концентрация быстро растет — это и вызывает сокращение миофибрилл.
Расслабление мышц начинается при снижении концентрации кальция до значения 10–6 моль/л. Это обеспечивает АТФ-зависимый кальциевый насос, выкачивающий эти ионы в саркоплазматический ретикулум или за пределы миоцита. В этом ему также помогает система Na+/Ca2+. Все эти процессы, разумеется, идут с затратой энергии и «стоят» немало АТФ.
(в) Регуляция мышечного сокращения ионами кальция. В покое в скелетной мышце связывание тропонина (субъединицы Т, С, I) с тропомиозином препятствует взаимодействию миозиновых головок с актином. Быстрый рост концентрации ионов кальция в цитоплазме из-за открывания каналов саркоплазматического ретикулума приводит к связыванию кальция с С-субъединицей тропонина. Это вызывает конформационную перестройку в тропонине, разрушению тропонин-тропомиозинового комплекса и освобождению связывающего миозин участка на молекуле актина — так начинается цикл мышечного сокращения.
Нервно-мышечный синапс необходим для передачи нервного импульса к мышце, которая реагирует на него сокращением. Он формируется на месте контакта терминали мотонейрона и концевой пластинки мышечного волокна и «обернут» шванновской клеткой. Такой синапс использует в качестве нейромедиатора ацетилхолин [31], спонтанное высвобождение небольшого количества которого в синаптическую щель создает так называемый миниатюрный потенциал концевой пластинки. А если высвободится разом содержимое множества везикул нейромедиатора, произойдет уже значительная постсинаптическая деполяризация — это полноценный потенциал концевой пластинки мышечного волокна. Итак, успешная передача возбуждения на мышечную клетку произошла (рис. 7).
Миодистрофия Дюшенна нарушает работу и нервно-мышечных синапсов. В миоцитах заболевшего величина потенциала концевой пластинки не может достигнуть порогового значения, нужного для деполяризации сарколеммы. Из-за этого передача сигнала в нервно-мышечном синапсе нарушается, а мышцы слабеют и перестают нормально работать.
Из-за отсутствия одного из компонентов DAPC — дистрогликана — комплекс в целом не может связывать агрин. Это крупный протеогликан, нужный для формирования кластеров ацетилхолиновых рецепторов в ходе синаптогенеза и формирования нервно-мышечных синапсов. Поэтому при миодистрофии Дюшенна эти процессы также нарушены [27].
Нарушение дифференциации мышечных стволовых клеток
Миодистрофия Дюшенна приводит не только к разрушению имеющихся мышечных клеток, но и препятствует их восстановлению за счет специальных стволовых клеток. Речь о миосателлитах или сателлитных мышечных клетках (muscle satellite stem cells, MuSC), которые находятся непосредственно в мышцах и необходимы для их роста.
Обычно сателлитные клетки покоятся, однако если мышечное волокно повредить или если оно начнет выделять факторы роста, эти стволовые клетки активируются, начинают быстро делиться, мигрировать и порождать новые миоциты. Популяции MuSC гетерогенны: среди них есть как стволовые клетки, так и предшественницы мышечных клеток, уже вступившие на путь дифференциации. Сателлитные клетки должны обновлять собственный запас и создавать приступившие к дифференциации клетки. Для этого MuSC проходят асимметричное деление — митоз, порождающий одну клетку стволовой, а другую — предшественницей мышечной. Так вот, для асимметричного митоза MuSC требуется опять-таки исправный дистрофиновый комплекс DAPC. А поскольку структура его при миодистрофии Дюшенна нарушена, у заболевших возникает еще одна проблема — с сателлитными мышечными клетками и регенерацией.
Механизм нарушения асимметричного деления связан с потерей клеткой нормальной способности к поляризации, т. е. приобретению отличающихся друг от друга областей, благодаря которым «потомки» клетки тоже не идентичны. В регуляции клеточной поляризации участвует сериновая/треониновая протеинкиназа MARK2. Отсутствие дистрофина и здесь всё портит: без него экспрессия MARK2 снижается. В итоге новых мышечных клеток образуется всё меньше, развивается фиброз мышц, и на их месте образуются жировая и рубцевая ткани.
Помимо проблем со стволовыми клетками, регенерации мышц препятствуют патологические изменения их микроокружения. Среди таких негативных факторов — и избыток АФК, и воспалительный процесс с участием макрофагов (M1 и M2) и цитокинов (TNF-α, TGF-β1): иммунитет работает на рост рубцовой и жировой ткани. Острая иммунная реакция запускает хроническое воспаление, нарушает внутриклеточную сигнализацию и, как водится, происходящие бок о бок патологические процессы усиливают друг друга по принципу положительной обратной связи [27].
Лечить и вылечить: терапия миодистрофии Дюшенна
Сегодня миодистрофии Дюшенна и Беккера всё еще остаются неизлечимыми заболеваниями. Используемые в клинике методы терапии нацелены только на облегчение симптомов. Но, конечно же, ученые и врачи не сидят сложа руки: они неутомимо продолжают поиск этиотропной терапии — такой, которая влияет на причину болезни: дефицит функционального дистрофина [18], [27].
Стремясь облегчить плачевное состояние пациента с МДД, мы можем: а) подействовать на «корень» проблемы, заменив сломанный ген DMD на нормальный или, по крайней мере, отчасти работающий; или б) влиять на вторичные проявления миодистрофии и тем самым притормозить их развитие и смягчить симптомы. Это увеличит и продолжительность жизни, что дает пациентам шанс дотянуть до момента, когда появится этиотропная терапия [18], [27].
Чем располагают врачи сегодня
В современной медицинской практике «золотым стандартом» остаются глюкокортикоиды, которые позволяют несколько улучшить состояние мышц и снизить воспаление, вызванное миодистрофией. Чаще всего используют преднизолон и дефлазакорт, причем второй препарат был создан специально для лечения миодистрофии Дюшенна, а клинические исследования доказали его бóльшую эффективность в сравнении с преднизолоном при МДД. Дефлазакорт особенно повлиял на скорость прогрессирования заболевания и, тем самым, на выживаемость пациентов.
Глюкокортикоиды смягчают симптомы миодистрофии, однако их долговременный прием связан с риском. Дело в том, что они могут вызвать «долгоиграющие» побочные эффекты (набор массы тела, апноэ во сне и т.д.). Ведутся исследования, которые должны установить оптимальный режим дозирования глюкокортикоидов при миодистрофии Дюшенна. При этом список глюкокортикоидов, применяемых при МДД, пополняется: сейчас ожидает патента новый препарат — ваморолон, частичный агонист глюкокортикоидного рецептора NR3C1, уже показавший обнадеживающие результаты для терапии МДД [18], [20].
К сожалению, на фоне длительного приема глюкокортикоидов у пациентов может развиться остеопороз и связанные с ним переломы позвонков и трубчатых костей. Вынужденный малоподвижный образ жизни только усугубляет проблему. При этом повреждения костей могут оставаться незамеченными, что требует пристального внимания врача. Для их своевременной диагностики, а также оценки плотности костной ткани сейчас используют рентгенографию (прежде всего поясничного отдела позвоночника) и исследование минерального состава скелета.
Для терапии остеопороза применяют бисфосфонаты, чаще внутривенно. При этом нарастающие изменения со стороны опорно-двигательной системы необходимо постоянно отслеживать. Деформации ступней и лодыжек могут потребовать хирургической коррекции; то же касается позвоночника. В случае, если угол его искривления из-за сколиоза превышает 20–30 градусов, проводят операцию по фиксации позвонков.
Другой важный метод лечения и поддержки — физиотерапия. Она должна помочь пациентам развивать мышцы, которые страдают больше всего, и замедлить их разрушение (потерю силы и подвижности) — всё это должно улучшить качество жизни пациентов. Такая лечебная физкультура представляет собой ежедневную растяжку, использовании шин и ортопедических устройств. Однако с этим подходом нужно быть осторожным, ведь избыточные и плохо подобранные тренировки могут лишь повредить хрупким мышцам.
При миодистрофии Дюшенна пациенты нуждаются в тщательном контроле состояния легких, ведь нарушения дыхания происходят довольно часто и весьма опасны. С этой целью используют, например, спирометр, позволяющий оценить объем и скорость вдоха. Необходимые меры коррекции состояния легких зависят от стадии заболевания. На амбулаторной стадии жалоб может не быть, но жизненная емкость и другие параметры легких уже ухудшаются. На этой же стадии рекомендуется сделать прививки от вируса гриппа и пневмококка.
На поздних стадиях требуется более строгий контроль за состоянием легких — обследования повторяют каждые полгода. При падении жизненного объема легких до 60% от предсказанного значения требуется повседневное использование устройств для искусственного дыхания. При тяжелом сколиозе, нарушающем дыхательную функцию, может потребоваться операция. Позднее пациенты могут даже нуждаться в использовании особых устройств, помогающих откашляться. Им также следует постоянно использовать пульсоксиметр на дому и различные способы насыщения крови кислородом.
Пристального внимание заслуживают и опасное осложнение со стороны сердца — кардиомиопатия. Это затруднительно, ведь кардиологические симптомы могут быть замаскированы другими, более драматичными. Обследования сердца (ЭКГ, МРТ сердца) начинают сразу после постановки диагноза «миодистрофия Дюшенна» и повторяют ежегодно. После 10 лет следует отслеживать состояние левого желудочка (на который «завязан» большой круг кровообращения), а также возможное развитие сердечной недостаточности. В таком случае пациентам назначают фармакотерапию: ингибиторы ангиотензинпревращающего фермента и блокаторы ангиотензиновых рецепторов. Если кардиомиопатия прогрессирует, пациентам может потребоваться дефибриллятор или даже пересадка сердца. Возможна также имплантация в грудную клетку устройства, которое стимулирует работу левого желудочка, или автономного дефибриллятора.
Разумеется, все эти вмешательства только облегчают страдания больных и помогают им прожить дольше. Однако конечной целью исследователей остается именно этиотропное лечение МДД — устранение причины миодистрофии. В наши дни это уже не кажется фантастикой, ведь первые успехи в лечении орфанных болезней уже достигнуты — и яркий пример тому этому упомянутая в начале статьи «Золгенсма».
Что ученые надеются получить завтра
Недавно «Биомолекула» подробно писала о перспективах лечения нервно-мышечных заболеваний — этому посвящена статья «Генная терапия нейромоторных болезней» [3]. В ней разобраны основные подходы к экспериментальному лечению БАС, СМА и миодистрофии Дюшенна. Здесь же мы кратко рассмотрим, с чем сейчас связывают свои надежды ученые, которые ищут действенную терапию МДД, и упомянем некоторые негенетические подходы (рис. 8).
Когда в 1987 г. ген DMD был клонирован и охарактеризован, и ученые поняли причину миодистрофии Дюшенна, некоторые видели картину в розовом свете. Они полагали, что через какие-нибудь десять лет начнется клиническое использование генетической терапии миодистрофии Дюшенна. Однако эти надежды не оправдались: рекордно большой ген DMD, состоящий из 2,6 миллиона пар оснований, или хотя бы его кДНК (11 тысяч пар оснований) просто не влезают в большинство вирусных векторов [18], [32–36].

Рисунок 8. Стратегии лечения МДД: действующие на причину развития болезни — дефицит дистрофина (нижний ряд) и на вторичные проявления патогенеза (средний ряд).
иллюстрация Валерии Кузык по [36].
К тому же мышечные клетки относятся к дифференцированным и уже не вступают в митоз, а мышечные волокна, их пучки и отдельные мускулы надежно упакованы в соединительную ткань. Так что для плазмиды или вируса «пробиться» в миоцит — задача не из легких. Тем более что мышц очень много и они большие, и генетически модифицировать надо если не все, то многие.
Однако ученые смогли-таки найти остроумный ответ на вопрос «как обеспечить синтез дистрофина там, где нет для этого гена?». Их вдохновил пример миодистрофии Беккера, пациенты с которой имеют гораздо более легкие симптомы благодаря сравнительно небольшому уцелевшему «кусочку» дистрофина (так называемые мини- и микро-дистрофины; рис. 5). Поэтому исследователи задались целью превратить одну миодистрофию в другую, менее тяжелую. При этом речи о радикальном излечении, к сожалению, пока не идет — при успехе этого подхода многие симптомы миодистрофии сохранятся, но станут намного легче.
Работы на мышах mdx и собаках (а именно, золотистых ретриверах — другой популярной животной модели МДД) показали, что аденоассоциированные вирусы (AAV) подходят для доставки гена микродистрофина в миоциты [32]. Выполнены и первые клинические испытания этого подхода (использованы серотипы rh74 и AAV9), но, к сожалению, были описаны несколько случаев серьезных побочных эффектов. Даже на фоне приема иммунодепрессантов у пациентов возникал острый иммунный ответ и другие осложнения. Помимо этого, у некоторых испытуемых вырабатывались антитела к белкам капсида AAV, что делало дальнейшую терапию невозможной [32].
Другое перспективное направление терапии миодистрофии Дюшенна — использование генного редактирования CRISPR/Cas. С его помощью можно обеспечить «проскакивание» отдельных экзонов при транскрипции (чаще всего 45, 51 и 53 экзонов), удаление, ремоделирование и нок-ин экзонов (для восстановления экспрессии функционального дистрофина). В экспериментах на мышиной модели удалось успешно отредактировать ген DMD так, чтобы скорректировать его мутации и добиться синтеза работающего белка [18], [27].
К сожалению, генное редактирование пока достаточно малоэффективно. К тому же его терапевтическое использование по-прежнему ограничено законом — и для того имеется целый ряд этических и практических причин. Другая трудность — доставка нуклеаз CRISPR/Cas в достаточно большое число ядер миоцитов. В этом могут помочь липидные наночастицы для внедрения мРНК белка Cas9 и гидовой РНК в клетки скелетных мышц за счет многократного введения. При этом введение наночастиц с помощью перфузии конечности позволяет подействовать сразу на множество групп мышц.
Значительное внимание привлекли методы, нацеленные на пропускание («проскакивание») экзонов DMD (exon skipping), основанные на антисмысловых олигонуклеотидах (РНК или ДНК). Это малые молекулы, которые проще ввести в клетку и которые целенаправленно связывают нужные экзоны пре-мРНК, в то же время оставаясь незаметными для системы сплайсинга. Подход позволяет восстановить рамку считывания или устранить конкретные мутации, чтобы обеспечить экспрессию мини-дистрофина. Такой метод уже показал эффективность у пациентов с миодистрофией Дюшенна — препарат на основе антисмысловых олигонуклеотидов вилтоларзен недавно одобрен FDA [36].
Другой способ «проскочить» нежелательные экзоны — с помощью малых модифицированных ядерных рибонуклеопротеинов. В них исходная антисмысловая часть заменена на антисмысловую последовательность нужного экзона. Благодаря этому она вместо гистоновой РНК избирательно связывает целевой экзон. Выходит, что этот метод сочетает в себе генную терапию и стратегию «проскакивания» экзонов. Его эффективность уже показали на животных моделях. Только что с помощью подхода мультиэкзонного пропускания (multi-exon skipping, MES) и системы CRISPR/Cas3 удалось удалить большую область (340 тысяч пар оснований) последовательности DMD — эксперименты провели на индуцированных стволовых клетках пациентов с МДД. Однако есть у этой технологии и недостатки: она подходит только для пациентов с определенными мутациями, а ее эффективность показана лишь у небольшого числа заболевших [18], [27], [38].
В тоже время, продолжается поиск новых химических препаратов, эффективных при МДД. Не влияя на генетическую первопричину, они, тем не менее, могут оказывать действие на различные патологические процессы при миодистрофии и потенциально иметь высокую эффективность. Такие средства довольно разнообразны и в последнее время используются во многих исследованиях, в том числе клинических. Это и ваморолон (упомянутый выше новый глюкокортикоид), и римепорид (первый в своем роде ингибитор протон/натриевого обменника 1 типа), которые находятся на разных стадиях клинических исследований. Сюда относится и оральный препарат эдазалонексент (CAT-1004), который ингибирует фактор транскрипции NF-κB и подавляет воспаление и фиброз — он уже показал способность замедлить прогрессирование болезни, если его прием начать до шестилетнего возраста [27], [39].
Различные химические препараты действуют на какие-то определенные аспекты разнообразной картины патогенеза миодистрофии Дюшенна: терипаратид и алендронат — на остеопороз; препарат JQ1 и аденил-янтарная кислота — на окислительный стресс; триазоловые ингибиторы (TAK1) ингибируют пропускающие ионы поры в митохондриях. Список подобных препаратов в действительности довольно длинный: в нем можно отыскать даже метформин, популярный антидиабетический препарат и геропротектор. Оказалось, что эта молекула к тому же улучшает состояние сердца у мышей mdx и замедляет его фиброз.
Другой интересный подход терапии миодистрофии Дюшенна связан с утрофином. Этот белок, схожий с дистрофином по последовательности на 80% (рис. 5), образует комплексы наподобие DAPC, которые тоже хорошо стабилизируют сарколемму, а значит, отчасти могут брать на себя работу дистрофина. Однако утрофин экспрессируется исключительно в нервно-мышечных синапсах и в месте контакта мышц с сухожилиями, а также в сарколемме регенерирующих скелетных мышечных волокон.
Известны две изоформы утрофина: A и B, транскрипция которых происходит с разных промоторов. В лишенных дистрофина мышцах активируется экспрессия утрофина — причем только А-изоформы. При этом его синтез можно усилить — например, с помощью антагониста арилгидрокарбонового рецептора эзутромида. К сожалению, клинические исследования II фазы этого препарата были прекращены из-за неэффективности. Остается надеяться, что сработают какие-то другие модуляторы утрофина — например, на основе олигонуклеотидов [18], [27].
Стоит упомянуть также подход на основе гена GALGT2, который кодирует фермент, стимулирующий оверэкспрессию других белков — тех, что связываются с ним в области нервно-мышечного синапса и стабилизируют мембрану миоцитов. Продолжаются клинические испытания генотерапии МДД с помощью этого гена, который доставили в клетки пациентов с помощью вирусного вектора rAAVrh74 [17].
Проблемы и перспективы
Подводя итог статьи, хочется еще раз взглянуть на сложную и пеструю картину, описывающую проявления миодистрофии Дюшенна—Беккера. А также на множество различных подходов, с помощью которых ученые и врачи надеются однажды перевести это смертельное орфанное заболевание в категорию излечимых. И, разумеется, на множество трудностей и несбывшихся надежд на этой картине [18], [20], [27].
Возникающая из-за полной или частичной утраты важного для работы мышц гена DMD и закодированного в нем белка дистрофина, миодистрофия Дюшенна—Беккера сильно нарушает работу миоцитов и мышечной ткани, ведь дистрофин скрепляет собой цитоскелет мышечных клеток с внеклеточным матриксом и взаимодействует с целым спектром белков-партнеров. Он также необходим для нормальной работы дистрофинового комплекса DAPC, важного для поддержания структуры мышечного волокна и клеточной сигнализации, в том числе генерации АФК, кальциевого гомеостаза, работы синапсов, регенерации мышц и т.д. Если дистрофина нет, вся эта сложная машинерия идет вразнос: массово гибнут миоциты, нарастает воспаление и фиброз, а несчастные пациенты — чаще всего мальчики и подростки — наблюдают, как болезнь лишает их возможности владеть ногами, туловищем, а после — легкими и сердцем...
К сожалению, сейчас врачи могут противопоставить этому лишь симптоматическое лечение (вроде глюкокортикоидов и физиотерапии), которое немного улучшает качество жизни и отодвигает неизбежный конец. Однако каждый прожитый год для пациента с МДД дает шанс дождаться этиотропного лечения, которое по-настоящему работает. Чтобы это стало реальностью, ученые ищут всё новые возможные мишени терапевтического вмешательства.
Такие способы лечения могут восстанавливать экспрессию DMD — хотя бы в виде мини-гена, худо-бедно работающего у пациентов с миодистрофией Беккера. Для его доставки особенно перспективны аденоассоциированные вирусы AAV. Далее, можно использовать генное редактирование CRISPR/Cas и антисмысловые олигонуклеотиды, чтобы «выкинуть» проблемные экзоны DMD и добиться синтеза функционального белка. Определенные надежды связаны с утрофином — белком, который в какой-то степени способен взять на себя функции дистрофина.
Вызывает оптимизм и то, что сейчас о миодистрофии мы уже знаем очень многое, и перспективы у исследователей МДД (как и у тысяч пациентов по всему миру) велики как никогда. Так, прямо во время написания этой статьи стало известно, что FDA по ускоренной процедуре одобрило первый препарат для генной терапии этой болезни — деландистроген моксепарвовек, получивший торговое наименование «Элевидис» (Elevidys). Он позволил добиться экспрессии микродистрофина у детей в возрасте 4–5 лет с миодистрофией Дюшенна. Однако клинический эффект Элевидиса — улучшение моторных функций — пока доказать не удалось. Это станет задачей новых клинических испытаний в ближайшем будущем (рис. 9).

Рисунок 9. Элевидис (delandistrogene moxeparvovec-rokl) — первый препарат от МДД, одобренный FDA для лечения детей с подтвержденными мутациями в гене DMD в возрасте 4–5 лет.
И конечно, мы все — и особенно пациенты с МДД — надеемся на появление принципиально новых методов лечения — причем это можно сказать не только о миодистрофии Дюшенна, но и о многих других орфанных болезнях, которые вместе затрагивают, как мы помним, каждого пятого человека на земном шаре.
Литература
- Вылечить миодистрофию Дюшенна: конкуренция групп, единство методик;
- Nguyen O., Yokota T. (2019). Antisense oligonucleotides for the treatment of cardiomyopathy in Duchenne muscular dystrophy. Am J Transl Res. 11, 1202–1218;
- Генная терапия нейромоторных болезней;
- Carlos R. Ferreira. (2019). The burden of rare diseases. Am J Med Genet. 179, 885-892;
- Редко, но метко: орфанные заболевания как вызов современной медицине;
- Надежда для СМАйликов;
- Самое дорогостоящее лекарство в мире;
- «Нейроновости»: «12 месяцев. Миодистрофия Дюшенна. Часть первая: рожденный бегать бежать не может»;
- Raymond A. Huml. (2015). Muscular Dystrophy: Historical Background and Types. Muscular Dystrophy. 5-7;
- A E Emery, M L Emery. (1993). Edward Meryon (1809-1880) and muscular dystrophy.. Journal of Medical Genetics. 30, 506-511;
- Alan Emery. (2001). Duchenne muscular dystrophy or Meryon's disease. The Lancet. 357, 1529;
- «Нейроновости»: «Как вызвать улыбку электричеством»;
- Nader Salari, Behnaz Fatahi, Elahe Valipour, Mohsen Kazeminia, Reza Fatahian, et. al.. (2022). Global prevalence of Duchenne and Becker muscular dystrophy: a systematic review and meta-analysis. J Orthop Surg Res. 17;
- Elena Zinina, Maria Bulakh, Alena Chukhrova, Oksana Ryzhkova, Peter Sparber, et. al.. (2022). Specificities of the DMD Gene Mutation Spectrum in Russian Patients. IJMS. 23, 12710;
- Karen T. Nozoe, Ricardo T. Akamine, Diego R. Mazzotti, Daniel N. Polesel, Luís F. Grossklauss, et. al.. (2016). Phenotypic contrasts of Duchenne Muscular Dystrophy in women: Two case reports. Sleep Science. 9, 129-133;
- Iris Zalaudek, Raphael M Bonelli, Peter Kötringer, Franz Reisecker, Klaus Wagner. (1999). Early diagnosis in Duchenne muscular dystrophy. The Lancet. 353, 1975;
- KMD Bushby, A Hill, JG Steele. (1999). Failure of early diagnosis in symptomatic Duchenne muscular dystrophy. The Lancet. 353, 557-558;
- Grant Patterson, Haley Conner, Mecham Groneman, Cyril Blavo, Mayur S. Parmar. (2023). Duchenne muscular dystrophy: Current treatment and emerging exon skipping and gene therapy approach. European Journal of Pharmacology. 947, 175675;
- Valeria Ricotti, Herbert Jägle, Maria Theodorou, Anthony T Moore, Francesco Muntoni, Dorothy A Thompson. (2016). Ocular and neurodevelopmental features of Duchenne muscular dystrophy: a signature of dystrophin function in the central nervous system. Eur J Hum Genet. 24, 562-568;
- D D Gaynetdinova, A A Novoselova. (2020). Current diagnosis and treatment of Duchenne muscular dystrophy. Kazan Med J. 101, 530-537;
- Erik Landfeldt, Rachel Thompson, Thomas Sejersen, Hugh J. McMillan, Janbernd Kirschner, Hanns Lochmüller. (2020). Life expectancy at birth in Duchenne muscular dystrophy: a systematic review and meta-analysis. Eur J Epidemiol. 35, 643-653;
- Passamano L., Taglia A., Palladino A., Viggiano E., D'Ambrosi P., Scutifero M., Cecio M. R., Torre V., De Luca F., Picillo E., Paciello O., Piluso G., Nigro G., Politano L. (2012). Improvement of survival in Duchenne Muscular Dystrophy: retrospective analysis of 835 patients. Acta Myol. 31, 121–125;
- 12 методов в картинках: полимеразная цепная реакция;
- 12 методов в картинках: секвенирование нуклеиновых кислот;
- Kuo Zhang, Xin Yang, Guigao Lin, Yanxi Han, Jinming Li. (2019). Molecular genetic testing and diagnosis strategies for dystrophinopathies in the era of next generation sequencing. Clinica Chimica Acta. 491, 66-73;
- Dong Wang, Min Gao, Kaihui Zhang, Ruifeng Jin, Yuqiang Lv, et. al.. (2019). Molecular Genetics Analysis of 70 Chinese Families With Muscular Dystrophy Using Multiplex Ligation-Dependent Probe Amplification and Next-Generation Sequencing. Front. Pharmacol.. 10;
- Mengyuan Chang, Yong Cai, Zihui Gao, Xin Chen, Boya Liu, et. al.. (2023). Duchenne muscular dystrophy: pathogenesis and promising therapies. J Neurol. 270, 3733-3749;
- Что такое внеклеточный матрикс и почему его все изучают;
- Kay E. Davies, Simon Guiraud. (2019). Micro-dystrophin Genes Bring Hope of an Effective Therapy for Duchenne Muscular Dystrophy. Molecular Therapy. 27, 486-488;
- Nertiyan Elangkovan, George Dickson. (2021). Gene Therapy for Duchenne Muscular Dystrophy. JND. 8, S303-S316;
- Загадочный кальциевый язык;
- Молекула здравого ума;
- Время первых: как аденоассоциированные вирусы стали лучшими в доставке генов in vivo;
- Лентивирусные векторы: как они стали лучшими векторами для терапии ex vivo;
- «Спутник V» и не только: сказ об аденовирусных вакцинах;
- Christian Kupatt, Alina Windisch, Alessandra Moretti, Eckhard Wolf, Wolfgang Wurst, Maggie C. Walter. (2021). Genome editing for Duchenne muscular dystrophy: a glimpse of the future?. Gene Ther. 28, 542-548;
- Rohini Roy Roshmi, Toshifumi Yokota. (2023). Viltolarsen: From Preclinical Studies to FDA Approval. Methods in Molecular Biology. 31-41;
- Yuto Kita, Yuya Okuzaki, Youichi Naoe, Joseph Lee, Uikyu Bang, et. al.. (2023). Dual CRISPR-Cas3 system for inducing multi-exon skipping in DMD patient-derived iPSCs. Stem Cell Reports;
- Richard S. Finkel, Craig M. McDonald, H. Lee Sweeney, Erika Finanger, Erin Neil Knierbein, et. al.. (2021). A Randomized, Double-Blind, Placebo-Controlled, Global Phase 3 Study of Edasalonexent in Pediatric Patients with Duchenne Muscular Dystrophy: Results of the PolarisDMD Trial. JND. 8, 769-784.






