
Лаборатория молекулярных основ эмбриогенеза: от гена к признаку
18 сентября 2016
Лаборатория молекулярных основ эмбриогенеза: от гена к признаку
- 2221
- 0
- 4
Лаборатория молекулярных основ эмбриогенеза: от гена к признаку
рисунок Елены Беловой
Статья на конкурс «био/мол/текст»: Лаборатория молекулярных основ эмбриогенеза ИБХ РАН была основана в 2006 году. Лаборатория изучает молекулярно-генетические механизмы раннего развития и эволюции нервной системы, а также регенерации на моделях низших позвоночных. Об истории лаборатории и об основных направлениях проводимых в ней исследований читайте в этом материале.
«Био/мол/текст»-2016
Эта работа опубликована в номинации «Места» конкурса «био/мол/текст»-2016.
Генеральным спонсором конкурса, согласно нашему краудфандингу, стал предприниматель Константин Синюшин, за что ему огромный человеческий респект!
Спонсором приза зрительских симпатий выступила фирма «Атлас».
Спонсор публикации этой статьи — Дмитрий Геннадиевич Калашников.
Наиболее замечательное достижение биологии за последние 100 лет — вывод о том, что подавляющая часть информации об организме закодирована в его геноме в виде линейной последовательности нуклеотидов. Очевидным доказательством этому служит, например, развитие однояйцевых близнецов или клонирование животных путем пересадки ядер, взятых из клеток одного организма, в энуклеированные (лишенные ядра) яйцеклетки других организмов. И в том, и в другом случае получаются особи чрезвычайно похожие друг на друга. Данные примеры демонстрируют, что развитие действительно представляет собой процесс «развертывания» информации, целиком содержащейся в геноме.
Именно этот процесс развертывания информации, записанной в геноме зиготы (оплодотворенной яйцеклетки), в многоклеточные структуры взрослого организма представляет собой основной предмет исследований биологии развития. Понимание механизмов данного процесса крайне важно, поскольку их нарушение часто лежит в основе различных наследственных и приобретенных болезней, в том числе многих типов рака. Также знание этих механизмов необходимо в таких стремительно развивающихся прикладных областях, как регенеративная и репродуктивная медицина. С другой стороны, изучение механизмов, обеспечивающих реализацию генетической информации в эмбриогенезе, важно для понимания фундаментальных принципов организации живой материи и имеет большой общенаучный интерес. Вопрос о том, каким образом из внешне гомогенного яйца получается организм со строго упорядоченной пространственной структурой, представляет собой важнейшую общенаучную проблему, лежащую на стыке интересов биологии, химии, физики и математики. В наиболее общем виде данная проблема может быть сформулирована как вопрос о механизмах динамической самоорганизации. Наша лаборатория молекулярных основ эмбриогенеза в ИБХ РАН по мере своих скромных сил пытается приблизиться к решению этого вопроса, изучая механизмы раннего развития мозга и регенерации.
Ген, который подарил нам мозг
Одним из отличительных признаков всех позвоночных животных, в том числе и человека, является конечный мозг — передний отдел эмбрионального мозга, из которого развиваются такие важнейшие структуры, как большие полушария головного мозга. Именно большие полушария мы обычно представляем себе, когда говорим о мозге в нашей обыденной жизни. Интересно, что все остальные типы многоклеточных животных, включая ближайших родственников позвоночных — протохордовых (баланоглоссов, ланцетников и оболочников), — не имеют выраженных анатомических структур, гомологичных конечному мозгу позвоночных. Это означает, что конечный мозг возник в эволюции только у предков современных позвоночных. Используя терминологию А.Н. Северцова, его появление можно назвать типичным ароморфозом — крупным эволюционным изменением, приводящим к общему повышению уровня организации организма. В связи с этим очень важен вопрос о генетических механизмах, лежащих в основе данного ароморфоза.
В свое время в нашей лаборатории был открыт моногенный класс гомеобоксных генов, представители которого специфично экспрессируются у всех исследованных позвоночных в клетках зачатка конечного мозга на самых ранних стадиях его развития. В соответствии с названием места экспрессии этих генов — передний валик нервной пластинки (anterior neural fold) — мы назвали открытый класс гомеобоксных генов — Anf [1–3]. Последующие исследования показали важную роль Anf в развитии конечного мозга.
Эта работа началась еще в лаборатории структуры и функции генов человека (СГФЧ) нашего института, бессменным заведующим которой является Евгений Давидович Свердлов, академик, известный исследователь геномов живых организмов и недавний лауреат премии Президента РФ. Туда я пришел после окончания кафедры эмбриологии биофака МГУ. В то время в лаборатории (с подачи одного из основателей ИБХ — Юрия Анатольевича Овчинникова) успешно развивался проект по клонированию Na-К-АТФазы. Им был нужен человек, который мог бы организовать инъекции мРНК в ооциты шпорцевой лягушки с целью получения функционального белка Na-К-АТФазы. В мою скромную задачу входило завести все это лягушиное хозяйство и наладить методику микроинъекций. Поскольку я окончил кафедру эмбриологии и уже тогда имел выраженные интересы в этой области, Евгений Давидович, видимо, почувствовав это, очень мудро разрешил мне заниматься параллельно с основной работой по инъекциям своими эмбриологическими проектами, что я и продолжал успешно делать. Более того, примерно через год мне удалось убедить Евгения Давидовича в том, что мне очень нужен помощник, и пригласить в качестве такового Сергея Лукьянова, который к тому времени тоже окончил кафедру эмбриологии и искал место распределения. Так мы с Сергеем образовали микрогруппу в составе лаборатории СФГЧ.
Постепенно, посещая лабораторные семинары и общаясь с коллегами, мы, эмбриологи, проникались молекулярно-генетическим духом, стараясь применить полученные новые знания к своим эмбриологическим объектам и идеям. Так, однажды, обдумывая результаты одной своей работы по ранней разметке эмбриональной эктодермы на два зачатка — зачаток центральной нервной системы, нервную пластинку и зачаток эпидермиса, — я пришел к выводу, что было бы здорово найти такие гены, которые бы специфично экспрессировались в нервной пластинке, но не в эпидермисе. Найдя такие гены и изучая затем, что заставляет их экспрессироваться подобным образом, можно было бы попытаться, по крайней мере, в этом конкретном случае, ответить на самый важный вопрос биологии развития: каковы механизмы создания пространственной упорядоченности в развивающемся эмбрионе.
Сложность задачи заключалась, однако, в том, что в ту «догеномную эру» еще не было эффективных методов прицельного поиска подобных дифференциально экспрессирующихся генов. Точнее, один метод — вычитающая гибридизация — уже был, но он был разработан для больших количеств тканей. Например, можно было взять несколько граммов ткани печени и столько же мышечной ткани, выделить из них мРНК и затем с помощью вычитающей гибридизации искать те мРНК, которые специфично представлены в печени, и те, которые в мышцах. В нашем же случае необходимо было проделать то же самое на микроколичествах эмбриональной ткани весом не более 100 микрограммов. Дело в том, что ранний зачаток ЦНС у эмбриона шпорцевой лягушки на стадии гаструляции составляет примерно 1/20 часть всего эмбриона, который имеет размер около 1 мм в диаметре. Этот зачаток и его альтернативу — зачаток эпидермиса, можно вырезать под микроскопом микрохирургическими инструментами, однако накопить большое количество таких прицельно вырезанных кусочков эмбриональных тканей практически невозможно.
К счастью, из разговоров в лаборатории и литературы мы узнали о недавно появившемся замечательном методе — полимеразной цепной реакции, — позволяющем амплифицировать даже отдельные нуклеотидные последовательности. Более того, в лаборатории вскоре появился прибор для этого метода — амплификатор фирмы PerkinElmer. Беда, однако, заключалась в том, что тогда не умели получать ПЦР-амплифицированные библиотеки кДНК из таких микроколичеств исходного материала, как было нужно нам. Основной проблемой было быстрое нарастание паразитных продуктов ПЦР — т.н. «бомбы». Если исходного материала было много, то «бомба» не мешала. Однако если исходной кДНК было очень мало (как в нашем случае), то «бомба» полностью подавляла ее амплификацию.
С «бомбой» тогда никто не умел бороться. Случайно, из разговоров в лаборатории я узнал, что муж нашей сотрудницы Татьяны Виноградовой — Александр Белявский — недавно разработал сложный, но эффективный метод борьбы с «бомбой» и опубликовал статью в Nucleic Acids Research, где впервые описал эффективное создание ПЦР-кДНК-библиотек на основе микроколичеств исходной мРНК. Белявский тогда работал у Клауса Раевского в Германии, но иногда наведывался в свой родной Институт молекулярной биологии им. Энгельгардта в Москве. Через Таню Виноградову я связался с Александром в один из его приездов и рассказал ему о нашей проблеме.
В результате Саша согласился помочь, сказав, однако, что времени у него всего несколько дней, т.к. он должен опять ехать в Германию, и лучше это все сделать в его следующий приезд — через несколько месяцев. Однако нам, конечно, ждать несколько месяцев совсем не хотелось, и мне удалось убедить Белявского начать сразу же. Мы договорились, что к нему в ИМБ приедет Сергей Лукьянов с нашими образцами и рядом с Белявским сам будет делать все операции, точно следуя его инструкциям, а Белявский будет при этом заниматься своими делами. В результате я вырезал по одному фрагменту нервной пластинки и эпидермиса из одного эмбриона шпорцевой лягушки на стадии средней гаструлы, мы их растворили в лизис-буфере, взятом у Белявского, и Сережа поехал.
В итоге им удалось за эти несколько дней и ночей невероятной по напряженности работы не только сделать амплифицированные кДНК-библиотеки, но и провести их вычитающую гибридизацию по методу, на ходу придуманному Белявским. Затем Белявский уехал в Германию, а Сергей вернулся в ИБХ с двумя образцами кДНК, обогащенными, соответственно, нейро- и эпидермис-специфичными последовательностями. Чтобы представить интенсивность этой работы, достаточно сказать, что, по рассказам Сергея, на третью ночь Белявский уже периодически засыпал за работой, и Сереже приходилось его будить, чтобы спросить, как делать очередную стадию. Далее, следуя оставленным Белявским инструкциям и на ходу изобретая свои собственные технологии, Сергей и присоединившийся к нам аспирант лаборатории Чертова, Олег Васильев, провели дифференциальный скрининг плазмидных библиотек, полученных на основе привезенных из ИМБ образцов кДНК.
В результате были найдены два перспективных клона, содержащих вставки генов, потенциально специфично экспрессирующихся в нейроэктодерме и эпидермисе. С последующим сиквенсом этих клонов помог идейно присоединившийся к нам другой сотрудник ИБХ — Юрий Владимирович Смирнов, который в отличие от нас с Сергеем обладал очень ценным качеством: он умел секвенировать . Нужно сказать, что в те времена сиквенс еще делали вручную, и это было большим искусством, которым хорошо владели немногие. В результате с помощью Смирнова мы выяснили, что наши два клона содержат вставки кДНК двух неизвестных генов, один из которых, как раз нейроспецифичный, к нашей радости оказался гомеобоксным, что указывало на его возможную функцию в качестве важного транскрипционного регулятора ранней дифференцировки нейрального зачатка.
Кратко о сущности секвенирования рассказано в статье «Важнейшие методы молекулярной биологии и генной инженерии» [4]. А о некоторых вариантах этого метода можно узнать из статей: «454-секвенирование (высокопроизводительное пиросеквенирование ДНК)» и «Секвенирование единичных клеток (версия — Metazoa)» [5], [6]. — Ред.
В дальнейшем, когда мы проанализировали экспрессию этого гена, оказалось, что он действительно начинает экспрессироваться на самых ранних стадиях дифференцировки нервной пластинки, причем максимум экспрессии соответствовал зачатку наиболее переднего отдела эмбрионального мозга — конечного мозга. Поскольку у лягушки на ранних стадиях развития этот зачаток соответствует переднему валику нервной пластинки, мы назвали новый ген — Xanf, по первым буквам английского Xenopus anterior neural fold. Примечательно, что в то время еще не был разработан метод гибридизации in situ с РНК, который так широко применяется сейчас для изучения генной экспрессии в эмбрионах, и нам пришлось анализировать экспрессию с помощью метода ОТ-ПЦР, вырезая микрообразцы ткани из разных регионов на поверхности эмбриона.
Интересно, что спустя несколько лет, когда экспрессия этого гена была уже проанализирована методом гибридизации in situ, полученная картина в точности совпала с той виртуальной картой экспрессии, которую мы построили на основе данных ПЦР. Результаты всей этой работы мы опубликовали в 1992 году в журнале Developmental Biology [1]. А недавно в разговоре с одним из зарубежных коллег я узнал, что эта публикация имела драматические последствия для одной известной английской лаборатории. Они тогда тоже, но другими методами, клонировали ген Xanf и строили большие планы по дальнейшей работе с ним. Однако выход нашей статьи привел к тому, что группу, занимающуюся данным геном, расформировали, постдоки были перенаправлены на другие проекты, а кому-то даже пришлось отложить защиту диссертации.
Карьерные траектории
Для нас же с Сергеем данная работа послужила своего рода путевкой в научную жизнь. Сергей в процессе всего этого почувствовал большой интерес к разработке молекулярных технологий и, в первую очередь, обратил свой незаурядный талант на создание методов, связанных с ПЦР и вычитающей гибридизацией. В результате размышлений над одним неожиданным эффектом, полученным аспирантом лаборатории СФГЧ Геной Лаунером (сейчас он бросил молекулярную биологию и занимается более надежным делом — добычей золота), Сергей придумал и реализовал знаменитый метод супрессионной ПЦР [7].
В отличие от сложной и многостадийной технологии Белявского, этот метод позволяет легко избежать образования пресловутой «бомбы» и получать кДНК-библиотеки с помощью ПЦР, стартуя с любых микроколичеств исходного материала. На основе этого метода Сергей вместе с Евгением Давидовичем Свердловым создал метод супрессионной вычитающей гибридизации [8]. Именно этот метод составляет основу того комплекса работ, за которые Сергей и Евгений Давидович были награждены в 2016 году Государственной премией.
Осознать важность этих открытий можно также, вспомнив, что сегодня на их основе работают большинство китов фирмы Clontech и Evrogen по всему миру, а основная статья Сергея, который сейчас уже стал академиком и ректором 2-го медицинского университета имени Пирогова, имеет число цитирований по WoS близкое к 3000.
Затем были работы по флуоресцентным белкам из кораллов , иммунологии и много чему еще. Но это — уже другие истории.
Сергей Лукьянов и его коллеги открыли и описали большое число флуоресцирующих и окрашенных белков морских организмов, например, актиний (Anemonia majano и Ricordia yuma) и кораллов. Лукьянова справедливо называли в числе возможных лауреатов Нобелевской премии за GFP, но увы — премию в итоге получил Роджер Тсин: «Флуоресцирующая Нобелевская премия по химии» [9]. Отдел Сергея Лукьянова в ИБХ традиционно очень плотно занимается флуоресценцией, широко используемой в биологических исследованиях по всему миру [10], и его сотрудники опубликовали на «биомолекуле» уже несколько статей по этой теме: «Лучше один раз увидеть, или микроскопия сверхвысокого разрешения», «Флуоресцентный белок miniSOG убивает клетки светом» и «Флуоресцентные белки: разнообразнее, чем вы думали!» [11–13]. — Ред.
Глубже в эмбриогенез
Я же продолжил заниматься механизмами биологии развития и, в конце концов, с подачи и при помощи Евгения Давидовича Свердлова образовал в институте самостоятельную группу, а затем и лабораторию молекулярных основ эмбриогенеза. В настоящее время наша лаборатория разрабатывает несколько относительно независимых проектов, но все они так или иначе касаются раннего развития нервной системы и головного мозга. Один из этих проектов связан с продолжением исследования у позвоночных животных моногенного семейства гомеобоксных генов Anf, основание которому положил ген Xanf, найденный нами у шпорцевой лягушки (рис. 1).
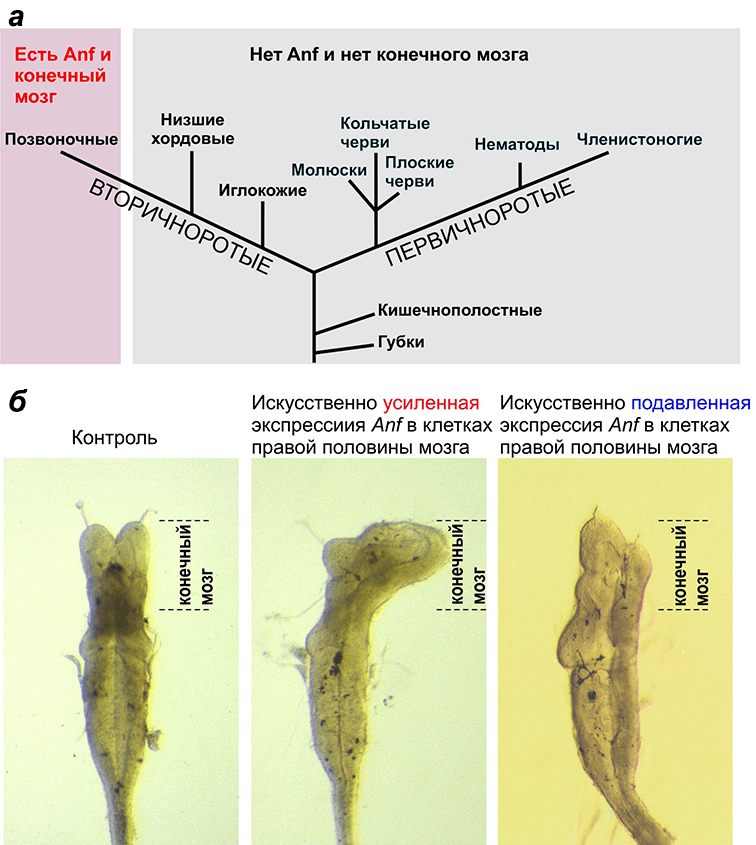
Рисунок 1. Гомеобоксный ген Anf — ключевой регулятор развития конечного мозга. а — Гомеобоксный ген Anf и конечный мозг присутствуют только у позвоночных животных, в том числе у человека, и отсутствуют у всех остальных животных. б — Искусственное изменение уровня экспрессии гомеобоксного гена Anf вызывает изменение размеров конечного мозга у головастика шпорцевой лягушки.
Наши дальнейшие эксперименты показали, что в клетках зачатка конечного мозга белок Anf играет роль специфического репрессора транскрипции, подавляя экспрессию генов, индуцирующих дифференцировку задних отделов мозга [14–18]. Известные мутации в этом гене у мыши и человека имеют рецессивный характер, но в гомозиготном состоянии приводят к серьезным аномалиям развития мозга — от недоразвития гипофиза и септооптической дисплазии (дисплазии оптического нерва и перегородки больших полушарий) до голопрозенцефалии (слияния желудочков конечного мозга) и анэнцефалии (отсутствия структур конечного мозга).
На основании всех этих данных, а также учитывая, что гены класса Anf отсутствуют у всех исследованных беспозвоночных животных, мы предположили, что возникновение этих генов у предков позвоночных могло послужить одной из ключевых предпосылок к возникновению конечного мозга в эволюции [18]. Согласно нашей гипотезе, репрессорная активность Anf в передней части зачатка центральной нервной системы у предков позвоночных обеспечила образование в этом регионе особой зоны, клетки которой оказались свободны от инструктирующего влияния генов, определяющих судьбу более задних регионов нервной системы. В результате эта зона нейрального зачатка, экспрессирующая Anf, получила возможность эволюционировать в новом направлении, что и привело в конце концов к образованию конечного мозга. То есть можно утверждать, что тот мозг, который мы сейчас имеем, и, в частности, наша способность читать и понимать этот текст во многом есть результат появления у предков позвоночных гена Anf.
А что у миноги?
Хотя выдвинутая нами гипотеза хорошо согласуется со многими известными в настоящее время данными, для более полного ее обоснования важно продемонстрировать выполнение такого необходимого условия, как присутствие генов Anf у всех классов позвоночных. К сожалению, до сих пор эти гены не были обнаружены у представителей самой древней группы современных позвоночных — у бесчелюстных (миног и миксин). И это при том, что геном одной из миног был секвенирован и стал недавно доступен для анализа. Как известно, ветвь, ведущая к современным миногам и миксинам, отделилась от общего ствола позвоночных на самых ранних этапах их эволюции — более 500 миллионов лет назад. Поэтому найти и изучить роль Anf у бесчелюстных было бы крайне важно, поскольку это бы означало, что данный класс генов действительно присутствует у самых древних животных, имеющих конечный мозг. Трудность здесь заключается, однако, в том, что геном миноги чрезвычайно богат GC-парами и трудно поддается секвенированию. Иногда даже получение некоторых фрагментов ДНК методом ПЦР представляет собой нетривиальную задачу. Кроме того, минога — достаточно редкий объект, не говоря уже об эмбрионах ранних стадий, на которых и должна предположительно происходить экспрессия Anf, то есть присутствовать его мРНК.
Один из текущих проектов нашей лаборатории посвящен именно поиску и изучению функций гена Anf у миноги. Занимаются этой работой Андрей Байрамов, Галина Ермакова и Федор Ерошкин. В рамках этого проекта для сбора эмбрионов камчатской миноги (одного из наиболее распространенных видов миноги с отсеквенированным геномом) Андрей Байрамов и Федор Ерошкин недавно провели экспедицию на Камчатку. Кроме того, в сотрудничестве с уникальным специалистом по миноге Александром Кучерявым из Института морфологии животных им. А.Н. Северцова удалось наладить непосредственно в нашей лаборатории получение эмбрионов нужной стадии у другого близкого вида — речной миноги. В результате нам наконец-то удалось клонировать гены Anf у этих двух видов миног. Примечательно, что это было сделано как раз с помощью методов, разработанных когда-то для супрессионной гибридизации Сергеем Лукьяновым. Более того, в экспериментах на ранних эмбрионах миноги, полученных в нашей лаборатории, мы экспериментально показали, что Anf у миноги так же, как и у других позвоночных, необходим для развития конечного мозга. Таким образом, нам удалось подтвердить нашу гипотезу о том, что данный гомеобоксный ген действительно присутствует во всех классах современных позвоночных, регулируя у них развитие конечного мозга. В настоящее время статья с описанием этой работы находиться на рецензии в одном из известных международных журналов.
Anf, Ras-dva и другие
Что же касается остальных проектов нашей лаборатории, то они так или иначе связаны (или берут свое начало) с геном Anf, а также с работами, начатыми мной еще в студенческие годы.
Один из таких проектов посвящен изучению роли пропавших в ходе эволюции позвоночных генов в регенерации. В свое время в поисках генных мишеней белка Anf мы наткнулись на довольно необычное явление. Оказалось, что некоторые из найденных генов-мишеней Anf, а именно гены секретируемого фактора Ag1 (рис. 2) и гены малых ГТФаз Ras-dva, присутствуют только в геномах низших позвоночных, рыб и амфибий, но отсутствуют у высших — рептилий, птиц и млекопитающих [19–22]. При этом у низших позвоночных данные гены, кодирующие совершенно разные типы белков, регулируют два важнейших процесса — развитие мозга и регенерацию конечностей [23–25]. Мы предположили, что исчезновение этих генов у высших позвоночных могло быть одной из причин, приведших к снижению у них регенерационных способностей. В то же время такая потеря могла привести к снятию каких-то молекулярных блоков, затрудняющих у низших позвоночных дальнейшее прогрессивное развитие мозга. Как известно, одно из отличий высших позвоночных заключается как раз в сильно развитом, по сравнению с низшими позвоночными, конечном мозге. Другими словами, исчезновение в эволюции найденных нами генов могло быть своеобразной платой, отданной предками высших позвоночных за возможность прогрессивного развития мозга. В ходе работы над данным проектом, которая сейчас успешно продолжается, нам удалось получить данные в пользу этой гипотезы.

Рисунок 2. Инъекции антисмыслового морфолинового олигонуклеотида блокируют трансляцию мРНК гена Ag1 , что приводит к ингибированию регенерации хвостового плавника у рыбы Danio rerio.
сайт ibch.ru
Важным результатом этой работы стала гипотеза о том, что и другие крупные эволюционные преобразования, существенно изменяющие развитие организмов, могут быть обусловлены не только перестройками регуляторных сетей, состоящих из одного и того же набора генов (как это, в основном, предполагается сейчас), но также возникновением и потерей, по крайней мере, некоторых важных генов. Но если это так, то идентификация подобных генов могла бы стать эффективным способом выявления генетических основ подобных эволюционных преобразований эмбриогенеза. Основываясь на данной гипотезе, совместно с коллегами из лаборатории Василия Александровича Любецкого Института проблем передачи информации им. А.А. Харкевича мы разработали алгоритм и компьютерную программу, позволяющую на основе сравнения геномов суперкомпьютером идентифицировать гены, возникшие или исчезнувшие на заданном этапе эволюции. С помощью этой программы нам недавно удалось обнаружить еще несколько генов, исчезнувших у высших позвоночных, но принимающих участие в регенерации у рыб и амфибий. Сейчас мы изучаем роль некоторых из этих генов в регенерации и развитии мозга у низших позвоночных. Этим проектом в основном занимаются Мария Терешина (см. видео ниже), Анастасия Иванова, Галина Ермакова и Дарья Короткова, но периодически подключаются и другие сотрудники лаборатории.
На 25-м семинаре Совета молодых ученых ИБХ Мария Терешина рассказала о некоторых генах, отвечающих за регенерацию, которую мы (люди) потеряли
Изучение генной сети, связанной с функционированием гена Anf в клетках раннего зачатка переднего мозга, также привело к открытию ряда других генов, играющих важную роль в эмбриогенезе. Так, нами впервые были открыты и изучены регуляторы раннего развития головного мозга — секретируемые белки Noggin2 и Noggin4 [26–29]. Основные участники данного проекта — Андрей Байрамов, Федор Ерошкин, Алексей Нестеренко, Александр Бородулин, Наталья Мартынова, Галина Ермакова и Евгений Орлов. Было показано, что важным свойством Noggin2 и Noggin4 является способность связывать и ингибировать функцию регулятора задних отделов ЦНС — секретируемого белка Wnt8 (рис. 3).
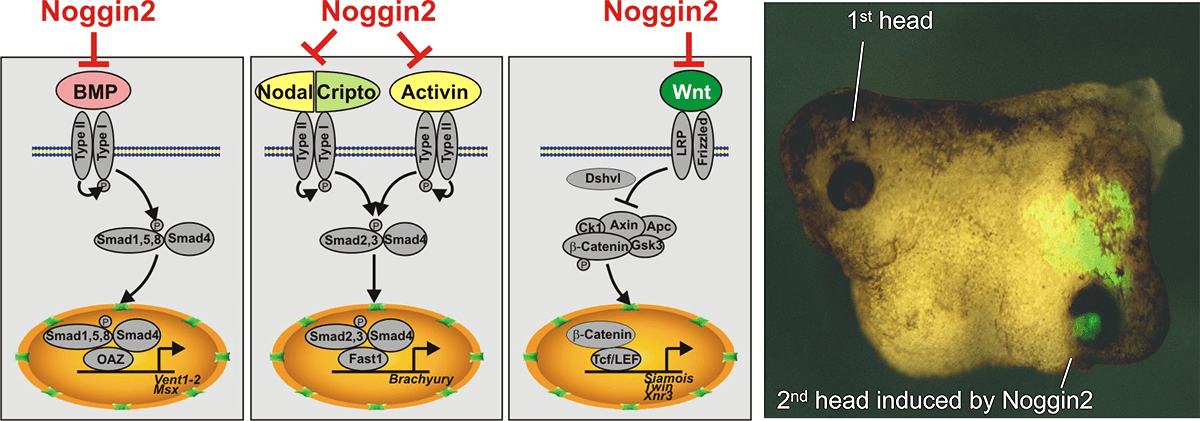
Рисунок 3. Секретируемый белок Noggin2 ингибирует три сигнальных каскада — BMP, Activin/Nodal и Wnt. Это является достаточным условием для индукции второй головы при искусственно вызванной экспрессии Noggin2 на брюшной стороне эмбриона шпорцевой лягушки.
сайт ibch.ru
В совместной работе с сотрудником кафедры биофизики МГУ Алексеем Нестеренко мы разработали на модели белков семейства Noggin и Wnt комплекс методов для изучения диффузии и взаимодействия морфогенов в межклеточном пространстве эмбриональных тканей. В результате впервые удалось измерить коэффициенты диффузии этих белков в живом эмбрионе лягушки (рис. 4) и продемонстрировать важную роль адсорбции на внеклеточном матриксе в их диффузии [29], [30]. В этом исследовании основную работу выполняли Алексей Нестеренко, Александр Бородулин и Евгений Орлов. Кроме того, впервые с помощью математического моделирования было показано, что такая адсорбция может играть роль важного фактора, необходимого для создания пространственно упорядоченных структур в эмбриогенезе.
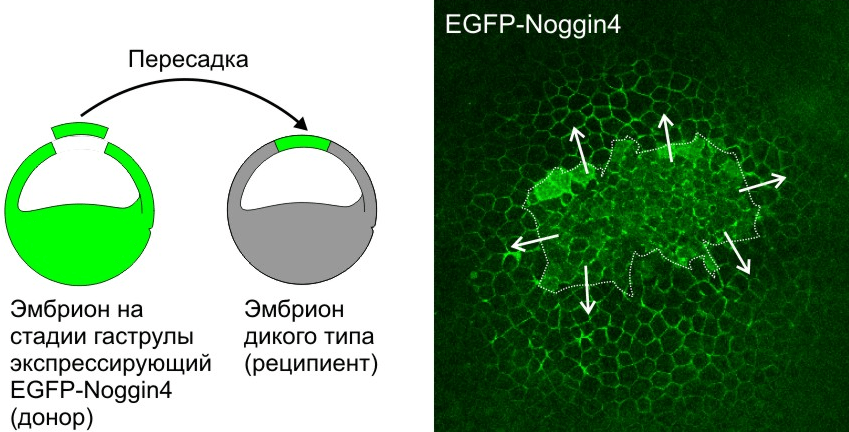
Рисунок 4. Секретируемый белок Noggin4, флуоресцентно меченный EGFP (EGFP-Noggin4), диффундирует из пересаженного кусочка эктодермы (граница выделена пунктиром), где он экспрессируется, по межклетникам эмбриона-реципиента на большие расстояния. Стрелки показывают направление диффузии.
сайт ibch.ru
Эти работы важны, поскольку знание закономерностей адсорбции морфогенных белков на внеклеточном матриксе позволяет строить более реалистичные реакционно-диффузионные модели ранней разметки эмбриона. Общепризнано, что закономерное подразделение эмбриона на территории с разной судьбой дифференцирующихся клеток происходит благодаря возникновению динамических пространственных (диссипативных) структур, возникающих в результате взаимодействий секретируемых белков-морфогенов.
Эти процессы могут быть описаны с помощью систем нелинейных дифференциальных уравнений с диффузией. Показано, что именно в таких динамических нелинейных системах могут возникать стационарные пространственные структуры в виде градиентов концентраций белков-морфогенов. В результате клетки эмбриона, расположенные на определенном расстоянии вдоль такого градиента, получают воздействие соответствующей этому расстоянию концентрации морфогена и таким образом получают импульс к дифференцировке в определенном направлении. Из теории диссипативных структур известно, что одним из условий существования таких структур является наличие в системе, по крайней мере, двух диффундирующих и нелинейно взаимодействующих морфогенов с резко различающимися коэффициентами диффузии. Между тем, все реальные белки-морфогены имеют близкие размеры и, соответственно, примерно одинаковые гидродинамические коэффициенты диффузии. Наша работа показывает, что разница в скоростях диффузии морфогенов может достигаться за счет разной силы их адсорбции на внеклеточном матриксе.
Кроме того, важным итогом этой работы стал вывод о том, что такая адсорбция позволяет существенно увеличить разнообразие форм возможных диссипативных структур на основе диффундирующих морфогенов, что, соответственно, создает предпосылки для развития более разнообразных морфологических форм в эмбриогенезе. В настоящее время направление, связанное с изучением диффузии морфогенов, является одним из основных в нашей лаборатории.
В ходе поиска белков, способных напрямую взаимодействовать с белком Anf, нами был найден еще один интересный для понимания механизмов регуляции эмбриогенеза ген — Zyxin [31]. Ранее белок Zyxin изучался другими авторами исключительно на уровне отдельных клеток, растущих в культуре. Было установлено, что данный белок с одной стороны участвует в сборке актинового цитоскелета, а с другой — способен перемещаться в клеточное ядро, регулируя там экспрессию определенных генов. Поэтому было сделано предположение, что Zyxin может осуществлять связь между клеточными движениями, основанными на перестройках цитоскелета, и генной экспрессией. Помимо взаимодействия с транскрипционным фактором Anf, мы установили, что в эмбрионе на ранних стадиях развития центральной нервной системы Zyxin ингибирует сигнальный каскад, активируемый секретируемыми белками семейства Hedgehog [32]. Полученные данные впервые демонстрируют связь между одним из цитоскелетных белков-регуляторов морфогенетических движений клеток и важным сигнальным каскадом, управляющим дифференцировкой клеток в нейральном зачатке.
В настоящее время мы работаем над проектом по широкомасштабному поиску генных мишеней Zyxin в модельном объекте — раннем эмбрионе шпорцевой лягушки. В основном, этой работой занимаются Наталья Мартынова и Федор Ерошкин. С помощью высокопроизводительного секвенирования мы сравнили транскриптомы нормальных эмбрионов и эмбрионов с заблокированной трансляцией мРНК Zyxin. Данная работа проводилась в сотрудничестве с группой исследователей, возглавляемой Егором Прохорчуком из Центра биоинженерии РАН. Одним из интересных результатов этой работы стало установление того факта, что Zyxin, по-видимому, регулирует экспрессию мастер-генов, определяющих стволовой статус клетки. Учитывая то, что одна из функций Zyxin — регуляция морфогенетических движений, данные о возможной регуляции экспрессии этих генов представляют особый интерес, поскольку они указывают на возможный конкретный путь связи морфогенеза со стволовым статусом клеток.
Проблеме взаимосвязи морфогенеза с регуляцией экспрессии генов и клеточной дифференцировкой посвящен еще один проект, развиваемый в нашей лаборатории Федором Ерошкиным. Выяснение механизмов такой взаимосвязи крайне важно для понимания того, каким образом из отдельных клеток образуется гармонично сложенный многоклеточный орган или даже целый эмбрион. Дело в том, что клеточная дифференцировка в эмбриогенезе происходит на фоне морфогенетических процессов, приводящих к изменению формы эмбриона и его зачатков за счет активных перемещений и переупаковки его клеток. Например, нервная пластинка в ходе нейруляции растягивается в продольном направлении более чем в три раза (рис. 5).
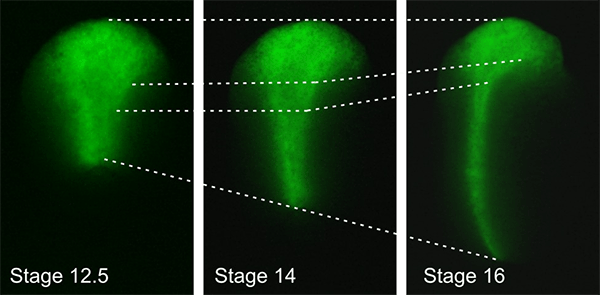
Рисунок 5. В ходе нейруляции зачаток центральной нервной системы — нервная пластинка — сильно растягивается в продольном направлении в результате слаженных морфогенетических движений, слагающих ее из соседних клеток. Показаны три последовательные стадии развития одного и того же эмбриона шпорцевой лягушки. Зеленым цветом отмечены клетки нервной пластинки. Пунктирные линии соединяют одинаковые группы клеток.
В развиваемом в лаборатории проекте мы пытаемся понять механизм обратной связи между механическими напряжениями, возникающими в тканях эмбриона в результате морфогенетических движений клеток, и генной экспрессией в этих же клетках. Предположение о том, что дальнодействующие механические напряжения могли бы играть роль сигнала обратной связи между морфогенетическими движениями клеток и процессами клеточной дифференцировки и, следовательно, генной экспрессией, возникло у меня еще в период работы над дипломной работой на биофаке МГУ, которую я выполнял под руководством Льва Владимировича Белоусова. На основании этой идеи и экспериментальных данных Л.В. Белоусова о феномене контактной поляризации клеток физик-теоретик Борис Николаевич Белинцев предложил теоретическую модель пространственной самоорганизации клеточной дифференцировки в эпителиальных пластах эмбриональных тканей [33].
К сожалению, хотя мы сравнительно легко могли регулировать механические напряжения и анализировать последствия такой регуляции на тканевом уровне с помощью микрохирургической техники, мы не могли целенаправленно искать механо-чувствительные гены, поскольку в то время еще не существовало методов, позволявших делать это на таких микрообъектах, как фрагменты эмбриональных тканей. Примечательно, что именно эта задача стимулировала нас тогда с Сергеем Лукьяновым к разработке подобных методов на модели единичных тканевых фрагментов, вырезанных с помощью микрохирургии из эмбриона шпорцевой лягушки. В результате была создана серия методов вычитающей гибридизации, позволивших нам, в частности, клонировать гомеобоксный ген Anf, о котором говорилось выше. Однако, как выяснилось в процессе этой работы, методы вычитающей гибридизации в принципе не давали возможности уверенно выявлять дифференциально экспрессирующиеся гены, у которых разница в экспрессии между опытным и контрольным образцом была менее десяти раз. А именно к последним, как сейчас выясняется, относятся гены, реагирующие на механические напряжения, и именно поэтому нам тогда не удалось обнаружить подобные гены.
Между тем, современный метод высокопроизводительного секвенирования транскриптомов, в отличие от вычитающей гибридизации, позволяет уверенно выявлять гены, у которых разница в экспрессии между контролем и опытом составляет всего несколько раз. Используя данный метод, нам недавно удалось выявить ряд генов, экспрессия которых регулируется механическими напряжениями, возникающими в раннем зачатке нервной системы в результате движений его клеток. Мы надеемся, что дальнейшее изучение механизмов регуляции экспрессии этих генов позволит понять, каким образом осуществляется обратная связь между полями механических напряжений в эмбриональных тканях и генной экспрессией.
В ходе работы над вышеуказанными проектами наша лаборатория сотрудничает с другими лабораториями нашего института, с кафедрой биофизики МГУ, Центром «Биоинженерия» РАН, НИИ физико-химической биологии им. А.Н. Белозерского МГУ, Институтом проблем передачи информации РАН, НИЦ Курчатовский институт, а также с рядом зарубежных лабораторий. Из числа последних наиболее тесное сотрудничество в последнее время развивается с двумя лабораториями в США: профессора Роберта Грейнджера (Robert Grainger) из университета Виргинии и профессора Марка Киршнера (Marс Kirshner) из Медицинской школы Гарварда.
Кроме вышеописанных фундаментально-научных исследований, в нашей лаборатории уже многие годы проводятся работы по созданию новых методик мониторинга различных клеточных процессов в эмбриогенезе с использованием новых флуоресцентных репортерных белков [34–39]. Данные работы проводятся в сотрудничестве с лабораториями биофотоники (заведующий Константин Лукьянов), геномики адаптивного иммунитета (зав. Дмитрий Чудаков) и молекулярных технологий (зав. Всеволод Белоусов). В частности, нами была разработана технология двухцветного репортерного вектора, существенно повышающая эффективность функционального промоторного анализа благодаря возможности сравнивать экспрессионный потенциал двух делеционных мутантов изучаемого генного промотора в одном и том же трансгенном эмбрионе [16].
Еще одна интересная недавняя работа, выполненная совместно с лабораторией Всеволода Белоусова, была посвящена исследованию изменений кислотности цитоплазмы при регенерации хвоста у головастиков шпорцевой лягушки с помощью флуоресцентного pH сенсора Sypher2 [40]. В этой работе нам удалось обнаружить ранее неизвестный эффект — быстрое закисление цитоплазмы клеток вблизи места ампутации хвоста. Этот эффект является одной из первых реакций организма на ампутацию и, вероятно, может иметь важное регуляторное значение для последующей регенерации.
Также в лаборатории проводятся уникальные для нашей страны работы по созданию и поддержанию линий трансгенных лягушек Xenopus laevis (рис. 6), экспрессирующих флуоресцентные репортеры и сенсоры (ответственные: Галина Ермакова, Елена Соловьева, Марина Серебрякова и Елена Радзиховская). Эмбрионы, получаемые от таких лягушек, находят применение во многих исследованиях по биологии развития.
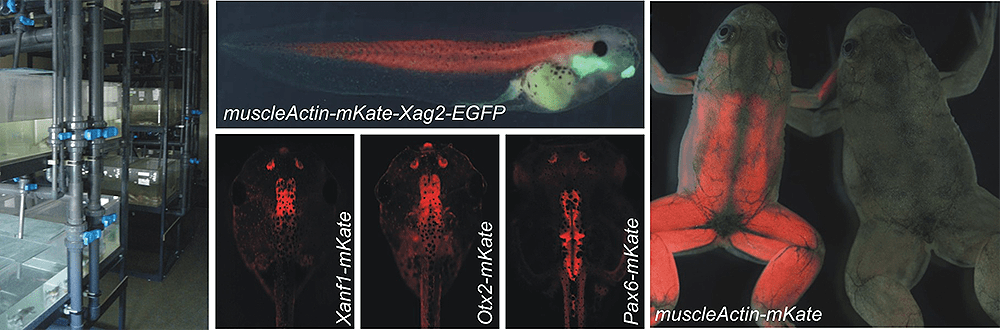
Рисунок 6. Аквариальная комната , где содержатся лягушки и головастики некоторых трансгенных линий, а также взрослые лягушки, экспрессирующие флуоресцентные белки под контролем промоторов различных генов.
сайт ibch.ru
Итак, начав с открытия одного из главных регуляторов раннего развития конечного мозга — гомеобоксного гена Anf, и занимаясь затем изучением генов, входящих в его регуляторную сеть, нам удалось выяснить некоторые важные механизмы раннего развития и эволюции мозга позвоночных, а также приблизиться к пониманию причин снижения в ходе эволюции регенерационных способностей. Кроме того, данные исследования позволили заложить основы для нескольких новых направлений, которые, как мы надеемся, приведут к еще более интересным результатам. Таким образом, можно сказать, что ген Anf, создавший в ходе эволюции условия для возникновения конечного мозга у позвоночных, неожиданным образом сыграл важную роль и в нашей скромной судьбе, позволив состояться как ученым.
Литература
- Zaraisky A.G., Lukyanov S.A., Vasiliev O.L., Smirnov Y.V., Belyavsky A.V., Kazanskaya O.V. (1992). A novel homeobox gene expressed in the anterior neural plate of the Xenopus embryo. Dev. Biol. 152, 373–382;
- Zaraisky A.G., Ecochard V., Kazanskaya O.V., Lukyanov S.A., Fesenko I.V., Duprat A.M. (1995). The homeobox-containing gene XANF-1 may control development of the Spemann organizer. Development. 121, 3839–3847;
- Kazanskaya O.V., Severtzova E.A., Barth K.A., Ermakova G.V., Lukyanov S.A., Benyumov A.O. et al. (1997). Anf: a novel class of vertebrate homeobox genes expressed at the anterior end of the main embryonic axis. Gene. 200, 25–34;
- Важнейшие методы молекулярной биологии и генной инженерии;
- 454-секвенирование (высокопроизводительное пиросеквенирование ДНК);
- Секвенирование единичных клеток (версия — Metazoa);
- Lukyanov K., Diatchenko L., Chenchik A., Nanisetti A., Siebert P., Usman N. et al. (1997). Construction of cDNA libraries from small amounts of total RNA using the suppression PCR effect. Biochem. Biophys. Res. Commun. 230, 285–288;
- Diatchenko L., Lau Y.F., Campbell A.P., Chenchik A., Moqadam F., Huang B. et al. (1996). Suppression subtractive hybridization: a method for generating differentially regulated or tissue-specific cDNA probes and libraries. Proc. Natl. Acad. Sci. USA. 93, 6025–6030;
- Флуоресцирующая Нобелевская премия по химии;
- Флуоресцентные репортеры и их молекулярные репортажи;
- Флуоресцентные белки: разнообразнее, чем вы думали!;
- Лучше один раз увидеть, или Микроскопия сверхвысокого разрешения;
- Ermakova G.V., Alexandrova E.M., Kazanskaya O.V., Vasiliev O.L., Smith M.W., Zaraisky A.G. (1999). The homeobox gene, Xanf-1, can control both neural differentiation and patterning in the presumptive anterior neurectoderm of the Xenopus laevis embryo. Development. 126, 4513–4523;
- Eroshkin F., Kazanskaya O., Martynova N., Zaraisky A. (2002). Characterization of cis-regulatory elements of the homeobox gene Xanf-1. Gene. 285, 279–286;
- Martynova N., Eroshkin F., Ermakova G., Bayramov A., Gray J., Grainger R., Zaraisky A. (2004). Patterning the forebrain: FoxA4a/Pintallavis and Xvent2 determine the posterior limit of Xanf1 expression in the neural plate. Development. 131, 2329–2338;
- Bayramov A.V., Martynova N.Y., Eroshkin F.M., Ermakova G.V., Zaraisky A.G. (2004). The homeodomain-containing transcription factor X-nkx-5.1 inhibits expression of the homeobox gene Xanf-1 during the Xenopus laevis forebrain development. Mech. Dev. 121, 1425–1441;
- Ermakova G.V., Solovieva E.A., Martynova N.Y., Zaraisky A.G. (2007). The homeodomain factor Xanf represses expression of genes in the presumptive rostral forebrain that specify more caudal brain regions. Dev. Biol. 307, 483–497;
- Novoselov V.V., Alexandrova E.M., Ermakova G.V., Zaraisky A.G. (2003). Expression zones of three novel genes abut the developing anterior neural plate of Xenopus embryo. Gene Expr. Patterns. 3, 225–230;
- Tereshina M.B., Zaraisky A.G., Novoselov V.V. (2006). Ras-dva, a member of novel family of small GTPases, is required for the anterior ectoderm patterning in the Xenopus laevis embryo. Development. 133, 485–494;
- Efimov V.A., Birikh K.R., Staroverov D.B., Lukyanov S.A., Tereshina M.B., Zaraisky A.G., Chakhmakhcheva O.G. (2006). Hydroxyproline-based DNA mimics provide an efficient gene silencing in vitro and in vivo. Nucleic Acids Res. 34, 2247–2257;
- Tereshina M.B., Bayramov A.V., Zaraisky A.G. (2011). Expression patterns of genes encoding small GTPases Ras-dva-1 and Ras-dva-2 in the Xenopus laevis tadpoles. Gene Expr. Patterns. 11, 156–161;
- Ivanova A.S., Tereshina M.B., Ermakova G.V., Belousov V.V., Zaraisky A.G. (2013). Agr genes, missing in amniotes, are involved in the body appendages regeneration in frog tadpoles. Sci. Rep. 3, 1279;
- Tereshina M.B., Ermakova G.V., Ivanova A.S., Zaraisky A.G. (2014). Ras-dva1 small GTPase regulates telencephalon development in Xenopus laevis embryos by controlling Fgf8 and Agr signaling at the anterior border of the neural plate. Biol. Open. 3, 192–203;
- Ivanova A.S., Shandarin I.N., Ermakova G.V., Minin A.A., Tereshina M.B., Zaraisky A.G. (2015). The secreted factor Ag1 missing in higher vertebrates regulates fins regeneration in Danio rerio. Sci. Rep. 5, 8123;
- Eroshkin F.M., Ermakova G.V., Bayramov A.V., Zaraisky A.G. (2006). Multiple noggins in vertebrate genome: cloning and expression of noggin2 and noggin4 in Xenopus laevis. Gene Expr. Patterns. 6, 180–186;
- Bayramov A.V., Eroshkin F.M., Martynova N.Y., Ermakova G.V., Solovieva E.A., Zaraisky A.G. (2011). Novel functions of Noggin proteins: inhibition of Activin/Nodal and Wnt signaling. Development. 138, 5345–5356;
- Borodulin A.V., Eroshkin F.M., Bayramov A.V., Zaraisky A.G. (2012). Noggin4 expression during chick embryonic development. Int. J. Dev. Biol. 56, 403–406;
- Eroshkin F.M., Nesterenko A.M., Borodulin A.V., Martynova N.Y., Ermakova G.V., Gyoeva F.K. et al. (2016). Noggin4 is a long-range inhibitor of Wnt8 signalling that regulates head development in Xenopus laevis. Sci. Rep. 6, 23049;
- Nesterenko A.M., Orlov E.E., Ermakova G.V., Ivanov I.A., Semenyuk P.I., Orlov V.N. et al. (2015). Affinity of the heparin binding motif of Noggin1 to heparan sulfate and its visualization in the embryonic tissues. Biochem. Biophys. Res. Commun. 468, 331–336;
- Martynova N.Y., Eroshkin F.M., Ermolina L.V., Ermakova G.V., Korotaeva A.L., Smurova K.M. et al. (2008). The LIM-domain protein Zyxin binds the homeodomain factor Xanf1/Hesx1 and modulates its activity in the anterior neural plate of Xenopus laevis embryo. Dev. Dyn. 237, 736–749;
- Martynova N.Y., Ermolina L.V., Ermakova G.V., Eroshkin F.M., Gyoeva F.K., Baturina N.S., Zaraisky A.G. (2013). The cytoskeletal protein Zyxin inhibits Shh signaling during the CNS patterning in Xenopus laevis through interaction with the transcription factor Gli1. Dev. Biol. 380, 37–48;
- Belintsev B.N., Beloussov L.V., Zaraisky A.G. (1987). Model of pattern formation in epithelial morphogenesis. J. Theor. Biol. 129, 369–394;
- Matz M.V., Fradkov A.F., Labas Y.A., Savitsky A.P., Zaraisky A.G., Markelov M.L., Lukyanov S.A. (1999). Fluorescent proteins from nonbioluminescent Anthozoa species. Nat. Biotechnol. 17, 969–973;
- Terskikh A., Fradkov A., Ermakova G., Zaraisky A., Tan P., Kajava A.V. et al. (2000). «Fluorescent timer»: protein that changes color with time. Science. 290, 1585–1588;
- Chudakov D.M., Belousov V.V., Zaraisky A.G., Novoselov V.V., Staroverov D.B., Zorov D.B. et al. (2003). Kindling fluorescent proteins for precise in vivo photolabeling. Nat. Biotechnol. 21, 191–194;
- Shcherbo D., Merzlyak E.M., Chepurnykh T.V., Fradkov A.F., Ermakova G.V., Solovieva E.A. et al. (2007). Bright far-red fluorescent protein for whole-body imaging. Nat. Methods. 4, 741–746;
- Shcherbo D., Shemiakina I.I., Ryabova A.V., Luker K.E., Schmidt B.T., Souslova E.A. et al. (2010). Near-infrared fluorescent proteins. Nat. Methods. 7, 827–829;
- Shemiakina I.I., Ermakova G.V., Cranfill P.J., Baird M.A., Evans R.A., Souslova E.A. et al. (2012). A monomeric red fluorescent protein with low cytotoxicity. Nat. Commun. 3, 1204;
- Matlashov M.E., Bogdanova Y.A., Ermakova G.V., Mishina N.M., Ermakova Y.G., Nikitin E.S. et al. (2015). Fluorescent ratiometric pH indicator SypHer2: Applications in neuroscience and regenerative biology. Biochim. Biophys. Acta. 1850, 2318–2328.






