-
Этой статьей мы открываем спецпроект, который расскажет о состоянии сегодняшней фармацевтической индустрии, о том, как она складывалась исторически и о наиболее замечательных лекарствах прошлого, настоящего и будущего. Прогресс в естественных науках увлек за собой и фармацевтику, создав базу для рационального «конструирования» лекарств, в том числе на основе биологических молекул. Многие знают про случайное открытие и последующее выделение из плесневого гриба пеницилла первого антибиотика, революционизировавшего лечение инфекционных болезней и способствовавшего спасению миллионов человеческих жизней во всем мире. Однако далеко не всем известно о достижениях, позволивших синтезировать малые лекарственные молекулы, в промышленных масштабах получать продуцируемые живыми клетками биопрепараты, а также создавать лекарства самой прогрессивной на сегодняшний день передовой (advanced) терапии. Обо всем этом, а также об истории развития фарминдустрии, ее современном состоянии и будущих перспективах, и расскажет наша статья.
-
Сегодня BIOCAD — одна из крупнейших российских фармацевтических компаний, специализирующаяся в том числе на разработке терапевтических моноклональных антител. Департамент вычислительной биологии (ДВБ) занимается биоинформатическим моделированием этих молекул, тем самым оптимизируя их разработку. Тому, как устроена компания в целом и ДВБ в частности, посвящена заключительная статья спецпроекта о терапевтических антителах.
-
Статья на конкурс «био/мол/текст»: Эта загадочная пропажа произошла около 17 миллионов лет назад, когда на нашей планете жили древние человекообразные обезьяны. Исчез фермент. «А что в этом загадочного? — спросите вы. — Такое регулярно случается: одни белки рождаются, другие перестают работать». А я отвечу вам, что герой этой истории — фермент, отсутствующий у человекообразных обезьян, — необходим другим млекопитающим. Например, трансгенные мыши, не способные его синтезировать, живут всего месяц. Безусловно, загадка исчезновения такого белка не осталась без внимания ученых.
-
Статья на конкурс «био/мол/текст»: Химия — одна из основных существующих наук. Достижения, которая привносит она, используются во многих других сферах деятельности. Из этой статьи вы узнаете о таких соединениях, как металлоорганические каркасы (metal-organic frameworks, MOFs), и о том, что интересного они могут дать человеку.
-
Статья на конкурс «био/мол/текст»: Мы привыкли интуитивно подразделять химические вещества на природные и не встречающиеся в природе. Конечно, с самого начала было известно, что эта классификация условная. И тем не менее она прочно вошла в наши представления. Поэтому даже от людей с учеными степенями нередко можно услышать фразы вроде «Биодеструкция фенола в природе невозможна». Данная статья ставит задачу показать читателю возможности живых организмов по синтезу и накоплению веществ, традиционно рассматриваемых в качестве «не встречающихся в природе». Немного касается она и биодеструкции некоторых таких соединений. А основной вывод в том, что под давлением фактов представления о природных веществах рано или поздно будут пересматриваться.
-
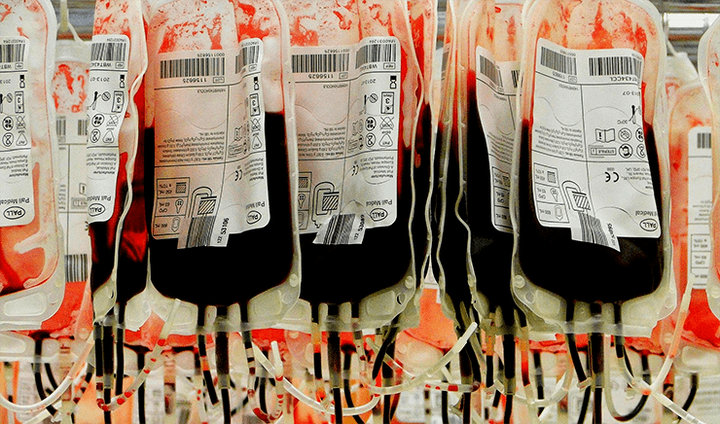
Статья на конкурс «био/мол/текст»: Никто из нас не застрахован от непредвиденных обстоятельств, когда судьбу может решить каждая минута. Например, в результате серьезной травмы, тяжелых родов или операций человек может потерять слишком много крови. Еще в античные времена люди поняли, что такие кровопотери можно компенсировать вливанием крови других людей, однако долгое время такие процедуры были безуспешны, зачастую ухудшали состояние и так тяжелого больного, а иногда даже приводили к смерти. Лишь с начала XX века переливания крови были поставлены на поток. Это произошло благодаря тому, что австрийский ученый Карл Ландштейнер понял, что кровь разных людей отличается по набору неких молекулярных меток, и чтобы переливания были успешны, эти молекулы у донора и реципиента должны быть совместимы. Что же это за метки и какие у них свойства? Почему кровь людей разная? Ведь неспроста же природа исхитрилась, создавая все это разнообразие. Каково современное состояние трансфузиологии, учения о переливании крови, и как человечество пришло к тому, что мы имеем сейчас в этой области? Давайте же разберемся в иммунологической гематологии и постараемся ответить на все эти вопросы.
-
2007Статья на конкурс «био/мол/текст»: Предложив милейшему медленному лори сходить в бар, вы с удивлением узнаете, что... Нет, это не начало какой-то выдуманной истории, просто это чудесное создание не прочь налечь на что-нибудь покрепче. Неужели у лори был неудачный день на дереве, или же это вполне обоснованный выбор? Сейчас мы и разберемся.
-
3593Вот Сколковский институт науки и технологий. А это Центр наук о жизни в Сколковском институте науки и технологий. А вот лаборатория изучения метаболизма прокариот Центра наук о жизни в Сколковском институте науки и технологий. А здесь ключевые слова лаборатории изучения метаболизма прокариот Центра наук о жизни в Сколковском институте науки и технологий: Genome mining, метод Topo-Seq, CRISPR, ДНК-гираза, метод HI-C, микроцины, гонка вооружений фагов и бактерий — и это лишь малая часть. В статье читатель узнает подробности внутренней жизни лаборатории и ее исследовательской работы.
-
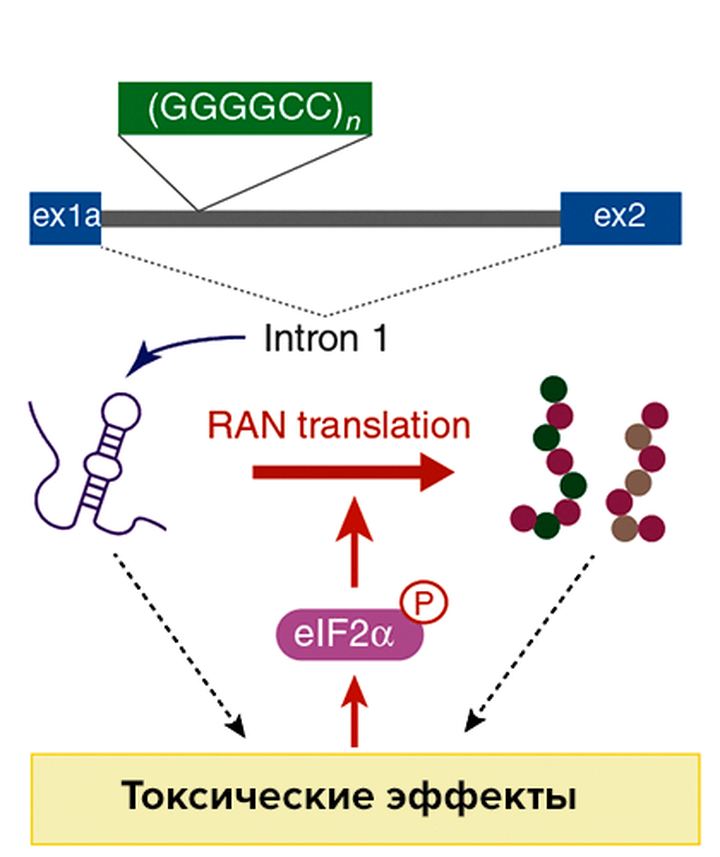
Всем нам известно со школы, что трансляция начинается со старт-кодона — кодона AUG. Однако в 2011 году был описан особый вид AUG-независимой трансляции, обычно характерный для генов, содержащих повторы из нескольких нуклеотидов. Очень часто увеличение количества таких повторов приводит к развитию нейродегенеративных заболеваний, например, болезни Хантингтона. Самое удивительное, что кодон AUG для синтеза таких белков с повторяющимися аминокислотами не нужен вовсе: трансляция может начинаться с любой из трех возможных рамок считывания. Этот загадочный вид трансляции получил название «RAN-трансляция» (от англ. repeat associated non-AUG translation). Как же она работает?
-
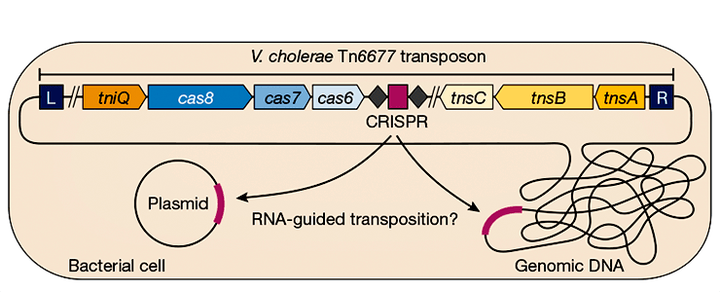
Уже давно известно, что системы CRISPR/Cas, защищающие бактерий и архей от вирусов, иногда обнаруживают в составе бактериофагов и транспозонов. Как правило, такие системы CRISPR/Cas неполные и не кодируют нуклеаз. Каково же функциональное предназначение этих «демо-версий» CRISPR/Cas? Недавно на страницах Nature американские исследователи сообщили, что бактериальные Tn7-подобные транспозоны используют свои системы CRISPR/Cas для РНК-направленной интеграции в геном. Более того, ученые предполагают, что транспозоны, которые содержат систему CRISPR/Cas и интегрируются в то место ДНК, которое комплементарно направляющей РНК, могут стать новым инструментом для редактирования генома. Наша статья посвящена этому интереснейшему открытию.


- Лента
- Спецпроекты
- ▶Подкаст
-
Конкурс
- О конкурсе «Био/мол/текст»
- «Био/мол/текст»-2025/2026
- «Био/мол/текст»-2024/2025
- «Био/мол/текст»-2023/2024
- «Био/мол/текст»-2022/2023
- «Био/мол/текст»-2021/2022
- «Био/мол/текст»-2020/2021
- «Био/мол/текст»-2019
- «Био/мол/текст»-2018
- «Био/мол/текст»-2017
- «Био/мол/текст»-2016
- «Био/мол/текст»-2015
- «Био/мол/текст»-2014
- «Био/мол/текст»-2013
- «Био/мол/текст»-2012
- «Био/мол/текст»-2011
- Объявления
- Авторы
- Партнеры
- Поддержать
Публикации
—
Темы
—
Авторы
—
Комментарии
—
Поиск не дал результатов
По вашему запросу ничего не найдено
- Медицина
- SARS-CoV-2
- «Биомолекула» — Forbes
- Аллергия
- Антибиотики
- Атеросклероз
- Аутоиммунитет
- Боль
- ВИЧ/СПИД
- Вакцины
- Вирус Зика
- Вирус Эбола
- Генная терапия
- Грипп
- Депрессия
- Дерматология
- Диагностика
- Здравоохранение
- Нейродегенерация
- Никотин
- Онкология
- Персонализированная медицина
- Питание
- Сон
- Стволовые клетки
- Фармакология
- Эпилепсия
- Биология
- «Сухая» биология
- Антропология
- Бионика
- Биофизика
- Вирусология
- Вопросы пола
- ГМО
- Генетика
- Иммунология
- Микробиология
- Нейробиология
- Носимые технологии
- Психогенетика
- Синтетическая биология
- Старение
- Структурная биология
- Цитология
- Эволюционная биология
- Экология
- Эмбриология
- Эпигенетика
- Этология
- Биомолекулы
- GPCR
- АФК
- Амилоиды
- Биомембраны
- Гормоны растений
- ДНК
- Ионные каналы
- МГЭ
- Матрикс
- Нейромедиаторы
- РНК
- Рецепторы
- Хроматин