ГМ-фаги на страже нашего здоровья
08 ноября 2022
ГМ-фаги на страже нашего здоровья
- 714
- 0
- 1
Фаги атакуют бактерию
рисунок автора статьи
-
Автор
-
Редактор
Статья на конкурс «Био/Мол/Текст»: Аббревиатура «ГМО» продолжает пугать многих людей по всему миру. Возможно, пугает даже больше, чем проблема антибиотикорезистентности бактерий. Что уж говорить о страхе перед вирусами, один из которых буквально несколько лет назад вызвал пандемию? Но что, если эти самые вирусы, да еще и генномодифицированные, смогут помочь нам в борьбе с бактериальными инфекциями? Что, если они окажутся нам не врагами, а друзьями? В этой статье мы разберемся, кто такие вирусы бактерий — бактериофаги, — чем они примечательны и как с их помощью мы, возможно, сможем предотвратить глобальную катастрофу.
Конкурс «Био/Мол/Текст»-2022/2023
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2022/2023.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Бактериальные инфекции: антибиотикорезистентность и альтернативы в лечении
Антибиотикорезистентность (АБР) становится глобальной проблемой [1–4]. Она приводит к повышенным медицинским затратам на лечение, увеличению длительности нахождения пациента в больнице и, в конце концов, — к повышенной смертности. Оценивается, что к 2050 году 10 миллионов жизней будут в смертельной опасности из-за АБР [5]. Растет количество болезней, от которых перестают помогать антибиотики: пневмония [6], туберкулез [7] и гонорея — это лишь вершина айсберга. Человечеству приходится находить новые способы борьбы с бактериальными заболеваниями, и один из них — использование методов генной инженерии [8] в отношении вирусов и бактерий. Далее мы разберем, почему генетическая модификация это не только не страшно, но и полезно, как ученые модифицируют организмы и почему за этим будущее.
Кто такие бактериофаги
Бактериофаги (или попросту фаги) — вирусы, поражающие бактерии и археи . В морях на каждую прокариотическую клетку приходится примерно 10 фагов [9–11], и есть основания полагать, что на суше происходит примерно то же самое [12].
О бактериофагах «Биомолекула» подробно рассказывала в одноименном спецпроекте. — Ред.
Фаги разделяются на умеренных и вирулентных. Первые встраивают свой геном в клеточную хромосому, где он может находиться долгое время. Этот процесс называется лизогенией (он возможен благодаря репрессорному гену, который подавляет разрушительные свойства бактериофага). Вирулентные же фаги после введения своего генома в клетку начинают реплицироваться, и вновь собранные вирусные частицы выходят в окружающую среду, завершая тем самым литический цикл (рис. 1).
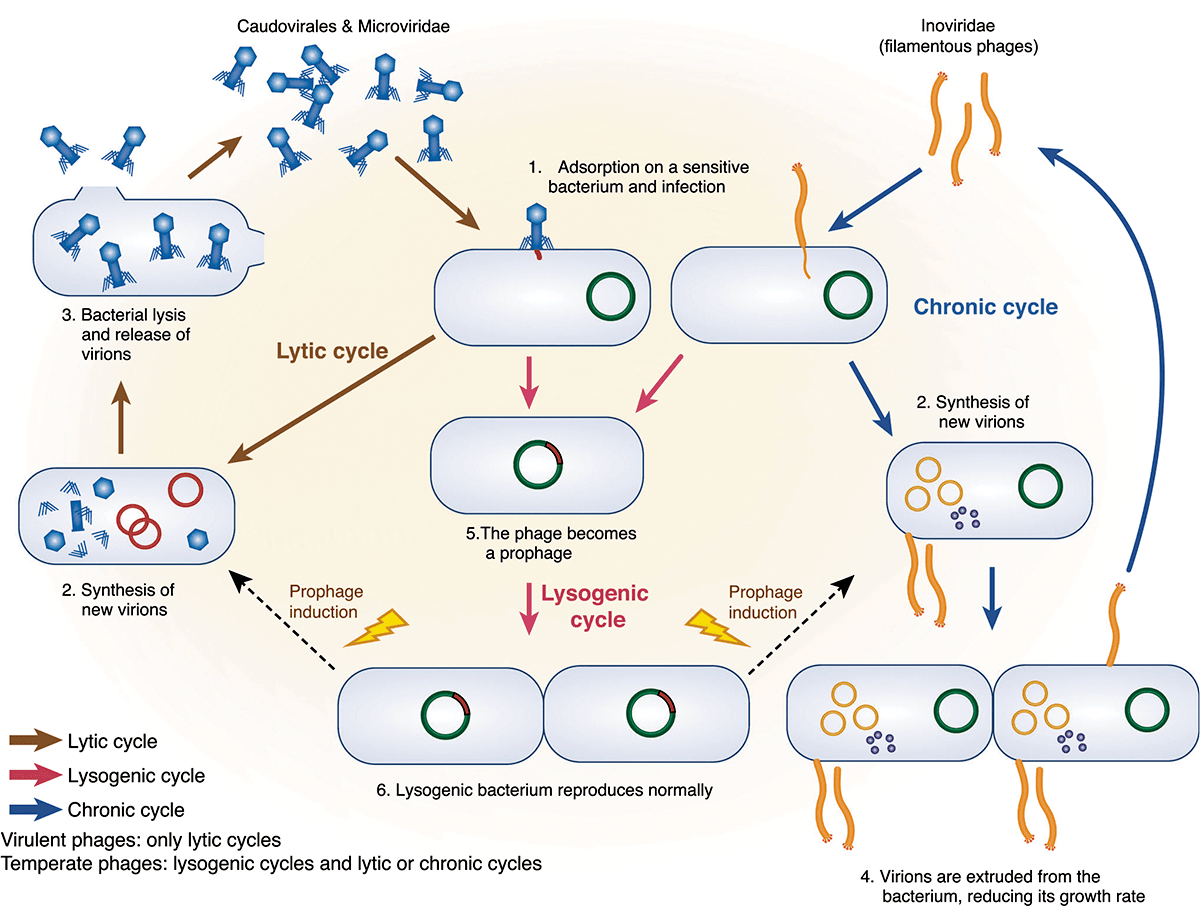
Рисунок 1. Жизненые циклы хвостатых и нитевидных фагов. Коричневая стрелочка — литический цикл; красная — лизогенный; синяя — жизненный цикл без лизиса клеток. 1 — Заражение клетки фагом. 2 — Синтез новых вирионов — вирусных частиц. 3 — Лизис клетки и выход фагов. 4 — Выход фагов из клеток без лизиса. 5 — Фаг становится профагом — частью хромосомы бактерии, куда он встраивается с помощью специальных ферментов. 6 — Бактерия размножается, реплицируя свою и, следовательно, фаговую ДНК.
Способность фагов находить и уничтожать бактериальную клетку сделало их в глазах исследователей потенциальным лекарством в лечении инфекций, вызываемых бактериями.
Краткая история терапии натуральными фагами
Первый раз применять бактериофагов в качестве лекарства начали почти сразу после их открытия, а именно в 1919 году, когда фаговый коктейль в качестве эксперимента ввели 12-летнему мальчику с тяжелой дизентерией. Симптомы инфекции ушли после первой дозы, и пациент полностью восстановился через несколько дней. Следующее десятилетие ученые во всем мире продолжали изучать и тестировать фаговую терапию на людях . Но со временем о бактериофагах практически забыли в связи с открытием антибиотиков [13]. Однако в наши дни все больше ученых вспоминают о фагах как об альтернативе антибиотикам, к которым становится устойчивым все большее число бактерий.
Подробнее историю применения фаготерапии читайте в статье «Бактериофаги в медицине» [14]. — Ред.
Прямое использование ГМ-фагов при бактериальных инфекциях
Генетическое модифицирование бактериофагов может значительно расширить потенциал их применения в науке и медицине. Например, бактериофаг ϕEf11 был впервые получен из изолята ротовой биопленки Enterococcus faecalis [15]. Ученые удалили репрессорный ген, ответственный за лизогению (после удаления его продукт не будет конкурировать за специальные сайты транскрипции в геноме вируса, что приведет к экспрессии литических генов), а также заменили гены ϕEf11, которые отвечают за репликацию ДНК и сборку вирусных частиц, генами родственного ему фага, тем самым заставив ϕEf11 более эффективно разрушать биопленку [16]. В итоге полученный ГМ-фаг отлично справился с уничтожением резистентной к ванкомицину E. faecalis, находящейся к тому же в биопленке [17].
Случаи применения ГМ-фагов в медицине далеко не единичны. Интересен будет и следующий прецедент.
Mycobacterium abscessus (M. abscessus) — быстрорастущая бактерия, вызывающая хроническую легочную инфекцию и способная инфицировать практически все органы, особенно у человека с ослабленным иммунитетом [18]. M. abscessus (она же nontuberculous mycobacteria (NTM) — нетуберкулезная микобактерия) быстро приобретает устойчивость к антибиотикам, что выливается в плохой клинический исход [19]. Люди с муковисцидозом (наследственным заболеванием, проявляющимся в накоплении жидкости в легких [20]) особенно подвержены заражению NTM [19]. Инфекции M. abscessus связаны с бóльшим ухудшением функций легких по сравнению с инфекциями типичными возбудителями муковисцидоза дыхательных путей и являются противопоказанием к пересадке легких [19]. При прогрессирующем муковисцидозе легких лечение антибиотиками может быть неудачным в связи со структурными изменениями легких. M. abscessus может образовывать биопленки внутри пораженных дыхательных путей [19], что препятствует успешному лечению.
Фаговая терапия M. abscessus не проста: клинически изолированные патогены очень сильно различаются по восприимчивости к разным бактериофагам, поэтому фаговые препараты должны подбираться для каждого пациента индивидуально [19]. Кроме того, большинство поражающих M. abscessus фагов — умеренные [19]. В недавно вышедшей статье описывается использование двух сконструированных микобактериофагов для лечения муковисцидоза и абсцесса легких, вызванных M. abscessus, резистентными к интенсивному лечению различными антибиотиками [19].
Клинический пример
В исследовании участвовал 26-летний мужчина с муковисцидозом, прогрессирующей бронхоэктатической болезнью, инфекцией M. abscessus и хронической инфекцией легких P. aeruginosa с множественной лекарственной устойчивостью (multidrug-resistant, MDR) и метициллинрезистентным Staphylococcus aureus (MRSA). Пять лет назад мужчина успешно лечился от легочной инфекции Mycobacterium avium без признаков рецидива. Во взрослом возрасте течение его болезни отличалось частыми легочными обострениями, требующими госпитализации и внутривенного лечения антибиотиками. В мае 2016 года (за 1582 дня до начала фаговой терапии (ДДНФТ)) анализы культуры мокроты впервые дали положительный результат на подвид M. abscessus с интактным геном erm (erythromycin resistance methylase gene, геном устойчивости к антибиотику эритромицину и ряду других антибиотиков [21]). В дальнейшем анализы пациента ухудшались. За 1236 ДДНФТ пациент начал принимать несколько антибиотиков. В течение последних 4,7 лет (включая 1582 ДДНФТ) больной принимал 4–5 лекарственных препаратов. Несмотря на интенсивную терапию, анализы на M. abscessus продолжали давать положительный результат. За 12 месяцев, предшествовавших введению фагов, пациенту потребовалось 11 госпитализаций продолжительностью от 11 до 21 дня. Ему было отказано в трансплантации легких тремя независимыми программами трансплантации из-за невозможности избавления от инфекции. Если бы все продолжилось такими же темпами, больному оставалось жить не более нескольких лет [19].
Секвенировав геном бактерий из легких больного, ученые обнаружили множество генов, участвующих в устойчивости к антибиотикам. После изоляты изучили на восприимчивость к ГМ-бактериофагам, у которых методами генной инженерии удалили часть репрессорного гена, сделав их литическими. Ученые в ходе испытаний отобрали двух бактериофагов, убивавших бактерий лучше всего. Ими оказались фаги BPsΔ33HTH_HRM10 и D29_HRM^GD40 (рис. 2). Их успешно размножили и проверили на токсичность. Фаги оказались безопасными для человека.
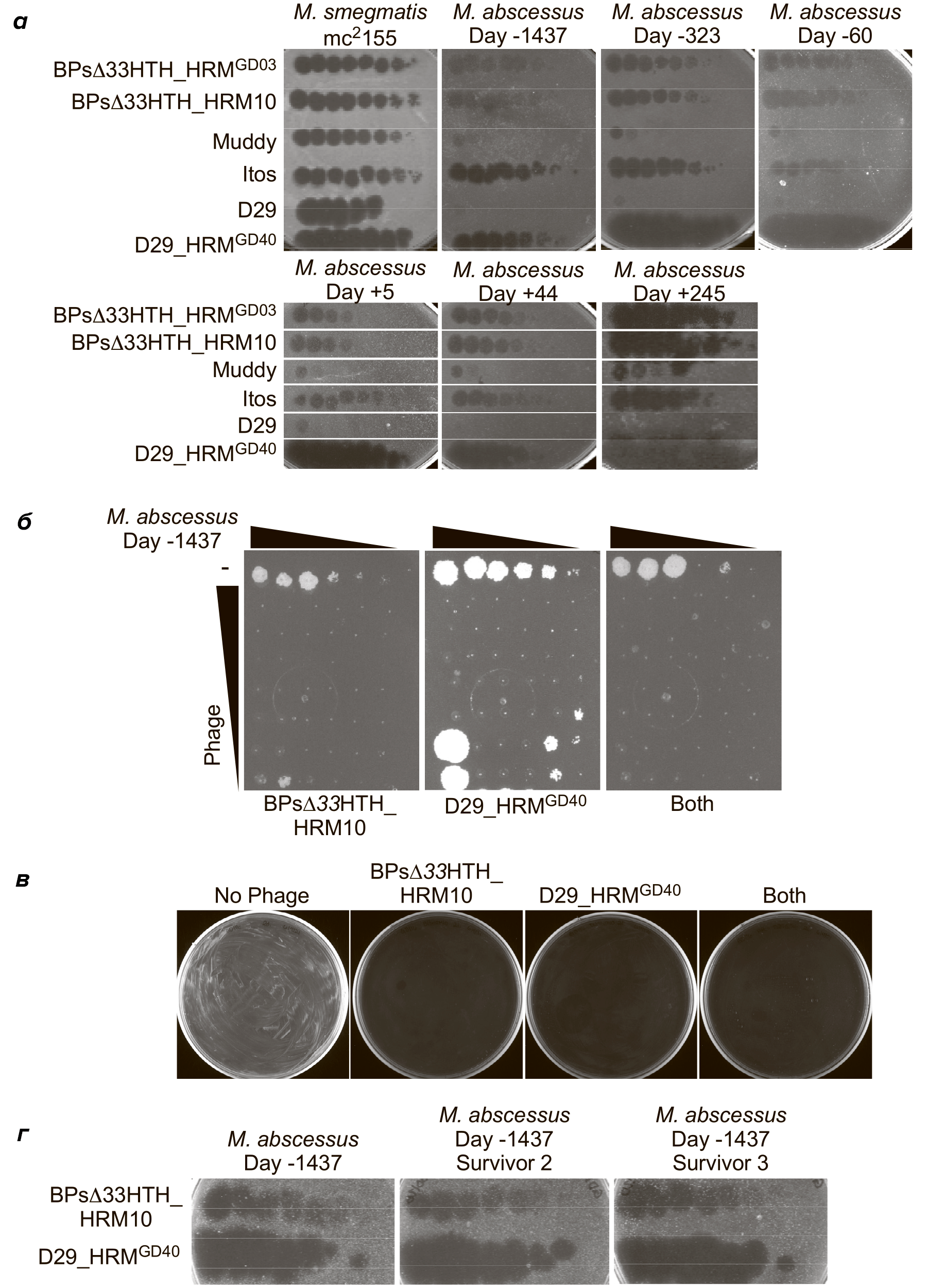
Рисунок 2. Тестирование бактериофагов на изолятах, полученных от больного. а — Нанесение различных бактериофагов на культуры M. abscessus, полученные от пациента. Круги — области, на которых произошел лизис бактерий. б — Уничтожение штаммов M. abscessus, полученных за 1437 ДДНЛФ, с помощью фагов BPΔ33HTH_HRM10, D29_HRM^GD40 или обоих. в — Анализ выживаемости, показывающий эффективность уничтожения M. abscessus вышеупомянутыми фагами, а также коктейлем из обоих. г — Исследование восприимчивости к бактериофагам двух выживших после испытаний фагами штаммов M. abscessus, собранных за 1437 ДДНФТ, показывающее, что оба штамма в итоге оказались восприимчивыми к фагам.
Фаговая терапия началась, когда пациент был близок к очередному обострению. Фагов вводили внутривенно два раза в день. Лечение переносилось хорошо, побочных эффектов не возникало. Через пять дней после начала терапии пациента выписали из больницы. В конце концов инфекцию удалось взять под контроль, и спустя год после начала терапии больному пересадили легкие.
Умеренные ГМ-фаги в терапии инфекционных заболеваний
Бактериофаги можно использовать не только для прямого лизиса клеток. Умеренные фаги способны встраивать в бактериальную хромосому нужные ученым гены. Есть несколько работ, в которых исследователи воспользовались этим.
Мутация гена rpsL является важнейшей в становлении резистентности бактерии к антибиотику стрептомицину. Это лекарство эффективно уничтожает как грамположительных, так и грамотрицательных бактерий. Однако выясняется, что от 20% до 85,2% бактерий Mycobacterium tuberculosis несет мутацию либо в гене rpsL, либо rrs, что становится причиной их резистентности к стрептомицину [22]. Продукт гена rpsL, S12, — высококонсервативный важный для клетки белок малой субъединицы рибосомы, а ген rrs кодирует 16S рибосомную РНК (РНК малой субъединицы рибосомы). Если в гене появляется мутация, стрептомицин перестает связываться с белком или РНК, и бактерия выживает.
Для эксперимента ученые вырастили на среде со стрептомицином колонии E. coli и отобрали бактерий, которые оказались устойчивыми к антибиотику. Изменения в rpsL обнаружили у 21 из 22 мутантов.
Ученые в ходе исследования использовали фаг лямбда штамм gt11 как удобное средство для доставки целевых генов в бактерию. Особенностью этого штамма является то, что он может запускать как литический, так и лизогенный цикл в зависимости от температуры окружающей среды , а также в его геноме присутствует делеция, позволяющая вставить в него интактные гены, ответственные за синтез немутантного S12. Один из резистентных штаммов E. coli инфицировали рекомбинантным фагом и культивировали при температуре 32 °C, что позволило фагу инициировать лизогенный цикл и встроиться в геном бактерии. В результате штамм стал чувствителен к антибиотику.
О фаге лябда «Биомолекула» писала в статье «Модельные организмы: фаг лямбда» спецпроекта «Двенадцать модельных организмов» [23]. — Ред.
В другом исследовании ученые создали умеренного ГМ-фага M13mp18 со сверхэкспрессией гена lexA3, продукт которого подавляет бактериальную систему SOS-репарации ДНК. Обработка нарушающими структуру ДНК антибиотиками штаммов бактерий, инфицированных модифицированным M13mp18, усилило бактерицидное действие антибиотиков на 4,5 и 2,7 порядка по сравнению с образцами, обработанными только антибиотиком и антибиотиком с интактным M13mp18 (с обычным уровнем экспрессии lexA3) соответственно. ГМ-фаг был эффективен даже в уничтожении штаммов, резистентных к лекарствам [24].
Ученые продемонстрировали эффективность данного метода и in vivo на мышах. Животные, получавшие антибиотик и ГМ-фаг, выживали в 80% случаев, в то время как получавшие только антибиотик мыши выживали в 20% случаев, а получавшие антибиотик и интактный фаг — в 50% случаев [24].
Фагмиды как ГМ-фаги
Не обойдем стороной в нашей статье и CRISPR/Cas [25], [26]. Ученые на основе нитчатых фагов создали фагмиду (вектор, который состоит из фага, объединенного с бактериальной плазмидой), направленную на ген β-лактамазы, необходимый клетке для устойчивости к β-лактамным антибиотикам [27]. После попадания фагмиды в бактерию, направляемая РНК нуклеаза связывается со специальной последовательностью ДНК внутри гена β-лактамазы и создает двухцепочечный разрыв, который приводит либо к гибели клетки, либо к потере антибиотикорезистентности. Данный метод можно использовать для таргетного уничтожения антибиотикорезистентных клеток. Количество клеток E. coli, несущих ген β-лактамазы и обработанных фагмидой, в результате эксперимента уменьшалось на 2–3 порядка, в то время как количество клеток без этого гена оставалось неизменным.
Еще немного про бактериофаги и CRISPR
С помощью системы CRISPR и ГМ-фагов можно модифицировать или инактивировать любой ген в популяции бактерий, не затрагивая при этом полезную микробиоту. Для этого ученые модифицировали бактериофаг ΦCD24-2, который стал кодировать самонаправляющуюся систему CRISPR для изменения эндогенной системы CRISPR/Cas3 бактерии Clostridium difficile, расположенной в ее хромосоме [28]. После инфицирования, доставленная фагом система CRISPR активирует эндогенный белок Cas3, который начинает последовательно уничтожать хромосому клетки-хозяина. Такой ГМ-фаг намного лучше уничтожал C. difficile, чем интактный.
Фаги как курьеры
Способность бактериофагов точечно поражать бактерии может использоваться для таргетной доставки лекарственных препаратов к клеткам. Так, ученые модифицировали нитевидный фаг fUSE5-ZZ [29], заменив белок его капсида p8 на более специфичный для связывания с бактерией пептид, а также с помощью специального минорного домена белка капсида соединили с фагом иммуноглобулин IgG [29], [30]. Так он стал еще точнее связываться нужной клеткой. Затем к фагу добавили неактивную форму хлорамфеникола — бактериостатического антибиотика. Ученым удалось связать с вирусом больше 40 тысяч молекул хлорамфеникола! Таким образом, бактериофаг таргетно связывался с клеткой-мишенью, а специальные ферменты — эстеразы — активировали хлорамфеникол вблизи бактерии. Этот подход увеличивал локальную концентрацию лекарства, что уменьшало его токсичность для всего организма пациента [29]. В ходе экспериментов in vitro модифицированный фаг успешно подавлял рост S. aureus, Streptococcus pyogenes и E. coli, а также был нетоксичен при введении его мышам [30], [31].
В геном бактериофагов можно встроить и ген, ингибирующий рост и выживаемость бактерий. Так, ученые сконструировали фаг М13, который стал нести токсичные гены gef и chpBK, вызывающие гибель клетки при недостатке питательных веществ. Бактерии, инфицированные таким ГМ-фагом, из-за чего в них синтезировался либо Gef, либо ChpBK, показали сокращение колониеобразующих единиц в 948 и 1579 раз соответственно.
ГМ-фаги как разрушители биопленки
Часто бактерии могут создавать колонии, где клетки связаны полисахаридным внеклеточным матриксом, который усиливает прикрепление клеток к поверхности и затрудняет доступ лекарств к бактериям [32]. Инфицирующие таких бактерий фаги часто продуцируют ферменты, разрушающие полисахариды биопленки. Те же фаги, которые лишены генов, кодирующих эти ферменты, могут быть модифицированы для получения их. Например, ученые создали ГМ-фаг T7, геном которого стал кодировать разрушающий биопленку фермент диспергин B [33].
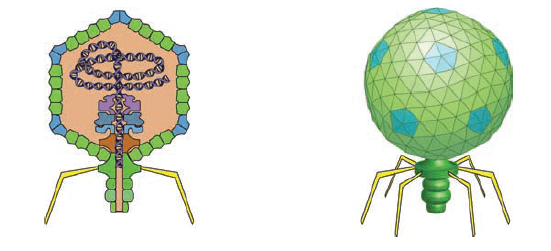
Рисунок 3. Строение бактериофага T7. ГМ-T7 уменьшал количество клеток в биопленке на 99% и был на два порядка эффективнее в разрушении биопленки, чем интактный фаг, лишенный диспергина B.
Однако разрушающие биопленку ферменты крайне специфичны к типу полисахаридов, с которыми они взаимодействуют, потому исследователи ищут разные подходы к разрушению биопленок. Так, ученые решили сконструировать фаг [34], ферменты которого будут вмешиваться в коммуникацию бактерий, нарушая чувство кворума [35], [36]. Получившийся фаг T7aiiA содержал ген бактерии Bacillus anthracis, продукт которого инактивирует молекулы чувства кворума — ацилгомосериновые лактоны. T7aiiA успешно подавлял чувство кворума в биопленке Pseudomonas aeruginosa и E. coli, уменьшая биомассу на 75% и 66% через 4 и 8 часов соответственно, тогда как интактный фаг T7 уменьшал биомассу на 24% и 32%.
Борьба с внутриклеточными патогенами с помощью ГМ-фагов
Некоторые бактерии, такие как Chlamydia trachomatis, являющаяся самой частой причиной заболеваний, передающихся половым путем, — это облигатные внутриклеточные патогены, что не дает бактериофагам уничтожить их, так как внутрь эукариотической клетки обычный фаг попасть не может — он просто не узнает рецепторы, через которые он мог бы проникнуть в нее. Однако проблема решается с помощью, как вы уже, наверное, догадались, генной инженерии [37], [38]. Для того чтобы у фага M13 была возможность добраться до бактерии, ученые заставили его производить два новых белка: интегрин-связывающий белок (англ. integrin-binding peptide, RGD), который соединили с белком p8 оболочки фага, и полимерный мембранный белок D (англ. polymorphic membrane protein D, PmpD), связанный с белком p3 оболочки фага [37]. RGD ответственен за интегрин-опосредованный эндоцитоз, благодаря чему фаг попадает внутрь эукариотической клетки. PmpD в свою очередь прерывает размножение C. trachomatis. ГМ-фаг использовали для предварительной обработки HeLa и первичных эндоцервикальных клеток, после чего к ним добавляли бактерий. В итоге количество C. trachomatis в клеточных линиях значительно уменьшилось [37].
ГМ-фаги как альтернатива фаговым коктейлям
Часто спектр хозяев конкретного бактериофага недостаточно велик для терапии инфекций. В таких случаях врачи используют фаговые коктейли. И хотя эта стратегия хорошо показала себя [39–42], до сих пор сложно подобрать конкретные фаги под разные виды и штаммы бактерий, а многие фаги в коктейле могут обладать широким спектром хозяев, что будет сказываться также и на полезной микробиоте.
В поисках альтернативы фаговым коктейлям, исследователи обнаружили взаимосвязь между белками хвостовых нитей капсида и спектром хозяев вирусов [43]. Так, ученые модифицировали фаг T2 (заражающий штамм E. coli K-12), заменив с помощью гомологичной рекомбинации гены (gp37 и gp38) его «родных» хвостовых нитей на гены фага PP01, который избирательно поражает штамм E. coli O157:H7 [44]. Сконструированный таким образом фаг T2ppD1 имел такой же спектр хозяев, как PP01, но потерял изначальную способность инфицировать штамм E. coli K-12. Казалось бы, почему сразу не использовать PP01 в качестве лекарства? Дело в том, что к PP01 у бактерий относительно быстро вырабатывается резистентность, чего можно избежать, создав новый бактериофаг на основе T2 [44].
Похожий подход применили и в другом исследовании, где ученые модифицировали все тот же фаг T2 путем гомологичной рекомбинации. После этого вирус стал поражать на 26% больше изолятов E. coli, собранных из окружающей среды [45].
Гибрид фагов T3 и T7 — T3/7 — создали на основе T3, у которого белки (продукты гена 17) части хвостовых нитей заменили на подобные белки фага T7. Такой ГМ-фаг имел больший спектр хозяев и лучше адсорбировался на них, чем интактные фаги T3 и T7 [46].
Спектр хозяев нитчатого фага fd расширили путем добавления рецептор-связывающего домена другого нитчатого фага IKe на N-конец белка гена 3 (англ. gene 3 protein, g3p) [47]. В итоге химерный fd стал инфицировать штаммы E. coli, несущие N-пили [47].
В другой работе все того же фага fd «научили» поражать не только E. coli, но и Vibrio cholerae, некоторые серотипы которого вызывают холеру, путем слияния гена оболочки pIII из fd с последовательностью гена orfU, кодирующего 274 N-концевые аминокислоты белка оболочки фага CTXφ [48]. Рекомбинантный бактериофаг fd-pIII^CTX приобрел способность инфицировать V. cholerae, при этом не утратив возможности инфицировать E. coli [48].
Проблемы использования ГМ-фагов в терапии
Казалось бы, терапия фагами всем хороша. Действительно, к ее плюсам можно отнести автоматическую дозировку лекарства, низкую токсичность и узкий потенциал развития резистентности. Но есть и свои минусы.
Умеренные фаги, встраиваясь в геном бактерии, способны защищать ее от инфицирования другими фагами или уничтожения антибиотиками [49], тем самым «своими руками» мешать успешной терапии инфекции. Однако от этой проблемы можно избавиться, используя генномодифицированных фагов, вырезав у них необходимые гены.
Фаги представляют собой относительно живые биологические агенты на основе белка и нуклеиновой кислоты, что потенциально позволяет им взаимодействовать с иммунной системой организма. Они могут активно размножаться и эволюционировать в ходе терапии. Все это может отпугнуть некоторые компании, которые хотят иметь четкое право собственности на свой продукт.
Размер генома многих хвостатых бактериофагов ограничен размером капсида, что сказывается на том, какое количество нужных нам генов мы можем добавить в геном вируса.
Использование ГМ-фагов в медицине заставляет задуматься о том, что будет, когда последние попадут в окружающую среду. ГМ-фаги смогут повлиять на динамику природного бактериального сообщества, эволюцию геномов и биогеохимию.
Дополнительную озабоченность вызывает возможное взаимодействие ГМ-фагов с эукариотическими клетками. Как было указано в статье, определенные манипуляции с бактериофагами могут позволить им взаимодействовать с клетками человека.
Суммируя все вышесказанное, мне хочется передать «эстафету» размышлений о том, необходимо ли развивать фаговую терапию и создавать генномодифицированных фагов, читателю и всему остальному миру. Рано или поздно этот вопрос встанет ребром, поэтому начать размышлять стоит уже сейчас!
Литература
- Антибиотики и антибиотикорезистентность: от древности до наших дней;
- Антибиотикорезистентность: How to make antibiotics great again*?;
- По следам антибиотиков: что могло пойти не так и как это исправить?;
- Что делать с резистентностью к антибиотикам? Новые данные: распространение между странами и борьба с мультилекарственной устойчивостью;
- Elias B. Chahine, John A. Dougherty, Krisy-Ann Thornby, Erenie H. Guirguis. (2022). Antibiotic Approvals in the Last Decade: Are We Keeping Up With Resistance?. Ann Pharmacother. 56, 441-462;
- Пневмококк и его инфекции;
- Туберкулез: роковая история коварной болезни;
- 12 методов в картинках: генная инженерия. Часть II: инструменты и техники;
- Curtis A. Suttle. (2005). Viruses in the sea. Nature. 437, 356-361;
- Jed A. Fuhrman. (1999). Marine viruses and their biogeochemical and ecological effects. Nature. 399, 541-548;
- Jed A. Fuhrman, Rachel T. Noble. (1995). Viruses and protists cause similar bacterial mortality in coastal seawater. Limnol. Oceanogr.. 40, 1236-1242;
- A. R. Mushegian. (2020). Are There 10 31 Virus Particles on Earth, or More, or Fewer?. J Bacteriol. 202;
- George P. C. Salmond, Peter C. Fineran. (2015). A century of the phage: past, present and future. Nat Rev Microbiol. 13, 777-786;
- Бактериофаги в медицине;
- R. H. Stevens, O. D. Porras, A. L. Delisle. (2009). Bacteriophages induced from lysogenic root canal isolates ofEnterococcus faecalis. Oral Microbiology and Immunology. 24, 278-284;
- H. Zhang, D. E. Fouts, J. DePew, R. H. Stevens. (2013). Genetic modifications to temperate Enterococcus faecalis phage ϕEf11 that abolish the establishment of lysogeny and sensitivity to repressor, and increase host range and productivity of lytic infection. Microbiology. 159, 1023-1035;
- Justine Monnerat Tinoco, Bettina Buttaro, Hongming Zhang, Nadia Liss, Luciana Sassone, Roy Stevens. (2016). Effect of a genetically engineered bacteriophage on Enterococcus faecalis biofilms. Archives of Oral Biology. 71, 80-86;
- Joon Young Song, Jang Wook Sohn, Hye Won Jeong, Hee Jin Cheong, Woo Joo Kim, Min Ja Kim. (2006). An outbreak of post-acupuncture cutaneous infection due to Mycobacterium abscessus. BMC Infect Dis. 6;
- Jerry A. Nick, Rebekah M. Dedrick, Alice L. Gray, Eszter K. Vladar, Bailey E. Smith, et. al.. (2022). Host and pathogen response to bacteriophage engineered against Mycobacterium abscessus lung infection. Cell. 185, 1860-1874.e12;
- Муковисцидоз — первые надежды;
- George A. Syrogiannopoulos, Ioanna N. Grivea, Amelia Tait-Kamradt, George D. Katopodis, Nicholas G. Beratis, et. al.. (2001). Identification of an erm (A) Erythromycin Resistance Methylase Gene in Streptococcus pneumoniae Isolated in Greece. Antimicrob Agents Chemother. 45, 342-344;
- Ruiru Shi, Jianyuan Zhang, Chuanyou Li, Yuko Kazumi, Isamu Sugawara. (2007). Detection of streptomycin resistance in Mycobacterium tuberculosis clinical isolates from China as determined by denaturing HPLC analysis and DNA sequencing. Microbes and Infection. 9, 1538-1544;
- Модельные организмы: фаг лямбда;
- Timothy K. Lu, James J. Collins. (2009). Engineered bacteriophage targeting gene networks as adjuvants for antibiotic therapy. Proc. Natl. Acad. Sci. U.S.A.. 106, 4629-4634;
- Просто о сложном: CRISPR/Cas;
- Как CRISPR/Cas работает не по специальности;
- Robert J Citorik, Mark Mimee, Timothy K Lu. (2014). Sequence-specific antimicrobials using efficiently delivered RNA-guided nucleases. Nat Biotechnol. 32, 1141-1145;
- Kurt Selle, Joshua R. Fletcher, Hannah Tuson, Daniel S. Schmitt, Lana McMillan, et. al.. (2020). In Vivo Targeting of Clostridioides difficile Using Phage-Delivered CRISPR-Cas3 Antimicrobials. mBio. 11;
- Iftach Yacoby, Marina Shamis, Hagit Bar, Doron Shabat, Itai Benhar. (2006). Targeting Antibacterial Agents by Using Drug-Carrying Filamentous Bacteriophages. Antimicrob Agents Chemother. 50, 2087-2097;
- Iftach Yacoby, Hagit Bar, Itai Benhar. (2007). Targeted Drug-Carrying Bacteriophages as Antibacterial Nanomedicines. Antimicrob Agents Chemother. 51, 2156-2163;
- Lilach Vaks, Itai Benhar. (2011). In vivo characteristics of targeted drug-carrying filamentous bacteriophage nanomedicines. Journal of Nanobiotechnology. 9, 58;
- Celia Ferriol-González, Pilar Domingo-Calap. (2020). Phages for Biofilm Removal. Antibiotics. 9, 268;
- Timothy K. Lu, James J. Collins. (2007). Dispersing biofilms with engineered enzymatic bacteriophage. Proc. Natl. Acad. Sci. U.S.A.. 104, 11197-11202;
- Ruoting Pei, Gisella R. Lamas-Samanamud. (2014). Inhibition of Biofilm Formation by T7 Bacteriophages Producing Quorum-Quenching Enzymes. Appl Environ Microbiol. 80, 5340-5348;
- Бактерии, молчать! Как и зачем вносить помехи в межклеточное общение;
- «Бактериофаг-1 Бактериофагу-2, приём!»;
- Shanta Raj Bhattarai, So Young Yoo, Seung-Wuk Lee, Deborah Dean. (2012). Engineered phage-based therapeutic materials inhibit Chlamydia trachomatis intracellular infection. Biomaterials. 33, 5166-5174;
- C. Bébéar, B. de Barbeyrac. (2009). Genital Chlamydia trachomatis infections. Clinical Microbiology and Infection. 15, 4-10;
- A. Wright, C.H. Hawkins, E.E. Änggård, D.R. Harper. (2009). A controlled clinical trial of a therapeutic bacteriophage preparation in chronic otitis due to antibiotic-resistantPseudomonas aeruginosa; a preliminary report of efficacy. Clinical Otolaryngology. 34, 349-357;
- Jingmin Gu, Xiaohe Liu, Yue Li, Wenyu Han, Liancheng Lei, et. al.. (2012). A Method for Generation Phage Cocktail with Great Therapeutic Potential. PLoS ONE. 7, e31698;
- Ana Oliveira, Rui Sereno, Joana Azeredo. (2010). In vivo efficiency evaluation of a phage cocktail in controlling severe colibacillosis in confined conditions and experimental poultry houses. Veterinary Microbiology. 146, 303-308;
- Abhishek Jaiswal, Hemanta Koley, Amit Ghosh, Anup Palit, Banwarilal Sarkar. (2013). Efficacy of cocktail phage therapy in treating Vibrio cholerae infection in rabbit model. Microbes and Infection. 15, 152-156;
- Diana P. Pires, Sara Cleto, Sanna Sillankorva, Joana Azeredo, Timothy K. Lu. (2016). Genetically Engineered Phages: a Review of Advances over the Last Decade. Microbiol Mol Biol Rev. 80, 523-543;
- Masatoshi Yoichi, Michiharu Abe, Kazuhiko Miyanaga, Hajime Unno, Yasunori Tanji. (2005). Alteration of tail fiber protein gp38 enables T2 phage to infect Escherichia coli O157:H7. Journal of Biotechnology. 115, 101-107;
- Faezeh Mahichi, Aidan John Synnott, Keiko Yamamichi, Toshiya Osada, Yasunori Tanji. (2009). Site-specific recombination of T2 phage using IP008 long tail fiber genes provides a targeted method for expanding host range while retaining lytic activity. FEMS Microbiology Letters. 295, 211-217;
- Tiao-Yin Lin, Yi-Haw Lo, Pin-Wei Tseng, Shun-Fu Chang, Yann-Tsyr Lin, Ton-Seng Chen. (2012). A T3 and T7 Recombinant Phage Acquires Efficient Adsorption and a Broader Host Range. PLoS ONE. 7, e30954;
- Roberto Marzari, Daniele Sblattero, Massimo Righi, Andrew Bradbury. (1997). Extending filamentous phage host range by the grafting of a heterologous receptor binding domain. Gene. 185, 27-33;
- Andrew J. Heilpern, Matthew K. Waldor. (2003). pIII CTX , a Predicted CTXφ Minor Coat Protein, Can Expand the Host Range of Coliphage fd To Include Vibrio cholerae. J Bacteriol. 185, 1037-1044;
- Jakob Haaber, Jørgen J. Leisner, Marianne T. Cohn, Arancha Catalan-Moreno, Jesper B. Nielsen, et. al.. (2016). Bacterial viruses enable their host to acquire antibiotic resistance genes from neighbouring cells. Nat Commun. 7;
- R. Sausset, M. A. Petit, V. Gaboriau-Routhiau, M. De Paepe. (2020). New insights into intestinal phages. Mucosal Immunol. 13, 205-215.