Метаболизм: великий разрушитель и созидатель
16 января 2025
Метаболизм: великий разрушитель и созидатель
- 422
- 0
- 2
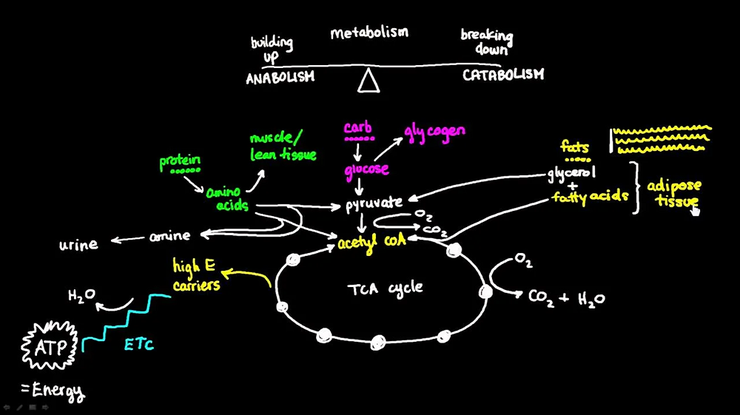
Эта медицинская схема отражает человеческий метаболизм, однако ее можно отнести и к целой биосфере. По существу, биодеградация — это часть катаболизма. Разумеется, катаболизм — расщепление крупных молекул — неразрывно связан с анаболизмом — синтезом крупных молекул из малых. В этой статье приведены примеры обоих процессов.
Рисунок в полном размере.
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Когда берешься за юбилейную, десятую по счету статью, безусловно чувствуешь груз ответственности. Оплошать и написать хуже, чем предыдущие, уже нельзя. Тем более, что по совместительству эта работа девятая, посвященная биодеградации (мы даже завели на «Биомолекуле» отдельную рубрику про это — Ред.). И отражающей это явление противоположности — биосинтезу необычных природных веществ.
Но нам повезло стать свидетелями бурного развития экспериментальной науки, которая всё настойчивее исправляет и корректирует устоявшиеся теории из учебников. Соответственно, среди конкретных примеров нет-нет, да и находятся самородки, которыми хочется поделиться с читателем. Тем более, что некоторые из этих примеров настолько новые и малоизвестные, что их еще не коснулась рука популяризатора. Есть желание стать первым.
Поэтому пусть эта статья будет не девятой или десятой. А частью одного большого, капитального труда. Воображение уже сформировало образ хорошей научно-популярной книги.
Конечно, надо понимать, что биодеградация — это не только путь превращения вещества, в котором формулы разделены стрелками. Это целый комплекс методов и стандартов, на первый взгляд далеких от биохимии. Охватывающих, например, физику, инженерные науки и сопротивление материалов. Этому тоже следует уделить внимание, чтобы не было перекоса в одну только биохимию.
Конкурс «Био/Мол/Текст»-2024/2025
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2024/2025.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Биодеградация с обратным знаком
В предыдущих статьях [1–8] я исходил биодеградацию вдоль и поперек: хорошо известную и сенсационную; полезную и вредную; переходящую в биосинтез или даже в свою противоположность — производство биоразлагаемых материалов. Но есть у нее и другая противоположность, лишь кратко упомянутая в статье [6]. Если материалы подвергаются биологическому разрушению, значит, их сохранность сильно зависит от способности ему противостоять. А значит, создавая новые материалы — пластмассы, металлы и их сплавы, новые составы стекол, композиты и керамику — ученые и инженеры должны помнить об их биостойкости. Особенно это важно для строительных материалов, когда на кону стоят не только комфорт, но и безопасность людей, сохранность их имущества.
Понимание этого пришло сравнительно недавно. Сначала обрастание микроорганизмами стало неприятным сюрпризом во влажных тропиках, где оно происходит особенно быстро. Сначала начали проверять на устойчивость к микроорганизмам именно материалы и изделия для этих регионов; но и многие из нас, обитателей умеренных широт, сталкиваются с победным маршем плесневых грибков на стенах квартир (рис. 1) — особенно в ванных комнатах, где условия приближаются к тропическим. А грибки, как мы знаем, не только портят интерьер: это источник аллергенов, а то и опасных токсинов.

Рисунок 1. Удручающее зрелище — комната, стены которой покрыты плесенью. Не то, что жить и работать — просто находиться в таком помещении опасно!
сайт Строй Как Надо
И теперь любую пластмассу и композитный материал обязательно исследуют на грибостойкость. Если из пластика при помощи пресса приготовить пластинку или пленку и оставить ее во влажной почве на месяц, она может обрасти мицелием грибов или бактериальной пленкой. А если не обрастет, если поверхность останется чистой — значит, материал можно считать устойчивым к биодеградации.
Проблема настолько актуальная, что созданы специальные регламенты и ГОСТы для оценки биостойкости. Например, изготовленные из тестируемого материала пластинки вертикально закапываются в почву на 28 суток. Затем пластинку вынимают, фотографируют, изменения поверхности тщательно фиксируют и оценивают по специальной шкале.
Разработаны и более сложные и точные методы, когда материал закапывают уже не на месяц, а на полгода. Оценивают уже не обрастание поверхности, а изменение прочности и механических характеристик материала. Пластинки должны иметь точные размеры, а упругость и прочность материала оценивают на специальной машине (рис. 2, справа), сгибающей и растягивающей пластинки. Если после такого «захоронения» материал сохраняет свойства — значит, тест на биостойкость пройден [9].
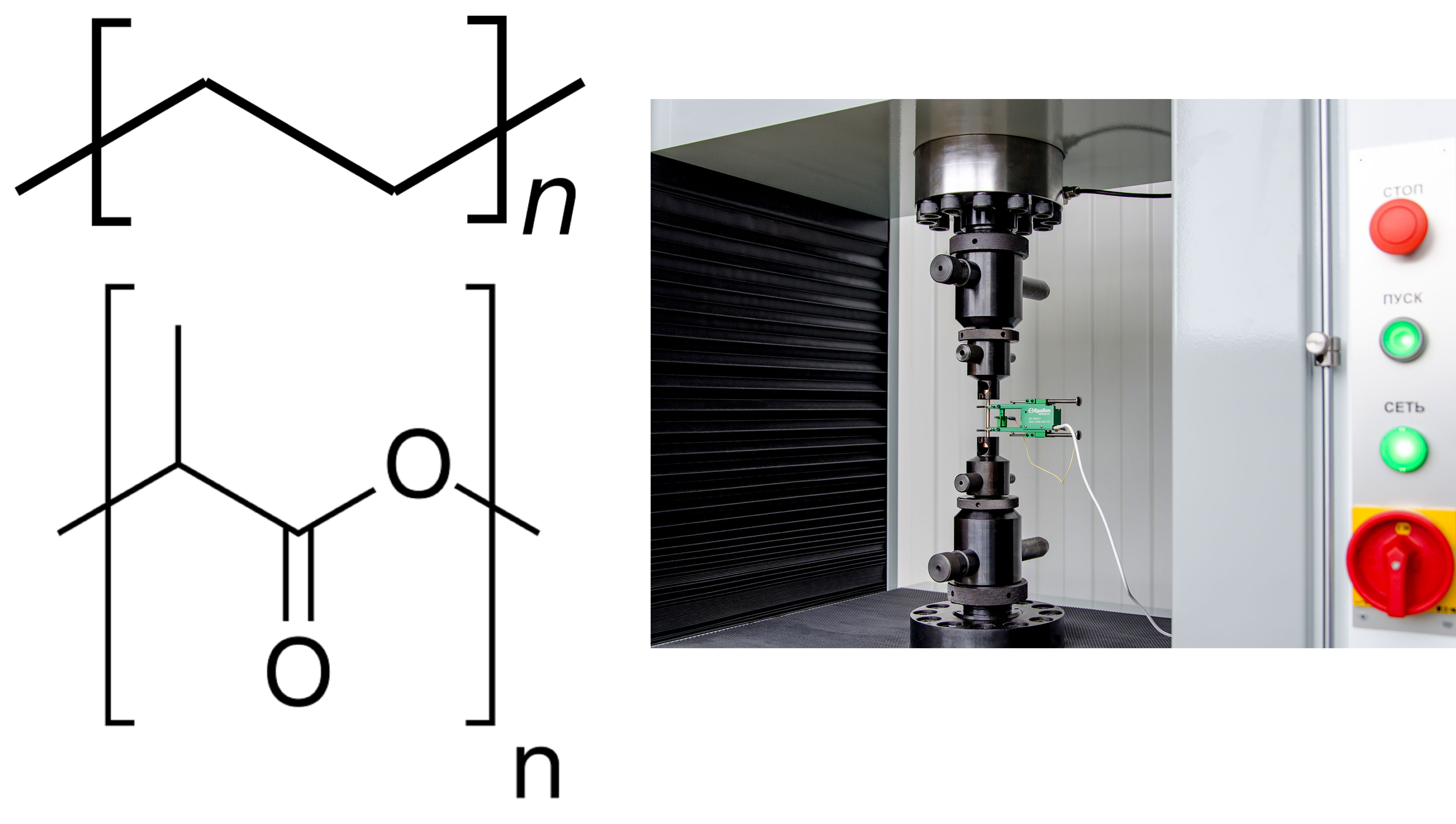
Рисунок 2. Проверка пластика «на зуб». Слева: формулы полиэтилена и полилактида. Справа: экстензометр — прибор для измерения деформации растяжением.
На биостойкость материала могут повлиять самые разные параметры. Например, я уже рассказывал [2], [7] про полиэтилен — самый заурядный пластик наших дней (рис. 2). Но это привычный полиэтилен с молекулярной массой 80–300 кДа, из которого делают пакеты и изоляцию на проводах. Сверхвысокомолекулярный полиэтилен высокой плотности (СВМПЭ) имеет молекулярную массу свыше 1 МДа, и его свойства сильно отличаются от привычных. Например, он чрезвычайно прочный — на его основе даже начали производить бронежилеты, превосходящие изделия из кевлара, эталона прочности среди полимеров. Конечно, получать такой полимер непросто, объемы производства невелики, а стоимость высока. К воздействиям внешней среды, в том числе к биодеградации, он тоже намного более стоек, чем «просто» полиэтилен. Оно и понятно — чем длиннее и массивнее молекулы полимера, тем плотнее они упакованы, тем прочнее сшиты ван-дер-ваальсовыми связями [10] и тем труднее ферментам до них добраться (хотя случаи разрушения СВМПЭ микроорганизмами всё же отмечены [11]).
Однако способность материала к биодеградации не всегда можно прикинуть, просто глядя на формулу или состав. Например, пластик полилактид — полиэфир молочной кислоты (рис. 2) — изначально позиционировался как биоразлагаемый. В самом деле, его мономер — молочная кислота, усваиваемая практически всеми живыми клетками. Сложноэфирные связи не представляют для ферментативного гидролиза никакой сложности. Тем не менее, на практике полилактид демонстрирует приличную биостойкость. Пластинки размером 90×90×8 мм, имитирующие фрагменты корпуса судна, не биодеградировали за 365 суток даже в условиях лаборатории, где не проявляются сезонные колебания климата [12]. Иными словами, «на биодеградацию надейся, а сам не плошай». Проблема пластикового мусора [8] продолжает оставаться актуальной.
- Биостойкость —
- свойство материала сопротивляться разрушительному воздействию биомеханических процессов, а также грибков и бактерий, микроорганизмов, которые приводят к разрушению или гниению. Разрушают материалы не только микроорганизмы, но и насекомые — жуки-точильщики и термиты; а в пресной или морской воде — моллюски.
Алмаз не устоит
На страницах своих статей я описывал биодеградацию самых разных веществ — ядовитых, радиоактивных и очень стойких, содержащих химические элементы от водорода до урана. Но вот что удивительно: углерод входит в состав практически всех биогенных веществ, но про его-то биодеградацию сказано очень мало.
В статье [4] я уже говорил, что углерод — самый необыкновенный и многоликий химический элемент. Перечислить все соединения углерода невозможно: число только известных молекул перевалило за сотню миллионов, а всё множество возможных конфигураций углеродного скелета, пожалуй, превышает число элементарных частиц во Вселенной — просто в силу «комбинаторного взрыва». Даже количество аллотропных модификаций углерода (рис. 3) намного больше, чем у любого другого элемента, и точное их число неизвестно: химики постоянно открывают новые. Однозначно можно сказать, что разнообразие аллотропов углерода вполне сопоставимо с количеством элементов в Периодической таблице Менделеева.
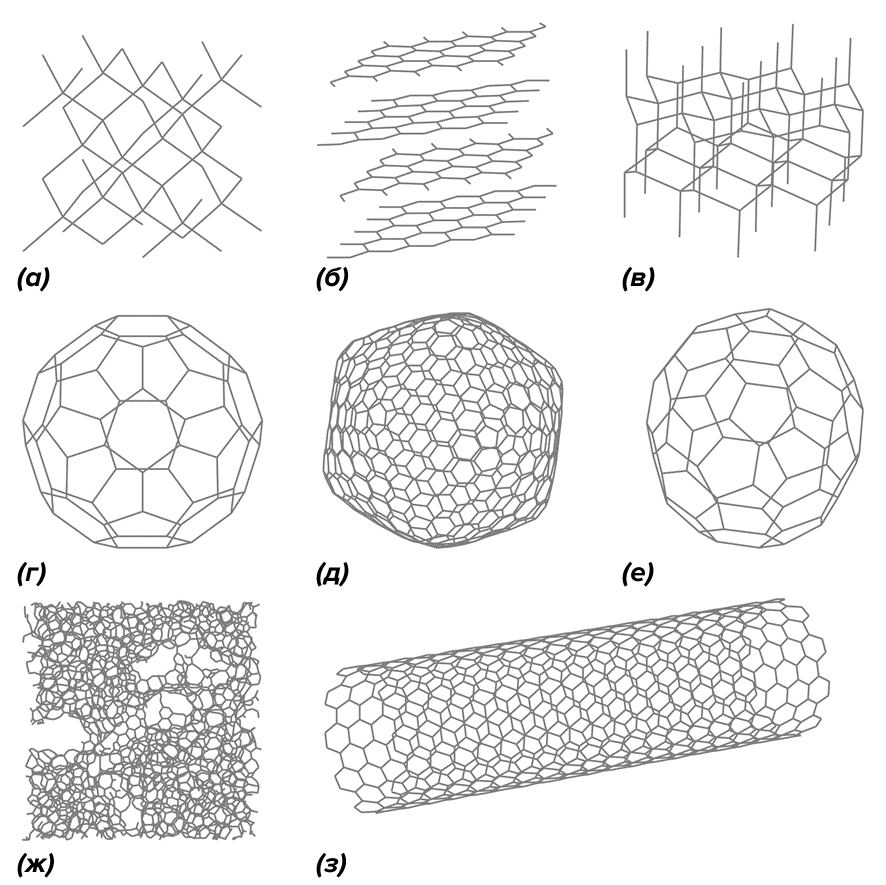
Рисунок 3. Восемь наиболее известных аллотропных модификаций углерода. (а) — лонсдейлит; (б) — графит; (в) — алмаз; (г), (д), (е) — фуллерены С60, С540, С70; (ж) — аморфный углерод; (з) — углеродная нанотрубка.
Надо сказать, что биодеградация элементного углерода не является чем-то из ряда вон выходящим. Грибы карбофилы, питающиеся обгоревшей и обугленной древесиной, известны давно. Описано (неполное) окисление фуллеренов и углеродных нанотрубок активными формами кислорода в тканях животных. Но, согласитесь, самая загадочная и магическая форма чистого углерода — это овеянный легендами алмаз. Это не только самый дорогой драгоценный камень: это самый твердый минерал и самая химически инертная форма углерода. Вероятно, алмаз конкурирует с тефлоном за титул самого стойкого углеродистого соединения.
И тем не менее, алмаз — это углерод — важнейший органический и биогенный элемент. Стало быть, биодеградация возможна и для него? В теории да. На практике этому препятствует высочайшая химическая инертность алмаза. Есть еще одно препятствие: алмаз — исключительно редкий минерал, и в процессе эволюции живым организмам трудно выработать адаптации к его усвоению. Слишком редко бактерии или корни растений контактируют с алмазами в природе.
Тем не менее, примеры биодеградации алмазов ближе, чем кажется. В последние десятилетия ученые сильно интересуются наноалмазами — формой углерода, которая представляет собой мельчайшие кристаллы алмаза, нанометровой величины. Конечно, физические свойства наноалмазов сильно отличаются от свойств бриллиантов из ювелирных украшений. Одно из важных свойств наноалмазов — огромная площадь поверхности, проистекающая из крошечных размеров частиц. А мы знаем, что рост площади поверхности вещества всегда приводит к росту химической и биологической активности, ведь реакции протекают именно на границе раздела.
И вот мне повстречалась статья коллектива из Польши [13], в которой описана биодеградация наноалмазов, а также тонких алмазных пластин культурами плесневых грибов Aspergillus niger, Mucor circinelloides, Chaetomium globosum, Fusarium oxysporum, Paecilomyces variotii, Penicillium ochrochloron, Phanerochaete chrysosporium, Trichoderma viride. Внушительный список (рис. 4)! Целый ряд методов, примененных авторами, подтвердил коррозию поверхности испытуемого вещества грибным мицелием. Значит, способность питаться алмазом в природе — не такая уж редкость? Авторы установили, что поверхность алмаза разрушается ферментами оксидоредуктазами: лакказами, лигнинпероксидазами, катехолдиоксигеназами. Эти ферменты как раз приспособлены разлагать самые «упорные» углеродистые субстраты.
Мне вспоминаются слова доктора технических наук, профессора и преподавателя биотехнологии Казанского технологического университета Альберта Владимировича Канарского, высказанные по поводу моей работы по биодеградации: «Если грибы выращивать в условиях дефицита углерода, они съедят абсолютно всё!».

Рисунок 4. Для одних драгоценность, а для других пища. Слева: ограненные мастером-ювелиром алмазы (бриллианты) — самые дорогие и одни из самых красивых драгоценных камней на свете. Несмотря на то, что алмаз — это чистый углерод, возможность биодеградации такого устойчивого вещества является настоящей сенсацией. Справа: мукор — гриб-редуцент, перед которым не устоит никакой пищевой субстрат, от хлеба до алмаза!
В своей предыдущей работе [7] я уже писал, что бактерии способны обугливать древесину, превращая ее в почти чистый углерод — каменный уголь. А недавно повстречал публикацию [14], в которой описана выработка аморфного углерода культурами архей метаногенов Methanocaldococcus jannaschii, Methanococcus maripaludis и Methanosarcina barkeri, а также анаэробных метанотрофных архей (рис. 5). Примером аморфного углерода может быть обыкновенная сажа (рис. 5). У этой аллотропной модификации нет четкой структуры, кристаллической решетки: cкорее, это хаотичный набор фрагментов разных аллотропных модификаций углерода.
В статье описаны свойства и структура углеподобного вещества, образующегося в процессе роста культур бактерий. К сожалению, метаболический путь его образования еще не известен. Вероятнее всего, микробы, метаболизирующие одноуглеродные молекулы, способны вырабатывать атомарный углерод, самопроизвольно полимеризующийся в аморфную структуру. Вообще, археи — это загадочная, самобытная и очень интересная группа живых организмов, биохимия и метаболомика которой резко контрастируют со всеми остальными формами жизни. Поэтому выработка аморфного углерода при комнатной температуре — возможно, не самое удивительное их достижение. А способность живых организмов (пускай и крайне экзотических) к созданию элементного углерода указывает и на потенциальную возможность других форм жизни к их усвоению.
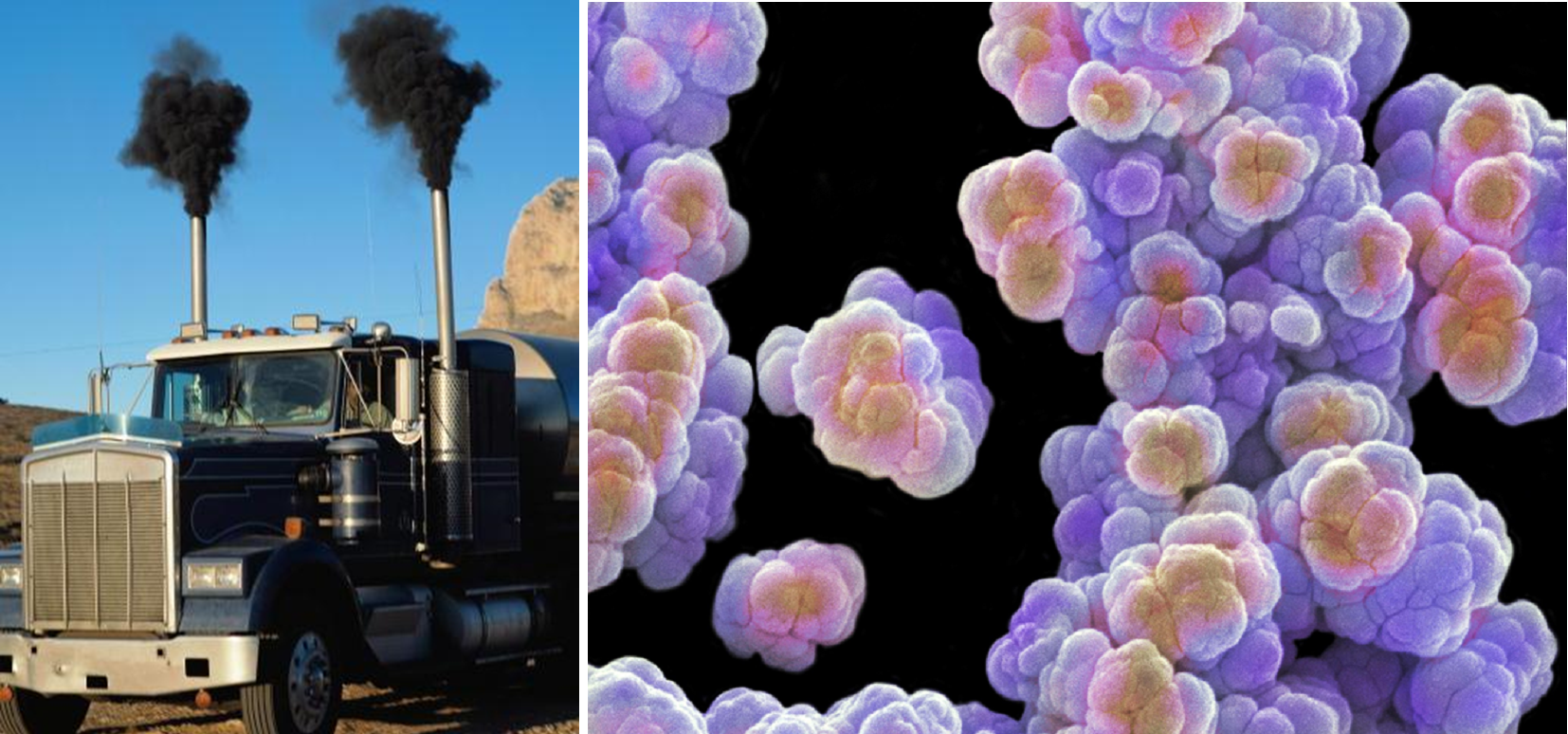
Рисунок 5. Жизнь — это горение. Когда великий Лавуазье произносил эти слова, он даже не подозревал, насколько они точны. Слева: аморфный углерод (см. рис. 3ж) — главный компонент сажи, образующейся при неполном сгорании органических веществ (например, дизельного топлива). А также компонент древесного угля и стеклоуглерода. Справа: Methanosarcina barkeri — метаногенная архея, уникальная большим разнообразием путей метаногенеза.
Озонатор в нашем теле
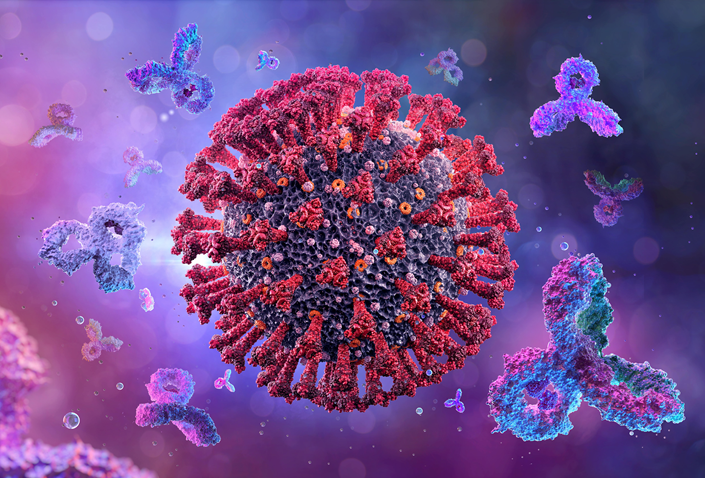
Долгие десятилетия неразрешимой загадкой для исследователей были антитела или иммуноглобулины — белки, выделяемые организмом позвоночных животных в ответ на проникновение антигена (чужеродного биополимера) и способные очень специфично связываться с последним, образуя комплекс, выпадающий в осадок (рис. 6, внизу). При этом, разумеется, антиген теряет активность. Основные антигены — это белки; менее активны нуклеиновые кислоты и полисахариды; а низкомолекулярные соединения, как правило, вообще не вызывают выработку антител. Организмы других таксономических групп, кроме позвоночных животных, имеют свое подобие антител — лектины, но они намного менее специфичны. Можно сказать, что антитело — это сильно усовершенствованный лектин. Как лектины, так и антитела являются гликопротеинами, то есть содержат белковый и углеводный фрагменты молекул. Но антитела, в отличие от лектинов, имеют константные и вариабельные участки. Первые консервативны и общи для всех антител одного вида животных, вторые содержат аминокислотные последовательности, уникальные для каждого конкретного антигена. Вариабельные участки, собственно говоря, и формируют комплекс с антигеном [15].
Самое поразительное заключается в том, что организм способен продуцировать антитела, специфичные к любому из бесконечного разнообразия антигенов, даже не встречающихся в природе. Избирательность связывания антител при этом настолько высока, что речь идет даже не о специфичности к антигену (что само по себе удивительно), а о специфичности к фрагментам молекулы антигена (так называемым эпитопам). Высочайшая специфичность антител уже нашла применение в практике. Существует особый вид хроматографии — аффинная (от лат. affinis — родственный), в которой в качестве сорбента используются антитела, иммобилизованные на твердом носителе. Аффинная хроматография позволяет извлекать конкретный белок из сложной смеси. Для того же, чтобы извлечь искомый белок из комплекса с антителами, через колонку пропускают буферный раствор с рН, при котором комплексы антиген—антитело распадаются.
Однако углубленное изучение антител показало, что их защитная функция может не ограничиваться формированием комплекса с антигеном. Сейчас, например, уже известны и получены искусственно антитела, обладающие ферментативной активностью. Они не просто связываются с молекулой ДНК, но и разрезают ее на фрагменты.
А в публикации [16] сообщается об открытии способности некоторых антител продуцировать газ озон — малоустойчивую аллотропную модификацию кислорода О3, обладающую свойствами намного более сильного окислителя по сравнению с двухатомным кислородом О2. Озон (рис. 6) — ядовитый газ голубого цвета, тяжелее воздуха, обладающий характерным запахом грозы. Он вырабатывается в воздухе при разрядах молний (рис. 6) и работе электроприборов, а в верхних слоях атмосферы формирует защитный озоновый слой, поглощающий губительную ультрафиолетовую область солнечного спектра. Высокая химическая активность и окислительная способность озона обусловливает его сильное антимикробное действие. В последние десятилетия сравнительно безопасное озонирование питьевой воды вытесняет применявшееся ранее хлорирование. И вот исследования продемонстрировали, что живая природа в очередной раз опередила человеческую цивилизацию. Антитела к клеточным стенкам бактерий продуцируют озон, а также перекись водорода — еще один известный дезинфицирующий агент.
Сенсация невзначай
На страницах своих статей я частенько упоминал природные галогенорганические вещества и немного касался истории их изучения. В наше время биологические молекулы, содержащие хлор, бром или йод, ни у кого не вызывают удивления. Они широко распространены в природе (их известно около четырех тысяч)+, а гормоны тироксин и трийодтиронин вырабатываются в организме человека и играют ключевую роль в поддержании нормального обмена веществ. Понятное дело, особенно богаты ими морские организмы — от бактерий до китов, — поскольку галогены накапливаются в морской и океанской воде. Фтор более экзотичен, хотя определенный набор фторорганических веществ в природе тоже есть. Например, знаменитое южноафриканское растение гифблаар (Dichapetalum cymosum) накапливает омега-фторжирные кислоты. В организме злосчастного травоядного, посягнувшего на листочки этого растения, они метаболизируют в исключительно ядовитые монофторуксусную и монофторлимонную кислоты, блокирующую цикл трикарбоновых кислот [17].
Но еще лет сто назад галогенированные природные вещества считались исключительно редкими. Впрочем, ну и что? Мало ли было заблуждений в науке, которые разрешились в свое время? А то, что галогенированные природные вещества, перестав быть экзотикой, всё еще не перестают нас удивлять.
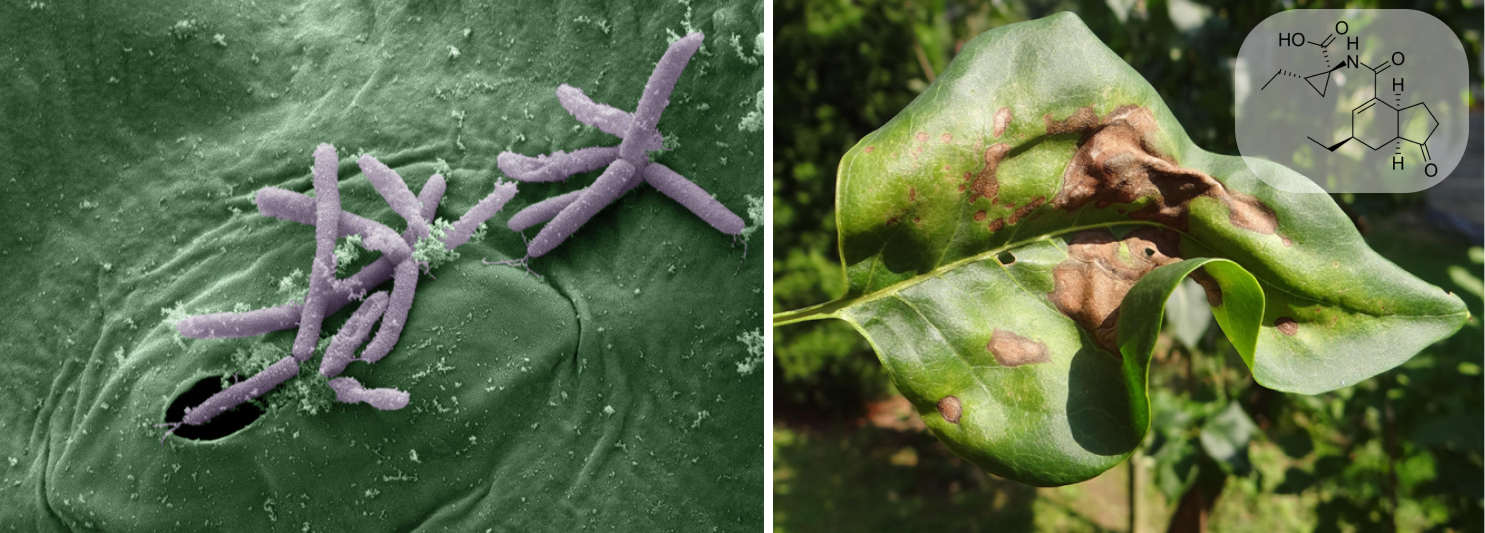
Фитопатогенная бактерия Pseudomonas syringae (рис. 7А) известна способностью вызывать некрозы у растений. Причем механизм умерщвления клеток очень интересен. Бактерии выделяют особые белки INA (ice nucleation active), являющиеся ядрами кристаллизации льда (рис. 7Б) [18]. Во время весенних или осенних заморозков формирующиеся кристаллы своими острыми гранями разрывают прочные клеточные стенки и ведут к гибели ткани — некрозу (рис. 7А).
А как этот опасный патоген проникает в растение? Бактерия продуцирует соединение, обладающее мощной биологической активностью для растительных клеток, — коронатин (рис. 7А). Это вещество подавляет реакцию закрывания устьиц листа в ответ на проникновение патогена и открывает дорогу бактериям внутрь растения.
Коронатин содержит довольно редко встречающийся в природе циклопропановый фрагмент, но в целом его трудно назвать экстраординарным. В конце концов, известных производных циклопропана в живых организмах набралось немало, им посвящены целые обзоры [19]. Циклопропановое кольцо формируется на стадии превращения аминокислоты L-алло-изолейцина в коронаминовую кислоту — предшественник коронатина. Казалось бы, и что? Сравнительно заурядная ступенька метаболического пути.
Однако при более детальном анализе этой «заурядной» реакции обнаружилась скромная сенсация, долгое время остававшаяся незамеченной [20]. Превращение бокового радикала алло-изолейцина начинается с его галогенирования до γ-хлор-алло-изолейцина. А дальше атом хлора отрывается, и боковой радикал замыкается в кольцо. Фактически, бактерия осуществляет известнейшие методы синтеза органических веществ, в которых связь углерод—углерод образуется на месте связи углерод—галоген. К ним относится, например, реакция Вюрца, с которой начинается изучение курсов органической химии в старших классах школы и вузах. Вспомним: если хлорэтан C2H5Cl пропустить над металлическим натрием, калием или серебром, то образуется хлорид соответствующего металла, а фрагменты углеродного скелета соединяются, и образуется газ бутан н-C4H10. Конечно, бактерии реакцию усовершенствовали, заменив агрессивный химический агент (металл) более тонким катализатором на основе фермента. Но, как часто бывает, реакция, совершенно заурядная для органического синтеза, в живом организме настолько уникальна, что сложно поверить в ее реальность. Кстати, ферменты дегалогеназы до сих пор были известны исключительно как агенты биодеградации галогенорганических веществ. Впервые они замечены в пути биосинтеза природного вещества.
Авторы назвали это явление «скрытым галогенированием». Можно предполагать, что оно не ограничивается единичным примером. В таком случае, разнообразие галогенированных природных соединений еще больше, чем мы знаем. К ним должны относиться промежуточные продукты метаболизма. Возможно, предки P. syringae синтезировали и накапливали L-γ-хлор-алло-изолейцин, который тоже использовали в качестве токсина, а в процессе дальнейшей эволюции метаболический путь стал длиннее и сложнее, включив дополнительную стадию дегалогенирования.
Основа биодеградации
В предыдущих статьях [2–8] неоднократно звучал ответ на вопрос, почему, собственно, возможна биодеградация. Конечно, главная причина — это громадное и далеко не описанное разнообразие природных веществ и путей, ведущих к их биосинтезу. Поэтому у большинства созданных человеком соединений есть природные аналоги. Или даже сами ксенобиотики неожиданно обнаруживаются в живой природе. Если живые организмы являются продуцентами многообразных (в том числе очень необычных) веществ, значит, они способны быть и их редуцентами, используя для этой цели одни и те же ферментные системы.
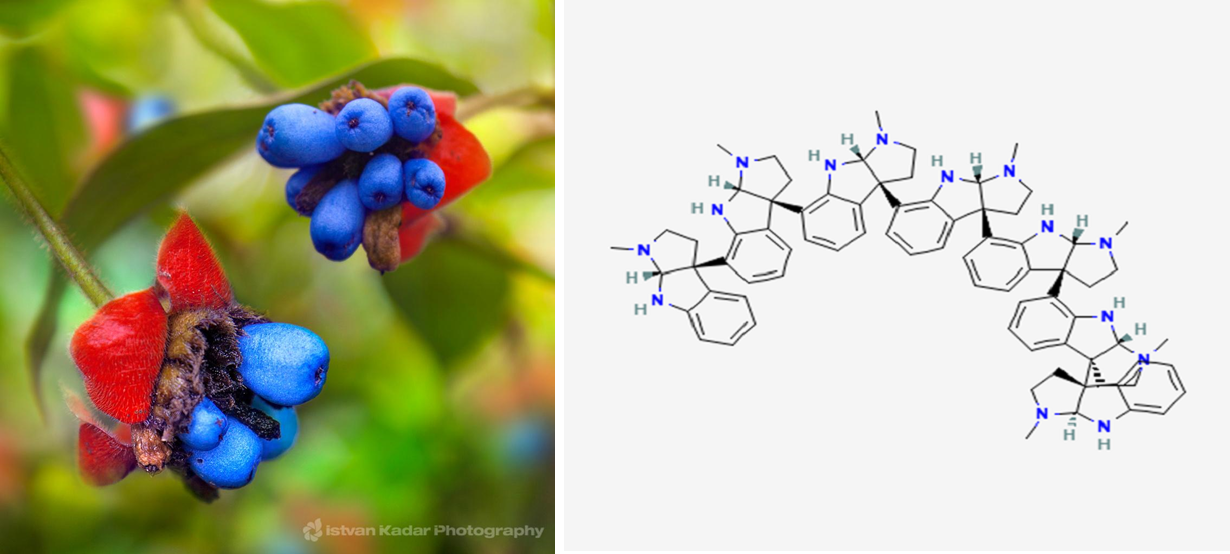
Психотрия — обширный род тропических растений, включающий почти 2000 разнообразных видов, некоторые из которых выделяются необычной формой соцветий (рис. 8А). Вещества, которые продуцируют некоторые психотрии, тоже весьма необычны (рис. 8Б).
Чего стоят необычные высокомолекулярные алкалоиды, накапливающиеся в растениях психотрии окрашенной Psychotria colorata. Например, вещество с говорящим названием психотридин. Эта сложная и тяжелая молекула представляет собой олигомер из пяти повторяющихся звеньев тетрагидроиндолопиррола. Каждое звено синтезируется из целой молекулы триптофана (соответственно, на синтез целой молекулы их уходит пять). Между тем, исходный триптофан с его массивным боковым радикалом — замещенным индолом — самая тяжелая белковая аминокислота. Такие гигантские молекулы среди алкалоидов встречаются очень редко. Между тем, родственный вид психотрия маслиновидная (P. oleoides) содержит алкалоид каледонин, еще более тяжелый гомолог психотридина. Он состоит из семи тетрагидроиндолопирроловых фрагментов (рис. 8Б) [21], [22]! Его формула C77H86N14, а молекулярная масса 1207 Да, как у небольшого белка! Алкалоиды психотрий интересны не только структурой. Благодаря высокой молекулярной массе, они эффективно блокируют болевые NMDA-рецепторы (N-метил-D-аспартата) и обладают сильным обезболивающим действием — индейцы Амазонии знали об этом и применяли психотрию в качестве лекарства испокон веков.
Кстати, триптофан — предшественник психотридина — сам синтезируется в клетках растений путем конденсации незамещенного гетероцикла индола [23]. То есть, формально (а в некоторых случаях на самом деле) он может рассматриваться как продукт биохимического обезвреживания индола, который может быть получен не только из биологического источника, но и из каменноугольной смолы. Вообще, сама возможность формирования подобных молекул в живом организме удивительна. Ведь триптофан — ценная (и для животных, и человека незаменимая) аминокислота, которую живые клетки просто так не транжирят. Возможно, разгадка кроется в сравнительно низкой концентрации психотридина и его гомологов в растении-продуценте. Или в исключительно хорошей обеспеченности питательными веществами в условиях его произрастания?
Разумеется, катаболизм — расщепление таких больших и сложных молекул как психотридин, каледонин и их гомологи — должен быть многостадийным процессом, вполне сопоставимым с их биосинтезом. В любом случае, если живые организмы способны вырабатывать столь сложные молекулы, значит, и задача по их расщеплению им должна быть по плечу. На этом, собственно, и основана биодеградация.
До новизны рукой подать
В своей статье [3] я уже рассказывал про арсеницин — природное вещество, содержащее мышьяк. Конечно, химический элемент №33, не без оснований ставший в массовом сознании символом токсичности, не является биогенным и играет в живых организмах куда менее важную роль, чем его более легкий аналог фосфор. Тем не менее, примитивные организмы — грибы, бактерии, водоросли и губки — частенько накапливают мышьяк в сравнительно высоких концентрациях и включают его в свои органические молекулы. Как результат, образуются очень необычные метаболиты.
В тропических морях обитают гигантские двустворчатые моллюски тридакны, которых не нужно представлять даже людям, далеким от зоологии (рис. 9, cверху). Гигантская тридакна — самый крупный двустворчатый моллюск на Земле: ее раковина весит несколько сотен килограммов и может содержать жемчужины размером с небольшую гирю. Конечно, таких внушительных размеров моллюск достиг благодаря симбиозу с фотосинтезирующими микроорганизмами — только лишь за счет фильтрации воды, как его более мелкие собратья, он бы не покрыл потребность в питании. Интереснейший путь метаболизма описан в работе [24]. Цианобактерия Synechocystis sp. PCC6803 (рис. 9, cнизу) — симбионт гигантского двустворчатого моллюска Tridacna maxima — восстанавливает мышьяковистую кислоту H3AsO3 до диметилмышьяковистой (СH3)2AsOН. Микроорганизмы, как выяснилось, «любят» это соединение и синтезируют из него разнообразные производные. Например, кишечная палочка Escherichia coli присоединяет диметиларсенит к оксикислотам с образованием диметиларсингидроксиалканоатов. Цианобактерии же присоединяют его к остатку сахара. Получается уникальный природный арсенобетаин и выполняющий, вероятно, роль токсина, защищающего бактерию, а заодно и родного моллюска. Арсеносахар может быть предшественником другой группы природных соединений мышьяка — арсенолипидов.

Рисунок 9. Самая большая в мире ракушка полностью зависит от невидимых глазом симбионтов. Тридакны (сверху) — не только самые крупные двустворчатые моллюски. Они еще очень красивы. Большую часть времени они проводят, выставляя на солнечный свет края мантии, в которых обитают водоросли и бактерии-симбионты (снизу показаны стадии деления цианобактерии Synechocystis sp.). Синяя оптическая окраска повышает эффективность фотосинтеза в жарких водах Красного моря.
Это интересно уже само по себе, поскольку расширяет представления о природных веществах. Но это еще не всё! Оказалось, что фермент ДДМАА-синтаза в лабораторных условиях может вместо диметилмышьяковистой кислоты присоединять триметилфосфин с образованием 5´-дезоксиаденозилтриметилфосфониевого катиона. Это первый фосфиносахар и первый фосфониевый катион, полученный в результате ферментативной реакции (рис. 10)! В природе соединения этого класса еще не обнаружены, но ход реакции свидетельствует о возможности существования природных фосфониевых катионов. Вообще удивительно, что триметилфосфин, или триметилфосфор — токсичная и огнеопасная летучая жидкость, не смешивающаяся с водой, — вступает в ферментативную реакцию.
Фосфины и их производные — весьма интересный класс веществ. Хотя в первую очередь они ассоциируются со зловонием и токсичностью, среди них встречаются катализаторы, люминофоры и даже лекарства. Возможность получения фосфинов и фосфониев сложного строения при помощи ферментов довольно заманчива.
Скажу честно: чем дольше изучаю природную химию, тем больше убеждаюсь: между нею и химией в целом вообще нет границ. Многообразие природных веществ охватывает все классы химических соединений, даже самые необычные.
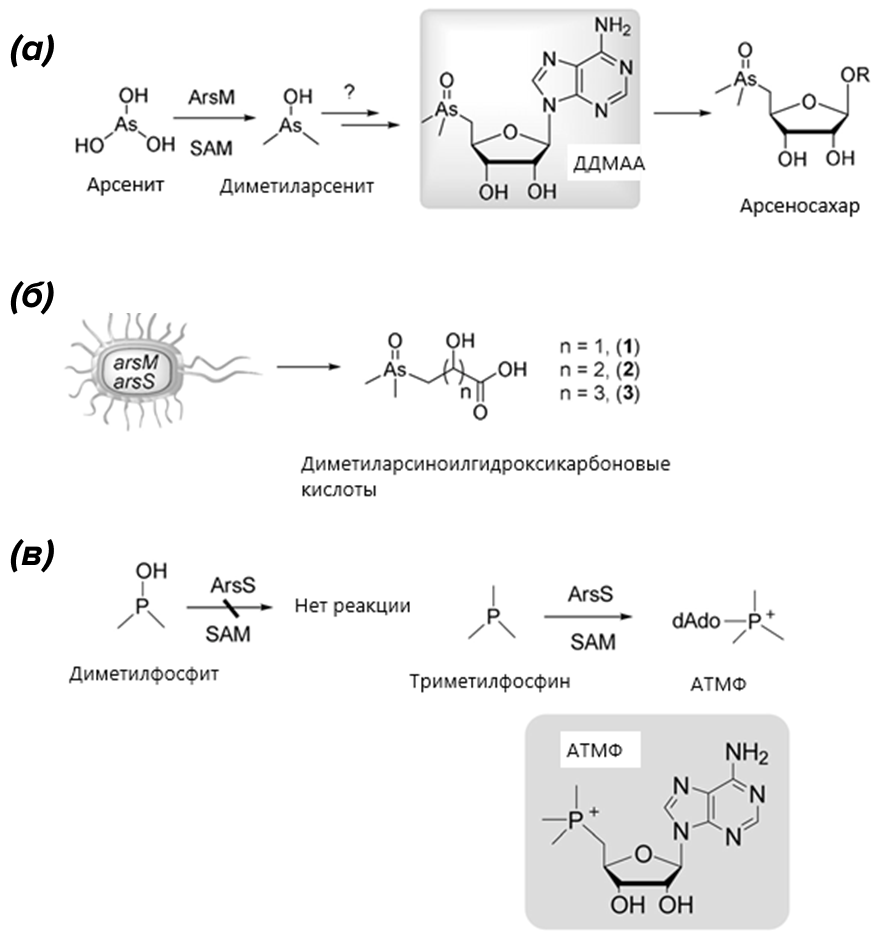
Рисунок 10. На вид сухие формулы искрятся волшебством природного метаболизма. (а) — биосинтез арсеносахара у Synechocystis sp. (б) — биосинтез арсиноилгидроксикарбоновых кислот кишечной палочкой. (в) — самое интересное. Заменив диметилмышьяковистую кислоту триметифосфином, получаем фосфониевый катион. Любопытно, что со структурным аналогом диметилмышьяковистой кислоты диметилфосфорноватистой кислотой реакция не идет, и замещенный фосфиноксид не образуется.
SAM — S-аденозилметионин (источник метильных групп в биосинтезе, который я уже упоминал в статье [5]), ArsM — арсенитметилаза, ArsS — ДДМАА-синтаза.
Не всё природное полезно
Жизнь современного человека полна стрессов. Это своеобразная расплата за сытое благополучие жителя мегаполиса, представителя «золотого миллиарда». Поэтому весь ХХ век в странах Западной Европы и США наблюдалась довольно странная на первый взгляд тенденция. Чем сильнее рос уровень жизни, тем больше рынок насыщался снотворными и седативными препаратами. В СССР и Российской Федерации качество жизни существенно отставало, но это не мешало «нашим людям» засыпать по ночам без услуг фармацевтических гигантов и консультаций психологов. И вообще, быть существенно здоровее в психологическом плане и оптимистичнее смотреть на жизнь.
О причинах такого социального явления можно сказать немало, но эти объяснения выходят за рамки моей статьи. Для естественных наук же важно то, что за последние сто лет в психофармакологии совершен грандиозный прорыв. И хотя человеческий мозг остается величайшей загадкой, созданы целые классы веществ, способных оказывать самое разнообразное влияние на его работу. Некоторые из них являются усовершенствованными модификациями природных соединений. Другие изначально были созданы химиками и не имеют природных аналогов.
К последним можно отнести две наиболее известные группы седативных препаратов — барбитураты и бензодиазепины. Барбитуровая кислота, представляющая собой сильно окисленную форму пиримидинового основания, была синтезирована еще в 1864 году знаменитым немецким химиком Адольфом Байером конденсацией мочевины и малоновой кислоты. Сама по себе она не обладает выраженной биологической активностью. Но если малоновую кислоту заменить диалкилмалоновой (или арилмалоновой), то можно получить барбитураты, оказывающие депрессантное, наркотическое и снотворное действие, очень сходное с действием алкоголя. И, подобно алкоголю, вызывающие зависимость после продолжительного применения. Замена мочевины тиомочевиной ведет к синтезу тиобарбитуратов, обладающих сходным действием.
Между 1903 и 1960 годами барбитураты (веронал, пентобарбитал, фенобарбитал и прочие) были самыми популярными снотворными и успокоительными препаратами, быстро вытеснившими более ранние, такие как хлороформ, паральдегид, хлоральгидрат [3] и неорганические бромиды. Однако высокая токсичность и вызываемая тяжелая наркотическая зависимость с постепенной деградацией личности больного вынудили в середине двадцатого столетия перейти к поиску новых классов препаратов. Ими стали бензодиазепины, впервые полученные в 1955 году и имеющие более сложную структуру, но гораздо менее токсичные. Оба класса веществ влияют на обмен γ-аминомасляной кислоты (ГАМК), связываясь с соответствующими рецепторами. Впрочем, бензодиазепины (диазепам, феназепам, нитразепам и прочие) тоже опасны для здоровья и вызывают зависимость [25–29].
Итак, врачей и пациентов эти препараты разочаровывают, хотя изрядно обогащают фармацевтов. По всей видимости, создать психотропный препарат, не вызывающий зависимость, просто невозможно, невзирая на все попытки. Ведь зависимость определяется не формулой, не структурой молекулы. А субъективными ощущениями от воздействия вещества.
А вот фундаментальная наука нисколько не разочарована. Напротив, сильно удивлена. Ведь бензодиазепины уже после их повсеместного внедрения в клиническую практику неожиданно стали находить в природных источниках. Сначала в микроорганизмах — грибках Penicillium cyclopium — обнаружили десхлордиазепам (полный структурный аналог диазепама, но без атома хлора). Даже описали путь его биосинтеза, что в случае редких веществ не всегда удается [30]. Затем (что, согласитесь, удивительно, но вполне ожидаемо) — в тканях мозга позвоночных [31]. Эти факты свидетельствуют о том, насколько мало мы знакомы даже с биохимией человеческого организма, в котором, кажется, уже не осталось белых пятен. В публикации утверждается, что диазепам и лоразепам являются натуральными метаболитами млекопитающих — крыс, людей, кроликов и быков.
В изрядно старой, но от этого не менее интересной статье я нашел сведения о том, что следовые концентрации фармакологически активных бензодиазепинов присутствуют в клубнях картофеля и зернах пшеницы [32]! Конечно, подспудно возникает сомнение, что авторы допускают систематическую ошибку и находят вещества «идентичные синтетическим» буквально везде. Закрадывается мысль, что ошибка эта не случайна. Возможно, фармацевтические компании заинтересованы придавать своим препаратам статус природных веществ, поскольку субъективно это снижает страх перед наносимым ими вредом.
С другой стороны, растения семейства пасленовых и ряд злаков склонны накапливать азотистые метаболиты, алкалоиды. Вполне возможно, что бензодиазепины представляют собой обширный класс природных соединений, но встречающийся в следовых концентрациях и обнаруженный только с появлением совершенных аналитических методов.
Кстати, простейший член ряда барбитуратов — незамещенная барбитуровая кислота — тоже, как выяснилось, является природным веществом и образуется в качестве промежуточного продукта редкого окислительного пути разложения урацила. Далее она распадается до малоновой кислоты и мочевины — тех исходных веществ, из которых барбитураты впервые были синтезированы [33].
Некоторые психотропные вещества не синтезированы с нуля, а являются полусинтетическми модификациями природных молекул, обладающих сходным, но менее выраженным действием. Помню, когда в 2002 году я пришел студентом в Институт органической и физической химии имени академика Арбузова, в котором впоследствии защитил диссертацию и проработал много лет, у всех на слуху было ужасное слово «прекурсоры». Такие общеизвестные, простенькие и явно недорогие вещества, как перманганат калия, ацетон, йод, красный фосфор, (Боже упаси!) уксусный ангидрид или метилэтилкетон раздобыть было почти невозможно. А всё потому, что их можно использовать в производстве наркотиков. Собственно, слово «прекурсор» на языке химии означает «предшественник, исходное вещество». В лихие девяностые и нулевые это слово приобрело более узкий и мрачный смысл. В черный список умудрились включить даже серную и соляную кислоты — реактивы, без которых никакая химия просто немыслима. Особый трагикомизм заключался в том, что многие прекурсоры (пускай не очень чистые) в то время свободно продавались в аптеках и хозяйственных магазинах, а красный фосфор содержится в каждом спичечном коробке. Очевидно, что злоумышленники приобретали их именно там. Но дипломированным сотрудникам лабораторий для приобретения тех же веществ требовалось преодолевать бюрократические препоны — примерно как с метиловым спиртом, про который я рассказывал в статье [2].
Итак, воздействуя на природные психотропные вещества прекурсорами, можно получать их полусинтетические аналоги, оказывающие более мощное воздействие. Так, из морфина получают героин, из кодеина — дезоморфин, из эфедрина — амфетамины. Последние оказывают действие, противоположное барбитуратам и бензодиазепинам — являются психостимуляторами. Природные алкалоиды эфедрин и катинон имеют структурное сходство с вырабатываемым корой надпочечников гормоном адреналином и вызывают сходный, мобилизующий эффект — подавляют аппетит и сонливость, пробуждают двигательную и мозговую активность, расширяют зрачки и вообще повышают чувствительность органов чувств.
В самом конце XIX столетия японский химик Нагаи Нагаёси восстановил эфедрин до вещества, получившего название метамфетамин. Отсутствие гидроксильных групп в сочетании с дополнительной метильной группой делают его более липофильным и устойчивым к действию ферментов по сравнению с окисленными аналогами. Поэтому метамфетамин, или первитин, в отличие от адреналина, легко проходит через гематоэнцефалический барьер и оказывает очень сильное воздействие на головной мозг. Действие адреналина длится всего несколько минут, а действие первитина — несколько часов.
Поэтому в середине двадцатого столетия немецкая и японская, а после Второй мировой войны американская армии применяли первитин в качестве боевого стимулятора. Впрочем, «суперменом» боец становился только после первых приемов. Длительное употребление первитина превращает человека в развалину — истощенного и дряхлого старика в расцвете лет, с разрушенной психикой, отсутствием интереса к жизни и ослабленным иммунитетом. К тому же, с тяжелейшей формой пристрастия к препарату. В настоящее время он входит в список запрещенных веществ и производится исключительно кустарно. В общем-то, заурядная судьба подававшего большие надежды лекарства, ставшего уличным наркотиком. Список подобных веществ расширяется с каждым годом, и это печальная тенденция.
Но от большинства других подобных соединений первитин и его чуть более слабый аналог амфетамин отличаются тем, что они... оказались природными соединениями. Уже после того, как они вышли из медицинского употребления и были запрещены, их в следовых концентрациях обнаружили в листьях акации Берландье (Acacia berlandieri), произрастающей в Техасе и Мексике. Это растение содержит целый коктейль ядовитых алкалоидов, в том числе никотин, мескалин, тирамин и мимозин [34]. Впрочем, хочу подчеркнуть в очередной раз. Статус «природного» отнюдь не делает вещество безвредным. Просто у многих (даже сравнительно грамотных) людей всё природное ассоциируется исключительно со здоровьем, чистотой и благостной гармонией, что, как видим, далековато от реальности.
Послесловие
Итак, в статье приведены несколько примеров, на первый взгляд, не имеющих между собой связи. Но на самом деле она есть. Мы увидели, насколько мощной и хорошо отлаженной силой является метаболизм живых клеток. Насколько совершенны крохотные неприметные химические заводы микроорганизмов, живущих повсюду и совершенно не стремящихся привлекать к себе внимание. Воистину, биосфера Земли — великий Разрушитель и Созидатель. Собственно, об этом говорил и писал академик Владимир Иванович Вернадский еще сто лет назад. С тех пор представления не поменялись — просто доведенные до совершенства научные методы позволили открыть множество новых примеров, неизвестных в те времена.
Впрочем, для реализации этой колоссальной мощи требуется время. Иногда очень длительное, с охватом целых геологических эпох. А мы, люди, должны обустраивать высокое качество жизни в своем доме — нашей общей планете — уже сегодня. Поэтому самоочищение и самоорганизация биосферы не должны быть для нас оправданием. Мы сами обязаны сохранять чистоту и порядок, для чего непрестанно поднимать самосознание. И оправдывать свой видовой эпитет — Homo sapiens sapiens: Человек разумный разумный.
Литература
- Биодеградация белого фосфора: как яд стал удобрением;
- Биодеградация ксенобиотиков как самозащита природы;
- Являются ли ксенобиотики ксенобиотиками? Одна из сторон разнообразия природных соединений;
- Раздумья о природной и неприродной химии;
- Биодеградация: что в ней удивительного?;
- От биодеградации к сюрпризам биохимии;
- Многоликая биодеградация;
- Биодеградация на переднем крае науки;
- Сахно О.Н., Селиванов О.Г., Чухланов В.Ю. Биостойкость полимерных материалов и методы ее оценки. Владимир, изд. ВлГУ, 2018. — 84 с.;
- Роль слабых взаимодействий в биополимерах;
- Xueqin Kang, Chi Yao, Shirong Ge. (2019). Biodegradation behavior and tribological properties of ultrahigh molecular weight polyethylene stabilized with α-tocopherol. ILT. 71, 494-498;
- Дектярев А.В., Гришин П.Р. (2020). Вопросы применения биоразлагаемых материалов в судостроении на примере полилактида. Материалы VIII Международного Балтийского морского форума: в 6 т. Том. 2. VIII Международная научная конференция «Морская техника и технологии. Безопасность морской индустрии». С.71–79;
- Mirosława Szczesna-Antczak, Agata Kaczorowska, Witold Kaczorowski, Tadeusz Antczak. (2014). Biomodification and biodeterioration of carbon coatings by fungal strains. International Biodeterioration & Biodegradation. 88, 106-117;
- Kylie D. Allen, Gunter Wegener, D. Matthew Sublett, Robert J. Bodnar, Xu Feng, et. al.. (2021). Biogenic formation of amorphous carbon by anaerobic methanotrophs and select methanogens. Sci. Adv.. 7;
- Краткая история открытия и применения антител;
- Paul Wentworth, Jonathan E. McDunn, Anita D. Wentworth, Cindy Takeuchi, Jorge Nieva, et. al.. (2002). Evidence for Antibody-Catalyzed Ozone Formation in Bacterial Killing and Inflammation. Science. 298, 2195-2199;
- David B. Harper, David O’Hagan, Cormac D. Murphy. (2003). Fluorinated Natural Products: Occurrence and Biosynthesis. The Handbook of Environmental Chemistry. 141-169;
- О, этот благодатный дождь из бактерий!;
- Ludger A. Wessjohann, Wolfgang Brandt, Thies Thiemann. (2003). Biosynthesis and Metabolism of Cyclopropane Rings in Natural Compounds. Chem. Rev.. 103, 1625-1648;
- Frédéric H. Vaillancourt, Ellen Yeh, David A. Vosburg, Sarah E. O'Connor, Christopher T. Walsh. (2005). Cryptic chlorination by a non-haem iron enzyme during cyclopropyl amino acid biosynthesis. Nature. 436, 1191-1194;
- Justin Kim, Mohammad Movassaghi. (2011). Concise Total Synthesis and Stereochemical Revision of (+)-Naseseazines A and B: Regioselective Arylative Dimerization of Diketopiperazine Alkaloids. J. Am. Chem. Soc.. 133, 14940-14943;
- Tony Z. Scott, Mohammad Movassaghi. (2024). Unified, Biosynthesis-Inspired, Completely Stereocontrolled Total Synthesis of All Highest-Order [n + 1] Oligocyclotryptamine Alkaloids. J. Am. Chem. Soc.. 146, 23574-23581;
- Michael F. Dunn, Dimitri Niks, Huu Ngo, Thomas R.M. Barends, Ilme Schlichting. (2008). Tryptophan synthase: the workings of a channeling nanomachine. Trends in Biochemical Sciences. 33, 254-264;
- Jinduo Cheng, Wenjuan Ji, Suze Ma, Xinjian Ji, Zixin Deng, et. al.. (2021). Characterization and Mechanistic Study of the Radical SAM Enzyme ArsS Involved in Arsenosugar Biosynthesis. Angew Chem Int Ed. 60, 7570-7575;
- Краткая история антидепрессантов;
- ttps://biomolecula.ru/articles/novaia-zhizn-psikhodelikov;
- Дивный новый мир психоделической терапии;
- Фармакофоры нейропластичности;
- Дарвин в сумасшедшем доме: эволюционный взгляд на психические расстройства;
- G. Bringmann. (1992). A first biosynthetic proposal for the in vivo formation of naturally occurring diazepam-like 1,4-benzodiazepines. J. Neural Transmission. 88, 77-82;
- Jorge H. Medina, Alejandro C. Paladini, Iván Izquierdo. (1993). Naturally occurring benzodiazepines and benzodiazepine-like molecules in brain. Behavioural Brain Research. 58, 1-8;
- Johannes Wildmann, Walter Vetter, Urs B. Ranalder, Karl Schmidt, Res Maurer, Hanns Möhler. (1988). Occurrence of pharmacologically active benzodiazepines in trace amounts in wheat and potato. Biochemical Pharmacology. 37, 3549-3559;
- Jure Piškur, Klaus D. Schnackerz, Gorm Andersen, Olof Björnberg. (2007). Comparative genomics reveals novel biochemical pathways. Trends in Genetics. 23, 369-372;
- Beverly A. Clement, Christina M. Goff, T. David A. Forbes. (1997). Toxic amines and alkaloids from Acacia berlandieri. Phytochemistry. 46, 249-254.