Вирус вирусу — не друг: как бактериофаги помогают бороться с вирусными инфекциями у человека
23 сентября 2022
Вирус вирусу — не друг: как бактериофаги помогают бороться с вирусными инфекциями у человека
- 5202
- 0
- 6
О бактериофагах принято говорить как об альтернативе антибиотикам. «Официально» к их применению в медицине нет других показаний, кроме как лечение бактериальных инфекций. Однако у фагов есть и другие полезные свойства. Многие исследования показывают, что они способны помочь в борьбе с вирусными инфекциями, в том числе злободневным COVID-19. Иллюстрация в высоком разрешении.
иллюстрация Анастасии Самоукиной
-
Автор
-
Редактор
-
Рецензент
-
Иллюстратор
В предыдущей статье спецпроекта мы говорили о том, как бактериофагов используют для лечения бактериальных инфекций. Такое применение логически вытекает из самой сути бактериофагов и отражено в их названии. Но «пожиратели бактерий» не так просты. Как мы отмечали в первой статье цикла, они способны проникать в кровь через слизистые оболочки органов, путешествовать по организму человека и взаимодействовать с его собственными клетками. Копнув глубже, ученые открыли многочисленные эффекты фагов, не связанные с уничтожением патогенных микроорганизмов. Например, обнаружили механизмы, работающие против вирусов человека. Это тоже может пригодиться в медицине, так как эффективных противовирусных препаратов до сих пор существует не так много.
Бактериофаги

Партнер спецпроекта — НПЦ «Микромир» — производитель препаратов с бактериофагами для применения в медицине и ветеринарии.
Бактериофаги — это вирусы, заражающие бактериальные клетки. Они составляют наиболее многочисленную и эволюционно древнюю группу вирусов в биосфере Земли. Бактериофаги играют важную роль в контроле численности микробных популяций и в горизонтальном переносе бактериальных генов, выступая в качестве векторных систем.
В спецпроекте мы дадим общую информацию о бактериофагах, истории их изучения, использовании в лаборатории, попытках применения в медицине и ветеринарии и возможных будущих применениях.
Вирусы и фаги — близкие родственники, но обитают в совершенно разных нишах. Это как владелец большой фермы и директор IT-агентства. Казалось бы, их сферы деятельности практически не пересекаются, и никакой конкуренции между ними быть не должно. Но исследования показывают, что это не так. Бактериофаги могут влиять на течение вирусных инфекций и помогать в их лечении. Ученым удалось обнаружить противовирусные эффекты «пожирателей бактерий» in vitro («в пробирке») и in vivo (на живых организмах) [1].
С началом пандемии COVID-19 врачи обнаружили, что у современной медицины не так много средств для борьбы с новой коронавирусной инфекцией. А ученые параллельно с разработкой новых препаратов стали искать противовирусные эффекты (или хотя бы какие-то эффекты, способные помочь пациентам с COVID-19) у уже существующих . И тут бактериофаги снова пригодились. У них обнаружили несколько полезных терапевтических механизмов, в основном в исследованиях с инфекциями, вызванными аденовирусами и вирусом SARS-CoV-2.
О том, как ученые ищут новые способы лечения инфекции COVID-19, и какие препараты могут быть перспективны, более подробно рассказано в наших статьях «COVID-19: что мы знаем и чего не знаем» [2] и «Как вылечить COVID-19?» [3].
Бактериофаги потенциально способны помочь двумя способами: влияя непосредственно на течение вирусной инфекции и работая против возбудителей вторичной бактериальной пневмонии.
Защита клеток от апоптоза
Апоптоз, или запрограммированная клеточная смерть, — распространенное явление при вирусных инфекциях. На уровне отдельной зараженной клетки это приносит пользу: живой резервуар возбудителя погибает, и распространение патогена тем самым ограничивается. Но если рассматривать инфекцию на уровне целого организма, то соотношение пользы и вреда станет не таким очевидным. Например, если клетка погибает очень медленно, а вирус размножается очень быстро — ему хватит времени, чтобы наделать своих копий, и в таком самопожертвовании не будет смысла. При некоторых инфекциях возбудитель поражает не какие-нибудь, а иммунные клетки, и их гибель оборачивается для организма катастрофой [4], [5]. Самый яркий пример — ВИЧ-инфекция, но к лимфопении (снижению уровня лейкоцитов в крови) приводят и другие вирусы, в том числе SARS-CoV и SARS-CoV-2 [1]. Ведущую роль в развитии лимфопении при вирусных инфекциях играет гибель лимфоцитов. Помимо апоптоза, она обусловлена пироптозом, аутофагией (когда клетка «переваривает» саму себя), действием вирус-специфических CD8+ цитотоксических Т-лимфоцитов (иммунных клеток, разрушающих поврежденные клетки), антителозависимой клеточно-опосредованной цитотоксичностью (разрушением клеток, «помеченных» антителами). Но именно апоптозу принадлежит ведущая роль (рис. 1) , [6].
Узнать подробнее об этом пути клеточной смерти можно из нашей статьи «Апоптоз, или Путь самурая» [7].
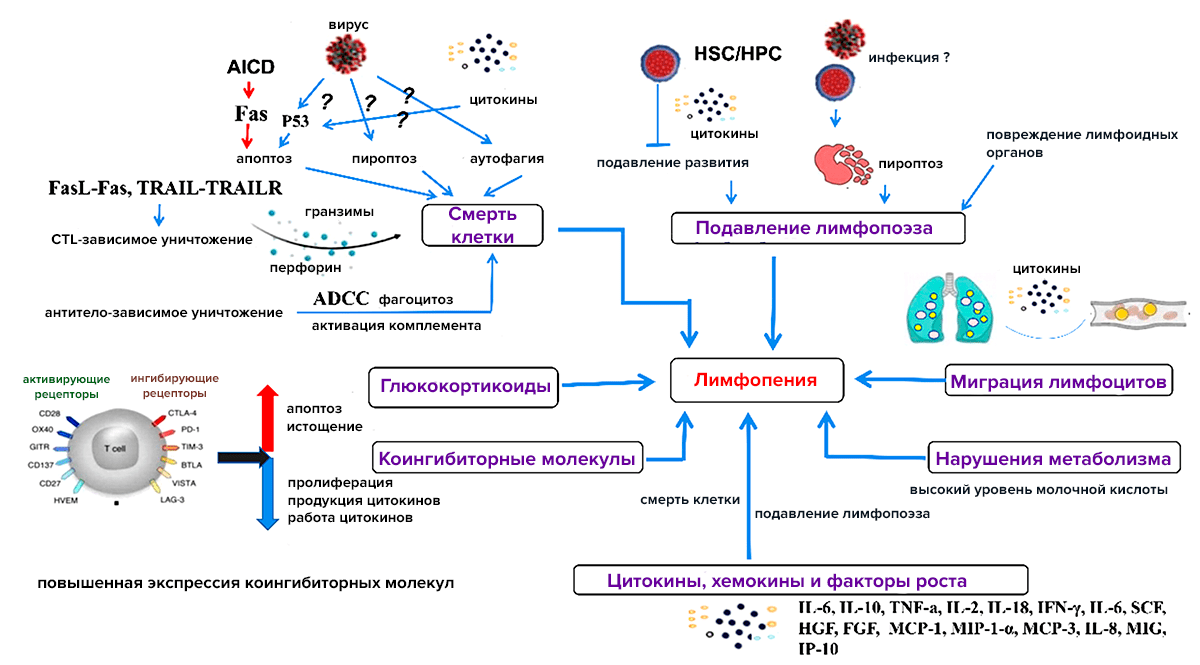
Рисунок 1. Причины лимфопении при вирусных инфекциях. Как видно на схеме, тут действует множество механизмов. Апоптоз играет ведущую роль.
[6], рисунок адаптирован
Сомнительна польза апоптоза (даже если он подавляет распространение инфекции) в тканях с ограниченной способностью к обновлению клеточного состава (например, в центральной нервной системе). Кроме того, апоптоз усугубляет ситуацию, когда функция органа и без того сильно нарушена [5].
При инфекции COVID-19 лимфопения встречается часто: по результатам некоторых исследований, более чем у 60% всех пациентов и более чем у 80% умерших. Причем более высокий уровень лейкоцитов в крови коррелирует с более благоприятным прогнозом [8], [9].
Некоторые исследования показывают, что бактериофаги могут помочь предотвратить апоптоз клеток при инфекционных заболеваниях. Например, в 2017 году ученые решили проверить, как реагируют клетки легких человека на бактериофагов синегнойной палочки (Pseudomonas aeruginosa). Это потребовалось для того, чтобы разобраться, можно ли применять фаготерапию при бактериальных инфекциях у людей с муковисцидозом. Из штаммов синегнойных палочек, полученных от детей с муковисцидозом, выделили фаг E79, который обладал самым выраженным антибактериальным эффектом. Исследователи собрали культуры клеток слизистой оболочки дыхательных путей у больных и здоровых детей, а затем культивировали эти клетки в присутствии E79. Исследование показало, что бактериофаг не увеличивает выработку цитокинов («воспалительных молекул»), но способствует снижению скорости апоптоза [1], [10], [11].
Другое исследование, опубликованное в 2013 году, показало, что фаг T4 защищает от гибели клетки легких человека, если добавить его в клеточную культуру до заражения аденовирусом или в любое время после того, как инфекция уже началась [1], [12].
Влияние на иммунологическую толерантность
Как всем известно из школьного курса биологии, главная задача иммунной системы человека — уничтожать вторгшихся в организм «чужаков» и собственные поврежденные, «неправильные» клетки. Но одновременно иммунитет должен постоянно себя сдерживать. Сражаясь с «ксеносами», важно не зацепить в пылу битвы «своих». Для этого существует иммунологическая толерантность. В организме человека одновременно работают как бы два иммунитета: «обычный» и «иммунитет наоборот». Во время инфекций баланс между ними нередко нарушается. Иммунная система становится более лояльной к возбудителю и более нетерпимой по отношению к собственным тканям организма, возникают аутоиммунные реакции.
Иммунологическая толерантность формируется еще во время созревания иммунных клеток — T- и B-лимфоцитов. Если созревающая клетка реагирует на собственные вещества организма, то ее гены подвергаются редактированию или она погибает. Это так называемая центральная иммунологическая толерантность. Но некоторые слишком агрессивные T-лимфоциты выживают. Организм предлагает им «сотрудничать» и превращает их в регуляторные T-клетки. Они работают на местах и сдерживают иммунную систему от атак на собственные ткани организма. И задача этой периферической иммунологической толерантности — устранять недоработки центральной [13], [14].
Считается, что важную роль в центральной и периферической иммунологической толерантности играет белок-рецептор под названием лимфоцитарный антиген 75. Часто его упоминают как CD205. Особенно много этого белка на поверхности дендритных клеток и моноцитов. Дендритные клетки — это помощники лимфоцитов. Они поглощают чужеродные частицы, разрушают их, а потом выставляют их фрагменты на своей поверхности и «знакомят» с ними иммунные клетки. Моноциты — крупные лейкоциты, часть врожденного иммунитета. Их всегда можно найти в очаге воспаления, они вырабатывают цитокины («воспалительные молекулы») и занимаются фагоцитозом (пожиранием чужеродных веществ) [15], [16].
Ученым известно, что дендритные клетки играют определенную роль в иммунотолерантности [17]. И отчасти эта роль связана с белком CD205. Он распознает вещества клеток, которые подвергаются апоптозу и некрозу. В зависимости от определенных условий, в одних случаях поглощение дендритной клеткой антигенов через CD205 приводит к иммунологической толерантности, а в других — к сильному иммунному ответу. Это свойство может быть полезно для лечения онкологических и аутоиммунных заболеваний [18], [19].
Оказалось, что некоторые бактериофаги влияют на CD205, и это помогает защитить клетки организма во время инфекции. В 2016 году ученые опубликовали статью о том, как исследовали эффекты фагов T4 и A3/R во время превращения моноцитов в дендритные клетки в очаге воспаления. Сами бактериофаги ни на какие важные белки-маркеры дифференцировки дендритных клеток не повлияли. А когда к клеткам добавили лизаты бактерий (остатки микроорганизмов, уничтоженных вирусами), доля CD205–позитивных клеток сильно уменьшилась [1], [20].
Вирусам вход запрещен
Есть немало доказательств того, что некоторые бактериофаги препятствуют адсорбции (прикреплению к клетке) и репликации (размножению) вирусов, инфицирующих человека. Так, в 2015 году ученые сообщили, что фаг T4 блокирует адсорбцию аденовирусов на клетках легких и почек человека, а также репликацию вируса в этих клетках. В другом исследовании, опубликованном в 2019 году, проверили, как влияют на размножение аденовирусов фаги T4 и A5/80. Оба бактериофага снижали экспрессию аденовирусных генов, а T4 заблокировал синтез ДНК [21], [22].
Считается, что фаг T4 нарушает прикрепление аденовирусов к клеткам человека с помощью мотива (последовательности аминокислот) KGD, который находится в капсидном белке бактериофага [1], [22]. Кроме того, мотив KGD (сайт связывания белка интегрина) обнаруживается в гликопротеинах H и L (gH/gL) вирусов Эпштейна—Барр. Взаимодействие между этими соединениями и вирусным гликопротеином B (gB) необходимо для того, чтобы вирусная оболочка слилась с мембраной клетки. Если мотив KGD инактивирован (например, в результате мутации), то возбудитель не может проникнуть в клетку. Это открывает потенциал для применения бактериофагов в лечении инфекционного мононуклеоза и других инфекций, вызванных вирусом Эпштейна–Барр [1], [23], [24].
Мотив KGD представлен и в основной петле спайкового белка (S) нового коронавируса SARS-CoV-2. Именно этот белок распознает рецептор ангиотензинпревращающего фермента 2 (ACE2) на поверхности клеток человека и затем связывается с ним рецептор-связывающим мотивом RBM. Ученые предположили, что за счет общего мотива KGD бактериофаги способны конкурировать с коронавирусом за связывание с ACE2 и тем самым защищать клетки от проникновения опасного патогена [1], [25].
Есть данные, что бактериофаги подавляют размножение вирусов через NF-κB. Так называется семейство из семи белков — факторов транскрипции. Они регулируют активность переписывания генетической информации с ДНК на РНК и тем самым влияют на производство цитокинов, выживаемость клетки, процесс апоптоза, воспаление, иммунный ответ. Белки NF-κB уже заранее присутствуют в цитоплазме, и это позволяет им быстро активироваться, когда клетка сталкивается со стрессовыми факторами — всего за несколько минут, ведь белок не нужно делать «с нуля» [12], [26].
Эти свойства делают систему NF-κB полезным инструментом не только для самой клетки, но и для вирусов. Ее «захватывают» и используют для транскрипции своей ДНК ВИЧ, Т-лимфотропный вирус человека 1-го типа, вирусы гепатитов B и C, Эпштейна—Барр, гриппа. Разные вирусы совершают такие диверсии различными способами. На рисунке 2 представлена схема, которая показывает, как сигнальная молекула во время вирусной инфекции связывается с киназой IkB (IKK) — клеточным рецептором. Эта киназа фосфорилирует молекулу IkBα, которая в норме является ингибитором NF-κB. В итоге фосфорилированная молекула IkB деградирует в клеточных протеасомах, а NF-κB проникает в ядро клетки и активирует считывание информации с генов. Бактериофаги способны прерывать фосфорилирование IkBα и тем самым нарушать путь активации NF-κB. Из-за этого эукариотический вирус не может активировать транскрипцию ДНК в клетке [12], [27].
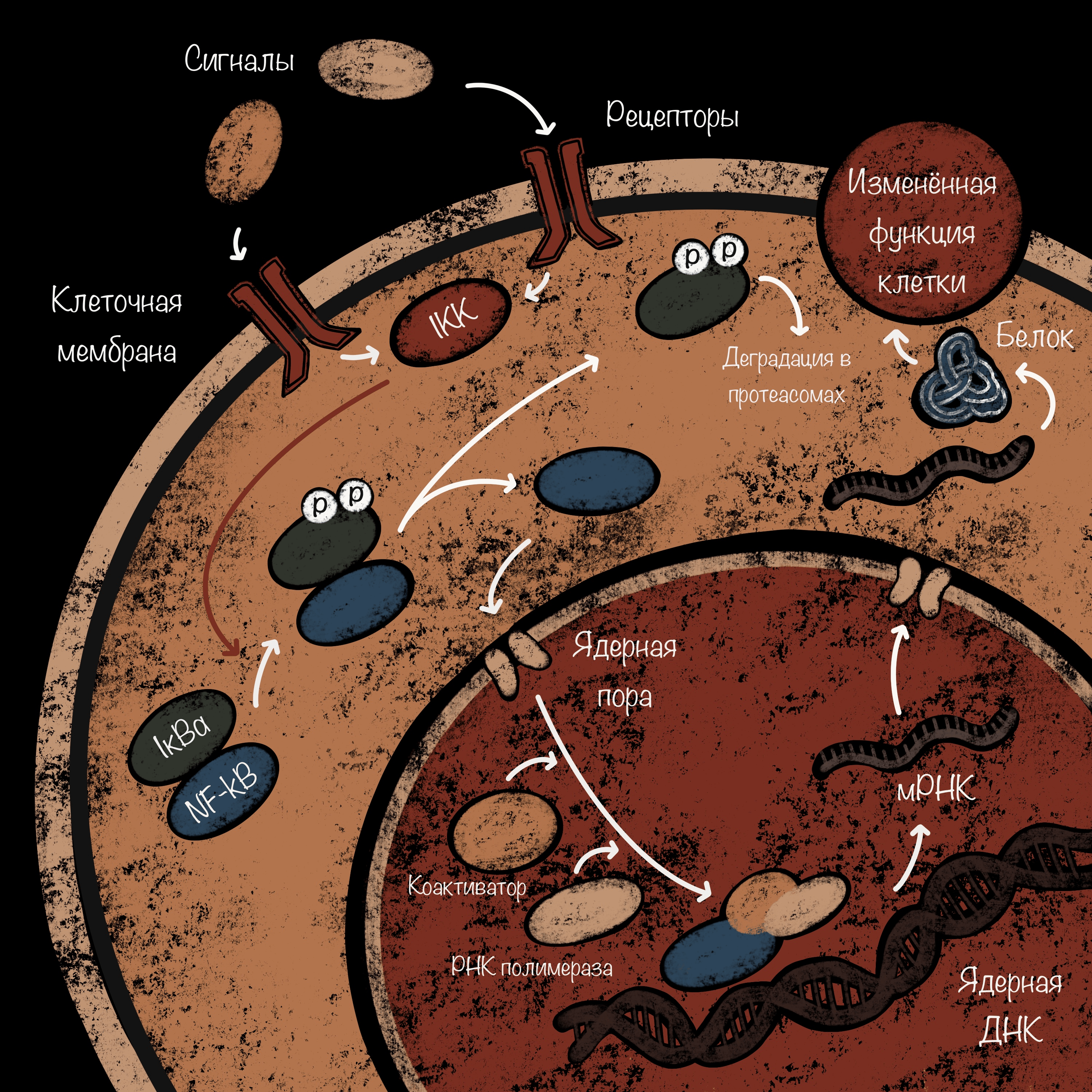
Рисунок 2. Механизм активации NF-κB.
иллюстрация Анастасии Самоукиной по [12]
Влияние бактериофагов на воспаление
Воспаление — естественная защитная реакция организма. В проблему оно превращается, когда становится слишком сильным. Тут снова к месту вспомнить об инфекции COVID-19 с ее цитокиновым штормом. По сути, это воспаление, замкнутое в порочный круг и усиливающее само себя.
Исследования показывают, что некоторые бактериофаги обладают мощным противовоспалительным эффектом, и дело не только в том, что они уничтожают бактерии, из-за которых всё началось. Ученым удалось открыть и другие механизмы, вот некоторые из них:
- Связывание липополисахаридов. Эти соединения входят в состав клеточных стенок грамотрицательных бактерий, а в организме человека вызывают острую воспалительную реакцию. Бактериофаги, паразитирующие на этих бактериях, часто используют липополисахариды как рецепторы для проникновения в клетку [28–30].
- Уменьшение выработки активных форм кислорода. Воспаление во время вирусных инфекций приводит к гибели клеток, и в результате выделяются активные формы кислорода (АФК). В принципе, это полезное явление, оно помогает бороться с патогенами. Но когда АФК много, страдают собственные ткани организма. Например, при инфекциях, вызванных респираторно-синцитиальным вирусом, поражение легких напрямую зависит от силы окислительного стресса. При COVID-19 на ранних стадиях картина на рентгенограммах легких тем хуже, чем больше вырабатывается АФК. Многие исследования на инфицированных клетках животных показывают, что антиоксиданты — вещества, нейтрализующие АФК, — приносят пользу. Известно, что бактериофаги подавляют выработку активных форм кислорода во время вирусных и бактериальных инфекций [1], [30–33].
- Инактивация NF-κB. Выше мы рассказывали, что многие вирусы активируют этот фактор транскрипции и используют для размножения. Собственные же клетки организма используют его, чтобы активировать врожденный и адаптивный иммунитет, запустить выработку цитокинов. Бактериофаги подавляют этот процесс. Например, когда в одном исследовании ученые инкубировали эпителиальные клетки вместе с фагом T4, активация NF-κB сильно уменьшалась или совсем не происходила. Сообщалось об аналогичных эффектах антистафилококкового фага [1], [34–36].
- Активация выработки интерлейкина-10 (ИЛ-10). Этот цитокин предотвращает воспаление, аутоиммунные реакции и связанное с ними повреждение тканей. Если его вырабатывается мало, то это грозит аутоиммунными заболеваниями и развитием опухолей [1], [37].
«Противовирусный иммунитет, проснись!»
Бактериофаги часто применяют местно, то есть вводят в определенный орган и ожидают, что лечебный эффект проявится именно в нем. Например, во время заболеваний ЛОР-органов фагопрепараты закапывают в нос, ими полощут горло, проводят ингаляции. Но можно сказать, что на самом деле бактериофаги всегда действуют системно. Они проникают в кровоток и взаимодействуют с иммунной системой. Их влияние на иммунитет многообразно, и тут еще есть что исследовать (рис. 3).
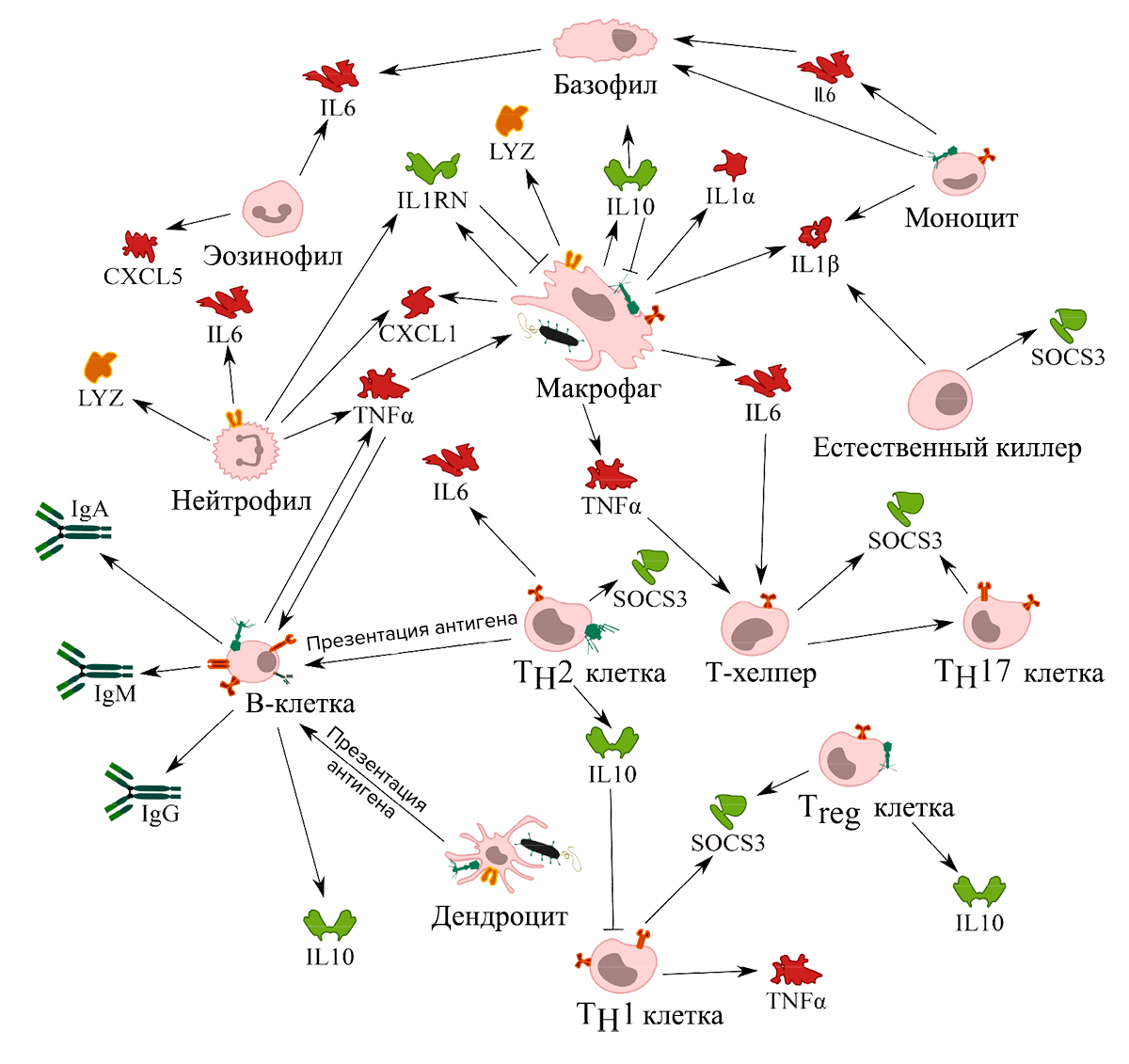
Рисунок 3. Клетки иммунной системы, с которыми взаимодействуют бактериофаги. Эти взаимодействия могут происходить сообща с хозяевами фагов — бактериями, — или напрямую. Фаги могут способствовать выработке цитокинов, которые усиливают воспаление (красный цвет) или подавляют его (зеленый цвет).
[32], рисунок адаптирован
Есть многочисленные научные данные о том, что бактериофаги стимулируют выработку двух веществ с мощным противовирусным действием — интерферона-альфа и интерлейкина-12. В 2019 году ученые обнаружили, что фаги кишечных палочек и молочнокислых бактерий усиливают выработку интерферона-гамма — еще одного противовирусного агента [38–40].
Известны и другие противовирусные эффекты бактериофагов, опосредованные иммунной системой:
- Они могут взаимодействовать с толл-подобными рецепторами (TLR). Эти рецепторы на поверхности клеток распознают патогены и подают сигналы иммунным клеткам. Например, бактериофаг T4 усиливает экспрессию гена TLR2. Этот рецептор распознает белки, входящие в состав вирусных капсидов, и усиливает противовирусный иммунитет [41], [42].
- Стафилококковый бактериофаг А5/80 повышает экспрессию гена интерлейкина-2, управляющего активностью NK-клеток, что важно для защиты от вирусов [41].
- Фаги способны обеспечивать противовирусный эффект путем активации выработки дефензина-2. В 2019 году ученые обнаружили, что фаг Т4 усиливает экспрессию гена hBD2 — человеческого бета-дефензина-2. Этот белок связывается с вирусами, подавляет их размножение, регулирует сигнальные пути, важные для противовирусной защиты, привлекает в зону инфекции иммунные клетки. В 2022 году обнаружили, что hBD2 связывается с рецептор-связывающим доменом (RBD) коронавируса SARS-CoV-2 и блокирует его проникновение в клетки [1], [43], [44].
Невидимые производители антител
Пандемия COVID-19 повысила актуальность не только бактериофагов, но и терапевтических антител. Это еще одно средство для борьбы с инфекциями, которое антибиотики отодвинули на второй план. В 1893 году ученые впервые обнаружили, что сыворотка больных дифтерией помогает защитить от заражения этой инфекцией. То было первое испытание пассивной иммунизации в действии. Впоследствии собрали сыворотки с антителами от лошадей, овец, кур и людей и использовали их для лечения дифтерии, столбняка, пневмококковой пневмонии, менингококкового менингита и других инфекций. А потом появился пенициллин. Пассивная иммунизация не исчезла совсем, но с тех пор ее применение стало ограниченным [45–47].
Интерес к лечению антителами возродился в 70-е годы прошлого столетия, когда ученые придумали, как создавать моноклональные антитела . Они производятся клетками одного клона и направлены против одного антигена. Поначалу их использовали только для исследований, а потом ими научились лечить разные болезни. Например, моноклональные тела используют для иммунотерапии рака, и это помогает продлевать жизни многих онкологических больных. Используют их и для борьбы с новой коронавирусной инфекцией.
У нас есть целый спецпроект о терапевтических антителах — там несколько интересных статей. А еще у нас есть спецпроект, посвященный биспецифическим антителам, способным связываться сразу с двумя мишенями. Это свойство оказалось весьма полезным в медицине.
Более 30 лет назад ученые смогли создать рекомбинантные антитела — их производят из отдельных «кусочков» с помощью генной инженерии, и для этого не нужны специальные клеточные линии или животные [45], [48]. В настоящее время антитела людей, переболевших COVID-19, применяют для борьбы с новой коронавирусной инфекцией.
Однако при чем тут бактериофаги? Они помогают «наштамповать» необходимые антитела намного быстрее, чем классическими методами.
В 1985 году американский биолог Джордж П. Смит (рис. 4) разработал методику фагового дисплея. Суть ее состоит в том, что в геном вируса бактерий можно вставить фрагмент ДНК, с которого будет синтезироваться определенный белок и «выставляться» на поверхности фага в связке с его собственным белком. Это дает возможность идентифицировать нужный белок при помощи реакции с другими веществами, отбирать определенные белки и при этом четко понимать, какие гены их кодируют. Сейчас благодаря фаговым дисплеям созданы целые библиотеки фаговых частиц, с чьей помощью можно отбирать, например, антитела, направленные против определенных антигенов [49], [50].
В 2018 году Джордж П. Смит вместе с американским молекулярным биологом Грегори П. Уинтером (рис. 5) получил Нобелевскую премию по химии «за фаговый дисплей пептидов и антител» [49], [51].
Фаги с нужными белками отбирают с помощью процедуры, которая называется пэннингом, или биопэннингом (рис. 6).
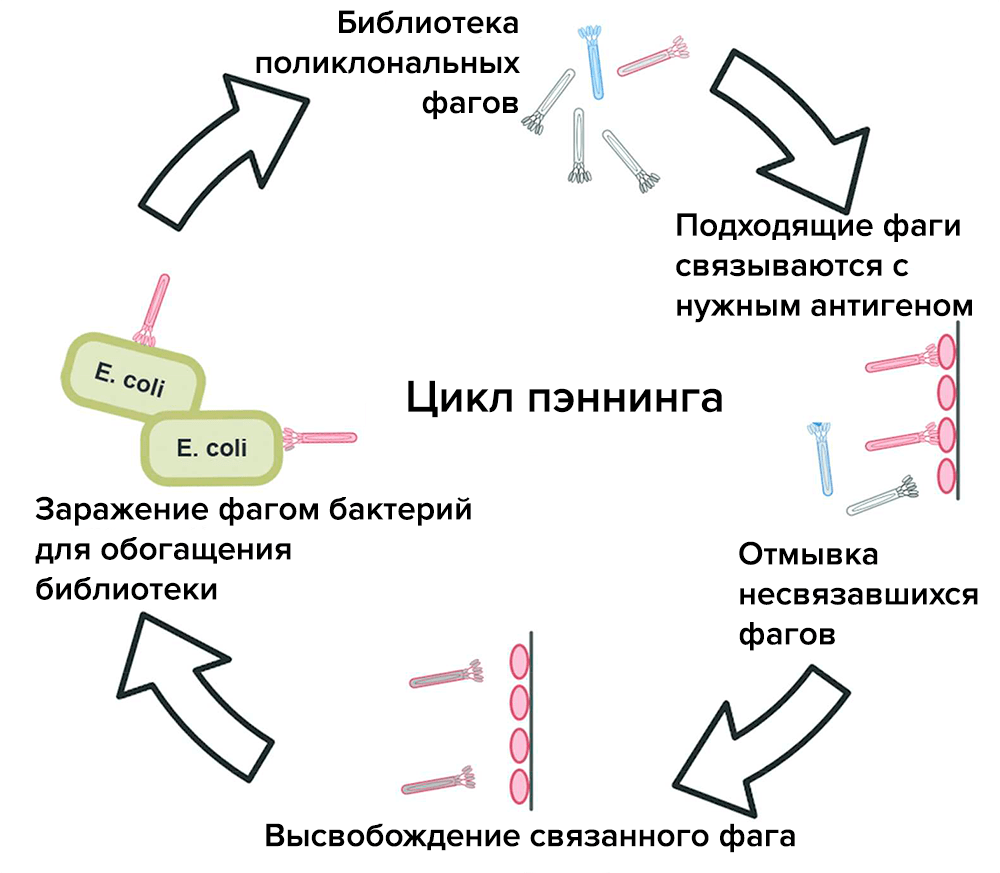
Рисунок 6. Этапы биопэннинга. Эта процедура позволяет отбирать бактериофаги с нужным белком. Так можно отбирать антитела против определенного антигена.
[50], рисунок адаптирован
Классический пэннинг требует высокой степени очистки антигена, с которым будет реагировать антитело в составе бактериофага. Но ученым часто приходится работать с неочищенными антигенами, и специально для этого была разработана методика пэннинга с мистическим названием «Инь-Ян». Это тот случай, когда наука взяла за основу концепцию одной из духовных практик: взять две противоположности и установить между ними баланс, чтобы получить гармонию. Во время такого пэннинга сначала заставляют связаться с «мусорными» антигенами все «лишние» фаги, а потом библиотеку переносят на неочищенный антиген-мишень (рис. 7) [52].
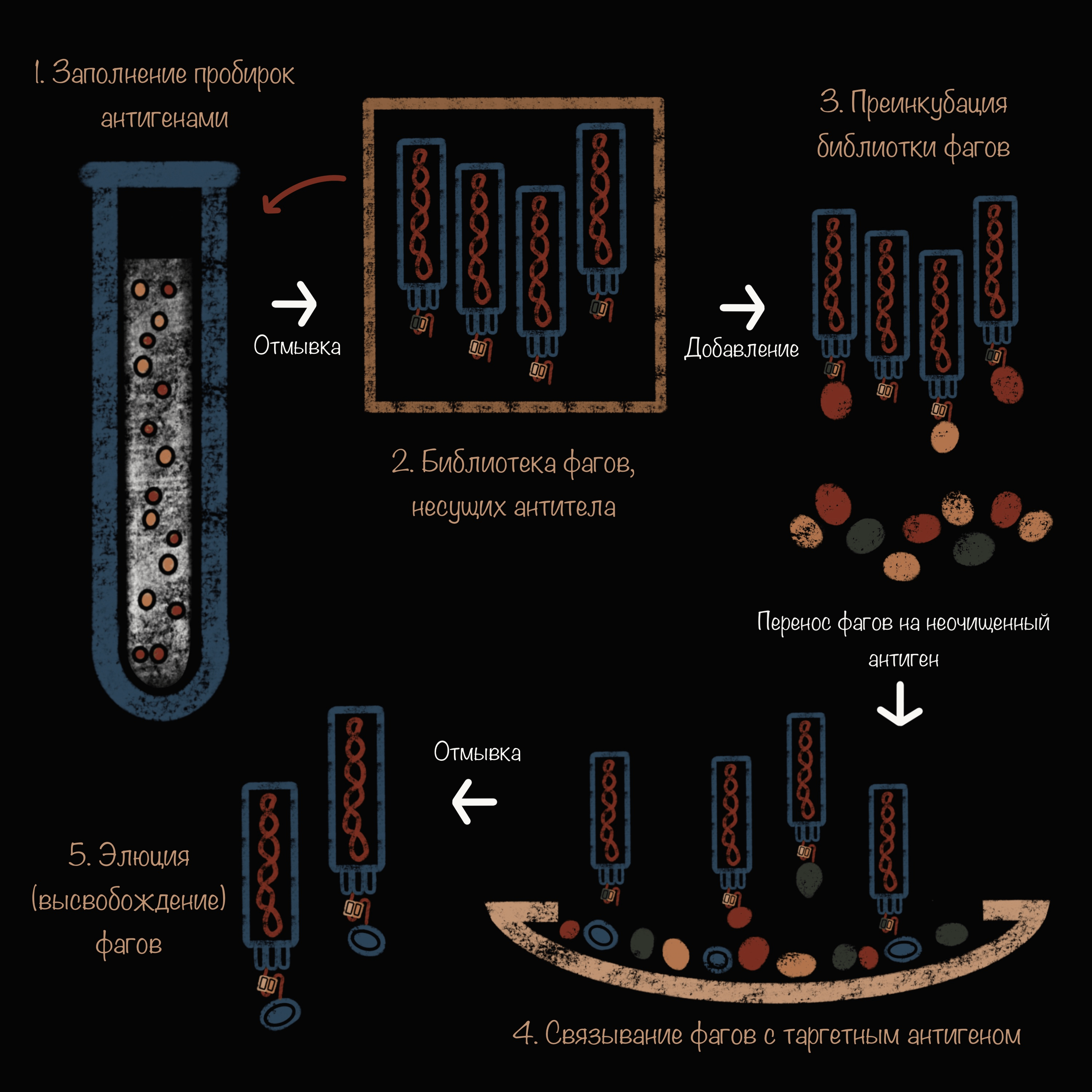
Рисунок 7. Принцип работы биопэннинга «Инь-Ян». Эта процедура состоит из пяти основных этапов. 1. Заполнение пробирок антигенами: лизатом E. coli и обезжиренным молоком (оставляют предварительно на ночь). Это помогает связать лишние фаги. 2. Добавление фаговой библиотеки антител в иммунопробирку. 3. Предварительная инкубация фаговой библиотеки в иммунопробирке в течение 1 ч. 4. Перенос предварительно инкубированной фаговой библиотеки в лунку, покрытую антигеном, к которому нужно подобрать антитела. 5. Отмывка от лишних фагов и антигенов и элюция (освобождение) бактериофагов, которые связались с нужным антигеном.
иллюстрация Анастасии Самоукиной по [52]
Благодаря этим технологиям, с помощью бактериофагов можно отбирать разные фрагменты молекул антител. А потом можно заразить фагами бактерии и получить готовые антитела. Причем разные фрагменты молекул можно сочетать таким образом, чтобы получить не только антитела, которые производит иммунная система человека, но и совершенно новые. И это открывает возможность быстро создавать иммуноглобулины для борьбы с COVID-19 и другими вирусными инфекциями. Если вирус мутирует, то с помощью фагов можно сконструировать новые антитела [45], [50], [53], [54].
Как сварить вакцину из фага?
Бактериофаги способны помочь не только в борьбе с вирусными инфекциями, но и в их профилактике. Их можно использовать в качестве вакцин. Это не новая идея: впервые ученые озвучили ее еще в 1988 году. Сейчас речь идет уже о трех разновидностях вакцин на основе «пожирателей бактерий» (рис. 8).
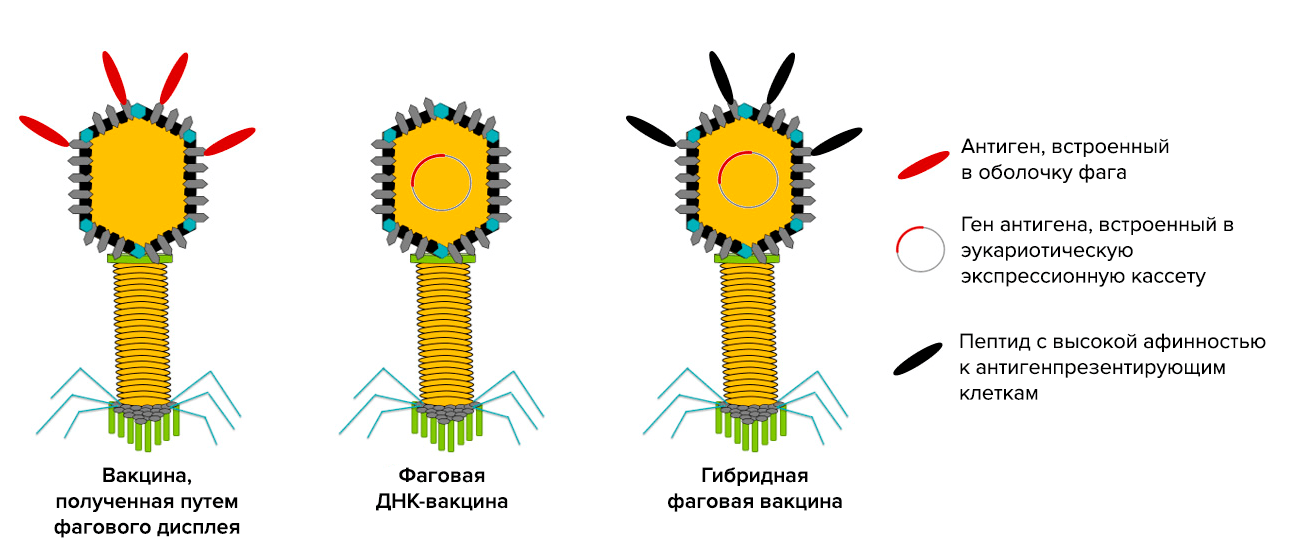
Рисунок 8. Три типа вакцин на основе бактериофагов. В будущем такие вполне могут появиться в прививочных календарях.
[55], рисунок адаптирован
Первый тип вакцин разработан на основе уже знакомого нам фагового дисплея. В ДНК фага можно ввести ген, который будет кодировать эпитоп (часть молекулы антигена, которую распознает иммунная система) или мимотоп (молекулу, которая имитирует эпитоп). Иммунная система отреагирует на антиген и выработает защиту, но при этом сам фаг по-прежнему будет безопасен для организма и через какое-то время покинет его. Такие вакцины уже показали потенциальную эффективность в некоторых исследованиях (табл. 1).
| Антиген в составе вакцины | На чем проводилось исследование | Эффекты после введения вакцины | Использованный фаг |
|---|---|---|---|
| Эпитоп вируса гепатита B S28–39 | Самки мышей | Индукция специфического ответа цитотоксических Т-лимфоцитов | М13 |
| Эпитоп гликопротеина G респираторно-синцитиального вируса | Мыши | Индукция/стимуляция сильного иммунного ответа против респираторно-синцитиального вируса | fd |
| Эпитопы гликопротеина G вируса простого герпеса 2 типа | Мыши | Стимуляция защитного иммунитета | fd-tet |
| Эктодомен белка M2 вируса гриппа А | Самки мышей |
|
Т7 |
ДНК-вакцины (мы разбирали их в статье «Что такое ДНК-вакцины и с чем их едят?» [56]) представляют большой интерес для ученых, и на них возлагают определенные надежды. Потенциально у них есть немало преимуществ. Они относительно просты и недороги в производстве, непривередливы к условиям хранения. После прививки антиген вырабатывается в течение длительного времени и вызывает ответ со стороны как клеточного, так и гуморального (действующего посредством антител) иммунитета. Но есть и некоторые недостатки. До сих пор вакцины на основе ДНК применяются лишь в ветеринарии. Пока проводятся лишь доклинические и клинические исследования (и некоторые из них уже завершились успешно) препаратов для иммунизации людей, в том числе против COVID-19 [57–59].
К слову о вакцинах против нового коронавируса. В архиве «Биомолекулы» про них накопилось немало статей. Мы освещали ситуацию с самого начала. Подробности можно почитать в статьях: «Вакцины против коронавируса: перспективы» [60], «Результаты 1/2 фаз испытания российской вакцины от COVID-19: разбираем статью в The Lancet» [61], «Гонки вакцин 2020» [62], «“Спутник V”, “ЭпиВакКорону”, “Модерну” делать будем? Ликбез по вакцинам против коронавируса» [63]. Ситуация с COVID-19 развивалась так быстро, что многое из этого уже стало историей — но вспомнить не помешает.
«Голые» ДНК-вакцины использовать весьма проблематично, потому что они не очень стабильны и вызывают слабый иммунный ответ. Всегда нужно использовать систему, которая доставит ДНК в клетки человека, в которых будет синтезироваться антиген. В роли такой системы доставки могут выступать и бактериофаги. Чтобы создать вакцину, в геном вируса вводят так называемую экспрессионную кассету. Она содержит, помимо ДНК, кодирующей сам антиген, регуляторные последовательности, обеспечивающие правильный синтез и трехмерную структуру белка-антигена. Причем в один фаг можно загрузить гены сразу нескольких антигенов [55].
Некоторые из разработанных противовирусных фаговых ДНК-вакцин представлены в таблице 2.
| Антиген, который кодирует ДНК в составе вакцины | На чем проводилось исследование | Эффекты после введения вакцины | Использованный фаг |
|---|---|---|---|
| Поверхностный антиген вируса гепатита B (HB) | Мыши и кролики | Анти-HB ответ | λ |
| Малый поверхностный антиген гепатита В (HBsAg) | Кролики | Сильный иммунный ответ с участием антител — иммуноглобулинов G и M | λ |
| Гликопротеин D вируса простого герпеса 1 | Мыши |
|
М13 |
| Протеин E7 вируса папилломы человека 16 типа | Мыши | Уменьшение объема опухолей, вызванных вирусом | λ ZAP |
Гибридные фаговые вакцины одновременно используют и метод фагового дисплея, и вставку ДНК-кассет. Причем фаг можно наделять сразу двумя полезными свойствами, например, выставить на его поверхности белки, за счет которых он будет эффективно доставляться в дендритные клетки, активирующие иммунные реакции, а внутрь загрузить ДНК самого антигена. Это помогает усиливать иммунный ответ [55].
Фаготерапия против вторичной бактериальной пневмонии
Мало того, что многие вирусы опасны сами по себе — они еще и открывают двери для вторичных бактериальных инфекций. Например, у больных гриппом часто обнаруживаются микроорганизмы Staphylococcus aureus, Staphylococcus pneumoniae, Aerococcus viridans, Haemophilius influenza и Moraxella catarrhalis. В условиях, когда организм и без того ослаблен, опасными могут стать даже бактерии-комменсалы, которые в норме не причиняют вреда.
Вторичные бактериальные инфекции представляют большую проблему для больных COVID-19, особенно тех, кто переносит болезнь тяжело, попадает в отделение интенсивной терапии. Во время коронавирусной инфекции в системе противовирусной защиты организма происходит «разрыв». Чтобы выработались антитела и начал работать адаптивный иммунитет, должно пройти время. Врожденному иммунитету долго приходится держать оборону в одиночку, а он не отличается особой разборчивостью и нередко орудует весьма агрессивно. «Ковровая бомбардировка» по вирусам приводит к сильному воспалению, которое еще больше ослабляет организм. Ткани превращаются в поле боя, усеянное остатками погибших клеток, и на них, как стервятники, слетаются бактерии [53], [55].
По данным исследования, опубликованного в 2021 году, частота вторичных бактериальных инфекций при COVID-19 выше, чем при гриппе: 12,6% против 8,7%. Причем их распространенность выше среди пациентов, находящихся в отделении интенсивной терапии. Ведь легкие этих больных работают хуже из-за более тяжелого течения инфекции и постоянного постельного режима. Исследование 2022 года показало, что среди 94 пациентов, обследованных в отделениях интенсивной терапии, 68% заразились хотя бы одной вторичной бактериальной инфекцией. Врачи диагностировали у них бактериальную пневмонию, у некоторых — сепсис. Это существенно (по некоторым данным, в 2,7 раза) повышает риск смерти [66], [67].
Ситуация усугубляется проблемой антибиотикорезистентности . И особенно высоки риски в клиниках, где из-за частого применения антибактериальных препаратов циркулируют устойчивые штаммы микроорганизмов. И тут на помощь приходят бактериофаги.
Ей посвящены наши статьи «Антибиотики и антибиотикорезистентность: от древности до наших дней» [68] и «Антибиотики vs Бактерии. «Война Бесконечности» или всему есть предел?» [69].
В марте 2020 года китайские врачи из Шанхая пролечили коктейлем из двух фагов вторичную CRAB-инфекцию (инфекция, вызванная устойчивой к карбапенемам бактерией Acinetobacter baumannii) у четверых пациентов с COVID-19 в палате интенсивной терапии. Прежде этим больным не помогли антибиотики. Экспериментальное лечение оказалось отчасти успешным (рис. 9) [70], [71].
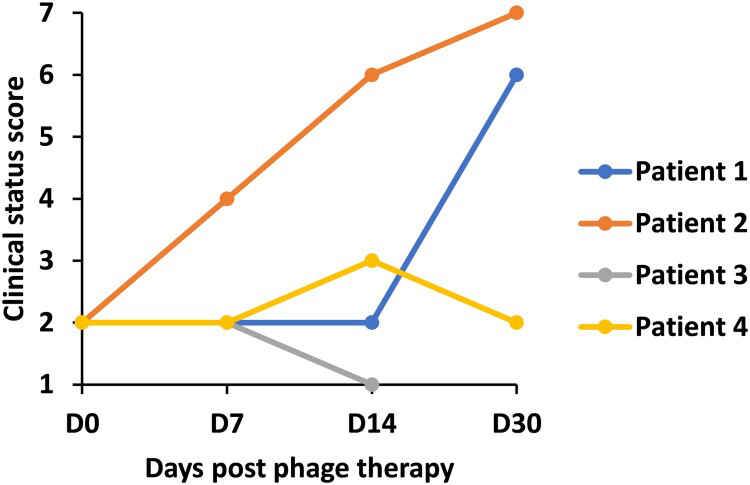
Рисунок 9. Течение заболевания у четверых пациентов с COVID-19 и вторичной бактериальной инфекцией на фоне лечения фагами в Шанхайском клиническом центре общественного здравоохранения. По горизонтали отмечены дни, прошедшие с момента начала применения бактериофагов — состояние пациентов оценивали на 7, 14 и 30 дни. По вертикали — оценка состояния больного по семибалльной шкале: 1 — пациент умер; 2 — находится в отделении интенсивной терапии на экстракорпоральной мембранной оксигенации или инвазивной (через трубку, установленную в трахею) вентиляции легких; 3 — проходит лечение в стационаре, находится на неинвазивной (через маску) вентиляции легких или высокопоточном кислородном устройстве; 4 — проходит лечение в стационаре, нуждается в оксигенотерапии; 5 — проходит лечение в стационаре, не нуждается в оксигенотерапии; 6 — выписан из стационара, но пока не может вернуться к привычному образу жизни; 7 — выписан, вернулся к привычному образу жизни.
Почти одновременно битва фагов за жизни пациентов с тяжелым течением новой коронавирусной инфекции началась в США. В сентябре 2020 года специалисты из компании Adaptive Phage Therapeutics (APT) объявили, что намерены лечить бактериофагами восемь пациентов с COVID-19 и вторичными CRAB-инфекциями, находящихся в тяжелом состоянии на искусственной вентиляции легких, в рамках экстренного разрешения на использования новых лекарственных препаратов eIND. Эта фаготерапия была названа PhageBank™. Ее первое испытание прошло успешно, и спустя два месяца американское Управление по санитарному надзору за качеством продуктов и медикаментов (FDA) предоставило компании APT расширенный доступ eIND на применение ее фагового банка для лечения пациентов с COVID-19, у которых к вирусной инфекции присоединилась инфекция, вызванная бактериями Acinetobacter baumannii, Pseudomonas aeruginosa (синегнойная палочка) или Staphylococcus aureus (золотистый стафилококк). Как заявляют сами специалисты из APT на сайте компании, «фаговая терапия позволила нам снизить бремя полирезистентной инфекции Acinetobacter baumannii у этих пациентов» [71], [72].
В России тоже растет интерес к бактериофагам как к терапевтическим агентам, способным помочь при COVID-19 и вторичных бактериальных инфекциях. В клинических рекомендациях Минздрава это не отражено, но на практике фаги применяются [73], [74]. Их использование допускается в Методических рекомендациях Национальной ассоциации специалистов по контролю инфекций, связанных с оказанием медицинской помощи (НП НАСКИ) от 2022 года. Ведется в России и исследовательская работа. Например, в 2021 году журнал «Общая реаниматология» опубликовал результаты пилотного исследования, посвященного применению бактериофагов у пациентов с рецидивирующими пневмониями и тяжелым поражением головного мозга. В исследование были включены 83 пациента, у 43 из которых применяли фаги ингаляционно, а остальным вводили антибиотики. Авторы работы отметили, что бактериофаготерапия работала так же хорошо, как и антибиотикотерапия [75].
Другая интересная публикация российских исследователей 2021 года посвящена применению бактериофагов в реабилитации пациентов, перенесших инфекцию COVID-19. Известно, что вирусные инфекции способны приводить к нарушению микрофлоры в разных органах. Состав микробиома меняется, в нем появляются нежелательные бактерии, и они влияют на иммунную систему, обменные процессы, работу органов, в том числе нервной системы. Из-за нарушения микробиоты повышается риск новых инфекций, выделяются сигнальные молекулы, приводящие к различным нарушениям, в том числе воспалению. Дисбиоз — не гнойная инфекция, антибиотики тут применять не имеет смысла, они могут лишь усилить проблему. Пробиотики, пребиотики и другие препараты зачастую не помогают добиться нужного эффекта. А вот бактериофаги за счет своей избирательности могут оказаться весьма полезными [76].
Интерес к бактериофаготерапии в научной и врачебной среде есть, в настоящее время он растет, а значит, и исследования в этом направлении продолжатся.
Литература
- Andrzej Górski, Ryszard Międzybrodzki, Maciej Żaczek, Jan Borysowski. (2020). Phages in the fight against COVID-19?. Future Microbiology. 15, 1095-1100;
- COVID-19: что мы знаем и чего не знаем;
- Как вылечить COVID-19? (Спойлер: пока точно не знаем, но догадываемся);
- Gurpreet K Singhera, Tiffany S Chan, Jenny Y Cheng, Timothy Z Vitalis, Kimm J Hamann, Delbert R Dorscheid. (2006). Apoptosis of viral-infected airway epithelial cells limit viral production and is altered by corticosteroid exposure. Respir Res. 7;
- Gergely Imre. (2020). Cell death signalling in virus infection. Cellular Signalling. 76, 109772;
- Zijing Guo, Zhidong Zhang, Meera Prajapati, Yanmin Li. (2021). Lymphopenia Caused by Virus Infections and the Mechanisms Beyond. Viruses. 13, 1876;
- Апоптоз, или Путь самурая;
- Lang Wang, Wenbo He, Xiaomei Yu, Dalong Hu, Mingwei Bao, et. al.. (2020). Coronavirus disease 2019 in elderly patients: Characteristics and prognostic factors based on 4-week follow-up. Journal of Infection. 80, 639-645;
- Cheng-Wen Lin, Kuan-Hsun Lin, Tsung-Han Hsieh, Shi-Yi Shiu, Jeng-Yi Li. (2006). Severe acute respiratory syndrome coronavirus 3C-like protease-induced apoptosis. FEMS Immunology & Medical Microbiology. 46, 375-380;
- Andrzej Górski, Jan Borysowski, Ryszard Miȩdzybrodzki. (2021). Bacteriophage Interactions With Epithelial Cells: Therapeutic Implications. Front. Microbiol.. 11;
- Stephanie Trend, Barbara J. Chang, Mark O’Dea, Stephen M. Stick, Anthony Kicic, et. al.. (2018). Use of a Primary Epithelial Cell Screening Tool to Investigate Phage Therapy in Cystic Fibrosis. Front. Pharmacol.. 9;
- Vijaya Nath Mishra, Nidhi Kumari, Abhishek Pathak, Rajnish Kumar Chaturvedi, Arun Kumar Gupta, Rameshwar Nath Chaurasia. (2020). Possible Role for Bacteriophages in the Treatment of SARS-CoV-2 Infection. International Journal of Microbiology. 2020, 1-5;
- V. A. Kozlov. (2020). T cell thymic selection and peripheral homeostatic proliferation in infectious diseases. Russian Journal of Infection and Immunity. 9, 629-638;
- Кожанова С.В., Бижигитова Б.Б., Балпанова Г.Т. (2011). Современные представления о механизмах центральной и периферической толерантности. «Вестник КазНМУ». 3, 104–108;
- CD205: relevant in antigen presentation, apoptosis, and tolerance. Bio-Rad;
- DEC-205 and antigen presentation. Biotechne;
- Cindy Audiger, M. Jubayer Rahman, Tae Jin Yun, Kristin V. Tarbell, Sylvie Lesage. (2017). The Importance of Dendritic Cells in Maintaining Immune Tolerance. J.I.. 198, 2223-2231;
- Rachel E. Shrimpton, Matt Butler, Anne-Sophie Morel, Efrem Eren, Swee Shan Hue, Mary A. Ritter. (2009). CD205 (DEC-205): A recognition receptor for apoptotic and necrotic self. Molecular Immunology. 46, 1229-1239;
- Matt Butler, Anne-Sophie Morel, William J. Jordan, Efrem Eren, Susan Hue, et. al.. (2007). Altered expression and endocytic function of CD205 in human dendritic cells, and detection of a CD205?DCL-1 fusion protein upon dendritic cell maturation. Immunology. 120, 362-371;
- Katarzyna Bocian, Jan Borysowski, Michał Zarzycki, Magdalena Pacek, Beata Weber-Dąbrowska, et. al.. (2016). The Effects of T4 and A3/R Bacteriophages on Differentiation of Human Myeloid Dendritic Cells. Front. Microbiol.. 7;
- Maciej Przybylski, Jan Borysowski, Renata Jakubowska-Zahorska, Beata Weber-Dąbrowska, Andrzej Górski. (2015). T4 bacteriophage-mediated inhibition of adsorption and replication of human adenovirus in vitro. Future Microbiology. 10, 453-460;
- Maciej Przybylski, Tomasz Dzieciątkowski, Jan Borysowski, Ryszard Międzybrodzki, Andrzej Górski. (2019). Inhibitory Effects of Bacteriophage Preparations on Adenoviral Replication. Intervirology. 62, 37-44;
- Johnson M. Epstein-Barr Virus (EBV) and Infectious Mononucleosis. (2025). BladGo;
- Jia Chen, Cynthia L. Rowe, Theodore S. Jardetzky, Richard Longnecker. (2012). The KGD Motif of Epstein-Barr Virus gH/gL Is Bifunctional, Orchestrating Infection of B Cells and Epithelial Cells. mBio. 3;
- Junwen Luan, Yue Lu, Shan Gao, Leiliang Zhang. (2020). A potential inhibitory role for integrin in the receptor targeting of SARS-CoV-2. Journal of Infection. 81, 318-356;
- M. Lienhard Schmitz, Michael Kracht, Vera V. Saul. (2014). The intricate interplay between RNA viruses and NF-κB. Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1843, 2754-2764;
- John Hiscott, Hakju Kwon, Pierre Génin. (2001). Hostile takeovers: viral appropriation of the NF-kB pathway. J. Clin. Invest.. 107, 143-151;
- Paulina Miernikiewicz, Anna Kłopot, Ryszard Soluch, Piotr Szkuta, Weronika Kęska, et. al.. (2016). T4 Phage Tail Adhesin Gp12 Counteracts LPS-Induced Inflammation In Vivo. Front. Microbiol.. 7;
- Monica Madalina Tucureanu, Daniela Rebleanu, Cristina Ana Constantinescu, Mariana Deleanu, Geanina Voicu, et. al.. (2017). Lipopolysaccharide-induced inflammation in monocytes/macrophages is blocked by liposomal delivery of Gi-protein inhibitor. IJN. Volume 13, 63-76;
- Andrzej Górski, Ewa Jończyk-Matysiak, Marzanna Łusiak-Szelachowska, Ryszard Międzybrodzki, Beata Weber-Dąbrowska, Jan Borysowski. (2017). The Potential of Phage Therapy in Sepsis. Front. Immunol.. 8;
- Ryszard Miedzybrodzki, Wojciech Fortuna, Beata Weber-Dabrowska, Andrzej Gorski. (2005). Bacterial viruses against viruses pathogenic for man?. Virus Research. 110, 1-8;
- Jonas Van Belleghem, Krystyna Dąbrowska, Mario Vaneechoutte, Jeremy Barr, Paul Bollyky. (2018). Interactions between Bacteriophage, Bacteria, and the Mammalian Immune System. Viruses. 11, 10;
- I. A. Ivanovа, A. A. Trufanova, A. V. Filippenko, I. A. Bespalova, N. D. Omelchenko. (2019). Bacteriophages and the immune system of the macroorganism. Zhurnal Mikrobiologii Epidemiologii i Immunobiologii. 79-84;
- Ting Liu, Lingyun Zhang, Donghyun Joo, Shao-Cong Sun. (2017). NF-κB signaling in inflammation. Sig Transduct Target Ther. 2;
- T. Lawrence. (2009). The Nuclear Factor NF- B Pathway in Inflammation. Cold Spring Harbor Perspectives in Biology. 1, a001651-a001651;
- Lili Zhang, Xiang Hou, Lichang Sun, Tao He, Ruicheng Wei, et. al.. (2018). Staphylococcus aureus Bacteriophage Suppresses LPS-Induced Inflammation in MAC-T Bovine Mammary Epithelial Cells. Front. Microbiol.. 9;
- Shankar Subramanian Iyer, Gehong Cheng. (2012). Role of Interleukin 10 Transcriptional Regulation in Inflammation and Autoimmune Disease. Crit Rev Immunol. 32, 23-63;
- Täborský I. and Dolník V. (1977). Ability of human polymorhonuclear blood cells to produce interferon after induction with phage double-stranded RNA. Acta Virol. 21: 499–502;
- Johanna M. Sweere, Jonas D. Van Belleghem, Heather Ishak, Michelle S. Bach, Medeea Popescu, et. al.. (2019). Bacteriophage trigger antiviral immunity and prevent clearance of bacterial infection. Science. 363;
- Nicolas Dufour, Raphaëlle Delattre, Anne Chevallereau, Jean-Damien Ricard, Laurent Debarbieux. (2019). Phage Therapy of Pneumonia Is Not Associated with an Overstimulation of the Inflammatory Response Compared to Antibiotic Treatment in Mice. Antimicrob Agents Chemother. 63;
- Jan Borysowski, Maciej Przybylski, Ryszard Międzybrodzki, Barbara Owczarek, Andrzej Górski. (2019). The effects of bacteriophages on the expression of genes involved in antimicrobial immunity. Postepy Hig Med Dosw. 73, 414-420;
- Kelly M. Shepardson, Benjamin Schwarz, Kyle Larson, Rachelle V. Morton, John Avera, et. al.. (2017). Induction of Antiviral Immune Response through Recognition of the Repeating Subunit Pattern of Viral Capsids Is Toll-Like Receptor 2 Dependent. mBio. 8;
- Liqun Zhang, Santosh K. Ghosh, Shrikanth C. Basavarajappa, Yinghua Chen, Pravesh Shrestha, et. al.. (2022). HBD-2 binds SARS-CoV-2 RBD and blocks viral entry: Strategy to combat COVID-19. iScience. 25, 103856;
- Ju Kim, Ye Lin Yang, Sun-Hee Jang, Yong-Suk Jang. (2018). Human β-defensin 2 plays a regulatory role in innate antiviral immunity and is capable of potentiating the induction of antigen-specific immunity. Virol J. 15;
- A. M. Shukra, N. V. Sridevi, Dev Chandran, Kapil Maithal. (2014). Production of recombinant antibodies using bacteriophages. European Journal of Microbiology and Immunology. 4, 91-98;
- A Casadevall, M D Scharff. (1994). Serum therapy revisited: animal models of infection and development of passive antibody therapy. Antimicrob Agents Chemother. 38, 1695-1702;
- Arturo Casadevall. (1999). Passive Antibody Therapies: Progress and Continuing Challenges. Clinical Immunology. 93, 5-15;
- COVID-19 Treatments and Medications. (2022). CDC;
- Rodrigo Barderas, Elena Benito-Peña. (2019). The 2018 Nobel Prize in Chemistry: phage display of peptides and antibodies. Anal Bioanal Chem. 411, 2475-2479;
- Conrad E. Z. Chan, Angeline P. C. Lim, Paul A. MacAry, Brendon J. Hanson. (2014). The role of phage display in therapeutic antibody discovery. International Immunology. 26, 649-657;
- Черный ящик изобилия. Нобелевская премия по химии 2018 года;
- Chia Chiu Lim, Patrick C. Y. Woo, Theam Soon Lim. (2019). Development of a Phage Display Panning Strategy Utilizing Crude Antigens: Isolation of MERS-CoV Nucleoprotein human antibodies. Sci Rep. 9;
- Marcin W. Wojewodzic. (2020). Bacteriophages Could Be a Potential Game Changer in the Trajectory of Coronavirus Disease (COVID-19). PHAGE. 1, 60-65;
- A. M. Shukra, N. V. Sridevi, Dev Chandran, Kapil Maithal. (2014). Production of recombinant antibodies using bacteriophages. European Journal of Microbiology and Immunology. 4, 91-98;
- Alejandro González-Mora, Jesús Hernández-Pérez, Hafiz M. N. Iqbal, Marco Rito-Palomares, Jorge Benavides. (2020). Bacteriophage-Based Vaccines: A Potent Approach for Antigen Delivery. Vaccines. 8, 504;
- Что такое ДНК-вакцины и с чем их едят?;
- Maryam Shafaati, Massoud Saidijam, Meysam Soleimani, Fereshte Hazrati, Rasoul Mirzaei, et. al.. (2022). A brief review on DNA vaccines in the era of COVID-19. Future Virology. 17, 49-66;
- IVI, INOVIO, and KNIH to partner with CEPI in a phase I/II clinical trial of INOVIO’s COVID-19 DNA vaccine in South Korea. (2020). International Vaccine Institute;
- Tung Thanh Le, Zacharias Andreadakis, Arun Kumar, Raúl Gómez Román, Stig Tollefsen, et. al.. (2020). The COVID-19 vaccine development landscape. Nat Rev Drug Discov;
- Вакцины против коронавируса: перспективы;
- Результаты 1/2 фаз испытания российской вакцины от COVID-19: разбираем статью в The Lancet;
- Гонки вакцин 2020;
- «Спутник V», «ЭпиВакКорону», «Модерну» делать будем? Ликбез по вакцинам против коронавируса;
- Daniela I. Staquicini, Fenny H. F. Tang, Christopher Markosian, Virginia J. Yao, Fernanda I. Staquicini, et. al.. (2021). Design and proof of concept for targeted phage-based COVID-19 vaccination strategies with a streamlined cold-free supply chain. Proc. Natl. Acad. Sci. U.S.A.. 118;
- Amin Hajitou, Roberto Rangel, Martin Trepel, Suren Soghomonyan, Juri G Gelovani, et. al.. (2007). Design and construction of targeted AAVP vectors for mammalian cell transduction. Nat Protoc. 2, 523-531;
- Astrid De Bruyn, Stijn Verellen, Liesbeth Bruckers, Laurien Geebelen, Ina Callebaut, et. al.. (2022). Secondary infection in COVID-19 critically ill patients: a retrospective single-center evaluation. BMC Infect Dis. 22;
- Noa Shafran, Inbal Shafran, Haim Ben-Zvi, Summer Sofer, Liron Sheena, et. al.. (2021). Secondary bacterial infection in COVID-19 patients is a stronger predictor for death compared to influenza patients. Sci Rep. 11;
- Антибиотики и антибиотикорезистентность: от древности до наших дней;
- Антибиотики vs Бактерии. «Война Бесконечности» или всему есть предел?;
- Nannan Wu, Jia Dai, Mingquan Guo, Jianhui Li, Xin Zhou, et. al.. (2021). Pre-optimized phage therapy on secondary Acinetobacter baumannii infection in four critical COVID-19 patients. Emerging Microbes & Infections. 10, 612-618;
- Nannan Wu, Li-Kuang Chen, Tongyu Zhu. (2022). Phage therapy for secondary bacterial infections with COVID-19. Current Opinion in Virology. 52, 9-14;
- FDA allows phage therapy for COVID19 patients. (2020). Bacteriophage.news;
- Елекоева Т. (2020). Макрофагом по коронавирусу: альтернативой антибиотикам может стать фаготерапия. «Деловой Петербург»;
- Коленцова О. (2021). Мне два коктейля: людей на ИВЛ начали индивидуально лечить «убийцами бактерий». «Известия»;
- N. V. Beloborodova, A. V. Grechko, M. M. Gurkova, A. Yu. Zurabov, F. M. Zurabov, et. al.. (2021). Adaptive Phage Therapy in the Treatment of Patients with Recurrent Pneumonia (Pilot Study). Obŝaâ reanimatologiâ. 17, 4-14;
- Natalya V. Beloborodova, Andrey V. Grechko, Alexander Yu. Zurabov, Fedor M. Zurabov, Artem N. Kuzovlev, et. al.. (2021). Prospects of using adaptive phage therapy in the rehabilitation of post-COVID-19 patients. Physical and rehabilitation medicine, medical rehabilitation. 3, 254-259.