Эпигенетика: невидимый командир генома
30 октября 2015
Эпигенетика: невидимый командир генома
- 30861
- 2
- 29
Стремительное изучение эпигенетики приближает нас к пониманию самых фундаментальных принципов устройства и функционирования внутренних систем всех живых организмов.
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Эпигенетика — это бурно развивающееся в последние годы направление современной науки. Наиболее очевидна роль эпигенетических механизмов в процессах развития, когда из клеток раннего зародыша, ДНК которых совершенно одинакова, возникает множество различающихся между собой специализированных клеток взрослого организма. Оказалось, однако, что эта роль не исчерпывается только развитием и может проявляться и после его завершения. Исследования последних лет показали, что здоровье человека может в значительной степени зависеть от того, в каких условиях происходило его раннее развитие. Выявлено также, что эпигенетические модификации могут передаваться и последующим поколениям, влияя на различные фенотипические проявления у детей и даже внуков.
Конкурс «био/мол/текст»-2015
Эта работа опубликована в номинации «Лучший обзор» конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: лаборатория биотехнологических исследований 3D Bioprinting Solutions и студия научной графики, анимации и моделирования Visual Science.
Знаете ли вы, что наши клетки обладают памятью? Они помнят не только то, что вы обычно едите на завтрак, но и чем питались во время беременности ваши мама и бабушка. Клетки хорошо помнят, занимаетесь ли вы спортом и как часто употребляете алкоголь. Память клеток хранит в себе ваши встречи с вирусами и то, насколько сильно вас любили в детстве. Клеточная память решает, будете ли вы склонны к ожирению и депрессиям. И во многом благодаря клеточной памяти мы отличаемся от шимпанзе, хотя имеем с ним примерно одинаковый состав генома. Эту удивительную особенность наших клеток помогла понять наука эпигенетика.
Наиболее виртуозно это делает иммунная система, сохраняя антитела к большинству вирусов, когда-либо вторгавшихся в организм. Именно индивидуальные профили этих антител теперь можно «читать» с помощью метода ВироСкан, причем зафиксировать всю историю иммунных баталий можно по одному микролитру крови: «Следствие ведет ВироСкан. Новый подход выявляет большинство вирусов, с которыми сталкивался человек» [1]. — Ред.
Эпигенетические ландшафты
Эпигенетика — довольно молодое направление современной науки. И пока она не так широко известна, как ее «родная сестра» — генетика. В переводе с греческого приставка «эпи-» означает «над», «выше», «поверх». Если генетика изучает процессы, которые ведут к изменениям в наших генах, в ДНК, то эпигенетика исследует изменения активности генов, при которых первичная структура ДНК остается прежней. Эпигенетика похожа на «командира», который в ответ на внешние стимулы (такие, как питание, эмоциональные стрессы, физические нагрузки) отдает приказы нашим генам усилить или, наоборот, ослабить их активность.
Подробно об эпигенетических процессах и связанных с ними явлениях рассказано в статьях: «Развитие и эпигенетика, или история о минотавре» [2], «Эпигенетические часы: сколько лет вашему метилому?» [3], «Обо всех РНК на свете, больших и малых» [4], «Шестое ДНК-основание: от открытия до признания» [5].
Пожалуй, самое емкое и в то же время точное определение принадлежит выдающемуся английскому биологу, нобелевскому лауреату Питеру Медавару: «Генетика предполагает, а эпигенетика располагает».
Развитие эпигенетики как отдельного направления молекулярной биологии началось в сороковых годах прошлого столетия. Тогда английский генетик Конрад Уоддингтон сформулировал концепцию «эпигенетического ландшафта» (рис. 1), объясняющую процесс формирования организма [6]. Прошло несколько десятилетий, прежде чем эпигенетику стали воспринимать серьезно, как новую научную дисциплину. Такое положение сохранялось долго потому, что эпигенетика своими выводами подрывала устоявшиеся в генетике догмы. Например, относительно наследования приобретенных признаков. Почти зеркально повторилась ситуация с открытием Б. Мак-Клинток мобильных элементов генома, в которые полвека мало кто хотел верить. Но после серии определяющих работ, проведенных в 70-х годах прошлого века Джоном Гёрдоном [7], Робином Холлидеем, Борисом Ванюшиным и другими, эпигенетику стали наконец воспринимать всерьез [8], [9], [10]. И уже недавно, на рубеже тысячелетий, был проведен ряд блестящих экспериментов, после которых стало ясно, что эпигенетические механизмы влияния на геном не только играют важнейшую роль в работе систем организма, но и могут наследоваться несколькими поколениями. Сразу в нескольких лабораториях были получены свидетельства, заставившие генетиков сильно задуматься.
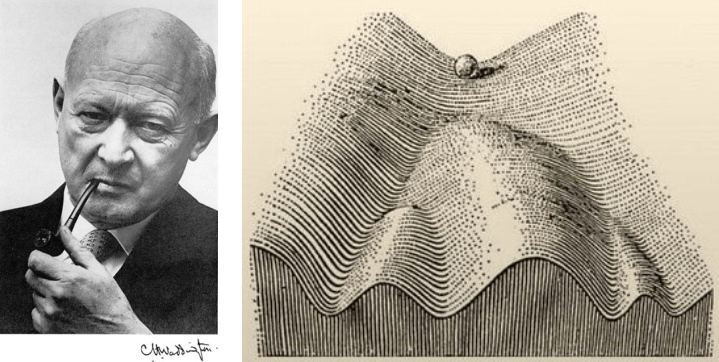
Рисунок 1. К.Х. Уоддингтон и его рисунок «эпигенетического ландшафта». Шарик вверху обозначает первоначальные неспециализированные клетки зародыша. Под воздействием генетических и эпигенетических сигналов клетке будет задана траектория онтогенеза (развития), и она станет специализированной — клеткой сердца, печени и т.д.
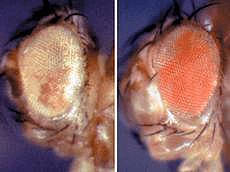
Рисунок 2. Глаза двух дрозофил. Разная окраска глаз обусловлена эпигенетическими изменениями.
Так, в 1998 году Р. Паро и Д. Кавалли проводили опыты с трансгенными линиями дрозофил, подвергая их тепловому воздействию. После этого дрозофилы меняли цвет глаз, и этот эффект — уже без внешнего влияния — сохранялся у нескольких поколений (рис. 2). Как обнаружилось, хромосомный элемент Fab-7 передавал эпигенетическую наследственность в процессе как митоза, так и мейоза [11].
В 2003 году американские ученые из Дюкского университета Р. Джиртл и Р. Уотерленд провели эксперимент с беременными трансгенными мышами агути (yellow agouti (Avy) mouse), которые имели желтую шерсть и предрасположенность к ожирению (рис. 3). Они добавляли в корм мышам фолиевую кислоту, витамин В12, холин и метионин. В результате этого появилось нормальное потомство без отклонений [12]. Пищевые факторы, выступавшие донорами метильных групп, путем метилирования ДНК нейтрализовали ген агути, вызывавший отклонения: фенотип их Avy-потомства изменялся за счет метилирования CpG-динуклеотидов в локусе Avy. Причем воздействие диеты сохранялось и в нескольких последующих поколениях: детеныши мышей агути, родившиеся нормальными благодаря пищевым добавкам, и сами рожали нормальных мышей. Хотя питание у них было уже обычное, не обогащенное метильными группами.
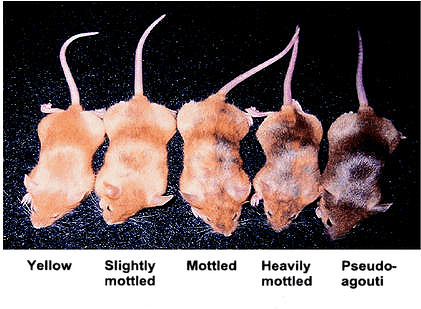
Рисунок 3. Подопытные мыши из лаборатории Рэнди Джиртла. Видно, как происходит изменение в окрасе шерсти детенышей в зависимости от приема матерью доноров метильных групп — фолиевой кислоты, витамина В12, холина и метионина.
Вслед за этим, в 2005 году, журнал Science опубликовал работу Майкла Скиннера и его коллег из Вашингтонского университета. Они обнаружили, что, если в пищу беременным самкам крыс добавлять пестицид винклозолин, у их потомков мужского пола резко снижается количество и жизнеспособность сперматозоидов. И эти эффекты сохранялись на протяжении четырех поколений. Была четко установлена их связь с эпигеномом: ухудшение репродуктивной функции коррелировало с изменениями метилирования ДНК в зародышевой линии [13].
Ученые были вынуждены сделать сенсационный вывод: вызванные стрессом эпигенетические изменения, не затронувшие последовательность нуклеотидов ДНК, могут закрепляться и передаваться следующим поколениям!
Судьба записана не только в генах
Позже выяснилось, что и у людей влияние эпигенетических механизмов (рис. 4, 5) так же велико. Исследования, о которых дальше пойдет речь, приобрели широкую известность — они упоминаются почти в каждой научной работе по эпигенетике. Ученые из Голландии и США в конце 2000-х годов обследовали пожилых голландцев, родившихся сразу после Второй мировой войны. Период беременности их матерей совпал с очень тяжелым временем, когда в Голландии зимой 1944–1945 гг. был настоящий голод. Ученым удалось установить: сильный эмоциональный стресс и полуголодный рацион матерей самым негативным образом повлиял на здоровье будущих детей. Родившись с малым весом, они во взрослой жизни в несколько раз чаще были подвержены болезням сердца, ожирению и диабету, чем их соотечественники, родившиеся на год-два позже (или раньше) [14].
Анализ их генома показал отсутствие метилирования ДНК именно в тех участках, где оно обеспечивает сохранность хорошего здоровья. Так, у пожилых голландцев, чьи матери пережили голод, существенно снижалось метилирование гена инсулиноподобного фактора роста 2 (ИФР-2), из-за чего количество ИФР-2 в крови повышалось. А этот фактор, как известно, имеет обратную связь с продолжительностью жизни: чем выше в организме уровень ИФР, тем жизнь короче [15].
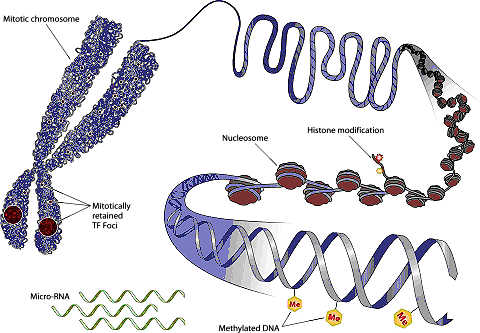
Рисунок 4. Структура хроматина и механизмы эпигенетических модификаций. Хроматин — комплекс белков и нуклеотидов, обеспечивающий надежное хранение и нормальную работу ДНК. В наших клетках упаковка ДНК похожа на склад бижутерии [18]. Иначе никак невозможно уложить спираль ДНК длиной в два метра в одно маленькое клеточное ядро. Нить ДНК наматывается в полтора оборота на многочисленные «бусинки», которые называются нуклеосомами. Эти нуклеосомы, в свою очередь, состоят из нескольких специальных белков, гистонов. Гистоны имеют «хвостики» — белковые наросты, которые могут удлиняться или укорачиваться особыми ферментами. Длина такого «хвоста» напрямую влияет на уровень активности генов, находящихся вблизи него.
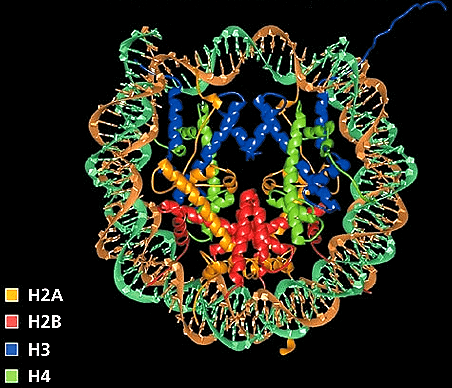
Рисунок 5. Рентгеновская кристаллическая структура нуклеосомы. Гистоны показаны желтым, красным, синим и зеленым цветами.
Новозеландским ученым П. Глюкману и М. Хансону удалось сформулировать логическое объяснение взаимосвязи количества пищи во время беременности матери со здоровьем ребенка. В 2004 году в журнале Science вышла их статья, в которой они сформулировали «гипотезу несоответствия» (mismatch hypothesis) [16]. В соответствии с ней в развивающемся организме на эпигенетическом уровне может происходить прогностическая адаптация к условиям обитания, которые ожидаются после рождения. Если прогноз подтверждается — это увеличивает шансы организма на выживание в мире, где ему предстоит жить, если нет — адаптация становится дезадаптацией, то есть болезнью. Например, если во время внутриутробного развития плод получает недостаточное количество пищи, в нем происходят метаболические перестройки, направленные на запасание пищевых ресурсов впрок, «на черный день».
Если после рождения пищи действительно мало, это помогает организму выжить. Если же мир, в который попадает человек, оказывается более благополучным, чем прогнозировалось, такой «запасливый» характер метаболизма может привести к ожирению и диабету 2-го типа на поздних этапах жизни. Именно этот вариант мы сегодня чаще всего и наблюдаем.
В целом, можно уверенно сказать, что период беременности и первых месяцев жизни является самым важным в жизни всех млекопитающих, в том числе и человека. Все имеющиеся сегодня данные говорят, что именно в этот период закладываются все основы не только физического, но и психического здоровья человека. И влияние этого начального периода жизни настолько велико, что не исчезает до самой глубокой старости, формируя — так или иначе — судьбу человека. Как метко выразился немецкий нейробиолог Петер Шпорк, «в преклонных годах на наше здоровье порой гораздо сильнее влияет рацион нашей матери в период беременности, чем пища в текущий момент жизни» [17]. В это трудно поверить, но факты прямо говорят об этом.
Эпигенетика помогла сделать очень важный вывод: от того, что ела мама во время беременности, в каком психологическом состоянии она находилась и сколько времени уделяла малышу в первые годы после его рождения, будет зависеть буквально вся дальнейшая жизнь ребенка. В это время закладываются основы всего.
Метилирование ДНК
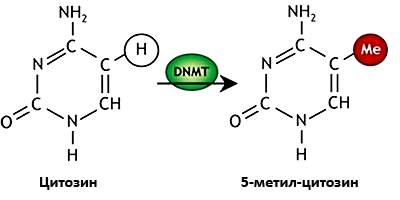
Рисунок 6. Метилирование цитозинового основания ДНК. Схема метилированного цитозина. Зеленым овалом со стрелкой показан главный фермент метилирования — ДНК-метилтрансфера́за (DNMT), красным кругом — метильная группа (—СН3).
Наиболее изученным механизмом эпигенетической регуляции активности генов является процесс метилирования, который заключается в добавлении метильной группы (одного атома углерода и трех атомов водорода, —CH3) к цитозиновым основаниям ДНК, находящимся в составе CpG-динуклеотида (рис. 6). Уже известно, что метилирование ДНК у эукариот видоспецифично, и у беспозвоночных степень метилирования генома очень незначительна по сравнению с позвоночными и растениями. Основы понимания функций метилирования были заложены еще полвека назад профессором МГУ Б.Ф. Ванюшиным и его коллегами. Хотя обычно считается (и вполне правильно), что метилирование «выключает» ген, не давая возможности регуляторным белкам связаться с ДНК, было обнаружено и обратное явление. Иногда метилирование ДНК выступает обязательным условием взаимодействия с белками — были описаны специальные m5CрG-связывающие белки [21].
Метилирование ДНК имеет наибольшее прикладное значение из всех эпигенетических механизмов, так как оно напрямую связано с рационом, эмоциональным статусом, мозговой деятельностью и другими факторами. Так что об этом стоит рассказать поподробнее. И начнем мы с рациона.
Сегодня уже известно, что многие пищевые продукты содержат компоненты, которые определенным образом влияют на эпигенетические процессы. Почти все женщины знают, что во время беременности очень важно потреблять достаточно фолиевой кислоты. Эпигенетика помогает понять исключительную важность этой кислоты в рационе: ведь все дело в том самом метилировании ДНК. Фолиевая кислота вместе с витамином В12 и аминокислотой метионином является донором («поставщиком») метильных групп, необходимых для нормального метилирования. Метилирование непосредственно участвует во многих процессах, связанных с развитием и формированием всех органов и систем ребенка: и в инактивации Х-хромосомы у эмбриона, и в геномном импринтинге, и в клеточной дифференцировке . Соответственно, принимая фолиевую кислоту, будущая мама имеет неплохие шансы выносить здорового ребенка без отклонений.
Подробно об этом написано в статьях на «Биомолекуле»: «Загадочное путешествие некодирующей РНК Xist по X-хромосоме» [22] и «Истории из жизни Х-хромосомы круглого червя-гермафродита» [23].
Витамин В12 и метионин почти невозможно получить из вегетарианского рациона, так как они содержатся преимущественно в животных продуктах. И дефицит витамина В12 и метионина, вызванный разгрузочными диетами беременной женщины, может иметь для ребенка самые неприятные последствия. Не так давно было обнаружено, что недостаток в рационе этих двух веществ, а также фолиевой кислоты, может стать причиной нарушения расхождения хромосом у плода. А это сильно повышает риск рождения ребенка с синдромом Дауна, что обычно считается простой трагической случайностью [24]. В свете этих фактов ответственность родителей сильно увеличивается, и списывать все на несчастный случай теперь будет затруднительно.
Также известно, что недоедание и стресс в период беременности меняют в «худшую сторону» концентрацию целого ряда гормонов в организмах матери и плода: глюкокортикоидов, катехоламинов, инсулина, гомона роста и др. Из-за этого у зародыша происходят негативные эпигенетические изменения (ремоделирование хроматина) в клетках гипоталамуса и гипофиза [25]. Чем это чревато? Тем, что малыш появится на свет с искаженной функцией гипоталамо-гипофизарной регуляторной системы. Из-за этого он будет хуже справляться со стрессом самой различной природы: с инфекциями, физическими и психическими нагрузками и т.д. Вполне очевидно, что, плохо питаясь и переживая во время вынашивания, мама делает из своего будущего ребенка уязвимого со всех сторон неудачника.
Пластичность эпигенома: опасности и возможности
Выяснилось, что так же, как стресс и недоедание, на здоровье плода могут влиять многочисленные вещества, искажающие нормальные процессы гормональной регуляции (рис. 7). Они получили название «эндокринные дизрапторы» (разрушители). Эти вещества, как правило, имеют искусственную природу: человечество получает их промышленным способом для своих нужд. Самым ярким и негативным примером, пожалуй, является бисфенол А, который уже много лет применяется в качестве отвердителя при изготовлении изделий из пластмасс. Он содержится во всей пластиковой таре, которая используется сегодня в пищевой промышленности: в пластиковых бутылках для воды и напитков, в пищевых контейнерах и многом другом. Бисфенол А присутствует в жестяных банках консервов и напитков (им выстилают внутренний слой банок), а также в стоматологических пломбах.
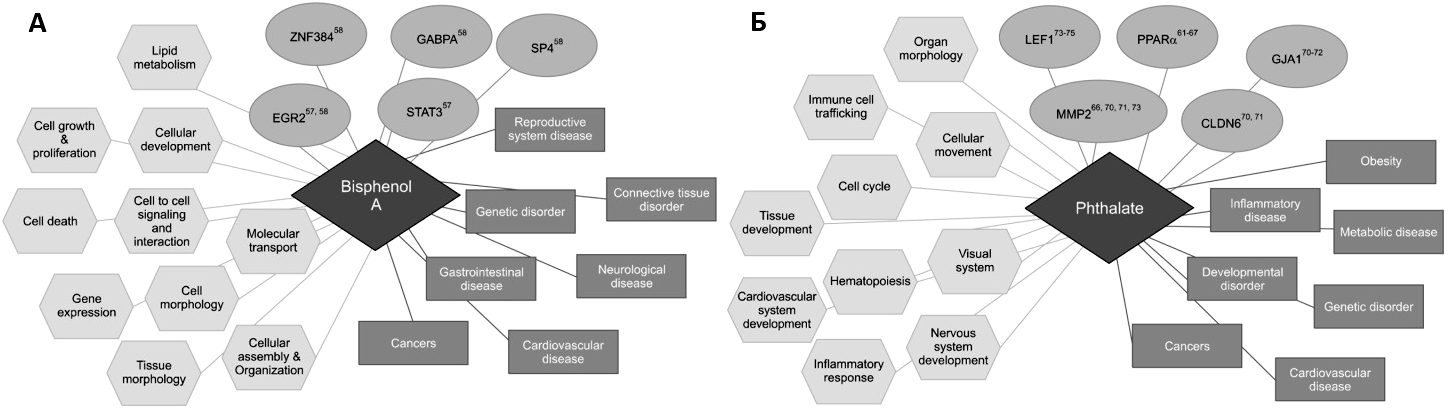
Рисунок 7. Молекулярные составляющие развития отклонений под воздействием «эндокринных разрушителей»: бисфенола А (А) и фталатов (В).
[34]. Нажмите на рисунок, чтобы просмотреть его в полном размере
Негативные воздействия даже небольших концентраций бисфенола А многочисленны и разнообразны, а распространение его таково, что сегодня почти невозможно найти человека без бисфенола А в организме. Его постоянно обнаруживают не только в крови, но и в грудном молоке и пуповинной крови беременных. Причем в амниотической жидкости (жидкости, окружающей эмбрион) концентрация бисфенола А в несколько раз превышает его содержание в сыворотке крови матери [26]. В 2003–2004 гг. американскими исследователями из Центра по контролю и профилактике заболеваний были получены такие результаты распространенности бисфенола А: из 2517 обследованных человек у 92% в моче содержался бисфенол, и его концентрация была значительно выше в организмах детей и подростков, у которых еще плохо сформированы «очистные системы» организма [27].
Очевидно, что, так или иначе, в результате контактов пищи с пластиком какая-то часть бисфенола попадает в организм человека. Последствия такого «обогащения» находятся сегодня в стадии активного изучения. Но уже всплывают тревожные факты.
Так, биологи с медицинского факультета Гарварда — Кэтрин Раковски и ее коллеги — обнаружили способность бисфенола А тормозить созревание яйцеклетки и тем самым приводить к бесплодию. Бисфенол сильно увеличивал частоту хромосомных аномалий в яйцеклетках. Вывод ученых был однозначным: «Поскольку соприкосновение с этим веществом происходит повсеместно, медикам надо знать, что бисфенол А может вызывать значительные нарушения в репродуктивной системе» [28].
Их коллеги из Колумбийского университета в экспериментах с животными выявили еще один тревожный факт. Они обнаружили способность бисфенола А стирать различия между полами и стимулировать рождение потомства с гомосексуальными наклонностями. Под воздействием бисфенола нарушалось нормальное метилирование генов, кодирующих рецепторы к эстрогенам — женским половым гормонам. Из-за этого мыши-самцы рождались с «женским» характером — покладистыми и спокойными. Исчезала разница в поведении самцов и самок. Профессор Ф. Шемпейн и его коллеги вынуждены были сказать: «Мы показали, что воздействие малых доз бисфенола А вызывает неизгладимые эпигенетические нарушения в головном мозге, что, возможно, лежит в основе прочных воздействий бисфенола А на функции мозга и поведение — особенно в отношении межполовых различий» [29].
Другие проведенные исследования показывают, что бисфенол А обладает очень сильно выраженной эстрогенной активностью (не зря его называют «вездесущим ксеноэстрогеном») и способен изменять во время развития эмбриона профиль метилирования, а значит, и активность некоторых генов (например, Hoxa10) [30], [31], [32]. Последствия этого для здоровья человека могут быть самыми неблагоприятными — во взрослом возрасте повышается риск развития некоторых болезней (ожирения, диабета, нарушений репродукции и др.) [33].
Но, к счастью, есть и противоположные примеры. Так, известно, что регулярное употребление зеленого чая может снижать риск онкозаболеваний, поскольку в нем содержится вещество эпигаллокатехин-3-галлат, которое может активизировать гены — супрессоры (подавители) опухолевого роста, деметилируя их ДНК. Очень популярным в последние годы модулятором эпигенетических процессов является генистеин, содержащийся в продуктах из сои. Многие исследователи напрямую связывают содержание сои в рационе жителей азиатских стран с их меньшей подверженностью некоторым возрастным болезням.
Характер — это судьба?
Эпигенетика также помогла понять, почему одни люди отличаются психологической устойчивостью и оптимизмом, а другие склонны к паническим настроениям и депрессии . Как это заведено в научном мире, вначале были проведены эксперименты с животными. Эта серия работ приобрела широкую известность и название «licking and grooming» (вылизывание и уход). Канадские биологи из Университета Макгилла — Майкл Мини и его коллеги — начали изучать влияние материнской заботы у крыс в первые месяцы жизни потомства [35]. Разделив крысят на две группы, они отнимали одну часть выводка у матерей сразу после рождения. Не получавшие материнской заботы в виде вылизывания, такие крысята все поголовно вырастали «неадекватными»: нервными, необщительными, агрессивными и трусливыми.
Дополнительно об этом — в статьях на «Биомолекуле»: «Развитие и эпигенетика, или история о минотавре» [2] и «Эпигенетика поведения: как бабушкин опыт отражается на ваших гена» [36].
Все детеныши в группе, получавшей материнскую заботу в полном объеме, развивались так, как это и положено крысам: энергичными, хорошо обучаемыми и социально активными. В чем же причина такого разительного отличия? Почему материнский уход оказал решающее влияние на развитие психических особенностей у потомства? Анализ ДНК помог ответить на эти вопросы.
Исследовав ДНК крыс, ученые выяснили, что у детенышей, которых не вылизывали матери, произошли негативные эпигенетические изменения в области мозга под названием гиппокамп. В гиппокампе оказалось уменьшено количество рецепторов к стрессовым гормонам. И именно из-за этого наблюдалась неадекватная реакция нервной системы на внешние раздражители: гипофиз подавал команду на избыточное производство стрессовых гормонов. Другими словами, те ситуации, которые переносились спокойно обычными крысами, у потомства, не получившего материнского ухода, вызывали неадекватно сильный стресс.
Как оказалось, все вышеописанное абсолютно точно подходит и к человеческому развитию. Были проведены многочисленные исследования детей, которые в раннем детстве лишались родительской заботы или подвергались какому-либо насилию. Все эти дети без исключения вырастали потом с той или иной искаженной функцией нервной системы. И эти искажения были эпигенетически закреплены в клетках мозга. Всем таким детям была свойственна неадекватная реакция даже на слабые раздражители, которые нормально воспринимались благополучными детьми. Все это формировало во взрослом возрасте склонность к алкоголизму, наркомании, суицидам и прочим неадекватным поступкам [37–39]. Вот почему первые годы после рождения являются решающими в формировании социального поведения и закладывают все основы характера. От того, сколько времени родители уделяли своему малышу в этот период, будет зависеть все его будущее: будет ли он психологически устойчивым, коммуникабельным и успешным или же склонным депрессиям и расстройствам.
Очевидно, что влияние эпигенома распространяется и на процессы, связанные со старением [40]. С возрастом можно наблюдать общее понижение метилирования, в том числе загадочных участков генома, которые составляют почти половину всей последовательности ДНК, — мобильных генетических элементов (МГЭ). Они были открыты полвека назад нобелевским лауреатом Барбарой Мак-Клинток как последовательности, способные — в отличие от обычных генов — удивительным образом перемещаться по ДНК . Излишне активизируясь с возрастом из-за деметилирования, МГЭ дестабилизируют геном, вызывая нежелательные хромосомные перестройки [41].
Об участии МГЭ в эволюции геномов и других процессах можно прочесть в следующих статьях: «Как составлялся геном эукариот: эндосимбиоз VS. непрерывный горизонтальный перенос» [42], «Тайны “молекулярных паразитов”, или Как путешествовать по геному» [43], «Разнообразия много не бывает: чем занимаются мобильные элементы генома в мозге» [44], «Геном человека: полезная книга, или глянцевый журнал?» [45].
Также с возрастом становятся отчетливыми изменения в метилировании генов, связанных с возрастными заболеваниями: атеросклерозом, гипертонией, диабетом, болезнью Альцгеймера и др. [25]. Кроме этого, была обнаружена прямая связь изменений эпигенома с продукцией активных форм кислорода, а также с функцией одного из белков, к которым приковано большое внимание геронтологов: белка p66Shc, названного академиком В.П. Скулачёвым «посредником запрограммированной гибели организма» [46]. И потому знание эпигенетических основ возрастных изменений может принести нам существенную пользу в борьбе за продление жизни и здоровую старость.
Итоги и перспективы
Изучение эпигенетических механизмов помогло понять очень важную истину: человеческая судьба формируется большей частью не астрологическими прогнозами, а поведением самогό человека и его родителей. Эпигенетика совершенно ясно показывает, что очень многое в жизни зависит от нас, и в наших силах поменять жизнь к лучшему.
Эпигенетика также стирает границы между человеком и внешней средой. Очевидно, что никто не может чувствовать себя в безопасности, пока практикуется масштабное использование опасных химических веществ. Пестициды винклозолин и метоксихлор, применяющиеся в сельском хозяйстве и действующие как «эндокринные разрушители», ртуть из промышленных отходов и бисфенол А из разлагающегося пластика проникают в почву и в воду рек и морей. А потом вместе с продуктами и водой попадают в организм человека. И это — реальная угроза для человечества.
Но есть и хорошие новости. В отличие от относительно стабильной генетической информации, эпигенетические «метки» при определенных условиях могут быть обратимыми. И это позволяет разработать принципиально новые стратегии и методы борьбы с самыми распространенными болезнями: методы, нацеленные на устранение тех эпигенетических модификаций, которые возникли у человека при воздействии неблагоприятных факторов. Не случайно нынешнее столетие некоторые ученые называют веком эпигенетики. При изучении истории развития естественных наук, биологии и генетики в частности, может сложиться впечатление, что все предыдущие годы были большим подготовительным этапом, накоплением сил перед открытиями действительно сверхважного значения. И, вероятно, мы сегодня стоим на пороге этих открытий.
Как это может реализовываться (и реализуется ужé), описано в статье «Пилюли для эпигенома» [47].
Первоначальный вариант статьи был опубликован в журнале «Популярная механика» [48].
Литература
- Следствие ведет ВироСкан. Новый подход выявляет большинство вирусов, с которыми сталкивался человек;
- Развитие и эпигенетика, или История о Минотавре;
- Эпигенетические часы: сколько лет вашему метилому?;
- Обо всех РНК на свете, больших и малых;
- Шестое ДНК-основание: от открытия до признания;
- Waddington C.H. (1942). Canalization of development and the inheritance of acquired characters. Nature. 150, 563–565;
- Нобелевская премия по физиологии и медицине (2012): индуцированные стволовые клетки;
- Holliday R. and Pugh J.E. (1975). DNA modification mechanisms and gene activity during development. Science. 187, 226–232;
- Gurdon J.B., Elsdale T.R., Fischberg M. (1958). Sexually mature individuals of Xenopus laevis from the transplantation of single somatic nuclei. Nature. 182, 64–65;
- Vanyushin B.F., Tkacheva S.G., Belozersky A.N. (1970). Rare bases in animal DNA. Nature. 225, 948–949;
- Cavalli G. and Paro R. (1998). The Drosophila Fab-7 chromosomal element conveys epigenetic inheritance during mitosis and meiosis. Cell. 93, 505–518;
- Waterland R.A. and Jirtle R.L. (2003). Transposable elements: targets for early nutritional effects on epigenetic gene regulation. Mol. Cell. Biol. 23, 5293–5300;
- Anway M.D., Cupp A.S., Uzumcu M., Skinner M.K. (2005). Epigenetic transgenerational actions of endocrine disruptors and male fertility. Science. 308, 1466–1469;
- Heijmans B.T., Tobi E.W., Stein A.D., Putter H., Blauw G.J., Susser E.S. et al. (2008). Persistent epigenetic differences associated with prenatal exposure to famine in humans. Proc. Natl. Acad. Sci. USA. 105, 17046–17049;
- Soubry A., Schildkraut J.M., Murtha A., Wang F., Huang Z., Bernal A. et al. (2013). Paternal obesity is associated with IGF2 hypomethylation in newborns: results from a Newborn Epigenetics Study (NEST) cohort. BMC Med. 11, 29;
- Gluckman P.D. and Hanson M.A. (2004). Living with the past: evolution, development, and patterns of disease. Science. 305, 1733–1736;
- Шпорк П. Читая между строк ДНК. М.: Ломоносовъ, 2013. — 272 с.;
- 100 лет хромосомной теории наследственности (1915–2015);
- Sayyed K. Zaidi, Daniel W. Young, Martin Montecino, Jane B. Lian, Janet L. Stein, et. al.. (2010). Architectural Epigenetics: Mitotic Retention of Mammalian Transcriptional Regulatory Information. Molecular and Cellular Biology. 30, 4758-4766;
- Meaney M.J. and Szyf M. (2005). Environmental programming of stress responses through DNA methylation: life at the interface between a dynamic environment and a fixed genome. Dialogues Clin. Neurosci. 7, 103–123;
- Ванюшин Б.Ф. (2013). Эпигенетика сегодня и завтра. Вавиловский журнал генетики и селекции. 17, 805–832;
- Загадочное путешествие некодирующей РНК Xist по X-хромосоме;
- Истории из жизни Х-хромосомы круглого червя-гермафродита;
- Гречанина Е.Я., Лесовой В.Н., Мясоедов В.В., Гречанина Ю.Б., Гусар В.А. (2010). Закономерная связь между развитием некоторых эпигенетических заболеваний и нарушением метилирования ДНК вследствие дефицита ферментов фолатного цикла. Ультразвуковая перинатальная диагностика. 29, 27–59;
- Вайсерман А.М., Войтенко В.П., Мехова Л.В. (2011). Эпигенетическая эпидемиология ассоциированных с возрастом заболеваний. Онтогенез. 42, 1–21;
- Ikezuki Y., Tsutsumi O., Takai Y., Kamei Y., Taketani Y. (2002). Determination of bisphenol A concentrations in human biological fluids reveals significant early prenatal exposure. Hum. Reprod. 17, 2839–2841;
- Calafat A.M., Ye X., Wong L.Y., Reidy J.A., Needham J.L. (2008). Exposure of the U.S. population to bisphenol A and 4-tertiary-octylphenol: 2003–2004. Environ. Health Perspect. 116, 39–44;
- Ronit Machtinger, Catherine M.H. Combelles, Stacey A. Missmer, Katharine F. Correia, Paige Williams, et. al.. (2013). Bisphenol-A and human oocyte maturation in vitro. Human Reproduction. 28, 2735-2745;
- M. Kundakovic, K. Gudsnuk, B. Franks, J. Madrid, R. L. Miller, et. al.. (2013). Sex-specific epigenetic disruption and behavioral changes following low-dose in utero bisphenol A exposure. Proceedings of the National Academy of Sciences. 110, 9956-9961;
- Трансляция Нох-генов: особая регуляция особых белков;
- Гены, от которых вырастают крылья. И ноги. И всё остальное;
- Bromer J.G., Zhou Y., Taylor M.B., Doherty L., Taylor H.S. (2010). Bisphenol-A exposure in utero leads to epigenetic alterations in the developmental programming of uterine estrogen response. FASEB J. 24, 2273–2280;
- Vaiserman A. (2014). Early-life exposure to endocrine disrupting chemicals and later-life health outcomes: an epigenetic bridge? Aging Dis. 5, 419–429;
- Yang O., Kim H.L., Weon J.I., Seo Y.R. (2015). Endocrine-disrupting chemicals: review of toxicological mechanisms using molecular pathway analysis. J. Cancer Prev. 20, 12–24;
- Meaney M.J., Szyf M., Seckl J.R. (2007). Epigenetic mechanisms of perinatal programming of hypothalamic pituitary adrenal function and health. Trends Mol. Med. 13, 269–277;
- Эпигенетика поведения: как бабушкин опыт отражается на ваших генах?;
- Nieratschker V., Batra A., Fallgatter A. (2013). Genetics and epigenetics of alcohol dependence. J. Mol. Psychiatry. 1, 1–6;
- Nielsen D.A., Utrankar A., Reyes J.A., Simons D.D., Kosten T.R. (2012). Epigenetics of drug abuse: predisposition or response. Pharmacogenomics. 13, 1149–1160;
- Labonte B. and Turecki G. (2010). The epigenetics of suicide: explaining the biological effects of early life environmental adversity. Arch. Suicide Res. 14, 291–310;
- Johnson A.A., Akman K., Calimport S.R., Wuttke D., Stolzing A., de Magalhães J.P. (2012). The role of DNA methylation in aging, rejuvenation, and age-related disease. Rejuvenation Res. 15, 483–494;
- Nikitin A.G. and Shmookler Reis R.J. (1997). Role of transposable elements in agerelated genomic instability. Genet. Res. 69, 183–195;
- Как составлялся геном эукариот: эндосимбиоз VS. непрерывный горизонтальный перенос;
- Тайны «молекулярных паразитов», или Как путешествовать по геному;
- Разнообразия много не бывает: чем занимаются мобильные элементы генома в мозге;
- Геном человека: полезная книга, или глянцевый журнал?;
- Young-Rae Kim, Cuk-Seong Kim, Asma Naqvi, Ajay Kumar, Santosh Kumar, et. al.. (2012). Epigenetic upregulation of p66shc mediates low-density lipoprotein cholesterol-induced endothelial cell dysfunction. American Journal of Physiology-Heart and Circulatory Physiology. 303, H189-H196;
- Пилюли для эпигенома;
- Ржешевский А. и Вайсерман А. (2015). Эпигенетика: гены и кое-что сверху. Популярная механика. 2, 30–33.