-
Сложность устройства биомолекулярных систем многократно возрастает в ряду прокариоты → одноклеточные эукариоты → многоклеточные эукариоты, — и одновременно на многие порядки снижается размер популяций. Чем более высоко развит организм, тем сложнее устроена сеть взаимодействий белковых молекул между собой, — и, по-видимому, само возникновение многоклеточности обязано замысловатым белок–белковым взаимодействиям. Оригинальное компьютерное исследование структурной стабильности родственных белков из различных групп организмов показывает, что эта сложность может быть следствием не эволюционных адаптаций, а «залатыванием» белковых дефектов, постепенно накапливающихся в популяциях ограниченного размера под действием генетического дрейфа.
-
Своим фантастическим прогрессом за последнее столетие биология обязана неслыханному развитию биофизических методов, позволяющих наблюдать за живой материей на уровне отдельных молекул. Однако, несмотря на широчайший арсенал, доступный исследователю, новые способы изучения биологических объектов все продолжают появляться, — причем, основной акцент теперь делается на неинвазивность, то есть минимальное нарушение условий, в которых существуют живые клетки или работают биомолекулы. Интерферометрия обратного рассеяния — новый метод изучения взаимодействия биологических молекул в мембране клеток между собой — основана на изменении параметров лазерного луча, отраженного от взаимодействующих молекул.
-
Несмотря на то, что одна из догм молекулярной биологии утверждает необходимость существования уникальной упорядоченной структуры молекулы белка для воплощения его функции, многие из белков функционируют и прекрасно себя «чувствуют» в состоянии полного «беспорядка». Исследования последних лет показывают, что такие неструктурированные белки отнюдь не исключение, а вполне себе правило.
-
«Биомолекула» не раз уже писала о структурной биологии и, в частности, о строении рецепторов, действующих через активацию G-белка. Осень 2010 года принесла ещё две структуры этих излюбленных фармакологами мембранных белков — дофаминового и хемокинового рецепторов. Однако структурщики и научная общественность пока пребывают в замешательстве: при чрезвычайно высокой общей «похожести», различия между отдельными представителями семейства пока не позволяют воссоздать общую молекулярную картину их действия. «Копилка» продолжает наполняться.
-
Двадцатый век стал веком междисциплинарных исследований, когда грань между «классическими» науками практически стёрлась. В XXI столетии тенденция усиливается — слияние «обычной» (хотя тоже междисциплинарной!) молекулярной биофизики и того, что по-английски называют theoretical computer science, породило необыкновенную область — компьютерный, или in silico, эксперимент. В этой статье рассказывается о методической подоплёке подхода in silico и о его конкретном использовании для имитационного изучения «жизни» биологических мембран и населяющих их белковых молекул.
-
Американская программа по структурным исследованиям белков (PSI), за десятилетие своей работы давшая миру более 5000 пространственных структур биологических молекул, для следующего этапа своих изысканий меняет курс. Дело в том, что из этих пяти тысяч лишь 128 белков — это белки человека, а большинство же лежит в базах данных мёртвым грузом, практически не вызывая интереса биологов. Следующая пятилетка программы PSI пройдёт под знамёнами человеческих объектов, и в первую очередь — рецепторов, действующих через активацию G-белков.
-
Механизм фолдинга белкá — процесса сворачивания цепочки аминокислот в уникальную пространственную структуру — занимает умы множества биофизиков во всем мире, но до окончательного понимания этого вопроса ещё очень далеко. Известно, что равновесие между свёрнутой и денатурированной формами белкá можно сдвинуть, введя в молекулу точечные мутации, а строго определённый их набор может даже привести к появлению новой функции и изменить мотив упаковки полипептидной цепи в пространстве. Мы уже писали об эксперименте, в котором посредством многочисленных мутаций удалось последовательности двух изначально негомологичных белков сделать практически идентичными (88% остатков совпадали), сохранив при этом первоначальную структуру и функции. Теперь те же учёные довели эту пару до «совершенства»: различие в последовательности между двумя разными по строению и функциям белками составило всего один аминокислотный остаток.
-
Еще в начале XX века молекулярные основы жизни были совершенно неведомы, — и тем более впечатляет скорость, с которой человечеству удаётся постигать эти тончайшие явления в наши дни. В 2009 году Нобелевская премия по химии вручена за исследования, возможно, самой сложной молекулярной машины — рибосомы, являющейся клеточной «фабрикой» белка. Лауреатами премии стали Ада Йонат, Томас Стейц и Венкатраман Рамакришнан.
-
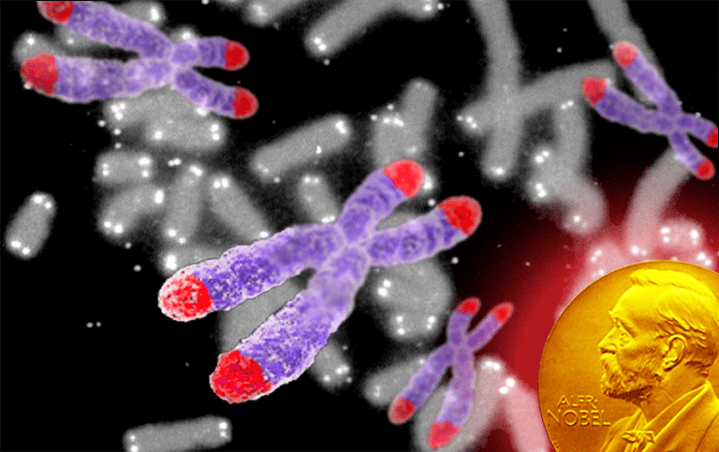
14305В 2009 году Нобелевская премия по физиологии и медицине вручена трём американским учёным, разрешившим важную биологическую проблему: как хромосомы при делении клетки копируются полностью, без того, чтобы ДНК на их кончиках укорачивалась? В результате их исследований стало известно, что «защитным колпачком» для хромосом служат особым образом устроенные окончания ДНК — теломеры, достройкой которых занимается специальный фермент — теломераза.
-
По до сих пор неизвестным причинам в состав белков живых организмов входят преимущественно L-энантиомеры (оптические изомеры) аминокислот, — за довольно редкими и разрозненными исключениями вроде пептидных веществ, образующихся в грибах и бактериях путём нерибосомного синтеза. (Зато сахара находятся преимущественно в D-форме.) Новое исследование выводит D-аминокислоты из «зазеркалья»: обнаружено, что некоторые бактерии — в частности, холерный вибрион и сенная палочка, — синтезируют D-формы аминокислот. Они используются бактериями как связующий компонент пептидогликанового слоя, а также регулируют работу ферментов, ответственных за армирование клеточных стенок.


- Лента
- Спецпроекты
- ▶Подкаст
-
Конкурс
- О конкурсе «Био/мол/текст»
- «Био/мол/текст»-2025/2026
- «Био/мол/текст»-2024/2025
- «Био/мол/текст»-2023/2024
- «Био/мол/текст»-2022/2023
- «Био/мол/текст»-2021/2022
- «Био/мол/текст»-2020/2021
- «Био/мол/текст»-2019
- «Био/мол/текст»-2018
- «Био/мол/текст»-2017
- «Био/мол/текст»-2016
- «Био/мол/текст»-2015
- «Био/мол/текст»-2014
- «Био/мол/текст»-2013
- «Био/мол/текст»-2012
- «Био/мол/текст»-2011
- Объявления
- Авторы
- Партнеры
- Поддержать
Публикации
—
Темы
—
Авторы
—
Комментарии
—
Поиск не дал результатов
По вашему запросу ничего не найдено
- Медицина
- SARS-CoV-2
- «Биомолекула» — Forbes
- Аллергия
- Антибиотики
- Атеросклероз
- Аутоиммунитет
- Боль
- ВИЧ/СПИД
- Вакцины
- Вирус Зика
- Вирус Эбола
- Генная терапия
- Грипп
- Депрессия
- Дерматология
- Диагностика
- Здравоохранение
- Нейродегенерация
- Никотин
- Онкология
- Персонализированная медицина
- Питание
- Сон
- Стволовые клетки
- Фармакология
- Эпилепсия
- Биология
- «Сухая» биология
- Антропология
- Бионика
- Биофизика
- Вирусология
- Вопросы пола
- ГМО
- Генетика
- Иммунология
- Микробиология
- Нейробиология
- Носимые технологии
- Психогенетика
- Синтетическая биология
- Старение
- Структурная биология
- Цитология
- Эволюционная биология
- Экология
- Эмбриология
- Эпигенетика
- Этология
- Биомолекулы
- GPCR
- АФК
- Амилоиды
- Биомембраны
- Гормоны растений
- ДНК
- Ионные каналы
- МГЭ
- Матрикс
- Нейромедиаторы
- РНК
- Рецепторы
- Хроматин