Аллостерические регуляторы GPCR: ключи от всех замков
06 ноября 2019
Аллостерические регуляторы GPCR: ключи от всех замков
- 3078
- 0
- 13
3D-модель структуры GPCR с низкомолекулярным агонистом в аллостерическом сайте
из архивов автора статьи
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: G-белок-сопряженные рецепторы (GPCR) уже не один десяток лет являются привлекательной мишенью для разработки лекарственных препаратов. Химическая структура этих рецепторов полна секретов, разгадка которых дала исследователям широкие возможности для изобретения новых способов регуляции их работы. В этой статье речь пойдет об аллостерических регуляторах GPCR, позволяющих точно «нацеливаться» на конкретные подтипы рецепторов, и о перспективах их практического применения. Чем же изученные вдоль и поперек рецепторы удивят нас на этот раз?
Конкурс «био/мол/текст»-2019
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2019.

Генеральный спонсор конкурса и партнер номинации «Сколтех» — Центр наук о жизни Сколтеха.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий выступила компания BioVitrum.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Немного о том, что такое GPCR
Рецепторы, относящиеся к классу GPCR, не случайно выбраны в качестве одной из самых важных мишеней для фармакологических препаратов — по некоторым данным, на их долю приходится до 40% современных лекарственных форм. И очень важно, что «нацеливание» на эти мишени полностью удовлетворяет принципам таргетной терапии [1]. Рецепторы, сопряженные с G-белком, или G-белок-сопряженные рецепторы (GPCR; G-protein coupled receptors), — это крупные мембранные белки, воспринимающие сигналы от множества разнообразных молекул и стимулов. Среди этих молекул — всем известные нейромедиаторы [2]: дофамин [3], серотонин [4], ацетилхолин [5], гамма-аминомасляная кислота [6] и норадреналин. Не менее популярны GPCR как мишени гормонов: глюкагона, адреналина, грелина, гормонов гипоталамуса и гипофиза. Есть среди GPCR не совсем обычные рецепторы — например, родопсины, которые активируются с помощью света [7], [8]. Кстати, за изучение пространственной структуры этих рецепторов в 2012 году вручена Нобелевская премия по химии [9].
Благодаря GPCR мы способны испытывать эмоции, боль, можем видеть, ощущать запахи и реагировать на множество стимулов окружающей среды. Генов этих рецепторов в нашем геноме почти тысяча, но, несмотря на такое разнообразие, их объединяет ряд общих моментов. Все GPCR плотно сидят в клеточной мембране, пронизывая ее семь раз. Бóльшая часть этих рецепторов, как следует из названия, при активации связываются с G-белками, которые ответственны за проведение сигнала внутри клетки (рис. 1). Количество статей о GPCR на «Биомолекуле» отражает интерес как к их структуре, так и к физиологическим эффектам, выраженным через эти рецепторы [10], [11]; с полным списком материалов по теме можно ознакомиться в одноименном разделе.
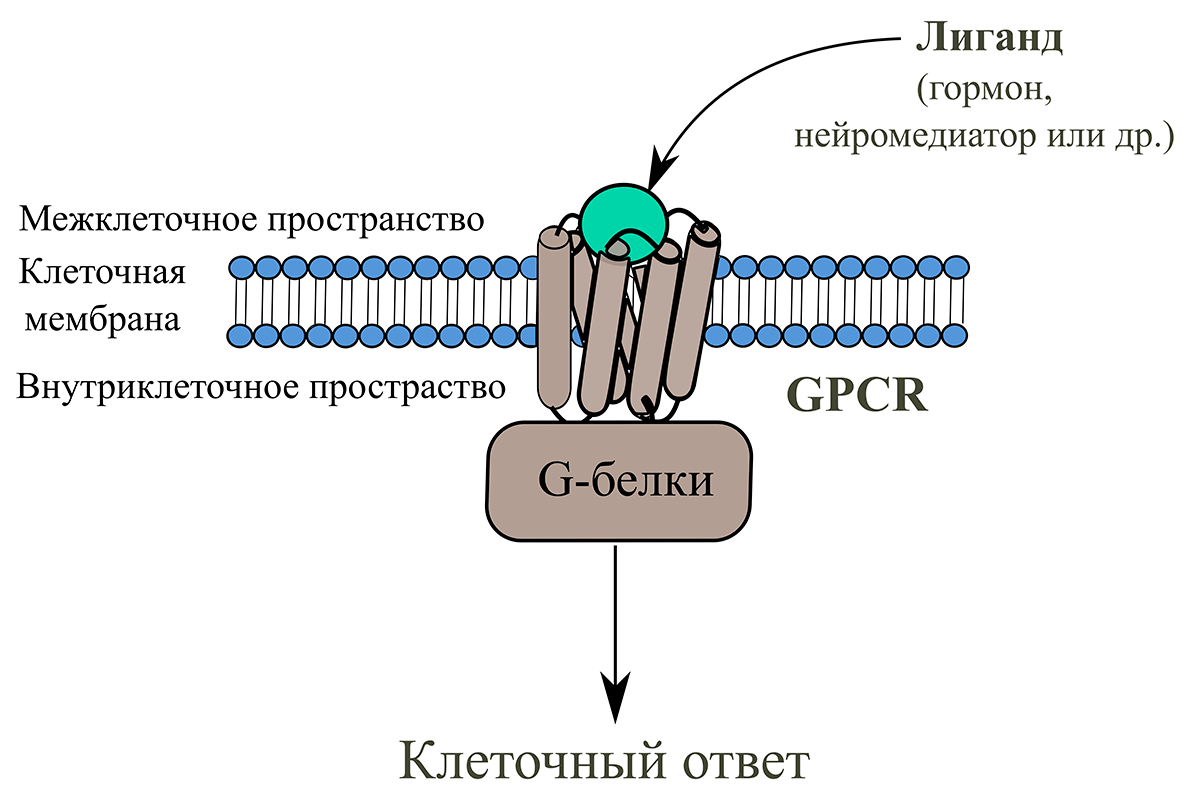
Рисунок 1. Передача сигнала от лиганда в клетку с помощью рецепторов GPCR. С рецептором (пока еще неактивным) связывается специфичная для него молекула, называемая лигандом. Вследствие этого рецептор меняет свою форму (или, более научными словами, конформацию) и превращается в активный рецептор. Изменение конформации рецептора приводит к его взаимодействию с белками, расположенными на внутренней стороне мембраны. У GPCR такими белками служат в числе прочих G-белки, которые, «активируясь об рецептор», инициируют передачу сигнала с помощью одного из внутриклеточных сигнальных путей, что в конечном счете приводит к развитию ответа на стимул.
Типы регуляторов GPCR
Рецепторы GPCR не только играют важную роль в нормальной физиологии и биохимии, но и открывают новые возможности в лечении множества заболеваний, поэтому очень важно научиться регулировать их работу. Но достигнуть этой цели непросто, и ученым пришлось глубоко погрузиться в изучение молекулярных структур GPCR, чтобы понять, как эти рецепторы влияют на физиологические эффекты на уровне всего организма [12]. Активировать GPCR можно несколькими способами.
Ортостерические регуляторы
Первый способ заключается во взаимодействии лиганда с ортостерическим сайтом — основным местом, с помощью которого активируется рецептор. Ортостерические лиганды могут быть агонистами, то есть, веществами, стимулирующими работу рецептора. Но работа рецептора также может быть подавлена специальными блокирующими лигандами, или антагонистами. Они связываются с рецептором, стабилизируя его неактивную конформацию. Ортостерические агонисты и антагонисты могут быть как природными (и выполнять свои физиологические функции в организме), так и искусственными (синтетическими), обычно очень похожими по химической структуре на свои естественные аналоги. Необходимость в искусственных ортостерических регуляторах может возникать по разным причинам. Если рецептор слишком активен или в организме присутствует избыток его природного агониста при какой-либо патологии, антагонист поможет «остудить» рецептор. Например, в патогенез некоторых мигреней большой вклад вносит активность 2В подтипа серотонинового рецептора, поэтому он является важной мишенью для разработки его антагонистов [13].
В ряде случаев ортостерические агонисты и антагонисты GPCR не отвечают тем задачам, которые перед ними ставит современная медицина. Дело в том, что большинство типов GPCR в организме имеет несколько подтипов, которые работают в разных клетках, а иногда в разных тканях, и тогда действие лекарства может оказаться «размытым». Упомянутых серотониновых рецепторов насчитывается до 15 подтипов. При этом они располагаются как в разных отделах центральной нервной системы, так и на периферии, и регулируют абсолютно разные физиологические процессы. Несмотря на то, что для многих из них существуют селективные (то есть специфичные к определенному подтипу) ортостерические агонисты и антагонисты, для некоторых подтипов эта проблема до сих пор актуальна [14].
И рецепторы серотонина — далеко не единственный пример. Низкая селективность лекарственных препаратов в отношении подтипов рецепторов приводит к появлению побочных эффектов. Поэтому актуальной задачей для фармакологов стал поиск нового способа активации рецепторов GPCR. И тогда на помощь исследователям пришла свойственная многим белкам, в том числе рецепторам GPCR, особенность — наличие дополнительных сайтов связывания химических веществ [15]. Наличие альтернативного сайта в GPCR дает возможность активировать рецептор, минуя классический ортостерический сайт. И именно на этих скрытых сайтах рецепторов GPCR сейчас сосредоточено внимание многих фармакологов, биологов и медиков.
Терминология, касающаяся регуляторов GPCR, может показаться немного запутанной, поэтому я попытался структурировать ее на рисунке 2. На схеме представлены лишь основные типы регуляторов, и если погрузиться в этот вопрос глубже, то их окажется еще больше.
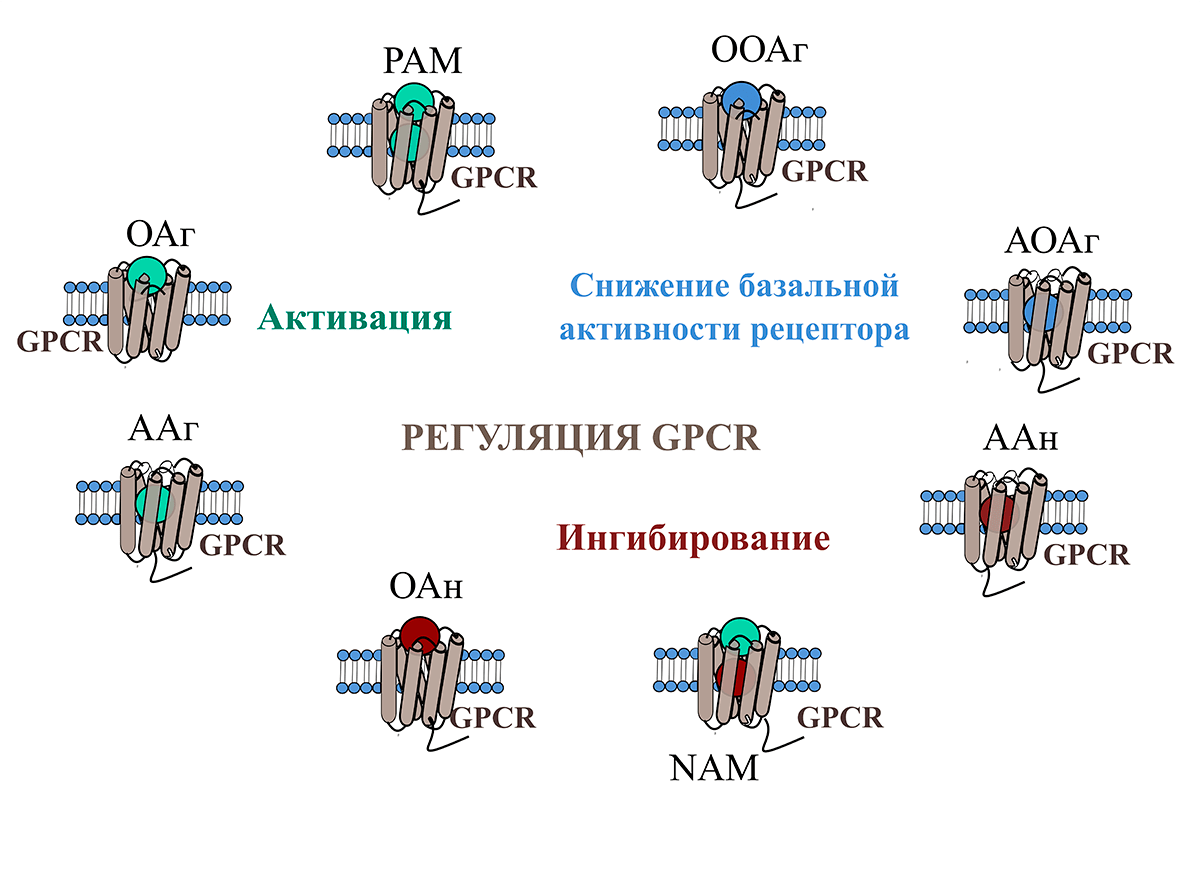
Рисунок 2. Классификация регуляторов G-белок-сопряженных рецепторов. Условные обозначения: GPCR — рецептор, сопряженный с G-белком.
Регуляторы, активирующие рецептор: ОАг — ортостерический агонист, молекула, которая активирует рецептор, действуя через основной сайт связывания; ААг — аллостерический агонист, активирует рецептор, связываясь с альтернативным (аллостерическим) сайтом; PAM — позитивный аллостерический модулятор (positive allosteric modulator), вещество, усиливающее действие ортостерического агониста.
Регуляторы, ингибирующие рецептор: ОАн — ортостерический антагонист, молекула, которая подавляет работу рецептора, действуя через ортостерический сайт; ААн — аллостерический антагонист, молекула, которая подавляет работу рецептора, связываясь с его аллостерическим сайтом; NAM — негативный аллостерический модулятор (negative allosteric modulator), вещество, которое подавляет эффект ортостерического агониста, действуя через аллостерический сайт.
Регуляторы, снижающие активность рецепторов, обладающих базальной активностью. Эти рецепторы работают даже в отсутствии агониста в активном сайте. А обратные агонисты снижают их базальную активность. ООАг — обратный ортостерический агонист, снижает базальную активность рецептора, связываясь с его ортостерическим сайтом; АОАг — аллостерический обратный агонист, снижает базальную активность рецептора, связываясь с его аллостерическим сайтом.
Аллостерические регуляторы GPCR
Эти альтернативные сайты связывания с GPCR называют аллостерическими (алло- (греч.) — другой). И в отличие от ортостерических сайтов, они характеризуется большей специфичностью, то есть аллостерические сайты в разных подтипах рецепторов отличаются сильнее, чем их ортостерические сайты. Это позволяет рассматривать вещества, связывающиеся с аллостерическими сайтами GPCR, в качестве новых, более селективных препаратов для активации или ингибирования определенных подтипов рецепторов.
Расположение ортостерических и аллостерических сайтов у разных групп GPCR схематично показано на рисунке 3. Так же, как и в случае ортостерических лигандов, аллостерические регуляторы могут быть агонистами и антагонистами. Многие из известных ныне аллостерических регуляторов обладают способностью усиливать (положительные аллостерические модуляторы, PAM) или ослаблять (негативные аллостерические модуляторы, NAM) действие ортостерического лиганда. Подобное свойство аллостерических модуляторов может быть полезно для достижения более мягкого эффекта от введения ортостерического лиганда: он не будет конкурировать с ортостерическим лигандом, а лишь дополнять (модулировать) его действие.
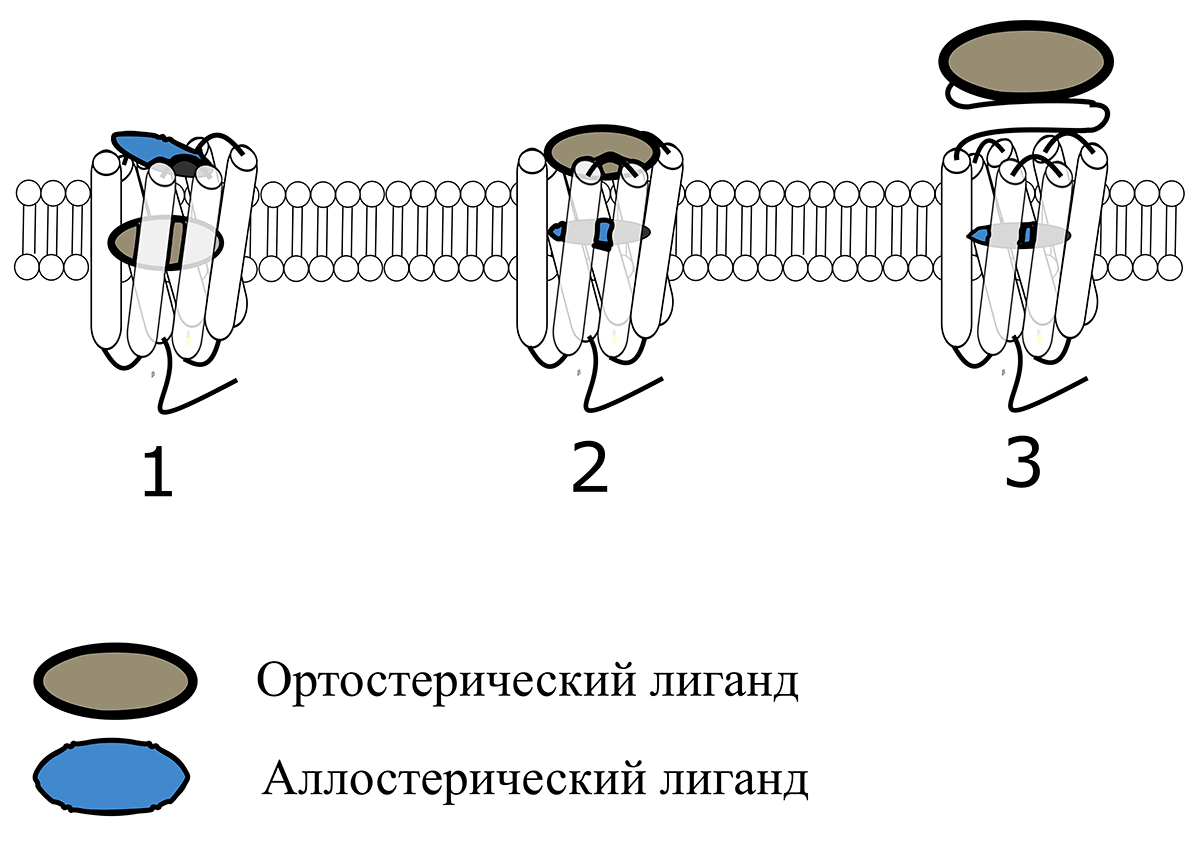
Рисунок 3. Расположение ортостерических и аллостерических сайтов связывания в G-белок-сопряженных рецепторах. 1. Класс A — рецепторы, которые активируются низкомолекулярными ортостерическими лигандами (моноаминами, нуклеотидами) или небольшими пептидами. У таких рецепторов аллостерические сайты расположены на внеклеточных петлях. Примеры: серотониновые, адреналиновые, аденозиновые и др. рецепторы. 2. Класс B — рецепторы, которые активируются небольшими пептидами и белками. Такие крупные молекулы уже не могут проникнуть внутрь трансмембранного домена и взаимодействуют с внеклеточными петлями рецепторов. Например, рецепторы хемокинов, глюкагона, многих других гормонов и нейропептидов. 3. Класс C — рецепторы, которые активируются крупными белками, взаимодействующими с большим трансмембранным доменом, представляющим собой ортостерический сайт этих рецепторов. К ним относятся рецепторы лютеинизирующего, фолликулостимулирующего, тиреотропного и некоторых других гормонов. Аллостерические сайты рецепторов 2 и 3 расположены глубоко в трансмембранном домене. Зачастую, аллостерические сайты рецепторов образуются случайно, и аллостерические лиганды для них остаются неизвестными. Такие рецепторы, как и рецепторы, для которых не выяснен основной, ортостерический лиганд, называют орфанными.
Более подробно о классификации аллостерических регуляторов можно почитать в научных журналах [16], [17], [18]. Аллостерические регуляторы уже нельзя назвать диковинкой в области фармацевтики, и, чтобы проиллюстрировать это, я приведу пару примеров.
Использование аллостерических регуляторов в медицине
Исследования и разработка аллостерических регуляторов для рецепторов хемокинов в последние годы достигли впечатляющих результатов. Хемокиновые рецепторы служат мишенями для хемокинов — белков, основная задача которых обеспечивать миграцию клеток в организме. Они играют важную роль в работе иммунной системы, в развитии аллергических реакций, в патогенезе аутоиммунных заболеваний [19]. В организме насчитывается около 50 хемокинов и 20-и рецепторов к ним [10]. Таким образом, один рецептор может активироваться несколькими видами хемокинов, а те, в свою очередь, могут взаимодействовать с разными подтипами рецепторов.
В этих запутанных взаимоотношениях хемокинов и их рецепторов поиск аллостерических регуляторов стал единственным возможным способом целенаправленно активировать нужный подтип рецептора без влияния на другие. Высокий интерес к рецепторам хемокинов связан также с их участием в жизненном цикле вируса иммунодефицита человека (ВИЧ) [20], [21]. Связываясь с хемокиновым рецептором CCR5, ВИЧ проникает в лимфоцит и начинает продуцировать вирусные частицы. Аллостерические регуляторы связываются с рецепторами хемокинов в их трансмембранном домене, как показано на рисунке 3. Компания Pfizer разработала препарат maraviroc — аллостерический антагонист CCR5, уже использующийся при лечении ВИЧ [22], [23].
Еще один препарат — антагонист рецептора CXCR4 plerixafor (Genzyme), который изначально планировали использовать для лечения ВИЧ, — нашел применение в лечении некоторых видов лимфом, в том числе неходжкинской лимфомы. Несколько лекарственных препаратов — аллостерических регуляторов хемокиновых рецепторов — проходят разные этапы клинических испытаний. Здесь можно выделить ряд наиболее успешных направлений. Например, такие регуляторы найдены для хемокиновых рецепторов 1 и 2 типов (CXCR1 и CXCR2), которые активируются интерлейкином-8. Рецепторы CXCR1 и CXCR2 играют важную роль в развитии иммунного ответа, острых и хронических воспалительных процессах, в онкологических и аутоиммунных патологиях. Препарат репариксин (reparixin) ингибирует взаимодействие хемокиновых рецепторов 1 и 2 типов с интерлейкином-8. Это свойство репариксина нашло применение в лечении онкологических заболеваний, при которых препарат предотвращает метастазирование опухолей. Также показан эффект репариксина в качестве препарата, предотвращающего отторжение тканей при трансплантологии. Еще один аллостерический регулятор (с активностью NAM) рецепторов CXCR1 и CXCR2 — препарат ladarixin. Сейчас изучается его способность защищать инсулин-продуцирующие β-клетки поджелудочной железы от разрушающего действия аутоиммунных процессов, что очень важно при лечении некоторых форм диабета [24], [25].
Разрабатывают аллостерические регуляторы и для рецепторов гликопротеиновых гипофизарных гормонов. Гормоны, секретируемые передней долей гипофиза, регулируют эндокринную функцию многих желез внутренней секреции. Тиреотропный гормон (ТТГ) регулирует работу щитовидной железы, лютеинизирующий гормон (ЛГ) стимулирует синтез мужских и женских половых гормонов в семенниках и яичниках, а фолликулостимулирующий гормон (ФСГ) управляет процессами сперматогенеза и овогенеза. Но, несмотря на такие далекие друг от друга мишени действия этих гормонов, все они представляют собой огромные белковые молекулы, которые не могут просто так проникнуть в трансмембранный домен рецептора. Для связывания таких лигандов их рецепторы «отрастили» специальный эктодомен, взаимодействие с которым приводит к активации рецептора. С рецепторами ТТГ, ФСГ и ЛГ связан ряд серьезных патологий, поэтому поиск и совершенствование подходов для регуляции этих рецепторов до сих пор остается актуальным [26]. Рецепторы гликопротеиновых гормонов также имеют свои аллостерические сайты, которые расположены в трансмембранном канале, как показано на рисунке 3.
Рецепторы ЛГ и ФСГ играют важную роль в репродуктивных технологиях, таких как экстракорпоральное оплодотворение [27], где с помощью высоких доз гонадотропных гормонов воздействуют на рецепторы ЛГ и ФСГ и запускают процессы овогенеза. Но перечисленные гормоны имеют ряд побочных эффектов, в том числе синдром гиперстимуляции яичников. Таким образом, в случае рецепторов ЛГ и ФСГ, активно идет поиск аллостерических агонистов, которые могут повысить уровень половых гормонов и наладить процессы гаметогенеза. Аллостерические сайты рецепторов ЛГ и ФСГ расположены в трансмембранном домене, а значит, связываться с ним могут только низкомолекулярные вещества, активирующие рецептор без конкуренции с гормонами за ортостерический сайт [16].
Наибольшие успехи в этой области связаны с поиском низкомолекулярных аллостерических агонистов рецептора ЛГ. Еще в 2002 году открыли класс веществ — производных тиенопиримидина, способных стимулировать созревание фолликула у самок мышей [28]. Обладая способностью активировать рецептор ЛГ, тиенопиримидиновые производные были лишены присущих гонадотропинам побочных эффектов: снижения чувствительности стероидогенных тканей к эндогенным гонадотропинам, развития иммунного ответа, гиперторофии и гиперваскуляризации мужских и женских гамет. И что самое приятное, эти соединения оказались активны при пероральном введении животным, что дало им еще одно преимущество над гонадотропинами [29]. В последние годы ряд тиенопиримидиновых производных проходит разные фазы клинических испытаний как индукторы овуляции у женщин. В то же время, в лаборатории молекулярной эндокринологии и нейрохимии ИЭФБ РАН в Санкт-Петербурге, где я работаю над своей кандидатской диссертацией, уже несколько лет идет исследование биологической активности отечественных аналогов тиенопиримидиновых производных, способных корректировать нарушение синтеза и секреции тестостерона у самцов при различных гормональных нарушениях.
Что касается еще одного рецептора гипофизарных гормонов, а именно рецептора ТТГ, все усилия исследователей, наоборот, сосредоточены на поиске антагонистов и обратных агонистов рецептора ТТГ, которые могли бы помочь при таких патологиях, как болезнь Грейвса [30] и тиреотоксический зоб. Дело в том, что рецептор ТТГ обладает постоянной базальной активностью, а связывание с ТТГ приводит к еще большей его активации. В случае болезни Грейвса и других аутоиммунных заболеваний, антитела атакуют рецептор ТТГ, вызывая его гиперактивацию, поэтому очень важно найти способ снизить его активность до базального уровня. Как и в случае рецепторов ФСГ и ЛГ, аллостерический сайт рецептора ТТГ расположен в трансмембранной области. Был разработан ряд веществ, способных подавлять активность рецептора ТТГ, но наиболее интересными свойствами обладали соединения NCGC00242595 и NCGC00242364. Это обратные агонисты, то есть они занимают аллостерический сайт рецептора ТТГ и снижают его базальную активность. Аллостерические антагонисты, в отличие от обратных агонистов, блокируют возможность как активировать рецептор, так и ингибировать его другими молекулами. Таким образом, с одной стороны, эти вещества предотвращают активацию рецептора антителами и развитие гипертиреоза, а с другой — сохраняют базальную активность рецептора, предотвращая развитие гипотиреоза [31]. Поэтому, в зависимости от патологии, обойма препаратов, обладающих такими разными свойствами, позволит клиницистам подбирать медикамент для конкретного вида гипертиреоза с учетом сопутствующих заболеваний человека. Остается надеяться, что подобные разработки будут успешно доведены до своего логического завершения, и мы получим эффективные препараты для лечения гипертиреозов.
Еще одно важное преимущество аллостерических регуляторов GPCR заключено в их химической природе. Их маленький размер позволяет избегать побочных эффектов, присущих крупным гликопротеиновым гормонам, но при этом не лишает их эффективности.
Помимо указанных рецепторов хемокинов и гипофизарных гормонов, для множества других рецепторов ведется успешный поиск аллостерических регуляторов. Среди этих GPCR каннабиноидные, опиоидные, серотониновые, дофаминовые и глутаматные рецепторы.
Несмотря на то, что исследование аллостерических регуляторов перспективно и приведет к появлению множества эффективных, специфичных, современных лекарственных препаратов, необходимо упомянуть о тех проблемах, с которыми сталкиваются исследователи. Процесс разработки многих современных препаратов начинается с драг-дизайна [32]. Для этого используют разные современные методы, такие как молекулярное моделирование [33], [34] и докинг [32]. Далее прототипы соединений проходят несколько этапов оптимизации. А затем несколько наиболее эффективных прототипов подвергаются исследованию биологической активности на клеточных линиях и на животных. Иногда те препараты, которые были эффективны на клеточных культурах, не работают при исследовании на животных. Причина этого не всегда понятна. Возможно, некоторые препараты метаболизируются и теряют свою активность, или связываются белками плазмы крови, или клетки-мишени этих веществ просто отличаются от таковых в клеточных линиях.
Другие препараты оказываются токсичными для организма или проявляют иные побочные эффекты. Только после подробного анализа влияния веществ-кандидатов на животных нескольких биологических видов, наиболее активные вещества отправляют на стадию клинических испытаний [34]. Поэтому неудивительно, что зачастую с момента первых публикаций об эффектах тех или иных препаратов до начала клинических исследований проходят многие годы. А с учетом клинических исследований, время появления нового лекарства в аптеке может измеряться десятилетиями. Поэтому появление на рынке хотя бы одного препарата требует много времени и усилий множества людей самых разных специальностей. Кстати, не так давно на «Биомолекуле» вышел спецпроект «Клинические исследования». В статьях проекта освещается научная, техническая и финансовая стороны вывода на рынок новых лекарственных препаратов.
Заключение
Итак, разработка аллостерических регуляторов рецепторов GPCR позволяет надеяться на появление нового поколения лекарств с минимальными побочными эффектами. Более того, раскрыты такие свойства аллостерических регуляторов, которые открывают новые возможности для фармакологии. Я еще раз кратко назову их.
- Направленное действие на определенные подтипы рецепторов (селективность).
- Возможность совместного действия аллостерических регуляторов с ортостерическим лигандом, поскольку они не конкурируют за сайт связывания.
- Способность аллостерических регуляторов усиливать или ослаблять действие ортостерических лигандов.
Помимо препаратов на основе малых молекул, сейчас активно развиваются препараты второго поколения (в том числе высокоспецифичные антитела), а самая передовая терапия базируется, как правило, на генетических технологиях [35].
Как показывают приведенные примеры, аллостерические регуляторы GPCR обладают очень широким спектром применения. Все эти новые данные дают надежду на то, что, несмотря на сложности, с которыми сталкиваются исследователи, в конце концов, ХХI век ознаменуется новыми достижениями в этой области фармакологии... И кто знает, какие еще секреты хранят в себе рецепторы GPCR, и что нам предстоит узнать в будущем?
Литература
- Таргетная терапия — прицельный удар по болезни;
- Как происходит выделение нейромедиатора;
- Дофаминовые болезни;
- Серотониновые сети;
- Молекула здравого ума;
- Спокоен как GABA;
- Eric A. Wold, Jianping Chen, Kathryn A. Cunningham, Jia Zhou. (2019). Allosteric Modulation of Class A GPCRs: Targets, Agents, and Emerging Concepts. J. Med. Chem.. 62, 88-127;
- Зрительный родопсин — рецептор, реагирующий на свет;
- Нобелевская премия по химии (2012): за рецепторы наших первого, третьего и четвертого чувств;
- Структуры рецепторов GPCR «в копилку»;
- Воздействие на апелинергическую систему как перспективное направление биофармацевтики;
- Рецепторы в активной форме;
- Piero Barbanti, C. Aurilia, G. Egeo, L. Fofi, R. Palmirotta. (2017). Serotonin receptor targeted therapy for migraine treatment: an overview of drugs in phase I and II clinical development. Expert Opinion on Investigational Drugs. 26, 269-277;
- Nicholas M. Barnes, Trevor Sharp. (1999). A review of central 5-HT receptors and their function. Neuropharmacology. 38, 1083-1152;
- P. Jeffrey Conn, Arthur Christopoulos, Craig W. Lindsley. (2009). Allosteric modulators of GPCRs: a novel approach for the treatment of CNS disorders. Nat Rev Drug Discov. 8, 41-54;
- Alexander O. Shpakov, Kira V. Derkach, Andrey A. Bakhtyukov, Dmitry V. Dar’in. (2019). The Low-Molecular-Weight Ligands of the Gonadotropin Receptors as the New Generation of the Regulators of the Reproductive Functions and Steroidogenesis. Innovations In Assisted Reproduction Technology [Working Title];
- Arthur Christopoulos, Jean-Pierre Changeux, William A. Catterall, Doriano Fabbro, Thomas P. Burris, et. al.. (2014). International Union of Basic and Clinical Pharmacology. XC. Multisite Pharmacology: Recommendations for the Nomenclature of Receptor Allosterism and Allosteric Ligands. Pharmacol Rev. 66, 918-947;
- А. А. Бахтюков, А. О. Шпаков. (2019). Низкомолекулярные аллостерические регуляторы G-белок-сопряженных рецепторов полипептидных гормонов. Рос. физиол. журн. им. И.М. Сеченова. 105, 269-283;
- Иммунитет: борьба с чужими и… своими;
- СПИД: как ВИЧ разрушает нашу иммунную систему;
- Связанные одной лентой;
- Carlo Giaquinto, Muthuhadini Patience Mawela, Kulkanya Chokephaibulkit, Marinella Della Negra, Ismail Haroon Mitha, et. al.. (2018). Pharmacokinetics, Safety and Efficacy of Maraviroc in Treatment-experienced Pediatric Patients Infected With CCR5-Tropic HIV-1. The Pediatric Infectious Disease Journal. 37, 459-465;
- Q. Tan, Y. Zhu, J. Li, Z. Chen, G. W. Han, et. al.. (2013). Structure of the CCR5 Chemokine Receptor-HIV Entry Inhibitor Maraviroc Complex. Science. 341, 1387-1390;
- Сахарный диабет I типа, или Охота на поджелудочную железу;
- Marcello Allegretti, Maria Candida Cesta, Massimo Locati. (2016). Allosteric Modulation of Chemoattractant Receptors. Front. Immunol.. 7;
- Selvaraj G. Nataraja, Henry N. Yu, Stephen S. Palmer. (2015). Discovery and Development of Small Molecule Allosteric Modulators of Glycoprotein Hormone Receptors. Front. Endocrinol.. 6;
- «За экстракорпоральное оплодотворение» — это не тост, а Нобелевская премия!;
- N. C. R. van Straten, G. G. Schoonus-Gerritsma, R. G. van Someren, J. Draaijer, A. E. P. Adang, et. al.. (2002). The First Orally Active Low Molecular Weight Agonists for the LH Receptor: Thienopyr(im)idines with Therapeutic Potential for Ovulation Induction. ChemBioChem. 3, 1023-1026;
- R. van de Lagemaat, C.M. Timmers, J. Kelder, C. van Koppen, S. Mosselman, R.G.J.M. Hanssen. (2008). Induction of ovulation by a potent, orally active, low molecular weight agonist (Org 43553) of the luteinizing hormone receptor. Human Reproduction. 24, 640-648;
- Один день из жизни Грейвса;
- Susanne Neumann, Eshel A. Nir, Elena Eliseeva, Wenwei Huang, Juan Marugan, et. al.. (2014). A Selective TSH Receptor Antagonist Inhibits Stimulation of Thyroid Function in Female Mice. Endocrinology. 155, 310-314;
- Виртуальные тропы реальных лекарств;
- 12 методов в картинках: «сухая» биология;
- Драг-дизайн: как в современном мире создаются новые лекарства;
- Три поколения лекарств;
- Emma T. van der Westhuizen, Celine Valant, Patrick M. Sexton, Arthur Christopoulos. (2015). Endogenous Allosteric Modulators of G Protein–Coupled Receptors. J Pharmacol Exp Ther. 353, 246-260.