
Горячая линия: новый способ общения с клетками
25 июля 2025
Горячая линия: новый способ общения с клетками
- 1074
- 0
- 9
Наночастицы алмаза позволяют локально измерять и контролировать температуру клетки.
Рисунок в оригинальном разрешении.
иллюстрация Александры Мартыновой
-
Автор
-
Редакторы
-
Иллюстратор
Со стороны может показаться, что температура в клетке — лишь еще одно подтверждение того, что живая система функционирует, и внутри нее все стабильно и тихо. Однако это не так — на микроуровне температура способна тонко управлять делами клетки: изменять структуру белков, запускать сигнальные каскады и даже активировать экспрессию генов. И теперь у нас появилась возможность установить с клеткой настоящую «горячую линию»: тонкую, но реальную связь, посредством которой мы можем «слушать», задавать вопросы и даже получать ответы. Ученые разработали инструмент, способный не только измерять крошечные температурные изменения, но и прицельно нагревать отдельные участки клетки — и все это с точностью до долей градуса. Речь идет о наночастицах алмаза, содержащих особые атомные центры в структуре, которые одновременно служат термометром и локальным нагревателем. Благодаря уникальным оптическим свойствам таких центров можно отслеживать температуру прямо в живой клетке и управлять ею в отдельных компартментах при помощи лазера. Эта разработка открывает путь к новой форме клеточной коммуникации — и вправду «горячим» разговорам с клеткой.
Ультрасовременные методы
Методы, которыми оперирует современная наука, постоянно совершенствуются. Некоторые области развиваются настолько стремительно, что порой даже специалистам сложно уследить за новейшими приборами и модификациями методик. Так происходит, например, в геномике. Другие же области (такие как гистология и связанные с ней световая и флуоресцентная микроскопия) развиваются куда медленнее, но всё равно расширяются и обзаводятся более высокопроизводительными методами. В статьях нового спецпроекта (он продолжает наш хит — «12 биологических методов в картинках») мы хотим рассказать, какие методы помогают ученым совершать новые открытия сегодня, и чего нам ждать в будущем.

Партнер этой статьи — компания «Вандер Технолоджис»
Почему жизнь теплая?
Когда мы обращаем взгляд в ночное небо, космос видится нам бескрайним, холодным, а еще очень пустым пространством. Все потому, что та жизнь, которую мы знаем — вещь довольно хрупкая, и во Вселенной она далеко не везде может найти для себя теплый уголок [1]. Да-да, именно теплый. Ни ледяные астероиды, ни раскаленные звезды привычным нам формам жизни не подходят. Земная жизнь, если оценивать глобально, вообще может существовать в очень узком диапазоне температур. И большинство ее форм тянутся к тому самому теплу.
Нам это кажется вполне логичным и не вызывает никаких противоречий. Но почему у животных и температуры такие «теплые» отношения? Как температура помогает нам жить и можно ли, изменяя ее, переиначить работу наших клеток? Обо всем этом и будет идти речь в этой статье.
Пределы жизни
Существование любого организма требует энергии, а энергия в биологии неизбежно связана с теплом. Возьмем хотя бы обмен веществ — по сути это постоянное преобразование энергии, часть которой расходуется на работу, а остаток рассеивается в виде тепла. Поэтому жизнь обычно теплая — тепло является побочным продуктом и одновременно условием жизни.
Если же говорить о том тепле, которое нас окружает, то оно тоже имеет большое значение. Животные, растения, бактерии и другие формы жизни приспособились существовать при определенной температуре. Большинство из них комфортно себя чувствуют в пределах от +20 до +45 oC [2]. При более низких температурах вещества в их клетках реагируют вяло, мембраны теряют подвижность, трескаются и даже бьются, клетки «засыпают»; а при совсем высоких — органические молекулы, в первую очередь белки, разрушаются (рис. 1). Получается, что температура — это один из ключевых факторов, определяющих, где жизнь возможна, а где нет, и какая именно [3]. Но строгих правил, конечно же, нет!
Возьмем для примера холод. Если бактерию кинуть в снег, все реакции в клетке практически остановятся. Для одних организмов это не смертельно, а для других — еще как. Большинство млекопитающих при охлаждении тела ниже +25..+30 oC впадают в бессознательное состояние, когда метаболизм уже не поддерживает нормальную работу мозга. У человека гипотермия ниже ~35 oC вызывает сонливость, а при +30 oC наступает потеря сознания, сердечный ритм и дыхание замедляются. Да, некоторые животные могут переждать такие условия, и вы даже знаете примеры — это спячка у медведя, ежа или летучей мыши. Но всему есть предел. Если холод слишком сильный, вода, которая обычно составляет более 70% массы клетки, может превратиться в лед и просто разорвет ее изнутри [4]. Тем более удивительно, что некоторых судьба завела и в такие условия. Например, арктические рыбы спокойно живут в воде, охлажденной до −2 oC [5], благодаря «антифризным» белкам в крови [6], [7]. А ведь есть еще и бактерии, функционирующие в рассолах при −20 oC [3], и тихоходки [8], способные пережить понижение температуры почти до абсолютного нуля, впадая в анабиоз [9], [10]. Вечная мерзлота — не преграда и для некоторых других животных, например, коловраток и нематод [11]. [12]. Случается, справляются с ней и семена растений. И всё же это скорее исключения, чем правило. Тепло для жизни остается гораздо более предпочтительным, чем холод.
При этом обратная крайность — то есть сильный нагрев — тоже не приветствуется. Если вместо пакетика чая в стакан с кипятком бросить ту же бактерию, все ее белки денатурируют (то есть свернутся как вареное яйцо), а мембраны и ДНК расплавятся [13]. Для человека опасной считается температура тела выше +41 oC. После преодоления этого порога начинается тепловой удар, ферменты перестают нормально работать, могут возникать судороги, повреждается мозг. Поэтому любое недомогание при работе на жаре — дело серьезное. Но природа удивительна, и, раз она создала организмы, устойчивые к заморозке, должны быть и те, которым не страшно кипячение. Их называют экстремофилы [14], [15]. Например, некоторые археи растут при +100–110 oC в горячих источниках. А абсолютный рекорд принадлежит метаногену Methanopyrus kandleri, способному размножаться при 122 oC (правда, под высоким давлением, чтобы не вскипела вода) [16].
Тем не менее, умеренное тепло для жизни в подавляющем большинстве куда лучше, чем слишком сильные жара или холод (рис. 1).
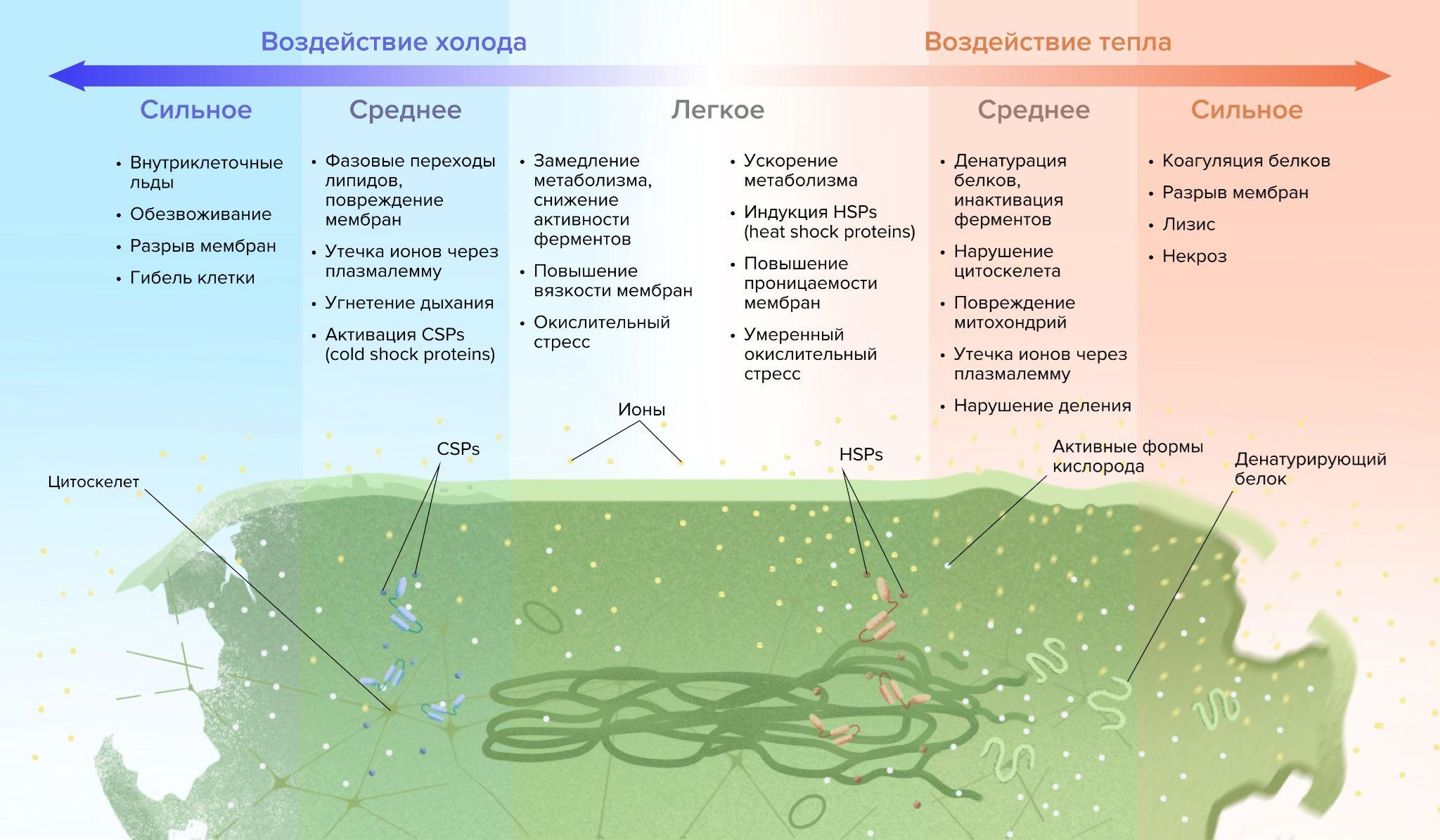
Рисунок 1. Процессы, происходящие в клетке под воздействием холода и тепла (слева направо — повышение температуры). В зависимости от выбранного температурного диапазона клетка будет испытывать разные последствия, которые могут проявляться на физическом (например, скорость диффузии молекул), химическом (скорость химических реакций) или генетическом (экспрессия белков теплового шока) уровне.
иллюстрация Александры Мартыновой
Температурный гомеостаз и теплокровность
Как мы с вами убедились, температура окружающей среды оказывает сильное влияние на внутреннюю температуру живого организма и влечет различные последствия. Но чтобы не зависеть от окружающей среды полностью, природой предусмотрен гомеостаз — поддержание постоянных условий внутри организма. Мы с вами, как и другие млекопитающие, теплокровны, то есть способны поддерживать внутренние ~37 oC независимо от погоды. Птицы вообще разогреваются до ~40 oC и стабильно держат эту планку [17]. Но опять же — зачем? Оказывается, в теплом состоянии ферменты работают на пике эффективности, мышцы сокращаются быстрее, нервные импульсы бегут стремительнее [18–20]. Теплокровный зверек может бегать и охотиться даже холодной ночью, тогда как земноводное или рептилии в это время могут только спать. Но другая сторона медали, конечно же, есть, и заключается она в большом расходе энергии на этот обогрев. Мы, словно печки, постоянно топим пищей свой организм, чтобы не остыть.
Собственно, поэтому механизмы гомеостаза до остроты отточены эволюцией. Есть терморегуляционные центры в мозге, которые при отклонении температуры включают разные механизмы защиты: дрожь, сужение или расширение сосудов, потоотделение. В итоге температура ядра тела колеблется в узком диапазоне — примерно ±0,5 oC от нормы [21]. Кроме физиологической терморегуляции есть и поведенческая: все мы под палящим солнцем непроизвольно ищем тень, а после бассейна греемся на солнце.
Биотермодинамика в двух словах
Почему же всё живое так чувствительно к теплу? Как всегда, всё сводится к биохимии. Еще в конце XIX века шведский ученый Сванте Аррениус вывел уравнение [20], описывающее, как скорость химической реакции растет с повышением температуры (рис. 3). Попросту говоря — чем теплее, тем чаще молекулы сталкиваются и преодолевают энергетический барьер реакции. Голландец Якоб Вант-Гофф добавил наглядное правило: температурный коэффициент, иллюстрирующий отношение новой скорости реакций к изначальной. Многие биохимические процессы при повышении температуры на 10 oC идут примерно в 2–3 раза быстрее. Например, если фермент разлагает субстрат при +30 ℃ за 1 секунду, то при +40 oC — уже за полсекунды. Конечно, бесконечно это продолжаться не может — при слишком высоких температурах ферменты сами разваливаются. Для каждого фермента есть оптимум, обычно близкий к нормальной температуре организма.

Рисунок 3. Влияние температуры на химическую реакцию. Слева изображено уравнение Аррениуса, которое описывает температурную зависимость скорости химической реакции, справа — температурная зависимость константы равновесия, выраженная в виде правила Вант-Гоффа.
иллюстрация Александры Мартыновой, вдохновленная кадром из к/ф «Матрица»
Но биотермодинамика — это не только ферменты. Помимо скорости, температура влияет и на равновесие реакций, на проницаемость мембран и на растворимость газов. Даже структура ДНК зависит от температуры: при нагреве двойная спираль расплетается, а при охлаждении снова сплетается. Иными словами, температура регулирует направление и скорость биохимических процессов [22].
Источники энергии в клетке
Откуда же берется тепло в организме? Это побочный продукт метаболизма, который в основном работает благодаря митохондриям. Митохондрия поглощает продукты расщепления пищи (например, пируват из гликолиза, жирные кислоты) и через серию окислительных реакций с участием того самого кислорода, который мы добываем из воздуха, синтезирует АТФ — «универсальную энергетическую валюту клетки». Однако ни один энерготрансфер не проходит со 100%-эффективностью, и митохондрия, подобно тепловому двигателю, выделяет часть энергии в виде тепла [23].
Мы подробно рассмотрели биоэнергетику митохондрий вот в этой статье [24].
Любые другие энергетические реакции в клетке тоже не идеальны и рассеивают значительную долю энергии в тепло. Например, распад глюкозы в процессе гликолиза. Гликолиз менее эффективен, чем дыхание в митохондриях, и, соответственно, выделяет больше тепла. Для наглядности можно вспомнить так называемый эффект Варбурга [25] — в быстро растущих раковых клетках преобладает быстрый гликолиз, и они выделяют больше тепла, чем обычные клетки. Эта закономерность даже используется в медицинской термографии: опухоли часто немного теплее окружающих тканей, что позволяет легче их детектировать (рис. 4) [26], [27].
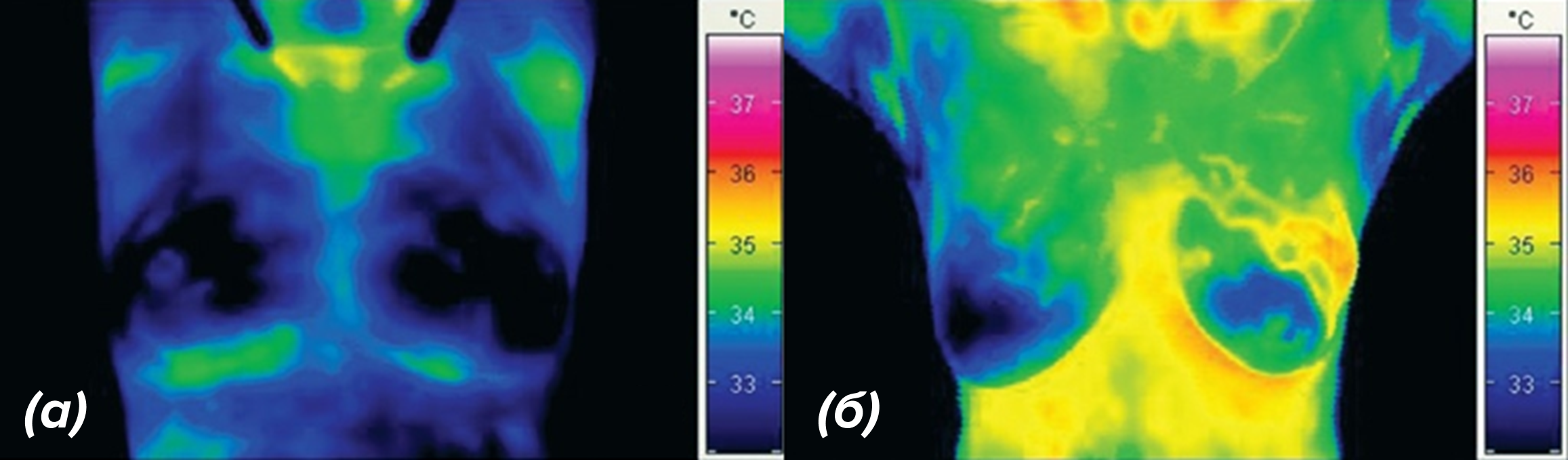
Рисунок 4. Термограммы молочной железы, полученные с помощью тепловой инфракрасной камеры (диапазон температур: 32–38 oC). (а) — нормальная грудь; (б) — патологические изменения.
Теплокровные животные, хоть и обладают интенсивным метаболизмом, но также делают ставку и на мышцы — вспомните, например, свою дрожь на холоде. Каждое сокращение мышцы выделяет тепло, появляющееся вследствие гидролиза АТФ [28]. Даже работа мозга с его десятками миллиардов нейронов ведет к выделению значительного количества тепла. Мозг, несмотря на то что составляет лишь ~2% массы тела, потребляет ~20% энергии покоя, поэтому не удивительно, что он заметно греется . Средняя температура глубинных отделов мозга человека приближена к 38–39 oC, что чуть выше температуры тела в целом [29]. Поэтому такая «эффективная неэффективность» внутренних процессов в клетке и огромные энергозатраты органов позволяют нам не зависеть от температуры на улице и быть продуктивными даже в самый холодный зимний вечер.
Но кстати не так уж сильно, если прикинуть его «вычислительную мощность». Электронные компьютеры при том же числе искусственных нейронов в ИИ-нейросети, что и в мозге человека, и при том же числе операций в секунду на сегодняшний день оказались бы в 1 000–10 000 раз менее энергоэффективны, чем старый добрый человеческий мозг.
Энергия «на потом»
Живые клетки умеют не только тратить, но и запасать энергию. В физике мы привыкли, что энергию можно запасать: например, поднимая груз или заряжая аккумулятор. В клетке тоже есть аккумуляторы энергии — рассмотрим их основные формы.
Во-первых, это ионные градиенты на мембранах, поддерживаемые любой клеткой и предшествующие другим формам запасания энергии (рис. 5). Клеточная мембрана и мембраны органелл работают как конденсаторы, разделяя заряды, например в виде катионов водорода (H+), как это делает митохондрия. В результате на мембране возникает электрохимический градиент: с одной стороны избыток протонов, с другой — их недостаток. Система работает как натянутая пружина. Стремясь вернуться, протоны проходят через специальный канал в белке АТФ-синтазе, напоминающем генератор гидроэлектростанции, и синтезируют АТФ, про которую речь пойдет дальше. Нервные клетки создают Na+/K+-градиент, лежащий в основе передачи нервного импульса [30]. Когда градиент разряжается и через мембрану устремляются ионные токи, часть энергии тоже рассеивается в тепло. Кстати, работа ионных насосов (Na+/K+- или кальциевых АТФаз) тоже выделяет тепло, подобно работающему двигателю [31]. То есть, восстанавливая ионные градиенты, клетка тоже греется.
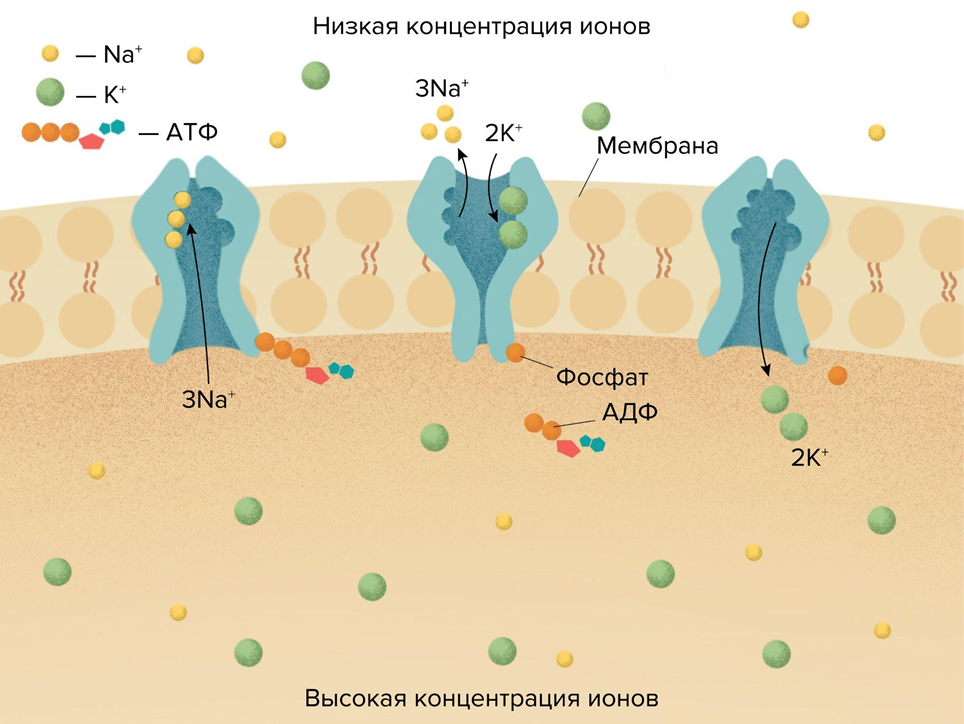
Рисунок 5. Создание ионного градиента на цитоплазматической мембране клетки. Этот градиент создается Na+/K+-АТФазой, которая активно переносит ионы K+ внутрь клетки, а Na+ — наружу, как бы обменивая их друг на друга; с затратой АТФ. На каждую молекулу АТФ транспортируется два иона калия и три иона натрия.
иллюстрация Александры Мартыновой
Во-вторых, это химические связи высокоэнергетических молекул. Классический пример — АТФ (рис. 6), в связях между фосфатами которой хранится энергия, превышающая энергетический порог почти любых реакций анаболизма. АТФ расщепляется до АДФ и остатка ортофосфорной кислоты, высвободившаяся энергия идет на реакцию, а остаток превращается в тепло. Этот принцип в химии называется сопряжением — процесс передачи энергии от одной реакции (например, расщепления АТФ) передается для другой (синтеза). Другие макроэргические соединения — ГТФ (гуанозинтрифосфат), креатинфосфат, ацилфосфаты — работают аналогичным образом.
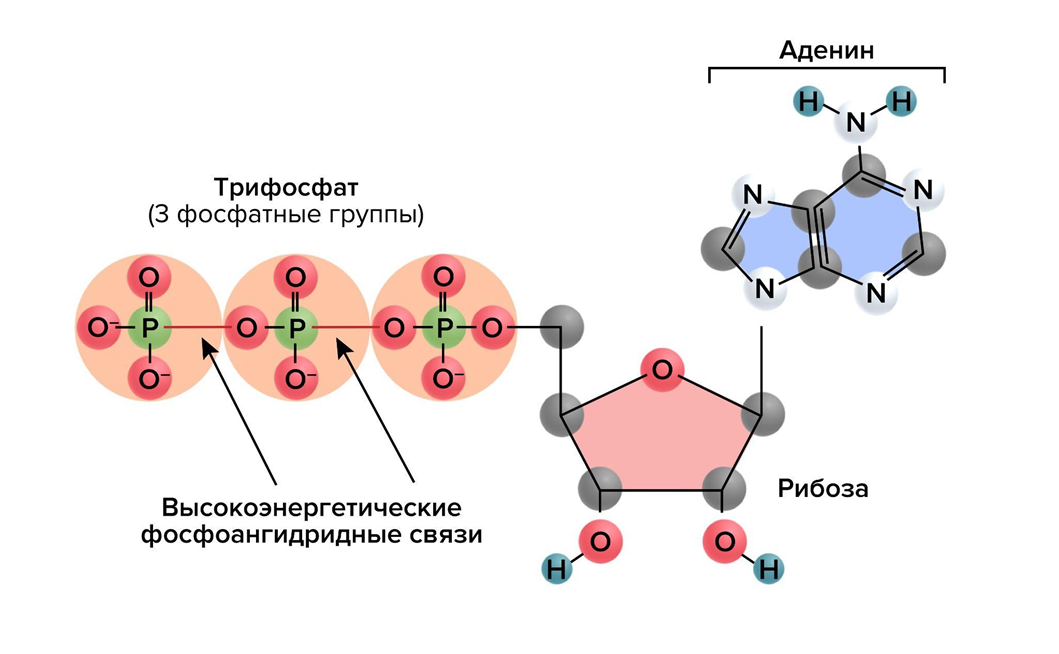
Рисунок 6. Структура АТФ (аденозинтрифосфорной кислоты) — главной макроэргической молекулы в клетке. АТФ состоит из аденозина и трех связанных в цепочку фосфатных групп, каждая из которых несет отрицательный заряд, создающий сильное электростатическое отталкивание, словно у сжатой пружины. При гидролизе фосфата «стопор» снимается, запасенная энергия высвобождается и может быть направлена на работу внутри клетки (чаще всего, химическую).
иллюстрация Александры Мартыновой
Но даже при наличии всех этих механизмов теплообразования и энергообмена возникает один важный вопрос: откуда клетка берет энергию, если АТФ постоянно расходуется? Проблема в том, что АТФ — это не «батарейка», а скорее «стимулятор». Ее молекулы живут всего несколько секунд и не запасаются надолго. По данным BiоNumbers, ежедневный оборот АТФ соответствует массе тела — при том, что в каждый момент времени ее содержится в теле не более 250 граммов [32]. Клетка непрерывно производит и использует АТФ по мере необходимости.
Именно поэтому живым существам нужны долгосрочные энергетические резервы. Это третий тип внутриклеточной энергии: химически связанная энергия веществ, таких как жиры, глюкоза и гликоген. Глюкоза — универсальное топливо, но она растворима и быстро расходуется. Поэтому в клетках печени и мышц глюкоза запасается в виде гликогена — плотной, нерастворимой макромолекулы, из которой при необходимости можно быстро высвободить глюкозу. У растений эту роль выполняет крахмал, у бактерий — гликогеновые гранулы, ассоциированные с карбоксисомами (рис. 7) [33].
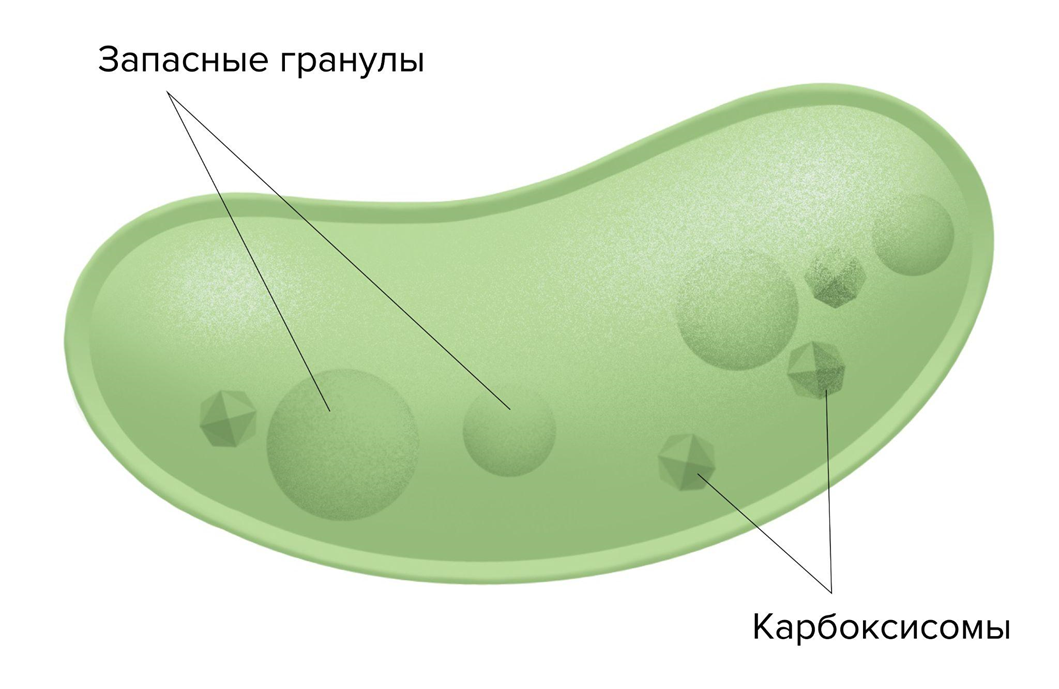
Рисунок 7. Запасные гранулы гликогена в фотосинтезирующей клетке бактерии. Карбоксисомы — бактериальные органоиды, представляющие из себя небольшие белковые тельца. Они содержат ферменты для фиксации углерода в виде молекул CO2. Синтезирующиеся моносахариды переводятся в форму запасных веществ, в первую очередь гликогена, который образует гранулы неподалеку.
иллюстрация Александры Мартыновой
Почему измерять температуру клетки сложно
Раз мы поняли, как важна температура для жизни и откуда она берется, возникает вопрос: «А какая она прямо внутри клетки?» Казалось бы, температура — вещь «глобальная», в таком малом объеме она должна мгновенно выравниваться с окружением. Долгое время так и думали: внутри клетки везде одинаковые +37 oC. Но ученых не оставляла идея: а вдруг там есть «горячие точки» — микрообласти, где идет интенсивная реакция, и температура на доли градуса выше? Ведь клетка неоднородна, и органоиды работают с разной интенсивностью в связи с разными функциями. Митохондрии синтезируют АТФ и часто работают сверхурочно, а липидные капли на мембране эндоплазматического ретикулума (ЭПР) отдыхают и ждут своего включения в синтетические пути. Проверить это долгое время не представлялось возможным — не было инструментов, и вот почему.
- Во-первых, размер. Термометр даже в виде микрозонда всё равно будет огромен по сравнению с клеткой и, касаясь ее, либо измерит свою собственную температуру, либо убьет клетку.
- Во-вторых, есть проблема масштаба времени. Температура — понятие равновесное. Чтобы говорить о температуре в точке, нужно, чтобы молекулы успели обменяться энергией между собой и достигнуть локального термодинамического равновесия. Клетка маленькая, но не бесконечно: при типичном размере ~10 мкм внутри нее температура выравнивается за микроскопические доли секунды (порядка 10−5 с). То есть локальное равновесие устанавливается очень быстро, и в принципе имеет смысл говорить о локальной температуре. Однако если одновременно происходят быстрые процессы (например, реакция бурно выделяет тепло), могут возникать микроградиенты на очень короткое время. Поймать их — технический вызов.
- Ну и в-третьих, амплитуда ожидаемо мала. Если митохондрия выделяет тепло, оно быстро уходит в виде кинетической энергии молекул в окружающую цитоплазму и затем — по всему объему клетки наружу. Расчеты показывают, что самостоятельно одна клетка не может сильно нагреть себя — слишком уж велика теплоемкость воды и быстро охлаждение. Критики идеи «горячих точек» утверждали, что прирост будет ничтожным (тысячные доли градуса) [34]. Однако прямых экспериментальных данных не было, шли споры теоретиков и экспериментаторов [31]. Для науки это классическая ситуация. Новое направление рождает дискуссии, пока не появятся надежные методы измерения.
А жарко ли митохондрии?
Другой вопрос — зачем вообще знать температуру внутри клетки с такой точностью? Ответ: чтобы понять, есть ли у клетки собственная терморегуляция на микроуровне, и влияет ли локальная температура на сигнальные процессы. Существует гипотеза «термического сигнала», которая гласит, что клетки умеют использовать локальные всплески тепла как сигнал, запускающий определенные реакции. Например, локальный нагрев около митохондрий может ускорять определенные ферментативные пути или высвобождать кальций из внутренних депо клетки.
До недавнего времени это были только догадки, но теперь у нас есть и первые экспериментальные данные. Например, в статье от наших соотечественников по новому методу температурного контроля в клетке [31], про который мы поговорим ниже (см. «Наноконтроллеры для мегазадач»), приведены очень интересные данные. При создании теплового градиента вокруг нейронов наблюдалось ускоренное удлинение их отростков, что подтверждает идею о роли тепла как направляющего сигнала для роста нейритов. В мышечных клетках кратковременный нагрев приводил к их сокращению даже без поступления из окружающей среды кальция , указывая на возможность активации внутренних кальциевых резервов под действием температуры. В экспериментах на культуре HeLa-клеток [35] локальное нагревание вызывало значительное повышение концентрации внутриклеточного кальция, который высвобождался, вероятно, через чувствительные к температуре IP3-рецепторы эндоплазматического ретикулума [31].
Кальций в форме Ca2+ необходим не только для мышечного сокращения, но и для самых разнообразных внутриклеточных сигнальных реакций [36].
Всё это дает право фантазировать на тему температурного сигналинга и прямого общения с клеткой. Ведь когда в ответ на локальный нагрев клетка изменяет уровень кальция или ускоряет рост нейритов — это не просто биохимия. Это ответ на сигнал на другом конце провода.
Если же отбросить фундаментальный интерес, есть вполне и практические причины развития этой области. Зная микротемпературу, мы лучше понимаем биоэнергетику: эффективность превращения энергии, долю теплоты. Также, научившись контролировать тепло в клетке, можно разрабатывать новые методы терапии — от избирательного нагрева опухолевых клеток до активации нужных сигнальных путей. Но прежде требуется решить инженерную задачу. Как заглянуть термометром внутрь живой клетки, да еще и не нарушив ее работу?
От термочувствительных белков до квантовых точек
За последние десятилетия ученые придумали несколько хитроумных подходов к внутриклеточной термометрии. Когда биологам нужно сделать что-то экстраординарное, они обращаются к белкам.
Одним из самых распространенных и удобных инструментов для визуализации процессов в живых клетках являются флуоресцентные белки — особые молекулы, которые при освещении возбуждаются и начинают светиться [40]. Они широко используются для изучения клеточной структуры и различных биохимических реакций. Некоторые мутантные формы этих белков оказались чувствительными к температуре и способны менять яркость или даже спектр излучения в зависимости от нагрева. Например, уже давно создан термочувствительный вариант зеленого флуоресцентного белка GFP, яркость которого снижается при повышении температуры. Встроив такой белок в клетку, можно по его свечению непосредственно под микроскопом отслеживать температурные изменения в разных участках цитоплазмы (рис. 8) [22], [41]. Аналогично можно использовать обычные ферменты и по их активности косвенно судить о нагреве, так как скорость катализируемой ими химической реакции будет повышаться, а вместе с ней и выход продукта за единицу времени. Преимущество таких «биологических термометров» — в естественной работе внутри клетки. Недостаток же — в сложности калибровки и зависимости сигнала от других факторов, таких как pH и микроокружение, поэтому вариант достаточно ненадежный.
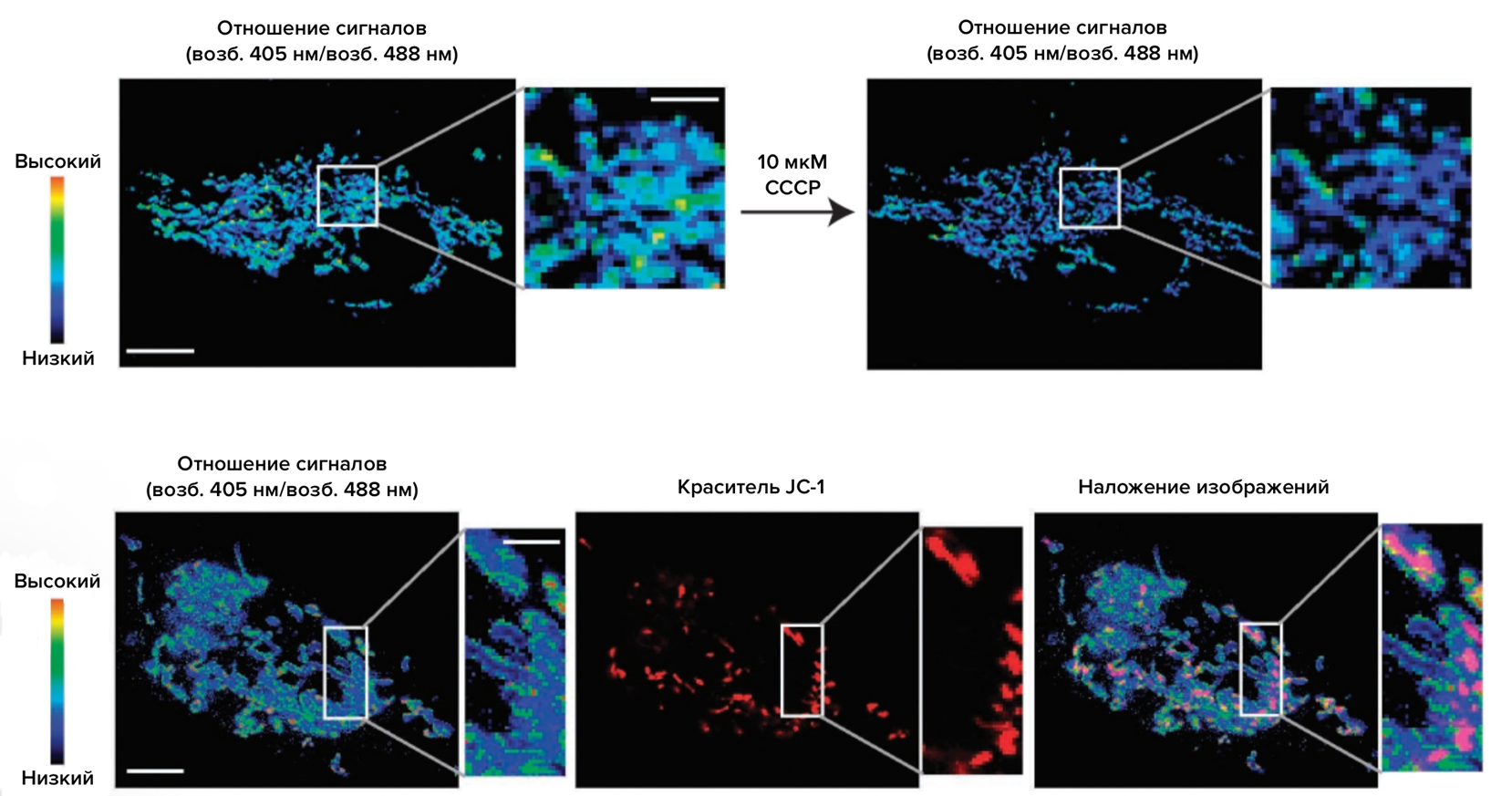
Рисунок 8. Использование флуоресцентного белка tsGFP1-mito для картирования температуры в митохондриях. Сверху: конфокальные изображения отношения флуоресценции tsGFP1-mito до и после обработки клеток HeLa веществом CCCP при 37 oC. Изменения отношения сигналов отражают локальное повышение температуры в митохондриях. Снизу слева — отношение сигналов tsGFP1-mito (индикатор митохондриальной температуры), в центре — флуоресценция красителя JC-1, который служит индикатором мембранного потенциала митохондрий: при высоком потенциале он флуоресцирует красным (агрегаты), при низком — зеленым (мономеры). Справа — наложение обоих каналов. Видна пространственная неоднородность температуры и мембранного потенциала в пределах митохондриальной сети. Масштабные линейки: 10 мкм (основные изображения) и 3–4 мкм (вставки).
CCCP — это не то, что вы подумали, а разобщитель митохондриального дыхания, разрушающий протонный градиент и запускающий тепловыделение.
Для индивидуального исследования подойдет флуоресценция красителей-зондов. Такие молекулы проникают в клетку и излучают свет разной интенсивности или спектра при разных температурах. Один такой термозонд EuTTA [42] излучает свет, который гасится при нагреве. Другой пример — полимерные наногели с флуоресцентными метками, которые при нагревании меняют конфигурацию и спектр излучения. Некоторые коммерческие термозонды позволяют измерять температуру с точностью ~0,5 oC прямо внутри живых клеток [43]. Однако они могут накапливаться неравномерно, влиять на клетку химически и, опять же, перевод флуоресцентного сигнала в градусы — отдельная задача.
Вполне логично предположить, что температуру можно измерять, анализируя тепловое движение молекул. Действительно, этот принцип используется, например, в методе комбинационного рассеяния света (известном как рамановская спектроскопия) измеряют два типа световых сигналов, отраженных от молекул. Их соотношение — стоксового и антистоксового — меняется в зависимости от температуры, поэтому по нему можно судить, насколько нагреты молекулы в клетке. Если навести лазер на небольшую область клетки и снять ее раман-спектр, можно вычислить локальную температуру по этому соотношению. Этот метод не требует введения красителей — используется естественная вибрация молекул клетки. Были работы, где раман-спектроскопией пытались уловить нагрев отдельных органоидов. Минус этого подхода в том, что улавливаемый сигнал крайне слабый, и нужны длительная экспозиция и мощный лазер. Поэтому такая спектроскопия пока привлекательна скорее теоретически.
Наночастицы некоторых материалов также могут служить термометрами. Например, квантовые точки — крошечные кристаллы полупроводника — меняют свою светимость с изменениями температуры. Если ввести их в клетку, то при нагреве они уменьшают интенсивность свечения, что можно зафиксировать микроскопом. В опытах с использованием квантовых точек CdTe удалось достичь чувствительности порядка 0,2 oC [31], [44].
Есть также флуоресцентные нанодатчики на основе оксидов, которые излучают сразу два разных сигнала. При этом важно не их абсолютное свечение, а соотношение между ними — оно зависит только от температуры и не меняется из-за того, сколько зонда оказалось в клетке. Такие нанотермометры были применены для измерений температуры цитоплазмы и даже митохондрий: некоторые работы сообщали, что митохондрии теплее цитоплазмы более чем на 1–2 oC 🔥 [22].
Алмазы с квантовыми центрами —
метод, заслуживающий отдельного внимания. Оказывается, даже алмаз можно заставить измерять температуру. Причем не где-нибудь, а прямо внутри живой клетки — с колебаниями всего в 0,05 Цельсия! Звучит как фантастика, но именно так работают так называемые алмазные наночастицы с квантовыми дефектами. Кстати, перспективу развития этого метода мы уже обозревали в нашей статье от 2015 года, в которой разбирается механизм работы таких приборов [47].
Такие сенсоры не только стабильны, инертны и нетоксичны, но еще и умеют светиться особым образом, позволяя определить температуру по сдвигу их флуоресценции. Впервые их применили в клетках в 2013 году, и с тех пор именно этот подход считается одним из самых перспективных в наноразмерной термометрии. Ни красители, ни белки не дают такой точности и долговечности. Поэтому наноалмазы — это уже не просто экзотика, а вполне рабочий инструмент, заслуживающий особого внимания.
Такие кристаллы состоят из алмаза — упорядоченной кристаллической решетки атомов углерода. Однако решетка не идеальна: в ней присутствуют точечные дефекты с атомом-примесью (обычно азота или кремния) — так называемые цветные центры [48]. Называются они так потому, что флуоресцируют при возбуждении светом. Кроме этого, у такого центра есть неспаренный электрон, квантовое состояние которого зависит от окружения. Измерение в этом случае основано на тепловом расширении решетки алмаза вокруг этого электрона и детектируемом через интенсивность флуоресценции центра изменении его квантовых свойств. Огромный плюс алмазных сенсоров — это их инертность и стабильность. Алмаз нетоксичен, не блекнет, не вступает в реакции. Его флуоресценция не выгорает со временем — в отличие от органических красителей. Поэтому нанокристалл алмаза можно внедрить в клетку и наблюдать за ним сколь угодно долго.
Как мы теперь понимаем, измерения алмазного нанодатчика всегда зависят от степени расширения кристаллической решетки, зависящей от температуры самого кристалла. При хорошем тепловом контакте эта температура равна температуре окружающей среды (клетки). В первых экспериментах требовались калибровка и выдерживание равновесия, чтобы гарантировать, что показания алмаза соответствуют локальной температуре клетки. Иными словами, ограничение ранних нанотермометров состояло в необходимости увериться, что «собственная» температура алмаза отражает температуру клетки. И главное — ранние нанодатчики только измеряли, но не могли локально греть клетку. Современная же наука шагнула гораздо дальше и превратила обычные термометры в полноценные термоконтроллеры.
Возможности и перспективы применения нанотермометров
Теперь, когда у ученых появился инструмент для точечного управления теплом в биосистемах, открывается множество направлений исследований и его потенциальных применений. Перечислим некоторые из самых захватывающих перспектив:
Термогенетика
Если в клетку встроить термочувствительный канал, то с помощью локального нагрева можно включать и выключать активность клетки. Представьте нейрон с термочувствительным каналом. Наведя на него инфракрасный лазер через череп (ткани относительно прозрачны для ИК), мы разогреем на пару градусов именно этот нейрон — канал откроется, и нейрон выстрелит импульсом. Так можно адресно активировать отдельные нейроны или их группы, не затрагивая соседние, что может сыграть важную роль в лечении многих неврологических заболеваний, например, таких как эпилепсия (мы уже писали про патогенез болезни и роль калиевых каналов в ее лечении [49]). Уже есть работы, где инфракрасным микролучом стимулировали нейроны у плодовых мушек. Метод называют FLIRT — Fast Local InfraRed Thermogenetics [50].
Локальная гипертермия в медицине
Идея убивать раковые клетки теплом — совсем не новая. Уже применяются наночастицы железа, которые нагреваются в переменном магнитном поле и точечно «выжигают» опухоль [51]. Но алмазные наночастицы с лазерным нагревом могут придать этому методу небывалую ранее точность. Их плюс — в флуоресценции, то есть мы можем визуализировать их и следить, куда они попали. Однако важнейшим вопросом остается эффективная доставка таких наночастиц именно в опухолевые клетки без задействования здоровых тканей. На сегодня таргетная доставка — одна из наиболее сложных задач в наномедицине, в случае ее успешного решения наночастицы алмаза могли бы обеспечить беспрецедентную точность гипертермии. Более того, вшитый термометр позволит не перегреть лишнего: как только в целевой клетке достигнута нужная температура, лазер отключится автоматически. Это умная гипертермия, управляемая обратной связью по температуре. Пока имеющиеся альтернативы не имеют такого уровня контроля.
Регуляция экспрессии генов теплом
В генетических конструкциях известны промоторы теплового шока — участки ДНК, которые активируют считывание генов при повышении температуры. Это эволюционный механизм: при перегреве клетки с помощью таких промоторов включают защитные белки. Биоинженеры уже используют тепловые промоторы, чтобы искусственно включать нужные гены нагревом клеточной культуры [52]. Но с нанотермометрическими нагревателями можно пойти дальше, а именно, активировать ген в одной клетке или даже в ее части. Например, заставить одну-единственную клетку в ткани вырабатывать лекарственный белок, нагревая именно ее. Это открывает дорогу к точечной генотерапии: включать и выключать гены в заданных местах организма по команде лазера. Такой тонкой пространственной регуляции никакими другими методами не добиться.
Нанотермометры — нейронауке
Мозг — это орган, чувствительный к температуре, и он сам прогрет неоднородно. Недавние исследования показали, что глубокие отделы мозга человека теплее поверхностных, и колебания температуры могут влиять на суточные ритмы и когнитивные функции [53]. С помощью нанотермометрии можно измерять микротемпературу в мозге лабораторных животных. Есть ли локальный нагрев при активной работе нейронов? Можно ли обнаружить мини-перегрев при эпилептическом припадке в очаге? А также — можно ли охладить небольшой участок мозга для терапии? Алмазные наночастицы, введенные в нужную зону и управляемые лазером, — потенциальный способ реализовать тепловую нанохирургию в мозге. Конечно, до практического применения тут далеко, но первые лабораторные эксперименты уже на горизонте.
И всё-таки: жарко ли митохондрии?
Нанотермометры позволят, наконец, поставить точку в спорах о «горячих митохондриях» в исследованиях биоэнергетики. Теперь можно прямо измерить температуру внутри митохондрии или рядом с ней, поместив туда сенсор, и увидеть, есть ли разница в температурах с остальной цитоплазмой. В 2022 году вышло исследование по измерению тепла, выделяемое изолированными митохондриями мышиного мозга с помощью алмазного квантового зонда [54]. При полном «сбросе» мембранного потенциала (с помощью CCCP, см. рис. 7) температура у митохондрий поднималась на 4–22 oC выше фоновой, достигая максимума в ~45 oC. Этот результат — важное свидетельство высокой термогенной активности митохондрий и наглядный пример применения наноалмазной термометрии в биоэнергетике.
Также был проведен эксперимент по измерению теплопроводности внутри клетки с помощью гибридных алмазных нанодатчиков [31]. Такие эксперименты помогают уточнить, как быстро рассеивается тепло в живой клетке, сравнить ее теплопроводность с водой. Стало возможно измерять тепловыделение при отдельных реакциях и эффективность молекулярных механизмов клетки более точно. Полученные данные могут обогатить наше понимание неравновесных процессов в клетке — от передачи энергии до тепловых градиентов в органеллах. А в перспективе такие знания помогут точнее интерпретировать поведение клеток при тепловом стрессе и создавать условия, в которых можно подбирать более стабильные белки или штаммы. Хотя на практике устойчивые ферменты чаще находят с помощью метода направленной эволюции или предсказаний нейросетей, понимание физической картины остается важной основой для таких подходов.
Микроэлектроника, химическая и фармацевтическая промышленность
Хотя исходно такие термометры-нагреватели рождены для биологии, сама технология точного измерения и регуляции температуры в микромасштабе может использоваться и за ее пределами. Например, в микроэлектронике — контролировать нагрев микропроцессоров в точках наиболее сильного выделения тепла (алмазы здесь весьма кстати: в чипах алмаз используется как высокотеплопроводный теплоотвод, а тут еще и сенсор на его базе). В химической микроаналитике — проводить реакции в микрочипах с точным термоконтролем отдельных зон (полезно для lab-on-a-chip устройств, ПЦР и т.д.).
В фармацевтических исследованиях температурные сенсоры открывают новые возможности для оценки действия лекарств. Микрокалориметрия, то есть измерение очень малых количеств тепла, позволяет регистрировать мельчайшие изменения теплопродукции клеток — как результат изменения их метаболической активности под действием препаратов или связывания молекул лекарств с их мишенями. Это особенно важно при разработке новых соединений. По тепловому отклику можно не только определить факт взаимодействия, но и количественно оценить аффинность и эффективность потенциального лекарства. Такой подход позволяет буквально «на глаз» увидеть, как меняется клеточный обмен веществ при добавлении тестируемого соединения — и делать это в реальном времени.
Конечно, каждое из этих направлений — целое поле для исследований. Но общее у них одно: они нуждаются в умении тонко управлять температурой на наноуровне, и теперь оно у нас есть.
Заключение
Еще недавно о температуре в клетке говорили как о данности: ну да, 37 ℃ и ладно. Теперь же мы начинаем понимать, что температура в живых системах — динамичный и тонко регулируемый параметр. На макроуровне организмы эволюционировали так, чтобы иметь сложные механизмы терморегуляции для выживания. На микроуровне, похоже, природа тоже не игнорирует тепло: локальные колебания температуры могут не только сопровождать, но и влиять на процессы в клетке. Современные исследования с применением нанотермометров подтверждают это. Там, где в клетке интенсивно «горит топливо», может быть чуть теплее, и клетка способна это почувствовать [22].
Но теперь чувствует не только клетка. С приходом новых технологий, таких как алмазные наноконтроллеры, ученые получили средство общения с клеткой — температура из фонового процесса превратилась в средство общения, а «горячая линия» — в реальный канал связи. И теперь, когда соединение установлено, можно наконец начать разговор.
Конечно, наука только начинает освоение этой области. Пока что данных мало, и каждая новая работа вызывает обсуждения. Пусть управление температурой в биологии — вещь не новая: термостаты, инкубаторы, ПЦР — всё это давно и прочно вошло в лабораторную практику. Но только сейчас стало возможным управлять температурой локально, с субклеточной точностью и в реальном времени. Возможно, впереди нас ждет целая волна открытий, ведь столько процессов можно пересмотреть под углом локальной термодинамики.
Литература
- Дикий-дикий космос;
- Chiara Schiraldi, Mario De Rosa. (2014). Mesophilic Organisms. Encyclopedia of Membranes. 1-2;
- Nancy Merino, Heidi S. Aronson, Diana P. Bojanova, Jayme Feyhl-Buska, Michael L. Wong, et. al.. (2019). Living at the Extremes: Extremophiles and the Limits of Life in a Planetary Context. Front. Microbiol.. 10;
- Cooper G. The Cell: A Molecular Approach. 2nd edition. MA: Sunderland, 2000. — 689 p.;
- Возможна ли жизнь без гемоглобина?;
- Arthur L. Devries. (1971). Glycoproteins as Biological Antifreeze Agents in Antarctic Fishes. Science. 172, 1152-1155;
- Установлен механизм действия «белков-антифризов»;
- Стрельба тихоходками;
- Анабиоз I. Минимальная жизнь;
- Анабиоз II. Смерть до востребования;
- Криобиология: как остановить биологические часы и запустить их обратно;
- Жизнь спустя 24 000 лет в вечной мерзлоте возможна?;
- Alberts B. Molecular Biology of the Cell. New York: Garland Science, 2002. — 1616 p.;
- Экстрим в природе;
- В диких условиях: как жил последний всеобщий предок LUCA;
- Paula Prondzinsky, Sakae Toyoda, Shawn Erin McGlynn. (2023). The methanogen core and pangenome: conservation and variability across biology’s growth temperature extremes. DNA Research. 30;
- Valery M. Gavrilov. (2013). Origin and development of homoiothermy: A case study of avian energetics. ABB. 04, 1-17;
- Jialiang Chen, Yihua Zhong, Jicheng Wang, Bing Shen, Jonathan Beckel, et. al.. (2023). Temperature Effect on Nerve Conduction Block Induced by High-Frequency (kHz) Biphasic Stimulation. Neuromodulation: Technology at the Neural Interface. 26, 607-613;
- F. F. Foldes, S. Kuze, E. S. Vizi, A. Deery. (1978). The influence of temperatute on neuromuscular performance. J. Neural Transmission. 43, 27-45;
- Svante Arrhenius. (1889). Über die Reaktionsgeschwindigkeit bei der Inversion von Rohrzucker durch Säuren. Zeitschrift für Physikalische Chemie. 4U, 226-248;
- Osilla E. Physiology, Temperature Regulation. FL: Treasure Island, 2025;
- Alexey G. Kruglov, Alexey M. Romshin, Anna B. Nikiforova, Arina Plotnikova, Igor I. Vlasov. (2023). Warm Cells, Hot Mitochondria: Achievements and Problems of Ultralocal Thermometry. IJMS. 24, 16955;
- David L. Nelson, Michael M. Cox Lehninger Biochemie — Springer Berlin Heidelberg, 2001;
- Болезни и изменения клеточного метаболизма;
- Вослед Варбургу — последние достижения в изучении биоэнергетики рака;
- V. Umadevi, S.V. Raghavan, Sandeep Jaipurkar. (2011). Framework for estimating tumour parameters using thermal imaging. Indian Journal of Medical Research. 134, 725-731;
- John B. Weaver. (2010). Hot nanoparticles light up cancer. Nature Nanotech. 5, 630-631;
- Cooper G. The Molecular Composition of Cells. MA, Sunderland: Sinauer Associates, 2000. — 728 p.;
- Marcus E. Raichle, Debra A. Gusnard. (2002). Appraising the brain's energy budget. Proc. Natl. Acad. Sci. U.S.A.. 99, 10237-10239;
- Формирование мембранного потенциала покоя;
- Alexey M. Romshin, Vadim Zeeb, Evgenii Glushkov, Aleksandra Radenovic, Andrey G. Sinogeikin, Igor I. Vlasov. (2023). Nanoscale thermal control of a single living cell enabled by diamond heater-thermometer. Sci Rep. 13;
- Pizzorno J. (2014). Mitochondria—Fundamental to Life and Health. Integr Med (Encinitas). 13, 8–15;
- Michelle Liberton, Jotham R. Austin, R. Howard Berg, Himadri B. Pakrasi. (2011). Unique Thylakoid Membrane Architecture of a Unicellular N2-Fixing Cyanobacterium Revealed by Electron Tomography. Plant Physiology. 155, 1656-1666;
- Guillaume Baffou, Hervé Rigneault, Didier Marguet, Ludovic Jullien. (2014). A critique of methods for temperature imaging in single cells. Nat Methods. 11, 899-901;
- Бессмертные клетки Генриетты Лакс;
- Загадочный кальциевый язык;
- Трогательная и жгучая — за что вручили Нобелевскую премию по медицине (2021);
- Michael J. Caterina, Mark A. Schumacher, Makoto Tominaga, Tobias A. Rosen, Jon D. Levine, David Julius. (1997). The capsaicin receptor: a heat-activated ion channel in the pain pathway. Nature. 389, 816-824;
- «Мятный холодок»: почему ментол создаёт ощущение прохлады во рту;
- Флуоресцирующая Нобелевская премия по химии;
- Shigeki Kiyonaka, Taketoshi Kajimoto, Reiko Sakaguchi, Daisuke Shinmi, Mariko Omatsu-Kanbe, et. al.. (2013). Genetically encoded fluorescent thermosensors visualize subcellular thermoregulation in living cells. Nat Methods. 10, 1232-1238;
- Mariana Alfaro, Marija Strojnik, Gonzalo Paez. (2007). EuTTA fluorescence lifetime and spectral power characterization for its use as an active medium for IR-to-visible conversion. SPIE Proceedings. 6678, 66781J;
- Kotaro Oyama, Mizuho Gotoh, Yuji Hosaka, Tomoko G. Oyama, Aya Kubonoya, et. al.. (2020). Single-cell temperature mapping with fluorescent thermometer nanosheets. Journal of General Physiology. 152;
- Laura M. Maestro, Carlos Jacinto, Ueslen R. Silva, Fiorenzo Vetrone, John A. Capobianco, et. al.. (2011). CdTe Quantum Dots as Nanothermometers: Towards Highly Sensitive Thermal Imaging. Small. 7, 1774-1778;
- Квантовые точки — наноразмерные сенсоры для медицины и биологии;
- Наночастицы для окраски биомолекул и QLED-дисплеев — за что вручили Нобелевскую премию по химии (2023);
- Что расскажут о белках алмазы;
- Gergő Thiering, Adam Gali. (2020). Color centers in diamond for quantum applications. Semiconductors and Semimetals. 1-36;
- Калиевые каналы как перспективное средство для генной терапии эпилепсии;
- Sophia M. Hirsch, Sriramkumar Sundaramoorthy, Tim Davies, Yelena Zhuravlev, Jennifer C. Waters, et. al.. (2018). FLIRT: fast local infrared thermogenetics for subcellular control of protein function. Nat Methods. 15, 921-923;
- Jaber Beyk, Hassan Tavakoli. (2019). Selective radiofrequency ablation of tumor by magnetically targeting of multifunctional iron oxide–gold nanohybrid. J Cancer Res Clin Oncol. 145, 2199-2209;
- Norma A Valdez-Cruz, Luis Caspeta, Néstor O Pérez, Octavio T Ramírez, Mauricio A Trujillo-Roldán. (2010). Production of recombinant proteins in E. coli by the heat inducible expression system based on the phage lambda pL and/or pR promoters. Microb Cell Fact. 9;
- Rzechorzek N. (2022). Human brains run hot — sometimes more than 40 °C. Nature. 606, 627-627;
- Alexey M. Romshin, Alexander A. Osypov, Irina Yu. Popova, Vadim E. Zeeb, Andrey G. Sinogeykin, Igor I. Vlasov. (2022). Heat Release by Isolated Mouse Brain Mitochondria Detected with Diamond Thermometer. Nanomaterials. 13, 98.







