Как системная биология раскрывает тайны мозга
12 февраля 2021
Как системная биология раскрывает тайны мозга
- 13360
- 0
- 13
Работа мозга — одна из самых интригующих тайн жизни. Рисунок в полном размере.
иллюстрация Любови Колосовской
-
Автор
-
Редакторы
-
Иллюстратор
Темы
Эта статья завершает цикл «Пятерка по системной биологии». В ней мы расскажем, в каком состоянии сейчас находятся науки о мозге, какие у них приоритеты и перспективы, а также опишем посвященные мозгу научные работы, выполненные в рамках стипендиальной программы по системной биологии ФМИ.
Пятерка по системной биологии
Победителями Стипендиальной программы по системной, клеточной и молекулярной биологии, организованной российскими аффилированными лицами компании «Филип Моррис Интернэшнл» (ФМИ) на базе Центра наук о жизни Сколковского института науки и технологий, ежегодно становятся пять молодых ученых до 35 лет. Знания по своим темам у стипендиатов, без сомнения, также заслуживают «пятерки» — поэтому спецпроект и получил такое название.
В статьях цикла наши авторы пообщаются со стипендиатами разных лет, профессорами и преподавателями Сколтеха, а также с представителями ФМИ.
Партнер спецпроекта — российские аффилированные лица компании «Филип Моррис Интернэшнл» (ФМИ), которая активно ведет исследования в области биомедицины, системной биологии и биотехнологий.
Как изучают мозг, почему это так сложно и зачем вообще это делать
Исследовать головной мозг очень тяжело, ведь этот орган невероятно сложен. Кора головного мозга делится на 180 участков [1] (рис. 1), которые состоят из нейронов с аналогичной структурой, функциями и связями, а всего человеческий мозг содержит около 84,6 миллиардов глиальных клеток, 86 миллиардов нейронов [2] и примерно 1015 синапсов, соединяющих нейроны друг с другом [3]. Это настолько умопомрачительно сложная сеть, что полное описание структуры всех связей в мозге человека — коннектóм — до сих пор недоступно. Еще бы: ведь даже небольшой набор данных (микроконнектом) с полным разрешением занимает 12 терабайт [4]!
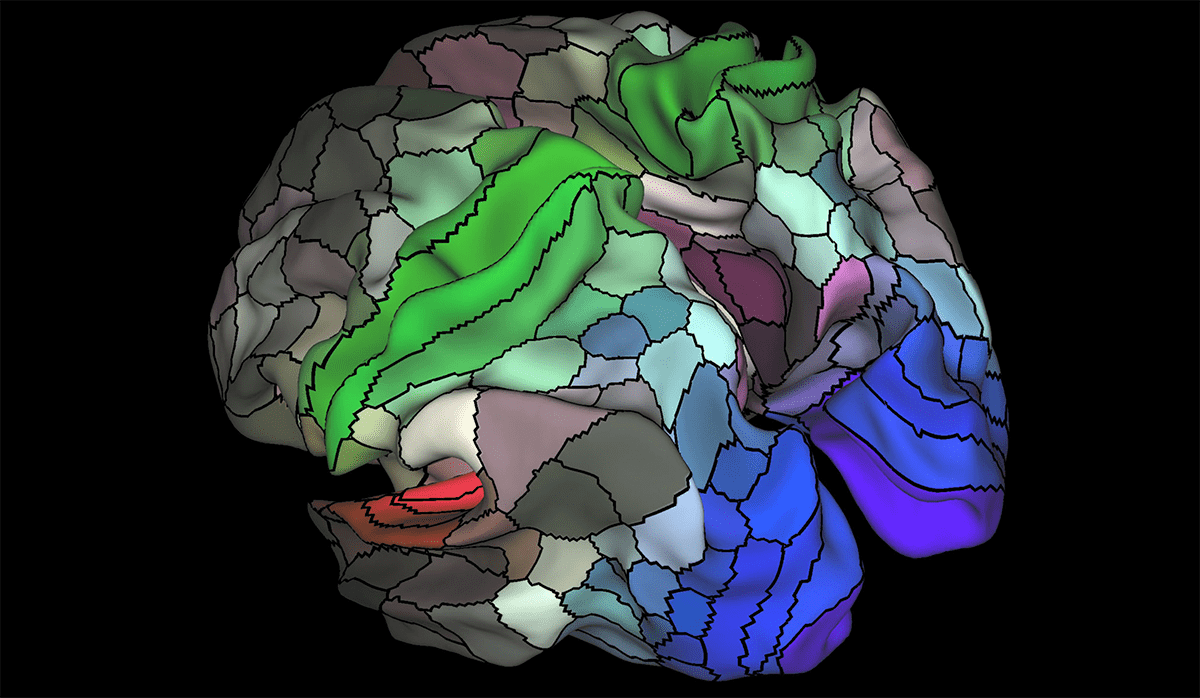
Рисунок 1. Карта коры головного мозга, полученная при помощи фМРТ: цветом выделены 180 участков с различными функциями
Однако изучать мозг критически важно, причем не только потому, что это интереснейший биологический объект. У фундаментальных исследований мозга есть важное практическое значение. Только досконально разобравшись, как работает мозг, мы научимся лечить заболевания головного мозга человека. Например, изучение нейронных основ амблиопии [5] — расстройства зрения у детей, при котором в мозг поступают искаженные сигналы, из-за чего зрительная кора головного мозга неправильно воспринимает сигналы от глаз, — уже помогло разобраться с происхождением болезни и выявить ранние чувствительные периоды, в течение которых ребенку проще всего помочь.
Сегодня в мире действует несколько международных проектов, посвященных фундаментальным исследованиям мозга. Например, в 2013 году сотрудники Национальных институтов здравоохранения (NIH) США запустили инициативу BRAIN, нацеленную на всестороннее изучение мозга на нескольких уровнях. При Институте нейровизуализации и информатики им. Марка и Мэри Стивенс (USC) действует Human Connectome Project, задача которого — построить карту нейронных сетей в человеческом мозге (то есть коннектом), которая выявит анатомические и функциональные связи в здоровом мозге человека и предоставит совокупность данных, необходимых для исследования причин заболеваний мозга. Например, дислексии, расстройств аутистического спектра, болезни Альцгеймера и шизофрении.
И это далеко не всё. Например, специалисты из Института исследования мозга Аллена под руководством Аллана Джонса составили транскриптомный атлас человеческого мозга. Он уже позволил расширить наши знания о функциях отдельных зон мозга, лучше понять причины заболеваний центральной нервной системы, а в будущем поможет разобраться с функциями малоизученных генов мозга, экспрессия которых была обнаружена при составлении атласа. Подробнее прочитать об этом можно в статье «Allen Brain Atlas: транскриптом мозга» [6].
В Европе действует проект Human Brain Project (HBP), включающий 121 научный институт из 20 стран. Его ключевая задача — моделирование головного мозга человека. HBP вырос из предыдущего крупного исследования — Blue Brain Project, — авторам которого удалось смоделировать нейронную колонку коры больших полушарий мозга крысы. Прочитать об этом подробнее можно в статьях «Blue Brain Project: как все связано?» [7] и «Blue brain project: связи и хаос» [8].
Аналогичные проекты существуют и в Азии. В Японии с 1997 года работает RIKEN Brain Science Institute (BSI), организованный по четырем основным направлениям исследований: разум и интеллект, функции нейронных цепей, механизмы заболеваний и развитие передовых технологий. А в 2010 году китайское Министерство науки и технологий (MOST) профинансировало проект Brainnetome — один из 50 крупных китайских проектов, сотрудники которого совместно с учеными из США занимаются визуализацией и вычислительным анализом того, как функционируют нормальные и поврежденные нейронные сети.
В нашей стране глобального проекта по исследованию мозга пока нет, а в уже существующих международных проектах Россия не участвует. В 2019 году президент Российской академии наук Александр Сергеев призвал запустить общенациональный проект по исследованию мозга, но он пока не стартовал. Тем не менее в нашей стране много научных центров, сотрудники которых очень активно занимаются исследованиями мозга — в том числе с международным сотрудничеством.
Если речь идет об изучении мозговой ткани, в большинстве случаев исследовать приходится мертвый или умирающий мозг, потому что иначе получить материал невозможно. Методы из этой группы обладают очень высоким разрешением, но не позволяют прослеживать функциональные изменения мозга. К ним относятся, например, нейромикроскопия и аффинное окрашивание нейронов.
«Сегодня существует много методов расшифровки состава ткани, отдельных клеток, активности генов, липидного состава мембран, метаболического состава с помощью масс-спектрометрии, с помощью биохимии, расшифровки последовательностей РНК и ДНК, — рассказывает профессор Филипп Хайтович. — Мы наконец-то получили возможность узнать, какие клетки есть в нашем мозге. Казалось бы, мы изучаем это уже много лет. Однако до сих пор не можем сказать, сколько типов нейронов и сколько типов глиальных клеток находится в тех или иных регионах мозга».
Благодаря методам молекулярной биологии мы понемногу начинаем получать ответы на эти вопросы. Например, о том, что о работе мозга смогли выяснить специалисты из исследовательской группы профессора Филиппа Хайтовича, можно прочитать в статье «Как биологи работают с большими массивами данных» [9]. Однако исследователей, которые пытаются раскрыть тайны мозга на молекулярном уровне, гораздо больше: многие из них работают в крупных проектах, посвященных мозгу, или в уже упоминавшемся Институте исследования мозга Аллена.
Но, к сожалению, у методов молекулярной биологии тоже есть ограничения — например, они не дают никакой информации о том, как эти клетки взаимодействуют друг другом, с клетками других типов и с остальными структурами в ходе работы мозга. И здесь на помощь приходят методики, позволяющие изучать работу живого мозга.
С этой целью в нейробиологии применяют оптогенетику [10], которая позволяет управлять модифицированными нейронами лабораторных животных при помощи света, позитронно-эмиссионную томографию (ПЭТ) и ряд других методик. Почитать о них можно в статье «12 методов в картинках: нейробиология» [11], а во врезке ниже мы расскажем о четырех самых популярных методиках, которые принесли человечеству множество ярких открытий.
Еще мы можем изучать работу мозга, используя модельные организмы — от грызунов до приматов. Однако нужно иметь в виду, что мозг этих живых существ ощутимо отличается от нашего и по числу анатомических областей в коре головного мозга, и по количеству связей между ними. Так что переносить на людей данные, полученные на животных, нужно с большой осторожностью. Почему так, можно узнать из статьи «Что особенного в мозге человека?» [15].
Тем не менее не все опыты можно провести на животных. В некоторых ситуациях могут помочь искусственно выращенные модели головного мозга — так называемые органоиды [18]. Но и тут, конечно, есть свои ограничения. Например, полученные органоиды пока имеют только кору; подкорковые структуры у них отсутствуют .
Узнать больше об органоидах можно из статьи «Как искусственные модели головного мозга и омиксные технологии пригодятся в борьбе с аутизмом» [19]. А о том, какие проблемы возникают при изучении человеческого мозга и как ученые пытаются их решать, рассказано в статье «Что нам стоит мозг построить?» [20].
В трех предыдущих статьях спецпроекта мы рассказывали о работах стипендиатов, посвященных системной, молекулярной и клеточной биологии [21]; системной иммунологии [22]; и системной биологии хроматина [23]. В этой статье речь пойдет о двух интересных работах, поддержанных стипендиальной программой по системной биологии ФМИ на базе Сколтеха. Обе работы касаются актуальных тем, интересующих научное сообщество по всему миру: эволюции и генетики мозга.
Чем мозг человека с РАС отличается от мозга здорового человека на молекулярном уровне
Расстройство аутистического спектра, или РАС, — это нарушение развития человека, которое может вызывать серьезные социальные, коммуникативные и поведенческие проблемы. Причем симптомы могут быть как легкими, так и довольно тяжелыми, сильно затрудняющими нормальную жизнь.
«Механизм возникновения РАС до сих пор неизвестен. Значит, такие исследования, как наше, очень важны, — рассказывает Екатерина Храмеева. — Они помогают собрать информацию о том, что же именно меняется в работе мозга и приводит к РАС».
Исследования РАС смогут облегчить жизнь людям с этим состоянием. Кроме того, работа поможет разобраться с уникальным механизмом нарушения эволюционно нового, специфичного для человека социального поведения, которое не встречается у обезьян. Но чтобы понять, чем «обычный» мозг отличается от мозга человека с РАС, необходимо изучать молекулярные маркеры, отличающие один объект от другого.
«Молекулярные маркеры — это любые отличия на молекулярном уровне между патологией и нормой, — рассказывает Екатерина Храмеева. — Чаще всего под “молекулярными маркерами” подразумевают молекулы, количество которых сильно изменяется при РАС. Это могут быть метаболиты — небольшие молекулы вроде глюкозы или аминокислот, образующиеся в процессе обмена веществ; гены, экспрессия которых сильно меняется при нарушениях в работе мозга; и генотипы — тогда речь идет о различиях на уровне ДНК между здоровыми и людьми, у которых есть нарушения в работе мозга».
По данным предыдущих исследований было известно, что в сыворотке крови людей с РАС повышалась концентрация глутамата [24] и продуктов гликолиза — лактата и пирувата. Напротив, понижалась концентрация карнитина [25] — переносчика жирных кислот из цитозоля в митохондрии — и глутатиона [26] — ключевого нейтрализатора активных форм кислорода. Несмотря на то, что существующие исследования охватывали различные аспекты изменения концентрации метаболитов при РАС, они не смогли полностью оценить метаболические различия, происходящие в мозге.
Чтобы разобраться с механизмом развития этого расстройства, нужно собрать воедино все данные по генотипам, генам и метаболитам и интегрировать их. Иными словами, нужно найти «поломку» на уровне ДНК, в результате которой уменьшается экспрессия определенного гена. Это очень непростая задача: в теории, из-за снижения экспрессии должно снижаться количество белка, так что эти белки синтезируют меньше метаболитов. Однако на практике связать гены и метаболиты не так просто: далеко не все поломки на уровне ДНК приводят к изменениям экспрессии, а информация о связи генов с метаболитами довольно скудная.
«Мы изучили 32 образца мозговой ткани пациентов с РАС, 40 образцов здоровых людей из группы контроля и еще по 40 от шимпанзе и макак. Каждая группа охватывала широкий возрастной диапазон: 2–60 лет для лиц с РАС и 0–61 год для контрольной группы. При помощи метода жидкостной хроматографии [27] и масс-спектрометрии (LC-MS) в положительном и отрицательном режимах ионизации нам удалось измерить в префронтальной коре 1366 метаболитов. Это далеко не все метаболиты, которые есть в мозге, зато наш экспериментальный метод позволял детектировать их с высокой точностью», — рассказывает Екатерина Храмеева.
РАС влияет на когнитивные способности, особенно ярко выраженные у людей. Измерения метаболома мозга у шимпанзе и макак позволили определить 170 из 1366 метаболитов как специфичные для человека: их уровни в человеческом мозге были значительно повышены или понижены по сравнению с приматами.
«Гены, отвечающие за синтез этих метаболитов, преимущественно находились в 27 путях. И оказалось, что эти 27 путей неслучайно перекрываются с путями, затронутыми изменениями в метаболизме у пациентов с РАС, — рассказывает Екатерина Храмеева — Так, пути метаболизма пирувата, пуринов и пиримидинов содержали большое количество изменений, специфичных для человека, и одновременно характерных для пациентов с РАС. Это наблюдение позволяет предположить, что при РАС могут быть нарушены эволюционно новые, приобретенные человеком особенности метаболизма мозга. Интересно, что похожая гипотеза была сформулирована ранее на основе измерений уровней экспрессии генов у человека, приматов и пациентов с РАС [28]».
Значительные отличия здорового мозга от мозга при РАС удалось найти для 202 (15%) из 1366 детектируемых метаболитов, преимущественно в 16 метаболических путях. Все различия в интенсивности метаболитов, группирующиеся по этим путям, были обнаружены в моче [29], [30]. А отличия, связанные с циклом трикарбоновых кислот, метаболизмом глутатиона и метаболизмом пирувата, были описаны в крови пациентов с РАС [31], [32].
«Из нашего исследования можно сделать вывод, что метаболические изменения в мозге при аутизме отражаются на метаболическом составе крови и мочи. Значит, их можно диагностировать. Возможно, наши наблюдения можно будет использовать для разработки новых методов лабораторной диагностики РАС», — объясняет Екатерина Храмеева.
Выявленные изменения в метаболизме пуринов у людей с РАС очень интересны, ведь передача пуринергических сигналов участвует в процессах развития нервной системы — включая пролиферацию, дифференцировку клеток и перекрестное взаимодействие нейронов и глии. До этого уже было показано, что пуринергическая передача сигналов изменяется при множестве психических расстройств, включая РАС [33].
Кроме того, серьезные отличия удалось обнаружить в пути метаболизма глутатиона [34], [35] (рис. 2) — этот синтезируемый прямо в мозге трипептид играет первостепенную роль в антиоксидантной защите мозга, охраняя его от повреждения активными формами кислорода. Истощение запасов глутатиона наблюдается при старении и различных неврологических расстройствах — например, при болезни Альцгеймера и болезни Паркинсона.
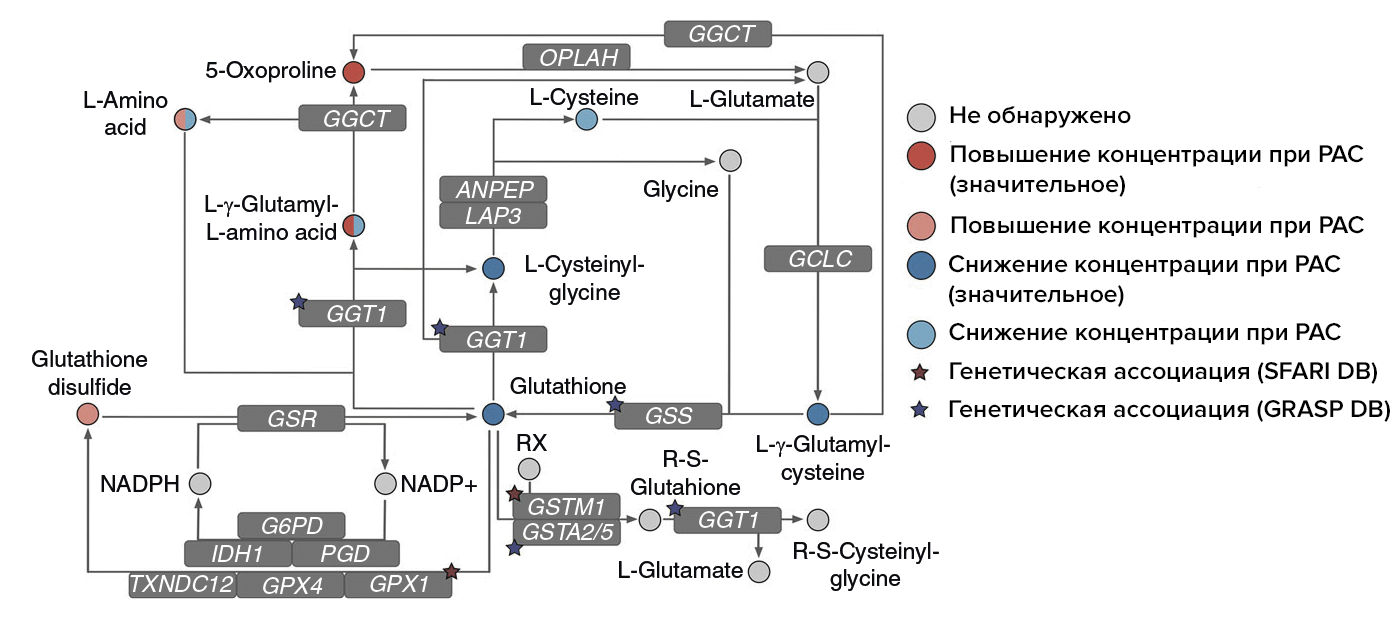
Рисунок 2. Упрощенное схематическое изображение пути метаболизма глутатиона. Звездочками отмечены гены, содержащие генетические варианты, связанные с РАС, — их нашлось 5 штук. Кроме того, при этом состоянии многие метаболиты также поменяли свою концентрацию. Эти данные позволяют предположить, что изменения в метаболизме глутатиона должны играть ключевую роль при развитии РАС.
Мозг людей с РАС отличался низкой концентрацией глутатиона и связанных с ним метаболитов: L-цистеинилглицина и L-γ-глутамил-L-цистеина. Но, помимо этого, разница наблюдалась и на уровне генетических вариантов, связанных с ферментами, катализирующими реакции с участием глутатиона и его метаболитов. Таких как ген, кодирующий ферменты из класса глутатионпероксидаз (GPX1 и GGT1), и гены системы детоксикации (GSTM1). Полиморфизмы в этих генах ранее уже связывали с РАС [36].
Правда ли, что люди пожертвовали регенерацией ради крупного мощного мозга?
Исследование Екатерины Храмеевой было сосредоточено на молекулярных основах нарушения развития человеческого мозга: это практичная тема, по результатам которой, возможно, когда-нибудь будут созданы методики для диагностики РАС по крови и моче. Однако исследования мозга — это еще и интереснейшая фундаментальная сторона. Например, Анастасия Иванова и ее коллеги из лаборатории молекулярных основ эмбриогенеза ИБХ РАН во главу угла поставили эволюционную историю. Их задачей было прояснить интересный эволюционный вопрос: чем пришлось «пожертвовать» представителям нашего вида, чтобы приобрести такой великолепный и сложный мозг?
Лаборатория ИБХ РАН, в которой работает Анастасия Иванова, занимается исследованиями механизмов раннего развития мозга. Все началось с исследований генов гомеобокса Anf, которые впервые появились в геномах позвоночных. Гены Anf контролируют развитие конечного мозга — у людей эта структура известна как кора головного мозга. Подробнее о том, как были открыты Anf, можно прочитать в статье «Лаборатория молекулярных основ эмбриогенеза: от гена к признаку» [39].
При этом гены, которые мы утратили в процессе эволюции, не менее интересны, чем гены, которые у нас остались. Один из генов-мишеней гомеобокса Anf, а именно ген секретируемой дисульфид-изомеразы Ag1, присутствует только в геномах низших позвоночных — рыб и амфибий, — но при этом его нет в геномах рептилий, птиц и млекопитающих. При этом у низших позвоночных этот ген регулирует развитие мозга и регенерацию конечностей.
Но что, если высшим позвоночным пришлось «пожертвовать» геном Ag1 и связанной с ним регенерацией как раз для того, чтобы приобрести конечный мозг?
Всего генов из группы Agr три: Ag1, Agr2 и Agr3. Все они регулируют раннее развитие переднего мозга у эмбрионов лягушки. Но из этой троицы в процессе эволюции только Ag1 экспрессируется на стадии формирования мозга (рис. 3). Ген Ag1 заинтересовал исследователей, потому что они увидели шанс проверить гипотезу, что в некоторых случаях крупные эволюционные события — например, изменения в регенеративной способности и развитии мозга у высших позвоночных, — могут быть вызваны «потерей» некоторых важных генов, участвующих в регуляторных механизмах, ответственных за эти события.
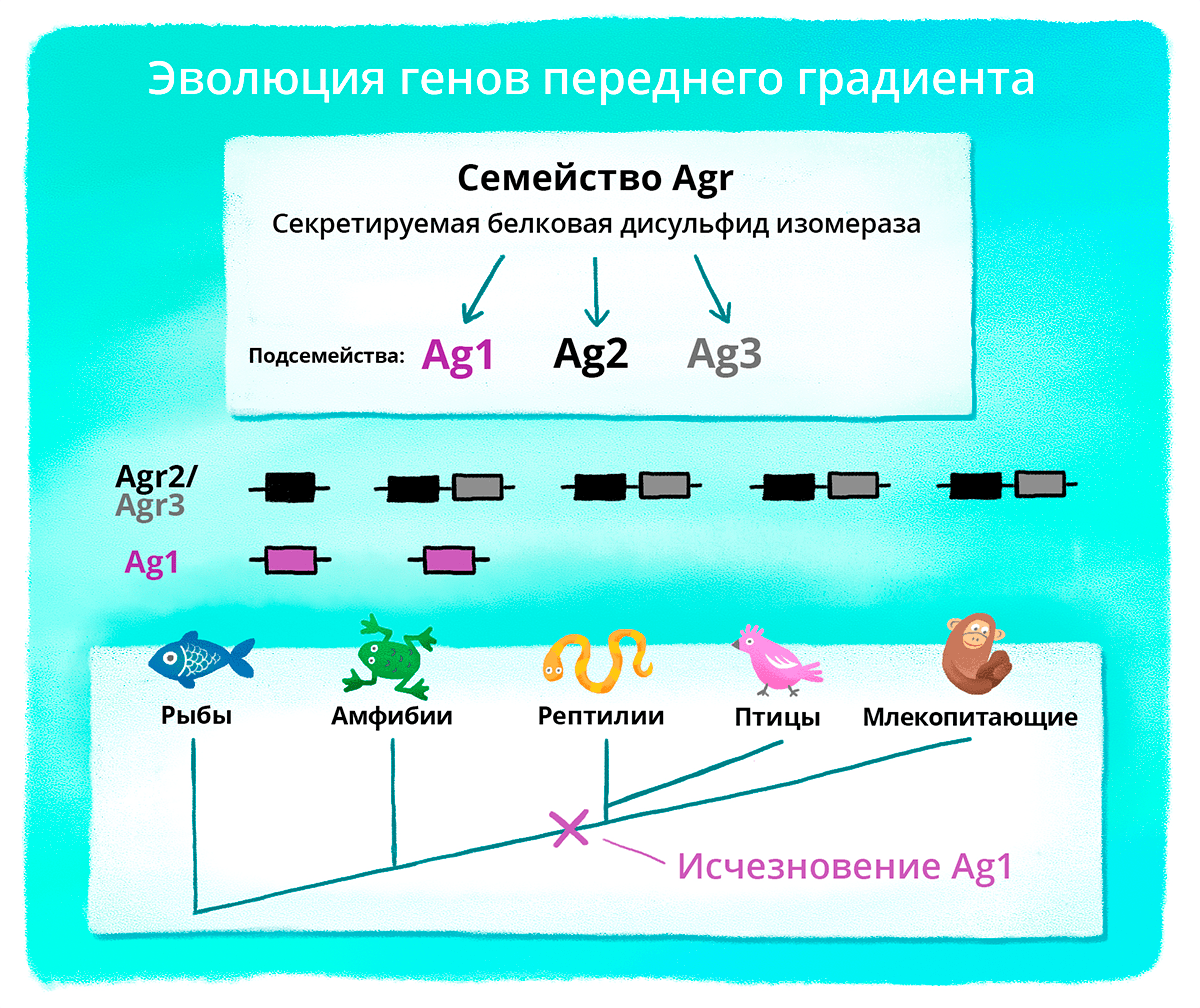
Рисунок 3. Как гены из группы Agr постепенно исчезали в процессе эволюции. Фиолетовым цветом выделен ген Ag1. На рисунке видно, что этот ген есть у рыб и амфибий, а у рептилий, птиц и млекопитающих он исчезает. У беспозвоночных этого гена нет.
презентация работы Анастасии Ивановой, адаптация Любови Колосовской
Во время эмбрионального развития у рыб и рептилий ген Ag1 участвует в формировании переднего мозга. Он ограничивает экспрессию нейтральных генов в области, прилегающей к мозгу, так что в результате вокруг формируются эктодермальные плакоды — особые утолщения эпителия.
У Homo sapiens sapiens эктодермальные плакоды, расположенные в верхней части головы, принимают участие в развитии нейронов сенсорной нервной системы, слухового пузырька и вестибулярного аппарата. А у шпорцевых лягушек они так и остаются утолщениями эпителия. Но если подавить экспрессию этого гена (частично, так как при полном подавлении его экспрессии зародыши погибают), передний мозг формируется значительно больших размеров, чем обычно.
«Гены Agr2 и Agr3 есть и у человека, причем их повышенная экспрессия связана со злокачественными опухолями, с их быстрым и агрессивным ростом и метастазированием, — рассказывает Анастасия Иванова. — Однако механизм работы этих генов до сих пор до конца не изучен. Нам показалось важным исследовать ген Ag1 на самой ранней ступени его появления. Мы хотели изучить его консервативность, а также сопоставить регулируемую им генную сеть с его исчезновением в эволюции».
Анастасия и ее коллеги хотели получить весь спектр генов, участвующих в регуляции работы Ag1, чтобы определить основной механизм его действия в раннем развитии и в регенерации. Им было интересно отследить, какой именно сигнальный каскад претерпел перестройку и какие гены были вовлечены в этот процесс.
Анастасия и коллеги подготовили образцы зачатка переднего мозга с нормальной и подавленной экспрессией Ag1 и провели высокопроизводительное РНК-секвенирование транскриптома. Они обнаружили, что во время развития переднего мозга Ag1 ингибирует несколько генов пролиферации. В образцах мозга ксенопуса, где был подавлен этот ген, наблюдалась сильная активация генов POU (у X. Laevis это гены Oct-91, Oct-60 и Oct-25) [41], которые играют решающую роль в развитии и функционировании нервной системы.
Ген Ag1 подавляет гены трех сигнальных путей. Это сигнальный путь MAPK [42], отвечающий за пролиферацию, дифференциацию, развитие, трансформацию и апоптоз; сигнальный путь Fox [43], регулирующий многие физиологические события, в том числе контроль клеточного цикла и апоптоз; и сигнальный путь TGF-β [44], который нужен для управления ростом и дифференциацией клеток у эмбрионов и взрослых особей. Судя по всему, за счет подавления этих сигнальных путей ген Ag1 блокирует деление клеток в соседней области переднего мозга. Так что исчезновение Ag1 у млекопитающих действительно могло привести к увеличению коры головного мозга.
В то же время Ag1 активирует экспрессию генов цитоскелета и нейруляции. Это ингибитор сигнального пути FoxO [45], цитоскелетные белки, фокальные контакты, через которые цитоскелет клетки соединяется с внеклеточным матриксом, и сигнальный путь р53, который реагирует на стрессы, способные нарушить точность репликации ДНК и помешать нормальному делению клеток. Исследователи предположили, что подавление FoxO-пути с эволюционной точки зрения требовалось для поддержания регенерации, потому что без этого невозможна клеточная пролиферация. Это позволяет выдвинуть гипотезу, что рептилии, птицы и млекопитающие были вынуждены «избавиться» от гена Ag1, чтобы защитить себя от рака.
Чтобы регенерация была успешной, организм должен успешно подавлять иммунный ответ. Ведь если иммунная система активна, раны заживают до того, как утраченный орган успеет регенерировать. Так и происходит в реальности: в процессе регенерации ген Ag1 подавляет некоторые гены, ответственные за иммунитет. Таким образом, исчезновение Ag1 может привести к высокому иммунному ответу и быстрой эпителизации раны.
В ходе работы ученые уделили особое внимание зависимым от Ag1 генам, которые также исчезли в ходе эволюции. Один из этих генов — Ras-dva1, кодирующий малую ГТФ-азу [46]. Этот фермент регулирует развитие мозга у эмбрионов ксенопуса. Кроме того, он отвечает за формирование бластемы — особого раневого эпителия со слоем потерявших специализацию клеток, из которого затем формируется утраченная конечность. Данные подтвердили, что Ras-dva1 активируется в ответ на ранение и участвует в регенерации у этого вида лягушек. Вполне вероятно, что утрата генов Ras-dva1 в ходе эволюции позвоночных могла привести к нарушению системы индукции регенерационной бластемы и, следовательно, к резкому ослаблению способности к регенерации у амниот.
Возможно, полное понимание механизмов регенерации у низших позвоночных позволит понять причину ее утраты у высших. А значит — определить, возможно ли путем активации определенных сигнальных каскадов включить «спящие» механизмы регенерации и активировать дедифференцировку клеток у взрослого человека, позволяя ему восстанавливать утраченные части тела, будь то конечность или внутренние органы.
«Проект, связанный со стипендией, завершился, но мы продолжаем подтверждать полученные данные различными методами и писать статьи, — рассказывает Анастасия Иванова. — Например, в 2018 году вышли два исследования, посвященные роли малых ГТФ-аз Ras-dva1 в регенерации у рыб и земноводных [47], [48].
О практическом применении говорить пока рано, мы все-таки фундаментальная лаборатория. Однако мы надеемся, что когда-нибудь фундаментальные исследования эволюционно консервативных мишеней и каскадов среди генов Agr лягут в основу таргетной терапии рака».
Будущее нейробиологии
Нейробиология — одно из самых быстро развивающихся направлений биологии. И это неудивительно, ведь о работе мозга мы еще знаем очень мало. До сих пор много неясного в области поведенческой биологии (как мозг управляет поведением). Много загадок в клеточной нейробиологии, которая исследует нейроны и глиальные клетки мозга, и в молекулярной нейробиологии, предмет изучения которой — роль отдельных молекул в нервной системе.
Только когда эти разделы наук о мозге накопят достаточно данных, наступит эра клинической нейробиологии — науки, которая изучает расстройства нервной системы. Возможно, лет через пятьдесят человечество настолько серьезно продвинется в изучении мозга, что мы наконец-то получим возможность эффективно лечить — а может быть, даже предотвращать — заболевания головного мозга.
Это действительно возможно, в том числе благодаря работам стипендиатов, появлению на свет которых помогли сотрудники ФМИ и Сколтеха, создавшие стипендию по системной биологии (см. врезку). Ведь компания ФМИ уже очень давно занимается не только исследованием табачных продуктов. Это и создание искусственных органов на чипе для научных исследований, и фундаментальные исследования по изучению вторичных метаболитов табака, и даже разработка вакцины от коронавируса. Подробнее о том, чем занимаются в ФМИ, можно прочитать в первой статье цикла «Стипендия по системной биологии: инициатива, которая вдохновляет» [51].
Стипендия ФМИ по системной биологии с каждым годом играет все более важную роль, причем не только в российской, но и в мировой науке.
«Первые стипендии были вручены весной 2016 года, уже почти 5 лет назад, — рассказывает Дмитрий Улупов. — Сегодня я вижу, что программа продолжает устойчиво работать, вызывает интерес в научном сообществе биологов и биоинформатиков, а главное — реально помогает молодым талантливым ученым реализовывать научные проекты в России».
По окончании трехлетней стипендии стипендиаты подготавливают финальную презентацию научных проектов. В 2018 и 2019 годах ее проводили как выездной симпозиум в Научно-исследовательском центре ФМИ в Невшателе (Швейцария), чтобы стипендиаты могли своими глазами увидеть, как ФМИ работает в области системной биологии, какое оборудование и методы использует, познакомиться с результатами наиболее актуальных исследований.
«С прошлого года из-за пандемии “живые” встречи, не говоря уже о зарубежных поездках, практически невозможны, поэтому симпозиум пришлось проводить в виртуальном формате, через Zoom, — рассказывает Дмитрий Улупов. — Тем не менее всем стипендиатам удалось представить результаты своих проектов и обсудить их с учеными Сколтеха и ФМИ, а мои швейцарские коллеги презентовали результаты краудсорсингового исследования микробиоты кишечника человека. Все это прошло в очень дружеской атмосфере».
На этом мы завершаем наш цикл. Надеемся, что вдохновили кого-то из вас подать заявку на стипендиальную программу!
Литература
- Matthew F. Glasser, Timothy S. Coalson, Emma C. Robinson, Carl D. Hacker, John Harwell, et. al.. (2016). A multi-modal parcellation of human cerebral cortex. Nature. 536, 171-178;
- Frederico A.C. Azevedo, Ludmila R.B. Carvalho, Lea T. Grinberg, José Marcelo Farfel, Renata E.L. Ferretti, et. al.. (2009). Equal numbers of neuronal and nonneuronal cells make the human brain an isometrically scaled-up primate brain. J. Comp. Neurol.. 513, 532-541;
- Sarah DeWeerdt. (2019). How to map the brain. Nature. 571, S6-S8;
- David C. Van Essen, Stephen M. Smith, Deanna M. Barch, Timothy E.J. Behrens, Essa Yacoub, Kamil Ugurbil. (2013). The WU-Minn Human Connectome Project: An overview. NeuroImage. 80, 62-79;
- Elizabeth A. Buffalo, J. Anthony Movshon, Robert H. Wurtz. (2019). From basic brain research to treating human brain disorders. Proc Natl Acad Sci USA. 116, 26167-26172;
- Allen Brain Atlas: транскриптом мозга;
- Blue Brain Project: как все связано?;
- Blue brain project: связи и хаос;
- Исследовательская группа Филиппа Хайтовича, или Как биологи работают с большими массивами данных;
- Светлая голова;
- 12 методов в картинках: нейробиология;
- Britton J.W., Frey L.C., Hopp J.L. et al. Electroencephalography (EEG): an introductory text and atlas of normal and abnormal findings in adults, children, and infants. Chicago: American Epilepsy Society, 2016;
- Эдгар Дуглас Эдриан: «всё или ничего»;
- Нейротехнологии Илона Маска;
- Что особенного в мозге человека?;
- Модельные организмы: грызуны;
- Модельные организмы: приматы;
- Anahita Amiri, Gianfilippo Coppola, Soraya Scuderi, Feinan Wu, Tanmoy Roychowdhury, et. al.. (2018). Transcriptome and epigenome landscape of human cortical development modeled in organoids. Science. 362, eaat6720;
- Как искусственные модели головного мозга и омиксные технологии пригодятся в борьбе с аутизмом;
- Что нам стоит мозг построить?..;
- Клеточная, молекулярная и системная биология: как биологи и биоинформатики вместе рисуют общую картину жизни;
- Системная иммунология: секреты Т-клеточного репертуара;
- Путешествие внутрь клеточного ядра, или Системная биология хроматина;
- Atsuko Shinohe, Kenji Hashimoto, Kazuhiko Nakamura, Masatsugu Tsujii, Yasuhide Iwata, et. al.. (2006). Increased serum levels of glutamate in adult patients with autism. Progress in Neuro-Psychopharmacology and Biological Psychiatry. 30, 1472-1477;
- Neil V Morgan, Shawn K Westaway, Jenny E V Morton, Allison Gregory, Paul Gissen, et. al.. (2006). PLA2G6, encoding a phospholipase A2, is mutated in neurodegenerative disorders with high brain iron. Nat Genet. 38, 752-754;
- M. Nei. (2007). The new mutation theory of phenotypic evolution. Proceedings of the National Academy of Sciences. 104, 12235-12242;
- 12 методов в картинках: очистка молекул и разделение смесей;
- Xiling Liu, Dingding Han, Mehmet Somel, Xi Jiang, Haiyang Hu, et. al.. (2016). Disruption of an Evolutionarily Novel Synaptic Expression Pattern in Autism. PLoS Biol. 14, e1002558;
- Binta Diémé, Sylvie Mavel, Hélène Blasco, Gabriele Tripi, Frédérique Bonnet-Brilhault, et. al.. (2015). Metabolomics Study of Urine in Autism Spectrum Disorders Using a Multiplatform Analytical Methodology. J. Proteome Res.. 14, 5273-5282;
- Federica Gevi, Lello Zolla, Stefano Gabriele, Antonio M. Persico. (2016). Urinary metabolomics of young Italian autistic children supports abnormal tryptophan and purine metabolism. Molecular Autism. 7;
- Hitoshi Kuwabara, Hidenori Yamasue, Shinsuke Koike, Hideyuki Inoue, Yuki Kawakubo, et. al.. (2013). Altered Metabolites in the Plasma of Autism Spectrum Disorder: A Capillary Electrophoresis Time-of-Flight Mass Spectroscopy Study. PLoS ONE. 8, e73814;
- Paul R. West, David G. Amaral, Preeti Bais, Alan M. Smith, Laura A. Egnash, et. al.. (2014). Metabolomics as a Tool for Discovery of Biomarkers of Autism Spectrum Disorder in the Blood Plasma of Children. PLoS ONE. 9, e112445;
- A Cheffer, A R G Castillo, J Corrêa-Velloso, M C B Gonçalves, Y Naaldijk, et. al.. (2018). Purinergic system in psychiatric diseases. Mol Psychiatry. 23, 94-106;
- Divya Dwivedi, Kanu Megha, Ritwick Mishra, Pravat K. Mandal. (2020). Glutathione in Brain: Overview of Its Conformations, Functions, Biochemical Characteristics, Quantitation and Potential Therapeutic Role in Brain Disorders. Neurochem Res. 45, 1461-1480;
- Ilia Kurochkin, Ekaterina Khrameeva, Anna Tkachev, Vita Stepanova, Anna Vanyushkina, et. al.. (2019). Metabolome signature of autism in the human prefrontal cortex. Commun Biol. 2;
- R. Anney, L. Klei, D. Pinto, R. Regan, J. Conroy, et. al.. (2010). A genome-wide scan for common alleles affecting risk for autism. Human Molecular Genetics. 19, 4072-4082;
- Sergey V. Ulianov, Semen A. Doronin, Ekaterina E. Khrameeva, Pavel I. Kos, Artem V. Luzhin, et. al.. (2019). Nuclear lamina integrity is required for proper spatial organization of chromatin in Drosophila. Nat Commun. 10;
- Неуловимая архитектура хроматина мухи;
- Лаборатория молекулярных основ эмбриогенеза: от гена к признаку;
- Модельные организмы: ксенопус;
- David S. Latchman. (1999). POU family transcription factors in the nervous system. J. Cell. Physiol.. 179, 126-133;
- Wei ZHANG, Hui Tu LIU. (2002). MAPK signal pathways in the regulation of cell proliferation in mammalian cells. Cell Res. 12, 9-18;
- Matthew E. Carter, Anne Brunet. (2007). FOXO transcription factors. Current Biology. 17, R113-R114;
- Alexander Weiss, Liliana Attisano. (2013). The TGFbeta Superfamily Signaling Pathway. WIREs Dev Biol. 2, 47-63;
- Mohd Farhan, Haitao Wang, Uma Gaur, Peter J. Little, Jiangping Xu, Wenhua Zheng. (2017). FOXO Signaling Pathways as Therapeutic Targets in Cancer. Int. J. Biol. Sci.. 13, 815-827;
- M. B. Tereshina, G. V. Ermakova, A. S. Ivanova, A. G. Zaraisky. (2014). Ras-dva1 small GTPase regulates telencephalon development in Xenopus laevis embryos by controlling Fgf8 and Agr signaling at the anterior border of the neural plate. Biology Open. 3, 192-203;
- Anastasiya S. Ivanova, Daria D. Korotkova, Galina V. Ermakova, Natalia Yu. Martynova, Andrey G. Zaraisky, Maria B. Tereshina. (2018). Ras-dva small GTPases lost during evolution of amniotes regulate regeneration in anamniotes. Sci Rep. 8;
- A. S. Ivanova, D. D. Korotkova, N. Y. Martynova, O. V. Averyanova, A. G. Zaraisky, M. B. Tereshina. (2018). Methods of In Vivo Gene-Specific Knockdown Using Morpholino and Vivo-Morpholino Oligonucleotides. Russ J Bioorg Chem. 44, 358-361;
- Anna Tkachev, Vita Stepanova, Lei Zhang, Ekaterina Khrameeva, Dmitry Zubkov, et. al.. (2019). Differences in lipidome and metabolome organization of prefrontal cortex among human populations. Sci Rep. 9;
- Katarzyna Bozek, Ekaterina E. Khrameeva, Jane Reznick, Damir Omerbašić, Nigel C. Bennett, et. al.. (2017). Lipidome determinants of maximal lifespan in mammals. Sci Rep. 7;
- Стипендия по системной биологии: инициатива, которая вдохновляет.