Путешествие внутрь клеточного ядра, или Системная биология хроматина
07 декабря 2020
Путешествие внутрь клеточного ядра, или Системная биология хроматина
- 2848
- 0
- 12
За последние десятилетия наука о хроматине из чисто описательной цитологической дисциплины превратилась в область системной биологии, активно использующую высокопроизводительное секвенирование для реконструкции пространственной организации генетической «начинки» клеточного ядра.
иллюстрация Любови Колосовской
-
Автор
-
Редакторы
-
Иллюстратор
Развитие технологий высокопроизводительного секвенирования позволило изучить структуру хроматина на ранее невиданном для клеточных биологов уровне — на уровне взаимодействий отдельных участков генома! Четвертая статья цикла «Пятерка по системной биологии» расскажет, как устроена современная наука о хроматине. Проекты стипендиатов посвящены как фундаментальным аспектам динамики хроматина и внутрихроматиновых взаимодействий, так и изучению организации хроматина с помощью высокопроизводительных методов у разных живых организмов.
Пятерка по системной биологии
Победителями Стипендиальной программы по системной, клеточной и молекулярной биологии, организованной российскими аффилированными лицами компании «Филип Моррис Интернэшнл» (ФМИ) на базе Центра наук о жизни Сколковского института науки и технологий, ежегодно становятся пять молодых ученых до 35 лет. Знания по своим темам у стипендиатов, без сомнения, также заслуживают «пятерки» — поэтому спецпроект и получил такое название.
В статьях цикла наши авторы пообщаются со стипендиатами разных лет, профессорами и преподавателями Сколтеха, а также с представителями ФМИ.
Партнер спецпроекта — российские аффилированные лица компании «Филип Моррис Интернэшнл» (ФМИ), которая активно ведет исследования в области биомедицины, системной биологии и биотехнологий.
Наука о хроматине: вчера, сегодня, завтра
Прорыв в исследованиях хроматина произошел около 10 лет назад, и сейчас это междисциплинарное направление, привлекающее лучшие умы во всем мире. В России этим занимается, прежде всего, группа Сергея Разина в Институте биологии гена РАН, первой в России освоившая передовой метод изучения организации хроматина Hi-C. С ней тесно сотрудничает лаборатория Екатерины Храмеевой, старшего преподавателя Сколковского института науки и технологий, получившей стипендию по системной биологии от «Филип Моррис Интернэшнл» (ФМИ) в 2016 году. Чтобы выяснить все интересные подробности, «Биомолекула» поговорила с Екатериной и другими стипендиатами .
Если вы не знаете, что такое «системная биология», советуем ознакомиться со второй статьей из этого спецпроекта: «Клеточная, молекулярная и системная биология: как биологи и биоинформатики вместе рисуют общую картину жизни» [1].
Под термином «хроматин» понимают комплекс геномной ДНК и белков, в виде которого генетический материал упакован в ядре эукариотической клетки (впрочем, сложная упаковка генома присуща не только эукариотам, а, например, еще и археям [2]). Этот термин в 1879 году предложил немецкий цитолог Вальтер Флемминг. Он изучал митоз с помощью светового микроскопа [3] и обнаружил, что в определенный момент в ядре клетки появляются легко визуализируемые нитевидные структуры. Сам Флемминг считал, что введенный им термин надолго не закрепится: «Слово “хроматин” будет существовать, пока его химическая природа остается неизвестной. Пока же им следует обозначать нитевидные, легко окрашиваемые структуры в ядре делящейся клетки [4]».
Вряд ли Флемминг мог предположить, что через более чем сто лет слово «хроматин» не только не исчезнет из словаря клеточной и молекулярной биологии, но и будет регулярно появляться в заголовках статей ведущих научных журналов, а сама наука о хроматине из области цитогенетики вырастет в динамично развивающееся междисциплинарное направление на стыке биологии, химии и информатики.
Но давайте обо всем по порядку.
Бурное изучение химической природы ДНК, начавшееся в первой половине XX века и завершившееся триумфальным открытием структуры ДНК Уотсоном и Криком, положило начало новой главе в изучении хроматина. В 1960-х годах биологи занялись исследованием белковой составляющей хроматина, а также его эпигенетических модификаций (подробнее об эпигенетике читайте в нашей статье «Эпигенетика: невидимый командир генома» [5]).
Однако несмотря на все успехи «охотников за хроматином», в те годы всё еще не было убедительного ответа на «детский» вопрос: как длинная, очень длинная молекула ДНК (у человека длиной 2 м в каждой клетке) умещается в крошечном пространстве клеточного ядра?
Подробнее об истории развитий представлений об организации хроматина, интервью с Леонидом Мирным из Массачусетского технологического института (о нем тоже идет речь в тексте) и о том, что сейчас известно о пространственной организации генома, читайте в нашей статье «Организовать геном: запутанная история гипотез и экспериментов» [6].
Во второй половине XX века специалисты по электронной микроскопии всерьез занялись изучением пространственной организации хроматина в клеточном ядре и достигли в этом существенных успехов. Так, в 1974 году была описана нуклеосома — «диск» из восьми молекул гистонов, на который намотана ДНК длиной примерно 200 пар оснований [7].
Однако попытки идентифицировать с помощью электронной микроскопии в хроматине структуры более высокого порядка дали неоднозначные результаты. Дело в том, что пробоподготовка препаратов для электронной микроскопии приводит к появлению множества артефактов, поэтому ряда структурных элементов хроматина, визуализируемых с помощью электронного микроскопа, в действительности в живой клетке просто нет.
Принципиально новая глава в изучении хроматина открылась на рубеже XX–XXI веков в связи с развитием методов высокопроизводительного секвенирования хроматина. Благодаря приходу биоинформатики в классическую цитологию биологи получили беспрецедентную возможность изучать пространственную организацию хроматина в живой клетке на уровне взаимодействий отдельных участков генома! Новые методы изучения организации хроматина, которые называют C-методами по названию первого разработанного из них — Chromosome Conformation Capture, — основываются на идее, что фрагменты генома, контактирующие друг с другом и, следовательно, располагающиеся рядом, можно сшить в одну молекулу ДНК, которую далее можно отсеквенировать [8] и узнать последовательности взаимодействующих участков.
Один из самых популярных методов для изучения пространственной организации хроматина — Hi-C (подробнее о нем см. во врезке ниже). Он позволяет изучать на полногеномном уровне взаимодействия различных участков генома.

Рисунок 1. Екатерина Храмеева, кандидат биологических наук, старший преподаватель Сколтеха
«Перелом случился с изобретением метода Hi-C в 2009 году, — рассказывает “Биомолекуле” Екатерина Храмеева, стипендиат 2016 года, которая, кстати, сейчас принимает участие в оценивании заявок на стипендию (рис. 1). — Статья с описанием метода Hi-C, вышедшая в Science [9], насчитывает около 3000 цитирований, что очень много. Hi-C — это, возможно, один из самых сложных протоколов в молекулярной биологии, в основном из-за своей многоступенчатости. Каждый отдельный шаг не вызывает запредельных трудностей, но все их нужно выполнить очень аккуратно и не допустить ошибки. И, главное, если всё же допущена ошибка на каком-то из этапов, об этом становится известно только в самом конце пути, когда потрачено много времени и денег на реактивы и секвенирование. Из-за таких трудностей на заре становления метода эксперименты Hi-C умели делать считанные лаборатории в мире (наши коллабораторы — лаборатория Сергея Владимировича Разина в Институте биологии гена РАН — была одной из них), но теперь Hi-C научились делать многие группы, и публикации о хроматине без Hi-C-данных — редкость.
«Биомолекула» опубликовала интереснейшую статью, повествующую о становлении нового подхода к изучению клеточного ядра «из первых рук»: «Новый взгляд на геном: не просто цепочка генов, а трехмерная сеть, интегрирующая функциональные домены ядра» [10]. Ее автор, Сергей Владимирович Разин, стал одним из основателей новой науки о хроматине и пионером этой области в России. Результаты, полученные его лабораторией, неоднократно публиковались в ведущих научных журналах, в частности, в 2017 году Nature опубликовал их исследование, посвященное реорганизации хроматина ооцита после оплодотворения [11], [12]. — прим. автора статьи.
Интересно, что ключевым прорывом стало именно использование высокопроизводительного секвенирования. Методы, похожие на Hi-C, были известны и до 2009 года, но они позволяли расшифровать укладку хроматина только на небольшой части генома, из-за чего их применимость была ограничена. Hi-C же впервые позволил получить полногеномную карту упаковки хроматина в ядре, причем очень точную. Такая карта — это очень большой объем информации, что называется, “большие данные”: огромная матрица, весь геном против всего генома. Поэтому сразу возникла необходимость в разработке новых вычислительных, биоинформатических методов для анализа этих данных, т.к. никакие из существующих не годились. Леонид Мирный и Максим Имакаев из Массачусетского технологического института были пионерами в этом направлении, потом другие группы подключились, в том числе и наша».
Помимо лаборатории Сергея Разина из Институте биологии гена РАН в России есть и другие группы, освоившие метод Hi-C, например, группа Вениамина Фишмана из Новосибирского государственного университета или лаборатория Олега Гусева в Казанском федеральном университете. Лаборатория Екатерины Храмеевой, одного из пионеров новой науки о хроматине в России, анализирует экспериментальные данные Hi-C, поставляемые учеными из ИБГ РАН.
«Сейчас ведутся попытки разработать новый метод, лучше Hi-C, — продолжает Екатерина. — Но пока появляются только улучшенные версии Hi-C с небольшими модификациями, повышающими качество данных на выходе. В целом, развитие идет скорее количественно. В последние годы публикуется всё больше и больше данных Hi-C в разных модельных системах и организмах, так как метод стал более доступным, да и секвенирование упало в цене. А для Hi-C это особенно важно: стоимость секвенирования для Hi-C примерно равна квадрату стоимости секвенирования для любого другого типа эксперимента, поскольку на выходе получаются двумерные данные в виде матрицы, а не одномерные, как для измерения экспрессии генов, например. Работ публикуется много, но мне кажется, что анализ данных не всегда поспевает за их производством: часто снимают только “сливки”, хотя еще столько интересного можно было исследовать!»
На вопрос о потенциальном практическом применении знаний о хроматине, полученных с помощью высокопроизводительных методов, Екатерина отвечает, что нарушения упаковки хроматина приводят к изменениями в экспрессии генов, и, как следствие, к тяжелым заболеваниям — нарушениям развития и онкологическим болезням: нейробластоме, лейкемии, медуллобластоме, глиоме, раку прямой кишки. Эти онкологические заболевания являются многофакторными и у каждого пациента могут быть вызваны поломками в разных местах генома. Таким образом, изучение всего многообразия нарушения упаковки хроматина необходимо для развития персональной медицины, для разработки новых методов лечения и диагностики.
«Если рассуждать более широко, то изучение хроматина позволит нам лучше понять известные и, возможно, определить новые молекулярные механизмы регуляции экспрессии генов, — считает Екатерина Храмеева. — Здесь особенно полезны знания о взаимосвязи структуры и функции, чем наша лаборатория в основном и занимается. Понимание регуляции экспрессии, в свою очередь, важно для идентификации механизмов развития целого спектра заболеваний. Без расшифровки этих механизмов невозможна разработка новых лекарственных препаратов и подходов к лечению».
Область на стыке клеточной биологии и биоинформатики, занимающуюся изучением пространственной организации хроматина, называют 3D-геномикой. Она позволяет взглянуть на многие биологические процессы с совершенно нового ракурса — изменений организации хроматина. Какие изменения в структуре хроматина можно найти в раковых клетках? Отличаются ли по пространственной организации хроматина клетки разных тканей одного организма или клетки разных биологических видов? Как меняется структура хроматина в клеточном ядре при разнообразных видах стресса? Есть в молодой науке о хроматине и огромный простор для улучшения старых и разработки новых алгоритмов, позволяющих получить как можно более точное представление об организации хроматина в разных типах клеток и разных организмах. «Биомолекула» узнала все подробности об этом из первых рук — от молодых российских исследователей, занимающихся хроматином.
Как устроен хроматин мыши и дрозофилы
Биология — пожалуй, самая антропоцентричная из всех естественных наук. Подавляющее большинство научных исследований по биологии, не связанных напрямую с изучением биоразнообразия, так или иначе ставят своей целью выяснение определенных деталей функционирования человеческого организма. Даже если непосредственным объектом изучения является мышь или другой живой организм, зачастую ученые пытаются на нем воспроизвести и детально рассмотреть некоторый аспект биологии Homo sapiens или характерный для него биологический процесс, в том числе патологический. Работы, направленные на исследование разнообразных живых организмов на молекулярном уровне, встречаются существенно реже.
Александра Галицына учится в аспирантуре Центра наук о жизни Сколковского института науки и технологий и в рамках стипендиальной программы ФМИ изучает трехмерную организацию хроматина у дрозофилы и мыши и сравнивает ее с таковой у человека (подробнее о Центре наук о жизни Сколтеха читайте в нашей статье «Биологический наукоград: как работает Центр наук о жизни Сколтеха» [18]).
Почему именно мышь и дрозофила? «Дело в том, что для использования методов машинного обучения и, в особенности, нейронных сетей, требуется большая обучающая выборка. Чем больше случайный шум в данных, тем бóльшим должен быть ее размер. Таким образом, я могу выбрать только те организмы, для которых этот шум достаточно низок, а объем полученных данных — достаточно высок. Конечно, что такое “достаточно” — вопрос спорный, но на данный момент под мои критерии подходят только три организма: человек, мышь и дрозофила (рис. 3)», — объясняет Александра. Однако не исключено, что в ближайшее время список организмов, для которых получены данные о трехмерной организации хроматина с подходящим качеством, будет пополняться. По мнению Александры, ближайший кандидат — нематода Caenorhabditis elegans.
«Биомолекула» ранее писала об одном исследовании хроматина дрозофилы, опубликованном лабораториями Екатерины Храмеевой и Сергея Разина [19].
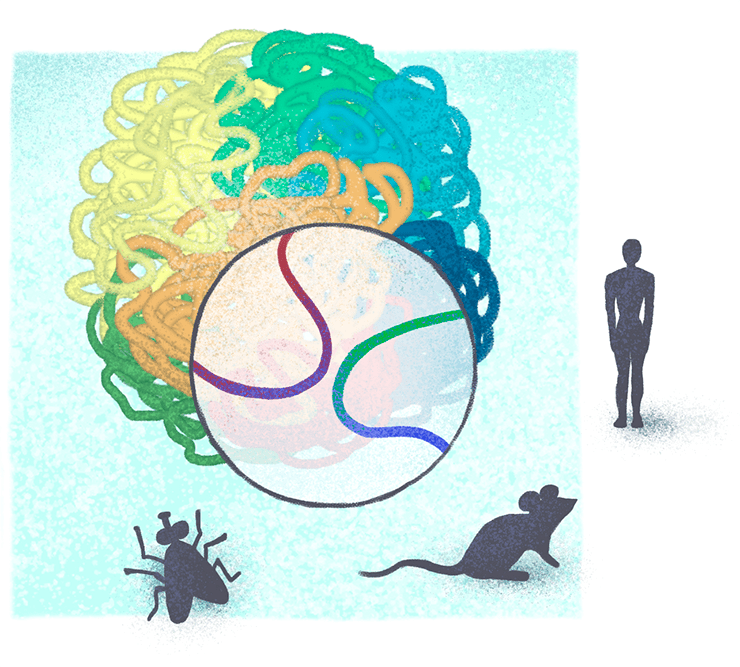
Рисунок 3. Работа Александры Галицыной посвящена изучению и сравнению пространственной организации хроматина у дрозофилы, мыши и человека. Подробности в тексте.
иллюстрация Любови Колосовской
Два важнейших фактора для предсказания пространственной укладки участка генома — это его гуанин-цитозиновый состав и транскрипционная активность, которая тесно связана с открытостью хроматина. Эти два признака определяют, насколько данный участок вообще склонен к взаимодействию с другими участками хроматина. Александра и коллеги смогли найти любопытную закономерность, характерную для хроматина человека и мыши: «Если какой-то локус однажды изменил свое расположение в геноме в ходе эволюции, например, переместился из большой хромосомы общего предка человека и мыши на маленькую или наоборот, его свойства образовывать контакты независимы от локального контекста нового положения, — рассказывает Александра “Биомолекуле”. — Таким образом, мы нашли некоторое общее правило, которое, хотя и одинаково применимо для мыши и человека, но, тем не менее, приводит к различию в структуре хроматина этих двух организмов». Это интересное наблюдение уже опубликовано в журнале PeerJ [20].
С участием Александры также удалось выявить интересные различия между механизмами формирования топологически-ассоциированных доменов у человека и у дрозофилы, на этот раз с помощью применения нейронных сетей. «У млекопитающих за образование хроматиновых доменов в основном отвечают два белка: когезин и CTCF. Согласно одной из основных современных гипотез — модели выпетливания ДНК, — когезин активно формирует петли хроматина и сворачивает ДНК. Однако он не может пройти сквозь расположенные на ДНК барьеры — связанные с ДНК молекулы CTCF, — которые и приводят к образованию границ доменов. Удивительно, но в дрозофиле это не является правилом: CTCF не приводит к столь выраженному образованию границ. Вместо этого действуют другие белковые факторы, в частности, новый потенциальный доминантный инсулятор дрозофилы Chriz. Это удалось показать с помощью применения рекуррентных нейронных сетей, которые учитывают локальный контекст ДНК».
Александра считает, что главной сложностью, с которой она столкнулась во время работы над «хроматиновым» проектом, оказалась нехватка вовсе не научных статей по теме или подходящих исследовательских инструментов, а общения с другими специалистами, исследующими хроматин. «Допустим, я обнаружила новую особенность в трехмерной организации хроматина, но заслуживает ли она внимания? Нашелся хороший метод или способ интерпретации результатов, но достаточно ли его применение обоснованно? Могу ли я сделать напрашивающийся теоретический вывод из моего анализа? На практике все эти вопросы оказываются намного тоньше и сложнее, — признается Александра. — Решение этой проблемы, я бы даже сказала, способ развивать свою мысль, который был хорошо известен и до меня, — это общение с ведущими мировыми специалистами. Часть средств стипендии пошла на то, чтобы такое общение обеспечить. Так, мне удалось рассказать о результатах своих исследований на нескольких конференциях и, благодаря обратной связи международных специалистов, разобраться со многими исследовательскими вопросами и проблемами. Наконец, главной для меня оказалась стажировка в Массачусетском технологическом институте, которая вряд ли случилась бы без поддержки стипендии. Там я познакомилась с последними достижениями теоретической мысли о структуре хроматина, что позволило мне объяснить многие наблюдаемые феномены».
«Биомолекула» спросила у Александры, какие организмы сейчас исследуют на предмет трехмерной организации генома. Иногда неожиданные открытия происходят даже в случае таких, казалось бы, вдоль и поперек изученных организмов . Например, недавно в журнале PNAS появилось сообщение, что РНК-полимераза бактерии Bacillus subtilis (она же — сенная палочка) может выступать в роли барьера для выпетливания ДНК, аналогично тому, как это делает CTCF млекопитающих [21]. «Именно эту модель мы сейчас разрабатываем в применении к моему проекту», — комментирует Александра.
Кстати, у «Биомолекулы» выходит целый цикл статей о модельных организмах, обязательно загляните!
«Что касается немодельных организмов, здесь возможна любая экзотика, — продолжает Александра. — Из примечательного — внушительный американский проект DNA Zoo, в котором с помощью Hi-C собирают геномы и исследуют свойства хроматина десятков видов. Существуют и препринты о хроматине организмов, которые по-настоящему меняют наше представление о возможностях организации хроматина. Например, это работа из лаборатории Йоба Деккера на динофлагелляте Symbiodinium microadriaticum [22]. Хроматин этой водоросли, возможно, находится в кристаллоподобном состоянии, в нем отсутствуют привычные для других организмов компартменты, а домены обладают рядом уникальных и необъяснимых свойств. Думаю, что в этой области в ближайшие годы нас ждут важные открытия и смена ряда гипотез. Наконец, у нас в Сколтехе сейчас занимаются очень любопытным объектом — слизевиком Dictyostelium discoideum. Это одноклеточная амеба, которая в течение своего спороносного цикла претерпевает радикальные изменения поведения и фенотипа и, как мы надеемся, структуры хроматина. Проект выполняется в большой коллаборации, в которой задействованы группы Сергея Владимировича Разина, Михаила Сергеевича Гельфанда и Екатерины Храмеевой из Сколтеха, а также группа Леонида Мирного из Массачусетского технологического института. Я надеюсь, что о подробностях нам удастся рассказать в готовящейся работе».
Подробнее о лаборатории Михаила Гельфанда в Сколтехе читайте в нашей статье «Биоинформатика в Сколтехе: как программисты и биоинформатики вместе делают науку» [23] из цикла о Центре наук о жизни.
Моделируя хроматин
Биологи привыкли рассматривать хроматин как носитель наследственной информации, опуская, что он собой представляет с точки зрения физики. В то же время для изучения пространственной организации хроматина именно свежий взгляд со стороны физики может дать весьма интересные результаты.
Павел Кос, сотрудник кафедры физики полимеров и кристаллов физического факультета МГУ, изучает не только трехмерную конформацию хроматина саму по себе, но и моделирует кинетику ее поведения с помощью физического подхода. «Если говорить грубо, то хроматин является длинной полимерной цепью. О поведении длинных полимерных цепей в физике полимеров известно довольно много (рис. 4). Однако далеко не всегда поведение полимерной системы может быть описано аналитически, и в этом случае используют компьютерное моделирование», — рассказывает Павел «Биомолекуле».
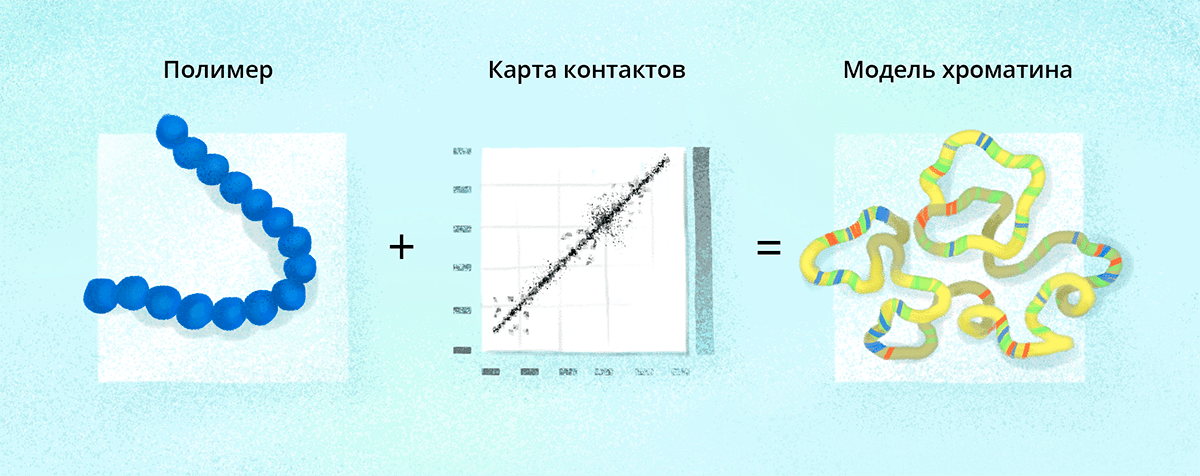
Рисунок 4. Моделируя хроматин, Павел в качестве исходной модели использовал полимерную цепь, представленную в виде шариков на пружине. Длина цепи соответствует хромосоме в масштабе 1 шарик к 10 тысячам пар оснований. Затем, используя экспериментальную информацию о контактах между участками хромосомы в одиночной клетке, группа Павла получила трехмерную структуру хромосомы. Далее исследователи раскрасили ее в соответствии с экспериментальными данными об активности хроматина. Это позволило изучить распределение активного и неактивного хроматина в трехмерном пространстве внутри хромосомной территории в клеточном ядре. Оказалось, что некоторые элементы укладки хроматина повторяются в различных клетках, несмотря на большую межклеточную вариабельность пространственной организации хроматина.
иллюстрация Любови Колосовской по наброску Павла Коса
Павел отмечает, что результаты компьютерного моделирования необходимо подтверждать с помощью экспериментов: «При моделировании изучаемый эффект воспроизводится в идеальном окружении, то есть с использованием выбранного набора факторов. Реальность, как правило, далека от идеального случая».
Экспериментальные результаты, использованные в работе Павла [25], предоставляла лаборатория Сергея Владимировича Разина из ИБГ РАН. «Из экспериментальных данных мы использовали информацию о контактах между разными участками хроматина, а также тип этих участков. Эта информация была перенесена в модель, — объясняет Павел. — При построении модели любой системы мы всегда ориентируемся на теоретические предсказания и экспериментальные эффекты, которые хотелось бы описать. Персистентная длина (жесткость полимерной цепи), параметры взаимодействия между мономерными звеньями и растворителем, а также технические параметры были взяты преимущественно из литературы. В некоторых случаях требовались дополнительные исследования поведения системы в зависимости от конкретного параметра, по результатам которых и выбирались оптимальные значения. В ходе работ было также проведено множество положительных и отрицательных контрольных тестов, чтобы подтвердить выявленные эффекты. Все многочисленные сложные расчеты выполнялись на суперкомпьютере “Ломоносов-2”, для расчета одной системы использовалось 84–140 ядер, а время расчета одной системы составляло до шести суток».
Рассказывая о результатах своей работы в рамках стипендиальной программы ФМИ, Павел отмечает:
«Во-первых, мы разработали мощный инструмент для построения трехмерной архитектуры хроматина в ядре клетки и подтвердили его состоятельность на большом массиве экспериментальных данных. Он позволяет изучать не только статику и кинетику, но также и динамику хроматина. Это очень ценно, так как хроматин подвижен, и многие эффекты невозможно описать без учета этого. Во-вторых, в ходе исследований было установлено, что, несмотря на большую межклеточную вариабельность, ряд мотивов укладки хроматина воспроизводится в отдельных клетках. Иначе говоря, коллективные особенности трехмерной архитектуры проявляются в одиночных клетках. На практике гипотетически результаты моей работы могут позволить выявить место поломки регуляции транскрипции и, как минимум, объяснить причину, а, как максимум, устранить такую поломку. Однако такие рассуждения неизбежно приводят нас к этическим вопросам. Дело в том, что даже при наличии надежного инструмента редактирования генома, неясным остается, до каких пор мы можем его использовать: тяжелые генетические заболевания, легкие заболевания, косметические изменения. Чем меньше необходимость изменений для нормальной жизни, тем больше к ним вопросов».
Заключение
Что же ждет науку о хроматине в ближайшие несколько лет? «Я вижу большой потенциал в развитии методов анализа, — продолжает делиться с “Биомолекулой” Екатерина Храмеева. — Данных по хроматину уже много и будет еще больше, при этом анализ отстает. Надо думать, что мы дополнительно можем полезного извлечь из этих данных, если копнем глубже и будем более аккуратными в вычислениях. Уверена, что очень многое можно сделать. Мы смотрим в направлении методов машинного обучения, нейронных сетей, пробуем применять их к анализу хроматиновых данных, а также пытаемся переносить математические методы из других областей науки на хроматин [26].
Что касается экспериментальной части, есть мнение, что Hi-C скоро отойдет на второй план, и его заменят принципиально другие методы, основанные на микроскопии. Действительно, это направление сейчас бурно развивается, появляются очень интересные и перспективные методы. Но пока они уступают Hi-C: либо не позволяют получить полногеномную картину, либо слишком трудоемкие. Посмотрим, удастся ли им победить эти проблемы и вытеснить Hi-C по популярности».
Применение новых методов для изучения структуры хроматина открывает широчайшие возможности для исследования клеток разных типов и организмов, в том числе клеток сложнейшего органа — головного мозга. Например, Екатерина Храмеева использует метод Hi-C для изучения мозга на уровне отдельных нейронов. Следующая статья нашего спецпроекта расскажет о проектах по изучению системной нейробиологии, которые ведутся в рамках стипендии ФМИ на базе Сколтеха.
Литература
- Клеточная, молекулярная и системная биология: как биологи и биоинформатики вместе рисуют общую картину жизни;
- Из чего же сделан хроматин архей?;
- 12 методов в картинках: микроскопия;
- Ute Deichmann. (2015). Chromatin: Its history, current research, and the seminal researchers and their philosophy. Perspectives in Biology and Medicine. 58, 143-164;
- Эпигенетика: невидимый командир генома;
- Организовать геном: запутанная история гипотез и экспериментов;
- A. L. Olins, D. E. Olins. (1974). Spheroid Chromatin Units (ngr Bodies). Science. 183, 330-332;
- 12 методов в картинках: секвенирование нуклеиновых кислот;
- E. Lieberman-Aiden, N. L. van Berkum, L. Williams, M. Imakaev, T. Ragoczy, et. al.. (2009). Comprehensive Mapping of Long-Range Interactions Reveals Folding Principles of the Human Genome. Science. 326, 289-293;
- Новый взгляд на геном: не просто цепочка генов, а трехмерная сеть, интегрирующая функциональные домены ядра;
- Половая жизнь хроматина;
- Ilya M. Flyamer, Johanna Gassler, Maxim Imakaev, Hugo B. Brandão, Sergey V. Ulianov, et. al.. (2017). Single-nucleus Hi-C reveals unique chromatin reorganization at oocyte-to-zygote transition. Nature. 544, 110-114;
- Quentin Szabo, Daniel Jost, Jia-Ming Chang, Diego I. Cattoni, Giorgio L. Papadopoulos, et. al.. (2018). TADs are 3D structural units of higher-order chromosome organization in Drosophila. Sci. Adv.. 4, eaar8082;
- Shana J. Sturla, Alan R. Boobis, Rex E. FitzGerald, Julia Hoeng, Robert J. Kavlock, et. al.. (2014). Systems Toxicology: From Basic Research to Risk Assessment. Chem. Res. Toxicol.. 27, 314-329;
- Нанопоровое секвенирование: на пороге третьей геномной революции;
- Deepak Babu, Melissa J Fullwood. (2015). 3D genome organization in health and disease: emerging opportunities in cancer translational medicine. Nucleus. 6, 382-393;
- Mohamed-Amin Choukrallah, PMI R&D, Philip Morris Products S.A., Neuchâtel, Switzerland. (2019). Computational Epigenomics: From Fundamental Research to Disease Prediction and Risk Assessment. Computational Biology. 101-118;
- Биологический наукоград: как работает Центр наук о жизни Сколтеха;
- Ядерная ламина и пространственная организация хроматина у дрозофилы;
- Margarita D. Samborskaia, Aleksandra Galitsyna, Ilya Pletenev, Anna Trofimova, Andrey A. Mironov, et. al.. (2020). Cumulative contact frequency of a chromatin region is an intrinsic property linked to its function. PeerJ. 8, e9566;
- Hugo B. Brandão, Payel Paul, Aafke A. van den Berg, David Z. Rudner, Xindan Wang, Leonid A. Mirny. (2019). RNA polymerases as moving barriers to condensin loop extrusion. Proc Natl Acad Sci USA. 116, 20489-20499;
- Ankita Nand, Ye Zhan, Octavio R. Salazar, Manuel Aranda, Christian R. Voolstra, Job Dekker Chromosome-scale assembly of the coral endosymbiont Symbiodinium microadriaticum genome provides insight into the unique biology of dinoflagellate chromosomes — Cold Spring Harbor Laboratory;
- Биоинформатика в Сколтехе: как программисты и биологи вместе делают науку;
- Стипендия по системной биологии: инициатива, которая вдохновляет;
- Sergey V. Ulianov, Semen A. Doronin, Ekaterina E. Khrameeva, Pavel I. Kos, Artem V. Luzhin, et. al.. (2019). Nuclear lamina integrity is required for proper spatial organization of chromatin in Drosophila. Nat Commun. 10;
- Sergey V. Ulianov, Ekaterina E. Khrameeva, Alexey A. Gavrilov, Ilya M. Flyamer, Pavel Kos, et. al.. (2016). Active chromatin and transcription play a key role in chromosome partitioning into topologically associating domains. Genome Res.. 26, 70-84.