Что нам стоит мозг построить?..
05 ноября 2019
Что нам стоит мозг построить?..
- 984
- 0
- 10
«Сенсация нейробиологии, достойная публикации в Nature», дубль №... (изображение не несет цели кого-либо оскорбить, все совпадения случайны, расслабьтесь, это просто мем)
коллаж автора статьи
-
Автор
-
Редакторы
Темы
Статья на конкурс «био/мол/текст»: Последние несколько лет при упоминании нейросетей на ум обычно приходит что-то «компьютерное». А как же нейронные сети нашего с вами мозга? Не всем известно, что ученые активно работают над созданием подобий нервной системы человека, иногда демонстрируя необычные подходы и обнадеживающие результаты. Нет, никаких этических проблем и «монстров Франкенштейна» — только современная наука, проверенные, перспективные методы и критический взгляд. Предлагаю вашему вниманию чуть больше, чем новость о недавно созданной функционирующей трехмерной модели человеческой нейронной сети, и чуть меньше, чем обзор других подобных исследований. Мы разберемся, зачем все это нужно, что уже достигнуто, и что господам ученым еще нужно доработать, прежде чем делать громкие заявления.
Конкурс «био/мол/текст»-2019
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2019.

Генеральный спонсор конкурса и партнер номинации «Сколтех» — Центр наук о жизни Сколтеха.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий выступила компания BioVitrum.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Если вы «вобьете» в поисковую строку базы данных PubMed “neural network”, то получите почти 66 тысяч результатов (рис. 1). После прочтения названий первых ста статей становится очевидным, что в англоязычной литературе под этим словосочетанием чаще понимают искусственные нейронные сети (ИНС).
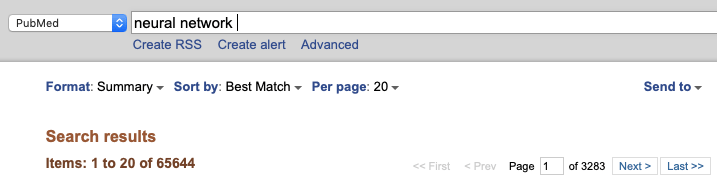
Рисунок 1. Что «спросить» у PubMed’a, если интересуют математические модели и deep learning
скриншот с компьютера вашего покорного слуги, 12.09.2019 г.
Чтобы обнаружить исследования, связанные с биологическими нейронными сетями, стоит сузить круг поиска, скажем, так: (рис. 2).
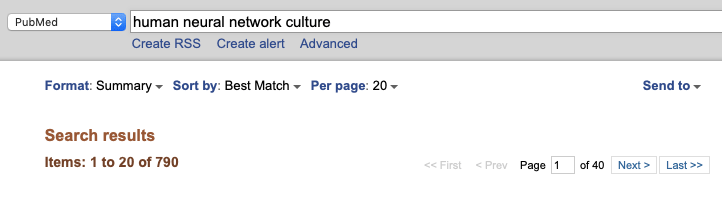
Рисунок 2. Что «спросить» у PubMed’a, если интересуют нейротехнологии (один из вариантов)
скриншот с компьютера вашего покорного слуги, 12.09.2019 г.
Всего около 800 результатов (в 82,5 раз меньше!), зато речь по большей части о биологических объектах. ИНС уже сегодня используют для редактирования фотографий, разработки лекарств, анализа и прогнозирования финансовой отчетности и прочего. Пока они не начали семимильными шагами исследовать мозг своих создателей, который на данный момент используется для куда большего количества полезных и интересных вещей, ученым предстоит еще много работы, потому что, как это часто бывает в науке, новое открытие приносит больше вопросов, чем ответов. Действительно, наши знания об устройстве нервной системы, о высшей нервной деятельности, с одной стороны, постоянно пополняются. С другой же — они пока не позволяют сделать выводы о том, насколько всё это соотносится с работой ИНС, не дают целостного, лишенного белых пятен представления о формировании памяти, рисках развития психиатрических и нейродегенеративных заболеваний и методах их лечения, а также о пределах возможностей здорового мозга. И это лишь часть вопросов нейробиологии, актуальность которых не нуждается в доказательстве.
За последние 20 лет немалые успехи в перечисленных сферах интереса были достигнуты с помощью нейротехнологий. Они же открывают обнадеживающие перспективы как для фундаментальной науки, так и для клиники. Одно из популярных направлений нейротехнологий — создание в лаборатории подобий биологических нейронных сетей. В лучших научных журналах каждый год выходит по нескольку статей о таких исследованиях, не говоря уже об изданиях, редакторы которых проводят менее жесткий отбор. И вот интересующийся человек в обрушившемся на него потоке информации (менее бурном, чем на рис. 1) случайно или намеренно находит следующую статью: «Функциональные и устойчивые трехмерные модели нейронной сети человека из плюрипотентных стволовых клеток». Среди читателей, столкнувшихся с таким заголовком, найдутся те, кто подумают, что ученые вот-вот вырастят мозг в пробирке или посуде покрупнее, а также те, кто слышали о чем-то «похожем» еще в 2015 году [1]. Давайте разберемся, в чем тут суть и чем это исследование примечательно среди всех прочих. Для особо пытливых умов — ссылка на оригинальную статью, опубликованную в 2018 году Уильямом Кантли (William L. Cantley) и соавторами в журнале ACS Biomaterials Science & Engineering [2], который сообщает читателям о последних достижениях в биотехнологии. Прежде чем приступить к обсуждению методов и результатов, предлагаю пройти по стопам авторов статьи, чтобы понять, какие предпосылки и размышления привели их и некоторых других ученых к созданию 3D-модели биологической нейросети.
В чем проблема?
Нужда рождает изобретение, изобретение — две нужды.
Зачем вообще что-то конструировать, если мы хотим изучать нервную систему человека? Дело в том, что результативность исследования, возможность воспроизводимости и правильной интерпретации результатов во многом зависят от используемой модели. Какой бы современной и многообещающей ни была методика, если модельный объект выбран неправильно — ценность нашей работы сомнительна.
Почему бы тогда сразу не проводить исследование на человеке? Неинвазивные методы, такие как фМРТ и ЭЭГ, широко используются в медицине, но не позволяют выйти на уровень одиночных клеток, что было бы интересно на данном этапе развития нейробиологии. Выход — имплантация нейротрофических электродов. А если мы хотим избежать инвазивных процедур, которые влияют на состояние исследуемого организма и для которых сложно найти добровольцев и получить разрешение? Для этого используют животные модели или человеческие модели in vitro.
В силу этических причин и удобства работы многие исследования в биологии и биомедицине проводят именно на животных. Но каковы пределы экстраполяции полученных результатов на человека? Вспомним очевидное: поведение и «умственные способности» грызунов, врановых птиц и приматов (популярных модельных объектов в нейробиологии) несколько отличаются от человеческих. Между тем, специфические функции живых систем нередко реализуются за счет особенностей строения последних. К примеру, опубликованное в 2018 году исследование с использованием постмортального среза человеческого мозга показало наличие неизвестного ранее (!) подтипа нейронов, не характерного для грызунов [3]. Согласно полученным данным, они блокируют возбуждающие импульсы, направленные к пирамидальным нейронам, которые у человека изначально более возбудимы, чем у мышей и крыс [4]. Вероятно, вновь открытый подтип клеток в нашей коре участвует в тонкой регуляции, предохраняющей нас от «перегрузки», которая не угрожает «классическим» модельным объектам, — вот и новое направление в фундаментальной науке.
Что касается применения животных в медицинских исследованиях, здесь также есть проблемы. Сегодня все новые методы лечения до испытания на добровольцах тестируют на животных, но менее 10% из них проходят первую фазу клинических исследований [5], что значительно замедляет темпы развития современной медицины. Вероятно, это связано с тем, что ответы на некоторые экспериментальные воздействия специфичны не только для вида, но и для линии — ученый должен понимать, что иногда результаты, полученные с использованием животных из его вивария, он не сможет экстраполировать даже на их собратьев из природных сообществ, не говоря уже о человеке. Все эти факты заставили ученых, в том числе коллектив Кантли, задуматься о лучшей модели.
Новая надежда
Нет ничего важнее, чем понимать истоки изобретения, — и, по-моему, они гораздо интереснее самих изобретений.
...а еще это помогает не повторить чужие ошибки, используя чужие достижения (примечание автора статьи)
Вот здесь мы и подходим к клеточным и тканевым культурам (про них точно нужно почитать, иначе будет непонятно [6]). Более очевидным решением будет забор материала у донора/пациента для поддержания в культуре и дальнейших исследований. Мы можем воздействовать на клетки мозга, не угрожая жизни и здоровью человека и не нарушая этических норм. Что, и теперь есть проблемы? Да, и это решение не идеально. Во-первых, клетки зачастую либо повреждаются при заборе, либо взяты посмертно, поэтому уже есть отличия от in vivo. Во-вторых, «взрослые» (дифференцированные) нейроны — постмитотические клетки, иначе говоря, утратившие способность к делению. А это значит, что у них ограничены срок жизни в культуре и способность к экспансии. К тому же тонкие срезы мозга и культуры в висячей капле мало подвержены некоторым экспериментальным вмешательствам, так как являются закрытыми системами [7]. Проще говоря, если нарушить какие-то из взаимодействий элементов, вся система развалится, как и наш эксперимент.
...или hanging drop cultures — это метод выращивания ткани в небольшой капле среды, подвешенной на перевернутом часовом стекле за счет поверхностного натяжения; помогает снизить соотношение площадь поверхности / объем и испарение.
На помощь пришли человеческие индуцированные плюрипотентные стволовые клетки (чИПСК, далее ИПСК ). Для их получения не нужны эмбрионы (как для эмбриональных стволовых клеток (ЭСК)) и опыты на животных, их можно превратить в любой тип клеток, кроме клеток внезародышевых структур, они делятся, и, что не менее важно, накопление знаний о работе с ними совместными усилиями лабораторий по всему миру позволяет постепенно стандартизировать методики.
ИПСК и ЭСК имеют одинаковые потенции. Они могут дать начало всем типам клеток взрослого организма. Но первые получены из дифференцированных клеток донора (здесь — человека) путем «отката настроек», а вторые — из бластоцисты (еще до прикрепления зародыша к матке). Подробнее об этом можно почитать на «Биомолекуле» [8].
В настоящее время известны некоторые молекулярные и физические факторы, влияющие на дифференциацию, существуют протоколы и коммерческие материалы для применения ИПСК в изучении различных типов клеток и их физиологических и патологических состояний. Используются они и в создании биологических нейронных сетей. Группа Уильяма Кантли не первая и не последняя из прибегнувших к этой технологии. Но современные подходы не делают поставленную ими задачу менее трудоемкой и амбициозной. С какими еще сложностями ученым предстояло столкнуться?
Все дело в устройстве нашей нервной ткани [9]. Она состоит не только из нейронов, но также нейросекреторных и вспомогательных глиальных клеток, выполняющих трофическую, барьерную, защитную и другие функции. Нейроны, в свою очередь, являются уязвимыми компонентами системы. Неспособные к делению и выполняющие основные функции нервной системы, они не могут работать на износ — они, сами и при помощи глии, должны поддерживать себя в хорошей форме. А для «питания» им нужна исключительно глюкоза, при этом в достаточном количестве, так как они с трудом переносят даже незначительный ее дефицит [10].
Таким образом, при создании культуры нейронной сети, необходимо учитывать:
- жесткость матрицы;
- микрокапиллярные процессы (оседание клеток в поры каркаса, доставка им питательных веществ и кислорода);
- наличие в среде необходимых молекулярных факторов;
- температуру и газовый состав;
- плотность высевания клеток.
Что сейчас? Как это проверили? (и почему этого мало)
Теперь, наконец, мы можем перейти к обсуждению статьи 2018 года о «функциональных и устойчивых трехмерных моделях», упомянутой во введении [2]. Целью исследования было создание биологически релевантных и в то же время долго функционирующих моделей человеческой нейронной сети с помощью ИПСК (подробнее о первом репрограммировании клеток можно почитать в статье «Нобелевская премия по физиологии и медицине (2012): индуцированные стволовые клетки» [11]). Методика основывается на предыдущей работе того же коллектива, проведенной с ЭСК грызунов [12], но существенно улучшена. ИПСК получили из фибробластов небольшого участка кожи, перепрограммированных обратно в стволовое состояние с помощью ретровирусного вектора, несущего гены Oct3/4, Sox2, Klf4 и c-Myc, — «коктейль Яманаки». Сейчас эта процедура стандартизована, ученые могут получить ИПСК из специальных биобанков или самостоятельно в лаборатории. Конечно, это не так просто (только 0,1–1% обработанных «коктейлем» клеток станут стволовыми), но согласитесь, звучит безобиднее, чем «биопсия нервной ткани» и «вживление электродов». Для сравнения из этих же клеток создали двумерную нейронную сеть. Кроме того, предшественники ИПСК были взяты не только у двух здоровых доноров, но и у страдающих от болезней Альцгеймера (БА) и Паркинсона (БП) (всего четыре линии клеток). Поскольку сейчас точно не известно, какой именно фактор (или факторы) запускает пока что необратимый процесс развития этих заболеваний, нельзя исключать генетическую составляющую (об этих болезнях есть обстоятельные статьи на «Биомолекуле», например «На руинах памяти: настоящее и будущее болезни Альцгеймера» [13] и «Болезнь Паркинсона: что изучать? как изучать?» [14]). В связи с этим ученые и медики заинтересованы в создании не только адекватной «человеческой» модели, но и в пациент-специфической. Фибробласты больных доноров были перепрограммированы так же, как описано выше. Авторы статьи основывались на данных других коллективов об использовании ИПСК для создания моделей нейродегенеративных заболеваний. Согласно этой информации, после дифференциации нейроны проявляли соответствующие признаки: повышенный уровень бета-амилоида [15] и фосфорилированного тау-белка, характерных для болезни Альцгеймера ([16], [17]) и митохондриальную дисфункцию, развивающуюся при паркинсонизме [18]. Это обнадеживает, но не удивляет: если мутации, ассоциируемые с развитием упомянутых болезней (например, ApoE4, Tom40 для БА [19] и G2019S (мутация LRRK2) для БП [20]), есть у донора клеток, то, очевидно, они будут и у модели in vitro. Это дает целостную, напоминающую школьную генетику картину: неправильный ген → неправильный фермент → неправильное всё, что связано с катализируемыми ими реакциями. То есть, если всё так и работает, с помощью «устойчиво функционирующих трехмерных нейронных сетей» можно будет изучать этиологию, патогенез и методы лечения не только этих заболеваний.
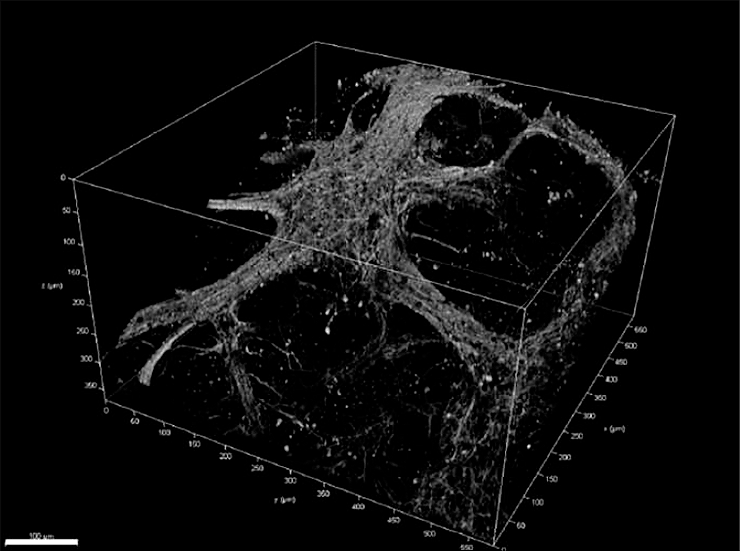
Теперь, когда клетки получены и ждали своего часа, ученые занялись архитектурой будущей нейронной сети. Они создали скаффолд, наилучший русскоязычный синоним к которому в данном случае — каркас. Основу изготовили из фиброина шелка, который выбрали из-за биосовместимости и получили из коконов Bombyx mori. Затем ее обработали кристаллами NaCl для создания микроскопических ниш, предназначенных для ИПСК (в оригинале — sponge-like structure). После этого основу покрыли поли-L-орнитином и ламиниом — это полимеры, способствующие клеточной адгезии (прикреплению) [22], а также дифференциации и делению клеток. Примечательна форма скаффолда, напоминающая пончик, — в центре намеренно было сделано «окно» 2 мм в диаметре, тогда как общий диаметр каркаса 6 мм (рис. 3). Оно было нужно, чтобы увидеть, что на «каркасах» действительно образуется трехмерная нейронная сеть. Для тех, кто заинтересовался: один из соавторов (David L. Kaplan) ранее опубликовал подробную методику создания прототипа этого скаффолда, но центрального окна в нем не было [23].
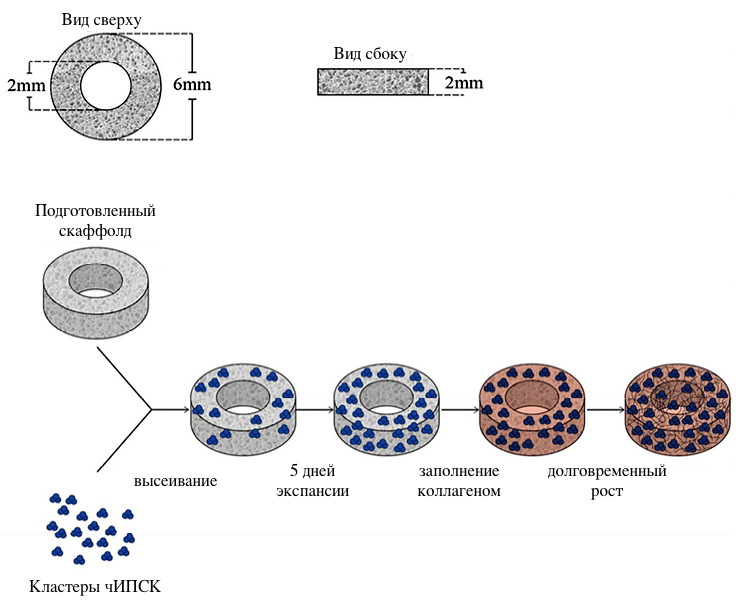
Рисунок 3. Дизайн скаффолда и схема эксперимента. Первоначальная концентрация ИПСК: 5×105 клеток/скаффолд.
[2], рисунок адаптирован
Следующей задачей было «заселение» клеток. Оптимальная «плотность населения» — это такая, при которой культура растет достаточно быстро, но при этом клетки не мешают друг другу жить. Ученым пришлось заселить 16 пробных скаффолдов (4 варианта концентрации × 4 возраста клеток). Через неделю оптимальная плотность была определена. После этого одновременно были созданы трехмерные культуры из клеток, полученных от здоровых доноров и страдающих болезнями Альцгеймера и Паркинсона. Двумерную культуру, также ранее упомянутую, вырастили из «здоровых» клеток на шестилуночном планшете, покрытом теми же биоадгезивными полимерами. Будущие нейронные сети сначала росли в специальной питательной среде для ИПСК. Спустя пять дней скаффолды трехмерных культур заполнили коллагеновым гидрогелем, имитирующим внеклеточный матрикс [24], а среду заменили на специально разработанную для нервной ткани.
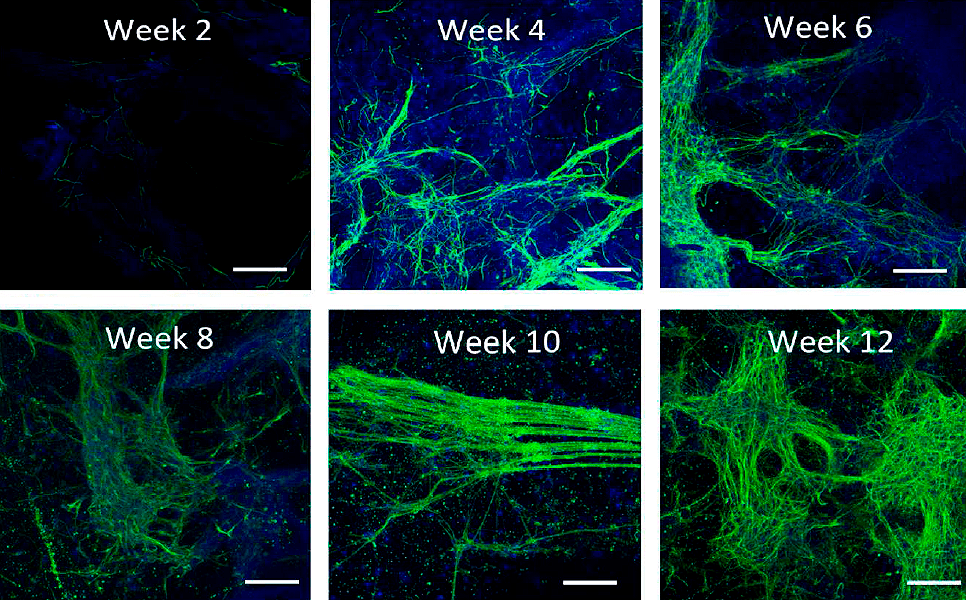
Спустя восемь недель нейронные сети смело можно было назвать трехмерными (рис. 4), при этом важно отметить, что ИПСК здесь не проходят стадию эмбриоидного тельца — плотного сферического образования, внутренние клетки которого могут быть подвержены гипоксии при его разрастании (что, кстати, напоминает условия, создающиеся в опухоли [25]). Это выгодно отличает данную работу от одной из предыдущих [1] еще и возможностью визуализации аксонов.
Между тем, стадия эмбриоидного тельца может быть полезна при моделировании тех же опухолей или ранних стадий развития мозга. Пусть эти частные случаи не были целью авторов данного исследования, не стоит сбрасывать со счетов другие подходы. Каждой проблеме — своя модель.
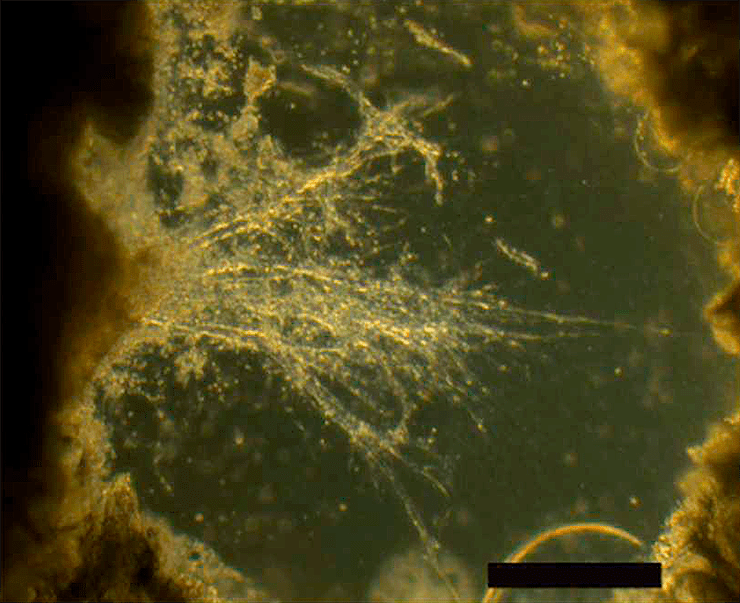
Рисунок 4. Пример успешного роста в центральном окне через восемь недель после заливки коллагеном. Сети так быстро растут... Масштабная линейка: 500 мкм (то есть 0,5 мм).
Затем необходимо было убедиться, что из стволовых клеток получаются нужные нам нейроны и глия. Проверить это можно разными способами и желательно всеми сразу (чтобы напечататься в хорошем журнале). Из исходных плюрипотентных стволовых клеток в нашем организме получаются клеточные типы, которые можно отличить по тому, какие гены в них активны, — а значит и по тому, какие молекулы они синтезируют. Для нервных клеток это специфические белки цитоскелета (например бета-3-тубулин), нейромедиаторы с их рецепторами и еще маркеры происхождения из эктодермы (внешнего зародышевого листка, из которого образуется нервная система, покровы и др.). Первые обнаружили с помощью иммуноцитохимии и конфокальной микроскопии, а на основе полученных данных построили компьютерную модель (рис. 5а и 5б). Для анализа активности генов использовали полимеразную цепную реакцию в режиме реального времени (подробнее об этих методах можно почитать в статьях «12 методов в картинках: иммунологические технологии» [26], «12 методов в картинках: микроскопия» [27] и «12 методов в картинках: полимеразная цепная реакция» [28] на «Биомолекуле»). Выяснилось, что спустя 2, 6 и 10 недель развития нужные гены стали активнее в трехмерной нейросети, чем в двумерной. А еще в двумерных нейросетях был более высокий уровень экспрессии генов-маркеров стволовых клеток или клеток энтодермы. То есть в 2D-варианте ИПСК дифференцировались медленнее или не в те клеточные типы, которые нужны. Например, на участках соприкосновения с лабораторной посудой, которых было немало у двумерной культуры, были замечены несвойственные нервной системе клетки (даже сокращающиеся) — кардиомиоциты! Видимо, свою роль сыграла та самая «жесткость матрицы».
И в двумерном, и в трехмерном вариантах обнаруживали нейроны, вырабатывающие ферменты для синтеза нейромедиаторов (дофамина [29], ацетилхолина [30], серотонина [31]), а также имеющие рецепторы к глутамату [32], причем последний маркер был более выражен в 3D-нейросети. Все это характерно для возбуждающих нейронов. Клеток, имеющих рецепторы к тормозному медиатору — гамма-аминомасляной кислоте [33], — почти не было в обоих вариантах нейронной сети, что может говорить о незначительном количестве тормозных нейронов. Это подтвердила функциональная диагностика. Помимо нервных клеток обнаружили астроциты: их наличие подтвердили с помощью отслеживания экспрессии и визуализации глиального фибриллярного кислого белка (GFAP). Эти клетки помогают нейронам получать питательные вещества из крови и мигрировать на ранних стадиях образования органов, заслоняют их собой от патогенов и токсинов (ГЭБ), а также осуществляют захват нейромедиаторов из синаптической щели, чтобы вовремя прекратить передачу сигнала . Если образно, то нейрон — это неприспособленный к жизни гений-трудоголик, который выходит из равновесия при любых потрясениях, а астроцит — его мама, которая живет с ним до старости, обеспечивает ему бытовой комфорт и надеется, что сыночка когда-нибудь получит Нобелевскую. Но не стоит забывать, что у нейрона есть и другие «родственники»: олигодендроциты, эпендимная глия и микроглия, без которых не обойтись in vivo, и они не были обнаружены в данной нейронной сети.
Завершение, или терминация, — важный и подчас недооцениваемый элемент многих, если не любых биологических процессов. То же можно сказать о торможении в нервной системе.
А что с культурами, выращенными из ИПСК больных доноров? При сравнении со «здоровыми» нейронными сетями через три месяца после начала развития в них обнаружены те же типы клеток с небольшими вариациями по уровню активности некоторых генов. Удивительно это или нет — бета-амилоидные бляшки или клубки нейрофибрилл тау-белка не были выявлены на этом сроке развития. Неужели экспериментаторы где-то напортачили? Не исключено, но если присмотреться к формулировкам в их статье и в статьях, на которые они ссылались, можно заметить, что их предшественники не говорили напрямую у бляшках и клубках — только о значительно более высоком уровне бета-амилоида и фосфорилированного тау-белка в случае с болезнью Альцгеймера [16], а также биохимических изменениях и генетических особенностях, связанных с паркинсонизмом ([18], [20]). Этого коллектив Кантли не проверил (или не опубликовал результаты), что несколько досадно, но показал, что выбранная методика подходит для создания функционирующей нейронной сети почти без нарушений дифференциации ИПСК, даже если они получены не от здорового донора.
Хорошая модель должна не только иметь нужные компоненты, но и соответствующее «поведение». Время экспериментировать! Ученые регистрировали локальный потенциал на мембране (электрохимические процессы) и кальциевый статус клетки.
По кальциевым каналам можно обнаружить синапсы; перемещение кальция между частями клетки, между клеткой и внешней средой важно для передачи сигнала; подробнее о работе химических синапсов можно... посмотреть в комиксе «Как происходит выделение нейромедиатора» [34].
Ответы на электрическое раздражение и фармакологические препараты — блокаторы мембранных каналов и антагонисты рецепторов — соответствуют полученным данным об активности генов. Значит, нейроны действительно синтезируют перечисленные нейромедиаторы и рецепторы. Ответы на эти воздействия, а также спонтанную активность ученые наблюдали на протяжении девяти месяцев! Для клеточной культуры из дифференцированных постмитотических клеток это достаточно большой срок.
Заключение
Стоит отметить, что в нашей нервной системе гораздо больше типов нейронов и глиальных клеток, функционирует она куда дольше и взаимодействия ее элементов сложнее по сравнению с «функционирующими и устойчивыми трехмерными моделями» [2]. Несомненно, это лишь шаг на пути к созданию живой системы, отражающей строение человеческого мозга и многообразие протекающих в нем процессов, закрепившихся в ходе длительного и непреклонного естественного отбора.
Но у подхода Уильяма Кантли (W.L. Cantley) и соавторов есть важные преимущества по сравнению с предыдущими. В первую очередь, отказ от эмбриоидного тельца и других сферических образований в пользу пористого каркаса, на котором клетки проходили начальные этапы экспансии и дифференциации. Благодаря центральному окну исследователи убедились, что получили не 2D-сеть, облепившую объект сложной формы, а трехмерную структуру.
Использование скаффолда дало еще несколько преимуществ. В отличие от нейросфероидов, получившуюся нейронную сеть проще наблюдать в режиме реального времени ввиду большего ее размера и меньшей плотности клеток, большинство из которых еще и не соприкасалось с дном культуральной посуды, как в двумерной нейросети. Последнее обстоятельство, а также должный уход и правильный выбор среды позволили минимизировать отклонения от нужного пути дифференциации.
Ученые подтвердили это с помощью молекулярных методов и микроскопии, то есть по внешнему виду клеток, элементам цитоскелета и активности генов. Они отслеживали маркеры нейронов, астроцитов и эктодермы, из которой образуется нервная ткань, а также гены клеток «нежелательных» типов и плюрипотентности. Именно соотношение активности «нужных» и «ненужных» генов на одинаковых сроках развития стало основным доводом в пользу 3D-модели относительно двумерной, так как последняя показывала больше отклонений от необходимого пути дифференциации. Сочетание методов позволило ученым и читателям их статьи получить бóльшую уверенность в полученных результатах, потому что ПЦР — довольно чувствительный метод, особенно к ошибкам экспериментаторов, и его результаты неплохо бы визуализировать (иммуноцитохимически «отметить» рецепторы, внутриклеточные белки и т.д.). А затем и проверить, работает ли система в целом, проведя функциональную диагностику: детектировать распространение потенциала действия, синаптическую передачу и другие процессы, без которых эта модель была бы просто набором нужных элементов.
Все это авторы сделали, но, к сожалению, в статье слишком мало внимания уделено другим типам клеток нервной ситстемы: олигодендроцитам и микроглие, например, — и нет ожидаемого развития истории с культурами, выращенными из клеток людей, страдающих болезнями Альцгеймера и Паркинсона (по описанию они мало отличались от «здоровых» трехмерных моделей). В разделе «Обсуждение» ученые обнадежили читателей, что в дальнейшем они будут исследовать наличие других типов дифференциации и патологий, а также использовать методы визуализации, не требующие флуоресцентных красителей, которые могут быть токсичны для клеток, сокращая потенциальный срок жизни культуры, хотя девятимесячный уже впечатляет.
Резюмируя, можно сказать, что оригинальный подход коллектива к созданию трехмерной модели человеческой нейронной сети был оправдан и выделил их работу среди прочих, опубликованные результаты вызывают доверие, а неопубликованные — желание в скором времени увидеть продолжение этой истории.
Будем надеяться на дальнейшие успехи подобных исследований. Несмотря на то, что многие предыдущие подходы имели свои плюсы, а попытки — результаты, от настоящего «мозга в пробирке» мы еще далеки. Давайте же, по совету Лейбница, научимся понимать истоки уже существующих изобретений, чтобы создавать новые. Тем более что это действительно интересно!
Литература
- Anca M Paşca, Steven A Sloan, Laura E Clarke, Yuan Tian, Christopher D Makinson, et. al.. (2015). Functional cortical neurons and astrocytes from human pluripotent stem cells in 3D culture. Nat Methods. 12, 671-678;
- William L. Cantley, Chuang Du, Selene Lomoio, Thomas DePalma, Emily Peirent, et. al.. (2018). Functional and Sustainable 3D Human Neural Network Models from Pluripotent Stem Cells. ACS Biomater. Sci. Eng.. 4, 4278-4288;
- Eszter Boldog, Trygve E. Bakken, Rebecca D. Hodge, Mark Novotny, Brian D. Aevermann, et. al.. (2018). Transcriptomic and morphophysiological evidence for a specialized human cortical GABAergic cell type. Nat Neurosci. 21, 1185-1195;
- Guy Eyal, Matthijs B Verhoog, Guilherme Testa-Silva, Yair Deitcher, Johannes C Lodder, et. al.. (2016). Unique membrane properties and enhanced signal processing in human neocortical neurons. eLife. 5;
- Michael Hay, David W Thomas, John L Craighead, Celia Economides, Jesse Rosenthal. (2014). Clinical development success rates for investigational drugs. Nat Biotechnol. 32, 40-51;
- 12 методов в картинках: клеточные технологии;
- Millet L.J. and Gillette M.U. (2012). Over a century of neuron culture: from the hanging drop to microfluidic devices. Yale J. Biol. Med. 4, 501–521;
- Такие разные стволовые клетки;
- 12 методов в картинках: нейробиология;
- Прожорливый мозг;
- Нобелевская премия по физиологии и медицине (2012): индуцированные стволовые клетки;
- M. D. Tang-Schomer, J. D. White, L. W. Tien, L. I. Schmitt, T. M. Valentin, et. al.. (2014). Bioengineered functional brain-like cortical tissue. Proceedings of the National Academy of Sciences. 111, 13811-13816;
- На руинах памяти: настоящее и будущее болезни Альцгеймера;
- Болезнь Паркинсона: что изучать? как изучать?;
- β-амилоид: невидимый враг или тайный защитник? Запутанная тропка болезни Альцгеймера;
- Mason A. Israel, Shauna H. Yuan, Cedric Bardy, Sol M. Reyna, Yangling Mu, et. al.. (2012). Probing sporadic and familial Alzheimer’s disease using induced pluripotent stem cells. Nature. 482, 216-220;
- Se Hoon Choi, Young Hye Kim, Matthias Hebisch, Christopher Sliwinski, Seungkyu Lee, et. al.. (2014). A three-dimensional human neural cell culture model of Alzheimer’s disease. Nature. 515, 274-278;
- O. Cooper, H. Seo, S. Andrabi, C. Guardia-Laguarta, J. Graziotto, et. al.. (2012). Pharmacological Rescue of Mitochondrial Deficits in iPSC-Derived Neural Cells from Patients with Familial Parkinson's Disease. Science Translational Medicine. 4, 141ra90-141ra90;
- Болезнь Альцгеймера: ген, от которого я без ума;
- Johannes Jungverdorben, Andreas Till, Oliver Brüstle. (2017). Induced pluripotent stem cell-based modeling of neurodegenerative diseases: a focus on autophagy. J Mol Med. 95, 705-718;
- Снежный ком проблем с плюрипотентностью;
- Якунина Л.Д., Курбанов Р.А., Бондарь О.В., Абдуллин Т.И. (2012). Сравнительное исследование поведения клеток спинального ганглия крысы и линии РС12 на поверхностях, модифицированных биоадгезивными полимерами. «Гены и клетки». 3, 173–176;
- Rina Nazarov, Hyoung-Joon Jin, David L. Kaplan. (2004). Porous 3-D Scaffolds from Regenerated Silk Fibroin. Biomacromolecules. 5, 718-726;
- Что такое внеклеточный матрикс и почему его все изучают;
- Christopher G. Hubert, Maricruz Rivera, Lisa C. Spangler, Qiulian Wu, Stephen C. Mack, et. al.. (2016). A Three-Dimensional Organoid Culture System Derived from Human Glioblastomas Recapitulates the Hypoxic Gradients and Cancer Stem Cell Heterogeneity of Tumors Found In Vivo. Cancer Res. 76, 2465-2477;
- 12 методов в картинках: иммунологические технологии;
- 12 методов в картинках: микроскопия;
- 12 методов в картинках: полимеразная цепная реакция;
- Дофаминовые болезни;
- Молекула здравого ума;
- Серотониновые сети;
- Очень нервное возбуждение;
- Спокоен как GABA;
- Как происходит выделение нейромедиатора;
- Julia Izsak, Henrik Seth, Mats Andersson, Dzeneta Vizlin-Hodzic, Stephan Theiss, et. al.. (2019). Robust Generation of Person-Specific, Synchronously Active Neuronal Networks Using Purely Isogenic Human iPSC-3D Neural Aggregate Cultures. Front. Neurosci.. 13;
- Cleber A. Trujillo, Richard Gao, Priscilla D. Negraes, Jing Gu, Justin Buchanan, et. al.. (2019). Complex Oscillatory Waves Emerging from Cortical Organoids Model Early Human Brain Network Development. Cell Stem Cell.