Лекарство из будущего: пептидный анальгетик на основе пуротоксина из яда паука
21 января 2026
Лекарство из будущего: пептидный анальгетик на основе пуротоксина из яда паука
- 320
- 0
- 4
Паук томизус — мастер маскировки. Он способен прятаться в цветках и нападать на насекомых, избавляя растение от паразитов. Пуротоксин из его яда показал не менее впечатляющие способности в борьбе с болью и даже кашлем.
Рисунок в оригинальном разрешении.
иллюстрация Лили Матвеевой
-
Автор
-
Редакторы
-
Рецензент
-
Иллюстраторы
Темы
Боль — важный и необходимый защитный сигнал нервной системы, но когда она становится хронической, качество жизни человека резко ухудшается. У каждого из нас в аптечке есть препараты от боли. Большинство из них могут оказывать побочные эффекты или вызывать привыкание. В 2025 году журнал Molecular Therapy опубликовал работу большой российской команды исследователей под руководством Александра Василевского из Института биоорганической химии в Москве. В своей статье исследователи представили PT-6 — антагонист пуринорецепторов P2X3: уникальный в своем роде пептид, обладающий преимуществами, которые оставят позади все известные в настоящее время анальгетики.
Нейрофармакология
Заболевания нервной системы — одна из самых сложных и важных областей медицины. Их фармацевтическое лечение очень осложняется наличием гематоэнцефалического барьера, который не пропускает в мозг некоторые вещества. Необходимость обойти этот барьер, а также сложности при подборе мишеней и особенно трудности в понимании патогенеза большинства болезней — вот проблемы, которые приходится преодолевать при разработке новых лекарств от заболеваний нервной системы. Этот спецпроект расскажет о трудностях в лечении «нервных болезней», о тех победах, которые уже находятся у нас на счету, а также о перспективах развития этой области фармакологии.
Жизнь — боль
У многих заболеваний, сопровождающих жизнь человека, есть одно общее свойство — боль. Ученые выделяют несколько видов болевых ощущений, но наше внимание сегодня будет сосредоточено на ноцицептивной боли, возникающей при раздражении окончаний чувствительных нейронов из-за повреждения тканей или воспаления. В передаче болевого сигнала участвует множество рецепторов, расположенных в мембране нейронов. Некоторые из них расположены непосредственно в нервных окончаниях чувствительных нейронов и воспринимают изменение температуры, механическое или химическое воздействия [1]. Чувствительные нейроны передают сигнал в задние рога спинного мозга, где «дежурят» рецепторы, помогающие передать нервный импульс следующему нейрону по цепочке. Одним из активаторов чувствительных нейронов служит хорошо известная молекула АТФ — да-да, та самая «энергетическая валюта» клетки может провоцировать болевой сигнал! Она действует на пуриновые рецепторы, главным образом на изоформу P2X3, расположенную в мембране чувствительных нейронов (рис. 1). Другие подтипы P2X рецепторов — P2X2, P2X4, P2X7 — также активно участвуют в появлении разных типов боли: ноцицептивной, нейропатической и вызванной воспалением [2].
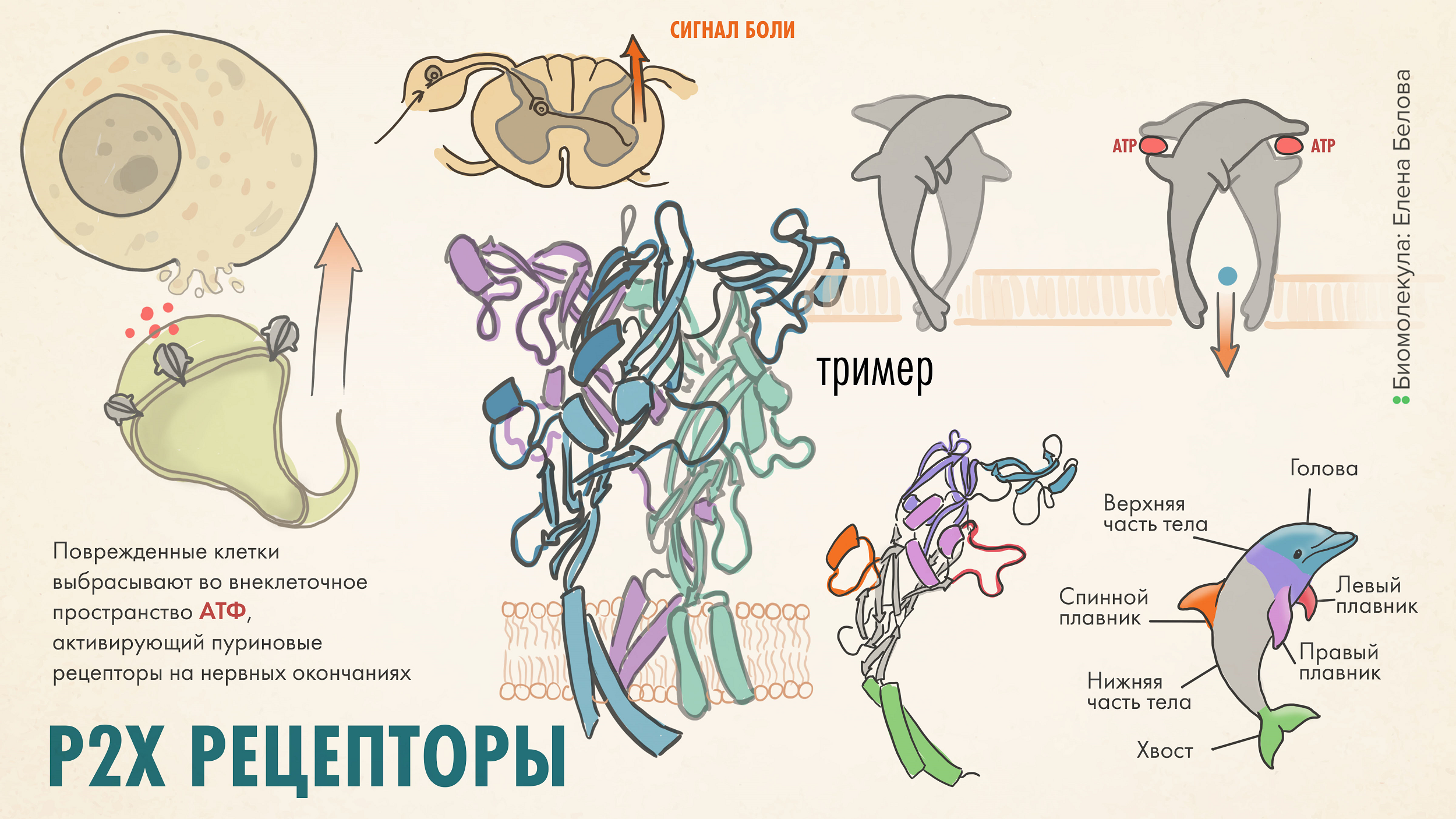
Рисунок 1. Как пуриновые рецепторы участвуют в передаче сигнала о боли. Пуринорецепторы активируются молекулой АТФ, высвобождаемой из поврежденных клеток или нервных окончаний, что приводит к быстрому открытию канала и проведению нервного импульса. Это способствует высвобождению глутамата чувствительными нейронами и передаче болевого сигнала нейронам в спинном мозге и далее по цепочке в головной мозг. Несколько изоформ P2X участвуют в болевой активации (в первую очередь, P2X3), и все они похожи по строению: это тример (гомо или гетеро). Каждый мономер напоминает по форме дельфина и даже имеет обозначения, соответствующие частям тела этого морского животного.
иллюстрация Елены Беловой
Рецепторы P2X3 — гомотримеры. Активация таких рецепторных комплексов с помощью АТФ приводит к высвобождению ключевого нейромедиатора нервной системы — глутамата — и передаче болевого сигнала от чувствительных нейронов к нейронам, расположенным в спинном и головном мозге [3], [4]. Если копнуть в механизм работы P2X3 чуть глубже, то мы увидим, что это лиганд-управляемые катионселективные каналы, то есть взаимодействие с АТФ приводит к открытию канала внутри белка и входу ионов Na+ и Ca2+ в клетку, в результате чего происходит деполяризация чувствительного нейрона, возникновение потенциала действия и секреция глутамата (рис. 2). Но с активностью этих рецепторов связана не только боль. Кашлевой рефлекс также опосредуется чувствительными нейронами, которые содержат в своих мембранах пуринорецепторы. Поэтому, как мы увидим ниже, фармкомпании «охотятся» за эффективными антагонистами пуринорецепторов и для лечения кашля тоже. Еще больше о такой необычной роли молекулы АТФ читайте в статье «Биомолекулы»: «Вторая жизнь АТФ: от главной батарейки до нейромедиатора» [5].
Изоформа P2X3 обнаружена также в нейронах, отвечающих за восприятие вкусовых ощущений, в составе гетеромера с изоформой P2X2. Так что в нервной системе существует два очень похожих рецепторных комплекса: гомотример P2X3 и гетеротример P2X2/3, что очень сильно затрудняет разработку лекарственных препаратов и повышает требования к их селективности. Ведь действующее вещество должно специфично связываться только с изоформой P2X3, поскольку это основной «болевой» подтип рецепторов, но при этом не мешать работать гетеромеру P2X2/3, чтобы не влиять на восприятие вкуса.
В настоящее время разрабатывается несколько препаратов, ингибирующих рецепторы P2X3 и нацеленных на борьбу в первую очередь с кашлем, а один был одобрен к применению в Японии, ЕС, Великобритании и Швейцарии. Всё это соединения непептидной природы (так называемые «малые молекулы»). В литературе неоднократно сообщалось о таком побочном эффекте этих препаратов, как дисгевзия или агевзия, то есть расстройство или полная потеря вкуса, что связано с низкой способностью этих веществ различать изоформы рецепторов. Но, согласитесь, расплачиваться за жизнь без кашля или боли отсутствием вкуса — не очень заманчивая перспектива.
Зачем нужен поиск новых анальгетиков?
Всё это приводит нас к вопросу — а так ли уж нужен поиск новых обезболивающих, ведь на рынке уже существуют десятки препаратов? В настоящее время анальгетики представлены в аптеке по большей части нестероидными противовоспалительными препаратами (НПВП) или опиоидами. Препараты из первой группы подавляют активность фермента циклооксигеназы и блокируют выработку простагландинов, вызывающих болевые ощущения. Вы хорошо знаете эти препараты: диклофенак, аспирин и ибупрофен, которые есть, наверное, в каждой аптечке. К недостаткам НПВП можно отнести неспецифичность действия, поскольку они ингибируют разные изоформы циклооксигеназы и могут воздействовать на другие мишени. Опиоидные анальгетики «бьют» по одноименным опиоидным рецепторам в центральной нервной системе, разрывая цепь передачи болевых ощущений, однако плата за это — привыкание и развитие зависимости от препаратов. Снижение контроля за использованием таких «тяжелых» обезболивающих, а также активное продвижение их на рынок привело к опиоидному кризису в США, который начался 1990-е годы и продолжается до сих пор. В результате злоупотребления опиоидами за последние десятилетия погибли сотни тысяч человек [6].
Словом, если посмотреть вокруг внимательно, то мы увидим, что на современном рынке наблюдается острая нехватка эффективных и безопасных обезболивающих препаратов. И решить эту проблему, используя уже известные подходы, в настоящее время представляется сложной задачей. Нужны новые мишени для действия препаратов, а сами анальгетики должны быть более селективными и безопасными, чтобы обеспечить эффективность действия и уменьшить количество побочных эффектов.
Библиотека пептидов в яде пауков
Вот с такой непростой задачей столкнулись авторы статьи, о которой сегодня пойдет речь; и решить ее помогли токсины из яда паука томизуса (Thomisus onustus). Среди насекомых, паукообразных и рептилий наличие специальных желез, выделяющих яды, совсем не редкость. Для ученых они — настоящий кладезь разнообразных биологически активных веществ. В железах одного маленького паучка могут синтезироваться тысячи токсинов, большинство из которых чаще всего представляют собой пептиды или белки [7], [8].
Многие миллионы лет естественный отбор «шлифовал» структуру этих веществ, которые стали самыми эффективными в природе лигандами к рецепторам животных. Благодаря такому разнообразию токсинов пауки могут успешно охотиться и защищаться, а их яд действует на множество мишеней в организме жертвы. Молекулярная эволюция токсинов привела к созданию не только «убойных» ядов, но и веществ, обладающих анальгезирующими свойствами. Получилась своего рода линейка потенциальных препаратов, которой бы позавидовала любая фармкомпания.
Пептиды, на которые обратили внимание авторы статьи, обладают сложной трехмерной структурой и избирательно ингибируют P2X3 пуринорецепторы, описанные выше. Эти рецепторы расположены в чувствительных нейронах спинальных ганглиев и тройничного нерва и поэтому играют важную роль в периферических болевых реакциях. О первом из такого рода пептидов (PT1) исследователи сообщали еще в 2000-х годах [9], а сейчас опубликовали результаты работы уже над новым препаратом, PT6.
Погружаемся в «пуриновую» тематику: как и для чего разрабатывают ингибиторы P2X3
Авторы — не единственные, кто разрабатывает ингибиторы P2X3 рецепторов. В 2023 году на европейский рынок вышел препарат фирмы Merck джефапиксант, который продается под торговой маркой Lyfnua и назначается для лечения хронического кашля. Помните, выше мы писали о том, что пуринорецептор P2X3 в равной степени важен и для передачи боли, и кашлевого рефлекса. Еще ряд препаратов — камлипиксант, сивопиксант и элиапиксант — находятся на разных стадиях клинических испытаний. Однако к этим препаратам все еще остается ряд вопросов, которые касаются как эффективности, так и наличия разнообразных побочных эффектов. Так, например, эти препараты могут вызывать описанный выше и очень неприятный побочный эффект — дисгевзию (нарушение вкуса) или агевзию (потерю вкуса).
Может возникнуть вопрос, стоит ли тягаться с маститыми гигантами фарминдустрии, если их препараты уже близки к тому, чтобы наводнить рынок? И тут стоит сказать, что пуротоксин из яда маленького паучка совсем не так прост. Прежде всего — это пептид, обладающий высокой селективностью и эффективностью, до которой далеко другим антагонистам P2X3. Перечисленные выше «пиксанты» — это сравнительно простые соединения. Возможно, именно поэтому их сложно сделать в достаточной мере селективными, чтобы они «различали» тримеры P2X3 и P2X2/3. Пуротоксины имеют принципиально другое строение: сложная пептидная молекула, уложенная в уникальную трехмерную структуру, скрепленную дисульфидными мостиками, может точно узнавать конкретные аминокислотные остатки в рецепторе и связываться с ними. Это значит, что пуротоксин может действовать целенаправленно именно на ту изоформу рецептора, которую нужно ингибировать (в нашем случае — P2X3), и не влиять на изоформу P2X2 или гетеротример P2X2/3. А чем выше селективность лекарственного препарата, тем меньше побочных эффектов. То есть пуротоксин может решить проблему дисгевзии, причем без потери анальгетического эффекта.
Мы поговорили с автором статьи, Александром Василевским, и попросили его ответить на несколько вопросов, чтобы лучше понять механизм действия пуротоксина (рис. 2) и значение работы, проделанной командой [10].
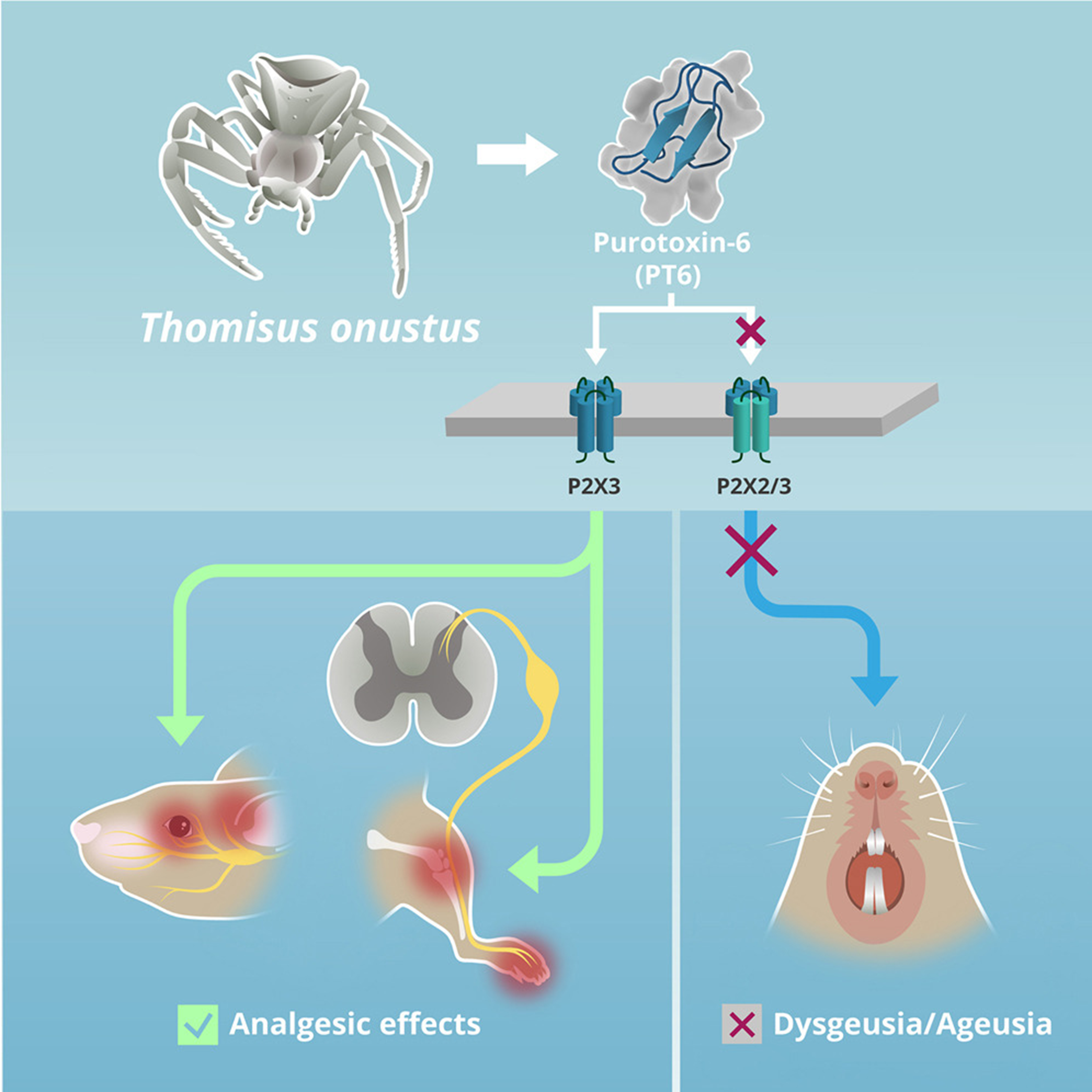
Рисунок 2. Пуротоксин PT-6 — кандидат в идеальные анальгетики. Это вещество ингибирует рецепторы P2X3, которые играют важную роль в передаче болевого сигнала в мозг. В отличие от других антагонистов P2X-рецепторов, PT-6 — это пептид, обладающий уникальной трехмерной структурой; он способен селективно действовать на гомотример P2X3, не влияя на другие формы рецептора. Это выгодно отличает пуротоксин от известных ранее ингибиторов пуринорецепторов. Такая избирательность действия предотвращает распространенный побочный эффект для данного класса препаратов — нарушение или полную потерю вкуса.
графический абстракт к статье [10] (иллюстрация Ларисы Беляевой)
― Александр, здравствуйте! Спасибо, что согласились рассказать о своей работе. Правильно ли я понимаю, что пуротоксины — это первые изученные антагонисты P2X3 именно пептидной природы? (Джефапиксант и другие — низкомолекулярные вещества.)
― Не совсем, до нашего исследования был известен спинорфин. Это эндогенный пептид, ингибирующий ферменты-протеазы, которые гидролизуют энкефалины, чем, по-видимому, и обусловлена его активность в центральной нервной системе. Корейские исследователи показали, что спинорфин в очень низких концентрациях ингибирует P2X3. С чем он связывается в рецепторе? Каков механизм его действия? Насколько я понимаю, сейчас ничего не известно в деталях, но статья опубликована, и она вышла до нашей работы. Мы его пробовали использовать как контроль в наших тестах и наблюдали активность. Важно понимать, что этот пептид состоит из семи аминокислотных остатков, а значит, у него, скорей всего, будет короткое время жизни, фармакокинетические параметры для лекарства не очень подходящие. То есть, если спинорфин развивать как лекарство, то его нужно как-то модифицировать, а потом думать, что делать с его первым описанным действием, а именно с тем, что он ингибитор протеаз. Нужно от этого избавляться или не нужно. Почему мы в некотором смысле считаем, что молодцы? Потому что в области токсинов PT1 и PT6 — это в настоящее время единственный пример эффективных ингибиторов P2X3. И много лет держится наше достижение, хотя очень многие ведущие группы, занимающиеся болевыми рецепторами, пытались найти токсин, который бы воздействовал на пуриновые рецепторы, но ни у кого, кроме нас, пока не получилось.
Почему это важно? Отчасти есть субъективный человеческий фактор, потому что существует достаточно сильное комьюнити, которое занимается токсинами из природных ядов, и оно образует такую связанную «экосистему», достаточно яркую, потому что людям же нравится, когда рассказывают что-то про пауков или змей. Это здорово. И если в этом сообществе появляется какая-то идея, то она проникает в массовое сознание. Это скорее субъективная социологическая причина — так сообщество устроено. А есть, наверное, и объективные причины. Например, структурные особенности наших соединений. Токсины — плотно уложенные небольшие белки, прошитые дисульфидными связями, что придает им стабильность. А стабильность — это хорошо для дальнейшей разработки лекарственного препарата. Есть и другие причины такого внимательного изучения токсинов: высокие специфичность и аффинность к их мишеням.
― Поскольку вы анализировали очень большое количество нейротоксинов в яде этого паука, известно ли что-нибудь о том, как у них формируются библиотеки токсинов, насколько это быстрый процесс с точки зрения эволюции?
― Если изучить состав яда какого-нибудь ядовитого существа, окажется, что там не один токсин, не одна молекула, а сотни и тысячи. Токсином мы называем индивидуальный компонент яда, за исключением воды, солей, каких-нибудь простых соединений вроде сахаров. Тут граница не очень четкая, но вот так сложилось в области, что индивидуальный компонент называют токсином, даже если функция этого компонента неизвестна, или токсичность его не изучена, или даже ясно, что он не токсичен. Пуротоксины не обладают такими эффектами, но мы их всё равно токсинами зовем. Если на структуру разных токсинов посмотреть, то очень часто это гомологи, то есть родственные соединения, и они объединяются в семейства. При более подробном анализе структуры токсинов оказывается, что есть консервативные и вариабельные области. Консервативны, как правило, дисульфидные мостики, то есть остатки цистеина, а другие остатки аминокислот, расположенные в петлях, часто очень вариабельны.
И вот из-за такой особенности в области распространилось понятие о природных ядах как комбинаторных библиотеках токсинов [7]. Раньше, когда не было известно последовательностей геномов ядовитых животных, все грезили тем, что найдут механизм, ответственный за вариабельность структуры токсинов, и все надеялись, что это будет что-то похожее на способ образования антител или Т-клеточного рецептора [11], но ничего не вышло, и оказалось, что это всё просто мультигенные семейства. Значит, «один ген — один токсин». Есть механизмы, которые дополнительно повышают вариабельность (например, альтернативный сплайсинг и посттрансляционные модификации), но вклад их минорный.
Дальше — вопрос скорости эволюции. И здесь тоже всё непросто. Раньше считали, что эволюция токсинов похожа на историю антилопы и гепарда. И та, и другой бегают очень быстро, потому что одному надо догнать, а другой — убежать. Эта логика была распространена и на область природных токсинов тоже. Ядовитое животное производит токсины, а те, на кого охотятся, должны защищаться — например, у них мутируют мишени токсинов, приобретая устойчивость. Семейства паучьих генов эволюционируют достаточно быстро по эволюционным меркам, но медленнее, чем, например, яды змей или конотоксины моллюсков [12].
― А какие функции у пуротоксинов в природе?
― Биологическая функция пуротоксинов не ясна вообще. Их влияние на наши рецепторы — скорее всего, просто стечение обстоятельств, это удача, а биологическая функция у них наверняка какая-то другая. Почему я так уверенно говорю? Потому что, допустим, опубликованный в нашей статье PT6 мы выделили из яда очень маленького паука, для которого млекопитающие вообще не являются мишенью. У него и хелицеры такого размера, что он не сможет даже прокусить нашу кожу. Поэтому, очевидно, его токсины не нацелены на рецепторы человека. И даже, наверное, других млекопитающих. Но для чего-то пуротоксины нужны, потому что среди самых эволюционно продвинутых и многочисленных аранеоморфных пауков мы находим их гомологи. Значит, раз они такие распространенные, у них есть какая-то биологическая функция. Мишень абсолютного большинства пауков — это насекомые, и мы пытались тестировать наши вещества на насекомых, но нигде мы не видели никаких эффектов. Так что это всё еще открытый вопрос.
История открытия: почему так важно вовремя сменить тему исследований
Лаборатория молекулярных инструментов для нейробиологии ИБХ РАН, которой руководит Александр, имеет богатую историю изучения токсинов животных. Эти исследования были начаты еще академиком Евгением Васильевичем Гришиным, под руководством которого были открыты и описаны биологически активные вещества из десятков видов животных и растений. Нейротоксины, изученные Евгением Васильевичем, стали важным инструментом для исследования ионных каналов в мембранах нервных клеток. Научная школа, созданная академиком Гришиным, послужила фундаментом для поиска среди нейротоксинов новых высокоселективных модуляторов активности ионных каналов — потенциальных лекарственных препаратов нового поколения.
— Расскажите, как вы пришли к этому открытию и какую роль сыграл ваш учитель, академик Гришин?
— Евгений Васильевич Гришин прославился в мире тем, что открыл некоторые важные токсины. И в том числе и его стараниями токсины теперь понимаются как важнейший исследовательский инструмент в нейробиологии, в частности, как инструмент изучения ионных каналов.
В его карьере было несколько важных вех. Он открыл аргиопин из яда паука-кругопряда, который блокировал глутаматные рецепторы [13], и вот этим прославился на весь мир. Он был первым, кто выделил такой токсин, описал структуру. Одна из следующих вех — это токсины черной вдовы, или каракурта. Гришин стал пионером в изучении молекулярной структуры и механизма действия этих токсинов [14]. Они называются латротоксины. Альфа-латротоксин, который воздействует на нас, млекопитающих, связывается с молекулами клеточной адгезии на пресинаптической мембране, встраивается в нее и делает пору, проницаемую для кальция, который самопроизвольно входит в терминаль, что провоцирует выброс нейромедиатора. Теперь не нужно произвольного сигнала, нейромедиатор выделяется сам, без того, чтобы «прибежал» потенциал действия. Молекулы клеточной адгезии, с которыми связывается латротоксин, обусловливают формирование и поддержание синапса как структуры, то есть взаимодействие одного нейрона с другим или с мышечным волокном. Для контакта двух клеток нужны молекулы клеточной адгезии с той и с другой стороны. Латротоксин был тем инструментом, который помог открыть эти молекулы.
И латротоксиновая тематика была основной, когда я пришел в лабораторию Гришина. Но он уже тогда понимал, что нужно двигаться дальше. Нужно было принимать решение, какую тему назначать основной. И в тот момент как раз стала популярна тема токсинов и боли. Очевидно, что токсины — компоненты ядов — должны воздействовать на систему восприятия боли. Поэтому, конечно, в составе природных ядов содержатся токсины, которые селективно воздействуют на болевые рецепторы. Тогда только-только начиналось изучение молекулярной природы восприятия боли и болевых рецепторов, а в ядах есть такие токсины, которые нацелены на эти белки. И было еще одно наблюдение, что, похоже, в ядах содержатся не только активаторы боли, но еще почему-то и ингибиторы болевых рецепторов. Почему так — мы до сих пор не понимаем, но тем не менее они там, очевидно, есть. И мы выбрали тогда в качестве мишеней три основные группы рецепторов. Прежде всего, терморецепторы TRPV1 [15]. Потом кислото-чувствительные ионные каналы (ASIC), активируемые внеклеточным снижением pH. И третья группа, которые активируются внеклеточным АТФ, — P2X — и надо сказать, что для всех них найдены свои токсины. Например, Гришину удалось открыть первый токсин-ингибитор TRPV1 [16]. Но самая яркая работа — пуриновая, потому что здесь мы первые, и до сих пор аналогичных результатов у других групп нет.
Про эффекты препарата и сравнение с другими известными анальгетиками
Давайте теперь подробнее рассмотрим, какими особенностями обладают пуротоксины и почему работа авторов статьи заслуживает особого внимания. Ими было изучено целое семейство пуротоксинов, и они выбрали соединения не только эффективные как ингибиторы P2X3 рецепторов, но и которые возможно производить в промышленных масштабах, поскольку для таких крупных исследований нужно значительно больше вещества, чем возможно получить из яда пауков. В случае пептидов это значит иметь возможность вырастить их в бактериальной системе или получить органическим синтезом. Исследователи ориентировались на такие соединения, которые могут образовывать в бактериальных клетках нативную, то есть естественную трехмерную структуру. Затем ученые убедились, что полученные в бактериальной культуре пептиды действуют на рецепторы P2X3 человека в культуре клеток и являются их антагонистами.
Но изучить работу препарата только «в пробирке» недостаточно. После введения в живой организм молекула, особенно пептидной природы, может быть изменена многочисленными ферментами или вовсе потерять свою активность. Поэтому очень важно грамотно провести исследования in vivo. Но как оценить эффективность анальгетика на животных, ведь они не могут рассказать о том, что чувствуют? Для этого существует множество проверенных тестов, в ходе которых животные испытывают боль, а анальгетик снижает (или нет) ее интенсивность, и всё это можно посчитать и представить в виде количественных данных. Часть из этих тестов считается неселективными, то есть в них боль обусловлена сразу несколькими физиологическими механизмами.
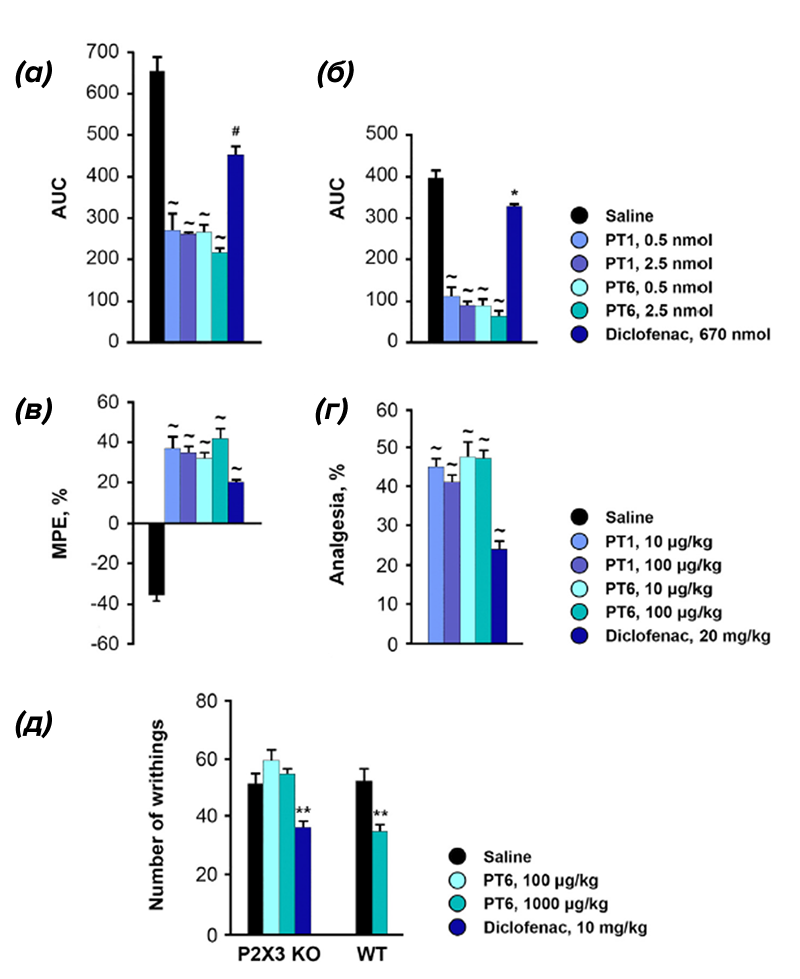
Одним из таких тестов, которые использовали авторы работы, было введение полного адъюванта Фрейнда (CFA-тест). Часто он используется для иммунизации, но также может применяться в болевых тестах, поскольку CFA вызывает воспаление, а также термическую гиперальгезию, то есть повышенную чувствительность к высокой температуре. Эту особенность CFA и используют в тесте. После его введения в заднюю лапу мышь помещают на горячую пластину и смотрят, сколько времени пройдет прежде, чем животное лапу отдернет. Результаты этого и описанных далее тестов можно увидеть на рис. 3. Аналогично CFA-тесту, крысам в лапу вводили раствор формалина, который также вызывает воспаление и болевую реакцию, проявляющуюся в том, что животное начинает дергать лапой или облизывать ее. Еще один общий болевой тест — это «уксусные корчи». Мышам внутрибрюшинно вводят слабый раствор уксусной кислоты, который вызывает болевую реакцию. Она выражается в сокращениях мышц живота, скручивании туловища и вытягивании конечностей. Во всех этих тестах исследователи вводили пуротоксин или препараты сравнения (например, НПВП диклофенак) и изучали их эффективность.
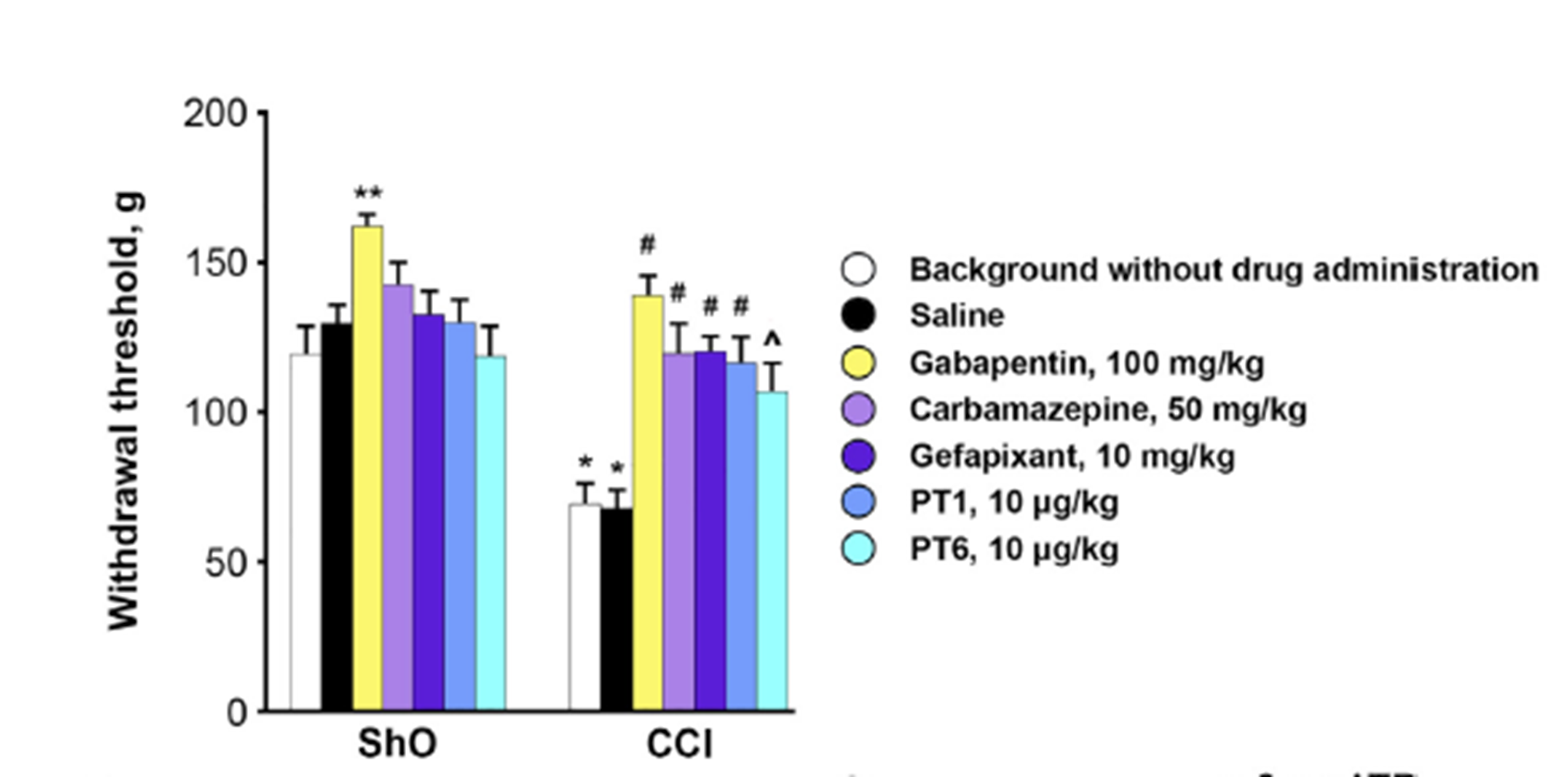
Другая часть тестов была более селективна, то есть помогала оценить способность пуротоксина действовать именно на рецепторы P2X3 при определенных патологических состояниях и снижать выраженность боли. В качестве моделей заболеваний были выбраны остеоартрит и невралгия тройничного нерва, в патогенез которых вовлечена эта изоформа пуринорецепторов. Для того, чтобы эксперимент был более объективным, эффекты пуротоксина в случае с моделью невралгии тройничного нерва сравнивали с габапентином и карбамазепином, которые используются для лечения этого заболевания, а также с ближайшим «конкурентом» джефапиксантом, описанным выше.
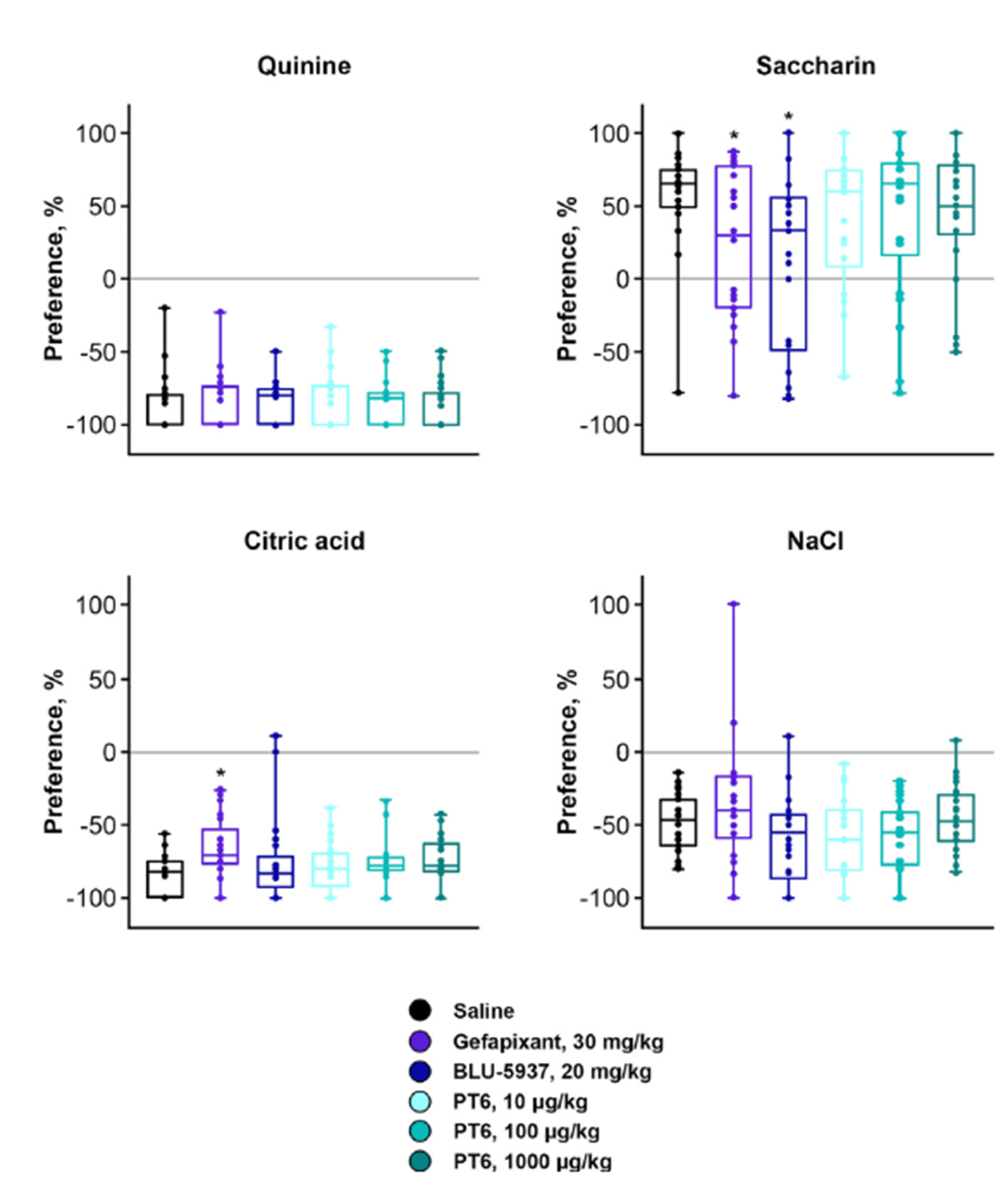
Рисунок 4. Влияние обезболивающих препаратов на вкусовые предпочтения у мышей. Хинин — горький, лимонная кислота — кислая, сахарин — сладкий, NaCl — соленый. Как мы видим на графике, мыши, которым вводили джефапиксант или камлипиксинт (BLU-5937), хуже различали сахарин и лимонную кислоту, поэтому сладкий сахарин они выбирали реже, а кислую лимонную кислоту чаще, чем контрольные животные или те, которым вводили PT6 в разных дозах. Это говорит о нарушениях восприятия вкуса, вызванных джефапиксантом или камлипиксинтом. При этом пуротоксин никак не влиял на восприятие вкуса.
PT6 действительно оказался очень эффективным (рис. 3Б в крутилке). И здесь нам еще раз стоит вспомнить о том, что PT6 — пептид. Для него характерна очень высокая селективность действия. Иными словами, лиганд связывается с рецептором очень избирательно и крепко. И благодаря этому пуротоксин оказался эффективен в дозах, в 100 раз меньших, чем джефапиксант. Как видно из рис. 3А и 3Б, PT6 хорошо работает в дозе 10–100 мкг/кг, в то время как эффективная доза джефапиксанта составила 10 мг/кг.
Казалось бы, проведенных тестов более чем достаточно, чтобы показать, что PT6 — это действительно перспективный анальгетик? Но авторы пошли дальше и изучили влияние пуротоксина на мышей с нокаутом [17] гена рецептора P2X3, полученного с помощью технологии CRISPR-Cas [18]. Как и предполагалось, обезболивающий эффект PT6 отсутствовал при введении нокаутированным мышам (рис. 3д), а значит — его действие связано именно с рецептором P2X3.
Как было отмечено выше, основной побочный эффект антагонистов P2X3 — это частичная или полная потеря вкуса. И авторам было очень важно доказать, что пуротоксин действует именно на гомотримерную форму рецептора P2X3. Для этого использовали тест с двумя бутылками: мышам предлагали на выбор воду или раствор, имеющий вкус (сладкий, соленый, горький или кислый), после чего оценивали, как и насколько изменились вкусовые предпочтения животных. Ведь очевидно, что при прочих равных сладкую воду пить приятнее, чем обычную, а горькую жидкость вообще лучше избегать. Оказалось, что пуротоксин действительно не влиял на вкусовые предпочтения мышей, а вот джефапиксант и камлипиксант заставляли мышей быть менее разборчивыми и потреблять раствор лимонной кислоты в большей мере, чем это делали контрольные животные, и при этом реже выбирать раствор сахарозы, что свидетельствует о признаках дисгевзии (рис. 4).
О перспективах исследования
Публикации в ведущих научных журналах — это, безусловно, важное достижение для любого ученого. Но каждый исследователь мечтает, что его работа станет по-настоящему полезна, а значит, ее результаты приведут к созданию практически значимого продукта. И здесь команде Александра Василевского тоже есть, чем похвастаться. В конце интервью мы спросили Александра о перспективах исследования и планах на будущее.
― Фундаментальных планов громадьё. Надо картировать фармакофор, надо создавать пептидомиметик, надо определять сайт связывания лекарства. Есть и совсем фундаментальная цель, которая мало пересекается с разработкой. Похоже, у нас есть токсины, которые воздействуют на другие пуриновые рецепторы, это тоже интересно изучать и развивать дальше, поскольку другие изоформы также вовлечены в механизмы восприятия боли (P2X2, P2X4, P2X7). Также было бы здорово получить структуру комплекса рецептора и пуротоксина.
Что касается разработки, то мы никак не начнем клинические исследования, но надеюсь, что вот-вот приступим. Всё, считай, готово, нам нужно подавать досье (необходимая документация для проведения клинических испытаний) и начинать клинические исследования. Это ближайший шаг. От первой фазы многое будет зависеть. Первая фаза — это безопасность на небольшой выборке, и если повезет, то тогда самое интересное будет на второй фазе [19]. Вторая фаза — это уже эффективность [20]. Индикацию выбираю не я, а инвестор и генеральный директор нашей компании «Анальгетики будущего» (Future Analgesics). То есть они определяют вектор движения, что для начала надо попробовать развиваться там, где у других получилось. Поэтому, наверное, это будет все-таки кашель. На эту тему проще привлечь финансирование. И если у создателей джефапиксанта и камлипиксанта получается с кашлем, то значит, и нам надо с кашлем. Такая логика. Интересно, кстати, что ингибиторы P2X3 —— это первые новые по механизму действия антитуссивные препараты за десятки лет.
― Как это вообще делается? Можете буквально в двух словах рассказать, как спонсор оценивает рынок и смотрит, где есть свободные ниши, куда можно попробовать войти?
― В двух словах не ответишь. Это очень сложно. Потому что идея научная может быть шикарная, и in vitro у вас всё прекрасно работает, и известно из литературы, что этот рецептор важен при тех или иных заболеваниях. А приходишь разговаривать с людьми из индустрии, и они говорят, что, ну, да, здорово, молодцы, но это неинтересно. Следующий. Чтобы начинать общаться с серьезными инвесторами, недостаточно молекулярного механизма и результатов in vitro. Мы заходили, когда уже за государственные деньги сделали доклинику. Когда уже было понятно, что по ряду показателей пуротоксин действительно может превратиться в лекарство. Уже были на руках результаты, что токсичность отсутствует; что есть специфическая активность в разных моделях, релевантных для соответствующих заболеваний; что изучена фармакокинетика и результаты неплохие, что тоже важно, потому что ваше лекарство может прекрасно действовать на рецептор, но вводишь в организм — и оно тут же выводится или инактивируется, или не проникает к рецептору.
Дальше синтез. То есть ты показываешь, что это не какое-то навороченное соединение, в котором 100 стадий синтеза, и это невозможно дорого, и мало кто умеет. А что ты разработал технологию, которая масштабируема, с которой, если дело дойдет до производства, может всё получиться. Ну, и личные качества важны. Получается, что ты общаешься с людьми, а не с роботами. Public relations — это суперважный фактор. И даже потом, когда вроде все нашлись, и ты думаешь, что, наконец, можно заниматься своей наукой, а разработка идет своим чередом, люди, которые профессионалы, этим занимаются. Но это не совсем так, и надо все время принимать участие. Зато интересно. Это целый мир, по масштабам сопоставимый с академией, и очень интересно, как там все устроено.
― Александр, в статье принимал участие большой коллектив авторов из разных организаций, расскажите, пожалуйста, какой вклад внесли соавторы исследования?
― Институт биоорганической химии, здесь были открыты эти токсины, синтезированы, изучена их структура и проведены многие эксперименты по активности. Дальше компания Future Analgesics. Это сколковская компания, которую мы создали для развития пуротоксина как лекарства. Институт биофизики клетки РАН, это Станислав Сергеевич Колесников и его команда, которые занимаются физиологией вкуса и в том числе пуриновыми рецепторами. Исследование механизма действия пуротоксинов на рецепторы с помощью электрофизиологии выполнили там. Казанский университет — это тесты на менингах и тройничном нерве. В Институте биологии гена нам сделали нокаутных по гену рецептора P2X3 мышей. В институте фармакологии Закусова была выполнена часть экспериментов на животных. Наконец, МГУ — это модель невралгии.
― Александр, спасибо за интервью, поздравляем с выходом статьи и желаем дальнейших успехов!
― Спасибо вам за интерес! О своей работе рассказать — это большое удовольствие.

Рисунок 5. Кампай! Александр Василевский и редактор этой статьи на конференции в Японии в 2010 году.
фото Дмитрия Зленко из архива Антона Чугунова
Литература
- Молекулярная биология боли;
- Louis‐Philippe Bernier, Ariel R Ase, Philippe Séguéla. (2018). P2X receptor channels in chronic pain pathways. British J Pharmacology. 175, 2219-2230;
- I J. Llewellyn-Smith, G Burnstock. (1998). Ultrastructural localization of P2X3receptors in rat sensory neurons. NeuroReport. 9, 2545-2550;
- V. Staikopoulos, B.J. Sessle, J.B. Furness, E.A. Jennings. (2007). Localization of P2X2 and P2X3 receptors in rat trigeminal ganglion neurons. Neuroscience. 144, 208-216;
- Вторая жизнь АТФ: от главной батарейки до нейромедиатора;
- Nora D. Volkow, Carlos Blanco. (2021). The changing opioid crisis: development, challenges and opportunities. Mol Psychiatry. 26, 218-233;
- Великому комбинатору и не снилось: комбинаторика токсинов пауков;
- Яды — высокоточное оружие: компьютерное исследование природных нейротоксинов;
- Oleg O. Krishtal. (2009). Novel peptide from spider venom inhibits P2X3 receptors and inflammatory pain. Ann Neurol.. NA-NA;
- Peter Oparin, Oksana Khokhlova, Aleksandr Cherkashin, Kirill Nadezhdin, Victor Palikov, et. al.. (2025). Potent painkiller from spider venom antagonizes P2X3 receptors without dysgeusia. Molecular Therapy. 33, 771-785;
- Анализ индивидуальных репертуаров Т-клеточных рецепторов;
- Thomas F. Duda, Stephen R. Palumbi. (1999). Molecular genetics of ecological diversification: Duplication and rapid evolution of toxin genes of the venomous gastropod Conus. Proc. Natl. Acad. Sci. U.S.A.. 96, 6820-6823;
- Grishin E.V., Volkova T.M., Arsenev A.S., Reshetova O.S., Onoprienko V.V. (1986). Structural-functional characteristics of argiopine — the ion channel blockers from the spider Argiope lobata venom. Bioorganicheskaia Khimiia. 12, 1121–1124;
- E.V. Grishin. (1998). Black widow spider toxins: the present and the future. Toxicon. 36, 1693-1701;
- Трогательная и жгучая — за что вручили Нобелевскую премию по медицине (2021);
- Yaroslav A. Andreev, Sergey A. Kozlov, Sergey G. Koshelev, Ekaterina A. Ivanova, Margarita M. Monastyrnaya, et. al.. (2008). Analgesic Compound from Sea AnemoneHeteractis crispaIs the First Polypeptide Inhibitor of Vanilloid Receptor 1 (TRPV1). J. Biol. Chem.. 283, 23914-23921;
- Трансгенные животные и современная медицина: сломать, чтобы починить;
- 12 методов в картинках: генная инженерия. Часть II: инструменты и техники;
- С миру по нитке: как соединились компоненты клинического исследования;
- Путь к тысячам аптек начинается с одной молекулы.