Трансгенные животные и современная медицина: сломать, чтобы починить
28 марта 2025
Трансгенные животные и современная медицина: сломать, чтобы починить
- 2226
- 1
- 13
Нам со школьной скамьи повторяют, что между человеком и другими животными очень много общего. И вот, наконец, благодаря успехам генной и клеточной инженерии, мы можем использовать эти общие черты при создании моделей, имитирующих заболевания человека.
Рисунок в полном размере.
иллюстрация Елены Беловой
-
Автор
-
Редакторы
-
Иллюстратор
Последние десятилетия были ознаменованы бурным развитием методов генной и клеточной инженерии. В практику исследователей вошли вирусные векторы, позволяющие доставить чужеродную ДНК в клетку, а нуклеазы, такие как CRISPR/Cas9, произвели настоящую революцию, сделав возможным внесение прицельных изменений в геном животных. Эти технологии позволили создать огромное количество трансгенных моделей заболеваний человека, что стало хорошим подспорьем для современной медицины — рассказываем об этом в продолжении спецпроекта «Генная и клеточная терапии».
Генная и клеточная терапии

Четвертый сезон спецпроекта о генной и клеточной терапиях рассказывает о конкретных применениях этих новейших методов для лечения нейромоторных, онкологических, офтальмологических и других заболеваний.
Партнер спецпроекта — Департамент разработки генотерапевтических препаратов одной из крупнейших российских биотехнологических компаний — BIOCAD. BIOCAD заслужил серьезные позиции на мировом фармацевтическом рынке благодаря выпуску лекарственных препаратов на основе антител.
Трансгенные животные несут в своих клетках чужеродную ДНК, искусственно введенную в их организм с помощью методов генной и клеточной инженерии [1], [2]. В последние десятилетия эти методики, а также биотехнологии в целом стали символом прогресса, наравне с полетами в космос. Зародившаяся одновременно с открытием двойной спирали ДНК Уотсоном и Криком всего за несколько десятилетий эта отрасль накопила огромный научный опыт и впитала множество современных технических достижений. Переработав их, биотехнология породила множество инновационных подходов, нашедших применение в медицине, фундаментальной науке, сельском хозяйстве. В спецпроекте «Генная и клеточная терапии» можно найти множество интересных статей о роли биотехнологических подходов в лечении самых разнообразных генетических заболеваний человека, а в первой статье («Генная терапия: познакомьтесь с лекарствами будущего» [3]) вы найдете подробный вводный обзор этой отрасли.
Мы же сегодня постараемся заглянуть за кулисы современной генной и клеточной инженерии, чтобы узнать больше о том, каким образом ученые исследуют различные заболевания, влияющие на здоровье миллионов людей. Речь пойдет о трансгенных животных, которые благодаря достижениям генетики и биотехнологий стали незаменимыми помощниками в изучении болезней человека. Эти технологии предоставляют уникальные возможности в моделировании различных патологий, позволяя ученым искать новые подходы к их лечению и профилактике.
Если вбить в поисковик вопрос «сколько всего заболеваний у человека?», в ответ можно получить огромное количество ссылок с самой разнообразной информацией, но общим трендом можно считать ответ: несколько десятков тысяч. И даже если исключить из этого списка все травмы и другие состояния, обусловленные внешними факторами, список остается внушительным. Оставшиеся заболевания можно условно разделить на наследственные патологии и мультифакторные заболевания, к которым, в частности, относятся и болезни с генетической предрасположенностью. Изучение каждого такого заболевания — крайне непростая задача. Для первой категории сложность состоит в низкой распространенности болезни в популяции (см.: «Редко, но метко: орфанные заболевания как вызов современной медицине» [4]), что затрудняет сбор данных и их статистический анализ. Для второй категории основной проблемой стало выявление конкретного генетического компонента из множества факторов, влияющих на развитие патологии, таких как возраст, образ жизни, экологические условия и многое другое.
Развитие методов генной инженерии позволило ученым воспроизводить определенные генетические изменения не только на отдельных культурах клеток, но и на полноценных живых организмах. Такие организмы используются для моделирования болезней человека на системном уровне, где можно исследовать взаимодействие генов с гормонами, нейромедиаторами, ростовыми факторами и прочими регуляторами, которые невозможно полностью воссоздать в искусственной среде. Ранее, в рамках проекта «Модельные организмы» (см.: «Кто такие модельные организмы?» [5]) мы рассказывали о тех животных, которые внесли самый большой вклад в развитие биологии, а здесь мы познакомим вас с теми животными, которые используются для моделирования заболеваний человека с применением новейших методов генного редактирования.
Немного истории, или первые шаги в использовании трансгенных животных
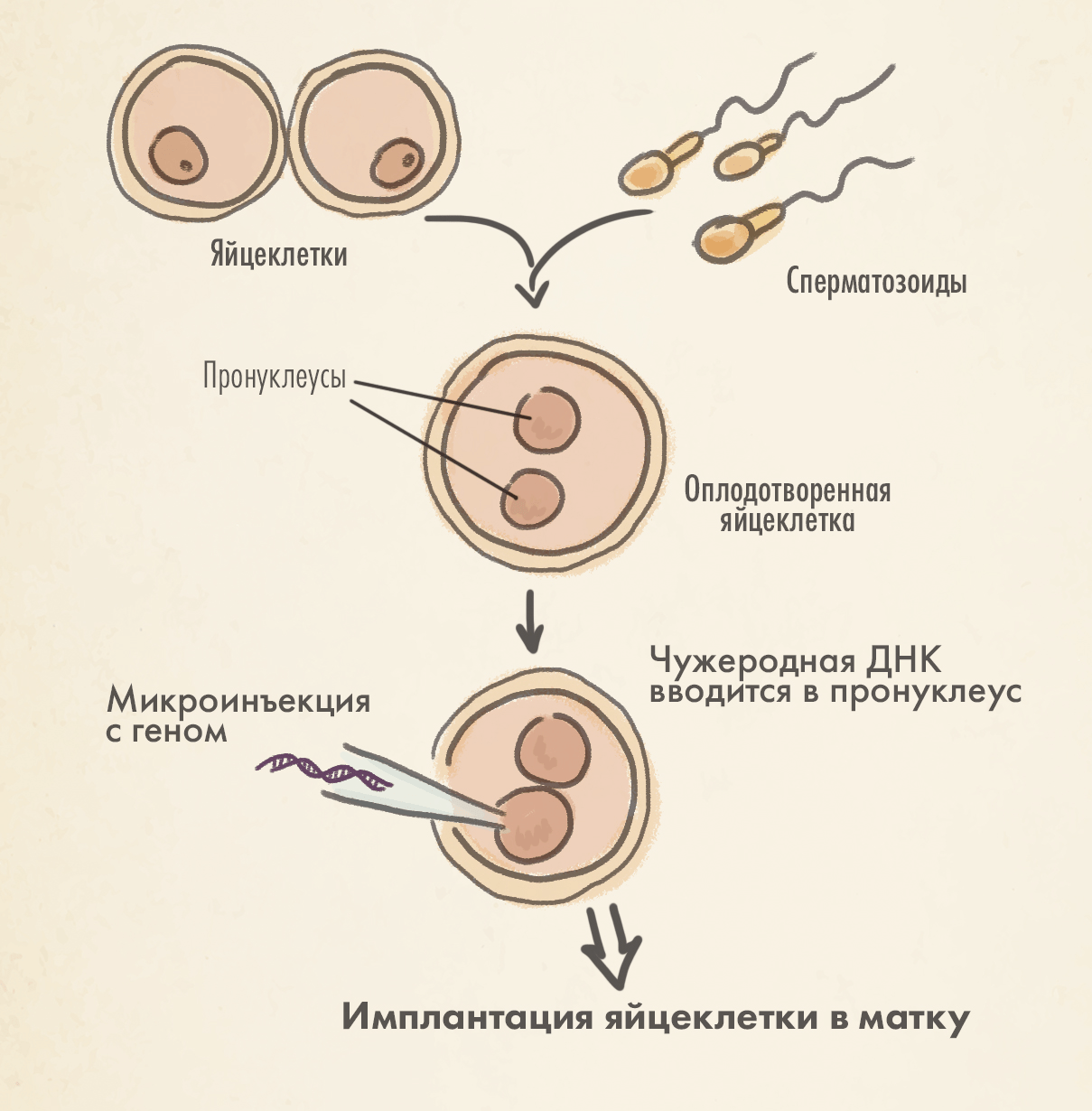
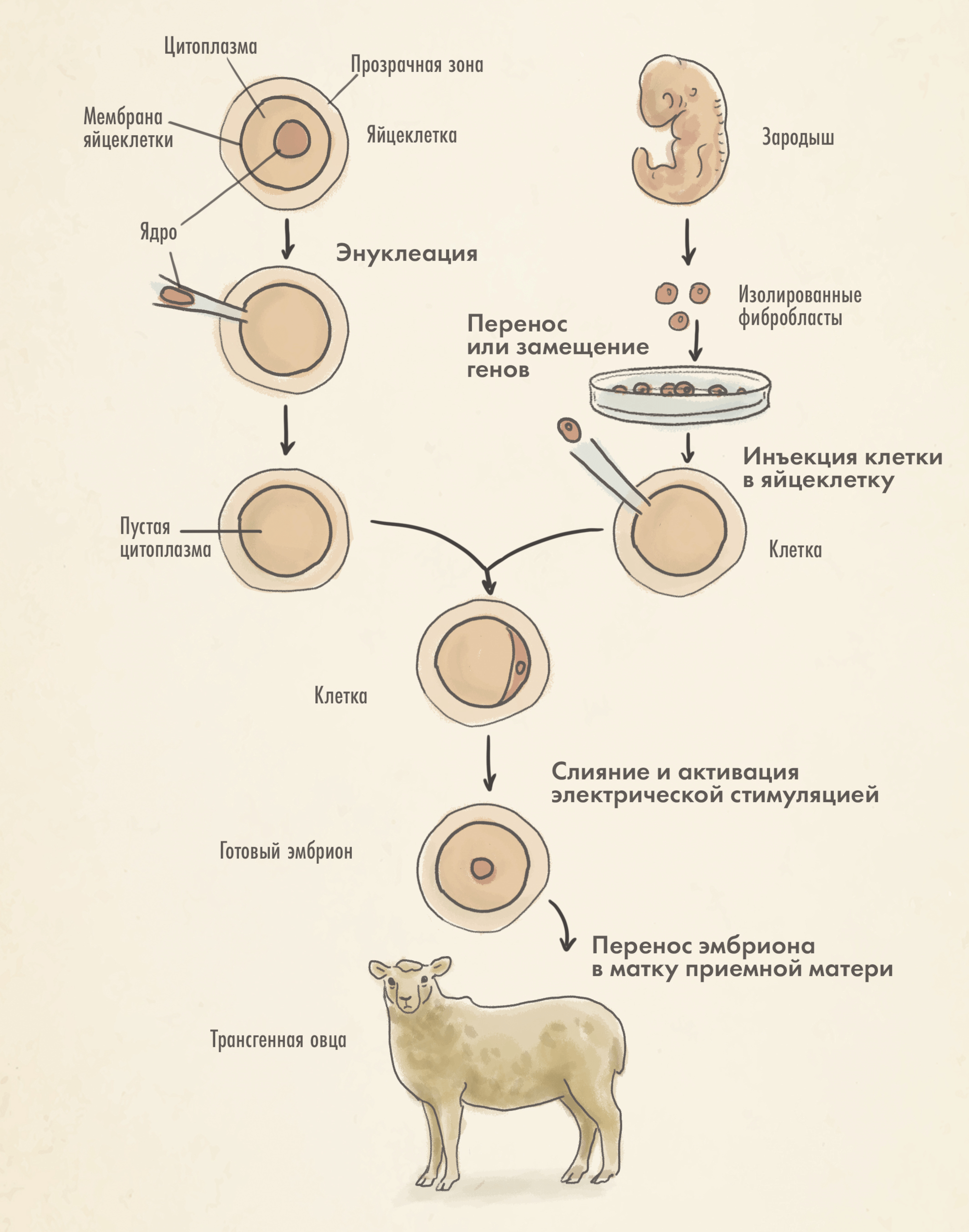
Первые шаги в создании трансгенных животных были сделаны довольно давно — Рудольф Йениш создал первую трансгенную мышь в 1974 году. Это стало возможно благодаря разработке новой методики введения чужеродной ДНК в пронуклеус эмбриональной клетки (рис. 8А). Однако, чтобы усовершенствовать эту методику и добиться возможности получения трансгенных мышей, способных к воспроизведению, понадобилось еще восемь лет кропотливой работы. Этот же метод был успешно адаптирован для создания трансгенных моделей кроликов, овец и свиней (1985), крыс (1990) и коров (1991). Наравне с млекопитающими были получены трансгенные модели нематоды Caenorhabditis elegans [6], плодовой мушки Drosophila [7], лягушки Xenopus [8] и некоторых рыб [9].
Пронуклеусом называют ядра гамет в составе оплодотворенной зиготы до их слияния и образования первой клетки нового организма.
Генная и клеточная инженерия, зародившаяся в исследованиях культур клеток прокариот и эукариот, стремилась решить более сложные задачи с использованием трансгенных животных [10]. Доставить чужеродную ДНК в мышь — это, конечно, хорошо, но если мы «выключим» определенный ген (knock-out) [11] или изменим его работу (knock-in), то что изменится в организме? А что, если мы сможем имитировать на животных редкие генетические заболевания или находить гены, ответственные за развитие болезней, имеющих лишь наследственную компоненту? Всеми этими вопросами задавались исследователи, и это требовало значительного совершенствования методов создания генномодифицированных животных.
Дело в том, что у технологии микроинъекции линейной ДНК в пронуклеус эмбриональной клетки есть важный недостаток — низкая эффективность. Чтобы добиться рождения хотя бы небольшого процента трансгенных животных, требовалось вводить тысячи копий линейной ДНК, что особенно затрудняло работу при переходе от грызунов к более крупными млекопитающим [10]. Кроме того, геном сложноорганизованных эукариотических клеток требовал инструментов, обеспечивающих высокую точность и стабильность проводимых изменений. Поэтому основными направлениями развития современной генной и клеточной инженерии в контексте развития трансгенных моделей животных (рис. 1) можно считать:
-
совершенствование методов доставки измененной ДНК в клетки эмбрионов животных;
-
поиск типов клеток, в которые было бы удобнее переносить модифицированную ДНК; и
-
разработка более точных и эффективных инструментов модификации ДНК.
О том, как решаются в настоящее время эти проблемы и как используются самые современные генно-инженерные инструменты, такие как знаменитая CRISPR/Cas9, мы расскажем во второй части статьи.
Пушистые спасители, или как используются генномодифицированные животные
Некоторые виды животных служат человеку многие тысячи лет и проходят с ним самые сложные этапы развития человечества. Домашний скот дает молоко и мясо, помогает сеять и собирать урожай; собака охраняет дом и пасет стада; а кошка охраняет амбары от грызунов и просто делает нас счастливее (читайте об этом тут: «Ветеринария: эволюция, революции, инновации» [16]). С развитием науки в начале 20 века животные стали использоваться в качестве модельных организмов для экспериментов в физиологии, биохимии, фармакологии, генетике и многих других биомедицинских дисциплинах. Развитие генной и клеточной инженерии не только открыло новые горизонты в селекции и гибридизации сельскохозяйственных животных, но и значительно расширило возможности молекулярной биологии. Генноинженерные модели стали незаменимым инструментом для изучения множества заболеваний человека. Эти модели активно применяются для исследований сердечно-сосудистых заболеваний, метаболических нарушений, нейродегенеративных и онкологических процессов, аутоиммунных заболеваний, а также некоторых психиатрических дисфункций [17]. Эти болезни роднит сложный и системный характер, часто связанный с наследственной предрасположенностью, но определяемый не единичным геном, а взаимодействием множества генов и факторов окружающей среды. Именно сложность многофакторных наследственных заболеваний делает их изучение чрезвычайно трудным. У людей, как правило, трудно определить, какой именно ген или группа генов несет ответственность за развитие того или иного нарушения. Однако использование трансгенных животных позволяет воспроизводить уникальные мутации и изучать их последствия. Например, ученые могут «выключить» конкретный ген (loss-of-function) или изменить его работу и оценить, к каким функциональным изменениям это приведет. Такой подход помогает не только разобраться, как определенный ген влияет на организм, но и глубже понять биохимические и физиологические механизмы, лежащие в основе тех или иных процессов.
Другое важное применение моделей трансгенных животных — исследование редких (орфанных) заболеваний [18]. Такие болезни поражают ограниченное количество людей, чем сильно усложняют исследования их механизмов и поиск способов лечения. С одним из таких примеров вы сможете ознакомиться в третьей части нашей статьи, где мы расскажем, как причины развития дыхательной недостаточности при муковисцидозе были изучены с помощью генномодифицированных хорьков.
Что лежит в ящике с инструментами генного инженера?
Любая современная технология требует использования высокоточных инструментов для ее реализации. И если для тяжелой промышленности нужны мощные лазеры и роботизированные станки (и еще много чего другого), то для биотехнологии ключевую роль играют специализированные молекулярные инструменты, позволяющие аккуратно вносить изменения в генетический материал организма-мишени. К счастью, большую часть работы в этом направлении за нас сделала эволюция, снабдив вирусы разнообразными белками (или кодирующими их генами), которые помогают не только успешно попасть в организм «хозяина», но и встроить свою генетическую информацию в его геном.
Другие инструменты, а именно ферменты, способные разрезать или модифицировать чужеродный генетический материал, появились в клетках бактерий и некоторых эукариот в ответ на вирусную угрозу. Эти инструменты совершенствовались миллиарды лет, а мы знаем о них всего несколько десятилетий. Тем не менее, применение этих инструментов в биотехнологии уже позволило добиться серьезных успехов, и ниже я расскажу об основных особенностях этого молекулярного арсенала. Методы генной инженерии мы уже разбирали подробно в материалах спецпроекта «12 биологических методов в картинках» [1]; тут приведем лишь краткий обзор этих подходов, который поможет вам освежить в памяти основные достижения и современные технологии, лежащие в основе генной инженерии.
Как доставить чужеродную ДНК в клетки животных?
Если вы боитесь ГМО, то лучше пропустите этот раздел. В нем мы разберем вопрос: как сделать, чтобы трансген достиг своей цели и «прижился» в эукариотической клетке? Изощренные молекулярные инструменты — безусловно, важный фактор в успешном получении трансгенных животных; но не менее значимым этапом является доставка измененного генетического материала или инструментов для его изменения (например, CRISPR/Cas9). Поэтому теперь мы рассмотрим методы внедрения трансгена в клетки животных (рис. 6).
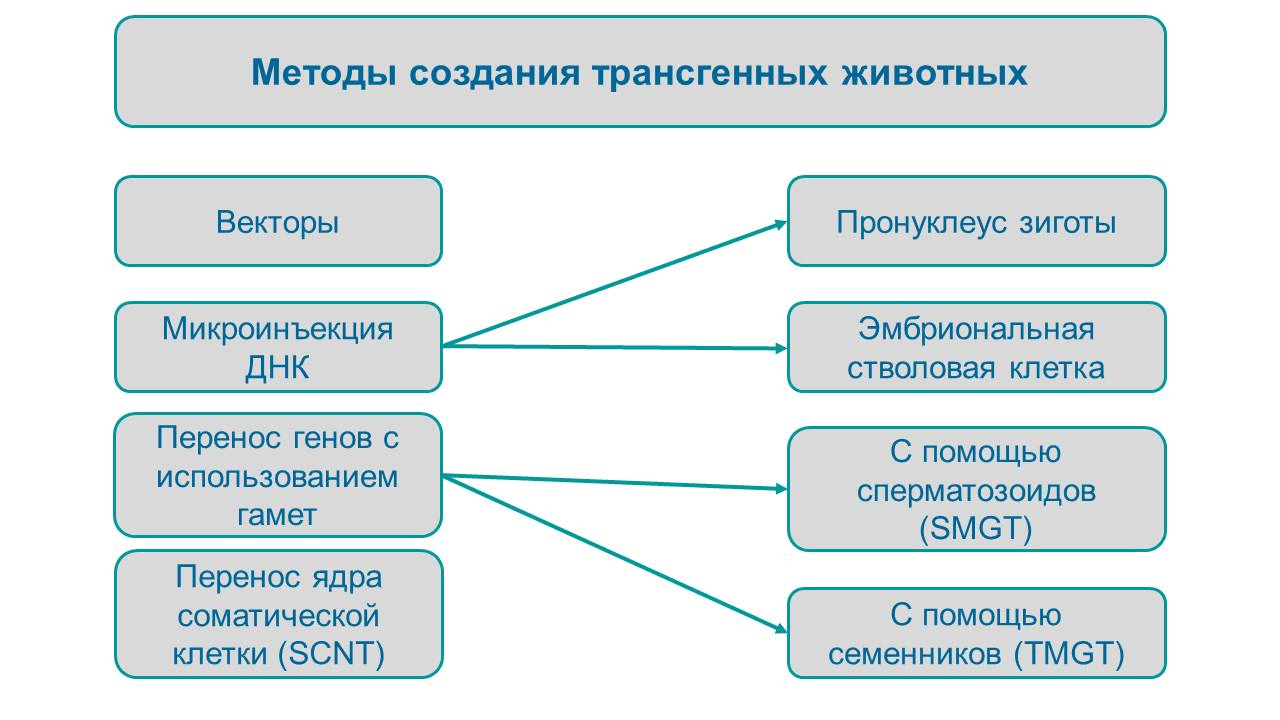
Рисунок 6. Основные способы доставки чужеродной ДНК в клетки трансгенных животных.
рисунок автора по [33]
Векторы
в молекулярной биологии — это небольшие молекулы нуклеиновых кислот, чаще всего ДНК, которые служат «транспортером» для введения чужеродного генетического материала (например, генов) в клетки. При получении генномодифицированных бактерий чаще всего используются векторы на основе бактериальных плазмид или бактериофагов — вирусов бактерий. В экспериментах на более сложных эукариотических клетках, в том числе клетках животных и человека, нужно использовать более сложные векторы, и здесь лидирующую нишу заняли вирусы (рис. 7). Вот некоторые из наиболее популярных в практике [33].
-
Ретровирусные векторы — конструкции на основе РНК-вирусов, «умеющие» синтезировать ДНК из РНК благодаря ферменту обратной транскриптазе. В такой вектор помещается всего несколько тысяч нуклеотидов, что недостаточно для крупных генов; но фрагменты НК и небольшие гены таким образом доставить в клетку хозяина можно, поэтому ретровирусные векторы использовали для создания препаратов CAR-T-терапии [34]. Об одном из наиболее популярных ретровирусных векторов — лентивирусном — мы подробно рассказывали в специальной статье спецпроекта [35]. Лентивирусные векторы способны интегрироваться в геном клетки-хозяина и обеспечивать не только стабильную и долговременную экспрессию введенных генов, но и их передачу при каждом клеточном делении. Несомненный плюс таких векторов для создания трансгенных моделей животных — способность нести систему CRISPR/Cas9.
-
Векторы на основе аденоассоциированного вируса (AAV). Вирус, который изучали еще с 1960-х, поначалу вызывал исключительно научный интерес. Но знания, накопленные за десятилетия его исследования, легли в основу его практического применения. AAV-векторы могут нести ≈4700 пар нуклеотидов генетического материала и не способны к самостоятельной репликации (требуют наличия вирусов-помощников: аденовируса или вирус герпеса), что снижает их патогенность. Гены, доставляемые при помощи AAV, сохраняются в клетке в виде эписомы — независимой молекулы ДНК, аналогичной плазмидам у бактерий. Они не встраиваются в геном клетки-хозяина, что значительно снижает риск случайного повреждения собственных генов организма и повышает безопасность создания моделей in vivo.
Об AAV и о том, как они стали самым популярным вектором для генной терапии, читайте в одной из статей спецпроекта: «Время первых: как аденоассоциированные вирусы стали лучшими в доставке генов in vivo» [36].
-
Аденовирусный вектор на основе безоболочечного ДНК-вируса используется достаточно широко [37] и может нести больше «полезной нагрузки» в сравнении с двумя вариантами выше; также генные инженеры научились дополнительно «кастомизировать» его, еще больше увеличивая количество переносимой ДНК. Автоинженеры снимают с гоночных болидов «Формулы 1» все лишнее — так же и биоинженеры удалили из ДНК вируса все кодирующие последовательности, не нужные для доставки модифицированного генетического материала в клетки-мишени [33].
-
Липидные наночастицы (lipid nanoparticles, LNP) — это молекулярные комплексы липидов и нуклеиновых кислот. В последние годы их популярность для доставки терапевтических препаратов на основе ДНК и РНК набирает обороты. Уже есть одобренные препараты на основе LNP, такие как патисиран (patisiran, Onpattro), механизм действия которого основан на принципе РНК-интерференции (используется для лечения редкого наследственного заболевания полинейропатии). Другим примером успешного использования LNP стали мРНК-вакцины против SARS-CoV-2 [38] компаний Moderna и Pfizer/BioNTech.
Этот же подход начали применять для создания трансгенных животных. В частности, с помощью LNP уже удалось доставить мРНК рекомбиназы Cre в организм и добиться флуоресценции в определенных клетках трансгенной мыши, имеющей «вставку» с геном флуоресцирующего белка Lox-Stop-Lox-tdTomato. Также LNP используют для доставки системы CRISPR/Cas9. С помощью LNP вводят мРНК, кодирующую белок Cas9 и направляющую РНК (sgРНК), что позволяет редактировать гены непосредственно в клетках мышей. В настоящее время технология доставки компонентов системы редактирования генома еще нуждается в оптимизации, что связано с большим размером таких систем как CRISPR/Cas9, однако у технологии LNP определенно есть потенциал [39].
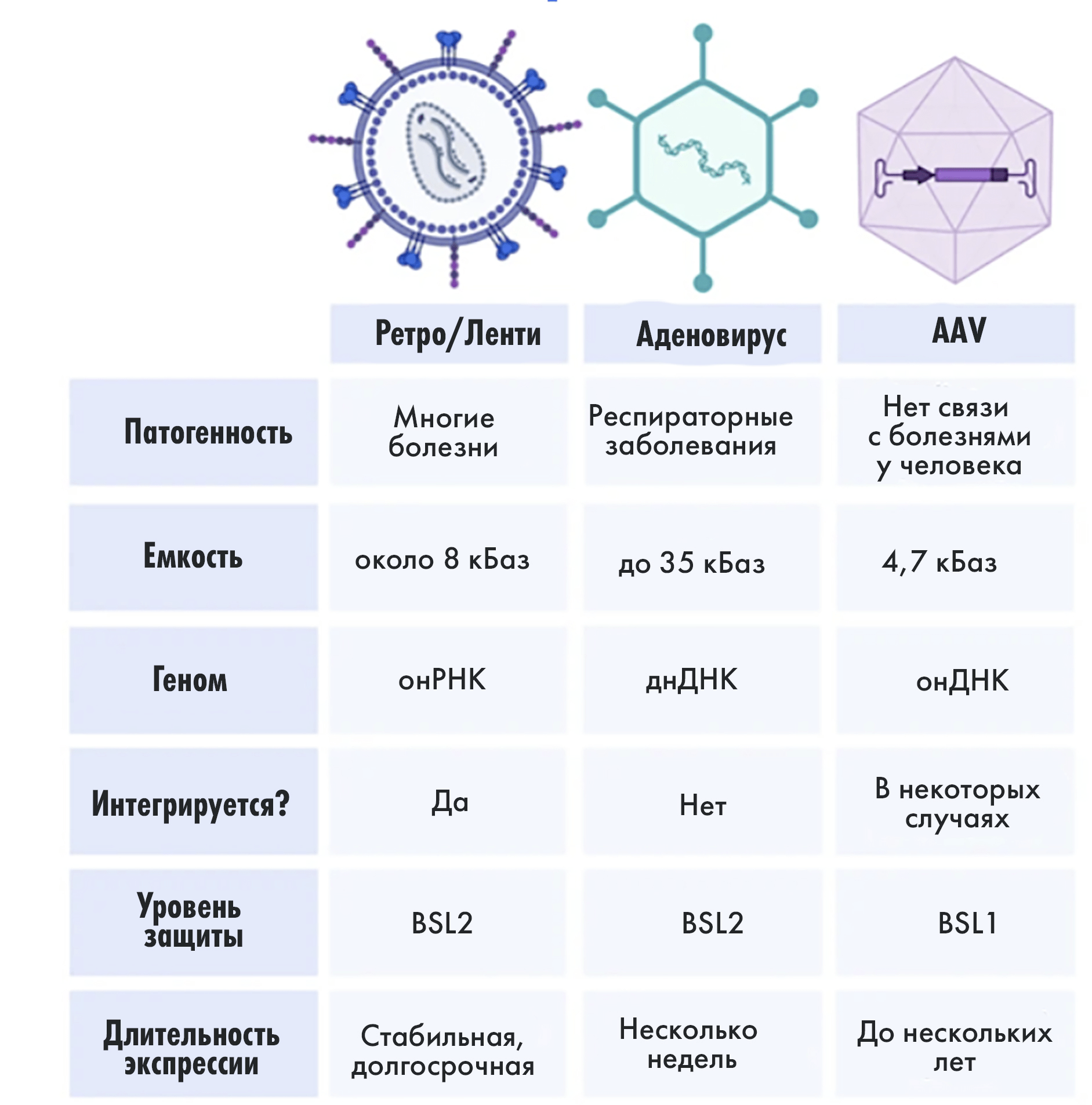
Рисунок 7. Самые распространенные вирусные векторы в генной инженерии. кБаза — килобаза (одна тысяча (пар) азотистых оснований); онРНК — однонитевая РНК, днДНК — двунитевая ДНК, онДНК — однонитевая ДНК; BSL1/2 (biosafety levels 1, 2) — уровни биологической безопасности 1, 2.
иллюстрация Елены Беловой по Viral Vectors 101: Types of viruses
Микроинъекция ДНК в клетку
Доставить трансген в клетки животного можно и без участия вирусных векторов. В таком случае используется трансфекция, то есть доставка чужеродной ДНК непосредственно в организм животного с помощью микроинъекции. В таком случае модифицированные гены попадают в организм уже на самых ранних стадиях эмбрионального развития, а значит будут присутствовать практически во всех клетках животного. Поэтому эти методы не подходят для введения трансгена в какой-то конкретный тип клеток (рис. 8).
-
Микроинъекция ДНК в пронуклеус зигот — один из самых старых, но не самых надежных методов (рис. 8А). Изобретенный еще в 1980-е, он использовался на множестве средних и крупных млекопитающих: кроликах, свиньях, козах и даже коровах, чем заслужил большое признание в животноводстве . Для доставки ДНК требуется большое количество зигот, при этом в каждую клетку должно попасть 500–5000 копий трансгенной ДНК для того, чтобы эффективность трансфекции достигла 1–4%. Это означает, что из сотни инъецированных клеток получается только 1–4 трансгенных мыши. А у более крупных млекопитающих эффективность еще ниже.
Кстати, если хотите подробнее почитать о животноводстве, то у нас есть целый спецпроект «Животноводство и ветеринария», посвященный этой теме.
-
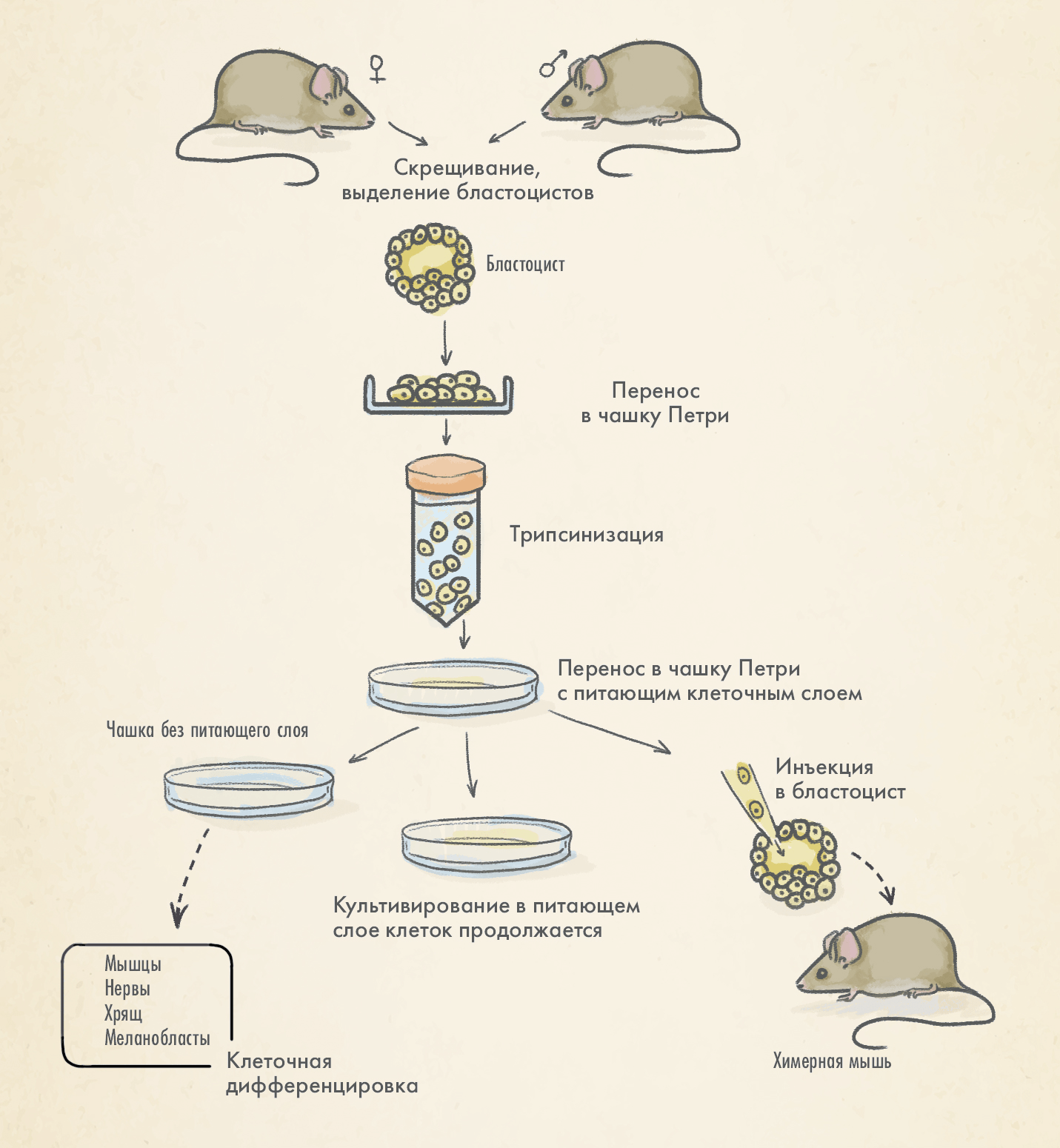
Эмбриональные стволовые клетки (ЭСК). Использование стволовых клеток стало логичным развитием технологии переноса трансгенной ДНК (рис. 8Б). ЭСК недифференцированы, следовательно, могут развиваться в любой тип клеток. Соответствующий трансген вводится в культуру эмбриональных стволовых клеток in vitro с использованием гомологичной рекомбинации, о которой мы упоминали выше [33].
Массовый перенос генов с использованием гамет
В какой-то момент ученые задумались: «если мы хотим доставить измененную ДНК в яйцеклетку, почему бы нам не использовать самый естественный вектор, выточенный за сотни миллионов лет эволюции?». Оказалось, что инкубация сперматозоидов с плазмидной ДНК при определенных условиях приводит к переносу генетического материала в ядро гаметы, и дальнейшее слияние с яйцеклеткой приводит к экспрессии нужного гена. Вот какие методы используют гаметы:
-
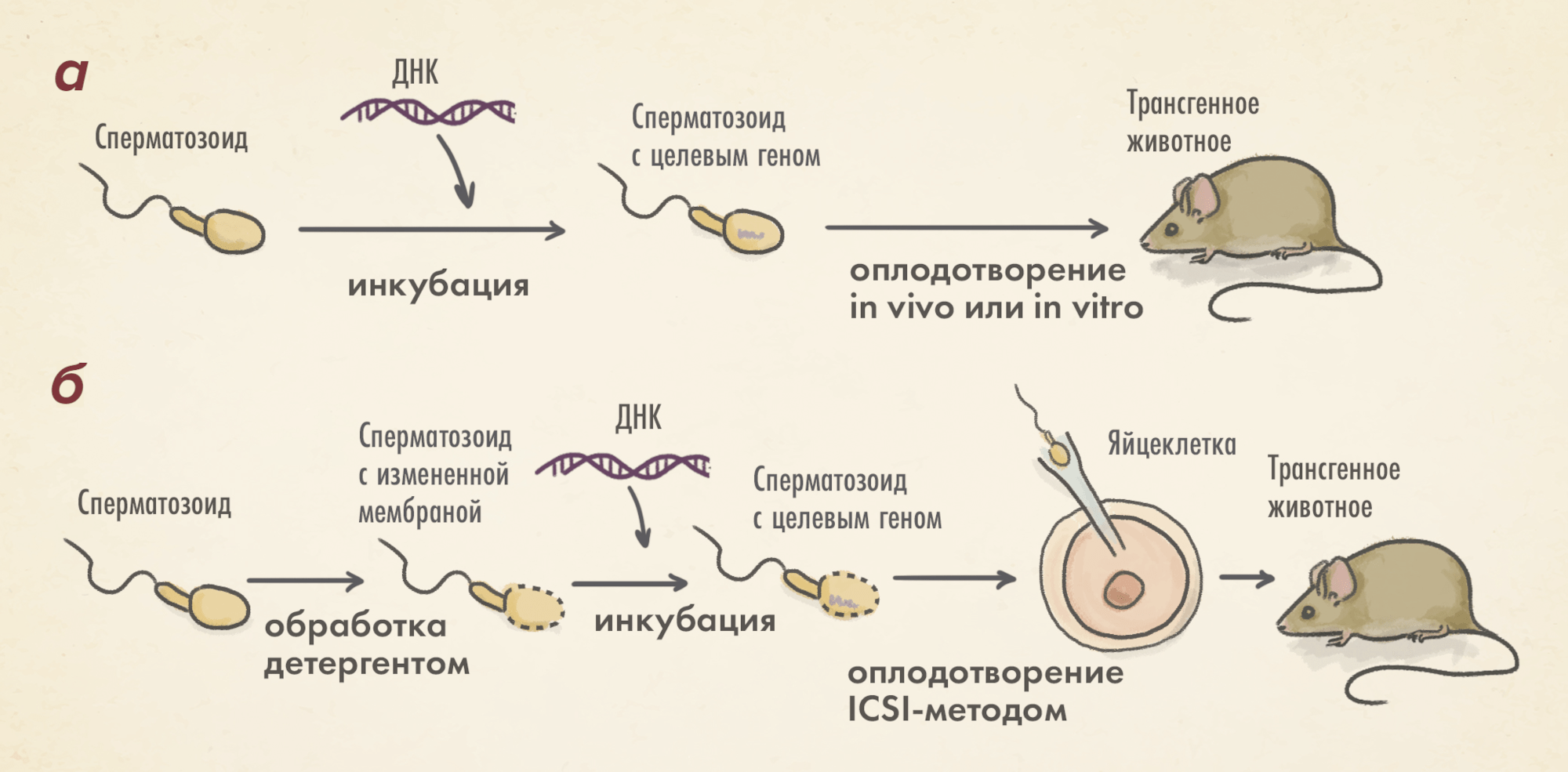
Перенос с помощью сперматозоидов (SMGT). В основе метода лежит способность сперматозоидов взаимодействовать с молекулами чужеродной ДНК. Данный метод получил широкое распространение в 2000–10-е годы при создании моделей трансгенных животных и в сельском хозяйстве (рис. 8В). В отличие от микроинъекции в пронуклеус, этот метод проще в использовании и дешевле. Частной модификацией SMGT является введение сперматозоидов, инъецированных трансгенной ДНК, прямо в цитоплазму ооцита. Этот метод успешно применяется не только для получения трансгенных животных, но и в рамках вспомогательных репродуктивных технологий у человека (естественно, сперматозоиды в такой ситуации не содержат никакой трансгенной ДНК, только «натурпродукт»). Технология SMGT может быть использована для переноса крупных фрагментов ДНК, в том числе целых искусственных хромосом [40].
-
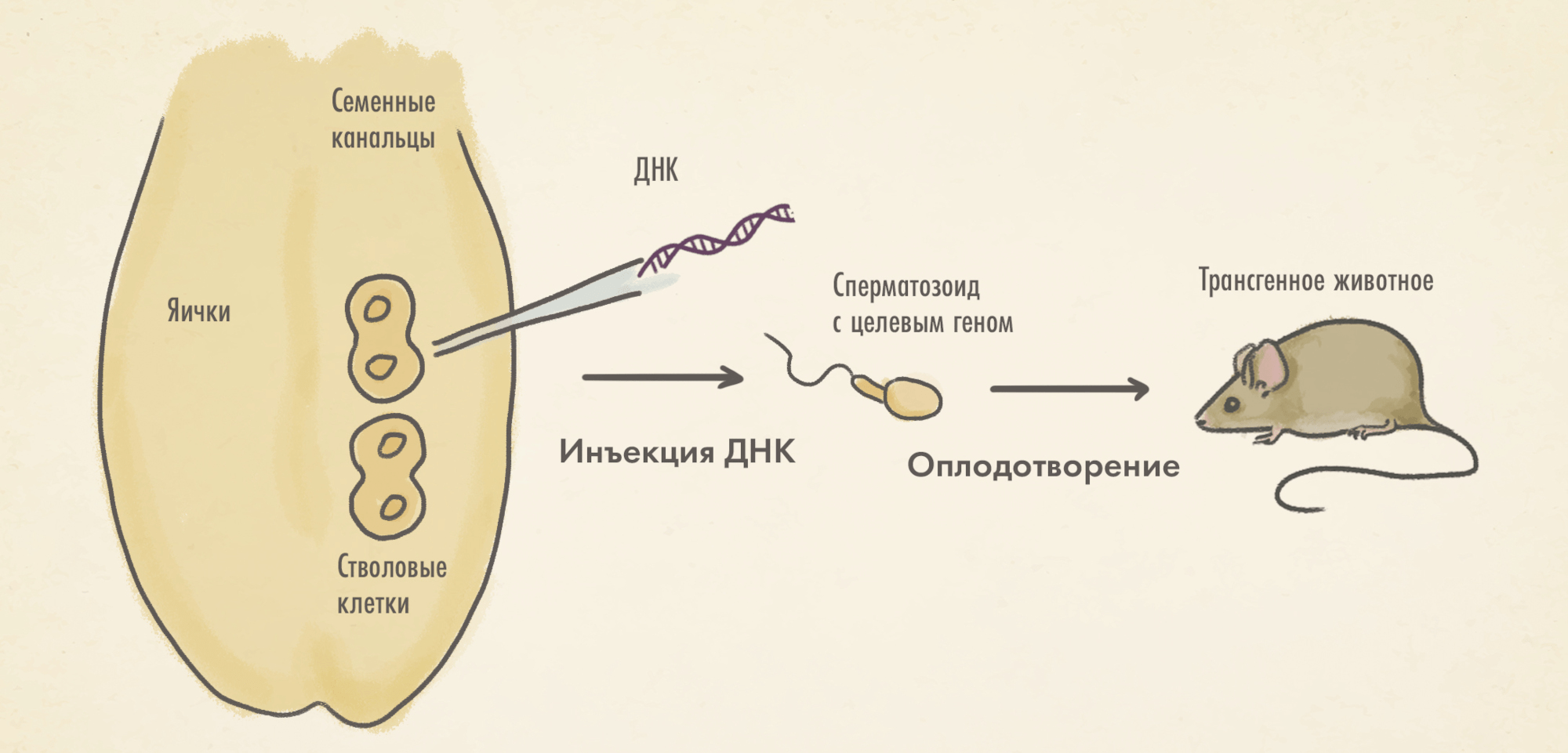
Перенос, опосредованный семенниками (TMGT). В основе этого метода лежит перенос чужеродной ДНК непосредственно в семенники животного (рис. 8Г). Технология может быть реализована с помощью прямой инъекции вектора в семенник. Другой, более распространенный подход — это использование предшественников сперматозоидов (сперматоцитов или сперматогониев [41]), которые инкубируются с модифицированной ДНК; затем производится инъекция в яичко, где эти сперматоциты продолжают дифференцироваться и превращаются в функциональные сперматозоиды. Одна из сильных сторон этого подхода — семенные канальцы яичка окружены гематотестикулярным барьером (аналогичным гематоэнцефалическому [42]) и поэтому внедрение генномодифицированных сперматоцитов не вызывает иммунного ответа со стороны организма хозяина. Кроме того, работа со сперматоцитами и сперматогониями в условиях ex vivo позволяет использовать любые вирусные векторы и отбирать только те клетки, которые были трансдуцированы [33].
-
Перенос ядра соматической клетки (SCNT). В основе метода — перенос модифицированного ядра в яйцеклетку, которая этого ядра лишена (рис. 8Д). Этот процесс позволяет «перепрограммировать» взрослую соматическую клетку, превращая ее в зародышевую; при этом генетический материал зиготы идентичен геному донора ядра. Затем зигота имплантируется в материнский организм. Благодаря тому, что ядро искусственно вводится в яйцеклетку, эффективность метода гораздо выше. Но в то же время этот метод гораздо более трудоемкий по сравнению с прочими и не слишком активно применяется для создания трансгенных животных. Скорее, он занял специфическую нишу в сельском хозяйстве, а также может быть использован для клонирования вымерших видов животных [43].
* * *
Завершая обзор методов, хотелось бы особенно отметить, что успехи в развитии генной и клеточной инженерии за последние 30 лет позволили превратить создание трансгенных моделей животных в рутинную процедуру. Огромную роль в этом сыграло появление нуклеаз, таких как ZFN, TALEN и особенно CRISPR/Cas9. Многообразие методов доставки чужеродной ДНК в клетку многократно повысило эффективность этих процедур и снизило стоимость. Широкий арсенал биоинженерных инструментов позволил создавать модели трансгенных животных самых разных видов — от нематод до приматов. В следующем разделе мы рассмотрим несколько интересных на наш взгляд примеров применения приведенных выше методов для создания трансгенных животных.
Трансгенные животные как модели заболеваний человека
С момента появления первых трансгенных животных в 1970–80-е годы их стали использовать для фундаментальных исследований в биологии. Новые модели принесли большую пользу в исследовании клеточных и физиологических механизмов, изучение которых было невозможно на культурах клеток. Также благодаря появлению трансгенных животных стало возможно моделировать заболевания человека, изучать их механизмы и искать эффективное лечение.
В самом простом варианте болезнь может быть связана с мутациями в одном гене. Это характерно для многих орфанных заболеваний [4] — например, для муковисцидоза [15], о трансгенной модели которого мы расскажем ниже более подробно. Но гораздо чаще заболевания связаны с целым набором мутаций в разных генах, которые еще нужно выявить и описать. В таком случае перед учеными стоит задача исследовать конкретные гены, которые вызывают заболевание. И с этой задачей помогают справиться уже хорошо изученные виды животных — те самые модельные организмы [5].
Например, для исследований нейродегенеративных заболеваний человека используют нематоду Caenorhabditis elegans [6], о чем мы тоже расскажем в этой главе статьи. С другой стороны, речь может идти об использовании трансгенных моделей для поиска лекарственных препаратов или новых схем лечения заболеваний человека. Тогда очень важно получить модель, которая будет максимально приближена к человеку. Здесь большим достижением стало появление гуманизированных моделей животных, которым пересажены отдельные клетки человека или целые ткани и органы. Самым распространенным гуманизированным животным стала мышь, которой активно пересаживают компоненты иммунной системы, кожи, клетки печени, островков Лангерганса поджелудочной железы и многое другое. Кроме того, развитие технологий, описанных в предыдущем разделе, подготовило почву для переноса технологий модификации генома с животных на человека. Подробнее о результатах этой работы вы можете прочитать в других статьях нашего спецпроекта «Генная и клеточная терапии».
Трансгенные животные и рак молочной железы
Онкологические исследования [45] стали одной из основных областей использования трансгенных животных. Высокое сходство генов человека и мыши, участвующих в механизмах онкогенеза, сделало последнюю отличным модельным животным для этих исследований. В рамках этой статьи мы сосредоточимся только на моделях рака молочной железы — одном из самых распространенных онкологических заболеваний. По данным ВОЗ, рак молочной железы по распространенности занимает второе место в мире (11,6% или 2,3 млн заболевших из всех случаев онкологических заболеваний по данным на 2022 год), уступая только раку легких (12,4% или 2,5 млн случаев) [46].
Появление таргетной и иммунотерапии в онкологии значительно обогатило арсенал средств лечения рака и позволило улучшить прогнозы лечения и уменьшить побочные эффекты [34], [47]. Однако пациенты по-разному реагируют на терапию из-за индивидуальных особенностей развития опухолей. Поэтому очень важен поиск надежных биомаркеров, которые помогут выбрать наиболее эффективную терапию. Онкогенез — очень динамический процесс, в ходе которого происходят многочисленные генетические и эпигенетические изменения, а различные способы лечения могут даже подстегивать процессы эволюции опухолей. Кроме того, раковые клетки крайне гетерогенны генетически и фенотипически, что осложняет моделирование опухолей in vitro. В настоящее время исследования in vitro постоянно развиваются, появляются все новые подходы, такие как создание органоидов (опухолевых тканей, обладающих внутренней структурой, имитирующей реальную опухоль). Однако все эти модели не могут в полной мере отражать динамические изменения опухоли в живом организме.
В исследовании рака на животных используют два основных подхода. Первый заключается в применении ксенографтных моделей животных, которым были пересажены либо фрагменты опухолей пациентов (модель PDX — patient-derived xenograft model), либо клетки опухолевых клеточных линий человека. Это позволяет отслеживать развитие конкретных видов раковых опухолей и определенных генов, сыгравших ключевую роль в их развитии. В настоящее время создано множество ксенографтных моделей разных видов рака, которые позволяют точно имитировать определенные подтипы заболевания.
Несмотря на большие успехи в разработке таких моделей, у них есть и ограничения, касающиеся в первую очередь взаимодействия человеческой опухоли и иммунитета животного [48]. В частности, приходится использовать для этой цели «голых» мышей без иммунной системы, чтобы человеческие клетки не отторгались. Такие модели, следовательно, практически упускают из вида важный аспект взаимодействия иммунной системы и опухоли. Одно из решений — мыши с гуманизированной (то есть частично очеловеченной) иммунной системой, которые с успехом применяются для изучения иммуноонкологических препаратов, моделирования инфекций и аутоиммунных заболеваний [49]. Таких мышей получают генетической модификацией с помощью описанных выше методов, заменяя мышиный ген, кодирующий какой-либо белок иммунной системы, на гомологичный человеческий.
Второй подход представляет собой создание генномодифицированных мышей, которые больше подходят для изучения роли конкретных генов в развитии рака. Существует несколько способов вызвать у мышей развитие опухоли. Самый старый и простой — использование химических канцерогенов, которые вызывают генетические изменения, провоцирующие развитие опухоли. Однако такие модели вызывают малопредсказуемую картину развития рака, что ограничивает их использование. Другой подход — собственно внесение генетических изменений с использованием специфических инструментов, описанных выше. Здесь исследовательская мысль пошла по двум путям:
-
создание моделей, экспрессирующих чужеродные (трансгенные) протоонкогены, кодирующие белки, вовлеченные в регуляцию клеточного деления и способные вызвать злокачественное перерождение клеток;
-
удаление генов — супрессоров опухолей, которые кодируют белки, защищающие клетку от перехода на скользкую дорожку онкогенеза.
Для поиска лекарственных препаратов и изучения их эффективности используются трансгенные модели мышей, у которых развитие опухолей происходит в определенный период их жизни под влиянием конкретных факторов (например, какого-то химического вещества). Для этого протоонкогены экспрессируются в областях генома, которые находятся под контролем ряда тканеспецифичных промоторов — участков ДНК, активных именно в клетках молочной железы. Эти промоторы активируются под действием разнообразных факторов. Так, например, промотор вируса опухоли молочной железы у мышей (MMTV) начинает работать при половой зрелости, беременности или лактации. Другим способом активировать онкогенез клеток может уже знакомая нам рекомбиназа Cre. Если тканеспецифичный промотор позволяет управлять экспрессией онкогена, то система Cre-LoxP также может либо активировать экспрессию протоонкогена за счет специфической рекомбинации или подавлять экспрессию генов супрессии опухолей за счет вырезания участка гена [50].
Сверхэкспрессия или повышенная активность рецепторов (HER2) на клеточной поверхности часто наблюдаются при метастатическом раке молочной железы (рис. 9), в связи с чем эти рецепторы стали привлекательными мишенями для лекарственных средств. А мышь со сверхэкспрессией рецептора HER2 стала первой моделью рака молочной железы еще в далеком 1988 году. Далее эта технология постепенно совершенствовалась, а скорость, частота развития и агрессивность опухоли увеличивались по сравнению с первыми экспериментами [50].
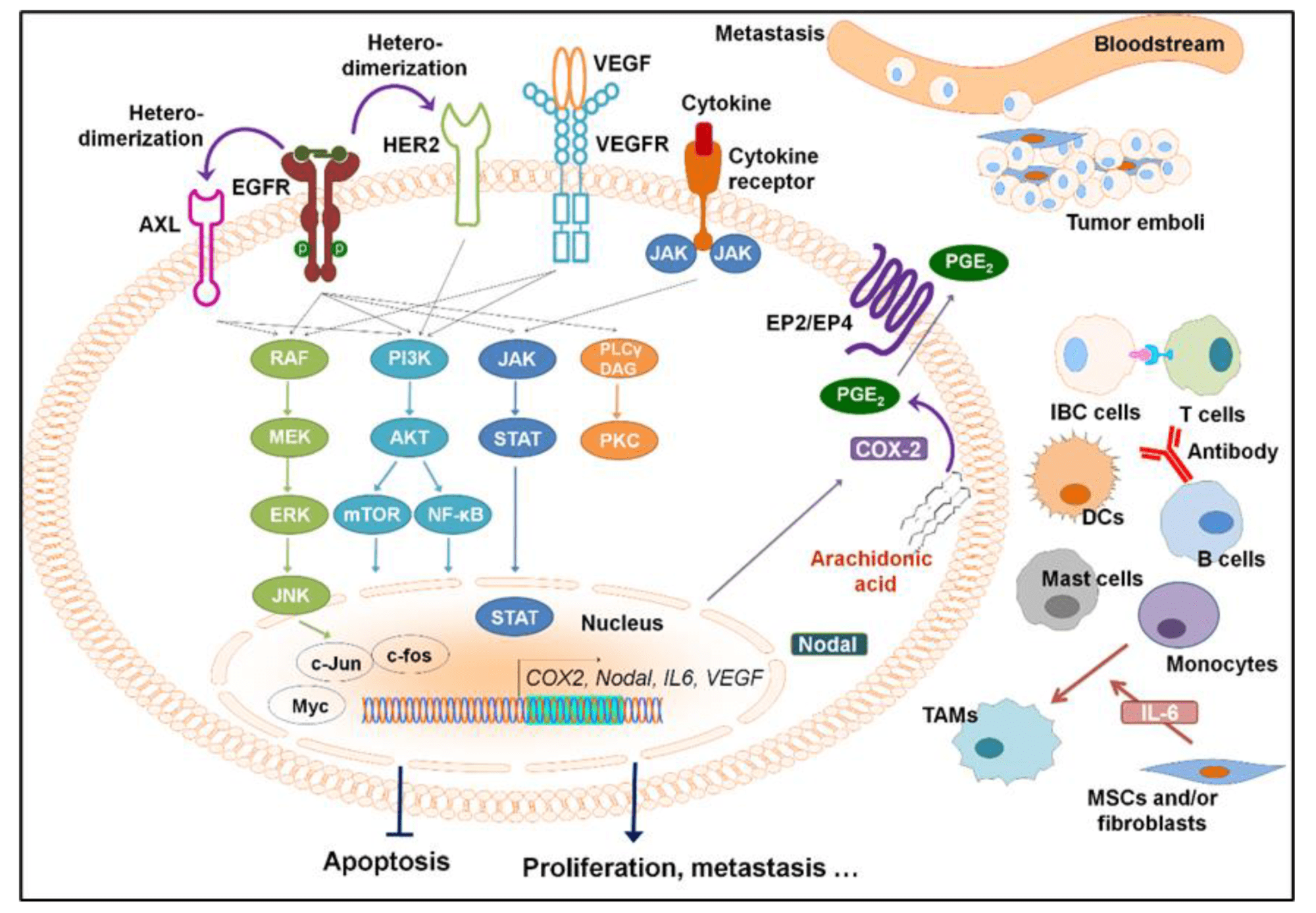
Рисунок 9. Основные сигнальные пути клетки, связанные с развитием рака молочной железы. На схеме показаны основные белки, регулирующие способность клетки к росту, делению и дифференцировке. Ген, кодирующий белок HER2 на клеточной поверхности, упомянут в нашем тексте как важный триггер в развитии онкологии и используются для создания трансгенных моделей мышей. Взаимодействие HER2 и рецептора EGF1 (EGFR1) со своими лигандами приводит к запуску внутриклеточных сигнальных каскадов, в результате чего активируется экспрессия тех генов, которые обеспечивают рост и деление клеток, а также метастазирование опухолей. VEGF — фактор роста эндотелия сосудов; PI3K — фосфоинозитид-3-киназа; RAF — протоонкогенная серин/треониновая протеинкиназа; mTOR — мишень рапамицина у млекопитающих; NF-kB — ядерный фактор κB; MEK — митоген-активируемая протеинкиназа; ERK — центральная MAP-киназа клетки; JNK — N-концевая киназа c-Jun; STAT — транскрипционный фактор STAT.
В размножении клеток и росте тканей огромную роль играют белки — ростовые факторы. Многие из способны запустить и рак, поскольку такие молекулы служат сигналом для клеток на рост и деление. Эти ростовые факторы доставляют много хлопот онкологам, вызывая метастазирование опухолей. Наиболее заметную роль в патогенезе рака молочной железы играют трансформирующий фактор роста β (TGFβ) и инсулиноподобные факторы роста I и II (IGF1 и IGF2). Поэтому трансгенные модели мышей со сверхэкспрессией самих ростовых факторов или их рецепторов находят применение в онкологических исследованиях. Однако полученные в таких исследованиях данные зачастую сложно перенести на человека, чем объясняется практически полное отсутствие успешных клинических испытаний препаратов, исследованных на подобных моделях [50].
Предпринимались попытки разработать ингибиторы рецептора IGF1 (IGF-1R) для лечения рака — первый такой препарат вошел в клинические исследования в 2003 году, и с тех пор в 183 исследованиях побывали 16 препаратов. Однако ни один не был одобрен, несмотря на хорошие данные на мышах, что иллюстрирует сложность трансляции доклинических данных в клинику [52].
Несмотря на такое высокое разнообразие моделей, специалисты призывают с большой осторожностью сопоставлять модели животных и подтипы рака молочной железы, а также соотносить полученные на этих моделях результаты с данными ксенографтных моделей. Несмотря схожий набор генов, вовлеченных в развитие того или иного подтипа рака, онкологи отмечают, что механизмы канцерогенеза таки сильно отличаются, что необходимо учитывать при переносе данных с животных моделей на человека, особенно трактуя результаты испытаний лекарственных препаратов. В настоящее время трансгенные мышиные модели используются для исследования механизмов канцерогенеза, а также в изучении активности препаратов, направленных на профилактику рака молочной железы, например, такого ретиноида как Bexarotene (Targretin) [53].
Трансгенные животные и заболевания центральной нервной системы
Исследование заболеваний нервной системы человека — очень сложная задача, ведь зачастую причиной болезни может быть не один, а множество генов и белков. Наиболее известны тут болезни Альцгеймера (БА) и Паркинсона (БП), боковой амиотрофический склероз, хорея Гентингтона и другие. Кстати, им посвящена отдельная статья спецпроекта по нейрофармакологии [54]. Подтверждает сложность исследования этих заболеваний и печальная статистика разработки лекарственных препаратов — огромное количество клинических испытаний закончились практически безрезультатно [55]. Другая группа заболеваний с явной наследственной компонентой — это психиатрические заболевания, такие как шизофрения, синдром дефицита внимания, посттравматическое стрессовое расстройство и многие другие. Животным моделям таких болезней посвящена статья на «Биомолекуле»: «Трансляционная психиатрия — как моделировать психические расстройства на животных?» [17].
Нейродегенеративные и психиатрические заболевания объединяет не только нарушение функций ЦНС, но и явная наследственная передача симптомов, а также сложность в установлении конкретных генов, вовлеченных в развитие болезни. Стратегии изучения механизмов развития этих заболеваний очень разнообразны. Часть моделей имитирует в основном определенные симптомы и не затрагивает геном; они создаются при помощи определенных химических веществ. В качестве примера таких фармакологических моделей можно вспомнить ротенон-индуцируемую и галоперидоловую модели БП или введение бета-амилоида для модели БА. Некоторые исследователи используют модели животных, у которых строение мозга максимально похоже на человека. Тогда выбор ученых падает на млекопитающих, и особенно на других приматов. Однако у этих моделей тоже есть свои ограничения, ведь нейронная сеть многих млекопитающих практически так же сложна, как и у человека, что затрудняет изучение молекулярных механизмов развития болезни. Чтобы изучить состояние отдельных нейронных цепей, а то и единичных клеток при той или иной мутации, нужна простая, понятная и хорошо изученная нервная система. И здесь на помощь исследователям приходят модели беспозвоночных: нематод, насекомых, моллюсков и рыб [56].
Старый друг приходит на помощь
Caenorhabditis elegans — один из классических организмов, широко используемый в эмбриологии, цитологии и, в том числе, в нейронауках. Только посмотрите, с какой любовью к этому милому червю пишет Марина Слащева в статье «Модельные организмы: нематода» [6]! Все дело в том, что C. elegans — организм с детерминированным, то есть строго определенным количеством клеток, а также полностью секвенированным геномом, что позволяет не только найти аналогичные человеческому гены, но и, используя специфические промоторы, внести генетическое изменение именно в те клетки, которые хочет исследователь.
Благодаря базе ортологов OrthoList2 для C. elegans известно 7943 гена-ортолога человеческих генов, что составляет 41% генома нематоды. Кроме того, C. elegans — тот редкий организм, для которого описан коннектом — вся нейронная сеть со всеми клетками и синапсами в них! Таким образом, в C. elegans можно внести изменения в конкретный ген конкретной линии нейронов, а если вместе с трансгеном в те же клетки поместить флуоресцентный белок, то за счет того, что нематода практически полностью прозрачна, можно визуализировать изменения, сопровождающие нейродегенерацию. Это в конечном счете позволяет точно связывать гибель или дисфункцию определенных клеток и фенотипические проявления заболевания [6].
Аналогичные по происхождению и выполняемым функциям гены организмов разных видов называются ортологами. А те гены, которые возникают в результате дупликации и затем приобретают разные функции в ходе эволюции — паралогами.
Болезнь Альцгеймера
Двумя основными молекулярными характеристиками БА считаются наличие в нервной ткани нерастворимых бляшек белков β-амилоида (Aβ) и нейрофибриллярных клубков, связанных с тау-белком. У млекопитающих Aβ накапливается во внеклеточных бляшках, после чего происходит их поглощение соседними клетками. Этот процесс вызывает формирование нейрофибриллярных клубков. У C. elegans нет точного ортолога тау-белка, как и белка-предшественника β-амилоида. Белок APL-1 нематоды является ортологом человеческих белков-предшественников бета-амилоида 1 и 2 (APLP1 и APLP2) и имеет высокий процент сходства с ними. Поэтому моделирование БА у C. elegans в первую очередь сосредоточено на переносе в геном нематоды тех участков генов APLP1 и APLP2, а также MAPT (ген тау-белка), которые сделают их белки максимально похожими на человеческие. Сосредоточив внимание на механосенсорных и глутаматэргических нейронах, исследователям удалось показать признаки нейродегенерации, такие как нейротоксичность амилоидных бляшек. Подобные эксперименты помогли определить ряд генов, которые могут играть роль ингибиторов или стимуляторов нейротоксичности. Например, такими генами стали APOEε2 и APOEε3, чья роль при лечении БА была подтверждена затем в исследовании на крысах [57].
Болезнь Паркинсона —
второе по распространенности в мире нейродегенеративное заболевание. Самые известные симптомы БП — это тремор и ригидность мышц, которые становятся следствием массовой гибели дофаминергических нейронов в области мозга со зловещим названием «черная субстанция». На «Биомолекуле» выходило множество статей, посвященных исследованию и поиску лекарственных препаратов для лечения этого заболевания [58], [59], [60]. Считается, что всего 10% случаев заболеваний имеют наследственный характер, в то время как остальные 90% возникают более или менее спонтанно. Генетические модели БП связаны с имитированием не всего заболевания, а конкретных его признаков. Такие классические признаки БП как тельца Леви, гибель нейронов в черной субстанции головного мозга или нарушение процессов аутофагии помогают лучше понять вклад генетической компоненты в развитие заболевания.
Тельца Леви содержат белок α-синуклеин [61]. Мутации в этом гене PARK1/SNCA у людей связаны с аутосомно-доминантным типом БП и приводят к нарушению структуры α-синуклеина и формированию телец Леви. У C. elegans есть ортологи PARK1/SNCA, что позволяет исследователям создавать модели сверхэкспрессии α-синуклеина (например, в дофаминергических нейронах C. elegans). Подобные модели широко использовались в сочетании с генетическим и лекарственным скринингом в рамках исследовательского проекта, включающего разные модельные системы (Drosophila, первичная культура мышиных и крысиных клеток). Они позволяют лучше понять влияние конкретных генов на развитие заболеваний и в будущем могут увеличить эффективность поиска лекарственных препаратов для лечения БП [57].
Трансгенные животные и орфанные заболевания человека
Исследования описанных выше заболеваний оправданы не только гуманистическими взглядами ученых и врачей, но и экономической необходимостью — ведь нейродегенерации и онкологические заболевания приводят к инвалидизации большого количества людей во всем мире, а тенденция к старению населения делает эту проблему еще острее. Однако есть заболевания, которые проявляются редко и встречаются у одного человека из многих тысяч. Это орфанные заболевания, о которых «Биомолекула» писала уже не раз (почитайте статью «Редко, но метко: орфанные заболевания как вызов современной медицине» [4] и другие [15], [62], [63]).
Муковисцидоз —
одно из самых распространенных орфанных заболеваний — 1 случай на 9000 в России (на «Биомолекуле» выходила про него статья «Муковисцидоз — первые надежды» [15]). Это заболевание связано с мутацией в гене CFTR, кодирующем трансмембранный хлоридный канал. Избирательный транспорт ионов через мембрану — один из важнейших процессов для поддержания постоянства внутренней среды в клетке, поэтому такая мутация приводит к нарушениям во множестве органов, в первую очередь — легких и кишечника. В легких мутация в CFTR приводит к нарушению секреции слизи, что приводит к инфекциям дыхательных путей. Если прибавить к этому сопутствующую недостаточность поджелудочной железы, непроходимость кишечника и нарушения работы репродуктивной системы, на выходе мы получаем крайне тяжелое инвалидизирующее и сокращающее жизнь заболевание [64].
Поскольку при муковисцидозе страдают в первую очередь легкие, напрашивалось решение разработать генную терапию, доставляющую туда вектор с «правильным» геном. Однако все такие попытки раз за разом терпели неудачу, несмотря на многообещающие доклинические исследования. Преодолеть иммунную защиту организма и заразить клетки хоть и «полезным», но все-таки вирусом, оказалось непростой задачей. Воспалительные процессы, сопровождающие заболевание, только усложняли задачу, а слишком плотная слизь на поверхности клеток ставила на пути у вектора физически непреодолимый барьер.
Стало понятно, что подобные неудачи вызваны незнанием деталей строения эпителия дыхательных путей, а «классические» животные модели — мыши — не отражают анатомическое и физиологическое строение дыхательных путей человека. У этих грызунов мутации CFTR у них попросту не приводят к муковисцидозу из-за другого строения и расположения ионоцитов — клеток, несущих этот ионный канал и отвечающих за секрецию слизи. Внимание исследователей переключилось на хорьков — животных, дыхательный тракт которых удивительным образом куда больше похож на человеческий, чем у других мелких млекопитающих. Одним хорькам «удаляли» CFTR, отвечающий за транспорт хлора в ионоцитах; а другим — ген FOX I1, управляющий дифференциацией клеток-предшественников ионоцитов. Все эти манипуляции позволили уточнить, как работают и распределяются ионоциты в дыхательных путях хорьков (рис. 10).
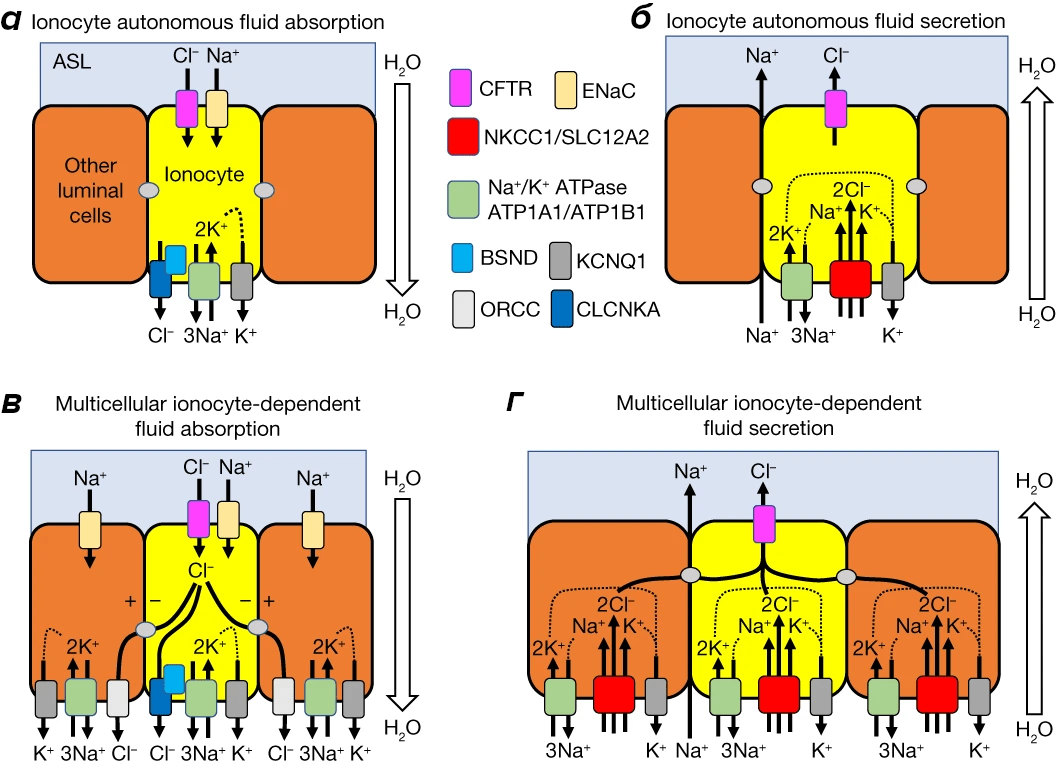
Рисунок 10. Регуляция транспорта жидкости в дыхательных путях с помощью легочных ионоцитов. Автономная модель: ионоциты регулируют поглощение (а) и секрецию (б) жидкости в дыхательных путях. Многоклеточная модель: механизм поглощения (в) и секреции (г) жидкости, в котором участвуют ионоциты и другие типы клеток. CFTR — Трансмембранный регулятор муковисцидоза; ENac — эпителиальный натриевый канал; NKCC1 — Na–K–Cl котранспортер; Na+/K+ ATPase — Na+/K+-АТФаза; BSND — барттин, β-субъединица CLCNKA; CLCNKA — потенциал-зависимый хлорный канал; ORCC — выпрямляющий хлорный канал; KCNQ1 — потенциал-зависимый калиевый канал.
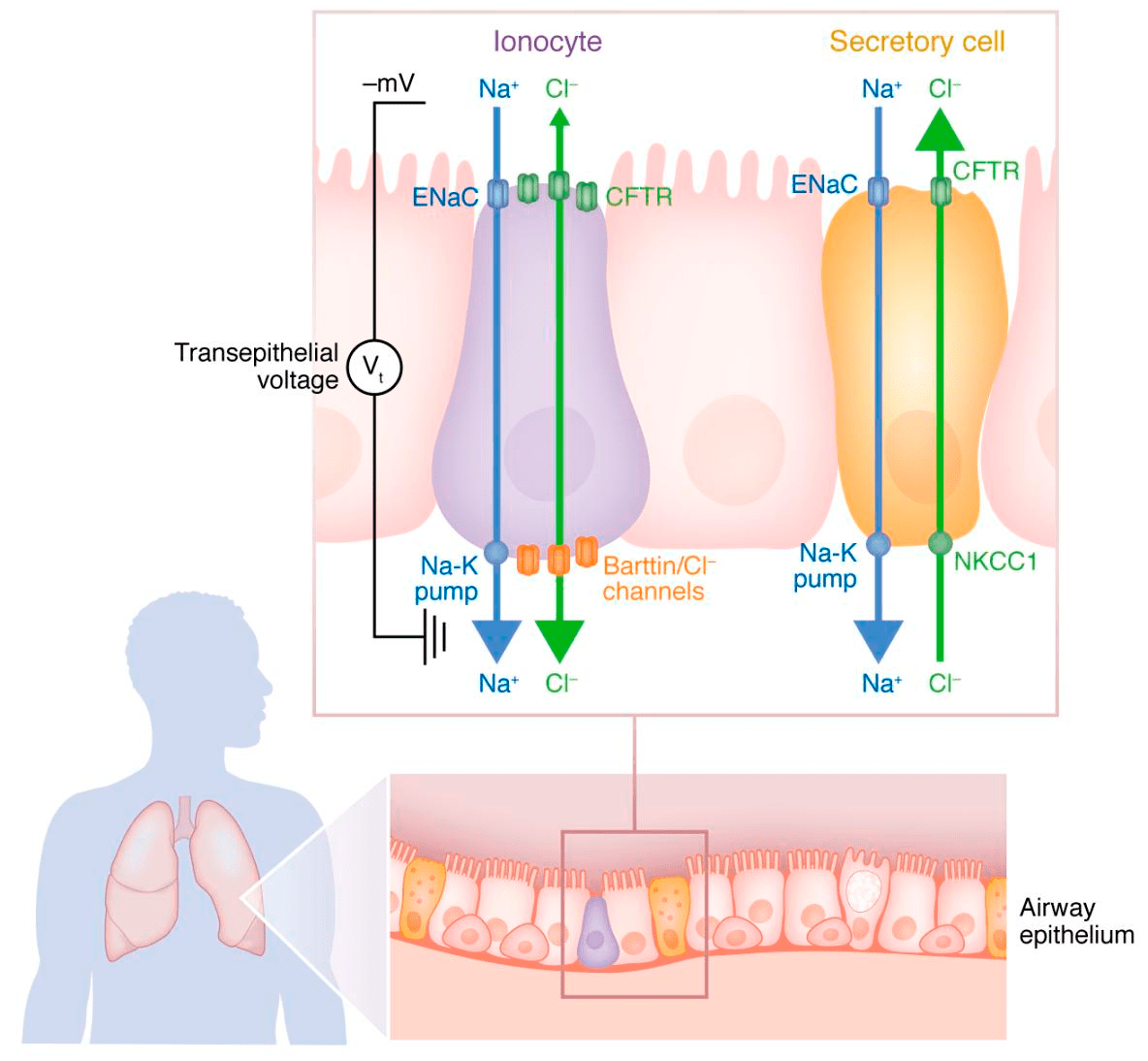
Рисунок 11. Значение хлорных каналов CFTR в ионоцитах и секреторных клетках дыхательных путей. Ионоцитов в дыхательных путях совсем немного, зато в них очень много каналов CFTR. В секреторных клетках транспортеров меньше, но количество самих этих клеток куда больше. Ионные каналы CFTR по-разному работают в ионоцитах и секреторных клетках. В ионоцитах CFTR поглощает ионы хлора, что становится возможным благодаря созданию электрохимического градиента с помощью натриевых каналов ENaC на апикальной стороне клетки, а также хлорным каналам (barttin/Cl− channels) и Na+/K+-АТФазе на базолатеральной мембране. Подобный механизм создает условия для поглощения ионоцитами жидкости с поверхности дыхательных путей. Секреторные же клетки, наоборот, переносят ионы хлора через транспортер NKCC1 на базолатеральной мембране и CFTR каналы на апикальной мембране на поверхность дыхательных путей.
Другая группа [66] уточнила данные, изучив культуру клеток эпителия человека in vitro, и установила более четкий механизм транспорта ионов хлора, а также определила еще ряд транспортеров, участвующих в транспорте ионов и воды через эпителии дыхательных путей (рис. 11).
Таким образом, комбинация методов in vitro (на клетках эпителия человека) и in vivo (на ГМ-хорьках) дает много полезной информаций о механизмах развития легочной недостаточности при муковисцидозе и открывает новые направления для разработки фармпрепаратов. Возможно теперь исследователи будут искать способы альтернативные генной терапии [65], [66]. Компания Spirovant уже начала такие исследования и показала эффективность генной терапии муковисцидоза (с использованием AAV-вектора) на модели трансгенных хорьков.
Заключение
Развитие технологий создания генномодифицированных животных решает сразу несколько задач современной медицины. Внесение изменений в геном животных помогает изучать патогенез заболеваний человека, а также искать эффективное их лечение. Современные методы редактирования генома, а также способы доставки генетических векторов постоянно совершенствуются. Это создало теоретическую и техническую базу для инновационного лечения опасных болезней людей, чему и посвящен весь наш спецпроект «Генная и клеточная терапии».
Литература
- 12 методов в картинках: генная инженерия. Часть II: инструменты и техники;
- 12 методов в картинках: клеточные технологии;
- Генная терапия: познакомьтесь с лекарствами будущего;
- Редко, но метко: орфанные заболевания как вызов современной медицине;
- Кто такие модельные организмы?;
- Модельные организмы: нематода;
- Модельные организмы: дрозофила;
- Модельные организмы: ксенопус;
- Модельные организмы: данио рерио;
- Louis-Marie Houdebine. (2007). Transgenic Animal Models in Biomedical Research. Target Discovery and Validation Reviews and Protocols. 163–202;
- Нобелевскую премию по физиологии или медицине вручили за технологию нокаутирования мышей;
- Модельные организмы: грызуны;
- Sharma R. (2022). How are transgenic mice used in cancer research? LinkedIn;
- Akkanawru P. (2015). Knock out/Genetically Modified Rat Models Set to Accentuate the Growth of Rat Model Market. LinkedIn;
- Муковисцидоз — первые надежды;
- Ветеринария: эволюция, революции, инновации;
- Трансляционная психиатрия — как моделировать психические расстройства на животных?;
- Lukas Gerasimavicius, Benjamin J. Livesey, Joseph A. Marsh. (2022). Loss-of-function, gain-of-function and dominant-negative mutations have profoundly different effects on protein structure. Nat Commun. 13;
- 12 методов в картинках: генная инженерия. Часть I, историческая;
- A.S. Volobueva, A.N. Orekhov, A.V. Deykin. (2019). An update on the tools for creating transgenic animal models of human diseases – focus on atherosclerosis. Braz J Med Biol Res. 52;
- A. Forster, R. Pannell, L. Drynan, F. Cano, N. Chan, et. al. (2005). Chromosomal Translocation Engineering to Recapitulate Primary Events of Human Cancer. Cold Spring Harbor Symposia on Quantitative Biology. 70, 275–282;
- Sarah L. Dallas, Yixia Xie, Lora A. Shiflett, Yasuyoshi Ueki. (2018). Mouse Cre Models for the Study of Bone Diseases. Curr Osteoporos Rep. 16, 466–477;
- Weinstein A. (2019). Mouse Modeling, Part 1: Genetically Engineered Mice. Addgene;
- Jian Zhang, Jing Zhao, Wen-jie Jiang, Xi-wei Shan, Xiao-mei Yang, Jian-gang Gao. (2012). Conditional gene manipulation: Cre-ating a new biological era. J. Zhejiang Univ. Sci. B. 13, 511–524;
- Madina Karimova, Victoria Splith, Janet Karpinski, M. Teresa Pisabarro, Frank Buchholz. (2016). Discovery of Nigri/nox and Panto/pox site-specific recombinase systems facilitates advanced genome engineering. Sci Rep. 6;
- Xin Xu, Yujin Yuan, Bihong Feng, Wei Deng. (2020). CRISPR/Cas9-mediated gene-editing technology in fruit quality improvement. Food Quality and Safety. 4, 159–166;
- Pradeep Reddy, Felipe Vilella, Juan Carlos Izpisua Belmonte, Carlos Simón. (2020). Use of Customizable Nucleases for Gene Editing and Other Novel Applications. Genes. 11, 976;
- Rajat M. Gupta, Kiran Musunuru. (2014). Expanding the genetic editing tool kit: ZFNs, TALENs, and CRISPR-Cas9. J. Clin. Invest. 124, 4154–4161;
- Minjung Song, Suresh Ramakrishna. (2018). Genome Editing in Stem Cells for Disease Therapeutics. Mol Biotechnol. 60, 329–338;
- CRISPR-эпопея и ее герои;
- Просто о сложном: CRISPR/Cas;
- Ellen Shrock, Marc Güell. (2017). CRISPR in Animals and Animal Models. Progress in Molecular Biology and Translational Science. 95–114;
- W.M.E. Shakweer, A.Y. Krivoruchko, Sh.M. Dessouki, A.A. Khattab. (2023). A review of transgenic animal techniques and their applications. Journal of Genetic Engineering and Biotechnology. 21, 55;
- Способны ли CAR-Т-клетки уничтожить опухоль?;
- Лентивирусные векторы: как они стали лучшими векторами для терапии ex vivo;
- Время первых: как аденоассоциированные вирусы стали лучшими в доставке генов in vivo;
- «Спутник V» и не только: сказ об аденовирусных вакцинах;
- мРНК-вакцина на страже коллективного иммунитета: за что вручили Нобелевскую премию в 2023 году;
- Hidefumi Mukai, Koki Ogawa, Naoya Kato, Shigeru Kawakami. (2022). Recent advances in lipid nanoparticles for delivery of nucleic acid, mRNA, and gene editing-based therapeutics. Drug Metabolism and Pharmacokinetics. 44, 100450;
- Hassan Abbasi, Sayyed Morteza Hosseini, Mahdi Hajian, Zahra Nasiri, Mehrnoosh Bahadorani, et. al. (2015). Lentiviral vector-mediated transduction of goat undifferentiated spermatogonia. Animal Reproduction Science. 163, 10–17;
- Сперматогенез. Всё, что вы хотели знать, но боялись спросить!;
- Сквозь тернии к нервам: особенности доставки лекарств в нервную систему;
- Геномные технологии в спасении исчезающих видов;
- Морозкина Т.С., Морозкина Н.В., Сокольчик И.Г. (2003). Воссоздание трансгенных животных — передовой рубеж биологической науки. Медицинские новости. 11, 9–11;
- От медицинской онкологии к молекулярной биологии рака;
- Глобальное бремя онкологических заболеваний растет параллельно с ростом потребности в услугах. (2024). Всемирная Организация Здравоохранения;
- Tecelra: явный прорыв в лечении синовиальной саркомы?;
- Yihan Liu, Wantao Wu, Changjing Cai, Hao Zhang, Hong Shen, Ying Han. (2023). Patient-derived xenograft models in cancer therapy: technologies and applications. Sig Transduct Target Ther. 8;
- Todd M. Allen, Michael A. Brehm, Sandra Bridges, Stacy Ferguson, Priti Kumar, et. al. (2019). Humanized immune system mouse models: progress, challenges and opportunities. Nat Immunol. 20, 770–774;
- Angelina T. Regua, Austin Arrigo, Daniel Doheny, Grace L. Wong, Hui-Wen Lo. (2021). Transgenic mouse models of breast cancer. Cancer Letters. 516, 73–83;
- Xiaoping Wang, Takashi Semba, Lan Thi Hanh Phi, Sudpreeda Chainitikun, Toshiaki Iwase, et. al. (2020). Targeting Signaling Pathways in Inflammatory Breast Cancer. Cancers. 12, 2479;
- Valerie Jentzsch, Leeza Osipenko, Jack W. Scannell, John A. Hickman. (2023). Costs and Causes of Oncology Drug Attrition With the Example of Insulin-Like Growth Factor-1 Receptor Inhibitors. JAMA Netw Open. 6, e2324977;
- P Brown. (2003). The mouse in preclinical trials: transgenic, carcinogen-induced, or xenograph models – which to use?. Breast Cancer Res. 5;
- Нейродегенерации, или Массовые вымирания нейронов;
- На руинах памяти: настоящее и будущее болезни Альцгеймера;
- Holly R. Robertson, Guoping Feng. (2011). Annual Research Review: Transgenic mouse models of childhood‐onset psychiatric disorders. Child Psychology Psychiatry. 52, 442–475;
- Kim A. Caldwell, Corey W. Willicott, Guy A. Caldwell. (2020). Modeling neurodegeneration in Caenorhabditis elegans. Disease Models & Mechanisms. 13;
- Болезнь Паркинсона: что изучать? как изучать?;
- Болезнь Паркинсона и астроциты: новый взгляд на лечение нейродегенеративных заболеваний;
- Лечение болезни Паркинсона нейротрофическими факторами: есть ли свет в конце туннеля?;
- Белок альфа-синуклеин — важный участник проявления болезни Паркинсона?;
- Руку, ногу и сердце: редкий АТТR-амилоидоз;
- Болезнь Фабри: частая среди редких;
- Feng Yuan, Grace N. Gasser, Evan Lemire, Daniel T. Montoro, Karthik Jagadeesh, et. al. (2023). Transgenic ferret models define pulmonary ionocyte diversity and function. Nature. 621, 857–867;
- Lei Lei, Soumba Traore, Guillermo S. Romano Ibarra, Philip H. Karp, Tayyab Rehman, et. al. (2023). CFTR-rich ionocytes mediate chloride absorption across airway epithelia. Journal of Clinical Investigation. 133;
- Burkhard Tümmler. (2023). Puzzle resolved: CFTR mediates chloride homeostasis by segregating absorption and secretion to different cell types. Journal of Clinical Investigation. 133.