Приложи лист подорожника, и все заживет: или как флавоноиды защищают тромбоциты от гибели и целый организм — от тромбозов
17 марта 2025
Приложи лист подорожника, и все заживет: или как флавоноиды защищают тромбоциты от гибели и целый организм — от тромбозов
- 411
- 0
- 0
Народная мудрость.
Рисунок в полном размере.
иллюстрация Анны Балыкиной
-
Авторы
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Тромбоциты — это клеточные фрагменты, циркулирующие в крови. Они — главные защитники организма от кровотечений. Чрезмерная активность тромбоцитов приводит к тромбозу, патологическому образованию внутрисосудистых сгустков, блокирующих ток крови с питательными элементами и кислородом в сторону здоровых тканей. Отсутствие кровотока в сосудах головы и сердца может привести к инсульту головного мозга и инфаркту миокарда. Также доказана ключевая роль активированных тромбоцитов в росте и развитии злокачественных опухолей, что на поздних стадиях может приводить к опухоль-ассоциированным тромбозам. Эти заболевания занимают лидирующие позиции среди причин смертности по всему миру, что приводит к широкому применению антитромбоцитарной терапии в клинике. Однако использование современных лекарственных препаратов ограничено развитием побочных реакций и резистентности у пациентов, по этой причине поиск новых более эффективных и безопасных соединений с антитромбоцитарной активностью остается актуальным. В результате своей работы мы выявили шесть соединений растительного происхождения с выраженными эффектами снижения активности тромбоцитов и защиты тромбоцитов от гибели, вызванной химиотерапевтическим препаратом ABT-737. В данной статье мы обсудим ход наших экспериментов и возможность применения описанных соединений в клинической практике.
Конкурс «Био/Мол/Текст»-2024/2025
Эта работа опубликована в номинации «Своя работа» конкурса «Био/Мол/Текст»-2024/2025.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Биология тромбоцитов
Тромбоциты человека представляют собой безъядерные постклеточные структуры, основной функцией которых является остановка кровотечений, то есть поддержание гемостаза. Когда кровеносный сосуд повреждается, организм запускает процесс предотвращения потери крови, в котором тромбоциты выполняют ключевую роль, образуя закупоривающую пробку — тромб — на месте повреждения [1].
Представьте себе тромбоциты в качестве социальных хамелеонов — настоящих мастеров баланса между активностью и спокойствием (рис. 1). Они напоминают амбивертов: в обычной, мирной обстановке тромбоциты ведут себя сдержанно, не вступая в контакты с окружающими клетками и со стенками сосудов или белками, как интроверты, предпочитающие «зону комфорта». При изменении окружающей среды — например, при повреждении сосуда — тромбоциты мгновенно превращаются в активированных экстравертов. Собираясь вместе, они образуют тромб и призывают своих «товарищей». Их можно сравнить с энтузиастами на вечеринке: они активно обнимаются (прикрепляются друг к другу — адгезируют), объединяются в группы и обмениваются новостями (высвобождают гранулы с биомолекулами, стимулирующими активацию других тромбоцитов). Однако эта энергия не бесконечна. С возрастом или после активных взаимодействий тромбоциты могут запустить программу самоуничтожения — апоптоз. Далее мы подробнее расскажем об этих состояниях тромбоцитов.

Рисунок 1. Иллюстрация покоящихся и активированных тромбоцитов (ТЦ). Одиноко стоящий в углу парень иллюстрирует покоящийся тромбоцит, который не взаимодействует с другими тромбоцитами и не участвует в образовании гемостатической пробки. Парни и девушки, активно беседующие в группах, изображают активированных тромбоцитов, которые обнимаются (прикрепляются друг к другу — адгезируют), обмениваются новостями (высвобождают гранулы с биомолекулами, стимулирующими активацию других тромбоцитов), способствуя формированию гемостатической пробки.
иллюстрация Анны Балыкиной и Лидии Найда
«Энтузиасты на вечеринке» или о механизмах активации тромбоцитов
При травматизации стенки сосуда обнажается коллаген и адгезивные белки, которые обычно скрыты от прямого контакта с клетками крови под однослойным сосудистым эпителием — эндотелием (рис. 2). На этот участок оседает из тока крови фактор фон Виллебранда (VWF). Тромбоциты распознают и связываются с данными белками с помощью рецепторов на своей поверхности, что служит сигналом для их активации. Активация приводит к изменению формы тромбоцитов: они становятся сферическими и образуют выросты плазматической мембраны — псевдоподии, которые помогают им лучше взаимодействовать друг с другом и со стенкой сосуда, увеличивая площадь поверхности. Одновременно с этим тромбоциты взаимодействуют и с другими активаторами в зоне повреждения: тромбином — фактором свертывания крови; тромбоксаном A2 (TXA2) и аденозиндифосфатом (АДФ). Последние два медиатора выделяются из ранее активированных тромбоцитов, распространяющих процесс активации и агрегации. Ключевым моментом активации тромбоцитов является изменение конформации (пространственная перегруппировка атомов в молекуле) поверхностного рецептора αIIbβ3, относящегося к семейству интегринов, которое происходит в результате сигналов от вышеперечисленных активаторов. При изменении конформации интегрин αIIbβ3 становится активированным и обретает способность связывать фибриноген — белок, который действует как мостик между тромбоцитами, сцепляя их между собой. Данное связывание приводит к агрегации тромбоцитов и формированию тромбоцитарной пробки, которая закрывает место дефекта сосудистой стенки [2]. Таким образом, тромбоциты — это жизненно важные звенья системы гемостаза, которые обеспечивают быструю и эффективную реакцию на повреждение сосудов и защищают организм от потери крови.
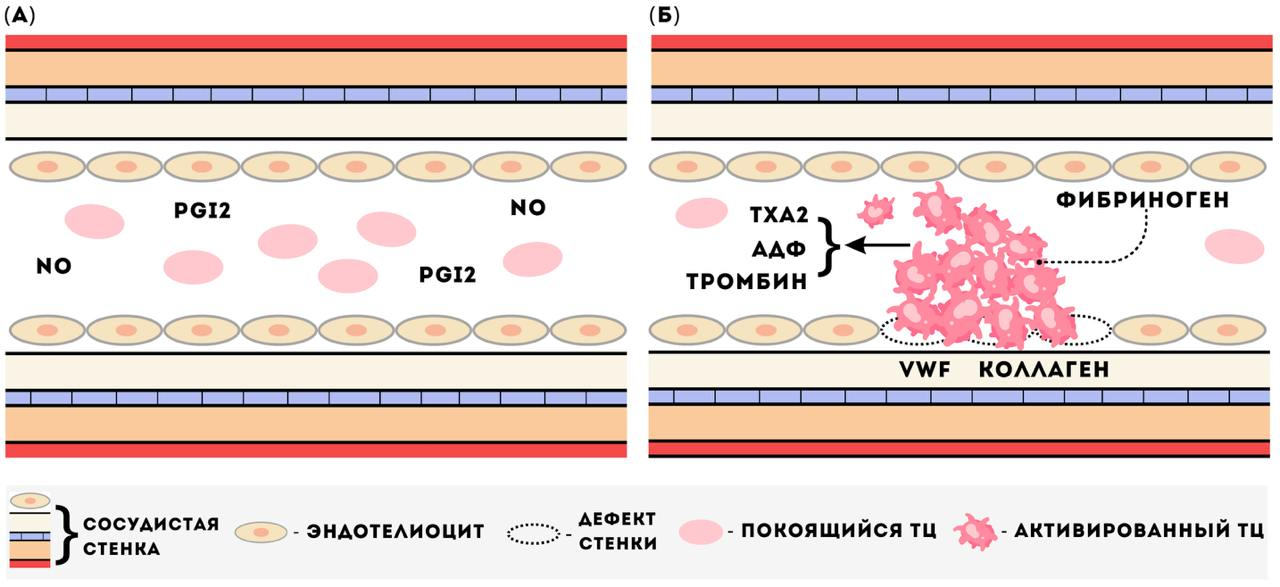
Рисунок 2. Упрощенная схема изменения активности тромбоцитов в сосудистом русле. (а) — в отсутствие повреждений сосудистой стенки тромбоциты находятся в покоящемся состоянии. В таком состоянии тромбоциты обладают плоской дисковидной формой и не вступают в контакт между собой. Покоящееся состояние обеспечивается за счет оксида азота (NO) и простациклина (PGI2), которые выделяются клетками сосуда — эндотелиоцитами. (б) — в месте повреждения сосуда тромбоциты взаимодействуют с адгезивными белками, коллагеном, а также с осевшим из тока крови фактором фон Виллебранда (VWF). Тромбоциты активируются, изменяют свою форму на сферическую, формируют выросты плазматической мембраны — псевдоподии, синтезируют тромбоксан A2 (TXA2) и аденозиндифосфат (АДФ), которые способствуют активации соседних покоящихся тромбоцитов. Активированные тромбоциты способны связывать фибриноген, что приводит к образованию «мостиков» между тромбоцитами и к их взаимодействию между собой — агрегации, формируя тромб и защищая от кровотечения.
иллюстрация Анны Балыкиной и Лидии Найда
«Тихие стратеги», или о механизмах ингибирования активации тромбоцитов
Ингибиторные пути в тромбоцитах представляют собой разветвленную сеть различных сигналов, посредников в их передаче и принимающих их субстратов, которые вместе поддерживают покоящееся состояние тромбоцитов. В норме эндотелиальные клетки, выстилающие сосуды изнутри, выделяют вещества, такие как простациклин (PGI2) и оксид азота (NO), которые не допускают активацию тромбоцитов и чрезмерное свертывание крови, как бы говоря тромбоцитам, что все нормально и опасности нет (рис. 2). Данные соединения вызывают активацию главных ингибиторных сигнальных путей тромбоцитов, связанных с активностью вторичных посредников: циклического аденозинмонофосфата и циклического гуанозинмонофосфата (cAMP и cGMP), которые относятся к циклическим нуклеотидам и синтезируются аденилат- и гуанилатциклазами (AC и GC) (рис. 3). Циклические нуклеотиды активируют ферменты, которые относятся к семейству протеинкиназ: протеинкиназы A и G (PKA и PKG). Регуляцией активности ингибиторных AC/сAMP/PKA и GC/cGMP/PKG сигнальных путей занимаются ферменты, фосфодиэстеразы (PDE), разрушающие циклические нуклеотиды сAMP и cGMP [3], [4].
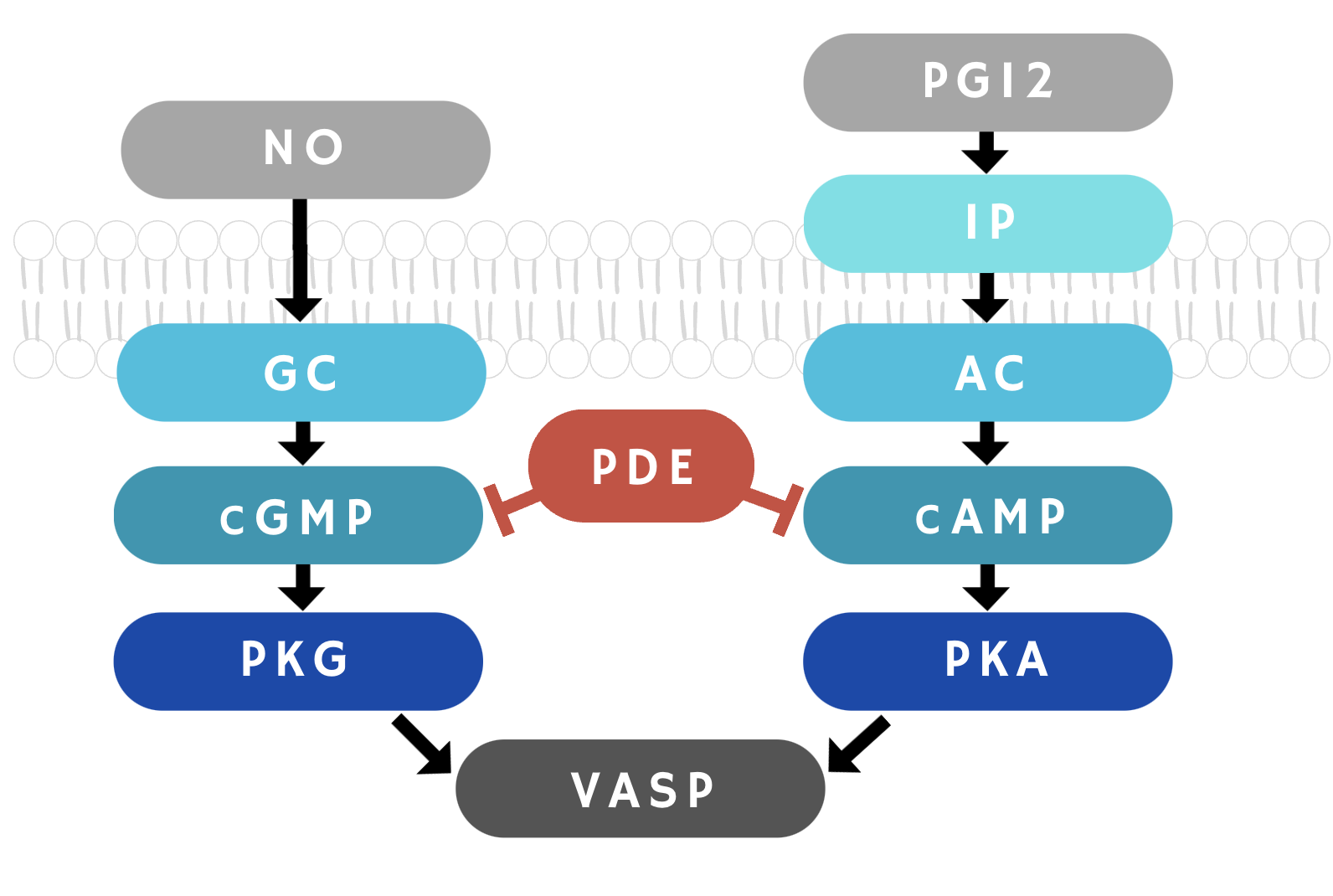
Рисунок 3. Главные ингибиторные сигнальные пути тромбоцита. Сигнальные молекулы — оксид азота (NO) и простациклин (PGI2) — запускают ингибирование активации тромбоцитов. NO проходит через мембрану тромбоцита, в то время как PGI2 действует на тромбоцит через свой рецептор (IP-рецептор), в результате чего активируются аденилат- и гуанилатциклазы (AC и GC). AC и GC синтезируют циклические нуклеотиды: циклический аденозинмонофосфат и циклический гуанозинмонофосфат (cAMP и cGMP), соответственно. При этом циклические нуклеотиды приводят к активации протеинкиназ A и G (PKA и PKG). Главная функция протеинкиназ — это перенос фосфатного остатка на белки, участвующие в гемостазе, за счет чего изменяется их активность. К таким белкам относится фосфопротеин, стимулируемый вазодилататорами (VASP), отвечающий за перестройку цитоскелета тромбоцитов и изменение их формы во время активации. Фосфорилирование VASP, вызванное PKA и PKG, приводит к подавлению его функции и к ингибированию активации тромбоцитов. Регуляцией активности данных сигнальных путей занимаются фосфодиэстеразы 2A, 3A и 5A (PDE2A, PDE3A и PDE5A), разрушающие циклические нуклеотиды, что прерывает работу ингибирующих сигнальных путей тромбоцита.
иллюстрация Анны Балыкиной
«Закат жизни», или о механизмах программируемой гибели тромбоцитов
В физиологических условиях продолжительность жизни и циркуляции тромбоцитов в кровотоке составляет примерно 5–9 дней, затем они разрушаются в селезенке и печени. Своевременный апоптоз (или программируемая гибель) тромбоцитов [5], как и любых других клеток, необходим для поддержания гомеостаза — постоянства качественной работы организма и поддержания благоприятных свойств. Снижение или усиление апоптоза тромбоцитов напоминает слишком низкий или, наоборот, слишком высокий уровень смертности населения. Как изменение уровня смертности населения ведет к нарушению демографического равновесия, так и изменения в скорости апоптоза тромбоцитов имеют серьезные последствия для организма. Отложенная гибель тромбоцитов приводит к циркуляции в кровотоке «старых» тромбоцитов [6] и к тромбоцитозу — увеличенному количеству тромбоцитов в крови, которое ассоциировано с повышенным риском тромбоза. При усиленной гибели количество тромбоцитов сокращается и развивается тромбоцитопения — патологическое состояние, при котором количество тромбоцитов в кровотоке опускается значительно ниже нормы, из-за чего увеличиваются риски серьезных кровотечений. В обоих случаях тромбоциты не способны обеспечивать нормальное образование тромба и поддерживать протекание реакций свертывания крови.
Механизм апоптоза хорошо изучен в ядерных клетках: в них апоптоз может проходить по внешнему и внутреннему (митохондриальному) пути. В регуляции индукции апоптоза по внутреннему пути участвуют многочисленные белки семейства Bcl-2: антиапоптотические белки (Bcl-2, Bcl-xl, Bcl-w, Mcl-1 и др.) предотвращают апоптоз и «сдерживают» проапоптотические эффекторные белки, которые его запускают (Bax, Bak и др.). При различных стимулах к запуску апоптоза, таких как гипоксия, ультрафиолет или повреждение генетического аппарата, запускается процесс, напоминающий молекулярную эстафету по передаче апоптотического сигнала. Первыми носителями эстафетной палочки являются белки семейства Bcl-2, которые воздействуют на митохондриальную мембрану. Изменение заряда мембраны митохондрий приводит к повышению ее проницаемости для цитохрома С. Цитохром С в составе апоптосомы передает эстафетную палочку инициаторным каспазам, а они, в свою очередь — эффекторным каспазам. Принимает эстафету фосфолипид фосфатидилсерин, изначально находящийся на внутренней поверхности плазматической мембраны клетки. Взяв эстафетную палочку, фосфатидилсерин финиширует на внешней поверхности плазматической мембраны. При этом процесс перехода фосфатидилсерина с внутренней поверхности мембраны на внешнюю называется экстернализацией фосфатидилсерина.
Тромбоциты содержат полностью функциональный внутренний путь апоптоза, однако в них присутствуют не все (или пока не были идентифицированы) белки апоптотического сигналинга. При этом изучение наличия молекул-участников внешнего пути апоптоза активно продолжается: установлено, что в тромбоцитах присутствуют регуляторные и адаптерные белки внешнего пути, но отсутствуют рецепторы смерти [7]. На данный момент считается, что апоптоз тромбоцитов реализуется только по внутреннему пути с участием митохондрий (рис. 4).
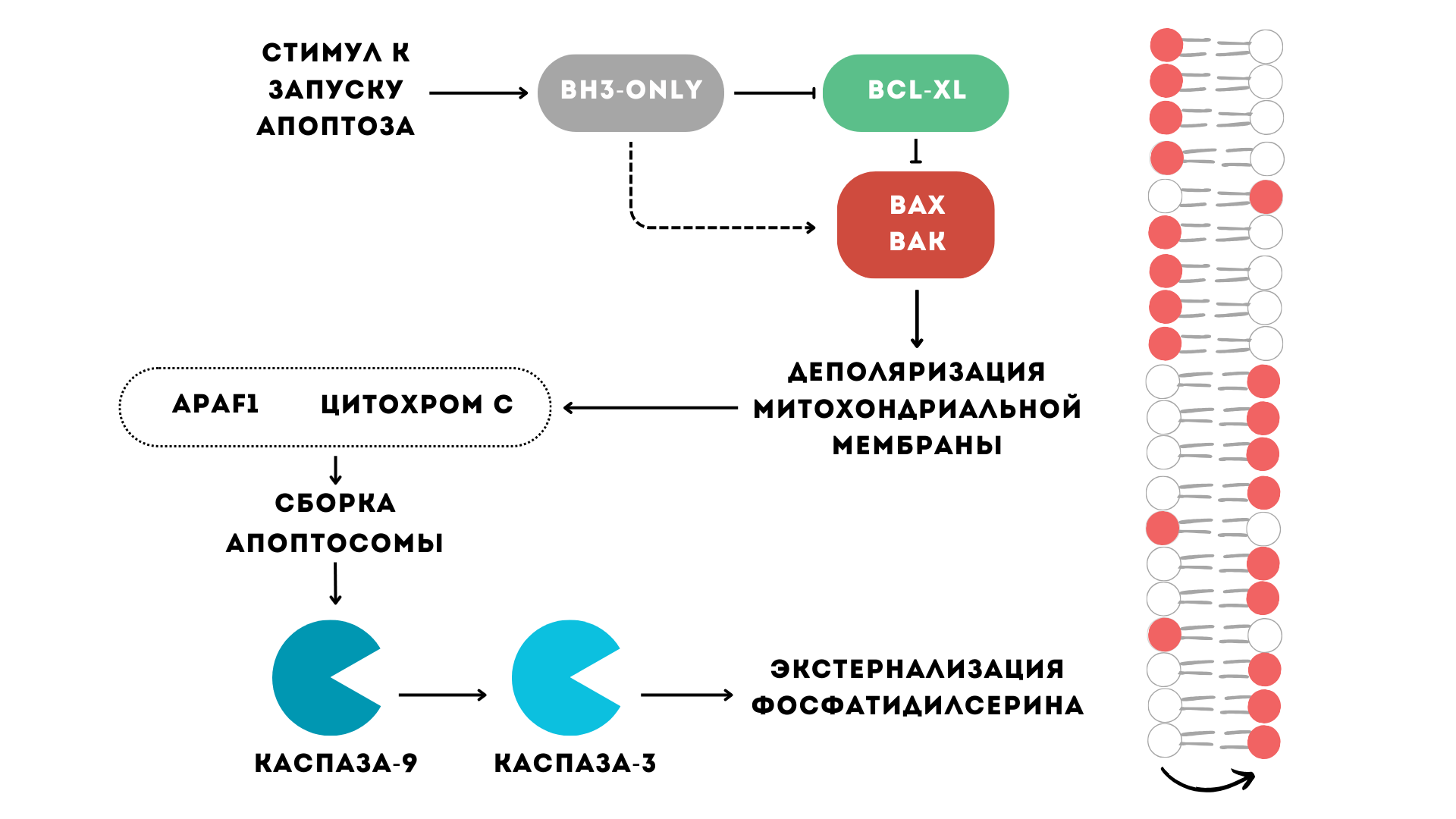
Рисунок 4. Механизм внутреннего пути апоптоза в тромбоцитах. При воздействии стимулов к запуску апоптоза на тромбоцит белки, содержащие только ВН3-домен (BH3-only), ингибируют действие антиапоптотических белков (Bcl-xL), как бы усиливая чувствительность клетки к апоптозу, или напрямую активируют проапоптотические белки (Bax, Bak). Это приводит к деполяризации митохондриальной мембраны, то есть отрицательный заряд внутри клетки изменяется на более положительный, и к увеличению ее проницаемости. За этим следует высвобождение из митохондрий цитохрома С и сборка в апоптосому белка Apaf-1 (апоптотический фактор, активируемый протеазами) и инициаторной каспазы-9. Апоптосома инициирует расщепление эффекторных каспазы-3 и каспазы-7 и экстернализацию фосфатидилсерина. В случае запуска апоптоза по внешнему пути, образование комплекса между лигандом и рецептором смерти приводит к активации инициаторной каспазы-8, дальнейшему протеолитическому расщеплению эффекторных каспаз и экстернализации фосфатидилсерина. Механизмы внутреннего и внешнего пути апоптоза могут пересекаться.
иллюстрация Лидии Найда
Применение антитромбоцитарной терапии
Понимание механизмов ингибирования активации тромбоцитов позволило использовать лекарственные соединения для подавления их излишней активности [8], [9]. На данный момент антитромбоцитарная терапия активно применяется в клинике для профилактики и лечения сердечно-сосудистых заболеваний. Такие распространенные заболевания, как инсульт головного мозга и инфаркт миокарда, могут быть вызваны тромбом, оторвавшимся от сосудистой стенки. Тромб в капилляре, кровоснабжающем участок головного мозга или сердечной мышцы, приводит к острому нарушению питания тканей и возможному последующему некрозу — необратимой гибели клеток, что может быть смертельным для пациента [10].
У онкологических пациентов может повышаться активность тромбоцитов из-за взаимодействий клеток опухоли с тромбоцитами. Это приводит к приобретению тромбоцитами патологического фенотипа, который в литературе называется «тромбоциты, обученные опухолью» [11]. Высвобождающиеся из тромбоцитарных гранул биологически активные молекулы усиливают пролиферацию опухолевых клеток и образование кровеносных сосудов, питающих опухоль [12], а также способствуют их экстравазации [13–15] (выходу опухолевой клетки из кровотока в ткани) и защите от иммунного распознавания [16], [17]. Так, активация тромбоцитов снижает выживаемость онкологических пациентов и способствует росту опухоли, а также может вызывать опухоль-ассоциированный (паранеопластический) тромбоз [18], [19]. Поэтому антитромбоцитарная терапия может быть рекомендована пациентам онкологического профиля на поздних стадиях.
Однако действие современных лекарственных препаратов с антитромбоцитарной активностью может вызывать различные побочные реакции (кровотечение, язвы пищеварительного тракта, аспирин-ассоциированная астма) и резистентность у пациентов, что может быть критично при необходимости продолжительной терапии. По этой причине остается актуальным поиск новых, более эффективных и менее токсичных антитромбоцитарных препаратов.
Проапоптотические соединения вызывают гибель нормальных и злокачественных клеток
Отличительная черта злокачественных клеток — изменение регуляции продолжительности жизни [20]. Множественные дефекты апоптотических сигнальных путей и повышенная экспрессия антиапоптотических белков характерны для неопластических клеток, что приводит к их устойчивости к апоптозу и к опухолевой прогрессии [21]. Исследовательские группы со всего мира вкладывают силы в поиск биомаркеров [22] и разработку новых препаратов, чтобы оказаться на шаг вперед опухоли и вызвать ее гибель, тем самым улучшить выживаемость и качество жизни пациентов. Например, получится ли эффективно воздействовать на злокачественную клетку соединениями на основе белков, содержащих только BH3-домен (рис. 4), и ингибировать ее антиапоптотические белки? Эта гипотеза легла в основу разработки новых химиотерапевтических препаратов — BH3-миметиков. Первым в этой группе препаратов было соединение ABT-737, которое обладает высокой аффинностью к белкам Bcl-xL, Bcl-w и Bcl-2. В исследованиях на клеточных линиях гематологических и некоторых солидных опухолей применение ABT-737 в качестве монотерапии и в комбинации с другими вариантами лечения, например с иными химиотерапевтическими агентами или с лучевой терапией, оказалось эффективным. Впоследствии были разработаны препараты навитоклакс (ABT-263), пероральный аналог ABT-737, который проходит клинические испытания для лечения гематологических злокачественных новообразований, и венетоклакс (ABT-199), новый высокоселективный ингибитор Bcl-2, который одобрен для лечения хронического лимфолейкоза, в основном как часть комбинированной противоопухолевой терапии на поздних стадиях, а также обладает значительно меньшей аффинностью к Bcl-xL [23].
В поддержание жизнедеятельности тромбоцитов главным образом вносит вклад антиапоптотический белок Bcl-xL. Однако ABT-737, 263 и 199 не могут различать, в каких клетках Bcl-xL выполняет жизненно важную физиологическую функцию, а в каких — обусловливает развитие патологического процесса. Обладая высоким сродством к Bcl-xL и ингибируя его, все перечисленные препараты оказывают токсическое действие на тромбоциты и способствуют их усиленной гибели. Таким образом, терапия, мишенью которой является Bcl-xL, имеет серьезный побочный эффект в виде кровотечений, вызванных тромбоцитопенией. По этой причине остается актуальным поиск способов защитить тромбоциты от цитотоксического действия препаратов-индукторов апоптоза у пациентов со злокачественными новообразованиями.
Многие пациенты онкологического профиля получают сложные комбинированные схемы лекарственной терапии, в особенности на поздних стадиях. Комбинированная противоопухолевая терапия обладает рядом важных преимуществ по сравнению с монотерапией. В рамках такой терапии препараты, воздействующие на разные механизмы и пути, могут обладать синергизмом действия, то есть их суммарный терапевтический эффект будет более выраженный и сильный. Таким образом, комбинация препаратов способна более эффективно подавлять рост и распространение опухолей, а дозу каждого из препаратов возможно снизить, при этом уменьшив токсическое действие на организм. Комбинированная терапия позволяет воздействовать на опухоли, гетерогенные по своему составу, то есть имеющие в своем составе множество клонов опухоли с различным фенотипом и метаболизмом [24]. Кроме этого, комбинированная терапия может также устранять побочные реакции от главных противоопухолевых лекарственных средств и даже снижать активность микроокружения опухоли (комплекса неопухолевых клеток, которые находятся в тесном контакте с опухолевыми клетками, помогают опухоли расти и избегать иммунного ответа) [25].
Флавоноиды
Флавоноиды — это соединения растительного происхождения, пищевыми источниками которых является большинство фруктов, ягод и овощей. В растениях флавоноиды присутствуют во всех видах тканей и являются незаменимыми участниками процессов развития, роста и размножения, а также определяют их вкус и цвет. Кроме этого, флавоноиды — защитники растений от бактериальных, грибковых, температурных и многих других видов поражений. У большинства флавоноидов значительно выражена антиоксидантная активность, которая проявляется в защите растений в результате окислительного стресса и последующей поломки ДНК [26], [27].
Структурно флавоноиды определяют как полифенолы, представляющие собой два ароматических кольца (A и B), которые соединены через три углеродных атома (C) (рис. 5). Флавоноиды представлены в растениях преимущественно в виде гликозидов, то есть в связи с остатками углеводов. Характер биологической активности молекулы в большей степени определяют агликоны флавоноидов — неуглеводная часть молекулы. При этом сила антиоксидантного эффекта коррелирует с количеством гидроксильных (-ОН) групп у флавоноида: чем больше таких групп, тем выраженнее его антиоксидантные свойства [28].

Рисунок 5. Структура флавоноидов: два ароматических кольца (A и B), которые соединены через три углеродных атома (С). Картинка взята из платформы для графического дизайна Canva.
иллюстрация Анны Балыкиной
Потенциал флавоноидов как антитромбоцитарных соединений
Флавоноиды являются распространенным компонентом препаратов традиционной китайской медицины, однако интерес к их свойствам и возможностям применения в современной медицине стремительно растет последние два десятилетия. Описан широкий спектр благоприятных свойств флавоноидов, в том числе антиоксидантный, противовоспалительный, противоопухолевый, антиапоптотический, бактерицидный, кардио- и нейропротекторный эффекты при воздействии на различные органы и ткани организма человека (рис. 6).
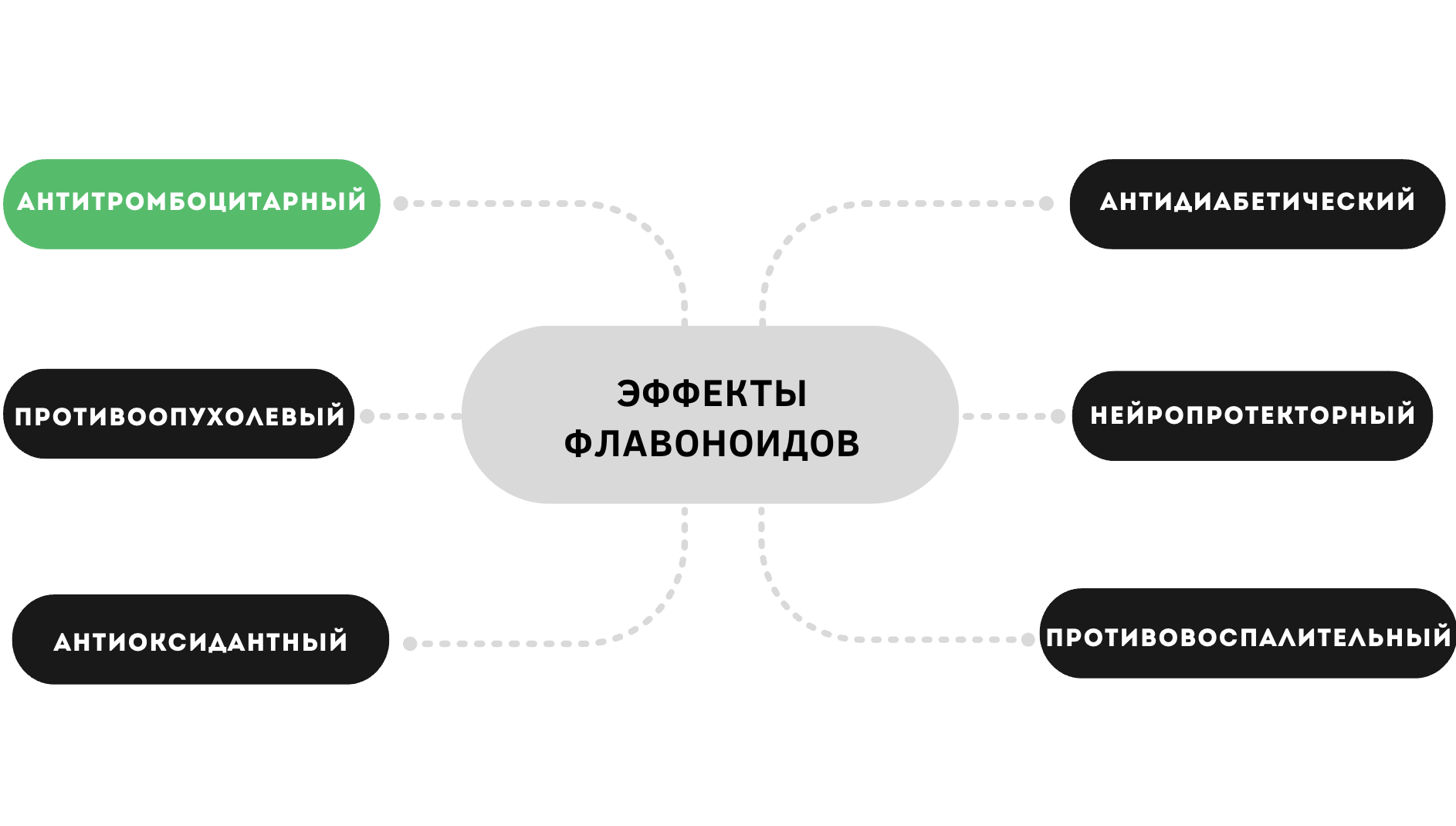
Рисунок 6. Биологические эффекты флавоноидов.
иллюстрация Анны Балыкиной
Благодаря способности флавоноидов усиливать фармакологический эффект некоторых лекарственных препаратов и преодолевать механизмы лекарственной устойчивости, а также вследствие низкой токсичности флавоноидов и их производных, на основе этих растительных соединений возможно создание новых высокоактивных и более безопасных лекарственных средств [29]. Изучение механизмов действия данных растительных соединений на тромбоциты позволит расширить возможности их применения в более безопасной и эффективной антитромбоцитарной терапии.
Потенциал флавоноидов как противоопухолевых соединений
В нормальных физиологических условиях полифенолы, в том числе флавоноиды, оказывают антиоксидантный эффект, хватая и нейтрализуя опасные активные формы кислорода (АФК), которые то и дело грозятся навести беспорядок в клетке, повредить белки, липиды и ДНК. Однако в отношении злокачественных клеток многие полифенолы, наоборот, являются прооксидантами, то есть вызывают увеличение АФК [30], [31]. Для некоторых флавоноидов уже была показана связь между усиленной генерацией АФК и апоптозом злокачественных клеток, и молекулярные механизмы, стоящие за этим эффектом, продолжают активно исследоваться [32], [33]. Было также установлено, что некоторые противоопухолевые препараты способны значительно увеличить концентрацию АФК в опухолевых клетках, что приводит к перегрузке антиоксидантных систем опухоли и к запуску апоптоза различными механизмами [34]. Актуальным является исследование совместного действия флавоноидов и препаратов с прооксидантным действием: это позволит установить возможность синергизма их действия, то есть усиление их суммарного эффекта при комбинированном применении. Кроме этого, многие флавоноиды способны влиять на белки, участвующие в регуляции апоптоза, выживаемости или скорости деления клеток злокачественной опухоли, не оказывая при этом цитотоксического эффекта на здоровые клетки [35], [36].
Противоопухолевая активность флавоноидов, которая реализуется различными механизмами, делает их перспективными соединениями для использования в комбинированной противоопухолевой терапии [37], [38]. Введение флавоноидов позволяет преодолеть лекарственную устойчивость к химиотерапевтическим препаратам, что существенно расширяет возможности их применения [39], [40]. Проапоптотическая активность флавоноидов в отношении злокачественных клеток и антиапоптотическое действие — в отношении нормальных — наводит на мысль о возможной успешной комбинации флавоноидов и химиотерапевтических препаратов-индукторов апоптоза. Однако в литературе нет данных о совместном действии флавоноидов и соединений проапоптотической группы на тромбоциты. По этой причине мы решили исследовать, способны ли флавоноиды стать телохранителями тромбоцитов и защитить их от токсического эффекта проапоптотической химиотерапии. Результаты нашей работы опубликованы в журнале International Journal of Molecular Sciences и доложены на российских и международных конференциях [41]. К слову, на «Биомолекуле» можно прочитать об аналогичной стратегии, разработанной для защиты клеток печени от негативного влияния химиотерапии с помощью вещества, полученного из семян расторопши [42].
Механизмы действия флавоноидов на тромбоциты
Антитромбоцитарный эффект флавоноидов
Разными исследовательскими группами было установлено, что агликоны флавоноидов ингибируют активацию тромбоцитов [43–45]. Однако точные механизмы данного эффекта не были изучены. В нашем исследовании мы выбрали шесть агликонов флавоноидов с ранее обнаруженным противотромбозным эффектом: лютеолин, мирицетин, кверцетин, кемпферол, эриодиктиол, апигенин для того, чтобы определить молекулярный механизм антитромбоцитарного действия. Для начала, с помощью проточной цитометрии [46] мы подтвердили, что все шесть агликонов флавоноидов вызывают ингибирование активации тромбоцитов. Мы выделили тромбоциты из крови здоровых доноров, не принимавших лекарственные средства, воздействующие на тромбоциты. Для оценки ингибиторного действия флавоноидов соединения добавляли к тромбоцитам на 30 минут, за чем следовала активация тромбоцитов тромбином. Действие тромбина приводит к изменению конформации интегрина αIIbβ3 на поверхности и образовании связи с фибриногеном. По этой причине активацию тромбоцитов мы оценивали по степени связывания αIIbβ3 с фибриногеном, меченым флуоресцентным красителем. Все тестируемые нами флавоноиды более чем на 50% ингибировали активацию тромбоцитов (рис. 7а).
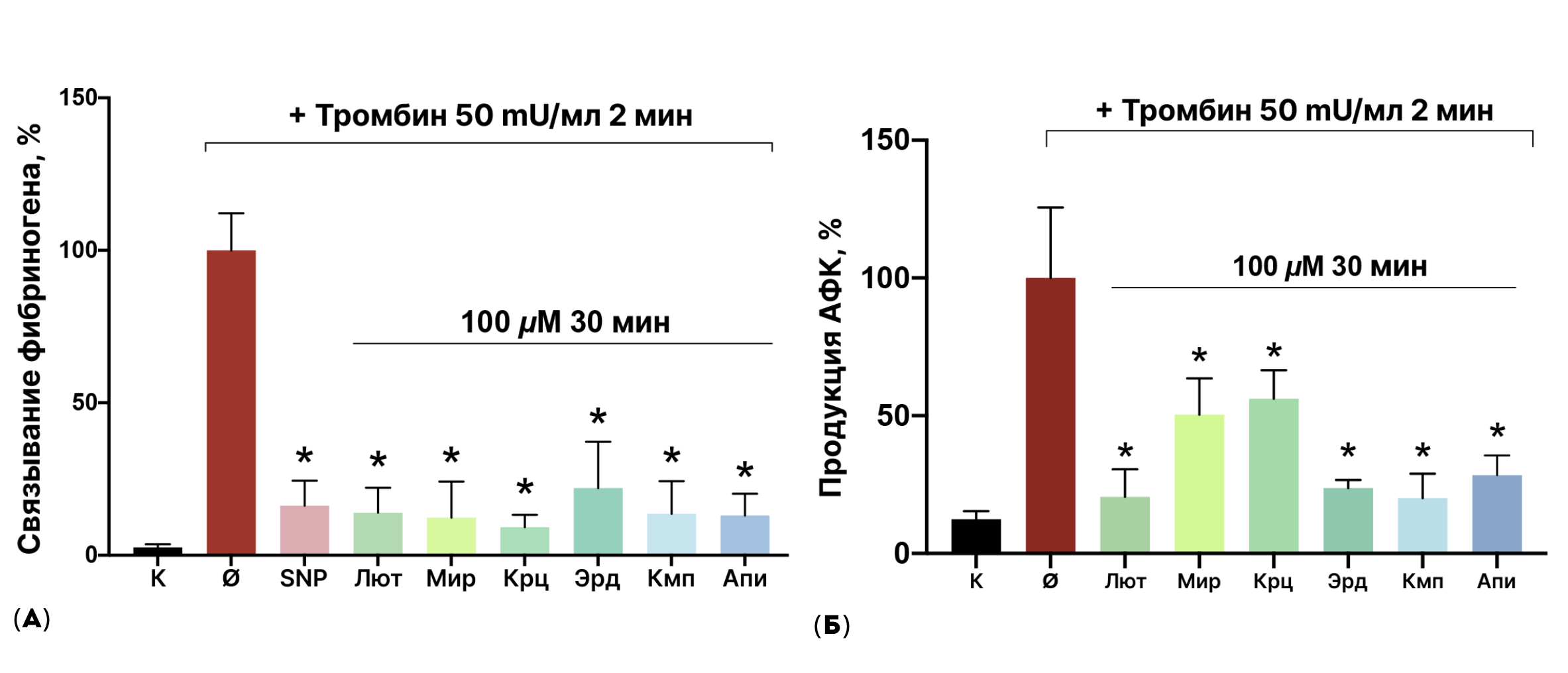
Рисунок 7. Агликоны флавоноидов оказывают антитромбоцитарный и антиоксидантный эффекты при действии на тромбоциты. Тромбоциты инкубировали с соответствующим флуоресцентным красителем и флавоноидами, затем добавляли тромбин. (а) — агликоны флавоноидов ингибировали активацию тромбоцитов, индуцированную тромбином, снижая степень связывания фибриногена с интегрином αIIbβ3. Для оценки относительной выраженности эффекта флавоноидов мы использовали мощный ингибитор активации тромбоцитов, нитропруссид натрия (SNP). Флавоноиды более чем на 50% ингибировали активацию тромбоцитов, и их эффект был сопоставим с выраженностью эффекта SNP. (б) — агликоны флавоноидов ингибировали образование активных форм кислорода (АФК) в тромбоцитах, вызванное тромбином.
Лютеолин (Лют), мирицетин (Мир), кверцетин (Крц), эриодиктиол (Эрд), кемпферол (Кмп) и апигенин (Апи). Проба с тромбином была обозначена как 100%, n = 6, критерий Манна-Уитни. * — р < 0,05 по сравнению с тромбином.
иллюстрация Анны Балыкиной и Лидии Найда
Антитромбоцитарный эффект может быть вызван снижением продукции АФК. Многие флавоноиды могут оказывать антиоксидантный эффект при воздействии на различные клетки. В нашем исследовании мы подтвердили способность агликонов флавоноидов снижать продукцию АФК в тромбоцитах (рис. 7б). Антитромбоцитарный эффект флавоноидов также может быть связан с изменением жизнеспособности тромбоцитов за счет индукции прямой цитотоксичности — некроза, апоптоза или прокоагулянтной трансформации тромбоцитов (одной из особенных программ гибели, обладающей признаками, характерными как для апоптоза, так и для некроза) [47], [488]. По этой причине мы оценили связь между антитромбоцитарным эффектом флавоноидов и индукцией клеточной гибели, измеряя степень экстернализации фосфатидилсерина и работу особых ферментов, активных только в живой клетке — внутриклеточных эстераз. Мы показали, что агликоны флавоноидов не вызывают ни одну из форм гибели тромбоцитов.
Ранее в разделе, посвященном биологии тромбоцитов, мы описали главные ингибиторные сигнальные механизмы в тромбоцитах. Эти механизмы связаны с системой циклических нуклеотидов: AC/cAMP/PKA и GC/cGMP/PKG сигнальные пути. За счет активации этих сигнальных путей ферменты PKA и PKG присоединяют фосфатные остатки на фосфопротеин, стимулируемый вазодилататорами (VASP). VASP становится фосфорилированным, что предотвращает его главную функцию — изменение формы тромбоцитов во время активации. Таким образом, по степени фосфорилирования VASP можно судить об активности AC/cAMP/PKA и GC/cGMP/PKG сигнальных путей.
Для того, чтобы оценить степень фосфорилирования VASP, мы использовали вестерн-блот анализ. Данный метод позволяет обнаружить определенные белки в образце за счет различной скорости движения белков в геле под действием силы электрического тока. В результате происходит разделение белков по молекулярной массе: крупным белкам сложно проходить через мелкие поры геля, а самые маленькие проходят очень быстро. После разделения белков добавляют распознающие искомый белок молекулы — «первичные» антитела, которые однозначно связываются по принципу «ключ-замок». Затем добавляют «вторичные» антитела со светящейся (люминесцентной) меткой, которые связываются с первичными антителами. В результате образуется бутерброд из трех слоев: искомый белок, первичное антитело и вторичное антитело, способное светиться. По уровню свечения вторичного антитела можно судить о количестве искомого белка: при высоком количестве белка с ним связывается больше «первичных» антител, а с ними — больше «вторичных» [49]. Тогда при детекции мы наблюдаем более яркую люминесценцию и более широкую темную область на светочувствительной пленке.
В нашем эксперименте, используя «первичные» антитела к фосфорилированному белку VASP, мы показали, что флавоноиды время- (1–30 мин) и дозозависимо (5–100 мкМ) стимулируют фосфорилирование VASP (рис. 8а). Следовательно, флавоноиды активируют AC/cAMP/PKA или GC/cGMP/PKG сигнальные пути.
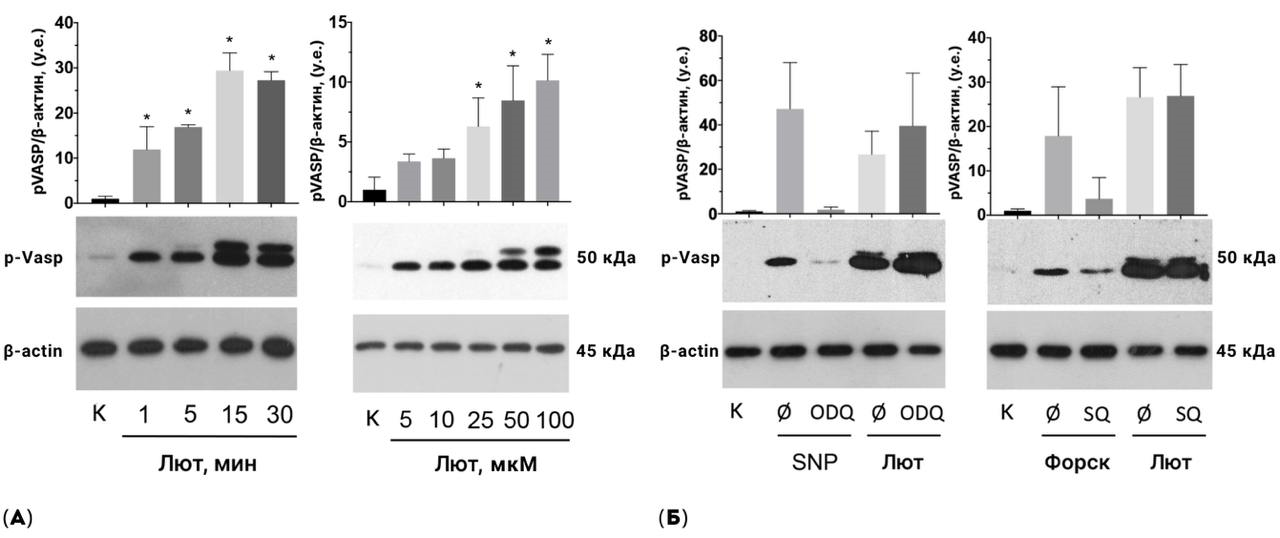
Рисунок 8. Агликоны флавоноидов вызывали активацию ингибирующей системы тромбоцитов (ТЦ), опосредованной через циклические нуклеотиды, при этом их молекулярный эффект не был связан с действием на аденилат- или гуанилатциклазу (AC и GC). (а) — на примере одного из исследованных соединений — лютеолина (Лют) — мы видим, что флавоноиды вызывали время- и дозо зависимое фосфорилирование VASP в ТЦ. Для данного исследования мы использовали метод вестерн-блот анализ. Пробы с ТЦ инкубировали с флавоноидами при концентрации 100 мкМ в течение 1-30 минут, либо в течении 30 минут в концентрации от 5 до 100 мкМ. Затем разрушали мембрану ТЦ за счет воздействия додецилсульфат натрия при нагревании на 95°C в течение 5 минут, чтобы внутриклеточные белки стали доступны для дальнейшего анализа. Содержимое проб вводили в полиакриламидный гель, представляющий собой «молекулярное сито», в котором под действием электрического тока белки разделяются по массе. Разделенные белки переносили с геля на нитроцеллюлозную мембрану. Далее мембрану с белками инкубировали с «первичными» антителами, которые распознают фосфорилированный фосфопротеин, стимулируемый вазодилататорами (p-VASP). Детекцию проводили за счет связывания люминесцирующих «вторичных антител» с «первичными антителами» к p-VASP. В результате на светочувствительной пленке мы получили изображение с бендами — «полосками» разной интенсивности. Бенды на рисунке обозначают пробы из одного эксперимента, состоящего из контроля (К, ТЦ инкубированные обозначенное время без агликонов флавоноидов) и проб с агликонами флавоноидов при разном времени инкубации или при разной концентрации. Чем ярче интенсивность свечения (то есть чем темнее и шире бенд), тем активнее ингибиторные сигнальные пути в ТЦ в этой пробе. Каждый эксперимент мы повторили 3 раза. Чтобы определить, как относится свечение фосфорилирования VASP между пробами в одном эксперименте, мы использовали белок домашнего хозяйства — β-актин, который постоянно и стабильно синтезируется в ТЦ независимо от внешних условий и показывает общее количество белка в каждой пробе. Используя программу ImageJ, мы количественно оценили свечение p-VASP и β-актина, затем мы рассчитали интенсивность сигнала p-VASP относительно сигнала от β-актина для каждой пробы (p-VASP/β-актин). Далее мы обозначили относительное свечение p-VASP в К пробе за 1, и выразили остальные пробы относительно контрольной. (б) — репрезентативный результат вестерн-блот анализа: на примере одного из исследованных флавоноидов — Лют — мы видим, что степень фосфорилирования VASP, вызванная агликонами флавоноидов, не изменялась под действием ингибитора AC, SQ22563 (SQ), и ингибитора GC, ODQ. Форсколин (Форск) и нитропруссид натрия (SNP) были использованы в качестве контроля работы ингибиторов, соответственно. Эксперимент проводили аналогично (а), ингибиторы добавляли к ТЦ на 10 минут перед инкубацией с флавоноидами (100 мкМ, 30 мин). Статистическую значимость (ANOVA, критерий Шапиро-Уилка p > 0,05, тест Левена p > 0,05, тест Тьюки HSD). * — р < 0,05 по сравнению с контролем (а) или с действием флавоноида без добавления соответствующего ингибитора: SQ или ODQ (б).
иллюстрация Анны Балыкиной и Лидии Найда
Мы обнаружили, что ингибиторный эффект агликонов флавоноидов вызван активацией сигнальных путей, связанных с действием циклических нуклеотидов: AC/cAMP/PKA или GC/cGMP/PKG (рис. 8а) при измерении фосфорилирования субстратного белка VASP. Чтобы выяснить молекулярную мишень этого эффекта, мы попробовали оценить каждое звено этого пути (рис. 3) по отдельности: 1) активируют ли агликоны флавоноидов AC или GC, 2) активируют ли PKA или PKG, или 3) блокируют ли агликоны действие фермента PDE — главного регулятора активности данных сигнальных путей, разрушающего cAMP и cGMP.
Для оценки первого звена сигнальных путей (AC или GС), мы инкубировали тромбоциты с ингибиторами AC и GC совместно с агликонами флавоноидов и снова измеряли фосфорилирование субстратного белка VASP. Если бы эффект агликонов флавоноидов был направлен на это звено, то ингибиторы блокировали бы действие соединений, и VASP не был бы фосфорилирован. Однако наши результаты показали, что фосфорилирование VASP, вызванное агликонами флавоноидов, не предотвращается ингибированием AC или GC, и, следовательно, агликоны флавоноидов не действует на это звено (рис. 8б).
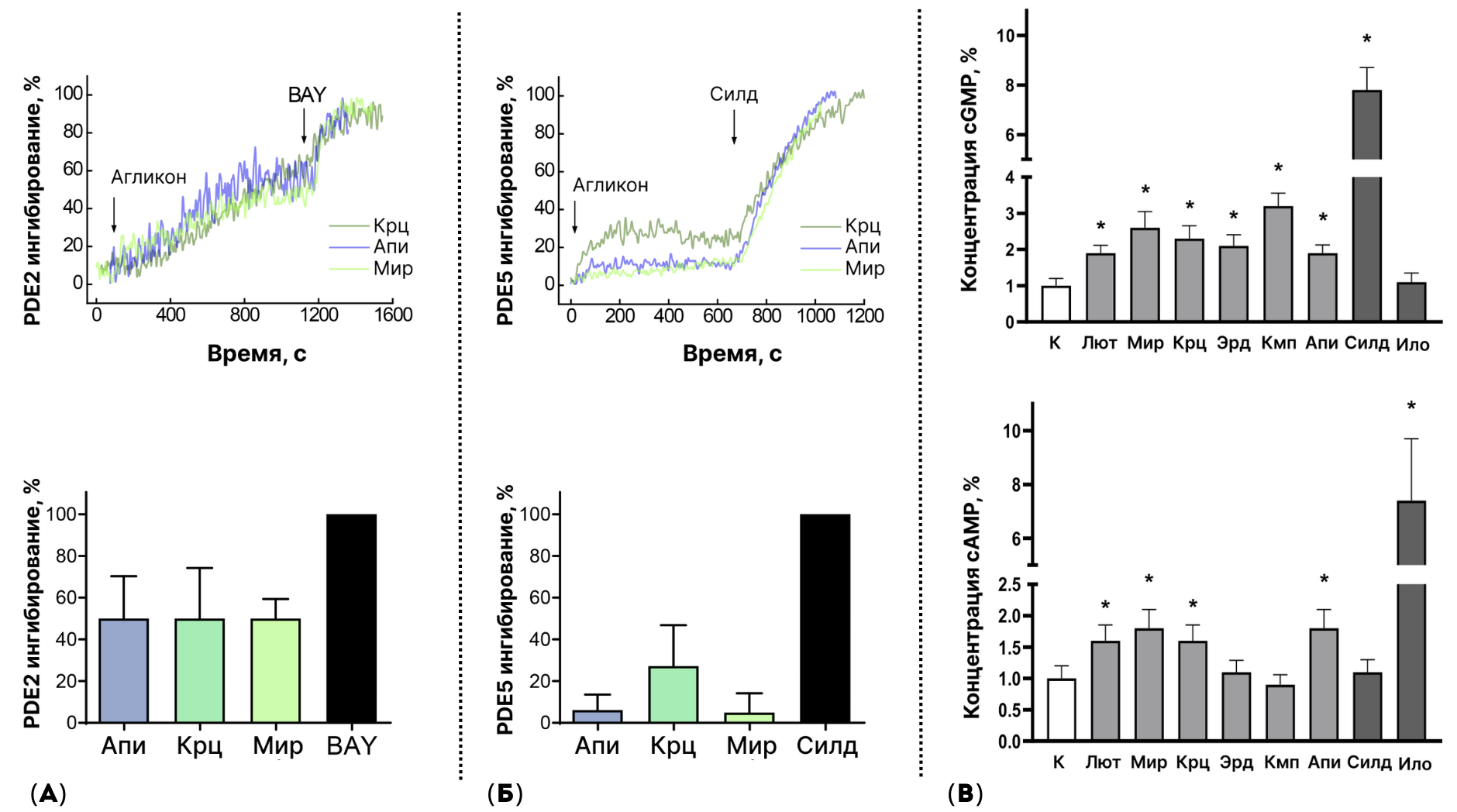
Рисунок 9. Агликоны флавоноидов вызывали антитромбоцитарный эффект за счет ингибирования фосфодиэстеразы 2 и/или 5 (PDE2 и/или PDE5). Тромбоциты инкубировали с агликонами флавоноидов при концентрации 100 мкМ в течение 30 мин. (а, б) — репрезентативный анализ блокирующего действия агликонов флавоноидов на различные изоформы PDE: PDE2 и PDE5. Мониторинг степени ингибирования фосфодиэстераз флавоноидами был произведен в реальном времени в живых клетках (HEK293) и был основан на эффекте Фёрстеровского переноса энергии (FRET). Измененные клетки HEK293 экспрессировали биосенсоры PDE2 и PDE5, которые позволяли детектировать ингибирование активности этих ферментов при инкубации с агликонами флавоноидов. BAY и BAY 60-7550 (BAY) и силденафил (Силд) были использованы в качестве позитивных контролей как вещества с известным ингибирующим эффектом на PDE2 и PDE5. (в) — гликоны флавоноидов повышали концентрации циклических нуклеотидов cAMP/cGMP в тромбоцитах, измеренные методом жидкостной хроматографии и тандемной масс-спектрометрии (LC-MS/MS). Для каждого образца это соотношение было выражено по отношению к контролю (К) и было обозначено как 1. n=3, one-way ANOVA, критерий Шапиро-Уилка p > 0,05, тест Левена p > 0,05, тест Тьюки HSD. * — р < 0,05 по сравнению с контролем. Илопрост (Ило), лютеолин (Лют), мирицетин (Мир), кверцетин (Крц), эриодиктиол (Эрд), кемпферол (Кмп) и апигенин (Апи).
иллюстрация Анны Балыкиной и Лидии Найда
Далее нам нужно было установить, действуют ли агликоны флавоноидов на второе звено сигнальных путей (PKA или PKG) или на третье (PDE). Об активности этих звеньев можно судить по концентрации циклических нуклеотидов (cAMP и cGMP). Если бы флавоноиды активировали PKA или PKG напрямую, то концентрация циклических нуклеотидов снижалась бы по механизму «отрицательной обратной связи». То есть флавоноиды активировали бы PKA или PKG, и главная функция cAMP и cGMP словно уже реализована. cAMP и cGMP были бы больше не нужны клетке: молекулы бы удалялись, их синтез бы снижался, а их концентрация в клетке при измерении стала бы незначительной. Обратная ситуация будет наблюдаться, если блокируется действие PDE: PDE в активированном состоянии разрушают циклические нуклеотиды, а блокирование эффекта PDE вызвало бы увеличение концентрации cAMP и cGMP.
С помощью жидкостной хроматографии и тандемной масс-спектрометрии (LC-MS/MS) [50], мы измерили концентрацию cAMP и cGMP в тромбоцитах, предварительно проинкубированных с агликонами флавоноидов. Все шесть тестируемых соединений повышали концентрацию cGMP; при этом концентрация cAMP повышалась в образцах с тромбоцитами, инкубированными только с четырьмя соединениями: лютеолином, мирицетином, кверцетином и апигенином (рис. 9в). Следовательно, эффект агликонов флавоноидов реализуется через блокирование PDE.
Мы наблюдали, что одни соединения повышали концентрацию только cGMP, а другие — концентрацию обоих циклических нуклеотидов: и cAMP, и cGMP. Такая разница может быть связана с тем, что соединения действуют на разные изоформы фермента PDE. Для определения этого эффекта мы использовали метод на основе Фёрстеровского переноса энергии (FRET) с использованием специальных биосенсоров к разным изоформам PDE, присутствующим в тромбоцитах (рис. 9а, б). Мы установили, что флавоноиды ингибируют активацию тромбоцитов за счет блокирования действия PDE, а именно PDE2 и/или PDE5 изоформ. Блокирование PDE флавоноидами приводило к увеличению концентрации циклических нуклеотидов и активации главных ингибиторных сигнальных путей: AC/cAMP/PKA или GC/cGMP/PKG (рис. 10).
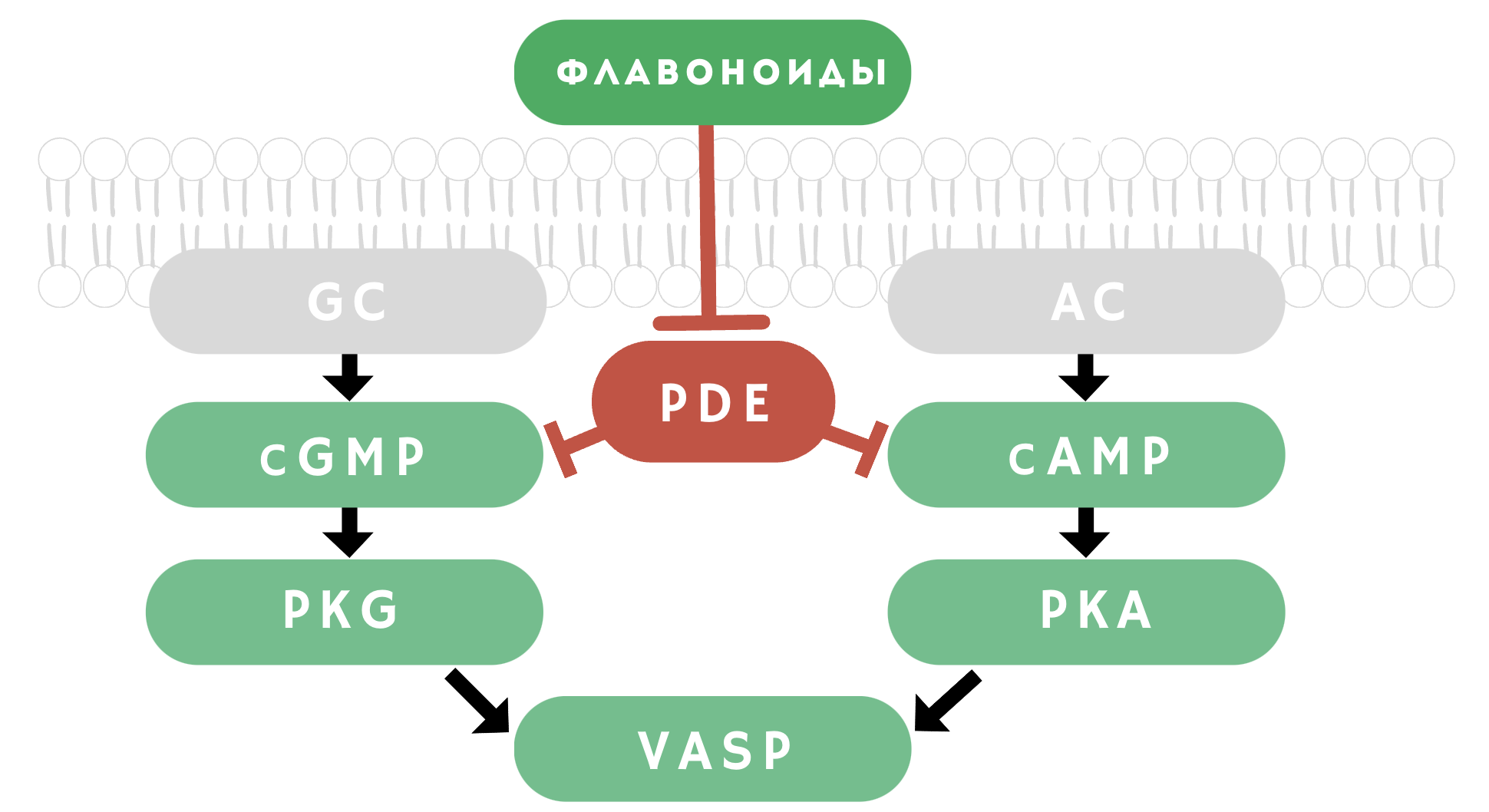
Рисунок 10. Флавоноиды оказывают антитромбоцитарный эффект за счет активации главных антитромбоцитарных сигнальных путей, ингибируя активность фосфодиэстераз. Гуанилатциклаза (GC), аденилатциклаза (AC), циклический гуанозинмонофосфат (cGMP), циклический аденозинмонофосфат (cAMP), протеинкиназа G (PKG), протеинкиназа A (PKA), фосфопротеин, стимулируемый вазодилататорами (VASP), фосфодиэстераза (PDE).
иллюстрация Анны Балыкиной и Лидии Найда
Антиапоптотический эффект флавоноидов
С помощью проточной цитометрии мы определили влияние агликонов флавоноидов на апоптоз тромбоцитов, вызванный проапоптотическим агентом ABT-737. В связи с тем, что в конце апоптотического каскада происходит экстернализация фосфатидилсерина, эффект соединений мы оценивали по степени экстернализации этого фосфолипида на внешней поверхности мембраны тромбоцитов. Мы инкубировали тромбоциты с флавоноидами, а затем индуцировали апоптоз с помощью ABT-737. По результатам, все растительные соединения значительно снижали экстернализацию фосфатидилсерина (рис. 11). Данные результаты позволяют сделать вывод об антиапоптотическом эффекте агликонов флавоноидов на тромбоциты.
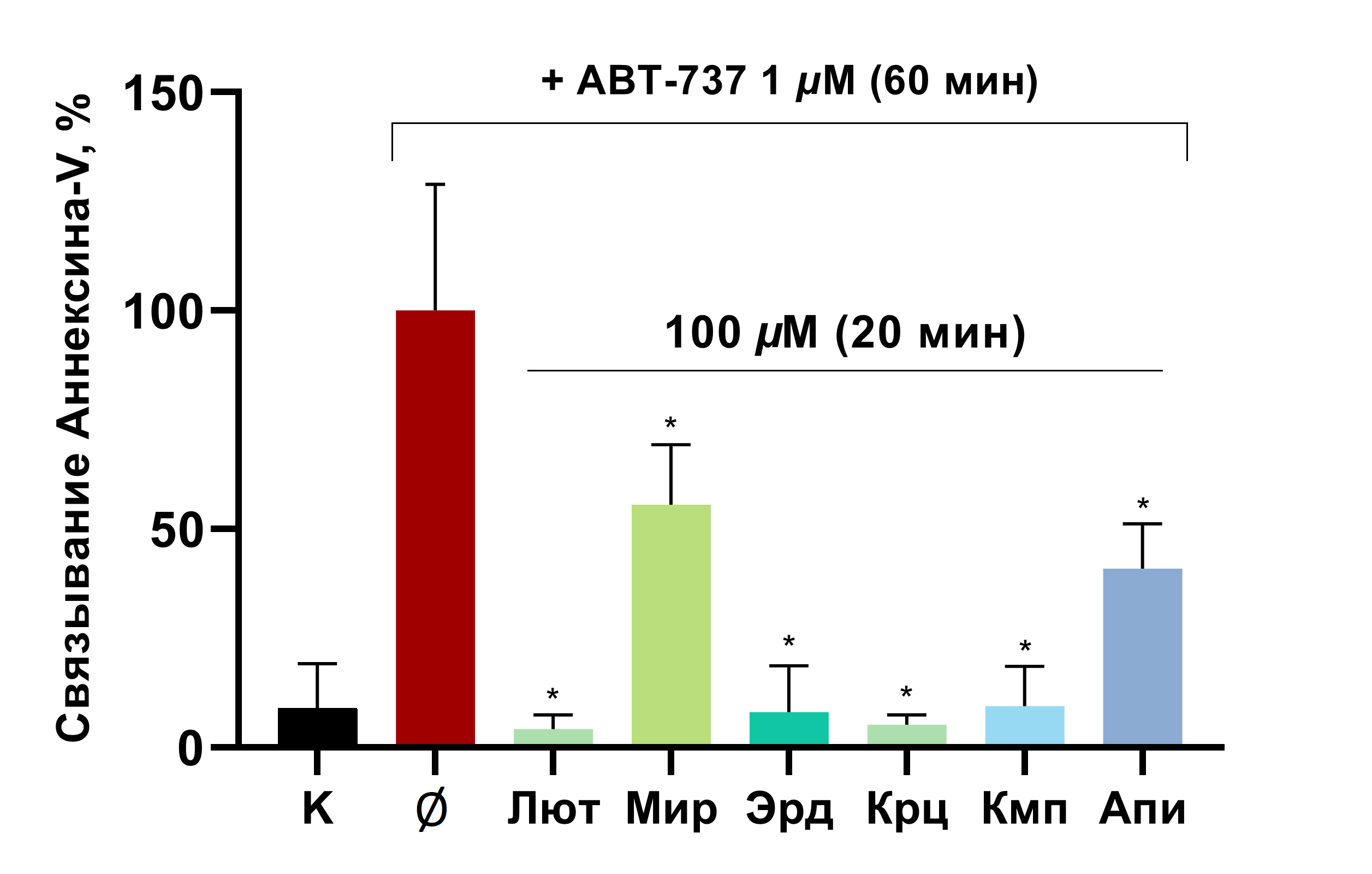
Рисунок 11. Агликоны флавоноидов ингибируют экстернализацию фосфатидилсерина, вызванную индуктором апоптоза ABT-737. Тромбоциты инкубировали с красителем Аннексином-V, затем добавляли флавоноиды на указанное время инкубации, после чего индуцировали апоптоз с помощью соединения ABT-737. Лютеолин (Лют), мирицетин (Мир), кверцетин (Крц), эриодиктиол (Эрд), кемпферол (Кмп) и апигенин (Апи). Проба с ABT-737 была обозначена как 100%, n = 8, one-way ANOVA, критерий Даннета. * — р < 0,05 по сравнению с ABT-737.
иллюстрация Анны Балыкиной
Применение результатов
Так как все агликоны флавоноидов оказывали антитромбоцитарное действие, их эффект может быть применим при разработке новых противотромбозных препаратов. Флавоноиды даже в высокой концентрации не вызывали индукцию апоптоза, образование прокоагулянтных тромбоцитов или цитотоксичность, что указывает на их безопасность и перспективность для разработки новых антиагрегантных средств. Из-за множества дополнительных полезных свойств, в том числе противовоспалительной и антиоксидантной активности, их эффект может быть подобен эффекту наиболее распространенного лекарственного препарата аспирина, но с меньшим количеством побочных эффектов. Эти благоприятные свойства флавоноидов могут быть применимы при терапии инсульта и инфаркта миокарда, в патофизиологических процессах которых есть ишемический и воспалительный компоненты. Антиоксидантные и антиагрегантные эффекты, обнаруженные у агликонов флавоноидов, делают их перспективными соединениями для пациентов с риском тромбоза, в особенности для людей старшего возраста [51].
Сочетание антиапоптотического и антитромбоцитарного действия агликонов флавоноидов при воздействии на тромбоциты позволило бы применить эти полезные свойства и в терапии онкологических пациентов, в том числе: 1) снизить или убрать побочный эффект проапоптотической химиотерапии, оказываемый на тромбоциты; 2) усилить эффект от противоопухолевой терапии проапоптотическими препаратами: напрямую увеличивая апоптоз злокачественных клеток и опосредованно — через ингибирование активности «тромбоцитов, обученных опухолью»; 3) снизить риск тромботических осложнений, ассоциированных со злокачественными опухолями. В связи с чем актуально исследовать возможность комбинирования современной химиотерапии с действием флавоноидов, в особенности у пациентов на поздних стадиях и с высокими рисками развития тромбоза. Так как флавоноиды сами не индуцируют апоптоз тромбоцитов, но индуцируют программируемую клеточную гибель в злокачественных клетках, мы предполагаем, что исследуемые агликоны флавоноидов при комбинированной химиотерапии также проявят двойственный эффект, не только защищая тромбоциты от индукции апоптоза, но и потенцируя апоптоз в опухолевых клетках [52] (рис. 12). Однако данная гипотеза требует дальнейшего подтверждения.
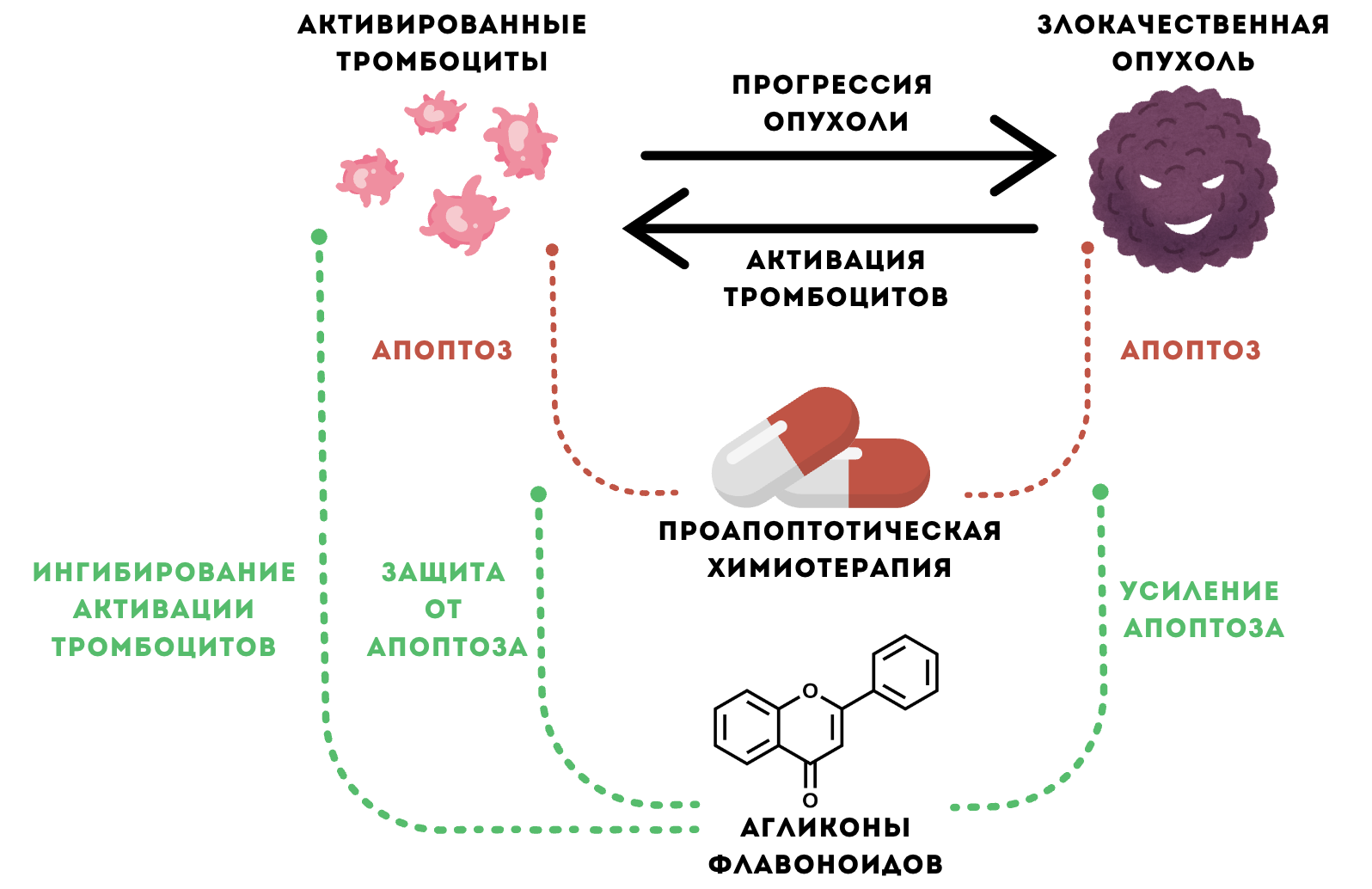
Рисунок 12. Перспективы использования комбинированной противоопухолевой химиотерапии, направленной на индукцию апоптоза, совместно с агликонами флавоноидов. Проапоптотическая химиотерапия, вызывает апоптоз не только злокачественных клеток, но и нормальных клеток организма, в том числе тромбоцитов. Тромбоциты гиперактивированы у пациентов со злокачественными опухолями и приобретают новое состояние «тромбоцитов, обученных опухолью», не только вызывая опухоль-ассоциированные тромбозы, но и помогая опухоли расти и прогрессировать. Однако апоптоз тромбоцитов, вызванный проапоптотической химиотерапией, может приводить к серьезным кровотечениям. Агликоны флавоноидов имеют множество полезных свойств для пациентов онкологического профиля, в том числе антитромбоцитарный эффект, антиапоптотический при действии на нормальные клетки организма и проапоптотический на злокачественные клетки. Комбинированная терапия данных противоопухолевых агентов с агликонами флавоноидов может: 1) снизить побочный эффект проапоптотической химиотерапии, оказываемый на тромбоциты и предотвратить кровотечения; 2) усилить апоптоз от противоопухолевой терапии проапоптотическими препаратами; 3) ингибировать активность «тромбоцитов, обученных опухолью», а следовательно снизить риск тромботических осложнений, ассоциированных со злокачественными опухолями, и риски опухолевой прогрессии. Такая стратегия может повысить эффективность и безопасность лечения злокачественных опухолей, улучшая прогноз и качество жизни пациентов.
иллюстрация Анны Балыкиной
Ограничения результатов
При дальнейшем изучении возможности применения флавоноидов необходимо обратить внимание на то, что флавоноиды обладают низкой пероральной биодоступностью, то есть низкой всасываемостью при проглатывании соединения. Данное свойство зависит от особенностей химической структуры молекул. Например, биодоступность флавоноидов в гликозилированном состоянии превышает биодоступность агликонов флавоноидов. На настоящий момент, изучение способов модификации и увеличения биодоступности флавоноидов активно ведется различными исследовательскими группами. Передовым направлением является разработка нановезикул для внутривенной доставки агликонов флавоноидов [54]. Такие нановезикулы являются своего рода пузырьками, внутрь которого помещают соединение. Преимуществом такой высокотехнологичной формы доставки является то, что к такому пузырьку возможно пришить на поверхность молекулу, которая распознает ткань доставки препарата (например, поверхностный опухолевый рецептор). Использование таких распознающих нановезикул позволит таргетно доставлять флавоноиды как соединения с низкой биодоступностью или в качестве компонента комбинированной противоопухолевой терапии, минимизировав токсичность и нежелательные эффекты за счет снижения дозирования и улучшения стабильности при хранении лекарственных средств.
Благодарности
Авторы выражают благодарность научному руководителю, д.б.н. Гамбаряну Степану Петровичу, и коллективу Лаборатории № 19 «Клеточные механизмы гомеостаза крови» ИЭФБ РАН, за поддержку и помощь в реализации проекта.
Работа выполнена при поддержке РНФ, грант № 23-15-00142.
Литература
- Последний путь тромбоцита;
- A.P. Bye, A.J. Unsworth, J.M. Gibbins. (2016). Platelet signaling: a complex interplay between inhibitory and activatory networks. Journal of Thrombosis and Haemostasis. 14, 918-930;
- A. SMOLENSKI. (2012). Novel roles of cAMP/cGMP‐dependent signaling in platelets. Journal of Thrombosis and Haemostasis. 10, 167-176;
- Stepan Gambaryan. (2022). The Role of NO/sGC/cGMP/PKG Signaling Pathway in Regulation of Platelet Function. Cells. 11, 3704;
- Апоптоз, или Путь самурая;
- Harriet E. Allan, Ami Vadgama, Paul C. Armstrong, Timothy D. Warner. (2023). What can we learn from senescent platelets, their transcriptomes and proteomes?. Platelets. 34;
- Nadine Goelz, Julia J. M. Eekels, Milica Pantic, Christoph T. Kamber, Oliver Speer, et. al.. (2021). Platelets express adaptor proteins of the extrinsic apoptosis pathway and can activate caspase-8. PLoS ONE. 16, e0244848;
- Armen Yuri Gasparyan, Timothy Watson, Gregory Y.H. Lip. (2008). The Role of Aspirin in Cardiovascular Prevention. Journal of the American College of Cardiology. 51, 1829-1843;
- Derrick L. Tao, Samuel Tassi Yunga, Craig D. Williams, Owen J. T. McCarty. (2021). Aspirin and antiplatelet treatments in cancer. Blood. 137, 3201-3211;
- S Willoughby. (2002). Platelets and cardiovascular disease. European Journal of Cardiovascular Nursing. 1, 273-288;
- Myron G. Best, Nik Sol, Irsan Kooi, Jihane Tannous, Bart A. Westerman, et. al.. (2015). RNA-Seq of Tumor-Educated Platelets Enables Blood-Based Pan-Cancer, Multiclass, and Molecular Pathway Cancer Diagnostics. Cancer Cell. 28, 666-676;
- Обнаружены организаторы побега раковых клеток из первичного очага;
- Метастазирование злокачественных опухолей: враг, который всегда впереди;
- Во власти опухоли: почему метастазы так сложно остановить?;
- Метастазирование опухолей;
- Иммунитет без тормозов: Нобелевская премия за антитела против рака (2018);
- Одураченные макрофаги, или Несколько слов о том, как злокачественные опухоли обманывают иммунитет;
- David G. Menter, Stephanie C. Tucker, Scott Kopetz, Anil K. Sood, John D. Crissman, Kenneth V. Honn. (2014). Platelets and cancer: a casual or causal relationship: revisited. Cancer Metastasis Rev. 33, 231-269;
- Anna Janowska‐Wieczorek, Marcin Wysoczynski, Jacek Kijowski, Leah Marquez‐Curtis, Bogdan Machalinski, et. al.. (2005). Microvesicles derived from activated platelets induce metastasis and angiogenesis in lung cancer. Intl Journal of Cancer. 113, 752-760;
- От медицинской онкологии к молекулярной биологии рака;
- Соревнуясь с раком;
- Как распознать рак при помощи биомаркеров?;
- Paul A. Townsend, Maria V. Kozhevnikova, Olivier N. F. Cexus, Andrey A. Zamyatnin, Surinder M. Soond. (2021). BH3-mimetics: recent developments in cancer therapy. J Exp Clin Cancer Res. 40;
- Страшней клешней на свете нет...;
- Опухолевые разговоры, или Роль микроокружения в развитии рака;
- Тараховский Ю. С., Ким Ю. А., Абдрасилов Б. С., Музафаров Е. Н. Флавоноиды: биохимия, биофизика, медицина. Пущино: Sуnchrobook, 2013. — 310 c.;
- Pier-Giorgio Pietta. (2000). Flavonoids as Antioxidants. J. Nat. Prod.. 63, 1035-1042;
- Guohua Cao, Emin Sofic, Ronald L. Prior. (1997). Antioxidant and Prooxidant Behavior of Flavonoids: Structure-Activity Relationships. Free Radical Biology and Medicine. 22, 749-760;
- Зеленые лекарства будущего;
- Malgorzata Kucinska, Hanna Piotrowska, Michał W. Luczak, Justyna Mikula-Pietrasik, Krzysztof Ksiazek, et. al.. (2014). Effects of hydroxylated resveratrol analogs on oxidative stress and cancer cells death in human acute T cell leukemia cell line. Chemico-Biological Interactions. 209, 96-110;
- A. Kunwar, S. Jayakumar, A. K. Srivastava, K. I. Priyadarsini. (2012). Dimethoxycurcumin-induced cell death in human breast carcinoma MCF7 cells: evidence for pro-oxidant activity, mitochondrial dysfunction, and apoptosis. Arch Toxicol. 86, 603-614;
- Dalia M. Kopustinskiene, Valdas Jakstas, Arunas Savickas, Jurga Bernatoniene. (2020). Flavonoids as Anticancer Agents. Nutrients. 12, 457;
- Fengjiao Wang, Lai Wang, Chao Qu, Lianyu Chen, Yawen Geng, et. al.. (2021). Kaempferol induces ROS-dependent apoptosis in pancreatic cancer cells via TGM2-mediated Akt/mTOR signaling. BMC Cancer. 21;
- Jing Zhou, Lu Zhang, Meng Wang, Li Zhou, Xuping Feng, et. al.. (2019). CPX Targeting DJ-1 Triggers ROS-induced Cell Death and Protective Autophagy in Colorectal Cancer. Theranostics. 9, 5577-5594;
- R. Vidya Priyadarsini, R. Senthil Murugan, S. Maitreyi, K. Ramalingam, D. Karunagaran, S. Nagini. (2010). The flavonoid quercetin induces cell cycle arrest and mitochondria-mediated apoptosis in human cervical cancer (HeLa) cells through p53 induction and NF-κB inhibition. European Journal of Pharmacology. 649, 84-91;
- Lei Zhang, Tai Zhou, Qiaorong Ji, Li He, Yan Lan, et. al.. (2023). Myricetin improves apoptosis after ischemic stroke via inhibiting MAPK-ERK pathway. Mol Biol Rep. 50, 2545-2557;
- Таргетная терапия — прицельный удар по болезни;
- Генная терапия против рака;
- Haixia Wang, Youjun Luo, Tiankui Qiao, Zhaoxia Wu, Zhonghua Huang. (2018). Luteolin sensitizes the antitumor effect of cisplatin in drug-resistant ovarian cancer via induction of apoptosis and inhibition of cell migration and invasion. J Ovarian Res. 11;
- Ritu Raina, Arif Hussain, Abdulmajeed G. Almutary, Shafiul Haque, Tasleem Raza, et. al.. (2023). Co-administration of Chrysin and Luteolin with Cisplatin and Topotecan Exhibits a Variable Therapeutic Value in Human Cancer Cells, HeLa. ACS Omega. 8, 41204-41213;
- Anna Balykina, Lidia Naida, Kürsat Kirkgöz, Viacheslav O. Nikolaev, Ekaterina Fock, et. al.. (2024). Antiplatelet Effects of Flavonoid Aglycones Are Mediated by Activation of Cyclic Nucleotide-Dependent Protein Kinases. IJMS. 25, 4864;
- На пути к безопасной химиотерапии;
- Tian-Ran Chen, Ling-Hua Wei, Xiao-Qing Guan, Chao Huang, Zhe-Yi Liu, et. al.. (2019). Biflavones from Ginkgo biloba as inhibitors of human thrombin. Bioorganic Chemistry. 92, 103199;
- Shu-Huey Tzeng, Wun-Chang Ko, Feng-Nien Ko, Che-Ming Teng. (1991). Inhibition of platelet aggregation by some flavonoids. Thrombosis Research. 64, 91-100;
- Cristina Zaragozá, Miguel Ángel Álvarez-Mon, Francisco Zaragozá, Lucinda Villaescusa. (2022). Flavonoids: Antiplatelet Effect as Inhibitors of COX-1. Molecules. 27, 1146;
- 12 методов в картинках: проточная цитофлуориметрия;
- Shaun P. Jackson, Simone M. Schoenwaelder. (2010). Procoagulant platelets: are they necrotic?. Blood. 116, 2011-2018;
- Артеменко Е.О., Свешникова А.Н., Пантелеев М.А. (2014). Программируемая клеточная смерть тромбоцитов при их сверхактивации. Онкогематология. 3, 63–66;
- 12 методов в картинках: иммунологические технологии;
- 12 методов в картинках: очистка молекул и разделение смесей;
- Eduardo Fuentes, Iván Palomo. (2016). Role of oxidative stress on platelet hyperreactivity during aging. Life Sciences. 148, 17-23;
- Zehra Tavsan, Hülya Ayar Kayali. (2019). Flavonoids showed anticancer effects on the ovarian cancer cells: Involvement of reactive oxygen species, apoptosis, cell cycle and invasion. Biomedicine & Pharmacotherapy. 116, 109004;
- Qiao-Ting Fu, Xiao-Qin Zhong, Mei-Yu Chen, Jia-Yi Gu, Jian Zhao, et. al.. (2023). Luteolin-Loaded Nanoparticles for the Treatment of Melanoma. IJN. Volume 18, 2053-2068.