СМА: три буквы — три лекарства
29 сентября 2023
СМА: три буквы — три лекарства
- 5729
- 0
- 3
Диагноз «СМА» у малыша до полутора лет означает, что без лечения ребенок не сможет ходить, а если болезнь проявила себя до шести месяцев — сидеть и даже переворачиваться.
Рисунок в оригинальном разрешении.
-
Автор
-
Редакторы
-
Иллюстратор
Спинальная мышечная атрофия — это болезнь, вызываемая гибелью моторных нейронов, заставляющих наши мышцы работать. Если эти нервные клетки умирают, мышечная ткань атрофируется, а человеку становится трудно (а при тяжелых формах — просто невозможно) поддерживать свое тело, самостоятельно есть и даже дышать. К счастью, сегодня человечество значительно продвинулось на пути лечения этого недуга. И всё благодаря генной терапии. В новой статье Спецпроекта по орфанным заболеваниям рассказываем о болезни, обозначаемой тремя буквами — СМА.
Орфанные заболевания

Пациенты с орфанными заболеваниями страдают в одиночестве и смятении. Они чувствуют себя изгоями «стандартной» медицины. Мечты о том, что их заболевание «усыновит» какая-нибудь компания, и лекарство, наконец, будет разработано — то, что не дает им впасть в отчаяние.
Материал создан при поддержке компании «Артген биотех», миссия которой — сделать научные открытия и достижения практическими технологиями, создавать и внедрять в жизнь биотехнологические разработки для эффективной борьбы с орфанными и социально значимыми заболеваниями человека. «Артген биотех» разрабатывает и выводит на рынок биомедицинские препараты, вакцины, методы генной терапии, препараты по направлениям регенеративной медицины и клеточных технологий, а также изделия медицинского назначения в областях тканевой инженерии и генетических исследований.
Заболевание, о котором пойдет речь в этой статье, долгое время носило имя «болезнь Верднига—Гоффмана». Пусть и первые описанные этими учеными в 1890-е годы случаи, скорее всего, не относились к спинальной мышечной атрофии (СМА) 1 типа, в конце концов благодаря им были сформулированы основные признаки болезни, которые определяют ее и сегодня: это симметричная слабость конечностей и гибель моторных нейронов передних рогов спинного мозга.
На протяжении очень долгого времени СМА не удавалось лечить, неизвестно было даже, отчего гибнут нервные клетки, связанные с мышцами. В течение почти 100 лет после открытия самой болезни врачи продолжали выделять различные виды СМА (4 известных нам сегодня типа были наконец выделены в 1991 году) и гадать, отличается ли детская форма от СМА у взрослых.
Главной загадкой спинальной мышечной атрофии стал вопрос: «Если болезнь имеет генетическую причину, как одна и та же мутация в каком-то гене может вызывать такие разные синдромы? Почему одни люди со СМА могут сидеть и даже ходить, а другие не способны переворачиваться в кровати и самостоятельно есть?» Ответа ждали до 1995 года, когда французская женщина-генетик Джудит Мелки с коллегами выяснили, что у сломанного при СМА гена есть ген-помощник, и он-то (по крайней мере — отчасти) и влияет на тяжесть недуга.
По материалам этой статьи мы выпустили вместе с компанией «Артген биотех» ролик про СМА. В нем Роман Деев, врач и научный сотрудник компании Genotarget, рассказывает об этой болезни — посмотрите, прежде чем продолжить чтение!
СМА: смерть двигательных нейронов
Итак, классическая проксимальная спинальная мышечная атрофия — это аутосомно-рецессивное генетическое заболевание, возникающее из-за мутаций в гене SMN1, который находится в пятой хромосоме и отвечает за синтез белка выживаемости моторных нейронов (рис. 1). Такую СМА называют 5q-СМА по номеру хромосомы, в которой произошел сбой.
Аутосомно-рецессивный тип наследования означает, что для проявления болезни обе копии гена, унаследованные от родителей, должны содержать мутацию, то есть быть поврежденными. В этом случае, если оба родителя здоровы, но являются носителями мутации (то есть у каждого из них одна из двух копий гена повреждена), с вероятностью 50% их ребенок унаследует носительство и с вероятностью 25% — родится больным.
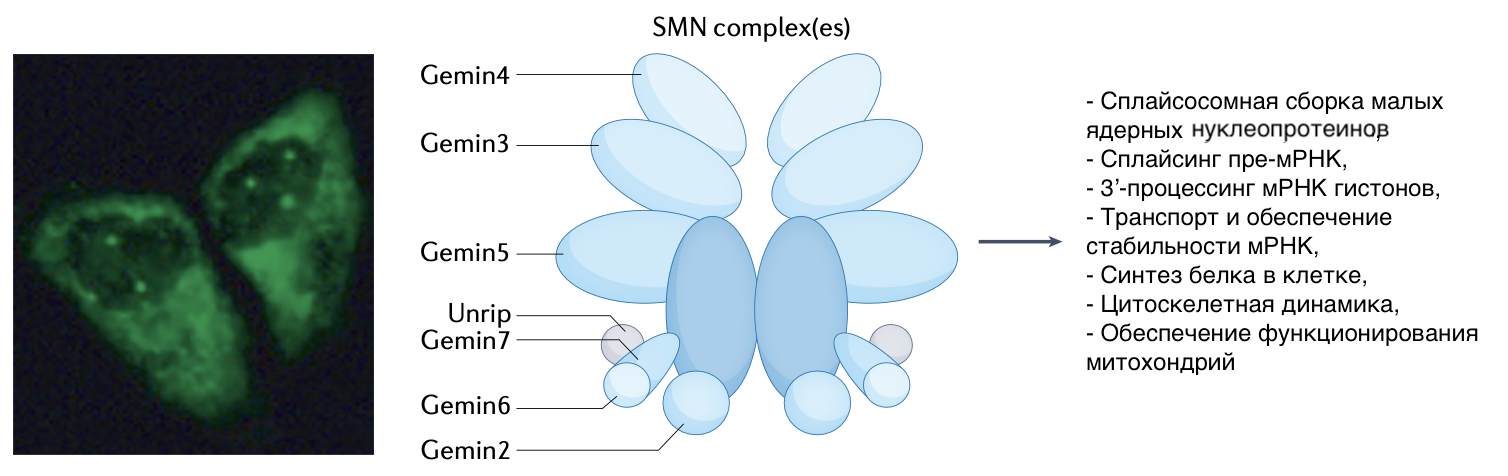
Рисунок 1. Состав и функции белка SMN в клетках человека. Комплекс SMN (в центре) содержится в ядре и цитоплазме клеток (слева). Полноценный, стабильный белок SMN имеет массу 38 кДа и чаще всего существует в олигомеризованной форме, связываясь сам с собой и с множеством других белков. Эта его способность образовывать различные комплексы позволяет белку выполнять множество функций в клетках. Основная, наиболее точно установленная роль SMN, заключается в поддержании точности сборки малых ядерных рибонуклеопротеинов в сплайсосомах — ядерных структурах, отвечающих за сплайсинг мРНК [1], [2]. Кроме того, SMN участвует в процессах транскрипции [3] и трансляции (которые наиболее активно происходят во время эмбрионального и постнатального развития [4]) и необходим для нормального функционирования митохондриальной дыхательной цепи в двигательных нейронах [5] и мышцах [6]. Более подробно о белке выживаемости мотонейронов читайте в статье «Надежда для СМАйликов» [7].
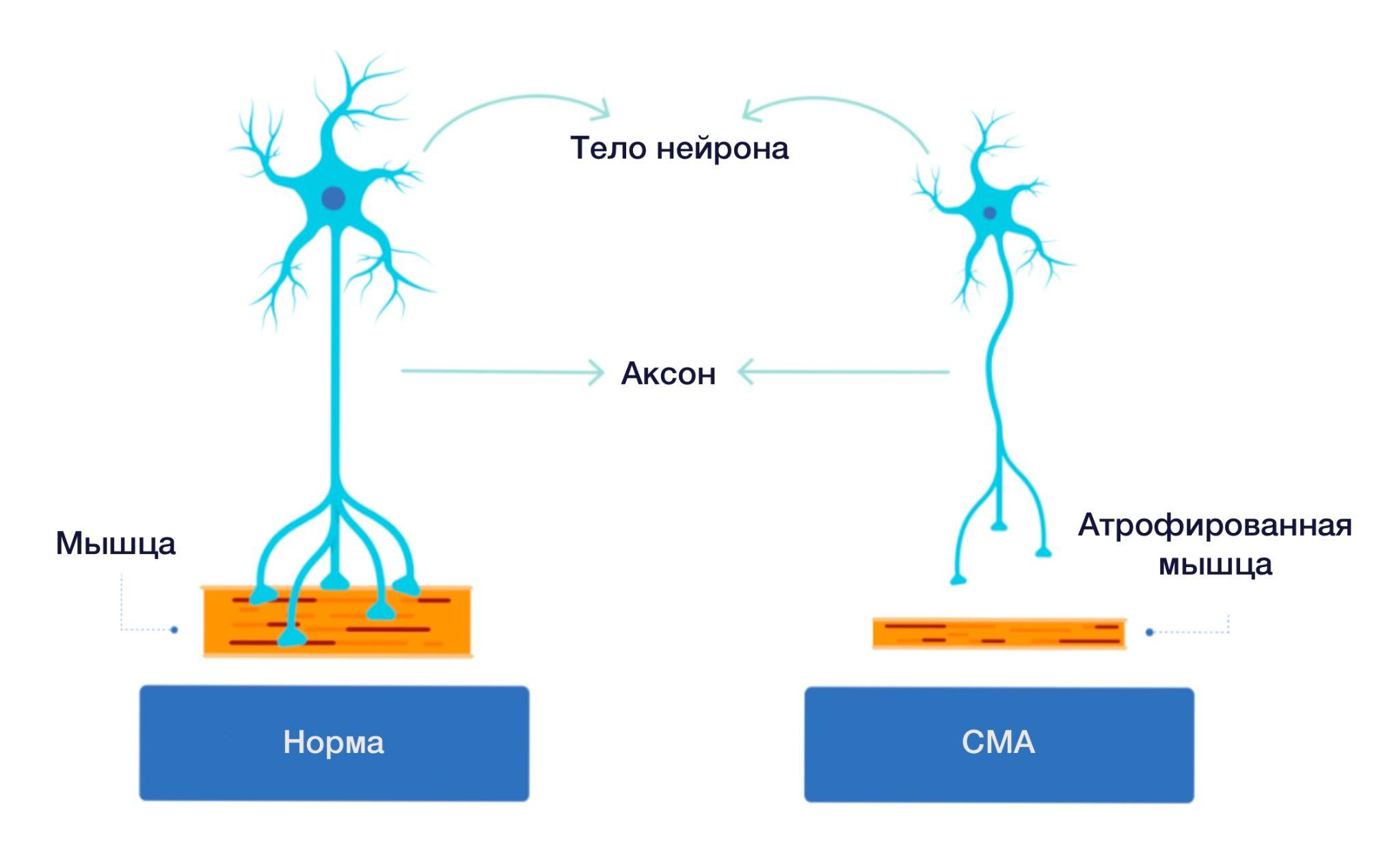
У больных СМА ген SMN1 сломан, из-за чего у них не вырабатывается белок SMN, особенно важный для жизни нервных клеток, обеспечивающих работу скелетных мышц, а также мышц, благодаря которым мы можем глотать и дышать (о том, как сказывается на мотонейронах и мышцах отсутствие белка SMN, показано на рисунке 2). Таким образом, СМА в тяжелой форме — болезнь смертельная.
Тут нужно отметить, что у гена SMN1 есть помощник — ген SMN2. Это почти полная его копия, которая, однако, не способна производить стабильный и функциональный белок SMN в больших количествах. Подробнее о том, почему SMN2 не может заменить на своем посту мутантную версию SMN1, мы уже писали в статье «Надежда для СМАйликов» [7], здесь же ограничимся наглядной схемой с кратким пояснением (рис. 3).
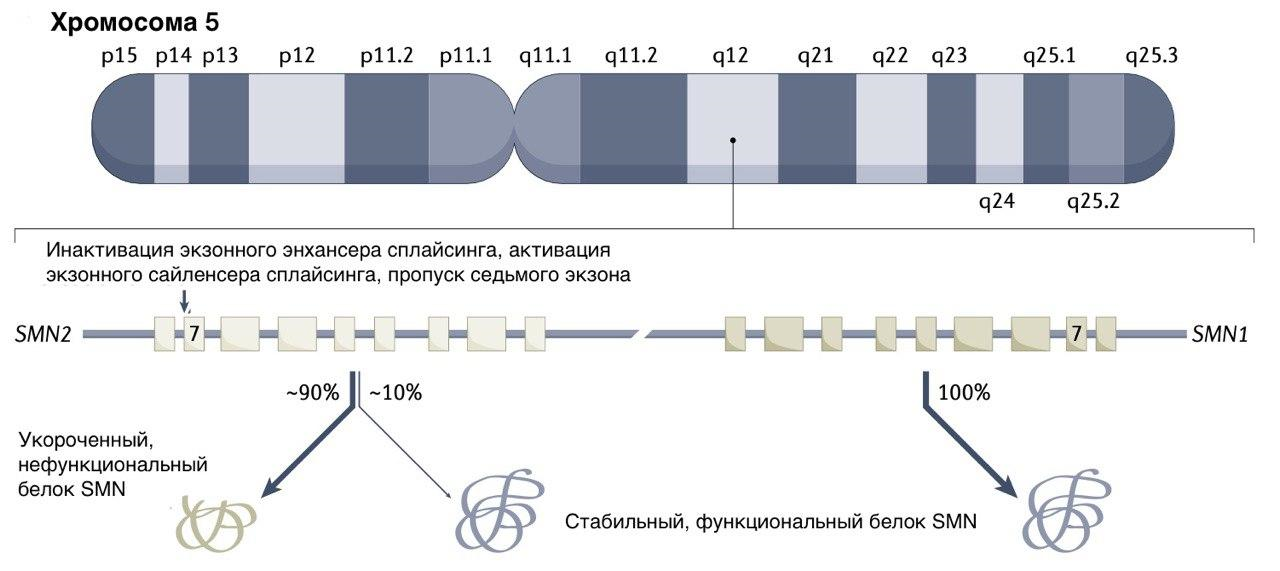
Рисунок 3. Схематичное изображение работы генов SMN1 и SMN2 человека на пятой хромосоме. У пациентов со СМА поврежден ген SMN1 и не затронут ген SMN2. К сожалению, SMN2, который отличается от своего старшего брата всего одной буквой (тимин вместо цитозина в седьмом экзоне), в 10 раз хуже производит свой целевой белок. Сплайсинг (переход от пре-мРНК к зрелой мРНК) для него происходит иначе; в результате седьмой экзон выпадает из мРНК, и белок SMN синтезируется в основном в укороченном виде. Такой неполноценный белок быстро деградирует и не выполняет своих функций. Однако, поскольку экзон 7 иногда всё же сохраняется, порядка 10% всех продуктов каждой копии SMN2 — полноразмерный функциональный белок.
Таким образом, если страдает ген SMN1, несмотря на наличие гена SMN2, количество белка SMN заметно уменьшается. При этом моторные нейроны оказываются особенно уязвимы к такой поломке. Дело в том, что способность гена SMN2 производить нормальный белок SMN, то есть частота включения седьмого экзона в готовую мРНК, может варьироваться в зависимости от типа клеток. В частности, именно двигательные нейроны продуцируют низкие уровни полноразмерной мРНК SMN из SMN2 по сравнению с другими клетками спинного мозга. Это неэффективное удержание экзона 7 у SMN2 в моторных нейронах приводит к особенно низким уровням SMN в этом типе клеток и, как следствие, к расцвету симптомов болезни.
Что же становится причиной поломки в ДНК? Ученые выяснили, что у 95% пациентов с 5q-SMA в гене SMN1 присутствуют потери части генетической информации (делеции) в 7 и 8 или только в 7 экзоне [13]. Чаще всего поломанный ген наследуется от родителей. Мутации de novo происходят с относительно высокой частотой (примерно 2%) из-за нестабильности этой части хромосомы. У пациентов с менее тяжелыми симптомами (СМА 2 и 3 типа) чаще выявляется замена седьмого экзона SMN1 на экзон SMN2, чем настоящие делеции SMN1.
СМА в мире орфанных заболеваний
Заболеваемость СМА во всем мире составляет ~1 на 10 000 младенцев [14]. Исследование 2021 года, посвященное впервые проведенному неонатальному скринингу на СМА в девяти странах, показало, что заболеваемость колеблется от 1 на 5000 до 1 на 28 000 детей [15]. В России сегодня проживает около 200 человек с диагнозом СМА. Да, болезнь редкая, но среди орфанных — весьма и весьма распространенная.
Орфанными (от англ. orphan — сирота) называют болезни, которые встречаются настолько редко, что долгое время фармкомпании не были заинтересованы в разработке лекарств против них [16]. На «Биомолекуле» уже вышли статьи о других заболеваниях из этой категории: ATTR-амилоидозе [17], болезни Фабри [18] и самой частой среди редких — миодистрофии Дюшенна [19].
В зависимости от того, как болезнь ведет себя, СМА разделяют на три основных типа (типы 1–3, табл. 1) и еще два менее распространенных (типы 0 и 4). Первые развиваются в детском возрасте. При 0 типе изменения в нервных клетках заметны уже у плода, а 4 тип впервые проявляется во взрослом возрасте и отличается менее выраженными симптомами.
СМА типа 1 (OMIM 253300 — номер в генетической базе данных, где собрана информация об известных наследуемых заболеваниях и генах, которые за них ответственны) является самой распространенной формой заболевания и составляет около 60% от всех случаев 5q-СМА. В отсутствие лечения этот тип проявляется у детей в течение уже первых шести месяцев жизни. Такие малыши, как правило, не могут самостоятельно сидеть, а приобретенные ранее двигательные навыки (такие как переворот на живот или опора на вытянутые руки) быстро теряются. У пациентов развивается синдром «вялого ребенка» — дети обвисают на руках, у них деформируется грудная клетка, они плохо едят, не могут нормально кашлять. В конце концов пациенты начинают испытывать трудности с глотанием и дыханием и в 90% случаев не доживают до двух лет из-за дыхательной недостаточности и сопутствующих инфекций.
Типы 2 (OMIM 253550) и 3 (OMIM 253400) встречаются реже — вероятность развития обоих приближена к 20%. Тип 2 также довольно тяжелый, а вот 3 тип СМА не такой страшный: пациенты с этим диагнозом могут ходить. Самый благоприятный, но довольно редкий тип — 4.
| Тип СМА | Обычный возраст манифестации болезни | Функция мышц, которой можно добиться поддерживающей терапией | Способность есть и общаться | Функция легких | Продолжительность жизни при условии поддерживающего лечения |
|---|---|---|---|---|---|
| 0 | В утробе | Отсутствует | Отсутствует | Крайне низкая | Дни или месяцы |
| 1 | 0–6 месяцев | Без возможности сидеть или переворачиваться | Низкая, требуется поддержка | Низкая, необходима поддержка | Месяцы (в среднем — 10 месяцев) |
| 2 | 7–18 месяцев | Способность сидеть | Нарушена в разной степени | Снижена, часто требуется поддержка | Годы (обычно — более 20 лет) |
| 3 | 1,5–10 лет | Способность ходить с ограничениями | Не затронута | Немного снижена, без симптомов | Обычная |
| 4 | больше 18 лет | Способность нормально ходить | Не затронута | Нормальная | Обычная |
При описании типов СМА не учитываются эффекты, связанные с использованием препаратов нусинерсена, онасемноген абепарвовека и рисдиплама.
Симптомы болезни: что СМА делает с нейронами и мышцами
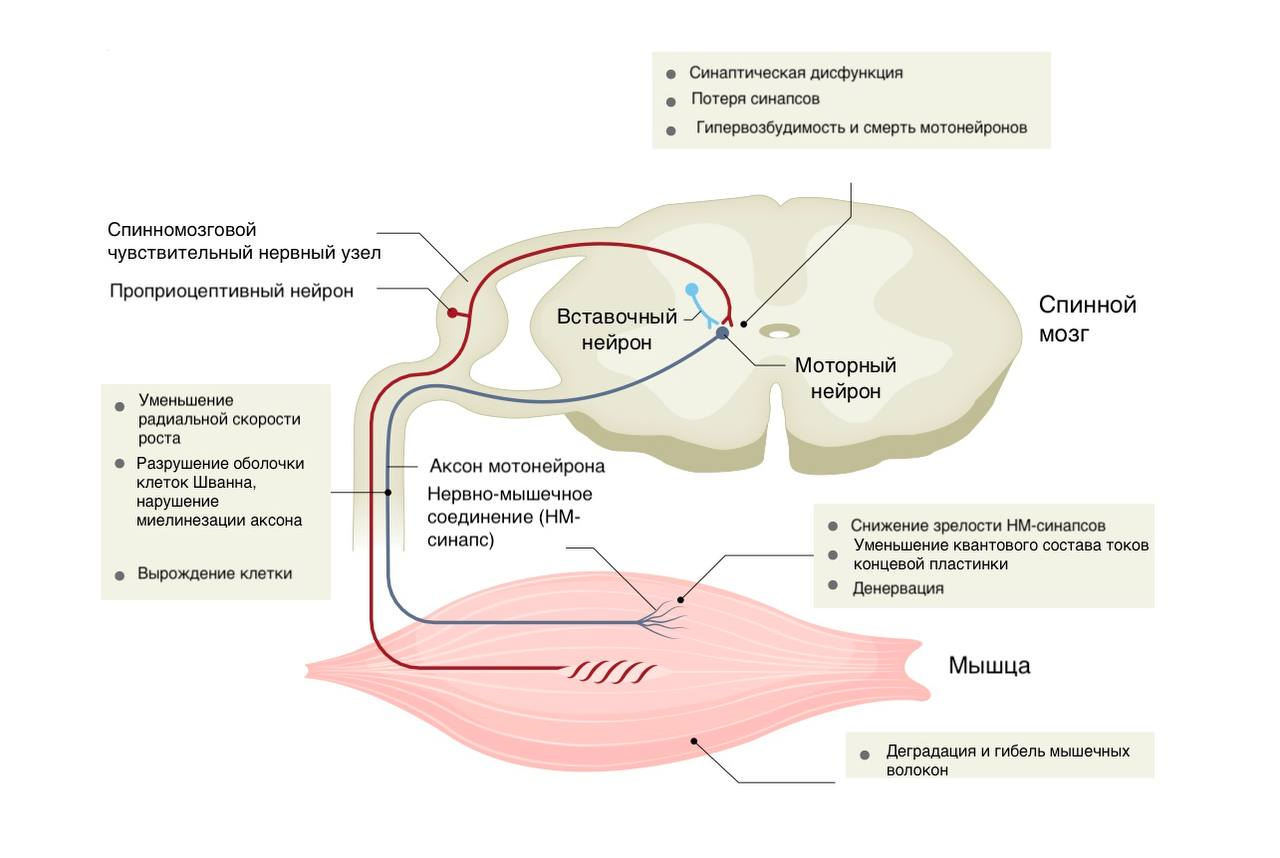
Основной симптом СМА — это слабость скелетных мышц, то есть потеря способности двигаться, ведь из-за болезни нарушается работа двигательных нейронов и связанных с ними мышечных волокон (обобщенно называемых двигательными единицами). Страдают как тела нервных клеток, так и их аксоны, а также миофибриллы-мишени. Со временем происходит разрушение аксонов и гибель нейронов, ответственных за моторные функции, а мышечная ткань в отсутствии сигналов от мозга замещается фиброзно-жировой. Особенно уязвимы незрелые двигательные единицы; они разрушаются крайне стремительно, поэтому проявления болезни у детей быстро нарастают. На более поздних стадиях заболевания нейродегенерация протекает медленнее.
Симптомы и возраст проявления сильно различаются в зависимости от типа заболевания (табл. 1). Тем не менее, все вариации болезни имеют общие черты — это потеря рефлексов, спонтанные подергивания (мышечные сокращения), сохранение чувствительности и характерная мышечная слабость, которая тем сильнее, чем ближе мышцы к центру туловища — отсюда в названии классической СМА слово «проксимальный». При СМА заметно ослабевают мышцы таза и плечевых суставов, а также верхней части ног и рук. А вот таких признаков поражения ЦНС, как судороги, спастика (постоянное напряжение мышц), потеря слуха или зрения, при СМА не наблюдается.
Своими тяжелыми симптомами славится СМА 1 типа (болезнь Верднига—Гоффмана, которая встречается чаще всего). Как мы уже писали, младенцы с этой формой болезни страдают от глубокой гипотонии, и им каждый день становится всё труднее глотать и дышать. При нулевом типе СМА симптомы еще ужаснее — они начинаются еще в утробе, что можно наблюдать по снижению активности плода. Рождаются такие детки очень слабыми, в тяжелом состоянии, и редко живут дольше нескольких месяцев.
У пациентов со СМА 2 типа (болезнь Дубовица) мышечная слабость примерно такая же, как у детей со СМА 1 типа, и даже если она менее выражена, у них, как правило, развивается сколиоз и различные нарушения дыхания. По мере нарастания симптомов все освоенные такими детьми навыки — например, возможность сидеть и стоять — теряются. Также со временем, ввиду лучшей выживаемости пациентов, у врачей копятся данные о когнитивных нарушениях, характерных и для 1, и для 2 типа болезни [20], [21].
Самые легкие симптомы у пациентов с 3 (болезнь Кугельберга—Веландера) и 4 формами. СМА третьего типа обычно сопровождается небольшими проявлениями мышечной слабости (в основном — ног), повышенной утомляемостью и склонностью к частым падениям, но в 50% случаев может приводить и к потере возможности ходить в подростковом возрасте. Когнитивные способности у пациентов со СМА 3 или 4 типа сохраняются.
Жизнь со СМА
Если болезнь не обнаруживают во время скрининга, чаще всего семьи сталкиваются со СМА неожиданно. Болезнь приходит как гром среди ясного неба — вчера ребенок развивался нормально и был здоров, а сегодня у него задержка в развитии. С этого момента начинается борьба за жизнь. И чтобы выиграть первый бой, нужно узнать диагноз.
Как найти поломанный ген? Диагностика СМА
Для того, чтобы поставить диагноз СМА, сперва следует обратиться к врачу-неврологу, который проведет клиническое обследование. Во время осмотра доктор оценит моторное развитие ребенка, проанализирует потерю у него уже приобретенных навыков (если она есть), измерит показатели массы и роста, проверит рефлексы. Уже тогда могут быть замечены явные симптомы болезни — например, деформация суставов из-за их чрезмерного разгибания, сниженный мышечный тонус, сколиоз и деформации грудной клетки.
Первичная диагностика крайне важна, так как именно на этом этапе делается предположение о том, с каким из множества нейромышечных расстройств пришлось столкнуться пациенту. Только среди самых распространенных наследственных заболеваний с похожими проявлениями:
- болезнь Шарко—Мари—Тута [22] (частота встречаемости — 1 на 2500 человек),
- дистрофии Дюшенна [19] и Беккера (1 на 3500 и 1–3 на 20 000 мужчин соответственно),
- дистрофические миотонии (1 на 8000 человек),
- лице-лопаточно-плечевые дистрофии (1 на 20 000 человек).
Хорошая новость в том, что вместе со СМА на них приходится порядка 80% всех подобных случаев. Тем не менее, врачу проще будет поставить верный диагноз, если у него есть возможность наблюдать больного в динамике, например, раз в полгода .
СМА только в 95% случаев связана с мутациями в гене SMN1. При этом другие виды СМА имеют схожие симптомы с классической версией. Это, например, SMARD, СБМА (болезнь Кеннеди), бульбоспинальная форма Виолетто-Ван-Лере и дистальная форма спинальной амиотрофии.
После осмотра невролог, заподозрив СМА, назначает сдачу анализов, а также консультацию у специалиста-генетика.
В качестве первого анализа, который сдают пациенты, выступает генетическое тестирование. Этот способ не вызывает затруднений, так как около 95% пациентов со СМА имеют гомозиготные делеции (когда из обеих копий гена исключены какие-то его участки) седьмого и восьмого экзонов или только седьмого экзона в гене SMN1. Таким образом, генетическим подтверждением 5q-СМА становятся двуаллельные мутации в SMN1. Изредка, однако, причина болезни кроется в редких точечных мутациях, найти которые сложнее. Тогда используют секвенирование — подробную расшифровку ДНК.
Сегодня важной частью теста является оценка копий вспомогательного гена SMN2, так как, исходя из этого, врачам становится понятно, насколько тяжелые симптомы его ждут и, если симптомов еще нет, нужно ли начинать лечение.
В такой генетической диагностике медикам помогают современные биологические методы. Это количественная полимеразная цепная реакция (ПЦР) в реальном времени, мультиплексная амплификация лигированных зондов (MLPA), цифровая ПЦР и методы секвенирования нового поколения .
О методе ПЦР [23] (включая его «цифровую» разновидность [24]) и секвенировании [25] на «Биомолекуле» есть прекрасные статьи, которые выходили в рамках спецпроекта «12 биологических методов в картинках».
Людей со спинальной мышечной атрофией диагностируют либо тогда, когда у них уже есть симптомы (в этом случае неизбежна необратимая потеря части двигательных нейронов, ведь симптомы болезни означают, что нервные клетки уже начали погибать), либо еще до этого — на стадии предсимптомов. Второй вариант касается обычно тех, кому генетический анализ делают из предосторожности, в случае, если СМА есть в семейной истории болезней. Однако развитые страны (США, Бельгия [26], Германия, Испания, Италия, Польша и с недавнего времени — Россия) периодически запускают проекты по скринингу всех новорожденных. Тогда анализ входит в набор тестов, которые делают еще в роддоме — «кровь из пятки». Такие программы помогают выявлять у большего количества малышей болезнь на стадии, когда она еще не заявила о себе, и вовремя начинать лечение.
Скрининг может проводиться также среди пар, только планирующих зачатие. В этом случае цель теста — выявить носительство сломанного гена, частота которого составляет 0,98–2,02% в зависимости от этнической принадлежности (примерно каждый пятидесятый человек [27]). Если в результате обследования окажется, что риск рождения больного ребенка велик, врач может предложить зачатие путем ЭКО с предимплантационный генетическим тестированием. Это позволит выбрать эмбрион без заболевания.
Помимо генетических тестов, у больного с мышечной слабостью могут измерить уровень креатинкиназы в сыворотке крови. Он может быть слегка повышен, а уровень креатинина в сыворотке у пациентов со СМА 1 или 2 типа низкий, что подтверждает снижение у них мышечной массы. При СМА 1 типа иногда также проводят рентгенографию. Она позволяет увидеть характерную для заболевания колоколообразную форму грудной клетки и «зонтикообразную» деформацию ребер, возникающую из-за слабости межреберных мышц.
Электромиография (ЭМГ) или электронейромиография (ЭНМГ) обычно выступает вспомогательным методом диагностики, когда болезнь слабо выражена, и врачам требуется исключить другие нервно-мышечные заболевания с похожими симптомами. Для детей старше 5 лет могут проводить и МРТ-исследование.
Наконец, для уточнения типа СМА врач может оценивать состояние мышц, опираясь на данные биопсии. Глядя на гистологические срезы, он определит наличие и степень атрофии мышечных волокон (рис. 5) [28]. Этот метод, однако, в настоящее время практически не используют из-за его травматичности — для анализа нужно взять у маленького пациента образец мышечной ткани.
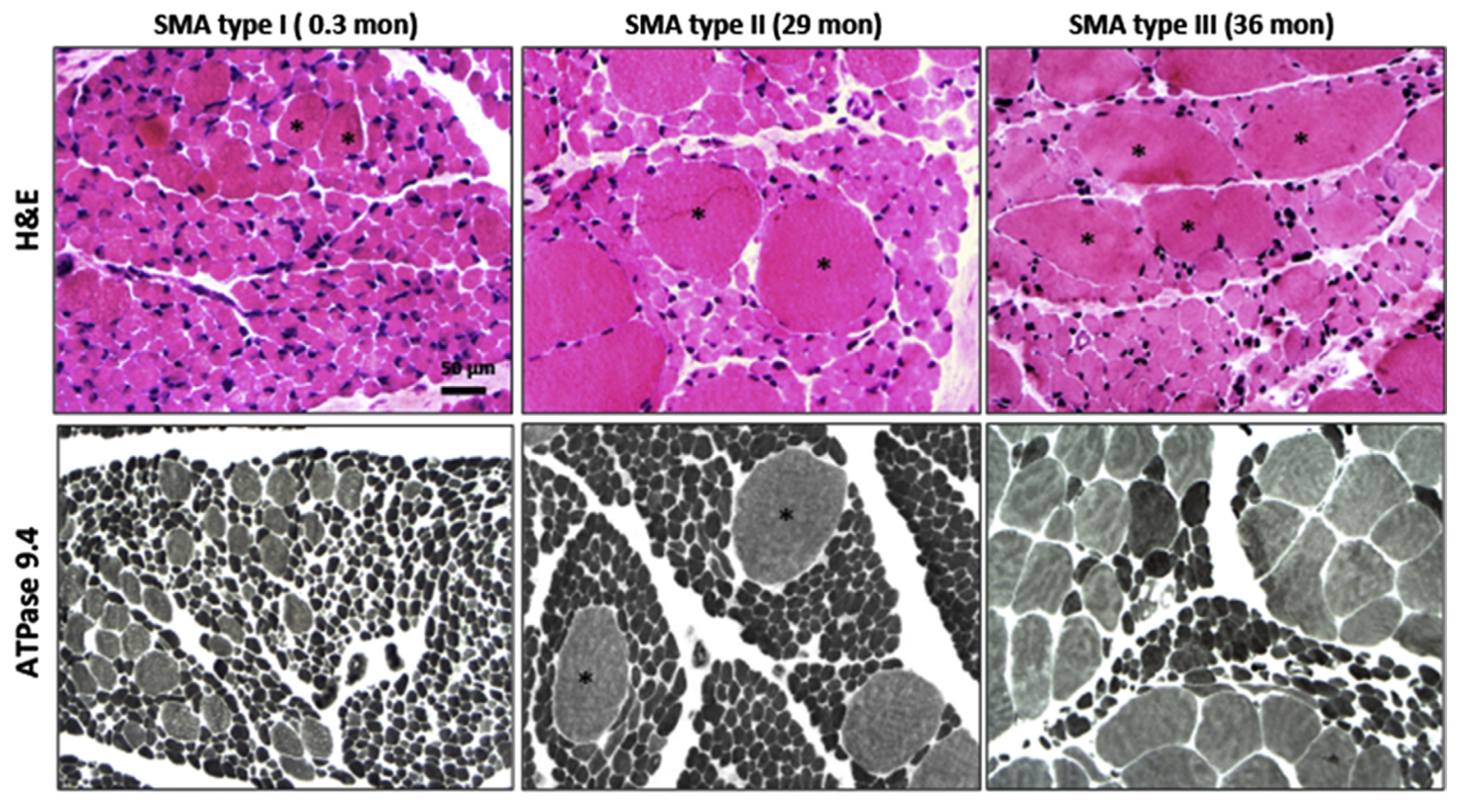
Рисунок 5. Результаты мышечной биопсии при СМА 1–3 типов. Ткань четырехглавой мышцы в верхнем ряду была окрашена гематоксилином и эозином, в нижнем ряду — АТФазой 9.4. На снимках видно, что при СМА 1–3 типов в мышечной ткани пациентов имеется большое количество очень маленьких, округлых волокон, но их процент по отношению к полноценным мышечным волокнам уменьшается с уменьшением тяжести заболевания. Звездочками отмечены вкрапления гипертрофированных волокон.
Благодаря биопсии мы можем наблюдать, как гибель мотонейронов из-за дефицита белка SMN приводит к атрофии мышц. Если у здорового человека мышечные волокна достаточно крупные, то при поражении спинальных ганглиев структура мышц заметно изменяется — пучки мышечных волокон в них выглядят истощенными и мелкими.
У моего ребенка СМА. Что же дальше?
После того, как диагноз поставлен, лечащий врач (чаще всего это невролог) подробно рассказывает родителям больного ребенка или самому пациенту, если он уже взрослый, в чем заключается причина болезни, как она будет развиваться, каков прогноз в этом конкретном случае и в чем будет заключаться тактика лечения.
«Спинраза», «Золгенсма» и «Эврисди»: как лечат СМА сегодня
С недавних пор медицина способна предложить СМАйликам эффективное патогенетическое лечение. Сегодня существует три препарата генной терапии против СМА, которые одобрены FDA и EMA и доступны пациентам во многих странах мира, включая Россию.
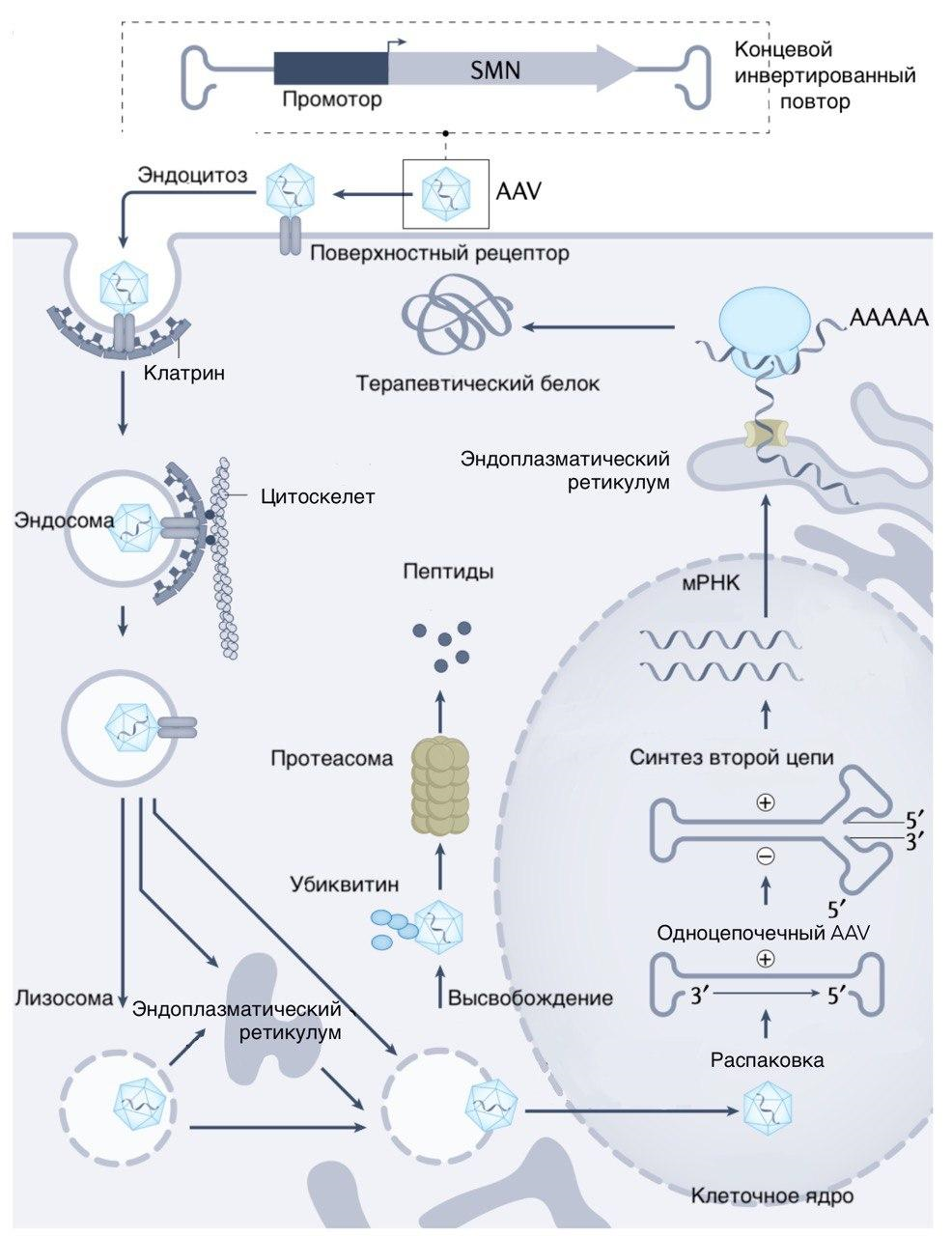
Рисунок 6. «Золгенсма» содержит кДНК (комплементарную ДНК, полученную на базе зрелой мРНК) с полным вариантом гена SMN1. Для ее доставки в клетки используется вектор на основе аденоассоциированного вируса (AAV9) [31]. Вектор проникает в клетки путем эндоцитоза, после чего часть векторов деградирует, а часть — проникает в ядра мотонейронов, где существует в форме внехромосомных элементов, продуцируя необходимый для нормального функционирования клеток белок SMN.
Первый, который приходит на ум, — знаменитая «Золгенсма» (онасемноген абепарвовек, AVXS-101) от компании Novartis, которая в 2019 году стала настоящим прорывом в генной терапии, а также прославилась своей рекордной стоимостью в 2,1 млн долларов США за одну дозу [29]. Суть ее действия в том, чтобы доставить в ядра моторных нейронов здоровый вариант гена SMN1, который будет производить нужный им белок (подробно о том, как работает этот препарат, мы уже писали в статье «Генная терапия нейромоторных болезней» [30], а схематично процесс производства замещающего белка SMN в мотонейронах показан на рис. 6). Лекарство вводят внутривенно один раз, чем раньше — тем лучше. Сегодня препарат одобрен для лечения детей до 2 лет со СМА 1 типа (в ЕС — для детей с массой тела менее 21 кг со СМА 1 типа или с подтвержденными мутациями в гене SMN1 при наличии не более 3 копий гена SMN2). В России «Золгенсма» стала доступна в 2021 году.
Свойства и эффективность «Золгенсмы» изучают уже довольно давно, а потому у ученых накопилось достаточно много информации о ней. Известно, что препарат обладает гепатотоксичностью [32] и может вызывать нарушения работы печени, но, несмотря на это, он остается крайне востребован . Всё благодаря результатам, которых удается достигнуть с его помощью и тому, что вводить его нужно лишь единожды. Применение «Золгенсмы» дает эффект и может улучшать моторные функции даже у детей с тяжелыми симптомами, хотя наилучших результатов удается добиться, если использовать препарат на ранних стадиях болезни, когда симптомов еще нет или они только начали проявляться [33], [34]. Тогда в некоторых случаях в результате терапии дети развиваются в пределах возрастных норм, приобретая навыки наравне со сверстниками.
У «Золгенсмы» есть и другие побочные эффекты, о них подробно рассказано в статье «Самое дорогостоящее лекарство в мире» [29].
У использования «Золгенсмы» есть важное ограничение, связанное с наличием у пациента иммунитета к аденовирусному вектору, входящему в ее состав. Перед тем, как получить лекарство, каждый ребенок должен сдать анализ на антитела к AAV9. Если он окажется положительным, препарат колоть бесполезно, он не сработает — иммунная система расправится с ним до того, как вектор с рабочей ДНК достигнет цели. Раньше биоматериал детей со СМА из России для проведения такого анализа нужно было отправлять за границу, в Нидерланды, что сильно тормозило процесс получения терапии. Сегодня наборы для проведения тестов закупаются для всех регионов страны фондом «Круг добра».
У «Спинразы» (нусинерсен) от компании Biogen, которая вышла на рынок первой — в 2016 году, — совершенно другой принцип действия. Являясь антисмысловым олигонуклеотидом (одноцепочечной молекулой РНК), она вмешивается в процесс синтеза белка, экспрессируемого геном SMN2, на уровне сплайсинга, в результате чего растет количество полноценного белка SMN, продуцируемого клеткой. В строгом смысле «Спинразу» нельзя отнести к генной терапии, так как она работает не на генном уровне, но при этом меняет экспрессию генов. Лекарство разрешено для всех возрастов и типов болезни, к 2023 году его получили в общей сложности более 15 000 пациентов. В России лекарство было зарегистрировано в 2019 году, а в 2020 году — включено в перечень жизненно необходимых и важнейших лекарственных препаратов (ЖНВЛП).
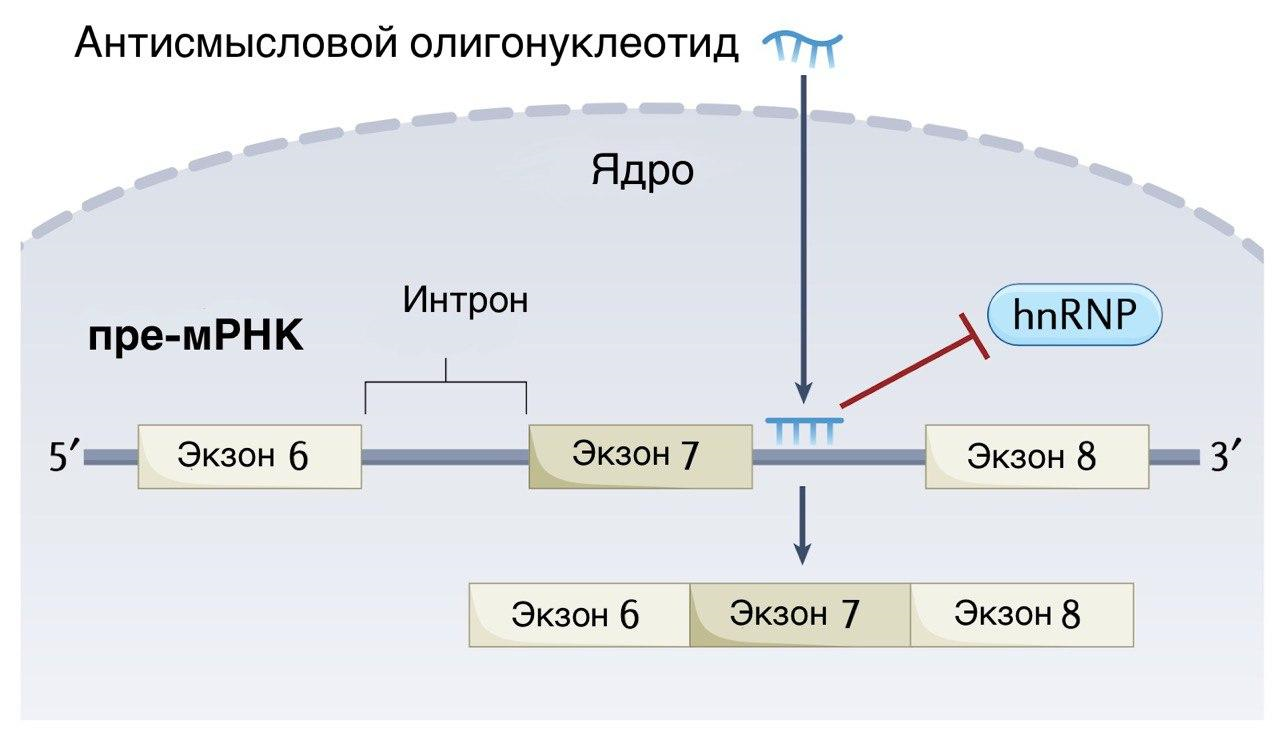
Рисунок 7. Нусинерсен влияет на сплайсинг (получение зрелой мРНК из пре-мРНК), препятствуя связыванию с пре-мРНК гетерогенных ядерных рибонуклеопротеинов (hnRNP), которые стимулируют исключение седьмого экзона из мРНК.
Для препарата доказан долгосрочный эффект, а в исследовании CHERISH, где участвовали пациенты от 2 до 12 лет, улучшение двигательных функций наблюдалось у 57% детей, получивших лечение, и у 26% детей, получивших имитацию терапии [35].
Основной недостаток «Спинразы» в том, что вводить препарат следует прямо в спинномозговую жидкость, что не назовешь безболезненным. Более того, люмбальная пункция может вызывать тяжелые осложнения, особенно если позвоночник больного искривлен, что при СМА не редкость. Инъекции лекарства нужно делать постоянно: 3 раза с интервалом в 2 недели, 1 раз через 35 дней и затем каждые 4 месяца на протяжении всей жизни.
Начинать применять «Спинразу» следует как можно раньше, тогда у пациента будет более высокий потенциал улучшений, хотя возможность приобретать новые двигательные навыки после терапии сохраняется для больных в любом возрасте.
Наконец, третий одобренный препарат против СМА был разработан компанией Roche в сотрудничестве с PTC Therapeutics и SMA Foundation. Это рисдиплам с коммерческим названием «Эврисди». Работает лекарство, как и «Спинраза», на уровне сплайсинга вспомогательного гена SMN2, но, в отличие от последнего, оно способно преодолевать гематоэнцефалический барьер , поэтому его можно вводить неинвазивно. Способ употребления «Эврисди» — пероральный, то есть самый физиологичный из всех. Принимать лекарство нужно постоянно и ежедневно.
Это не всегда преимущество. Системное воздействие «Эврисди» на периферическую нервную систему означает, что у него будет больше off-target эффектов. Например, лекарство может влиять на сплайсинг других генов.
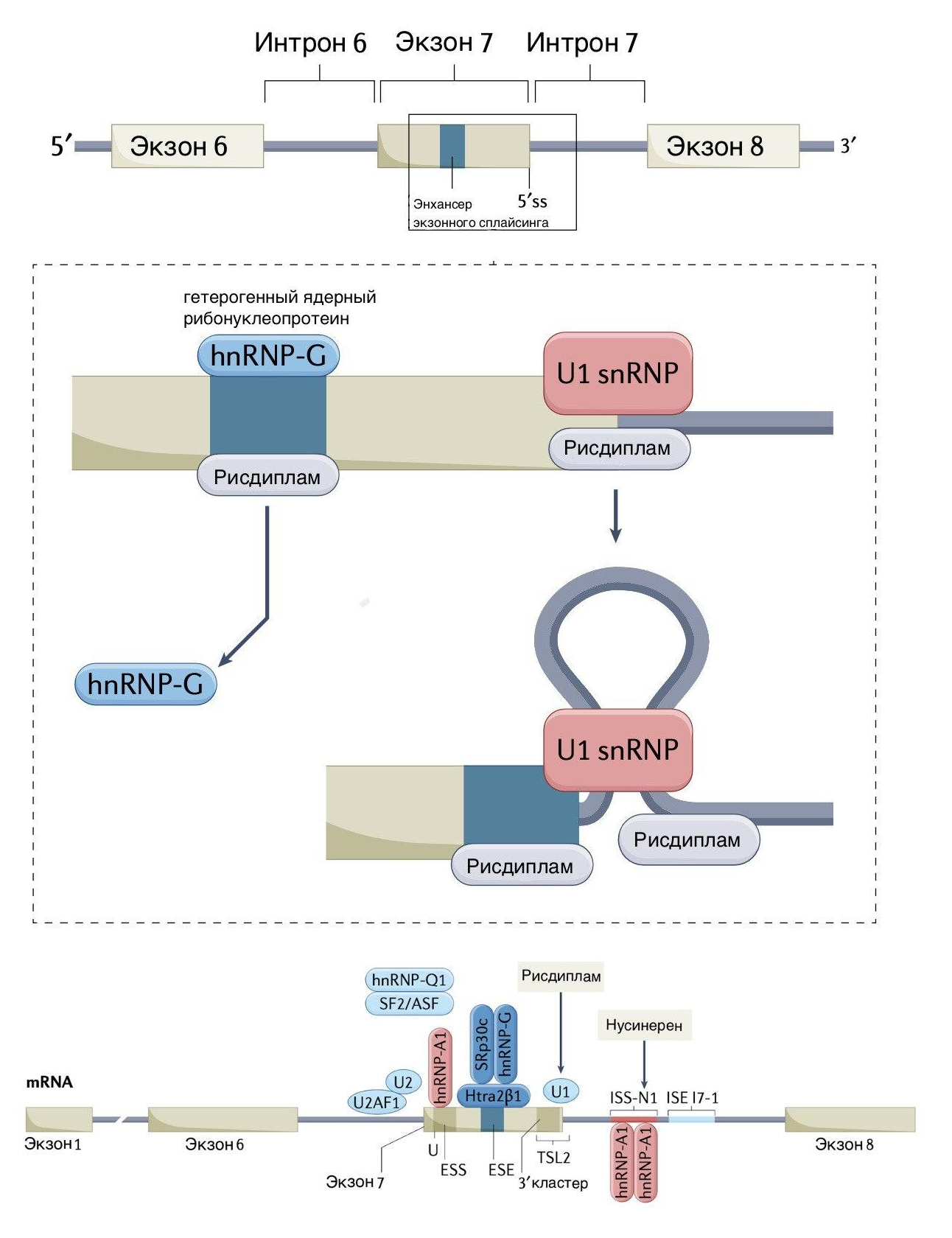
Рисунок 8. Принцип работы рисдиплама. Связывание лекарства с пре-мРНК гена SMN2 вызывает конформационные изменения в малых рибонуклеопротеинах, участвующих в сплайсинге. Это увеличивает частоту включения седьмого экзона в зрелую мРНК и приводит к более эффективному синтезу полноценного белка SMN. Заметим, что механизм действия рисдиплама отличается от того, как работает нусинерсен («Спинраза»). Если «Спинраза» стерически блокирует взаимодействие сайта ISS-N1 (экзонный сайленсер сплайсинга N1) и гетерогенных ядерных рибонуклеопротеинов А1 (hnRNP-A1), исключающих из зрелой мРНК седьмой экзон, то рисдиплам стимулирует прикрепление к пре-мРНК малых ядерных рибонуклеопротеинов U1, включающих этот экзон в матричную РНК.
В США, ЕС и с этого года — в России — лекарство одобрено для всех пациентов со СМА от рождения до совершеннолетия, а в других странах — в возрасте от двух месяцев и старше. В нашей стране «Эврисди» был зарегистрирован в 2020 году, меньше чем через 4 месяца после его одобрения FDA.
В исследованиях терапия рисдипламом улучшала двигательные навыки и моторные функции у детей со СМА 1 и 2 типа, а у взрослых пациентов со СМА 3 типа позволяла достигнуть стабилизации состояния (выборка взрослых пациентов была маленькой — всего 22 человека) [36], [37]. Сейчас также проводится изучение эффективности рисдиплама для детей в возрасте до 6 недель, у которых еще нет видимых признаков заболевания.
В таблице 2 мы собрали всю ключевую информацию по всем трем лекарствам, которые способны помочь пациентам со СМА.
| «Золгенсма» (Онасемноген абепарвовек) | «Спинраза» (Нусинерсен) | «Эврисди» (Рисдиплам) | |
|---|---|---|---|
| Тип лекарства | Реплицирующийся рекомбинантный аденоассоциированный вирусный вектор с человеческим трансгеном SMN1 | Антисмысловой олигонуклеотид | Производное пиридазина |
| Механизм работы лекарства | Вводит в клетки здоровый ген SMN1, который способен синтезировать белок SMN | Увеличивает количество полноценного белка SMN, синтезируемого геном SMN2 | |
| Способ и график введения | Внутривенно один раз | Интратекально, курсом из нескольких доз + поддерживающая доза каждые 4 месяца | Перорально каждый день |
| Количество людей, получивших лечение | Более 2 300 | Больше 15 000 | Более 8 500 |
| Кому подходит | Детям до 2 лет с 1–3 типами СМА | Всем, у кого диагностирована СМА | |
Поддерживающая терапия
Даже если пациент получил лечение, в большинстве случаев ему всё равно потребуется специальная поддержка и регулярные курсы реабилитации. Поддерживающая терапия при СМА — понятие комплексное. Сюда относится множество мероприятий, которые нацелены на улучшение жизни больных и борьбу с прогрессирующими симптомами. По сути, это постоянная работа, которая никогда не заканчивается, и для каждого пациента (лежачего, сидячего, ходячего) она будет своей.
Занимаются поддерживающей терапией не один, а несколько разных специалистов, а тактика помощи описана в специальных рекомендациях, которые последний раз обновлялись в 2018 году [39], [40]. Среди ключевых моментов оттуда можно выделить:
- Физиотерапию и ортопедическое лечение. Для больных со СМА большое значение имеет сохранение функции мышц, ослабленных болезнью, и предотвращение деформаций суставов и сколиоза. Лежачим пациентам показаны регулярные смены положения тела, массажи, плавание. Рекомендуется использование специальных матрасов, вертикализаторов, тренажеров, ортопедических и других приспособлений, которые будут помогать больному принять ту или иную позу (кресел, опор и так далее). Кроме того, во время реабилитации специалисты постоянно фиксируют изменения состояния пациента (утрату или приобретение двигательных навыков), чтобы вовремя корректировать терапию. Если необходимо, сколиоз исправляют путем операции.
- Респираторную помощь. Здесь также важен постоянный контроль функции дыхания, в том числе во сне. Лежачим больным нужно обеспечивать антигравитационную позу, когда слюна свободно вытекает изо рта под действием силы тяжести. Для всех пациентов со СМА рекомендована дыхательная гимнастика с помощью мешка Амбу. Если в дыхательных путях скапливается мокрота и сам человек ее откашлять не может, ее нужно удалять электроотсосом или откашливателем. В случае необходимости на помощь больным приходит неинвазивная вентиляция легких и системы, облегчающие кашель.
- Лечение бульбарной недостаточности. С больными СМА 1 и 2 типа, как правило, работают логопеды, диетологи и гастроэнтерологи. Со временем болезнь может вызывать проблемы с глотанием и речью, гастроэзофагеальный рефлюкс или запоры из-за сниженной перистальтики кишечника. Питаться при СМА рекомендуют дробно, каждые 3–4 часа небольшими порциями. Если больной ест в кровати, ее изголовье должно быть поднято хотя бы на 30°. Маленьких детей предпочтительно кормить в позе лежа на боку. При проблемах с глотанием пациентам может быть установлен назогастральный зонд или гастростома.
- Скорую медицинскую помощь. Лечащий врач должен иметь план ведения болезни на дому и организовывать предварительные встречи с местными службами неотложной помощи, оговаривая с ними вопрос безопасной транспортировки острого больного в стационар в случае необходимости. Особое внимание должно уделяться мониторингу самочувствия пациента, чтобы вовремя предотвратить или среагировать на возникновение острой дыхательной недостаточности, обезвоживания или других тяжелых состояний.
Кратко и понятно рекомендации для всех трех функциональных типов больных описаны на сайте «Семьи СМА».
Кто и как получает лечение против СМА в России
В нашей стране здравоохранение оплачивается государством, но на деле одобрение лекарств на территории России не означает, что они будут доступны для всех, кто в них нуждается, а главное — будут доступны в срок. Большинство детей со СМА в РФ могут рассчитывать на лекарственную помощь, но для этого их родителям или опекунам понадобится на сайте Госуслуг подать заявку на получение препарата через государственный фонд помощи детям «Круг добра». Только после получения всех необходимых направлений от врачей, одобрения этой заявки (в Фонд ее подает уже региональный орган управления здравоохранением) и индивидуальной закупки лекарства через аукцион маленький пациент получит жизненно необходимую для него инъекцию. От момента постановки диагноза до получения лечения пройти может несколько месяцев. Решать эту проблему уже пытаются. В том числе, в фонде думают над созданием запасов лекарств.
Для взрослых пациентов всё не так радужно. Финансирование их лечения — задача регионов, но больным часто приходится судиться, чтобы получить лекарства. Ситуация, вероятно, может измениться, если «Спинраза» и «Эврисди» против СМА у больных старше 18 лет будут внесены в перечень высокозатратных нозологий, тогда их будут приобретать за счет федеральных средств.
Не стоит также забывать, что лечение СМА — это не только «Золгенсма». Спинальная мышечная атрофия — болезнь хроническая, и качество жизни пациентов с этим диагнозом очень сильно зависит от доступа к современному оборудованию и расходным материалам, которые они будут использовать не однократно, а на ежедневной основе. Это и вертикализаторы, и ортезы, и инвалидные кресла, и оборудование, помогающее дышать, и зонды для питания, и многое другое. Если добавить сюда цену реабилитаций в стационаре, массажи, плавание, лечебную физкультуру, становится понятно, что болеть СМА — очень и очень дорого. Государственная страховка не покрывает всех этих расходов, и семьям больных неизбежно приходится обращаться за помощью к частным фондам, устраивать благотворительные денежные сборы или привлекать собственные средства для оплаты многочисленных видов лечения. К сожалению, и покупка лекарств ложится порой на плечи родителей и родственников. Например, если ребенком уже получено одно из лекарств, в другом могут отказать из-за отсутствия официальных рекомендаций по их комбинированному применению.
Куда обращаться, если в моей семье есть пациент со СМА
В России, как и в других странах, существуют благотворительные фонды, которые занимаются различными видами помощи семьям с детьми с неизлечимыми заболеваниями, а также клиники, помогающие сложным пациентам. Среди таких Фондов и помогающих организаций можно отметить:
- Фонд «Круг добра»,
- Фонд «Семьи СМА»,
- Фонд помощи хосписам «Вера»,
- Детский хоспис «Дом с маяком»,
- Марфо-Мариинский медицинский центр «Милосердие»,
- Научно-исследовательский клинический институт педиатрии имени академика Ю.Е. Вельтищева,
- ФГБОУ ВО РНИМУ им. Н.И. Пирогова,
- Клиника «Чайка».
Появятся ли новые лекарства? Чего ждать СМАйликам от завтрашнего дня
Ситуация со СМА полностью изменилась после выхода на рынок «Спинразы» и «Золгенсмы», которые вместе с «Эврисди» очень быстро стали для нее стандартами лечения. Врачам еще предстоит в полной мере оценить воздействие этих лекарств на людей, но уже очевидно, что без терапии последние имели бы совершенно другие показатели здоровья и продолжительность жизни. Уже сейчас количество пациентов с пролеченной СМА 1 типа заметно выросло, так как выросла их выживаемость.
В то же время, чем больше данных мы получаем, тем заметнее становятся пробелы в знаниях. Пока специалисты могут сказать очень мало о том, какой именно эффект можно получить для каждого конкретного пациента, прописывая ему разные лекарства (или те же лекарства, но в другой дозировке). Например, для врачей не ясно, имеет ли значение то, действует препарат только на центральную или еще и на периферическую нервную систему. Более того, непонятно, как сказывается на здоровье дефицит белка SMN во всех остальных клетках, то есть не в нейронах.
Известно, что мыши со СМА имеют патологии сердца, печени, поджелудочной железы, кишечника и сосудистой системы, что приводит к тканевой гипоксии [42], а восполнение концентрации SMN в периферических тканях способствует улучшению их выживаемости (примеров периферических нарушений в связи с дефицитом белка SMN у людей мало, но они есть [43], [44]). Уже это дает повод рассуждать о теоретическом повышении эффективности лечения путем использования нескольких препаратов с разным механизмом действия и с разным распределением в организме [45].
Таким образом, вопрос о том, имеет ли смысл комбинировать несколько лекарств, остается открытым. В настоящее время ведутся исследования комбинированной терапии, где пролеченные «Золгенсмой» пациенты получают «Спинразу», а также где помимо «Спинразы» или «Эврисди» больным назначают ингибиторы миостатина.
Разработка новых, альтернативных препаратов также не останавливается, хотя и не всегда заканчивается успешно. Например, после выхода на рынок «Спинразы» компания Novartis занималась исследованиями оральной формы модулятора сплайсинга гена SMN2 под названием Бранаплам, но в конечном счете работы в этом направлении были остановлены в 2021 году из-за широкого распространения других методов лечения, что затруднило проведение третьей фазы клинических исследований кандидата в лекарства. Не был также пока реализован выпуск Релдесемтива, активатора тропонина быстрых мышц от компании Cytokinetics [46].
Есть и более успешные кейсы. Так, компания Scholar Rock в настоящее время проводит третью фазу клинических испытаний своего препарата Апитегромаб (SRK-015), который предлагается использовать в комбинации со «Спинразой» и «Эврисди» для пациентов со СМА 2 и 3 типов. Лекарство призвано улучшать мышечный объем, силу, а также двигательную функцию. Это высокоизбирательный ингибитор надклеточной активации миостатина — белка, подавляющего рост мышц.
В России, в свою очередь, в ближайшие 8–9 лет может появиться аналог «Золгенсмы» с улучшенным профилем безопасности благодаря доработке вектора и встроенного в него гена SMN1. Компания «Биокад» уже получила разрешение на проведение клинических исследований нового лекарства ANB-4, в них смогут принять участие 12 маленьких пациентов в возрасте до 8 месяцев с диагностированной СМА 1 типа.
Иногда поисковые работы приводят к неожиданным результатам. Интригующе выглядят недавно опубликованные результаты исследования ученых из США, которые пытались узнать, как именно дефицит SMN вредит нейронам мышей, и открыли, что в деле замешан другой белок — Hspa8. Он необходим для передачи нервных сигналов к мышцам и чувствителен к недостатку белка SMN. Вся соль в том, что у Hspa8 есть вариант, который никак не реагирует на отсутствие SMN, и, если обеспечить его доставку в клетки, болезнь может быть побеждена. Первые результаты на животных моделях очень обнадеживающие — ученым удалось продлить жизнь мышам со СМА в 30 раз. Если идея сработает, мы получим новое лекарство с принципиально новым механизмом действия [47].
Частые вопросы о СМА
Можно ли полностью вылечить СМА?
К сожалению, нет. Несмотря на появление новых эффективных лекарств (таких, как «Золгенсма»), СМА остается неизлечимой. Приблизиться к полному выздоровлению можно, если генная терапия начата на очень раннем сроке, но в случае, когда симптомы болезни уже начали нарастать, даже частичного восстановления двигательных функций после проведения лечения приходится ждать очень долго, зачастую — годами. При этом пациентам постоянно нужно проходить курсы реабилитации, усердно работая ради повышения качества жизни.
И всё же сегодня СМА (в первую очередь — СМА 1 типа) перестала быть приговором и синонимом скорой смерти. Всё больше детей получают патогенетическое (т.е., направленное на механизмы развития болезни лечение) и достигают небывалых для их диагноза результатов: учатся самостоятельно есть, говорить, сидеть, управлять активной коляской. С заботой близких и помощью специалистов болезнь постепенно теряет свою силу, а дети со СМА получают шанс на счастливую жизнь.
Какие специалисты занимаются лечением и поддержкой пациентов со СМА?
Лечение СМА требует междисциплинарного подхода. Главным врачом для СМАйликов чаще всего становится невролог, но работать также предстоит и со множеством других врачей, включая генетиков (на этапе диагностики), пульмонолога или реаниматолога (они будут заниматься проблемами дыхания), ортопеда, нейрохирурга — в случае необходимости исправления сколиоза, нутрициолога или диетолога, гастроэнтеролога, кардиолога и специалиста по паллиативной помощи.
Можно ли родить здорового ребенка, если в семье уже есть малыш со СМА?
Ребенок может болеть классической СМА только в том случае, если оба его родителя — носители мутантного гена SMN1. При этом вероятность родить здорового малыша у такой пары при каждом новом зачатии всё еще составляет примерно 75% .
Если оба родителя имеют одну мутантную копию гена, их ребенок с 25% вероятностью получит обе «поломанные» копии и родится с диагнозом СМА. Однако около 2% всех случаев болезни не наследуются от родителей, а являются следствием мутаций, возникших спонтанно.
Гарантировать рождение здорового ребенка в паре, где уже есть дети со СМА, можно, обратившись к ЭКО с отбором здорового эмбриона (ЭКО + ПГД — преимплантационная генетическая диагностика).
Заключение
Спинальная мышечная атрофия по-прежнему остается тяжелым хроническим заболеванием, с которым людям приходится жить всю жизнь. И всё же пример СМА дает понять, что с генетическими заболеваниями можно бороться. Сегодня фармкомпании предлагают целых три лекарства против СМА с доказанной эффективностью, а в будущем, скорее всего, появятся и другие препараты, лишенные недостатков тех, что уже есть в нашем арсенале.
С другой стороны, уже имеющиеся лекарства мало разработать, важно сделать их доступными для всех пациентов, а в случае СМА против больных работает еще и время. Так как болезнь быстро прогрессирует, а погибшие нервные клетки нельзя восстановить, для достижения хороших результатов терапия должна быть получена как можно раньше, лучше всего — до появления видимых симптомов [48]. Поэтому борьба за жизни детей со СМА не может вестись только их семьями. Это ответственность всего общества.
Литература
- Livio Pellizzoni, Jeongsik Yong, Gideon Dreyfuss. (2002). Essential Role for the SMN Complex in the Specificity of snRNP Assembly. Science. 298, 1775-1779;
- Christoph Winkler, Christian Eggert, Dietmar Gradl, Gunter Meister, Marieke Giegerich, et. al.. (2005). Reduced U snRNP assembly causes motor axon degeneration in an animal model for spinal muscular atrophy. Genes Dev.. 19, 2320-2330;
- J. Strasswimmer. (1999). Identification of survival motor neuron as a transcriptional activator-binding protein. Human Molecular Genetics. 8, 1219-1226;
- Fabio Lauria, Paola Bernabò, Toma Tebaldi, Ewout Joan Nicolaas Groen, Elena Perenthaler, et. al.. (2020). SMN-primed ribosomes modulate the translation of transcripts related to spinal muscular atrophy. Nat Cell Biol. 22, 1239-1251;
- Nimrod Miller, Han Shi, Aaron S. Zelikovich, Yong-Chao Ma. (2016). Motor neuron mitochondrial dysfunction in spinal muscular atrophy. Hum. Mol. Genet.. 25, 3395-3406;
- Michela Ripolone, Dario Ronchi, Raffaella Violano, Dionis Vallejo, Gigliola Fagiolari, et. al.. (2015). Impaired Muscle Mitochondrial Biogenesis and Myogenesis in Spinal Muscular Atrophy. JAMA Neurol. 72, 666;
- Надежда для СМАйликов;
- (2022). Spinal muscular atrophy. Nat Rev Dis Primers. 8;
- Markus Feldkötter, Verena Schwarzer, Radu Wirth, Thomas F. Wienker, Brunhilde Wirth. (2002). Quantitative Analyses of SMN1 and SMN2 Based on Real-Time LightCycler PCR: Fast and Highly Reliable Carrier Testing and Prediction of Severity of Spinal Muscular Atrophy. The American Journal of Human Genetics. 70, 358-368;
- Maite Calucho, Sara Bernal, Laura Alías, Francesca March, Adoración Venceslá, et. al.. (2018). Correlation between SMA type and SMN2 copy number revisited: An analysis of 625 unrelated Spanish patients and a compilation of 2834 reported cases. Neuromuscular Disorders. 28, 208-215;
- Gabriela E. Oprea, Sandra Kröber, Michelle L. McWhorter, Wilfried Rossoll, Stefan Müller, et. al.. (2008). Plastin 3 Is a Protective Modifier of Autosomal Recessive Spinal Muscular Atrophy. Science. 320, 524-527;
- Markus Riessland, Anna Kaczmarek, Svenja Schneider, Kathryn J. Swoboda, Heiko Löhr, et. al.. (2017). Neurocalcin Delta Suppression Protects against Spinal Muscular Atrophy in Humans and across Species by Restoring Impaired Endocytosis. The American Journal of Human Genetics. 100, 297-315;
- Brunhilde Wirth. (2021). Spinal Muscular Atrophy: In the Challenge Lies a Solution. Trends in Neurosciences. 44, 306-322;
- Shuji Ogino, Debra G.B. Leonard, Hanna Rennert, Warren J. Ewens, Robert B. Wilson. (2002). Genetic risk assessment in carrier testing for spinal muscular atrophy. Am. J. Med. Genet.. 110, 301-307;
- Tamara Dangouloff, Eva Vrščaj, Laurent Servais, Damjan Osredkar, Thierry Adoukonou, et. al.. (2021). Newborn screening programs for spinal muscular atrophy worldwide: Where we stand and where to go. Neuromuscular Disorders. 31, 574-582;
- Редко, но метко: орфанные заболевания как вызов современной медицине;
- Руку, ногу и сердце: редкий АТТR-амилоидоз;
- Болезнь Фабри: частая среди редких;
- Тяжелая жизнь без дистрофина: мышечная дистрофия Дюшенна;
- Kathrin Kizina, Yakup Akkaya, Daniel Jokisch, Benjamin Stolte, Andreas Totzeck, et. al.. (2021). Cognitive Impairment in Adult Patients with 5q-Associated Spinal Muscular Atrophy. Brain Sciences. 11, 1184;
- Riccardo Masson, Chiara Brusa, Mariacristina Scoto, Giovanni Baranello. (2021). Brain, cognition, and language development in spinal muscular atrophy type 1: a scoping review. Develop Med Child Neuro. 63, 527-536;
- Одна болезнь, сто генов, миллионы людей: как вылечить болезнь Шарко—Мари—Тута;
- 12 методов в картинках: полимеразная цепная реакция;
- Цифровая ПЦР: измеряя истину;
- 12 методов в картинках: секвенирование нуклеиновых кислот;
- Бёмер Ф., Каберг Дж-Х., Дидиберг В. (2019). Скрининг новорожденных на СМА в Южной Бельгии. Нервно-мышечные расстройства;
- Anthony R. Gregg, Mahmoud Aarabi, Susan Klugman, Natalia T. Leach, Michael T. Bashford, et. al.. (2021). Screening for autosomal recessive and X-linked conditions during pregnancy and preconception: a practice resource of the American College of Medical Genetics and Genomics (ACMG). Genetics in Medicine. 23, 1793-1806;
- M.J. Pérez-García, L. Kong, C.J. Sumner, E.F. Tizzano. (2017). Developmental Aspects and Pathological Findings in Spinal Muscular Atrophy. Spinal Muscular Atrophy. 21-42;
- Самое дорогостоящее лекарство в мире;
- Генная терапия нейромоторных болезней;
- Время первых: как аденоассоциированные вирусы стали лучшими в доставке генов in vivo;
- Deepa Chand, Franziska Mohr, Hugh McMillan, Francis Fonyuy Tukov, Kyle Montgomery, et. al.. (2021). Hepatotoxicity following administration of onasemnogene abeparvovec (AVXS-101) for the treatment of spinal muscular atrophy. Journal of Hepatology. 74, 560-566;
- John W Day, Richard S Finkel, Claudia A Chiriboga, Anne M Connolly, Thomas O Crawford, et. al.. (2021). Onasemnogene abeparvovec gene therapy for symptomatic infantile-onset spinal muscular atrophy in patients with two copies of SMN2 (STR1VE): an open-label, single-arm, multicentre, phase 3 trial. The Lancet Neurology. 20, 284-293;
- Eugenio Mercuri, Francesco Muntoni, Giovanni Baranello, Riccardo Masson, Odile Boespflug-Tanguy, et. al.. (2021). Onasemnogene abeparvovec gene therapy for symptomatic infantile-onset spinal muscular atrophy type 1 (STR1VE-EU): an open-label, single-arm, multicentre, phase 3 trial. The Lancet Neurology. 20, 832-841;
- Eugenio Mercuri, Basil T. Darras, Claudia A. Chiriboga, John W. Day, Craig Campbell, et. al.. (2018). Nusinersen versus Sham Control in Later-Onset Spinal Muscular Atrophy. N Engl J Med. 378, 625-635;
- Basil T. Darras, Riccardo Masson, Maria Mazurkiewicz-Bełdzińska, Kristy Rose, Hui Xiong, et. al.. (2021). Risdiplam-Treated Infants with Type 1 Spinal Muscular Atrophy versus Historical Controls. N Engl J Med. 385, 427-435;
- Eugenio Mercuri, Nicolas Deconinck, Elena S Mazzone, Andres Nascimento, Maryam Oskoui, et. al.. (2022). Safety and efficacy of once-daily risdiplam in type 2 and non-ambulant type 3 spinal muscular atrophy (SUNFISH part 2): a phase 3, double-blind, randomised, placebo-controlled trial. The Lancet Neurology. 21, 42-52;
- David C. Schorling, Astrid Pechmann, Janbernd Kirschner. (2020). Advances in Treatment of Spinal Muscular Atrophy – New Phenotypes, New Challenges, New Implications for Care. JND. 7, 1-13;
- Richard S. Finkel, Eugenio Mercuri, Oscar H. Meyer, Anita K. Simonds, Mary K. Schroth, et. al.. (2018). Diagnosis and management of spinal muscular atrophy: Part 2: Pulmonary and acute care; medications, supplements and immunizations; other organ systems; and ethics. Neuromuscular Disorders. 28, 197-207;
- Eugenio Mercuri, Richard S. Finkel, Francesco Muntoni, Brunhilde Wirth, Jacqueline Montes, et. al.. (2018). Diagnosis and management of spinal muscular atrophy: Part 1: Recommendations for diagnosis, rehabilitation, orthopedic and nutritional care. Neuromuscular Disorders. 28, 103-115;
- Пациентский активизм и борьба с хроническими заболеваниями;
- Crystal Jing Jing Yeo, Basil T. Darras. (2020). Overturning the Paradigm of Spinal Muscular Atrophy as Just a Motor Neuron Disease. Pediatric Neurology. 109, 12-19;
- Cristofano G., Fucci M., Oliva M., De Rinaldis M., Trabacca A. (2022). Peripheral circulation disturbances in two consecutive children with spinal muscular atrophy and literature review. Acta Myol. 41, 84–88;
- Eilidh Somers, Robert D. Lees, Katie Hoban, James N. Sleigh, Haiyan Zhou, et. al.. (2016). Vascular Defects and Spinal Cord Hypoxia in Spinal Muscular Atrophy. Ann Neurol.. 79, 217-230;
- Kaitlyn M. Kray, Vicki L. McGovern, Deepti Chugh, W. David Arnold, Arthur H.M. Burghes. (2021). Dual SMN inducing therapies can rescue survival and motor unit function in symptomatic ∆7SMA mice. Neurobiology of Disease. 159, 105488;
- Stacy A. Rudnicki, Jinsy A. Andrews, Tina Duong, Bettina M. Cockroft, Fady I. Malik, et. al.. (2021). Reldesemtiv in Patients with Spinal Muscular Atrophy: a Phase 2 Hypothesis-Generating Study. Neurotherapeutics. 18, 1127-1136;
- Jeong-Ki Kim, Narendra N. Jha, Tomoyuki Awano, Charlotte Caine, Kishore Gollapalli, et. al.. (2023). A spinal muscular atrophy modifier implicates the SMN protein in SNARE complex assembly at neuromuscular synapses. Neuron. 111, 1423-1439.e4;
- Alessandra Govoni, Delia Gagliardi, Giacomo P. Comi, Stefania Corti. (2018). Time Is Motor Neuron: Therapeutic Window and Its Correlation with Pathogenetic Mechanisms in Spinal Muscular Atrophy. Mol Neurobiol. 55, 6307-6318.