Тканевая инженерия и что она может предложить сегодня
20 декабря 2024
Тканевая инженерия и что она может предложить сегодня
- 1447
- 1
- 9
Очередные муки выбора аутфита в недалеком будущем.
иллюстрация Александры Мартыновой.
-
Автор
-
Редакторы
-
Рецензент
-
Иллюстратор
Две с половиной тысячи лет назад люди вырезали искусственные зубы из бычьих костей, чтобы заполнить пробелы в своей ослепительной улыбке. С тех пор человечество немного шагнуло вперед и научилось пересобирать человека из собственных частей. Ну, хотя бы в теории. Так когда же настанет тот самый киберпанк с гардеробом из органов на каждый день? Поговорим об этом сегодня в продолжении спецпроекта «Регенеративная медицина».

Регенеративная медицина

Медицина без преувеличения преобразила жизнь всего человечества, позволив спасать от ран и лечить от болезней, в том числе — в недавнем прошлом неизлечимых. И хотя ее развитие не прекращается, в отдельную новую дисциплину выделяют медицину регенеративную, цель которой — восстанавливать повреждения тканей и органов, а также продлевать их бесперебойную работу, активируя внутренний регенеративный потенциал организма. Применение в реальной клинической практике стволовых клеток и компонентов их секретома; тканевая инженерия; активация обновления и регенерации клеток — уже реальность или пока отдаленная фантастика?
Партнер проекта — российская фармацевтическая компания «Биотехфарм», занимающаяся поставкой и продвижением лекарственных средств и изделий медицинского назначения в сфере гинекологии, урологии и репродуктивной медицины. Компания продвигает высокотехнологичные препараты, в том числе на основе цитокинов, секретомов, гиалуроновой кислоты и лактобактерий.
Главные препараты компании — «Суперлимф®», созданный на кафедре иммунологии РНИМУ им. Н.И. Пирогова, применяющийся для регенеративного лечения раневых поверхностей и инфекционных заболеваний урогенитального тракта; а также средства для интимной гигиены — «Эстрогиал™» и «Ацилакт ДУО».
Согласитесь, что сахарный диабет, костные патологии и ожоги третьей степени — крайне неприятные недуги. В случае этих заболеваний классические методы медицины упираются в предел своих возможностей и оказываются бесполезными, не позволяя добиться полного излечения. Поврежденные органы требуют замены, но не всегда есть возможность добыть донорский материал, поэтому приходится ограничиваться только паллиативной поддержкой пациента. Но что если немного пофантазировать о развитии медицинских технологий?
Новый гардероб
Выходом из этой ситуации могли бы стать искусственно создаваемые ткани, разработанные специально под клиническую картину, и наука активно работает в этом направлении. Ученые не отчаиваются и с энтузиазмом продвигают науку в светлое будущее, которое располагается где-то на стыке гистологии, эмбриологии, трансплантологии и биотехнологий. Под общим названием «тканевой инженерии» (ТИ) скрывается сложный процесс формирования из клеток тканевой структуры, которая позволит заместить несформированные и критически поврежденные части человеческого тела. В отличие от классических протезов, тканеинженерные конструкции замещают поврежденные участки с воссозданием исходной структуры органа, что приводит к восстановлению его функции. Поскольку такое вмешательство приводит к восстановлению тканей и органов, данную область относят к разделу регенеративной медицины [1]. Про прошлое, настоящее и грядущее метода расскажем в этой статье. Но для начала — прочитайте вводную публикацию: «Не можешь излечить — восстанови! Как появилась регенеративная медицина и какие у нее возможности сегодня» [2]!
Первые шаги
Клетки, каркасы и стимулирующие рост сигналы — эта триада стала основой тканевой инженерии. Однако свое начало она берет в другом когда-то авангардном направлении — биологии стволовых клеток (клеток, способных к самообновлению и дифференцировке). Давайте бросим взгляд на несколько десятилетий назад.
С 1960-х годов было показано, что некоторые популяции клеток способны давать клональные структуры — основу тканевой гетерогенности и формирования колоний клеток. Статья А. Дж. Беккера, Э. А. Маккалоха и Дж. Э. Тилла об исследованиях гемопоэтических клеток была опубликована в 1963 году в журнале Nature («Cytological Demonstration of the Clonal Nature of Spleen Colonies Derived from Transplanted Mouse Marrow Cells») и встретила большой интерес у научного сообщества [3]. Там описывались наблюдения за развитием колоний клеток, пересаженных от здоровой мыши на облученную селезенку другой особи (рис. 1). Колонии достигали значительного размера и давали потомков во все три линии миелоидной ветки гемопоэза: эритроцитарную, гранулоцитарную и мегакариоцитарную [3]. Этот эксперимент впервые продемонстрировал, что в организме животного могут прижиться клетки другой особи (или же свои, но из другого места), а этот факт открывает путь клиническому применению тканевой инженерии.
Над органами мышей вообще издеваются достаточно часто. Чего только стоит выращивание человеческой кишки в организме мыши для тестирования терапии пищеварительных заболеваний: «Желудок размером с горошину + человеческий кишечник, выращенный в мыши» [4]. — Ред.
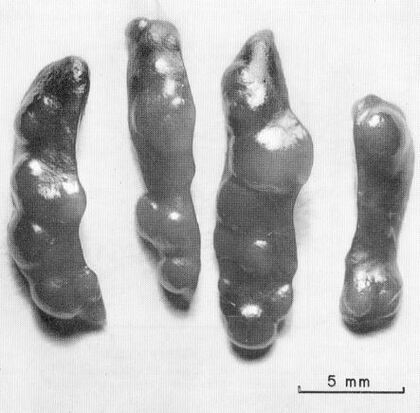
Рисунок 1. Как связаны селезенка мыши и тканевая инженерия? На фото — селезенки облученных мышей через 10 дней после трансплантации, отчетливо видны колониеобразующие единицы. Именно на селезенке впервые показано: клетки из одного места вполне могут прижиться в другом — то есть их можно пересаживать. А этот факт открывает перспективу для таких практических областей, как трансплантология и тканевая инженерия.
[5]
В 1978 году гемопоэтические стволовые клетки были обнаружены в пуповинной крови человека [6], а в 1981 были выделены плюрипотентные клетки мыши [7]. События развивались стремительно, и в 1998 году, наконец, были получены эмбриональные стволовые клетки человека (ЭСК) [8], что в конечном счете привело к вручению Нобелевской премии Джону Гердону и Синъе Яманаке «За открытие факта, что зрелые клетки могут быть „перепрограммированы“ обратно в плюрипотентное состояние»: «Нобелевская премия по физиологии и медицине (2012): индуцированные стволовые клетки» [9].
Тканевая инженерия как область до сих пор стремительно развивается, опираясь на знания о биологии стволовых клеток. Конечно, их способность превращаться в различные типы клеток открывает уникальные возможности для регенерации тканей. Сочетание клеток, искусственно созданных каркасов и стимулирующих сигналов позволяет ученым разрабатывать подходы к созданию функциональных тканей, которые могут быть использованы для трансплантации или восстановления органов.
Гены или воспитание?
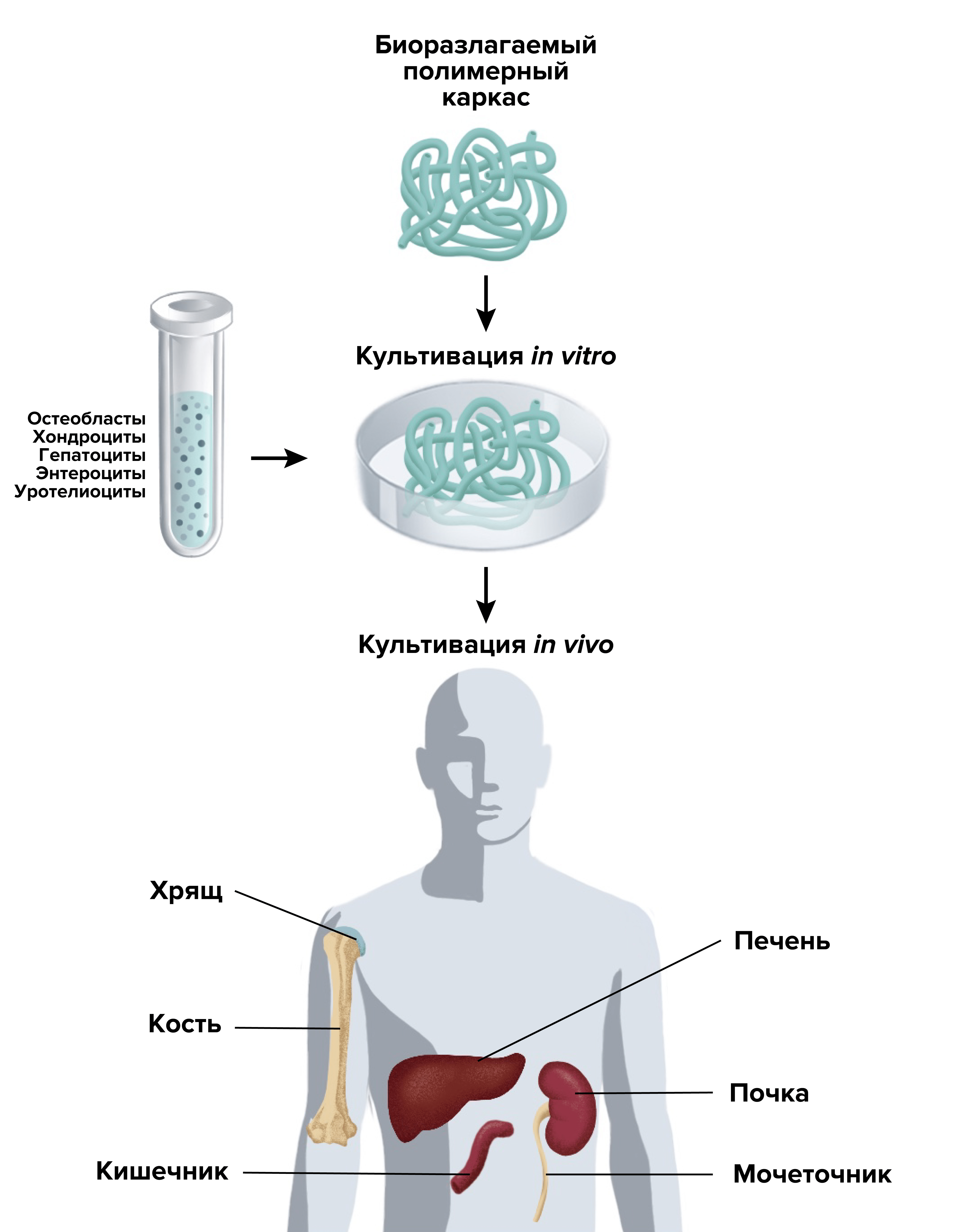
После открытия стволовых клеток ученые задались вопросом о природе плюрипотентности и вектора развития ткани. Казалось бы, при одинаковом геноме все клетки должны стройным маршем идти по единому пути развития. Однако ученые продолжали открывать все новые и новые типы клеток. Ответить на этот вопрос помогли исследования гистогенеза и клеточной ниши [10]. Важность субстрата и морфогенов в среде культивирования была продемонстрирована в трудах Джуды Фолкмана в 1970-х годах [11], он же впервые заговорил об использовании каркасов (скаффолдов), имитирующих естественный внеклеточный матрикс для наращивания клеточной массы. Каркасы служат для физического позиционирования клеток в пространстве, определяют направление роста и дифференцировки при имплантации, обеспечивают снабжение ткани кислородом и питательными веществами и по совместительству отвечают за биосовместимость трансплантированных клеток.
В последующие годы проводились классические тканеинженерные эксперименты как в лаборатории, так и в клинике. В 1991 году молодой пациент с синдромом Поландса (врожденным пороком развития грудной клетки и отсутствием грудины) стал первым человеком, получившим тканеинженерный имплант, состоящий из синтетического полимерного каркаса, заполненного аутологичными (то есть его собственными) хондроцитами [13]. Фундамент для клинического применения методов тканевой инженерии был заложен.
Правила удачной примерки
Главным трудом по теме тканевой инженерии можно назвать одноименную статью «Tissue engineering» 1993 года под авторством Роберта Лэнгера и Джозефа Ваканти, самую цитируемую в этой области на сегодняшний день [14]. Несмотря на небольшой объем, в этой фундаментальной работе были описаны основные принципы производства новой ткани и тонкости работы с клетками. Большое внимание уделяется и особенностям трансплантации, и работе с субстратом. Но что больше нас интересует, — это описание основных подходов к переносу культивированных тканей в организм пациента, которые используются по сей день и играют важную роль для регенеративной медицины. Рассмотрим их по порядку.
- Пересадка изолированных клеток позволяет избежать трудностей хирургического вмешательства с их дальнейшими осложнениями и заменяет только те клетки, которые обеспечивают необходимую функцию; а также манипулировать клетками перед трансплантацией. Главная проблема — риск развития иммунологического отторжения и низкая выживаемость клеток внутри тела реципиента.
- Индукция развития ткани. Это один метод тканевой инженерии, который направлен на стимуляцию регенерации или создания новых тканей с помощью различных биологических и физико-химических факторов. Успех этого подхода зависит от очистки и крупномасштабного производства соответствующих сигнальных молекул, таких как факторы роста (например, BMP — Bone Morphogenetic Protein или VEGF — Vascular Endothelial Growth Factor); и во многих случаях — от разработки методов доставки этих молекул к их мишеням [15].
- И конечно же, пересадка клеток в составе матриц [16]. В матрицах закрытого типа (рис. 2а) существуют ячейки для клеток, состоящие из изолированной мембраны, пропускающей питательные вещества и метаболиты, но предотвращающей разрушение трансплантата антителами и иммунными клетками. Эти системы могут быть имплантированы вовнутрь или использованы прямо на коже. В открытых матрицах клетки имплантируются и встраиваются в организм и свободно взаимодействуют с окружающими тканями (рис. 2б). Матрицы изготавливаются как из натуральных материалов, таких как коллаген; так и из синтетических полимеров. Иммунологическое отторжение может быть предотвращено с помощью иммуносупрессивных препаратов или заранее при использовании аутологичных клеток.
В двадцать первом веке вышеперечисленные идеи и методики получили бурное развитие. На сегодняшний день использование костных имплантов уже не попадет в заголовки газет, а рост десятков компаний, разрабатывающих заменители кожи, мало кого удивит. Область быстро растет, а ученые по всему миру ведут интенсивные разработки по многим фронтам. Ниже рассказываем про главный из них — медицину.
Haute couture — новейшие достижения тканевой инженерии
После успешной разработки скаффолдов и их первых имплантаций тканевая инженерия вышла на передовые позиции в области клинической медицины. Современные биоматериалы и усовершенствованные методы клеточной культивации с учетом микроокружения позволили создать новые решения для лечения сложных повреждений и заболеваний. Кожные заменители, трахейные импланты и искусственные сосуды — лишь часть того, что уже стало реальностью благодаря ТИ. Сегодня эти клинические применения представляют собой не просто экспериментальные разработки, а реальные технологии, меняющие подход к лечению пациентов и возвращающие людям утраченное качество жизни.
Новая кожа
С точки зрения тканевой инженерии пластические операции, лечение ожогов и трофических варикозов — крайне схожие вещи. Во всех этих случаях требуется наработка большого, а иногда и огромного объема кожного материала, с которым организм пациента не способен справится в одиночку. На помощь приходят дермоэпидермальные эквиваленты — биоинженерные продукты, разработанные для временной замены кожи и стимуляции ее регенерации при тяжелых повреждениях, при которых раны долго и медленно заживают. Заменители состоят из искусственно выращенных клеток и матриксов, которые поддерживают регенерацию и заживление, помогая восстановить функциональность и структуру кожи [17].
Наверное, самым популярным направлением применения кожных заменителей являются ожоги. Несмотря на распространенность и «рутинность» таких поражений, они представляют огромную угрозу для жизни пациента — ожоги более 40% тела по сути являются фатальными [18]. Сегодня лидером лечения глубоких и обширных (>30%) кожных ожогов выступает аутологичный препарат Epicel [19]. Это эпидермальный кожный заменитель, создаваемый из кератиноцитов пациента, добытых при биопсии и культивируемых в лабораторных условиях. Весь процесс создания листов клеток занимает несколько недель. Чаще всего Epicel применяется при тяжелых термических ожогах, когда у пациента просто недостаточно здоровой кожи для трансплантации. Как мы уже обсуждали, использование собственных клеток пациента — лучший вариант, так как минимизирует опасность отторжения и аллергических реакций. Epicel позволяет поддерживать влажную среду в зоне поражения и стимулирует процесс заживления, однако он не является долгосрочной заменой. Со временем покрытие частично рассасывается, а на его месте происходит регенерация собственного эпидермиса пациента. К сожалению, после такого лечения остаются напоминания о травме в виде шрамов, в ряде случаев даже развития плоскоклеточного рака [20, 21].
В случае серьезных повреждений, затрагивающих более глубокие (дермальные) слои кожи, прибегают к использованию другого дермального препарата — ацеллюлярного (бесклеточного) матрикса AlloDerm, созданного из донорской человеческой кожи. Из материала удаляют все клетки, что снижает риск отторжения, сохраняя при этом коллагеновую и эластиновую структуры [21]. Это стабильный матрикс, предоставляющий каркас для роста собственных клеток пациента. AlloDerm часто используется при реконструктивной хирургии, особенно при лечении ран при травмах, где требуется восстановление глубоких слоев кожи [22]. Также он используется при реконструкции молочной железы и лечении крупных раневых поверхностей. Материал легко интегрируется с тканями пациента, позволяя собственным клеткам мигрировать и заполнять матрикс для долгосрочного восстановления дермы.
Однако оба этих препарата не подходят для лечения хронических плохо заживающих ран, которые могут возникать в случае диабетических и венозных язв [23]. Но не стоит отчаиваться, ведь существуют комбинированные дермоэпидермальные эквиваленты, например, Apligraf [24]. Препарат создается из клеток пациента, выращенных на коллагеновом матриксе, и включает два слоя: дермальный, состоящий из фибробластов; и эпидермальный, состоящий из кератиноцитов, что делает его похожим на натуральную кожу. Живые клетки в составе Apligraf способствуют выработке факторов роста и других молекул, стимулирующих заживление, что делает его эффективным для лечения сложных ран. Продукт оказывает положительное воздействие на рану за счет активации регенерации, стимуляции образования новой ткани и улучшения микроциркуляции [25].
Несмотря на очевидные плюсы этих препаратов, все виды кожных заменителей являются временным решением. Они предназначены для запуска регенерации и заживления тканей (см. также врезку в конце раздела), а не для полного и постоянного замещения кожного покрова. Временный характер приживления обусловлен их структурой, механизмом действия и недостаточной биологической интеграцией с телом пациента. Идея применения кожных заменителей состоит в том, чтобы запустить восстановительные процессы в теле пациента, которые впоследствии самостоятельно заменят временное покрытие на естественную ткань. Они стимулируют рост кератиноцитов, фибробластов и других клеток пациента, которые заполняют и восстанавливают пораженные участки [26].
Когда речь идет о восстановлении поврежденных органов и тканей, многие случаи требуют более серьезного вмешательства — и здесь на помощь приходит трансплантология.
Обновляем гардероб
Мы уже обсудили заменители органов, а что насчет полноценной пересадки? Такими операциями заведует направление медицины под названием «трансплантология». На сегодняшний день она тоже активно использует достижения тканевой инженерии и биотехнологий для создания искусственных органов и тканей, что помогает минимизировать риск отторжения и улучшить качество жизни пациентов. Давайте поговорим о самых успешных коллаборациях ТИ и трансплантологии на сегодняшний день.
Биоинженерные кровеносные сосуды
Такие сосуды создаются путем культивирования клеток (обычно эндотелиальных и гладкомышечных) на биосовместимых матриксах (рис. 3). Их применение в медицине может стать спасением для пациентов с сердечно-сосудистыми заболеваниями, которым нужно создать новые сосуды для «ремонта» собственных или прокладки обходных шунтов [29].
Один из популярных способов создания таких сосудов — культивирование клеток на каркасе из коллагена, который со временем рассасывается, позволяя клеткам пациента формировать собственную сосудистую стенку. Исследуются также возможности 3D-печати сосудистых структур и использование донорских сосудов без клеток, которые могут быть заселены клетками пациента. Технология производства достаточно сложная — почитать про нее подробнее можно в статье «Кровеносные сосуды XXI века» [30]. Искусственные сосуды также необходимы при создании более сложных органов, таких как печень и почки, где требуется интеграция сложных сосудистых сетей [31].
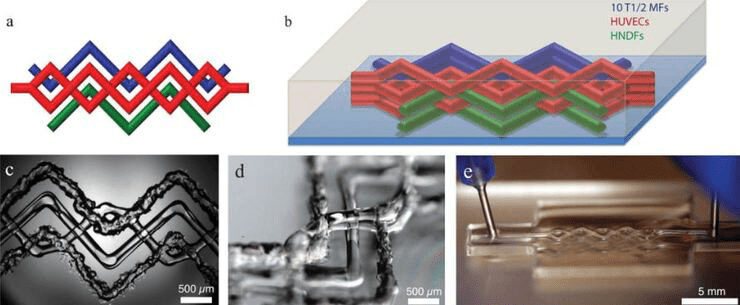
Рисунок 3. Создание искусственных сосудов. a,b) Схема тканевой конструкции с филаментами, напечатанными инкапсулированными фибробластами в желатин-метакрилоиле. c, d) Микроскопическое изображение напечатанного на 3D-принтере тканевого конструкта. e) Изображение, полученное во время удаления краски для создания каналов для клеток.
[34].
Биоинженерные трахеи
При повреждении трахеи, а это не такая уж редкая ситуация (приводят к этому травмы, инфекции и онкологические заболевания), возможна ее замена на биоинженерный аналог (рис. 4) — это позволяет сохранить жизненно важную дыхательную функцию. Один из методов создания искусственной трахеи включает использование поддерживающего рост клеток каркаса из синтетического материала, такого как полиэтилен, или биоматериалов. Каркас может быть децеллюляризован (очищен от клеток), после чего он заселяется клетками пациента — например, эпителиальными и хрящевыми. Они помогают формировать функциональный слой, способный противостоять дыхательному потоку и обеспечить гибкость трахеи [37].
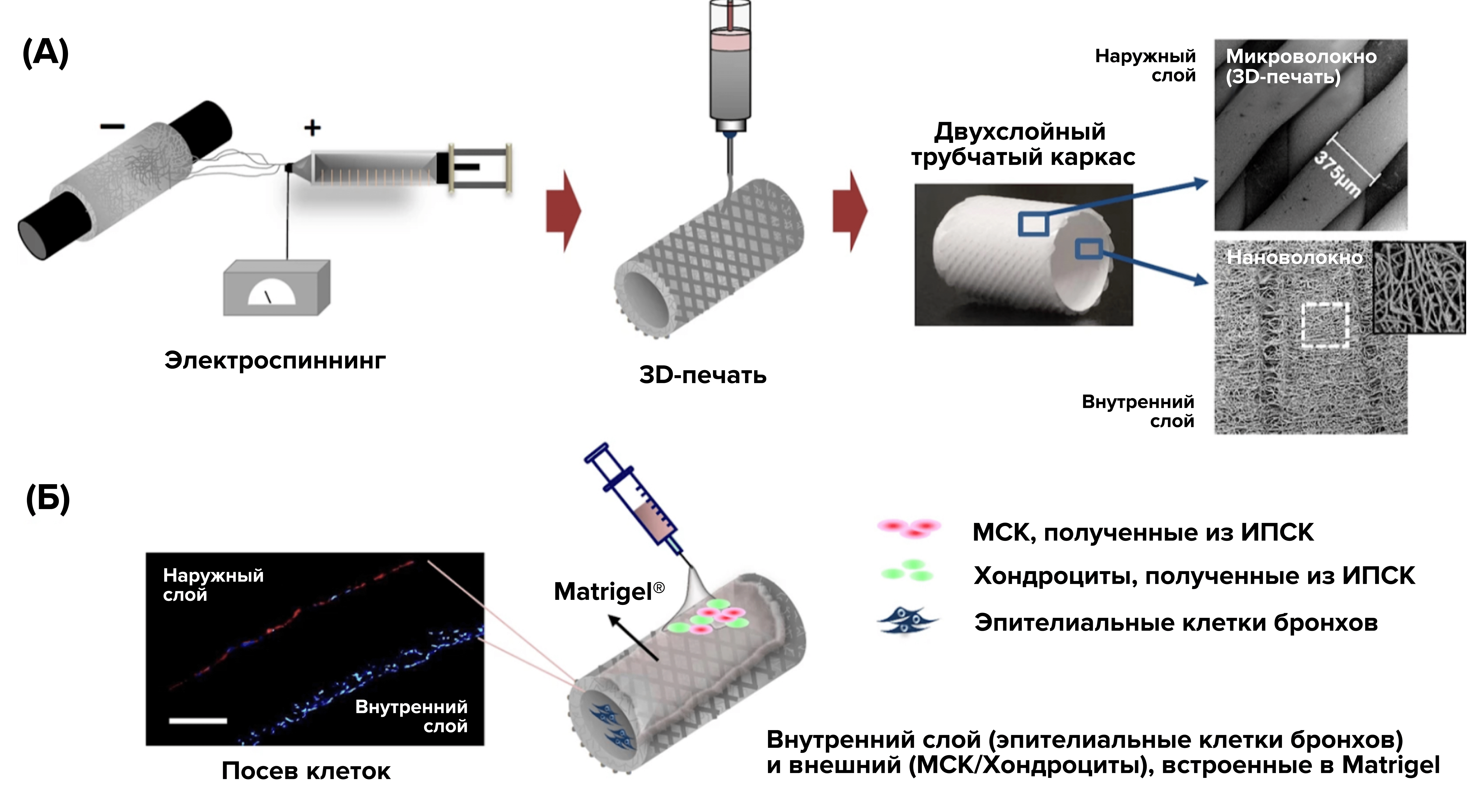
Рисунок 4. 3D каркасы трахей А) Изготовление объемных каркасов трахеи с использованием 3D-принтера и синтетических материалов. Б) Посев индуцированных плюрипотентных стволовых клеток (ИПСК), хондроцитов и бронхиальных эпителиоцитов.
[38].
Биоинженерные трахеи применяются для восстановления дыхательных путей у пациентов с врожденными дефектами, травмами или после резекции трахеи из-за рака. Такие трансплантаты снижают риск отторжения и позволяют избежать длительной зависимости от аппаратов искусственной вентиляции легких [39].
Первая полноценная биоинженерная трахея была «установлена» пациенту 13 января 2021 г. в больнице Маунт-Синай (США). На стол хирурга попала 56-летняя сотрудница социальной службы Соне Сайн: она страдала от тяжелой деформации трахеи в результате многочисленных интубаций, которые проводились из-за приступов астмы. В течение шести лет женщина дышала с помощью трахеостомы и ежедневно подвергалась риску удушья. Спустя три месяца после операции врачи не наблюдали никаких осложнений или признаков отторжения и сделали вывод об успешном окончании операции.
В целом, несмотря на начальную стадию развития метода, использование ТИ в рамках трансплантологии имеет ряд неоспоримых плюсов. Во-первых, использование собственных клеток пациента или клеток, прошедших специальную обработку, позволяет снизить риск иммунного ответа. Во-вторых, такие ткани могут интегрироваться с естественными тканями организма, минимизируя образование рубцов и поддерживая функцию органа. Благодаря тканевой инженерии можно восстанавливать утраченные структуры, включая мышцы, хрящи и даже нервную ткань [41].
Органоиды
Альтернативное применение тканеинженерных конструкций — в качестве доклинических моделей in vitro для скрининга лекарств и тестирования медицинских устройств (мы писали об этом в спецпроекте «Доклинические исследования»: «Лекарство в пробирке: доклинические исследования in vitro» [43]). ТИ модели обладают многочисленными потенциальными преимуществами, включая трехмерную геометрию, низкую стоимость конструирования, высокую воспроизводимость ткани и точный контроль условий выращивания, в том числе и человеческих клеток [44].
В самом классическом варианте для оценки безопасности, эффективности или механизмов действия новых лекарственных препаратов и медицинских технологий используются модели in vitro с контролируемыми условиями, такие как культуры клеток; или in vivo модели — животные. Несмотря на то, что оба варианта распространены повсеместно, ТИ предлагает более выигрышные варианты. Основное достижение тканевой инженерии в этом направлении — это органоиды: искусственные биологические структуры на базе одного или нескольких типов клеток, частично воспроизводящие структуру и функции своих аналогов in vivo [45].
По сравнению с более простым аналогом — клеточными культурами — органоиды могут воспроизводить более реалистичное микроокружение, включая межклеточные взаимодействия, дифференциацию клеток и даже реакцию на физиологические стимулы. Исследования на органах животных также могут уйти в прошлое, поскольку органоиды создаются из человеческих клеток, а потому лучше моделируют реакции, характерные для человека. Это помогает исследователям избежать проблем, связанных с экстраполяцией данных с животных на человека, и повышает точность предсказания эффективности и безопасности лекарств (рис. 5).
Рисунок 5. Тканеинженерная модель кожи, спроектированная для тестирования терапевтического лечения ран. Эта 3D-модель была создана на основе дермы кожи человека, заселенной кератиноцитами и фибробластами. Созданные методом биопсии, раны лечили биомиметическим гелем и коллагеновым гидрогелем и следили за скоростью восстановления. Подобные эксперименты проводят и при инфицировании ТИ моделей патогенными бактериями.
Диабет
Все мы знаем про сахарный диабет — заболевание, при котором β-клетки поджелудочной железы перестают вырабатывать инсулин в ответ на повышение уровня сахара в крови (так называемый диабет первого типа). А еще мы помним, что такое состояние организма может быть вызвано как разрушением клеток в результате аутоиммунной реакции организма (это первый тип: «Сахарный диабет I типа, или Охота на поджелудочную железу»), так и развитием инсулиновой резистентности (а это уже второй) [48, 49]. Но не все представляют, насколько заболевание распространено по миру. К 2030 году оно коснется 439 миллионов людей по всему миру и вынужденно свяжет их с медикаментозным лечением на всю оставшуюся жизнь [50].
В качестве альтернативы инсулинотерапии постоянно предлагаются методы лечения заболевания на основе клеточной имплантации для восстановления нормальной функции поджелудочной железы. Диабет 1 типа характеризуется потерей массы β-клеток и, следовательно, больше всего выиграет от клеточной заместительной терапии. Прорывным методом в этой области стал так называемый Эдмонтонский протокол. В 2000 году Шапиро с соавторами сообщили о своих наблюдениях за семью пациентами, которым в Университете Альберты (Эдмонтон, Канада) проводили иммуносупрессивную терапию с имплантацией островковых клеток из поджелудочных желез умерших доноров [51]. Этот протокол позволил устранить гипергликемию на первый год у всех семи пациентов, которым была проведена трансплантация островковых клеток. Однако через пять лет после трансплантации только 10% пациентов могли жить без препарата инсулина. Благодаря последним клиническим достижениям реакция пациентов значительно улучшилась: уже 50% остаются инсулиннезависимыми в течение целых пяти лет [52].
Недавно первое одобрение в США получила клеточная терапия диабета первого типа островковыми клетками умерших доноров. Компания CellTrans смогла стандартизировать этот процесс и показала, что ее клеточный продукт позволил 25 пациентам из 30 отказаться от инъекций инсулина, причем 10 из них обходятся без них уже более 5 лет.
Как видим, тканевая инженерия действительно дает надежду на более долгосрочные и эффективные методы лечения, позволяющие улучшить качество жизни огромного количества пациентов.
Проблемы дизайна
Тканевая инженерия и регенеративная медицина — прорывные направления, нацеленные на создание функциональных, пронизанных сосудами биоинженерных тканей и органов, способных полностью заменить утраченные структуры организма. Однако, несмотря на значительные достижения, существуют серьезные ограничения, которые ТИ должна преодолеть для достижения своей амбициозной цели — создания полноценных искусственных органов и тканей. Поговорим про основные проблемы, стоящие на пути к этому «Святому граалю» регенеративной медицины.
Контроль скорости размножения пересаженных клеток
Один из главных вызовов в ТИ — необходимость строгого контроля скорости деления клеток, помещенных на каркас или в трансплантат. Если клетки размножаются слишком медленно, они могут не успеть интегрироваться с тканями организма, что снижает шансы на успешное заживление или приживление органа. С другой стороны, слишком высокая скорость деления может привести к чрезмерному росту клеток, что увеличивает риск образования опухолей. Один из подходов к решению этой проблемы — использование факторов роста и других сигнальных молекул, которые регулируют пролиферацию клеток. Также ведутся исследования по генетической модификации клеток для управления скоростью их размножения [54].
Устойчивость и биосовместимость
Каркасы, на которые высаживают клетки, играют ключевую роль в создании искусственных тканей, так как они задают структуру для роста и интеграции клеток. Однако многие материалы, используемые для создания скаффолдов, либо слишком быстро разрушаются, либо не способны поддерживать нужную форму в течение длительного времени. Слишком быстрое разрушение может привести к деформации ткани, а недостаточно стабильные скаффолды могут повредить процесс интеграции и функцию трансплантата. Для решения этой проблемы разрабатываются новые биоматериалы, которые могут выдерживать механические нагрузки и медленно рассасываться по мере замены клетками организма. Комбинированные материалы с управляемыми разложением и гибкостью становятся перспективным направлением исследований [54].
Биоматериалы и клетки, используемые в трансплантате, должны быть биосовместимыми, чтобы не вызывать иммунные реакции и воспаление после имплантации. Несоответствие может привести к отторжению трансплантата или воспалению, что ставит под угрозу успешное приживление. Биосовместимые материалы способны интегрироваться с естественными тканями организма и не вызывать иммунного ответа. Использование децеллюляризованных (очищенных от клеток) тканей, покрытие материалов биоинертными веществами, а также использование стволовых клеток пациента снижают риск отторжения и повышают шанс на успех [56, 57].
В шаге от киберпанка
В этой статье мы убедились, что тканевая инженерия — это перспективная и, возможно, самая активно развивающаяся область регенеративной медицины, которая способна радикально изменить подходы к лечению заболеваний. Современные достижения в этой области уже помогают восстанавливать утраченные функции организма и дают пациентам шанс на полноценную жизнь.
Однако на пути к созданию полностью функциональных органов существует ряд серьезных проблем, таких как необходимость контроля скорости размножения клеток, создание устойчивых скаффолдов и обеспечение полной биосовместимости тканей. Решение этих задач требует скоординированных усилий в области биологии, медицины и биотехнологий.
Несмотря на эти трудности, тканевая инженерия продолжает совершать впечатляющие прорывы. Каждое новое открытие приближает нас к будущему, в котором восстановление повреждённых органов и тканей станет реальной и даже вполне рутинной процедурой (мечтаем: рис. 6).

Рисунок 6. «Придет время, когда наука опередит фантазию». — Жюль Верн.
иллюстрация Александры Мартыновой.
Литература
- Tissue Engineering and Regenerative Medicine;
- Не можешь излечить — восстанови! Как появилась регенеративная медицина и какие у нее возможности сегодня;
- Becker A.J., McCulloch E.A. and Till J.E. (1963). Cytological demonstration of the clonal nature of spleen colonies derived from transplanted mouse marrow cells. Nature. 197, 452-454;
- Желудок размером с горошину + человеческий кишечник, выращенный в мыши;
- Till J.E. and McCulloch E.A. (1961). A direct measurement of the radiation sensitivity of normal mouse bone marrow cells. Radiation Research. 14 (2), 213-222;
- Kaul H. and Ventikos Y. (2014). On the genealogy of tissue engineering and regenerative medicine. Tissue Eng. Part B Rev. 21 (2), 203–217;
- Evans M.J. and Kaufman M.H. (1981). Establishment in culture of pluripotential cells from mouse embryos. Nature. 292 (5819), 154-156;
- Thomson J.A. et al. (1998). Embryonic stem cell lines derived from human blastocysts. Science. 282 (5391), 1145-1147;
- Нобелевская премия по физиологии и медицине (2012): индуцированные стволовые клетки;
- Опухолевые разговоры, или Роль микроокружения в развитии рака;
- Folkman J. (1971). Tumor angiogenesis: therapeutic implications. N. Engl. J. Med. 285 (21), 1182-1186;
- Green Jr. W.T. (1977). Articular cartilage repair. behavior of rabbit chondrocytes during tissue culture and subsequent allografting. Clin. Orthop. Relat. Res. 124, 237-250;
- Vacanti C.A. (2006). The history of tissue engineering. J. Cell Mol. Med. 10 (3), 569-576;
- Langer R. and Vacanti J.P. Tissue engineering. Science. 260 (5110), 920-926;
- Регенерация на кончиках пальцев;
- Тканевая инженерия: мы живем в матрице;
- Vig K. et al. (2017). Advances in skin regeneration using tissue engineering. Int. J. Mol. Sci. 18 (4), 789;
- Jeschke M.G. et al. (2016). Morbidity and survival probability in burn patients in modern burn care. Crit. Care Med. 43 (4), 808-815;
- What is Epicel;
- Kenny E.M., Lagziel T., Hultman C.S. and Egro F.M. (2024). Skin substitutes and autograft techniques. Clinics in Plastic Surgery. 51 (2), 241-254;
- Epicel: Treatment and Care Guidelines;
- Агаджанова К.В. (2019). Современные методы лечения сложных ожогов. Медицина. Социология. Философия. Прикладные исследования. 6, 16-18;
- Chiu A., Sharma D. and Zhao F. (2022). Tissue engineering-based strategies for diabetic foot ulcer management. Adv. Wound Care (New Rochelle). 12 (3), 145-167;
- Apligraf: Living Cellular Skin Substitute;
- Junkins-Hopkins J.M. (2010). Biologic dressings. Dialogues in dermatology. 64 (1), E5-E7;
- Varkey M., Ding J. and Tredget E.E. (2015). Advances in skin substitutes—potential of tissue engineered skin for facilitating anti-fibrotic healing. J. Funct. Biomater. 6 (3), 547-563;
- От поцелуя до лимфомы один вирус;
- Суперлимф® при герпесе: как предотвратить обострения надолго? РМЖ;
- Zhu J., Wang Y., Zhong L., Pan F and Wang J. (2021). Advances in tissue engineering of vasculature through three-dimensional bioprinting. Dev. Dyn. 250 (12), 1717-1738;
- Кровеносные сосуды XXI века;
- Jouda H., Murillo L.L. and Wang T. (2022). Current progress in vascular engineering and its clinical applications. Cells. 11 (3), 493;
- Искусственные органы и тканевая инженерия;
- Органы из лаборатории;
- Kolesky D.B. et al. (2014). 3d bioprinting of vascularized, heterogeneous cell-laden tissue constructs. Advanced Materials. 26 (19), 3124-3130;
- Руководство по «выращиванию» зубов, или биоинжениринг в стоматологии;
- Инженерная биомеханика: материалы имплантатов в России сегодня;
- Triantafyllou M.S. (2017). Tuna fin hydraulics inspire aquatic robotics. Science. 357 (6348), 251-252;
- Martinod E. et al. (2018). Feasibility of bioengineered tracheal and bronchial reconstruction using stented aortic matrices. JAMA. 319 (21), 2212-2222;
- The BMJ (2023). Paolo macchiarini: disgraced surgeon is sentenced to 30 months in prison. The BMJ. 381, 1442;
- Doblado L.R., Martínez-Ramos C. and Pradas M.M. (2021). Biomaterials for neural tissue engineering. Front. Nanotechnol. 3, 643507;
- Kim I.G. et al. (2020). Transplantation of a 3d-printed tracheal graft combined with ips cell-derived mscs and chondrocytes. Sci. Rep. 10, 4326;
- Культивируемое мясо — продукт завтрашнего дня;
- Лекарство в пробирке: доклинические исследования in vitro;
- Gibbons M.C., Foley M.A. and Cardinal K. O'Halloran. (2012). Thinking inside the box: keeping tissue-engineered constructs in vitro for use as preclinical models. Tissue Eng. Part B Rev. 19 (1), 14-30;
- He J. et al. (2020). Organoid technology for tissue engineering. J. Mol. Cell Biol. 12 (8), 569-579;
- Shepherd J., Douglas I., Rimmer S., Swanson L. and MacNeil S. (2009). Development of three-dimensional tissue-engineered models of bacterial infected human skin wounds. Tissue Eng. Part C Methods. 15 (3), 475-484;
- Как искусственные модели головного мозга и омиксные технологии пригодятся в борьбе с аутизмом;
- Amer L.D., Mahoney M.J. and Bryant S.J. (2014). Tissue engineering approaches to cell-based type 1 diabetes therapy. Tissue Eng. Part B Rev. 20 (5), 455-467;
- Сахарный диабет I типа, или Охота на поджелудочную железу;
- Shaw J.E., Sicree R.A. and Zimmet P.Z. (2010). Global estimates of the prevalence of diabetes for 2010 and 2030. Diabetes Res. Clin. Pract. 87 (1), 4-14;
- Shapiro AM.J. et al. (2006). International trial of the edmonton protocol for islet transplantation. N. Engl. J. Med. 355 (13), 1318-1330;
- McCall M. and Shapiro AM.J. (2012). Update on islet transplantation. Cold Spring Harb Perspect. Med. 2 (7), a007823;
- Искусственные клетки в борьбе с сахарным диабетом;
- Новочадов В.В. (2013). Проблема управления клеточным заселением и ремоделированием тканеинженерных матриц для восстановления суставного хряща (обзор литературы). Природные системы и ресурсы. 1 (5), 19-28;
- Тумороиды — микроопухоли в пробирке;
- Мартюкова А.В. и Журкин К.И. (2018). Актуальные вопросы разработки матриц для стимуляции регенерации костных тканей. БМИК. 9, 434;
- Котлярова М.C. и др. (2017). Биорезорбируемые скаффолды на основе фиброина для регенерации костной ткани. Вестник Московского университета. Серия 16. Биология. 4, 222-228.