Точный удар: как редактирование мРНК победит неизлечимые болезни
17 декабря 2024
Точный удар: как редактирование мРНК победит неизлечимые болезни
- 652
- 2
- 5
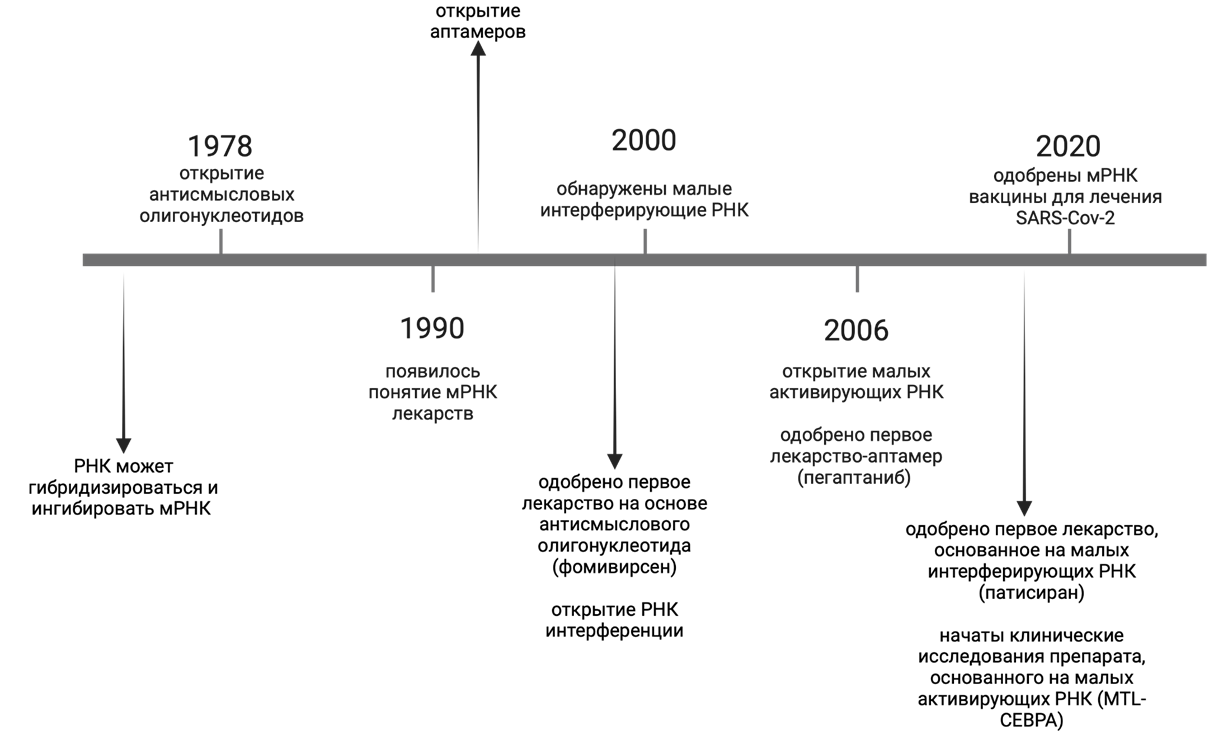
На сегодняшний день наиболее распространенные мРНК-препараты — антисмысловые олигонуклеотиды и лекарства на основе РНК-интерференции [1]. Однако в этом году стали доступны первые результаты клинических исследований молекул с принципиально новым механизмом действия — РНК-редактированием.
Рисунок в полном размере.
картинка сгенерирована с помощью нейросети и адаптирована автором
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Обычно в номинации «Академия и бизнес» обсуждают самые экономически успешные компании и стартапы, появляющиеся на слуху после своего ошеломительного успеха. Потом часто думаешь, как же повезло удачливым инвесторам, успевшим купить акции таких компаний в самом начале их пути, когда они были малоизвестными.
Однако в этой статье мы попытаемся рассказать читателям о компании, которая только-только сообщила о своих первых успехах. Wave Life Sciences — совсем небольшая фирма, торгующая акциями публично менее 10 лет, — в этом году заявила об успешно завершенной фазе ранних клинических испытаний, подтверждающих абсолютно новый механизм действия препарата для лечения редкого генетического заболевания. Стоит ли бежать закупаться акциями этой компании или лучше проявить осторожность — разбираемся в месте с «Биомолекулой».
Конкурс «Био/Мол/Текст»-2024/2025
Эта работа опубликована в номинации «Академия & Бизнес» конкурса «Био/Мол/Текст»-2024/2025.

Генеральный партнер конкурса и партнер номинации — международная инновационная биотехнологическая компания BIOCAD.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Подходы к лечению генетических заболеваний
Наверняка большинство читателей знакомы с понятием «центральная догма» молекулярной биологии, которое утверждает, что генетическая информация, зашифрованная в ДНК в виде генов, передается к более подвижному носителю — РНК, откуда считывается и реализуется в виде белков или некодирующих РНК. Именно белки и некодирующие РНК выполняют все функции в организме. Если в генах есть мутация, то она передастся и в РНК в процессе транскрипции; некоторые из мутаций приводят к нарушению функции белка, в результате чего развивается заболевание.
Как же можно помочь пациенту с генетической мутацией? Самое простое технологически — восполнить отсутствующий белок. Хорошим примером такой терапии является гемофилия — нарушение свертывания крови в результате генетической мутации факторов свертывания (рис. 1). Раньше существовала только заместительная терапия, то есть с помощью внутривенной инфузии отсутствующего фактора свертывания. Ученые также создавали факторы свертывания с более длинным периодом полувыведения, что увеличило периоды между инфузиями.
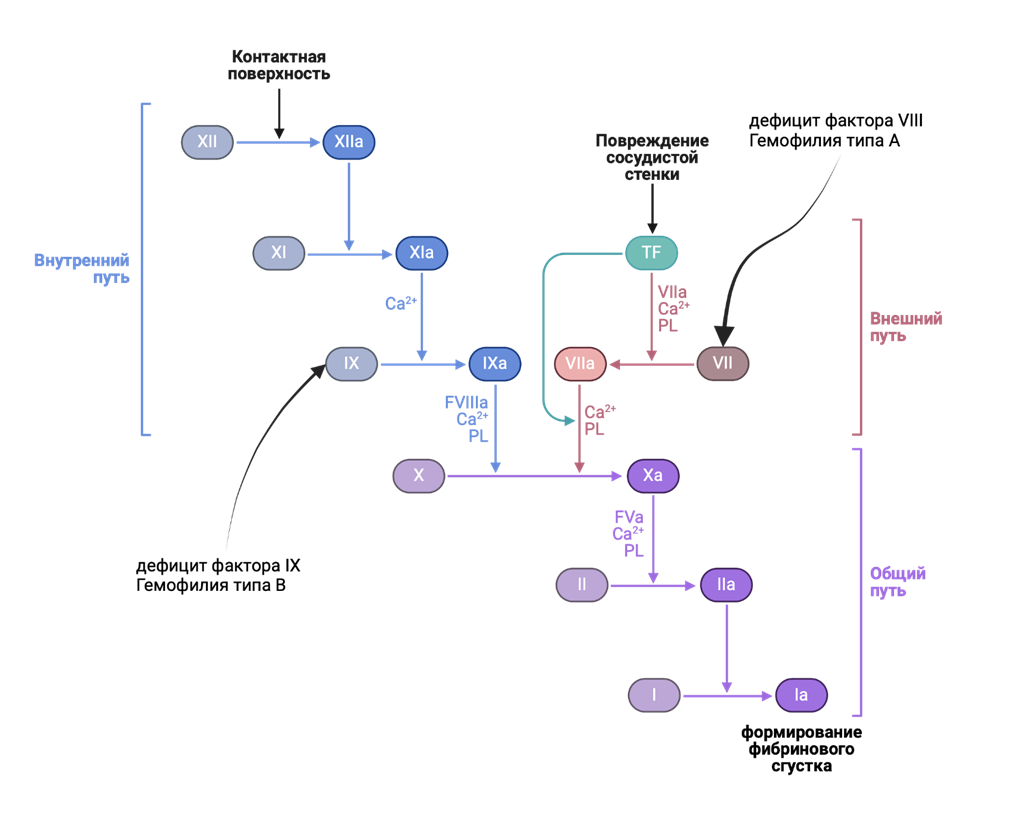
Рисунок 1. Каскад свертывания крови (коагуляции) похож на падение фишек домино: один фактор переходит в активную форму и запускает «конвертирование» другого. В результате этого каскада образуется сгусток, состоящий из белка фибрина. Фибрин полимеризуется и превращается в «паутинку», где «запутываются» эритроциты и другие клетки. (За подробностями этого процесса рекомендуем обратиться к статье «Как работает свертывание крови?» [2].) В случае гемофилии этот каскад нарушается. Два наиболее известных генетических типа гемофилии — недостаток факторов VIII (гемофилия типа А) и IX (гемофилия типа В).
[3], адаптировано с помощью Biorender
Дальше на помощь пришла генная терапия . В 2023 году был достигнут важный прорыв в области генетического редактирования соматических клеток с использованием технологии CRISPR/Cas9. FDA одобрило первую клеточную терапию, основанную на геномном редактировании, для лечения серповидноклеточной анемии. В рамках этой терапии гемопоэтические стволовые клетки пациента подвергаются редактированию, а затем возвращаются в организм, чтобы восстановить их нормальную функцию. Однако редактирование половых клеток остается предметом острых юридических и этических дискуссий. В большинстве стран мира вмешательства в геном человека на таком уровне строго запрещены, и подходы к регулированию этой области еще не сформированы окончательно. К генной терапии относится также доставка генов с помощью вирусов. Так, для лечения гемофилии В был разработан вектор с устойчивым уровнем экспрессии даже сейчас, спустя десятки лет после первого введения этого вектора пациентам. Но в случае гемофилии А возникли проблемы, ведь ген фактора VIII больше и сложнее. Потребовалось больше времени на разработку вектора, компания BioMarin все еще проводит III фазу клинических испытаний. Несмотря на все сложности, конечно, оба подхода помогают пациентам с разными генетическими заболеваниями по всему миру. Ведь всего лишь 100 лет назад пациенты с гемофилией не могли получить вообще никакого лечения.
По генной и клеточной терапиям на «Биомолекуле» есть большой и интересный спецпроект, ознакомление с которым рекомендуем начать со статьи «Генная терапия: познакомьтесь с лекарствами будущего» [4]. Про гемофилию там тоже недавно и подробно было: «Как болезни крови генной терапией лечили» [5]. — Ред.
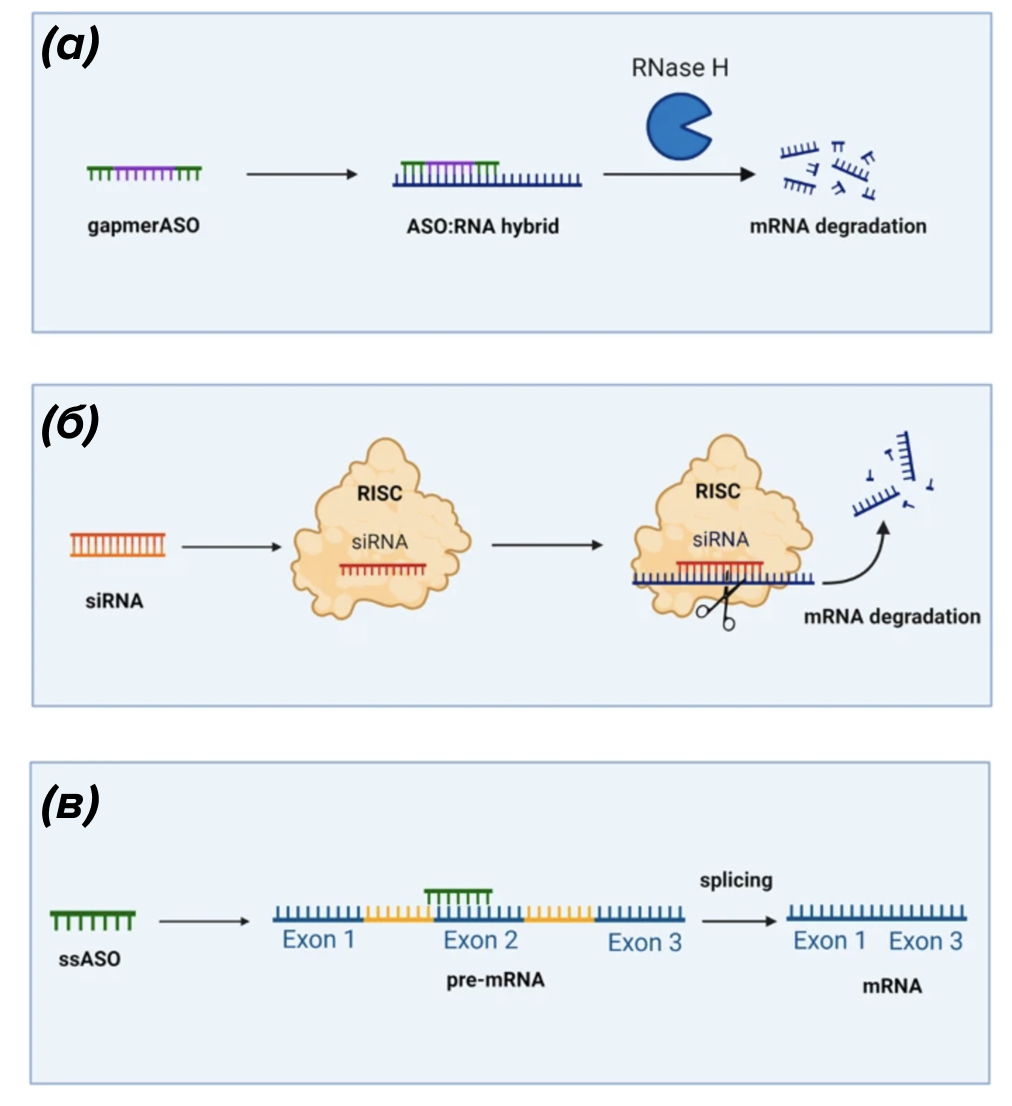
Воздействие на промежуточное звено — мРНК — возможно разными способами. Хронологию открытий разных технологий в мире РНК можно проследить на рис. 2А. Один из способов — использование антисенсовых (антисмысловых) олигонуклеотидов, которые способны подавлять активность конкретной мРНК через разные механизмы: стимулировать или предотвращать деградацию мРНК, исправлять ошибки сплайсинга (рис. 2Б). Разрабатываются также и интерферирующие РНК, например, в качестве терапии раковых клеток, которые выставляют на поверхность определенную молекулу, позволяющую им метастазировать [6]. А с помощью РНК-интерференции можно подавить экспрессию этого рецептора, в результате чего снижается способность раковых клеток расти и метастазировать. На рынке уже есть препараты обоих механизмов. Преимущество РНК-технологий в том, что можно химически создать очень специфичную к желаемой мишени РНК (антисенсовую, интерферирующую или другую РНК).
Механизмов воздействия на мРНК очень много, некоторые из них более успешны и уже вышли на рынок. Например, антисмысловой олигонуклеотид, исправляющий ошибки сплайсинга, — нусинерсен (Спинраза) — применяется для лечения генетического заболевания: спинальной мышечной атрофии . Конечно, этот препарат тоже необходимо вводить пожизненно, но без него у пациентов просто не было шансов. Сразу несколько препаратов с таким же механизмом действия были одобрены FDA для лечения миодистрофии Дюшенна . Причем каждый подходит для какого-то определенного нарушения сплайсинга. Также зарегистрированы препараты на основе малых интерферирующих РНК. Так, препарат инклисиран блокирует мРНК определенного гена — PCSK9, который участвует в деградации рецепторов ЛПНП, регулируя их количество в гепатоцитах. В результате уровень циркулирующего в крови холестерина снижается у пациентов с разными типами генетической гиперхолестеринемии. О еще одном примере РНК-интерферирующего олигонуклеотида, одобренного для лечения порфирии, которую ранее лечить было невозможно, можно почитать в другой статье «Биомолекулы» [13].
Оба этих заболевания очень детально рассмотрены в спецпроекте «Орфанные заболевания» «Биомолекулы»: «СМА: три буквы — три лекарства» [14] и «Тяжелая жизнь без дистрофина: мышечная дистрофия Дюшенна» [15]. Но помимо статей, мы также выпустили соответствующих два мультфильма, посмотреть которые также рекомендуем читателям. — Ред.
Однако в этой статье мы хотим поговорить о совершенно новом подходе лечения генетических заболеваний с помощью исправления ошибок в мРНК.
Редактирование РНК
Модификация РНК — это очень обширная тема, включающая в себя разные механизмы. Мы затронем только химическое редактирование РНК, а именно дезаминирование оснований, которого существует два типа:
- C/U или C-to-U (дезаминирование цитозина в урацил) осуществляется специальным ферментом. Классический пример такого механизма: дезаминирование аполипопротеина В в кишечнике человека приводит к образованию стоп-кодона, вследствие чего синтезируется «короткая» изоформа белка.
- A/I или A-to-I (дезаминирование аденозина в инозин) составляет около 90% всех редактирований РНК и осуществляется ферментами ADAR (adenosine deaminase acting on RNA — аденозиндезаминазы, воздействующие на РНК), чувствительной к двухцепочечным РНК (рис. 3). Такое редактирование тоже может быть тканеспецифичным; и сейчас, благодаря развивающимся технологиям секвенирования, активно собирают информацию о сайтах A-to-I редактирования [16], [17].
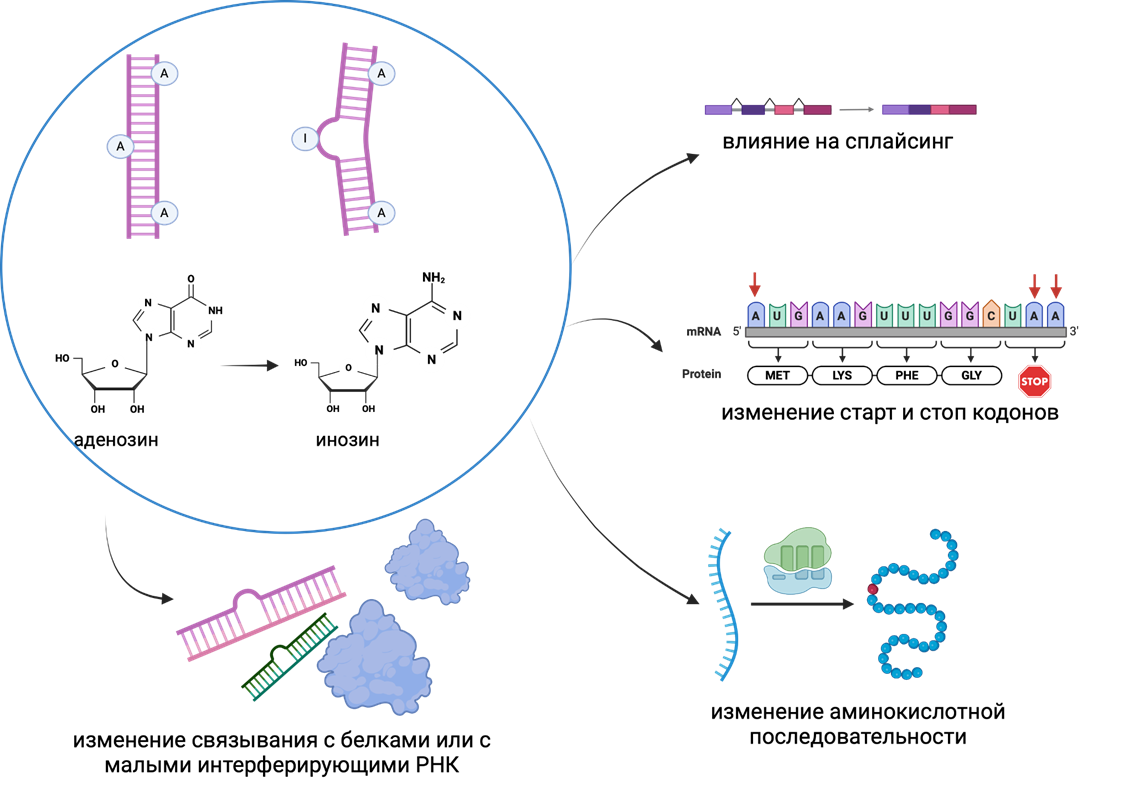
Рисунок 3. Влияние A-to-I редактирования РНК на изменение функции молекул мРНК и белка. Так как рибосома воспринимает инозин как гуанин, A-to-I редактирование может приводить к изменению аминокислотной последовательности, в частности, могут меняться старт- и стоп-кодоны и их локализация. Некоторые олигонуклеотиды конструируют таким образом, чтобы они исправляли ошибки сплайсинга мРНК. А после редактирования мРНК меняется ее связывание с белками и малыми интерферирующими РНК.
[18], адаптировано с помощью Biorender
Оба эти механизма потенциально интересны для исследований в качестве терапии, так как могут позволить исправить мутацию на уровне мРНК, не затрагивая геном человека. Осенью 2024 года компания Wave Life Sciences объявила о первом успешном клиническом испытании терапии, основанной на редактировании РНК, для лечения дефицита альфа-1 антитрипсина (А1АТ). Прошла только самая ранняя фаза клинических испытаний, подтверждающая механизм действия олигонуклеотида, который пока что называется WVE-006.
Что же показали Wave Life Sciences в своих клинических исследованиях
Wave Life Sciences — небольшая биотехнологическая компания, основанная в 2012 году. Всего за 12 лет существования компания уже создала собственную платформу для дизайна олигонуклеотидов для восстановления или, наоборот, снижения уровня РНК c учетом подбора специфичности к мишени. Также компания фокусируется на химических модификациях олигонуклеотидов для улучшения их доставки и биодоступности в организме. Например, WVE-006 представлен в виде N-ацетилгалактозамин-конъюгата. N-ацетилгалактозамин — это молекула сахара, которая связывается с определенным рецептором в печени. Если к этому сахару пришить олигонуклеотид, то он также будет доставлен в печень. Олигонуклеотид, в свою очередь, связывается с аденозидезаминазой ADAR, которая осуществляет редактирование мРНК. Для улучшения эффективности процесса предлагают использовать N-3-уридин (рис. 4). Как упоминалось выше, в случае Z-аллеля A1AT происходит точечная замена глутамата на лизин. Глутамат кодируется триплетом ГАГ, а лизин — ААГ. То есть происходит замена гуанина на аденин, который потом дезаминируется в инозин с помощью ADAR. Инозин во время трансляции воспринимается рибосомой как гуанозин [20].
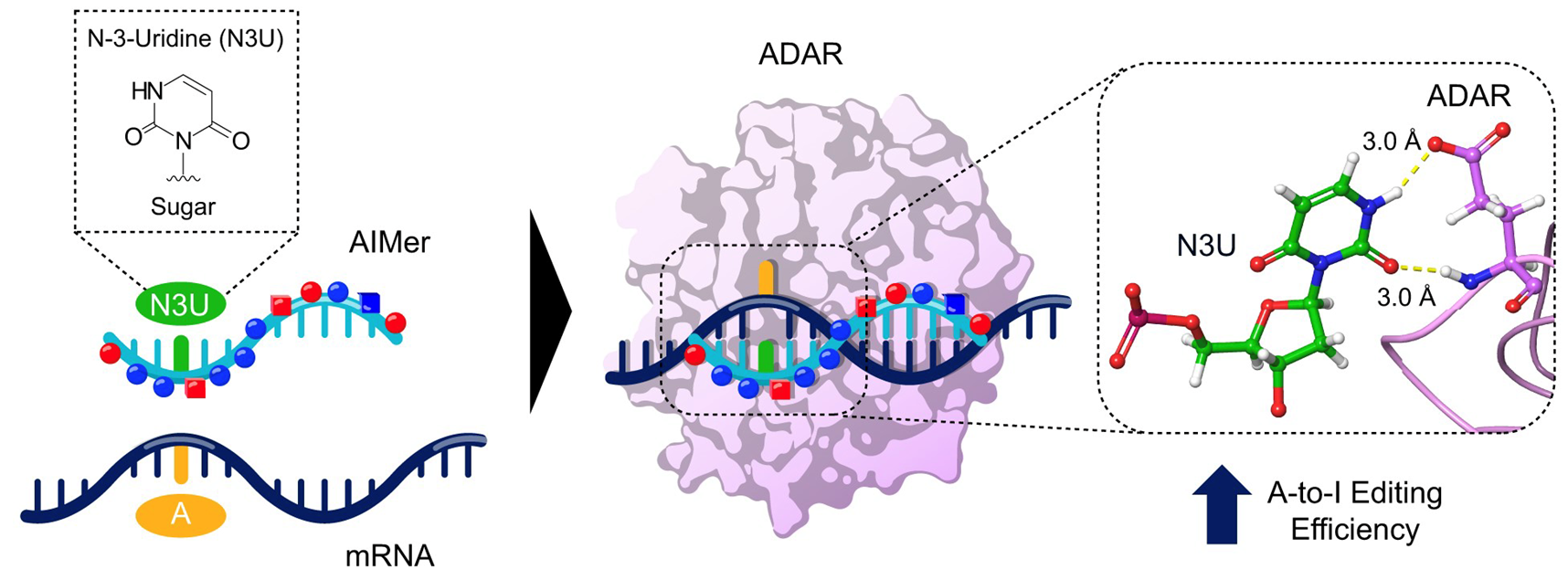
Рисунок 4. Эффективность редактирования мРНК можно улучшить за счет химических модификаций олигонуклеотида. Олигонуклеотид, специфичный к определенному участку мРНК, образует с ней двухцепочечный РНК-комплекс. N-3-уридин, находящийся напротив участка, который необходимо отредактировать, стабилизирует этот комплекс и «разворачивает» основание к активному центру ADAR. После чего происходит дезаминирование аденина с образованием инозина.
В 2022 году компания GSK объявила о коллаборации с Wave Life Sciences. GSK получит лицензию на использование платформы для подбора олигонуклеотидов, а также лицензию на WVE-006 для лечения дефицита A1AT; и разработает до восьми доклинических программ. Wave Life Sciences получили право продвинуть три проекта с использованием данных GSK, которые специализируются на генетике и геномике. Wave Life Sciences получили $170 млн авансом и право на выплаты за успехи и роялти. Коллаборация была заключена на четыре года, но, вероятно, компании ее продлят после успешных результатов, полученных в этом году. Ответственность за разработку и коммерциализацию перейдет к GSK после того, как Wave Life Sciences завершит свое клиническое исследование. В общей сложности, Wave Life Sciences имеет право на получение до $525 млн поэтапно, а также многоуровневых роялти от чистых продаж WVE-006 в будущем.
В октябре этого года компания представила отчет о результатах исследования олигонуклеотида WVE-006, который вводится подкожно. WVE-006 успешно редактирует мРНК, восстанавливая уровень нормального белка M-A1AT, что снижает риск заболеваний легких и печени. После одной дозы (200 мг) у первых двух пациентов с генотипом ZZ уровень M-A1AT составил более 60% от общего A1AT. Повышение функциональной активности белка наблюдалось уже через три дня и сохранялось до 57 дней. Препарат показал хорошую переносимость без серьезных побочных эффектов. Исследование еще продолжается, и Wave Life Sciences ожидает представить данные о многократном использовании препарата в 2025 году.
Кроме дефицита A1AT, компания также разрабатывает олигонуклеотиды для лечения ожирения. Причем в этом случае задача олигонуклеотида — подавить функцию мРНК гена INHBE. Для этого олигонуклеотида завершается стадия доклинических испытаний, а клинические испытания планируют начать в 2025 году. Кажется, что Wave Life Sciences делает большую ставку именно на механизм редактирования мРНК, так как в ее планах запустить клинические исследования олигонуклеотидов, мишенями которых являются ген PNPLA3, гомозиготные мутации в котором приводят к серьезным нарушениям печени; а также гены LDLR и APOB, участвующие в развитии сердечно-сосудистых заболеваний, к 2026 году.
Также компания проводит исследования олигонуклеотидов с разнообразными механизмами действия, включая РНК-интерференцию, воздействие на сплайсинг, а также создание антисенсовых нуклеотидов для лечения нейродегенеративных заболеваний, в частности болезни Хантингтона [22] и миодистрофии Дюшенна [15].
Как отреагировал рынок на отчет компании
За время своего существования, как и любая компания, Wave Life Sciences пережила несколько взлетов и падений. Сначала компания привлекала инвесторов, и акции с переменным успехом росли до конца 2019 года, когда стало понятно, что олигонуклеотид, который разрабатывался для лечения болезни Хантингтона, не «выстрелит» — улучшения были небольшими, и уровень мутантного белка хантингтина снизился всего на 12%. Тут нужно еще добавить, что в это же время свои исследования с использованием антисенсовых олигонуклеотидов проводили компании Roche и Ionis, которые установили планку для снижения патологического хантингтина в 42%. Маленькая Wave Life Sciences просто не смогла с ними конкурировать. Чуть ранее в том же году компания приостановила исследования препарата для лечения миодистрофии Дюшенна — тоже из-за отсутствия значительных результатов. Акции компании упали на 76% в этот непростой для них год. Акции компании держались на этом уровне до последнего времени. Уже в следующем году компания сменит фокус своего внимания именно на технологию редактирования мРНК. Но стабильно расти их акции начали только в этом году — после того, как были опубликованы результаты клинических испытаний (рис. 5). Причем на данный момент рост составляет более 200%. Трейдеры оценивают, что в долгосрочной перспективе акции компании вырастут еще минимум в 2–3 раза.
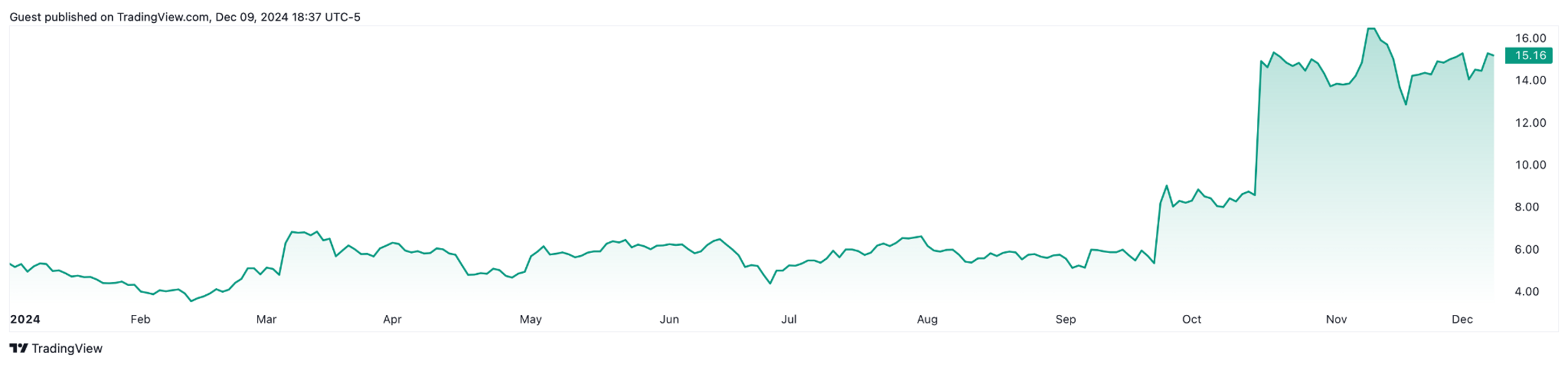
Рисунок 5. График стоимости акций WVE (USD). Стремительный рост начался сразу после публикации отчета 16 октября 2024 года.
Wave Life Sciences заявила, что наличные средства и их эквиваленты составили $310,9 млн по сравнению с $200,4 млн на 31 декабря 2023 года; и что этих денег хватит для финансирования исследований, без учета выплат от GSK, до 2027 года. Выручка за третий квартал 2024 года составила $7,7 млн против $49,2 млн за аналогичный период 2023 года — в прошлом году компания получила разовую выплату после завершения коллаборации с Takeda. На данный момент у компании нет устойчивого дохода от своих инвестиций, однако это может измениться после завершения клинических испытаний. Расходы на исследования и разработки выросли с $31,6 млн до $41,2 млн, а чистый убыток за третий квартал 2024 года составил $61,8 млн против чистой прибыли $7,3 млн годом ранее. Это тоже вполне оправданно, ведь Wave Life Sciences вкладывает много денег в исследования новых продуктов и клинические исследования, а убыток обусловлен тем, что их продукты еще не выведены на рынок. Соглашение с GSK, включающее авансовые выплаты и потенциальные роялти, является сильным стратегическим преимуществом. Если программы будут успешными, это может обеспечить долгосрочный доход.
К сожалению, очень часто случается, что результаты доклинической фазы выглядят обнадеживающе, но желаемый эффект не наблюдается в клинических испытаниях. Сейчас успех Wave Life Sciences зависит именно от результатов клинических испытаний. Пока что мы имеем хорошие результаты только по исследованиям однократной дозы WVE-006. Компания придерживается индивидуального подхода в создании препаратов, что может оказаться прорывом в лечении генетических заболеваний, для которых существует в лучшем случае только поддерживающая терапия. Кроме того, внимание привлекает и абсолютно уникальный механизм действия, ведь действие патента на препарат будет сохраняться около 20 лет, а разработка аналогичных лекарств у компаний конкурентов тоже потребует значительного времени. Другими словами, в случае успеха аналоги препаратов Wave Life Sciences появятся нескоро, так что присмотреться к этой компании определенно стоит, ведь ее акции вырастут в случае успешного завершения клинических исследований в 2025 году.
Литература
- Есть ли смысл в антисенсах?;
- Как работает свертывание крови?;
- Nikita Chernyi, Darina Gavrilova, Mane Saruhanyan, Ezekiel S. Oloruntimehin, Alexander Karabelsky, et. al.. (2024). Recent Advances in Gene Therapy for Hemophilia: Projecting the Perspectives. Biomolecules. 14, 854;
- Генная терапия: познакомьтесь с лекарствами будущего;
- Как болезни крови генной терапией лечили;
- Natalia Lapteva, An-Gang Yang, Denise E Sanders, Randall W Strube, Si-Yi Chen. (2005). CXCR4 knockdown by small interfering RNA abrogates breast tumor growth in vivo. Cancer Gene Ther. 12, 84-89;
- Обо всех РНК на свете, больших и малых;
- мРНК-вакцина на страже коллективного иммунитета: за что вручили Нобелевскую премию в 2023 году;
- МикроРНК с огромным влиянием — за что вручили Нобелевскую премию по медицине (2024);
- Yiran Zhu, Liyuan Zhu, Xian Wang, Hongchuan Jin. (2022). RNA-based therapeutics: an overview and prospectus. Cell Death Dis. 13;
- 12 методов в картинках: генная инженерия. Часть II: инструменты и техники;
- Marlen C. Lauffer, Willeke van Roon-Mom, Annemieke Aartsma-Rus, N = 1 Collaborative. (2024). Possibilities and limitations of antisense oligonucleotide therapies for the treatment of monogenic disorders. Commun Med. 4;
- РНК-интерференция: повторный успех;
- СМА: три буквы — три лекарства;
- Тяжелая жизнь без дистрофина: мышечная дистрофия Дюшенна;
- Gokul Ramaswami, Jin Billy Li. (2014). RADAR: a rigorously annotated database of A-to-I RNA editing. Nucl. Acids Res.. 42, D109-D113;
- Lev I. Levitsky, Mark V. Ivanov, Anton O. Goncharov, Anna A. Kliuchnikova, Julia A. Bubis, et. al.. (2023). Massive Proteogenomic Reanalysis of Publicly Available Proteomic Datasets of Human Tissues in Search for Protein Recoding via Adenosine-to-Inosine RNA Editing. J. Proteome Res.. 22, 1695-1711;
- David Rodriguez Morales, Mirolyuba Ilieva, Sarah Rennie, Shizuka Uchida. (2023). Potential usages of A-to-I RNA editing patterns as diagnostic biomarkers. American Journal of Physiology-Cell Physiology. 324, C837-C842;
- Редко, но метко: орфанные заболевания как вызов современной медицине;
- Alistair M. Chalk, Scott Taylor, Jacki E. Heraud-Farlow, Carl R. Walkley. (2019). The majority of A-to-I RNA editing is not required for mammalian homeostasis. Genome Biol. 20;
- Genliang Lu, Chikdu Shivalila, Prashant Monian, Hui Yu, Ian Harding, et. al.. (2024). Rational design of base, sugar and backbone modifications improves ADAR-mediated RNA editing. Nucleic Acids Research. 52, 10068-10084;
- Идентифицированы белки, «слипающиеся» при болезни Гентингтона.