-
Убиквитин — один из самых распространённых белков в природе. Он синтезируется во всех эукариотических клетках — от дрожжей до человека, а у человека — от клеток кожи до нейронов. Пика известности этот белок достиг в 1980-х, когда обнаружилось, что убиквитинилирование является «поцелуем смерти» для белков. Действительно, одна из форм убиквитина является маркером деградации выполнивших свою функцию или «поломанных» белков. Потом было обнаружено и второе, противоположное (!), его свойство — убиквитинилирование белков ряда сигнальных путей регулирует их активность и, в результате, опосредует передачу сигнала в ядро. Наконец, недавно было открыто, что функции убиквитина распространяются и на регулирование аппарата ядра: показана его роль в регулировании транскрипции генов путём модификации РНК-полимеразного комплекса.
-
Генетический код — это «алфавит», лежащий в основе функционирования любой живой системы на Земле. Ранее считавшийся неизменным и универсальным для всех организмов, генетический код, на самом деле, подвержен эволюционному процессу, в результате которого могут возникать различные аномалии — например, варианты кода, специфичные для отдельных биологических видов или даже субклеточных органелл (митохондрий). Одна из таких аномалий, по-видимому, представляет собой древнюю адаптацию, защищающую от окислительного стресса, вызванного переходом к аэробному дыханию, и приводящую к высокой концентрации метионина в митохондриях.
-
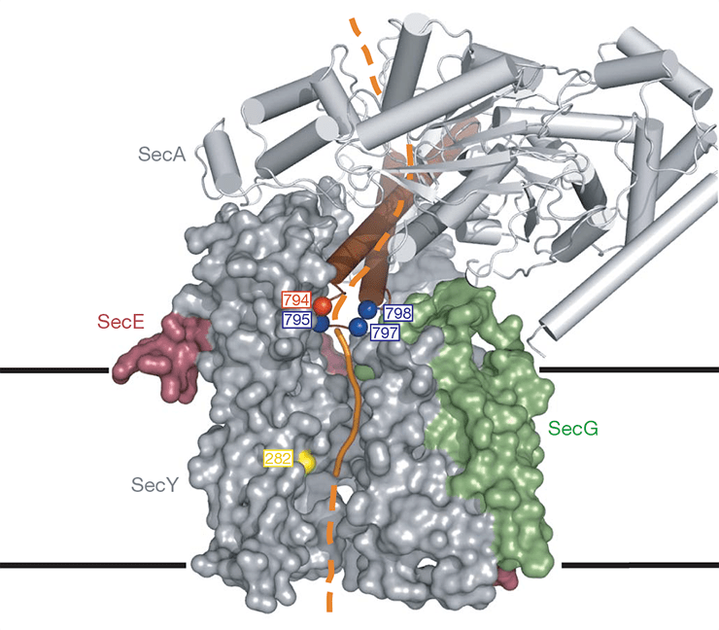
Более трети всех синтезируемых клеткой белков секретируется либо встраивается в мембрану, то есть — подвергается трансмембранному переносу. Этот процесс осуществляет специальный транслокационный комплекс, состоящий у бактерий из интегрального мембранного канала SecY и «мотора» SecA, который с помощью энергии АТФ «проталкивает» белóк через узкий канал SecY. До недавнего времени этот процесс был изучен только в самом общем виде (хотя было известно, например, в каких случаях белóк будет «вытолкнут» из клетки, а в каких — останется в мембране). Последние исследования пролили свет на молекулярный механизм взаимодействия SecY–SecA и то, как они осуществляют транспорт белков.
-
Многие наслышаны о вреде холестерина, содержащегося в продуктах, которые мы потребляем. Так ли уж вредна эта молекула для нашего организма? Холестерол (он же холестерин) и его производные являются важными компонентами клеточных мембран, особенно если речь заходит о нервной ткани. Недавно было опубликовано исследование, в котором обнаружена необычная функция холестерола. Оказывается, он способен связываться с холинергическими рецепторами, влияя при этом на их пространственную структуру. Кроме того, были обнаружены специфические сайты связывания холестерола. Это позволяет по-новому взглянуть на его роль в функционировании нервной ткани.
-
Животные воспринимают свет и реагируют на различные физические и химические сигналы с помощью интегральных белков клеточной мембраны, принадлежащих к семейству G-белоксопряжённыхрецепторов. Под действием этих сигналов рецептор «переключается» из неактивной формы в активированную, способную связывать G-белок и инициализировать внутриклеточные биохимические каскады. Менее десяти лет назад учёным удалось расшифровать пространственное строение одного из таких рецепторов — родопсина, — однако эта структура соответствовала неактивной форме белкá и не могла дать информации об активации рецептора. Недавно, после массы затраченных усилий, учёным удалось получить структуру активной формы родопсина и приблизиться, наконец, к пониманию молекулярных основ перехода рецепторов в активную форму.
-
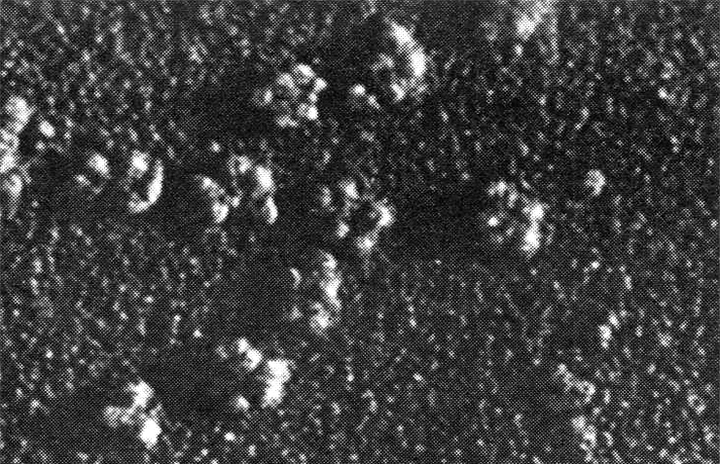
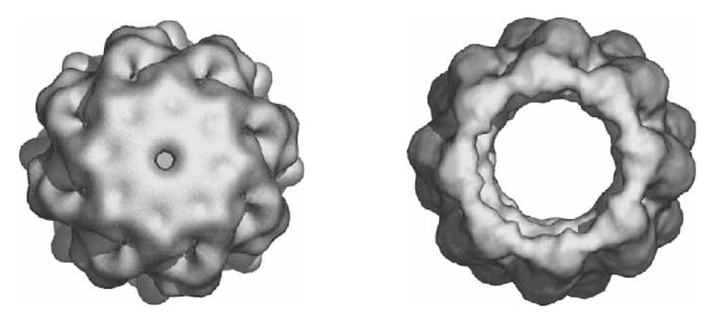
Шаперонины — белки, работающие «в паре» с шаперонами, — обеспечивают правильное сворачивание полипептидной цепи, временно «изолируя» только что сошедший с рибосомы белок в своей внутренней полости. При этом бактериальные шаперонины «закрываются» с помощью отдельной «крышки», а шаперонины эукариот имеют «встроенную» «задвижку». Учёным из Стэнфорда удалось выяснить, что механизм открывания/закрывания эукариотического шаперонина радикальным образом отличается от механизма его бактериального аналога, — несмотря на очень высокое структурное сходство.
-
Заболевания амилоидной природы — группа в основном неизлечимых прогрессирующих нейродегенеративных расстройств, включающая болезни Альцгеймера, Паркинсона и прионные заболевания. Молекулярный механизм этих болезней связывают со спонтанной пространственной перестройкой определённого белка (специфичного для каждого заболевания), придающей ему способность к полимеризации и образованию макромолекулярных фибрилл, токсичных для нервных клеток. Учёным из Чикаго удалось показать, что патогенным действием в болезни Альцгеймера обладают не только сами внутриклеточные фибриллы, но и предшествующие им сферические агрегаты, молекулы β-амилоидного пептида (Aβ) в которых имеют весьма схожую упаковку с фибрилло-образующими формами. β-структурные элементы, обнаруженные в этих молекулах, могут оказаться определяющим фактором для приобретения пептидом токсического действия.
-
Суметь проследить за движением отдельно взятой молекулы внутри живой клетки — значит приблизиться к пониманию пространственной организации сложнейших биохимических и биофизических процессов, составляющих основу жизни. Возможности оптических методов уже достаточны для того, чтобы увидеть перемещение отдельно взятой молекулы, но как понять, обусловлено ли оно функциональной необходимостью или же просто тепловым движением? Французские учёные предлагают статистический алгоритм анализа «траекторий» движения молекул, отличающий направленное движение от бесцельного.


- Лента
- Спецпроекты
- ▶Подкаст
-
Конкурс
- О конкурсе «Био/мол/текст»
- «Био/мол/текст»-2025/2026
- «Био/мол/текст»-2024/2025
- «Био/мол/текст»-2023/2024
- «Био/мол/текст»-2022/2023
- «Био/мол/текст»-2021/2022
- «Био/мол/текст»-2020/2021
- «Био/мол/текст»-2019
- «Био/мол/текст»-2018
- «Био/мол/текст»-2017
- «Био/мол/текст»-2016
- «Био/мол/текст»-2015
- «Био/мол/текст»-2014
- «Био/мол/текст»-2013
- «Био/мол/текст»-2012
- «Био/мол/текст»-2011
- Объявления
- Авторы
- Партнеры
- Поддержать
Публикации
—
Темы
—
Авторы
—
Комментарии
—
Поиск не дал результатов
По вашему запросу ничего не найдено
- Медицина
- SARS-CoV-2
- «Биомолекула» — Forbes
- Аллергия
- Антибиотики
- Атеросклероз
- Аутоиммунитет
- Боль
- ВИЧ/СПИД
- Вакцины
- Вирус Зика
- Вирус Эбола
- Генная терапия
- Грипп
- Депрессия
- Дерматология
- Диагностика
- Здравоохранение
- Нейродегенерация
- Никотин
- Онкология
- Персонализированная медицина
- Питание
- Сон
- Стволовые клетки
- Фармакология
- Эпилепсия
- Биология
- «Сухая» биология
- Антропология
- Бионика
- Биофизика
- Вирусология
- Вопросы пола
- ГМО
- Генетика
- Иммунология
- Микробиология
- Нейробиология
- Носимые технологии
- Психогенетика
- Синтетическая биология
- Старение
- Структурная биология
- Цитология
- Эволюционная биология
- Экология
- Эмбриология
- Эпигенетика
- Этология
- Биомолекулы
- GPCR
- АФК
- Амилоиды
- Биомембраны
- Гормоны растений
- ДНК
- Ионные каналы
- МГЭ
- Матрикс
- Нейромедиаторы
- РНК
- Рецепторы
- Хроматин