-
Статья на конкурс «био/мол/текст»: Химиотерапия рака основывается на приеме пациентом противоопухолевых антибиотиков, уничтожающих раковые клетки или останавливающих их рост. Химиотерапия не всегда достаточно эффективна и может наносить ощутимый вред организму. Из-за неселективного действия антибиотиков на здоровые клетки возникают побочные эффекты. Как сделать удар по раковым клеткам точечным, не задев при этом здоровые? Свойства опухолевой ткани существенно отличаются от нормальных. Можно добавить к нашему лекарству «систему наведения», которая распознает отличие и направит лекарство в нужное место. Эта концепция получила название адресной доставки.
-
Статья на конкурс «био/мол/текст»: Права ли была ваша бабушка, советуя лечить все болезни травами? Как и зачем вырастить растение в пробирке? Почему растения до сих пор остаются единственным источником многих лекарственных веществ? Как обмануть природу и добиться от зеленых лекарей синтеза нужного вам вещества? И какую страшную тайну скрывают растения за яркой окраской?
-
4786Статья на конкурс «био/мол/текст»: Слух кажется таким естественным, что мы никогда не задумываемся о нем. В статье вы узнаете не только о том, как работает ухо, но и познакомитесь с современными методами изучения молекулярных процессов передачи звука и передовыми технологиями коррекции патологий слуха с помощью оптогенетики.
-
Комикс на конкурс «био/мол/текст»: Моноклональные антитела — антитела, вырабатываемые иммунными клетками, принадлежащими к одному клеточному клону. Сегодня моноклональные антитела широко используются в исследовательских, диагностических и лечебных целях. Ни для кого не секрет, кому принадлежит открытие моноклональных антител и метода гибридом. Однако истории любят многократные повторения.
-
Комикс на конкурс «био/мол/текст»: Генная инженерия и биотехнология, будучи одними из главных направлений научно-технического прогресса, способствуют решению разнообразных задач. За счет генной инженерии совершен огромный шаг навстречу новым технологиям. В этой статье будет рассказано об истории открытия, становления и успехов биотехнологии, а также о тех вопросах, над которыми сейчас работают молекулярные биологи и биотехнологи.
-
Статья на конкурс «био/мол/текст»: На одной и той же молекуле ДНК уживаются два различных типа последовательностей — уникальные, то есть «неповторимые», и тандемные повторы, которые представляют собой повторяющиеся друг за другом копии одной и той же короткой последовательности. При этом возникают, существуют и изменяются они по законам, во многом отличающимся от тех, которые действуют в мире уникальных участков ДНК. Статья посвящена своеобразию повторяющихся участков ДНК, их значению для генома в целом, а также перспективам, которые открывает получение искусственных повторяющихся последовательностей с помощью генной инженерии.
-
Статья на конкурс «био/мол/текст»: Звук — неотъемлемая часть нашей жизни. Казалось бы, заурядное физическое явление, но сколько же всего оно нам дает! Благодаря слуху человек на заре своего существования мог избежать смертельной опасности или настигнуть добычу. Спустя векá — какое наслаждение приносят нам этюды Шопена и симфонии Бетховена! Какое воодушевление настигает нас, стоит нам услышать пафосный театральный монолог или торжественную речь на важном приеме! Но все-таки звук — это простая физика. А человеку свойственно использовать физические явления себе на пользу. И, вероятно, весьма неожиданно прозвучит то, что звук может помочь нам создавать лекарства от различных болезней.
-
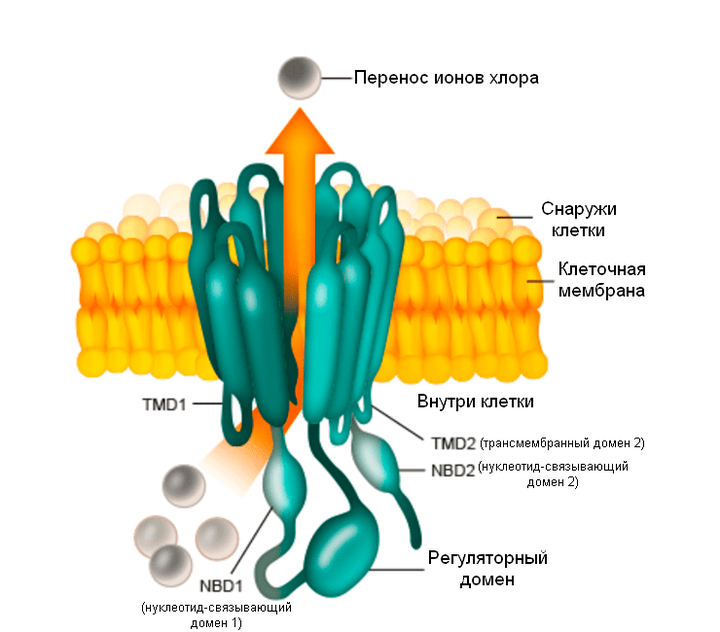
Статья на конкурс «био/мол/текст»: Муковисцидоз — самое распространенное из моногенетических заболеваний (обусловленных поломкой одного гена). При нем нарушено функционирование белка-переносчика ионов хлора через мембрану клетки — хлорного канала CFTR. Так как этот канал отвечает за нормальную работу эпителия в легких, кишечнике, поджелудочной железе и других органах, его дисфункция приводит к накоплению в этих органах слизи, повышению вероятности инфекций и в конце концов к преждевременной смерти. До последнего времени врачи могли лечить только симптомы муковисцидоза: разжижать слизь, расширять бронхи, снижать воспаление, а также уничтожать бактерий антибиотиками, причем все эти меры почти не продлевали жизнь. Но за последние годы был достигнут невиданный прогресс: средняя продолжительность жизни больных возросла более чем в два раза. В этой статье будет рассказано о препаратах, благодаря которым стал возможен такой успех, об истории их создания и перспективах. На данных примерах читатель также узнает, как происходит современная разработка лекарств.
-
Статья на конкурс «био/мол/текст»: Это интересный вопрос, ответ на который должен был дать проект «Геном человека», завершившийся в 2003 году. После того как ученые получили основную информацию о геноме человека, они попытались определить число генов, но эта задача оказалось не такой простой. Цель настоящей статьи — суммировать и проанализировать научные данные по составлению каталога генов у человека.
-
Статья на конкурс «био/мол/текст»: Точная последовательность нуклеотидов в цепях РНК и ДНК, единственная ошибка в которой может привести к отказу в работе всей молекулы, невольно заставляет задуматься о схожести устройства нуклеиновых кислот с компьютерной программой, которая может «вылететь», если в ее коде всего в одном месте проставлена неверная буква. Данная статья посвящена необычным функциям, которые могут выполнять нуклеиновые кислоты. Это рассказ о различных молекулярных механизмах, логических схемах и даже роботах, созданных на основе ДНК, на которые мы предлагаем взглянуть почти как на блок-схемы и строчки программного кода.


- Лента
- Спецпроекты
- ▶Подкаст
-
Конкурс
- О конкурсе «Био/мол/текст»
- «Био/мол/текст»-2025/2026
- «Био/мол/текст»-2024/2025
- «Био/мол/текст»-2023/2024
- «Био/мол/текст»-2022/2023
- «Био/мол/текст»-2021/2022
- «Био/мол/текст»-2020/2021
- «Био/мол/текст»-2019
- «Био/мол/текст»-2018
- «Био/мол/текст»-2017
- «Био/мол/текст»-2016
- «Био/мол/текст»-2015
- «Био/мол/текст»-2014
- «Био/мол/текст»-2013
- «Био/мол/текст»-2012
- «Био/мол/текст»-2011
- Объявления
- Авторы
- Партнеры
- Поддержать
Публикации
—
Темы
—
Авторы
—
Комментарии
—
Поиск не дал результатов
По вашему запросу ничего не найдено
- Медицина
- SARS-CoV-2
- «Биомолекула» — Forbes
- Аллергия
- Антибиотики
- Атеросклероз
- Аутоиммунитет
- Боль
- ВИЧ/СПИД
- Вакцины
- Вирус Зика
- Вирус Эбола
- Генная терапия
- Грипп
- Депрессия
- Дерматология
- Диагностика
- Здравоохранение
- Нейродегенерация
- Никотин
- Онкология
- Персонализированная медицина
- Питание
- Сон
- Стволовые клетки
- Фармакология
- Эпилепсия
- Биология
- «Сухая» биология
- Антропология
- Бионика
- Биофизика
- Вирусология
- Вопросы пола
- ГМО
- Генетика
- Иммунология
- Микробиология
- Нейробиология
- Носимые технологии
- Психогенетика
- Синтетическая биология
- Старение
- Структурная биология
- Цитология
- Эволюционная биология
- Экология
- Эмбриология
- Эпигенетика
- Этология
- Биомолекулы
- GPCR
- АФК
- Амилоиды
- Биомембраны
- Гормоны растений
- ДНК
- Ионные каналы
- МГЭ
- Матрикс
- Нейромедиаторы
- РНК
- Рецепторы
- Хроматин