
«Да, паразитирую! И дарю новые возможности!»
26 декабря 2024
«Да, паразитирую! И дарю новые возможности!»
- 572
- 0
- 4
На иллюстрации как будто показана передача информации с помощью токсоплазмы. Такое явление можно отнести к области научной фантастики. А вот и не только! Недавно исследователям удалось приручить токсоплазму так, чтобы она доставляла терапевтические белки прямо в цель — нейроны человека.
Рисунок в полном размере.
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Наверное, такими словами могла бы озаглавить автобиографию Toxoplasma gondii. Впрочем, по первому пункту вопросов нет — паразитический образ жизни токсоплазмы знаком еще со школьных учебников. А про какие такие возможности идет речь? Про инженерное применение токсоплазмы в качестве системы доставки при заместительной терапии орфанных нейродегенеративных заболеваний! И фармацевтическую компанию уже основали! А мы разберемся со всем по порядку.
Конкурс «Био/Мол/Текст»-2024/2025
Эта работа опубликована в номинации «Академия & Бизнес» конкурса «Био/Мол/Текст»-2024/2025.

Генеральный партнер конкурса и партнер номинации — международная инновационная биотехнологическая компания BIOCAD.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Гематоэнцефалический барьер (ГЭБ) получает солидную порцию лавров, когда мы говорим про доставку терапевтических молекул непосредственно в головной мозг. На «Биомолекуле» есть даже спецпроект, который называется «Нейрофармакология». В нем мои коллеги подробно описывают строение и функции этого барьера, а также рассказывают о ГЭБ как о протагонисте в контексте терапии заболеваний ЦНС. Рекомендую к прочтению, время пролетит незаметно [1]! А если вы по природе визуал, вам доставят несравненное эстетическое удовольствие иллюстрации в статье «Blood-brain barrier. Связующее между двумя мирами — кровеносной и центральной нервной системами» [2]!
В физиологических условиях ГЭБ мягко и бережно заботится о мозге, пропускает только необходимые для жизнедеятельности вещества и оставляет за бортом все ненужное [3]. Но любая гиперопека не проходит бесследно. И особенно если мы говорим о терапии заболеваний головного мозга, так как лекарственные средства ー вещества как раз-таки «ненужные» и в большинстве своем потенциально иммуногенные, то есть могут активировать иммунную систему для элиминации «патогена». Одно уточнение: здесь мы говорим про белки как терапевтические агенты, это важно. Более того, из-за большого молекулярного веса и физико-химических свойств белки не могут пересечь гематоэнцефалический барьер, как ни крути. Звучит как вызов для исследователей! И действительно: придумываются различные системы доставки и экспрессии целительных молекул в головной мозг, способы обхода ГЭБ и модификации имеющихся методов [4] (рис. 1), которые с каждым днем приближают медицину к счастливым улыбкам на лицах когда-то неизлечимых пациентов. Вот и Epeius Pharma была создана для такой благородной миссии!
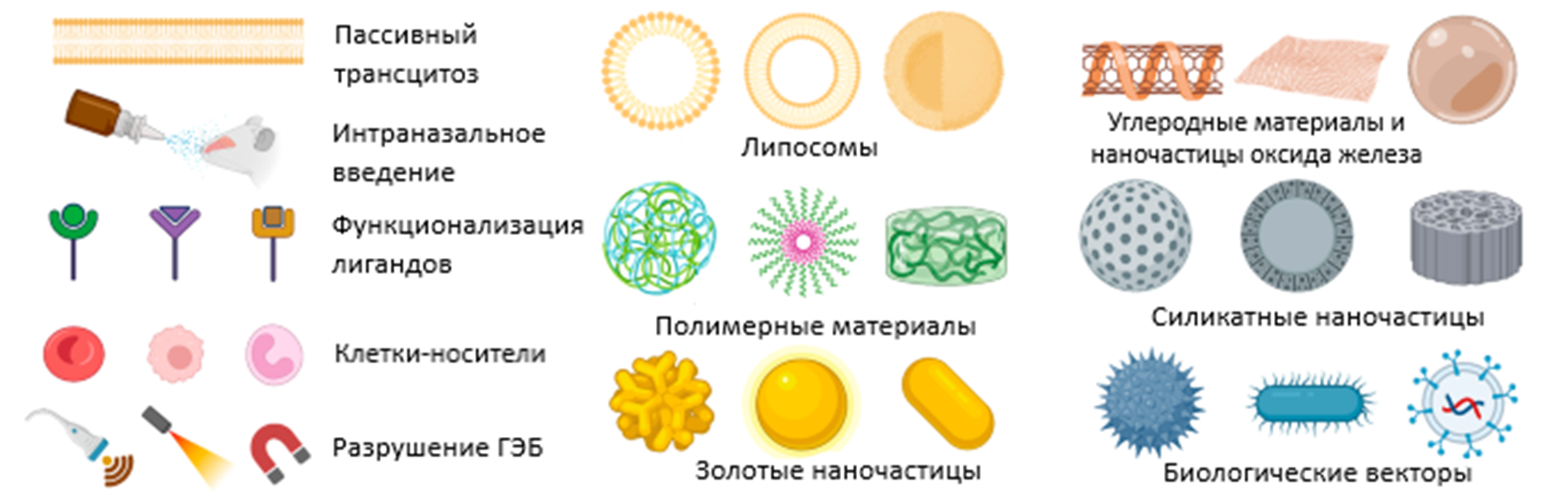
Рисунок 1. Существующие методы доставки лекарственных препаратов в головной мозг. Методов много, каждый имеет преимущества и недостатки, поэтому список однозначно будет пополняться. На данный момент используются как методы механической деструкции барьера, так и различные разработки в области коллоидной и физической химии: липосомы, наночастицы, полимерные материалы. Биовекторы и клетки-носители также не остаются в стороне у исследователей. Более подробно про методы доставки лекарственных препаратов через ГЭБ можно узнать из уже упомянутого спецпроекта «Нейрофармакология».
Компания молодая. Ее инвесторами являются компания Ramot из Тель-Авивского университета, которая занимается трансляцией академических знаний в прикладные технологии, и научно-исследовательские и инновационные службы Университета Глазго, Шотландия. Сборная исследовательская группа из этих стран — Шотландии и Израиля — и воплотила первоначальную идею о разработке нового терапевтического подхода в уже знакомую нам Epeius Pharma. Год ее основания ー 2019. Известно, что она находится под теплым крылом акселератора FutuRx из Израиля, на сайте которого не совсем дословно указывается: «Инкубатор предназначен для поддержки „юных“ фармацевтических предприятий, основанных на передовых научных достижениях в разработке лекарств». Акселератор уже имеет своих выпускников, а наш главный герой пока еще обучается на предпоследних курсах (рис. 2).

Рисунок 2. Логотип компании Epeius Pharma, которая трансформирует научные знания в осязаемые технологии. Конь с маленьким серым пятнышком на месте мозга, звучное название. Может, даже метафорически мифологическое, так как Эпей — участник Троянской войны и создатель того самого деревянного коня. Маленькое серое пятно, должно быть, объект нашего повествования — Toxoplasma gondii.
Что-то новенькое
Итак, что же нам предлагает компания Epeius Pharma? Серьезные препятствия в доставке терапевтических белков через гематоэнцефалический барьер можно решить паразитически! Я имею в виду, с применением внутриклеточного паразита Toxoplasma gondii, который неплохо обходит барьер посредством собственных систем нападения и секретирует необходимые для жизнедеятельности белки в нейроны и окружающую их среду на протяжении всего инфекционного процесса. Для стройности повествования нужно несколько строк посвятить собственно токсоплазме в ее исходной среде обитания.
Цель токсоплазмы ー вовсе не люди, а кошки. Мы являемся лишь промежуточными хозяевами, равно как и другие не кошачьи теплокровные [5]. Промежуточные хозяева (нас интересуют люди) являются местом бесполого размножения паразита и формирования тканевых цист ー покоящихся стадий. И эти цисты, в свою очередь, формируют персистирующую инфекцию, о которой человек с хорошим и крепким иммунитетом (по-другому, иммунокомпетентный) может даже не догадываться. Более того, по всему миру таких, безусловно, счастливчиков с крепким иммунитетом, но с токсоплазмой внутри, можно насчитать около трети [6].
Еще один важный для нашего рассказа момент ー это системы секреции белков токсоплазмы для успешной инвазии и реализации своего патогенного потенциала. Их три: микронемы, роптрии и плотные гранулы. Нам нужны только две последние. Роптрии находятся на апикальном полюсе паразита, связаны с цитоплазматической мембраной и имеют булавовидную форму. Их количество в клетке варьируется в зависимости от стадии развития. Например, во время острой фазы роптрий насчитывается до 12, а во время хронической ー до трех. Эти органеллы высвобождают так называемые эффекторные белки для проникновения в клетку хозяина и формирования паразитофорной вакуоли, то есть процессы синтеза в роптриях довольно кратковременны. Плотные гранулы ー это буквально пузырьки с белками, которые созревают в комплексе Гольджи, передвигаются к мембране и участвуют в поддержании и структуризации паразитофорной вакуоли [7]. Другими словами, белки плотных гранул обустраивают свой новый дом так, чтобы жизнь паразита оставалась долгой, и поэтому секретируются они непрестанно за все время персистенции токсоплазмы в хозяине [8].
Суммируя всю информацию, исследователи из Тель-Авивского университета под руководством Одеда Рехави предложили использовать токсоплазму как вектор для доставки терапевтических белков в ЦНС. В 2018 году они опубликовали препринт, в котором достаточно подробно описали все лабораторные манипуляции [9]. Исследователи сконструировали химерные гены, и в дальнейшем получили химерные белки по формуле: терапевтический белок + исходные белки токсоплазмы, секретируемые роптриями (токсофиллин) и плотными гранулами (GRA16) (рис. 3).
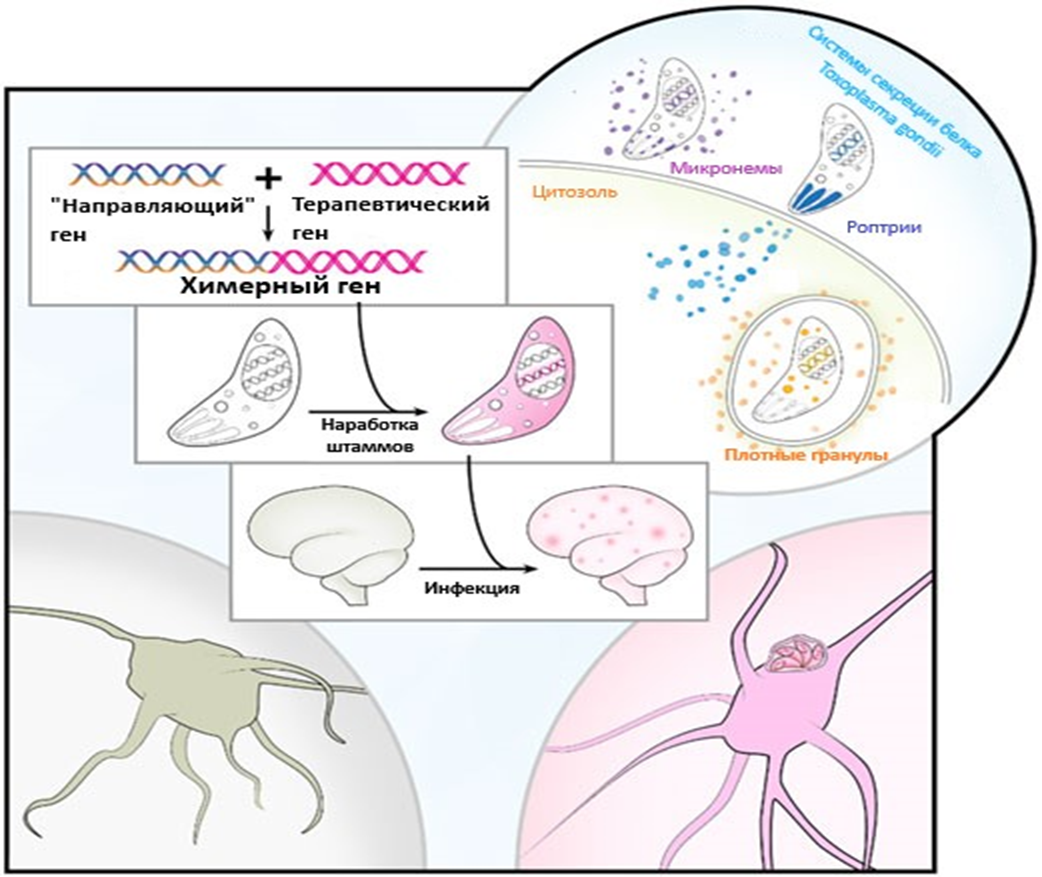
Рисунок 3. Манипуляции исследователей слева на картинке и системы секреции токсоплазмы справа. Так как сигналы локализации белков в роптриях и плотных гранулах на данный момент не обнаружены, ученые добавили к терапевтической последовательности «направляющий» ген токсофиллина или GRA16, соответственно. Это нужно, чтобы можно было прицельно доставить белки в роптрии и плотные гранулы. Такая конструкция вводится в токсоплазму ー создается трансгенная линия, которая секретирует терапевтический белок. Затем трансгенная токсоплазма активно мигрирует в ЦНС, обходит ГЭБ и доставляет белки нейронам! Справа же проиллюстрирована локализация систем секреции в токсоплазме, а также стадийность их воздействия на клетку хозяина. При образовании плотных гранул токсоплазма уже находится в паразитофорной вакуоли. В настоящий момент нельзя сказать, как белки плотных гранул попадают в ядро хозяина, преодолев и паразитофорную вакуоль, и мембранные комплексы хозяйской клетки. Однозначно можно отметить следующее: GRA16 точно достигает ядра клетки и даже нарушает экспрессию генов, ответственных за метаболизм и клеточный цикл хозяина.
Соответственно, интеграция с токсофиллином приводила к кратковременной экспрессии терапевтического белка, а с GRA16 ー к длительной. Выбирайте что хотите! А для своего исследования ученые сместили фокус на плотные гранулы и на GRA16.
Первоначальная выборка терапевтических молекул состояла из семи белков, генетические мутации в которых приводят к развитию ряда орфанных заболеваний ЦНС. На финише остался лишь один ー MeCP2, который имеет вес в процессах функционирования и поддержания нейронов. Его мутация вызывает потерю функциональности белка и синдром Ретта ー изнурительное расстройство с ранней и глубокой неврологической регрессией и плохой проекцией на двигательную активность, когнитивные и коммуникативные навыки [10]. До 2022 года синдром Ретта находился в рубрике F84 «Общие расстройства психологического развития» в МКБ-10, по которой диагностируют расстройства аутистического спектра (РАС). Действительно, симптомокомплекс синдрома Ретта пересекается с РАС. В МКБ-11 его перенесли в другую рубрику, однако «отголоски прошлого» остались — многим пациентам с синдромом Ретта ставят расстройство аутистического спектра до того, как выявляется мутация в MeCP2 [11]. Частота встречаемости синдрома — 1:9000 женщин в возрасте до 32 лет. Так как ген расположен на X-хромосоме, мальчики в таком случае нежизнеспособны [12].
Сам белок MeCP2 ー это такой «считыватель» метилома. Он и расшифровывается как «метил-CpG-связывающий белок». В его составе есть домен, который узнает метилированный динуклеотид цитозин—гуанин (сейчас известно, что и цитозин—аденин, и даже тринуклеотид цитозин—аденин—цитозин). Связывание с метилированной ДНК наделяет MeCP2 правом на регуляцию транскрипции, участие в альтернативном сплайсинге, ремоделировании хроматина и созревании микроРНК как самому, так и со своими коллегами [13], [14]. В общем, некоторая эпигенетическая история на нем довольно крепко держится и интенсивно реализуется.
А теперь к нейронам
Поскольку мишенью для доставки белка будут нейроны человека, исследователи из Epeius Pharma проверили, а будут ли? К счастью, оказалось, что да! Они дифференцировали клетки LUHMES (эмбриональные клетки-предшественники нейронов) в зрелые нейроны, а также использовали первичную культуру нейронов и нейробластомы мышей, и все инфицировали модифицированными токсоплазмами. Все получилось как надо ー и секреция, и экспорт, и накопление белка в ядрах нейронов, и функциональная активность! Дальнейшие исследования принесли уже полноценную публикацию статьи в журнале Nature microbiology. Дополнения к препринту проявились во включении в эксперимент лабораторных мышей и органоидов головного мозга человека [15].
Органоиды в общем смысле ー это самособирающиеся трехмерные модели, имитирующие клеточный состав и анатомическую структуру органа. Они являются как бы переходными между in vitro и in vivo моделями. Да, они имеют свои недостатки: органоиды гораздо меньше по размеру, в них нет кровеносных сосудов, из-за чего развивается некроз клеток (оговорюсь: есть некоторые методологические подходы по созданию органоидов с сосудистой сетью). Однако их главное преимущество — имитация трехмерной архитектуры органа — дает исследователям хорошее подспорье в использовании этих моделей во многих областях науки [16] (рис. 4).
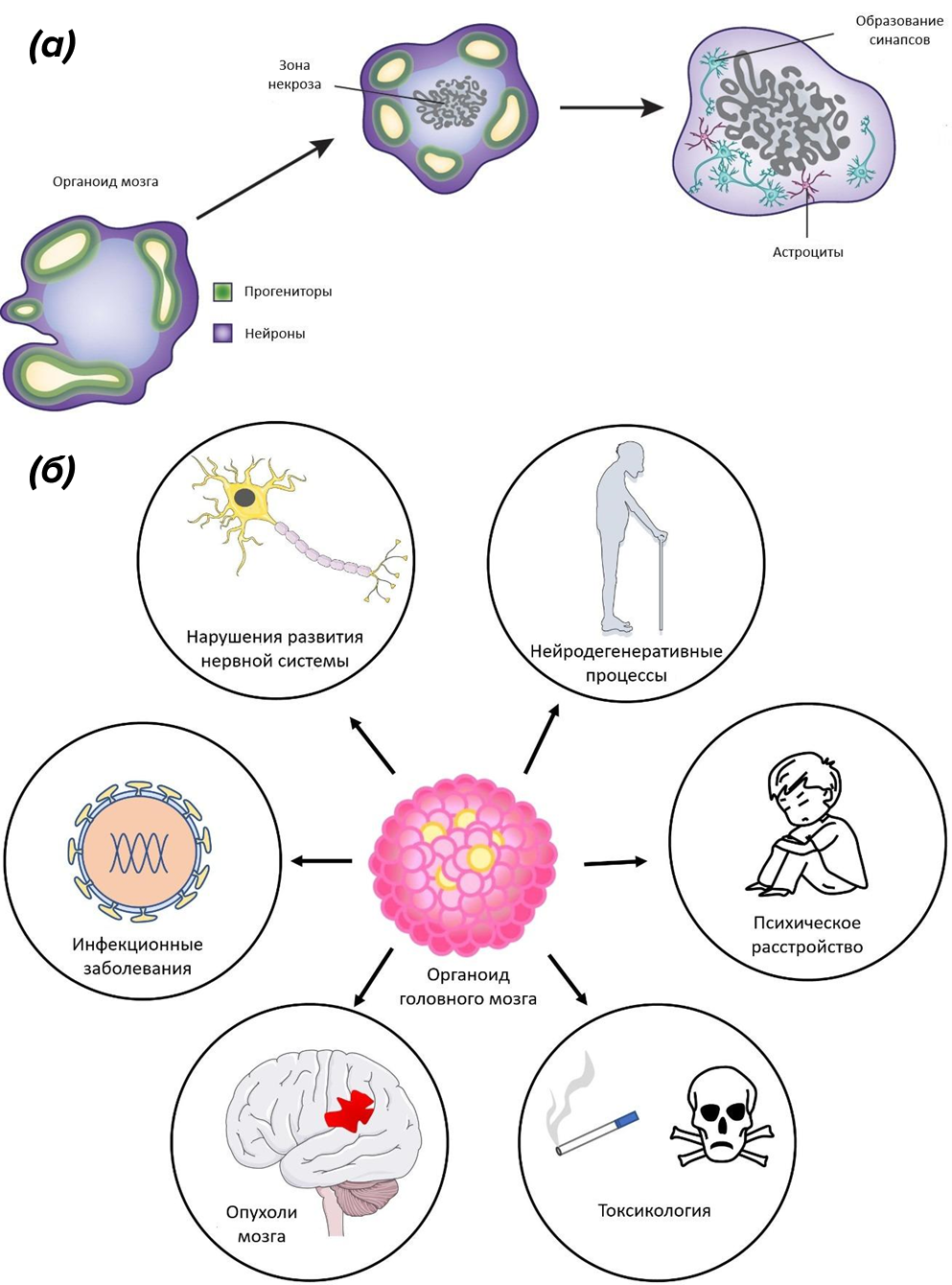
Рисунок 4. Схематичное изображение органоида головного мозга (а), а также его использование в разных разделах нейронауки (б). По мере роста органоида происходит неминуемая некротическая гибель клеток, которые оказались в центре. Связано это с тем, что диффузионный поток питательных веществ и кислорода не дотягивается до клеток, удаленных от периферии. Отсутствие кровеносных сосудов сейчас решается методами тканевой инженерии, сокультивацией органоида с клетками, выстилающими кровеносные сосуды, или трансплантацией органоида в модели in vivo. Однако образование зоны некроза не мешает органоиду сформировать трехмерную имитацию изучаемого органа. Под буквой (б) разъясняются приложения органоидов мозга в нейронауке, но благодаря им можно изучать не только патологические процессы, а также, например, механизмы внутриутробного развития головного мозга.
Сконструировав органоиды коры головного мозга и внедрив в них модифицированную токсоплазму, исследователи вновь увидели перед собой гладкую и ровную магистраль: при визуализации поздних органоидов (200-й день) обнаружилась устойчивая инфекция и стабильная доставка конструкции к нейронам. Самое время проверять в исследованиях in vivo!
И для in vivo был разработан низковирулентный штамм паразита, который достоверно вызывает бессимптомную инфекцию у мышей. На 18-й день после внутрибрюшинной инъекции сконструированных паразитов в мозгу мышей наблюдались цисты. Это хорошо. И, что еще лучше, экспрессия терапевтического белка находилась в терапевтических же концентрациях, потому что когда белка много ー происходит интоксикация организма и повышается процент смертности лабораторных мышек. Когда же белка мало — эффекта от препарата нет.
Далее исследователи захотели посмотреть, в каких частях мозга происходит накопление химерных белков. Для этого они использовали подход генной инженерии на основе системы рекомбинации Cre-loxP [22], чтобы добавить флуоресцентный индикатор в токсоплазму. Индикатор является неким компасом при визуализации мозга мышей под микроскопом. Получилось, что пунктами назначения для белков стали: кора больших полушарий, гиппокамп, ствол мозга, гипоталамус и таламус. По мнению большинства специалистов в области изучения синдрома Ретта, в основе заболевания лежит массивное поражение именно коры головного мозга. Поэтому полученные результаты очень по-доброму впечатляют (рис. 5)!
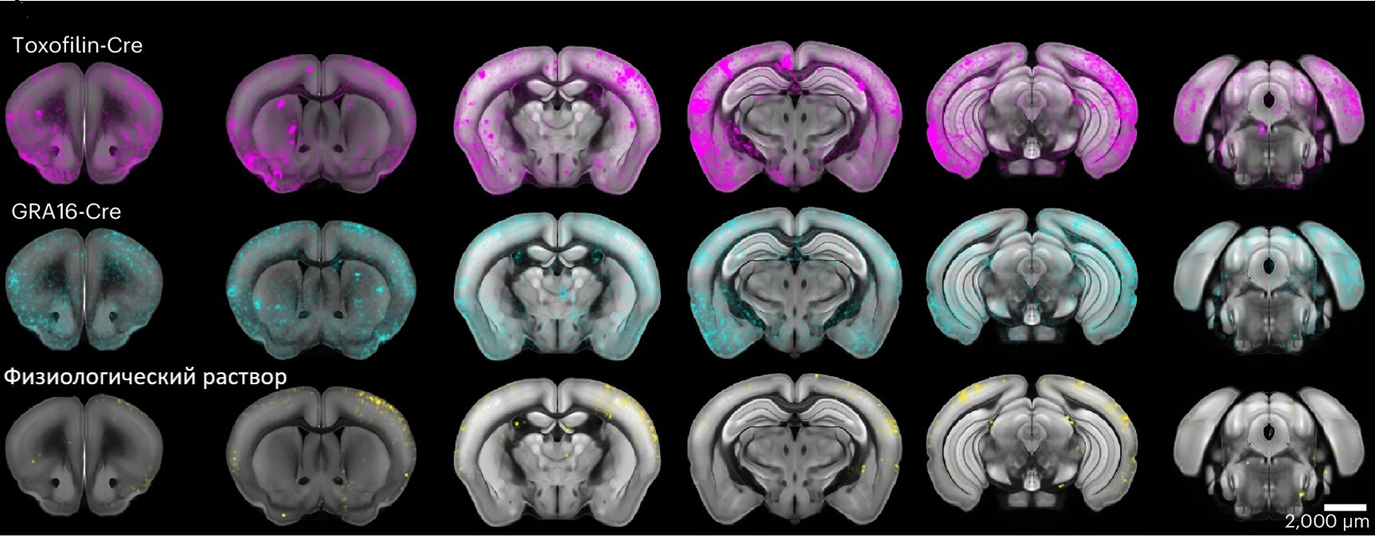
Рисунок 5. Распределение химерных белков по отделам головного мозга мышей. Видно, что в коре больших полушарий преобладает распределение как белков роптрий (фиолетовые, toxofillin-Cre), так и плотных гранул (бирюзовые, GRA16-Cre) по сравнению с другими отделами мозга. Однако фиолетового цвета все же визуально побольше, так как роптрии не требуют формирования паразитофорной вакуоли прежде, чем начать экспрессировать свои белки. Более того, белки роптрий могут инфицировать сразу несколько нейронов и действуют они быстро и кратковременно, в отличие от белков плотных гранул. Поэтому и накапливаются они быстрее.
Конечно, любой патоген является потенциально опасным. И Epeius Pharma это понимает. На данный момент исследователи изучают возможные механизмы снижения патогенных свойств паразита путем инактивации соответствующих генов, ограничения репликации in vivo или повышения чувствительности к противопаразитарным препаратам.
Одед Рехави в одном из интервью сказал: «Удивительно видеть, как идея становится реальностью. Мы начали с простого вопроса: можем ли мы использовать уникальные свойства токсоплазмы, чтобы она выделяла человеческие белки в нейроны? Я очень рад, что ответ „да“, и что эта концепция теперь воплощается в платформу доставки лекарств». Прекрасные слова вовлеченного исследователя! Давайте на такой позитивной волне двигаться дальше. Обещаю, там немного.
Что нам это дает?
В слегка отдаленной перспективе система доставки терапевтических белков с помощью токсоплазмы, скорее всего, будет успешным инженерным решением. По крайней мере, моя оптимистичность в это верит! Во-первых, проблемы преодоления гематоэнцефалического барьера лягут не на исследователей, а на токсоплазму. Во-вторых, исходные системы секреции паразита помогут разработать различные тактики и подходы в терапии как с кратковременным, так и с длительным эффектом. В-третьих, с помощью данного вектора становится возможным доставлять полноразмерные, длинные по аминокислотной последовательности белки в клетки-мишени. Это сейчас тоже большое ограничение при применении, например, вирусов как систем доставки [23], [24]. Также компания планирует сфокусироваться на доставке токсоплазмой терапевтических белков против других нейродегенеративных патологий. Какие патологии бывают и каковы механизмы их развития, можно опять же узнать из спецпроекта «Нейрофармакология» [25].
Как говорят сами исследователи, до выхода на рынок их продукту предстоит пройти долгий и, всего вероятнее, тернистый путь. На данный момент исследовательская группа привлекает ученых со всего мира к усовершенствованию системы доставки на основе токсоплазмы. Так, к Израилю и Шотландии уже присоединились ученые из Италии, США и Швейцарии. Возможно, международность проекта поможет привлечь инвесторов, что значительно ускорит исследование. И однозначно увеличит количество идей по устранению существующих недостатков. Потенциальные модификации системы могут заключаться в тестировании дополнительных белков для нацеливания на роптрии и плотные гранулы или, например, в использовании других штаммов токсоплазмы, чтобы минимизировать неспецифическое воздействие на организм.
К сожалению, у меня плохой глазомер, поэтому я не берусь даже примерно представлять, когда данная система доставки терапевтических белков выйдет на фармацевтический рынок. Однако сама идея кажется мне интересной и вполне реализуемой в будущем. В любом случае, работа кипит, компания набирается опыта. А мы проследим за развитием событий!
Литература
- Сквозь тернии к нервам: особенности доставки лекарств в нервную систему;
- Blood-brain barrier. Связующее между двумя мирами — кровеносной и центральной нервной системами;
- Di Wu, Qi Chen, Xiaojie Chen, Feng Han, Zhong Chen, Yi Wang. (2023). The blood–brain barrier: Structure, regulation and drug delivery. Sig Transduct Target Ther. 8;
- Прямо в мозг: препятствия и способы их преодолеть;
- Токсоплазма: тайный властелин мозга;
- Sumit K. Matta, Nicholas Rinkenberger, Ildiko R. Dunay, L. David Sibley. (2021). Toxoplasma gondii infection and its implications within the central nervous system. Nat Rev Microbiol. 19, 467-480;
- Aoife T. Heaslip, Shane R. Nelson, David M. Warshaw. (2016). Dense granule trafficking inToxoplasma gondiirequires a unique class 27 myosin and actin filaments. MBoC. 27, 2080-2089;
- Fumiaki Ihara, Yoshifumi Nishikawa. (2021). Toxoplasma gondii manipulates host cell signaling pathways via its secreted effector molecules. Parasitology International. 83, 102368;
- Shahar Bracha, Karoliina Hassi, Paul D. Ross, Stuart Cobb, Lilach Sheiner, Oded Rechavi Engineering Brain Parasites for Intracellular Delivery of Therapeutic Proteins — Cold Spring Harbor Laboratory;
- Разнообразия много не бывает: чем занимаются мобильные элементы генома в мозге;
- От МКБ-10 к МКБ-11: что было, что будет, чем сердце успокоится;
- Alison Anderson, Kingsley Wong, Peter Jacoby, Jenny Downs, Helen Leonard. (2014). Twenty years of surveillance in Rett syndrome: what does this tell us?. Orphanet J Rare Dis. 9;
- Молекулы и эпигеном ;
- Наследование и эпигеном;
- Shahar Bracha, Hannah J. Johnson, Nicole A. Pranckevicius, Francesca Catto, Athena E. Economides, et. al.. (2024). Engineering Toxoplasma gondii secretion systems for intracellular delivery of multiple large therapeutic proteins to neurons. Nat Microbiol. 9, 2051-2072;
- Xuyu Qian, Hongjun Song, Guo-li Ming. (2019). Brain organoids: advances, applications and challenges. Development. 146;
- Madeline A Lancaster. (2018). Brain organoids get vascularized. Nat Biotechnol. 36, 407-408;
- Yikai Shou, Feng Liang, Shunliang Xu, Xuekun Li. (2020). The Application of Brain Organoids: From Neuronal Development to Neurological Diseases. Front. Cell Dev. Biol.. 8;
- Как искусственные модели головного мозга и омиксные технологии пригодятся в борьбе с аутизмом;
- 12 методов в картинках: клеточные технологии;
- Лекарство в пробирке: доклинические исследования in vitro;
- 12 методов в картинках: генная инженерия. Часть II: инструменты и техники;
- Время первых: как аденоассоциированные вирусы стали лучшими в доставке генов in vivo;
- Генная терапия: познакомьтесь с лекарствами будущего;
- Нейродегенерации, или Массовые вымирания нейронов.







