Омикс-биомаркеры и ранняя диагностика: когда счастье возможно
23 февраля 2018
Омикс-биомаркеры и ранняя диагностика: когда счастье возможно
- 5718
- 3
- 15
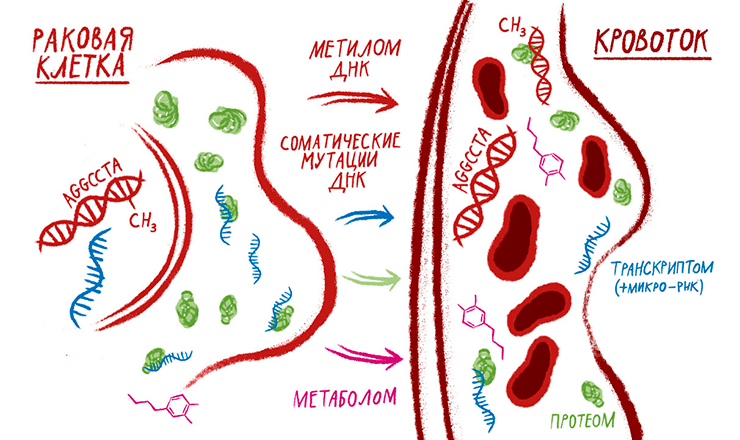
Мечта медицинского биохимика — малоинвазивный диагностический тест, выявляющий заболевания на самой ранней стадии. Из клеток злокачественных опухолей в кровоток поступают все основные типы биомолекул. Нужно научиться эффективно выявлять их среди нормальных компонентов крови или ее плазмы, а затем оценить их диагностический потенциал.
иллюстрация Алены Беляковой
-
Автор
-
Редакторы
-
Иллюстратор
Одна из важных целей омикс-технологий (в том числе транскриптомики, протеомики, метаболомики) в медицине — это поиск биомаркеров для диагностики распространенных неинфекционных заболеваний, в основном злокачественных опухолей. Часто говорят о ранней диагностике, то есть о тех случаях, когда болезнь выявляют впервые и на ранней стадии. Но всегда ли имеет смысл использовать молекулярные технологии для поиска ранних маркеров? Я хочу поговорить о том, какие параметры характеризуют молекулярные биомаркеры и их сочетания, для каких случаев их следует разрабатывать, а также рассказать о десятилетии развития постгеномных технологий в медицине и о собственном опыте в протеомике рака. Этот материал адресован в основном биологам и физикам, которые занимаются омикс-технологиями, но не всегда вдаются в медицинские подробности. Он поможет им избежать бесполезной работы с точки зрения постановки клинической задачи.
Одна из главных целей постгеномных, или омиксных, технологий в медицине — разработка биомаркеров для диагностики заболеваний [1]. Под постгеномными технологиями обычно подразумевают высокопроизводительное измерение продуктов генной экспрессии — транскриптомику и протеомику [2]. Косвенными продуктами генной экспрессии считают метаболиты, и их анализ — метаболомику — тоже часто причисляют к постгеномным методам, хотя, строго говоря, в составе метаболитов человеческого организма немало ксенобиотиков, которые к работе генома прямого отношения не имеют [3].
«Биомолекула» уже рассказывала, что такое омиксные технологии и как «большие данные» преобразили биологию сегодняшнего и завтрашнего дня: «„Омики“ — эпоха большой биологии» [4].
С другой стороны, возникает вопрос, что же такое биомаркеры, хотя это слово на слуху, и его значение понятно интуитивно. Биомаркер — измеряемый параметр, качественная или количественная характеристика которого свидетельствует о наличии или отсутствии какого-то заболевания или состояния. В широком смысле даже синяк под глазом может быть биомаркером. В клинической медицине такие биомаркеры называют симптомами. А вот в биохимии фигурируют другие, молекулярные биомаркеры, то есть измеряемые разными способами молекулы. И молекулы эти могут быть самыми разными — от простых ионов до высокомолекулярных белков, например антител к разным антигенам [5].
Технологии идентификации различных биомолекул в высокопроизводительном режиме стремительно прогрессируют [2], [6–10]. Совершенствуются и усложняются вычислительные методы обработки «больших данных» [11]. Тем не менее технологический прогресс не отменяет важности баланса омиксных методов и подготовительной клинической работы.
Существенная часть исследований использует в качестве групп сравнения пациентов с заболеваниями (например, со злокачественной опухолью), а в качестве контроля — практически здоровых людей или людей с хроническими патологиями, не имеющими отношения к интересующему заболеванию (в нашем случае — к раку). Иными словами, с помощью омикс-технологий разрабатывают тесты для ранней диагностики — чтобы как можно раньше отличить больных от здоровых, обнаружить заболевание на его ранней стадии [12]. Но всегда ли актуально это сравнение? Какими же свойствами должен обладать биомаркер, чтобы его целесообразно было использовать для ранней первичной диагностики, то есть когда болезнь выявляют впервые?
Я обратил внимание на эту проблему во время работы над грантовыми заявками по фундаментальной медицине [13]. В попытке разработать новые диагностические тесты их авторы часто предлагали сравнивать образцы от пациентов с разными стадиями злокачественных опухолей с пробами от относительно здоровых людей. При этом методы, которыми располагали исследователи, явно плохо соотносились с идеей скрининга — масштабного обследования большого количества здоровых людей для выявления относительно редкого заболевания. Ведь даже самые распространенные злокачественные опухоли, как мы увидим далее, остаются относительно редким явлением.
Что нужно, чтобы тест подходил для ранней диагностики
Не пересказывая учебники, напомню читателю о широко используемых параметрах диагностических тестов — точности, чувствительности и специфичности (см. врезку). Еще одним важным параметром, характеризующим новый тест, служит диагностическая ценность положительного результата (ДЦПР, PPV, positive predictive value) [14]. Она представляет собой отношение числа истинно положительных результатов (когда болезнь найдена верно) к сумме всех положительных результатов, истинных и ложных:

где ДЦПР — диагностическая ценность положительного результата, ИП — число истинно положительных результатов, ЛП — число ложноположительных результатов диагностики.
ДЦПР помогает оценить целесообразность использования теста для повального обследования какой-либо группы людей, то есть скрининга. Ее низкие значения могут сделать диагностический метод затратным и даже небезопасным с точки зрения общей выгоды для обследуемых. Но на этом остановимся чуть ниже.
Представим ситуацию, когда гипотетический омикс-тест (этим термином для краткости обозначим тест, разработанный при помощи геномных и постгеномных технологий) показал выдающиеся результаты и отличает пациентов от условно здоровых людей с чувствительностью и специфичностью 98%. Предположим, что речь идет о распространенной злокачественной опухоли с частотой возникновения в популяции 100 случаев на 100 000 населения: эти числа справедливы, например, для рака предстательной железы в странах-лидерах по заболеваемости им [15]. Подвергнем скринингу эти 100 000 человек. При чувствительности 98% из 100 действительно больных 98 будут правильно диагностированы и лишь двое окажутся пропущенными. При специфичности 98% из 99 900 здоровых людей, которых мы обследуем, диагноз «рак» будет ошибочно поставлен 2%, то есть 1998 из числа обследуемых. Легко рассчитать, что ДЦПР в этом случае составит всего 4,6%, а почти 2 000 человек получат моральный ущерб, и им будет назначено дорогостоящее и, возможно, травматичное обследование (рис. 2). Заметим, что 98-процентные чувствительность и специфичность — параметры, в исследованиях обычно не достижимые.

Рисунок 2. Даже при специфичности диагностики 98% число ложноположительных диагнозов относительно редких заболеваний будет значительным по абсолютному количеству обследуемых. Такие люди, в действительности не имеющие этой болезни, пройдут дорогое и травматичное обследование.
иллюстрация Алены Беляковой
Напрашивается вывод: чтобы омикс-тест был пригоден для ранней диагностики заболевания, требуется выполнение нескольких условий (рис. 3). Во-первых, в случае 100% специфичности ДЦПР автоматически достигнет 100% (см. формулу выше). Это возможно в том случае, когда биомаркер или определенное сочетание биомаркеров выявляется исключительно при патологии, но не в норме, то есть действует качественный принцип «есть или нет». Примером могут служить соматические мутации-водители, возникающие в геноме злокачественной опухоли [16]. Вероятность встретить их в герминативном геноме взрослого человека, не имеющего злокачественной опухоли, исчезающе мала. Если омикс-тесты предполагают обнаружение рака с помощью выявления мутантных последовательностей ДНК, РНК и белка в любом биологическом материале, у этих тестов есть шанс на использование для ранней диагностики.
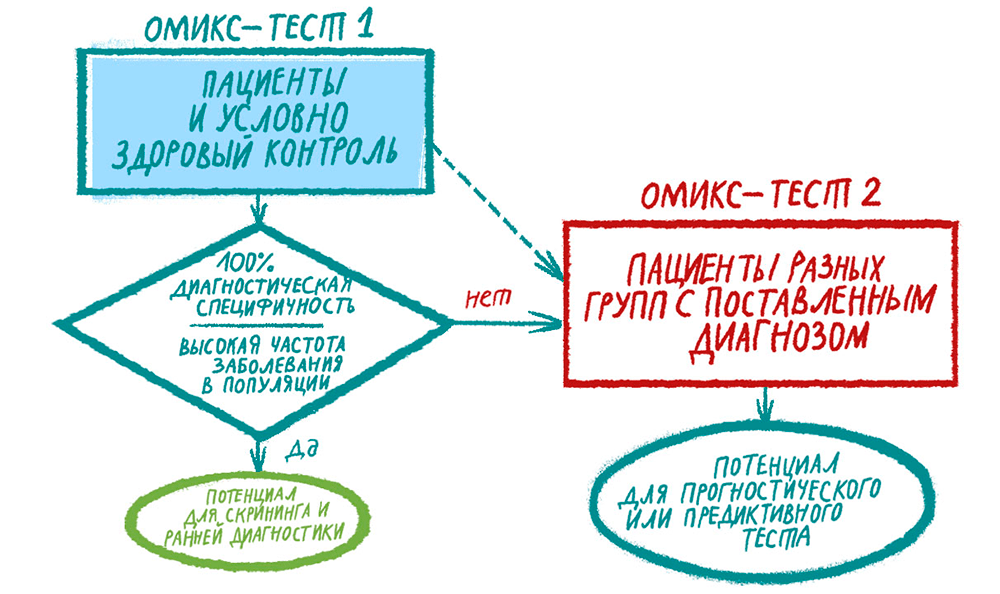
Рисунок 3. Выбор стратегии клинического исследования для разработки омикс-теста. Представлены условия, которые должны быть выполнены, чтобы тест подходил для ранней диагностики. Клинические потребности управляют дизайном исследования: в зависимости от задачи следует выбирать разные когорты обследуемых.
иллюстрация Алены Беляковой
Другим примером веществ, выявление которых претендует на 100-процентную диагностическую специфичность, служат онкометаболиты, синтезирующиеся исключительно в опухолевых клетках из-за мутаций, модифицирующих активность ферментов [17]. Не стоит забывать, что при абсолютной специфичности тест должен сохранять приемлемую диагностическую чувствительность. Отметим, что к сегодняшнему дню до выхода в практику дошли тесты, основанные преимущественно на мутантной опухолевой ДНК. В них также могут анализироваться участки генома с характерным для опухолей гиперметилированием оснований [18]. При этом явлении «отменяется» транскрипция генов-онкосупрессоров.
Например, с некоторыми оговорками скрининговым тестом для колоректального рака можно признать разрешенный к использованию в США тест для анализа кала Cologuard [19]. Этот тест мультиплексный и к тому же сочетает использование различных методов детекции разных молекулярных событий. Он предполагает количественное измерение ДНК с мутацией в гене KRAS, оценку аномального метилирования генов NDRG4, BMP3 и β-актина, а также иммунный анализ на гемоглобин.
Если специфичность теста не абсолютна, его всё же можно использовать для скрининга состояний, более распространенных, чем злокачественные опухоли. Однако высокие показатели заболеваемости характерны для инфекций, принципы диагностики которых обычно хорошо определены и отличаются от омиксных.
В клинике используют ряд биомаркеров для диагностики злокачественных опухолей, которые иногда позиционируют как скрининговые. В таком качестве выступали, например, различные формы простатоспецифического антигена (ПСА), измеряемые в плазме крови, и другие «раковые антигены» (cancer antigens, CA), обнаруженные в 80-е годы прошлого века иммунологическими методами. Однако диагностические характеристики этих молекул таковы, что сегодня они не прошли бы регулирующие инстанции по большинству показаний, по которым их использовали ранее. Поэтому медицинские сообщества в подавляющем большинстве случаев уже не прибегают к оценке «старых» онкомаркеров для ранней диагностики. Например, анализ уровня ПСА теперь не рекомендуют для широкого скрининга рака простаты [20]. Ведущую роль в ранней диагностике многих опухолей играют методы визуализации [21] и другие подходы, в том числе определение врачом сочетаний симптомов.
Омикс-тесты: от ранней диагностики к оценке рисков
В большинстве случаев панели постгеномных биомаркеров дают результаты, которые не позволяют использовать их для ранней диагностики заболеваний. Однако в медицине есть большая сфера, которая крайне нуждается в разработке и использовании биомаркеров. Речь идет о прогностических и предиктивных биомаркерах, приобретающих ценность уже после постановки диагноза [22]. Без таких маркеров сложно представить персонализированную медицину, которая предполагает разделение пациентов с одним диагнозом на группы и рациональный выбор для них разных видов профилактики и лечения [23], [24]. Несмотря на смысловое сходство упомянутых терминов, они служат для различения биомаркеров, прогнозирующих тяжесть заболевания и вероятность рецидива (прогностические), и биомаркеров, предсказывающих ответ на терапию (предиктивные).
Показательна история первых протеомных биомаркеров. В начале 2000-х годов для классификации образцов плазмы крови предложили использовать масс-спектры почти необработанной плазмы, полученные с помощью прямой MALDI-TOF-масс-спектрометрии [25]. Например, в исследовании, в котором я принимал участие в уже далеком 2005 году, сравнивали масс-спектры образцов от здоровых людей и от пациентов с раком яичников [26]. Скоро стало ясно, что, хотя такой анализ и способен распознавать заболевание, его характеристики не подходят для ранней диагностики. Поэтому рассматривать тесты такого рода как скрининговые перестали. Подход справедливо критиковали за работу в формате штрихкода, без идентификации компонентов диагностического профиля, а когда их всё же идентифицировали, они оказались в основном белками неспецифического воспалительного ответа с высокой концентрацией в крови.
Подробно о масс-спектрометрии рассказывает одна из статей нашего спецпроекта «12 биологических методов в картинках» — «Протеомика» [2]. — Ред.
Одна из американских компаний, которой принадлежали патенты на некоторые компоненты масс-спектрометрических профилей плазмы крови при раке яичников, сместила акценты разработок в сторону прогностического теста. Находки, сделанные при помощи MALDI-TOF-профилей, легли в основу разрешенного к использованию теста OVA1, определяющего уровни воспалительных белов и «старого» маркера CA-125 [27]. Такой тест ни в коем случае не рассматривается как скрининговый, а предсказывает риск злокачественности опухоли у пациенток с ранее выявленными (например, в ходе ультразвукового обследования) образованиями в малом тазу. Разумеется, речи о том, чтобы разделять с помощью этого теста больных и здоровых людей, нет. OVA1 помогает определить объем оперативного вмешательства и стратегию лечения. Этот тест не стал незаменимым на рынке из-за открытия уже биохимическими, а не протеомными методами, конкурентного биомаркера — белка HE4 [28]. В сочетании с СА-125 он выполняет аналогичные тесту OVA1 функции в составе дуплексного теста с оригинальным алгоритмом оценки риска ROMA [29]. Этот тест доступен и российским пациентам.
Число выполняемых в нашей стране проектов по созданию диагностических омикс-тестов, как представляется по заявкам, подаваемым в российские научные фонды, растет. Ими нередко управляют специалисты, отвечающие за сложную технологию, то есть физики, химики или биологи, которым помогают врачи. К сожалению, в ряде таких проектов, несмотря на огромные усилия, связанные с технической частью работы, современные приборы и реагенты, бывает некорректно и поверхностно поставлена клиническая задача, которая может оказаться заведомо невыполнимой. Например, для создания диагностического омикс-теста выбирают те опухоли, ранняя диагностика которых уже на достаточном уровне достижима методами визуализации.
В этой статье, где я упоминаю некоторые эпизоды из развития научного направления, в котором участвовал [26], [30], [31], хочется призвать сообщество, занимающееся постгеномными технологиями, эффективно контактировать с просвещенными клиницистами для постановки правильных, современных медицинских задач. Диагностические параметры омикс-анализов, обсуждаемые в этой работе применительно к злокачественным опухолям, относятся к любым неинфекционным заболеваниям, при диагностике которых имеет смысл применять молекулярные тесты. Во многих случаях адекватно поставленные задачи омикс-технологий, в особенности протеомики и метаболомики, связаны с разделением пациентов с уже поставленным диагнозом на группы для более корректного управления заболеванием, оценки рисков и назначения эффективной терапии.
Флагманское исследование по ранней диагностике рака
Уже после того, как первая версия этой статьи была опубликована [32], в журнале Science вышла значимая для направления работа, где для первичной диагностики восьми типов злокачественных опухолей сочетают анализ панели соматических мутаций в циркулирующей в крови ДНК (так называемая жидкая биопсия) и восемь уже применяемых белковых биомаркеров плазмы крови [33].
Сама постановка и результат масштабного исследования, в которое было вовлечено чуть менее 2 000 человек, хорошо согласуется с описанными здесь принципами омикс-эксперимента для первичной диагностики. Все используемые биомаркеры были направлены на достижение максимальной специфичности, а чувствительность — невысокая для отдельных компонентов теста — нарастала за счет множественности (мультиплексности) анализа.
Ассоциированные со злокачественными опухолями мутации тестировали примерно в 2000 положений нуклеотидов в составе 16 наиболее «злостных» раковых генов. Всё это делалось на циркулирующей в кровотоке свободной ДНК, в которой концентрация отдельного мутантного звена на начальных стадиях болезни не превышает одну молекулу на миллилитр. Поэтому для анализа требовалась особо чувствительная мультиплексная ПЦР [34]. Восемь белковых биомаркеров были «экспрессионными», то есть для вклада в диагностику их оценивали не качественно, как соматические мутации, а количественно. Их подбирали из ранее опубликованных работ так, чтобы при любой, даже невысокой чувствительности они при каком-либо пороге отсечения давали высокую специфичность. Как видим, основное в омикс-тесте — это контроль высокой специфичности, а с чувствительностью уже как сложится. Действительно, тест, который назвали CancerSEEK, на внушительной выборке обеспечивал специфичность выше 99%, а его чувствительность сильно варьировала в зависимости от типа опухоли. Она достигала впечатляющих показателей при раке яичников и печени (более 90%), но была намного ниже при раке молочной железы (менее 40%).
В упомянутом исследовании Джошуа Коена в Science проиллюстрирована тактика создания омикс-тестов для первичной диагностики злокачественных опухолей по плазме крови. Если такой тест достигнет рынка, что зависит от результатов его дальнейших проверок и его технических и экономических характеристик, процент выявленных злокачественных опухолей на ранних стадиях возрастет, а значит, большая часть из них будет излечиваться хирургически без дополнительной терапии. В сочетании с успехами в области преодоления иммунологической толерантности в отношении метастатических опухолей (лекарства-ингибиторы иммунного «контрольно-пропускного пункта» [35], различные противоопухолевые вакцины и подобные им способы, например, технология CAR-T [36]), можно ожидать, что в ближайшие десятилетия рак перейдет в разряд заболеваний с высокой вероятностью полного излечения.
Омикс-технологии — это всего лишь инструмент, пусть и изощренный. Работы по поиску биомаркеров, использующие эти технологии, иногда грешат отсутствием в постановке задачи какой-то гипотезы. Дескать, так как мы видим всё, мы всё равно что-нибудь найдем. Недостатки такого подхода могут быть скомпенсированы исключительно «грубой силой», то есть использованием большой выборки пациентов. Если у вас небольшой фундаментальный проект (а таково подавляющее большинство выдаваемых в нашей стране грантов), то лучше ограничить себя проверяемой гипотезой, чем претендовать на исчерпывающий анализ. Даже работа с биомаркерной панелью CancerSEEK, которую я подробно разобрал, по сути, была направленной, а не пыталась осуществить всеобъемлющий анализ. Как мне стало известно, в академическом мире повсеместно отказываются от протеомного и метаболомного профилирования во имя биомаркеров. Сами технические подходы при этом не отвергают (рис. 4), но используют в исследованиях, направляемых какими-либо гипотезами. Например, проекты по «безыдейному» профилированию сейчас, как правило, уже не поддерживаются грантами Общества Макса Планка в Германии и многими другими научными фондами и организациями.
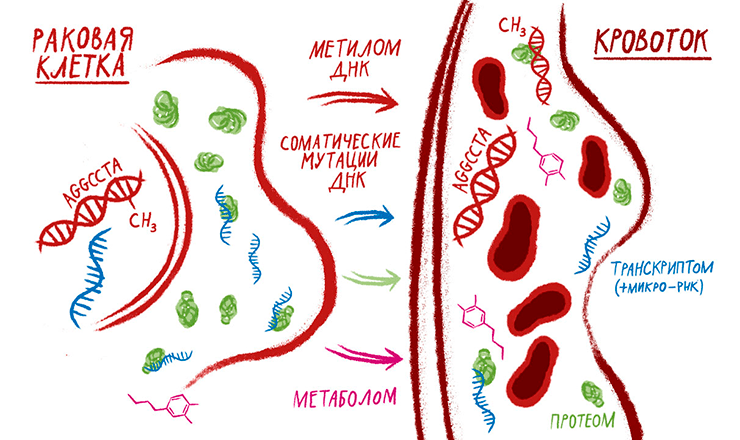
Рисунок 4. Омикс-биомаркеры злокачественных опухолей в плазме крови. Отличительная черта разработки большинства омикс-тестов для диагностики — отсутствие какой-либо гипотезы. Ведь могучая техника позволит нам видеть почти всё — вот маркеры и проявятся! Но наиболее успешными были те проекты, где аналитические методы не «расстреливали» всё подряд по принципу дробовика, а основывались на большом научном заделе. Это панели раковых мутаций, например те, что использовал Джошуа Коен с коллегами [33], составленные по «большим данным» проектов по секвенированию геномов злокачественных опухолей. Большинство известных омикс-технологий сегодня используют для поиска продуктов опухолевых клеток в периферической крови. Это называют геномикой для поиска раковых мутаций в циркулирующей ДНК [18]. В тех же ДНК ищут характерные для опухолей участки гиперметилирования с помощью эпигеномики [37]. Транскриптомику используют для профилирования в плазме крови различных РНК, в особенности микроРНК [38]. Протеомика в формате иммунологических тестов [6] и масс-спектрометрии [2] помогает в поиске белковых биомаркеров. Масс-спектрометрия также способна обнаруживать характерные для рака метаболиты (метаболомика).
иллюстрация Алены Беляковой
По материалам статьи автора, опубликованной в журнале «Биомедицинская химия» [32], с дополнениями.
Литература
- Byong Chul Yoo, Kyung-Hee Kim, Sang Myung Woo, Jae Kyung Myung. (2017). Clinical multi-omics strategies for the effective cancer management. Journal of Proteomics;
- 12 методов в картинках: протеомика;
- P.G. Lokhov, Institute of Biomedical Chemistry, Moscow, Russia, A.V. Lisitsa, A.I. Archakov, Institute of Biomedical Chemistry, Moscow, Russia, Institute of Biomedical Chemistry, Moscow, Russia. (2017). Metabolomic blood test: purpose, implementation and interpretation of data. Biomed Khim. 63, 232-240;
- «Омики» — эпоха большой биологии;
- Как распознать рак при помощи биомаркеров?;
- 12 методов в картинках: иммунологические технологии;
- 12 методов в картинках: проточная цитофлуориметрия;
- 12 методов в картинках: полимеразная цепная реакция;
- 12 методов в картинках: секвенирование нуклеиновых кислот;
- 12 методов в картинках: очистка молекул и разделение смесей;
- 12 методов в картинках: «сухая» биология;
- Ilda Patrícia Ribeiro, Leonor Barroso, Francisco Marques, Joana Barbosa Melo, Isabel Marques Carreira. (2016). Early detection and personalized treatment in oral cancer: the impact of omics approaches. Mol Cytogenet. 9;
- Как подать заявку на грант и не разозлить экспертов;
- Hongchang Shen, Keying Che, Lei Cong, Wei Dong, Tiehong Zhang, et. al.. (2017). Diagnostic and prognostic value of blood samples for KRAS mutation identification in lung cancer: a meta-analysis. Oncotarget. 8;
- Jacques Ferlay, Isabelle Soerjomataram, Rajesh Dikshit, Sultan Eser, Colin Mathers, et. al.. (2015). Cancer incidence and mortality worldwide: Sources, methods and major patterns in GLOBOCAN 2012. Int. J. Cancer. 136, E359-E386;
- Michael S. Lawrence, Petar Stojanov, Craig H. Mermel, James T. Robinson, Levi A. Garraway, et. al.. (2014). Discovery and saturation analysis of cancer genes across 21 tumour types. Nature. 505, 495-501;
- Marco Sciacovelli, Christian Frezza. (2016). Oncometabolites: Unconventional triggers of oncogenic signalling cascades. Free Radical Biology and Medicine. 100, 175-181;
- Геном, транскриптом, метилом и... фрагментом — российские ученые на пути становления новой биомаркерной концепции;
- Thomas F. Imperiale, David F. Ransohoff, Steven H. Itzkowitz, Theodore R. Levin, Philip Lavin, et. al.. (2014). Multitarget Stool DNA Testing for Colorectal-Cancer Screening. N Engl J Med. 370, 1287-1297;
- Axel Heidenreich, Patrick J. Bastian, Joaquim Bellmunt, Michel Bolla, Steven Joniau, et. al.. (2014). EAU Guidelines on Prostate Cancer. Part 1: Screening, Diagnosis, and Local Treatment with Curative Intent—Update 2013. European Urology. 65, 124-137;
- Martina Zanotel, Iliana Bednarova, Viviana Londero, Anna Linda, Michele Lorenzon, et. al.. (2018). Automated breast ultrasound: basic principles and emerging clinical applications. Radiol med. 123, 1-12;
- C.N.A.M. Oldenhuis, S.F. Oosting, J.A. Gietema, E.G.E. de Vries. (2008). Prognostic versus predictive value of biomarkers in oncology. European Journal of Cancer. 44, 946-953;
- И. И. Дедов, А. Н. Тюльпаков, В. П. Чехонин, В. П. Баклаушев, А. И. Арчаков, С. А. Мошковский. (2012). ПЕРСОНАЛИЗИРОВАННАЯ МЕДИЦИНА: СОВРЕМЕННОЕ СОСТОЯНИЕ И ПЕРСПЕКТИВЫ. Vestn. Ross. Akad. Med. Nauk.. 67, 4;
- От медицины для всех — к медицине для каждого!;
- M.A. Karpova, S.A. Moshkovskii, I.Y. Toropygin, A.I. Archakov. (2010). Cancer-specific MALDI-TOF profiles of blood serum and plasma: Biological meaning and perspectives. Journal of Proteomics. 73, 537-551;
- Sergei A. Moshkovskii, Marina V. Serebryakova, Konstantin B. Kuteykin-Teplyakov, Olga V. Tikhonova, Eugene I. Goufman, et. al.. (2005). Ovarian cancer marker of 11.7 kDa detected by proteomics is a serum amyloid A1. Proteomics. 5, 3790-3797;
- Danni Li, Daniel W Chan. (2014). Proteomic cancer biomarkers from discovery to approval: it’s worth the effort. Expert Review of Proteomics. 11, 135-136;
- Jinping Li, Sean Dowdy, Tracy Tipton, Karl Podratz, Wei-Guo Lu, et. al.. (2009). HE4 as a biomarker for ovarian and endometrial cancer management. Expert Review of Molecular Diagnostics. 9, 555-566;
- T Van Gorp, I Cadron, E Despierre, A Daemen, K Leunen, et. al.. (2011). HE4 and CA125 as a diagnostic test in ovarian cancer: prospective validation of the Risk of Ovarian Malignancy Algorithm. Br J Cancer. 104, 863-870;
- Sergei A. Moshkovskii, Maria A. Vlasova, Mikhail A. Pyatnitskiy, Olga V. Tikhonova, Metanat R. Safarova, et. al.. (2007). Acute phase serum amyloid A in ovarian cancer as an important component of proteome diagnostic profiling. Prot. Clin. Appl.. 1, 107-117;
- Sergei A. Moshkovskii, Elizaveta E. Sokolova, Ekaterina V. Brattseva, Maria A. Karpova, Mikhail A. Pyatnitskiy, et. al.. (2011). Proteome and cytokine serum profiling to diagnose a mycosis fungoides. Prot. Clin. Appl.. 5, 432-439;
- S.A. Moshkovskii, Institute of Biomedical Chemistry, Moscow, Russia. (2017). Omics biomarkers and early diagnostics. Biomed Khim. 63, 369-372;
- Joshua D. Cohen, Lu Li, Yuxuan Wang, Christopher Thoburn, Bahman Afsari, et. al.. (2018). Detection and localization of surgically resectable cancers with a multi-analyte blood test. Science. eaar3247;
- 12 методов в картинках: полимеразная цепная реакция;
- Кишечная микрофлора: третий нелишний в иммунотерапии рака;
- CAR-T-клетки, получаемые in situ (in vivo), — путь к удешевлению и широкодоступности технологии?;
- Эпигенетика: невидимый командир генома;
- Обо всех РНК на свете, больших и малых.