Церебральный паралич — нейробиологические механизмы и факторы риска
04 октября 2024
Церебральный паралич — нейробиологические механизмы и факторы риска
- 1649
- 0
- 5
Рисунок в полном размере.
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Церебральный паралич — самая частая причина двигательных нарушений у детей. Основными факторами риска считаются недоношенность, многоплодная беременность и осложнения при родах, но все больше исследований свидетельствует о роли генетики и инфекций. При этом нейробиологические механизмы болезни не описываются в популярной русскоязычной литературе. Данный обзор впервые рассказывает о нейроанатомических нарушениях, сопровождающих развитие церебрального паралича, включая различия между спастической, дискинетической и атаксической формами заболевания.
Конкурс «Био/Мол/Текст»-2024/2025
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2024/2025.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Церебральный паралич (в российской традиции его называют детским, хотя он не исчезает с возрастом) — самая частая причина двигательных нарушений у детей [1]. Вопросу лечения и реабилитации церебрального паралича посвящено достаточно много качественных русскоязычных статей, в первую очередь перевод знаменитого обзора State of the Evidence Traffic Lights 2019: Systematic Review of Interventions for Preventing and Treating Children with Cerebral Palsy от фонда «Обнаженные сердца». С другой стороны, детального, но доступного широкой аудитории описания, какие нарушения в головном мозге приводят к формированию церебрального паралича и конкретной его формы, не существует. Как человек, обладающий одновременно церебральным параличом (подробности здесь и здесь [2]) и ученой степенью в молекулярной нейробиологии, я решил заполнить этот пробел и описать факторы риска и нейробиологические механизмы развития церебрального паралича. В основу моей статьи лег подробный обзор The complex aetiology of cerebral palsy, опубликованный в 2018 году в журнале Nature Reviews Neurology [3]. В качестве краткого резюме моего рассказа очень рекомендую посмотреть вот этот англоязычный ролик на канале Osmosis от издательства Elsevier, а заодно и другие их ролики про множество разных заболеваний.
Эпидемиология и клиническая картина
Мета-анализ 2022 года [4] собрал эпидемиологические данные 27 стран и оценил частоту встречаемости в 3–4 на 1000 живых новорожденных в странах низкого и среднего достатка и в 1,5 на 1000 — в экономически благополучных странах. Однако в последних частота стала расти в конце 20 века из-за увеличения выживаемости недоношенных новорожденных (в первую очередь, благодаря широкому использованию сульфата магния и терапевтической гипотермии) [5].
В Международной классификации болезней 10 пересмотра церебральный паралич под кодом G80 относился к группе заболеваний нервной системы. В новом 11 пересмотре [6] церебральный паралич разделен на несколько отдельных нозологических единиц. Краткое описание согласно Американскому центру контроля заболеваний CDC:
- 8D20. Спастический церебральный паралич — самый частый тип, встречается у 90% пациентов. В этом случае усиливается тонус мышц, из-за чего люди часто ходят на носках с повернутыми внутрь коленями (походка «ножницы», scissors gait). Разделяют спастическую диплегию (ноги поражены больше, чем руки), спастическую гемиплегию (больше поражена одна сторона тела) и спастическую квадриплегию (поражены все конечности и лицо, часто сопровождается когнитивными, речевыми и зрительными нарушениями, эпилепсией).
- 8D21. Дискенетический церебральный паралич (5% случаев) — сложность координировать движения, тонус меняется от ослабленного к повышенному, частые гиперкинезы (непроизвольные движения).
- 8D22. Атаксический церебральный паралич (5% случаев) — нарушение равновесия и координации движений.
Нейробиологические механизмы
Три основные формы ЦП (спастическая, дискинетическая, атаксическая) связаны с повреждениями и нарушениями работы разных областей и систем головного мозга. Систематический обзор 2017 года [6], проведенный командой упомянутой в начале Ионы Новак, собрал воедино данные МРТ двух исследований [7], [8] пациентов с разными формами ЦП (см. таблицу из статьи ниже). Спастические формы характеризуются обширными повреждениями белого вещества, сниженной миелинизацией [9] (покрытием нервных волокон жировой оболочкой для эффективного проведения импульсов) и мозговыми кровоизлияниями (геморрагический инсульт). В мозге есть система центрального торможения (ее первым описал И.М. Сеченов, поэтому в русскоязычной традиции его еще называют «сеченовское торможение») — каждый вышележащий отдел непрерывно подавляет нижележащий, посылая постоянные тормозные сигналы [10]. Такая система очень энергозатратна, но остановить торможение можно гораздо быстрее, чем запускать активацию с нуля — это значительно ускоряет работу мозга. При этом повреждения высших отделов (коры) ослабляют это торможение, в результате чего моторные команды идут чаще, что приводит к усиленному тонусу мышц, характерному для спастического ЦП. Кроме того, для поддержания вертикального положения тела некоторые мышцы должны работать активнее, чем их антагонисты — например, разгибатели стопы. Из-за общего усиления мышечного тонуса нарушается баланс сгибателей и разгибателей, в результате чего люди со спастическим ЦП могут ходить на носках или ставить при шаге всю стопу вместо пятки. Повреждения серого вещества выражены гораздо менее в спастических формах, при этом являются ведущими при дискинетическом ЦП — нарушается структура подкорковых ядер (базальных ганглиев) и таламуса — важных структур, реализующих моторные программы вышележащих корковых центров. В результате при этой форме нарушается координация непроизвольных движений и особенно сильно выражены тремор и гиперкинезы (аналогичные симптомы также вызваны повреждением подкорковых ядер при болезни Паркинсона [11], [12]). Наконец, при атаксическом ЦП структурные нарушения мозга выражены в наименьшей степени и ограничены мозжечком — мозговым центром равновесия и поддержании позы.
| Односторонняя спастическая гемиплегия | Двусторонняя спастическая диплегия | Двусторонняя спастическая квадриплегия | Дискинетический ЦП | Атаксический ЦП |
|---|---|---|---|---|
| Общие двигательные симптомы (Prechtl General Movement Assessment) | ||||
| Бедный репертуар движений или ригидные синхронизированные движения, спонтанные движения небольшой амплитуды и средней скорости, асимметрия сегментных движений (запястья или кисти). Некоторые случаи гемиплегии могут быть пропущены из-за отсутствия двигательных симптомов. |
Ригидные синхронизированные движения, спонтанные движения небольшой амплитуды и средней скорости. | Раннее появление и большая длительность ригидных синхронизированных движений, спонтанные движения небольшой амплитуды и средней скорости. | Бедный репертуар движений, спонтанные движения небольшой амплитуды и средней скорости, круговые движения рук и растопыривание пальцев. | Неизвестно. |
| Нейроанатомия (Данные МРТ-исследований) | ||||
| — Очаговые сосудистые повреждения (24%); — Пороки развития (13%); — Одностороннее кровоизлияние 4 степени с порэнцефалией — Повреждения теменного белого вещества, включая треугольник боковых желудочков; — Инсульт средней мозговой артерии с асимметричной миелинизацией задней ножки внутренней капсулы (PLIC) |
— Двустороннее повреждение белого вещества (31–60%); — Кистозная перивентрикулярная лейкомаляция 2–3 степени с низкой или отсутствующей миелинизацией PLIC; — Средние или тяжелые повреждения белого вещества (перивентрикулярная эхогенность) |
— Повреждения серого вещества (34%); — Пороки развития (16%); — Кистозная перивентрикулярная лейкомаляция 3 степени с отсутствующей миелинизацией PLIC; — Тяжелые повреждения белого вещества, включающие или невключающие подкорковые ядра |
— Повреждения серого вещества (21%), включая таламические и чечевицеобразное ядра | — Пороки развития (18%); — Нормальная МРТ (24%–57%); — Повреждения мозжечка |
| Неврологические симптомы (Шкала неврологического осмотра Хаммерсмита) | ||||
| 50–73 | <50 | <50 <40 при 4–5 ранге по шкале классификации больших моторных нарушений GMFCS |
<50 | Неизвестно |
| Двигательные тесты | ||||
| — Асимметричное предпочтение руки; — Остановка двигательного развития в стадии сидения на полу; — Движение с опорой или шаги постоянно в одном направлении или одна нога постоянно является ведущей; — Обедненный репертуар двигательного поведения |
— Двигательная функция рук лучше по сравнению с нижними конечностями; — Дискомфорт при сидении на полу и его избегание; — Хождение на носках; — Обедненный репертуар двигательного поведения |
— Запрокидывание головы; — Постоянно скругленная спина при сидении с поддержкой; — Обе кисти сжаты в кулаки; — Медленное хватание обеими руками; — Обедненный репертуар двигательного поведения |
— Скрученное положение рук или шеи при произвольных движениях (может быть болезненным); — Сложно держать игрушку по средней линии тела, предпочитает разводить руки на ширину плеч; — Переключает руки, дотягиваясь до предметов; — Требуется намного больше времени для инициации движений; — Произвольные движения и эмоции ухудшают удержание положения; — Обедненный репертуар двигательного поведения |
Неспецифичные |
Нисходящие нервные волокна, начинающиеся в головном мозге, разделяют на пирамидные и экстрапирамидные — об этом просто и наглядно рассказывается в этом ролике. Пирамидные волокна начинаются в коре больших полушарий и отвечают за произвольные движения тела (кортикоспинальные волокна) и головы (кортикобульбарные волокна). Экстрапирамидные волокна начинаются в стволе головного мозга (средний мозг, мост, продолговатый мозг) и отвечают за непроизвольные движения, а также за поддержание позы и равновесия. Спастические формы ЦП вызваны повреждениями коры и нарушением работы пирамидных волокон, поэтому их также называют пирамидными. Атаксические и дискинетические формы вызваны повреждениями соответственно мозжечка и подкорковых ядер, нисходящие волокна которых идут в составе экстрапирамидной системы, поэтому эти две формы называют экстрамирамидными.
Однако нейроанатомические корреляты разных типов ЦП не дают понимания причин их развития — приводит ли повреждение той или иной области к спастической, дискинетической или атаксической форме, или же неврологические и нейроанатомические проявления развиваются параллельно под действием других факторов (генетических, эмбриологических). Так как спастические формы значительно превосходят все остальные по частоте (80–90%), выявить взаимосвязь между разными факторами риска и развития той или иной формы ЦП пока не удается.
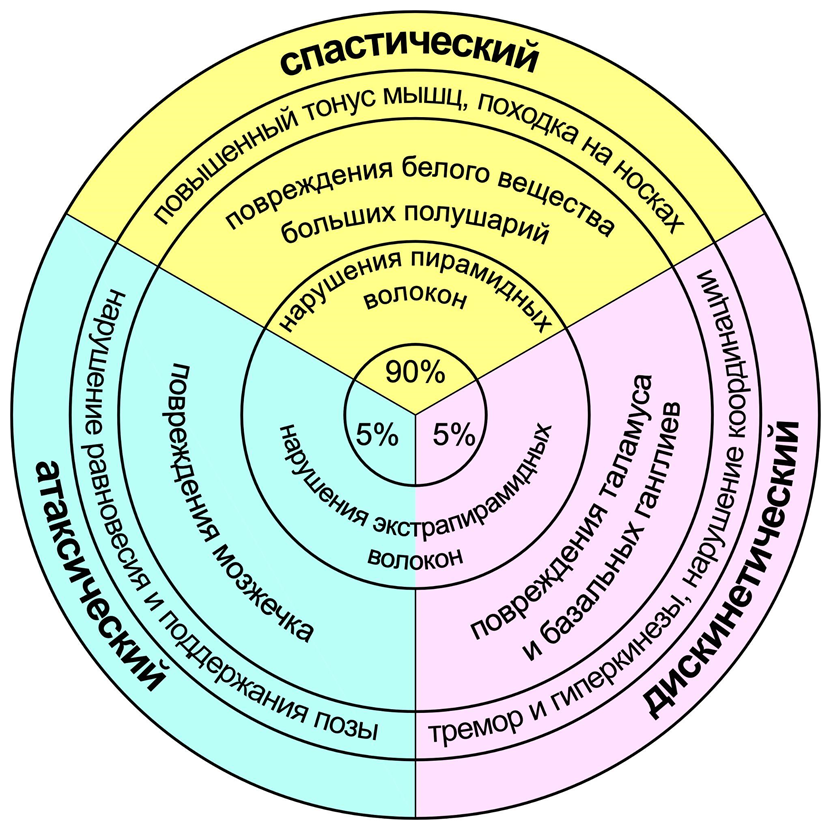
Рисунок 1. На рисунке изображены основные нейробиологические и неврологические проявления разных форм ЦП.
рисунок автора статьи
Факторы риска
Первое описание церебрального паралича (ЦП) было сделано английским врачом Джоном Уильямом Литтлом в 1843 году, в честь чего заболевание какое-то время называли болезнью Литтла. Литтл постулировал две основные причины церебрального паралича — перинатальная асфиксия (удушение) и преждевременные роды. И хотя за прошедшие почти два столетия этимологическая картина стала сложнее, эти причины по-прежнему считаются самыми распространенными.
Осложнения при родах
Первое систематическое изучение влияния фактора родовой травмы на последующий диагноз ЦП было проведено в 1959–1966 годах на 50 тысячах американских новорожденных [13]. Клинические показатели перинатальной асфиксии (низкая ЧСС плода, низкий балл по шкале Апгар, большое время до первого вдоха) наблюдались лишь у небольшого процента детей с ЦП, и наоборот, их присутствие слабо коррелировало с последующим диагнозом. 70% детей с ЦП имели нормальные баллы по шкале Апгар (7 и выше) через пять минут после рождения, а 95% детей с баллами от 0 до 3 и нормальной массой тела при рождении к школьному возрасту не имели значительных симптомов. Результаты свидетельствовали, что перинатальная асфиксия не является ведущей причиной развития ЦП.
То же исследование обнаружило, что достоверным фактором риска является положение плода при родах — если плод не перевернулся головой вперед, это увеличивает риск ЦП, причем как при вагинальных родах, так и при кесаревом сечении, вероятно, отражая нарушения развития, уже имеющиеся у плода к моменту развития.
Недоношенность
В экономически благополучных странах от трети до половины всех детей с ЦП рождаются преждевременно, эта доля меньше в странах с более высокой смертностью недоношенных новорожденных. Рождение до 28 недели увеличивает риск ЦП в 50 раз [14] — он развивается у 10% новорожденных. УЗИ-исследования недоношенных младенцев показали, что основная причина развития ЦП у них — повреждения белого вещества головного мозга, то есть нервных волокон, связывающих разные области мозга друг с другом и с периферией тела.
Механическая вентиляция легких — распространенный метод реабилитации сильно недоношенных новорожденных. Хотя его использование само по себе коррелирует с тяжестью нарушений, эпидемиологические наблюдения и исследования на животных [15—18] (про изучение ЦП в экспериментах у меня есть отдельная статья в блоге) свидетельствуют о том, что механическая вентиляция может вызывать системное воспаление и повреждения легких, что нарушает газообмен в крови и приводит к дополнительной гипоксии мозга. Повышенное содержание факторов воспаления в крови новорожденных в 2–3 раза увеличивает риск развития ЦП у рожденных ранее 28 недель [19] или с массой тела менее 1000 грамм [20]. С другой стороны, у преждевременно родившихся детей часто снижен уровень гормонов щитовидной железы (гипотироксинемия) и это снижение также коррелирует с развитием ЦП и когнитивных нарушений в школьном возрасте, вдвое увеличивая риск ЦП в сравнении с недоношенными детьми без гипотироксинемии [21]. Однако является ли связь между дефицитом тиреоидных гормонов и развитием ЦП причинно-следственной, пока не ясно — нужны клинические испытания [22] с введением гормонов недоношенным детям.
Многоплодная беременность
Среди близнецов риск смерти плода выше в пять раз, риск младенческой смерти выше в семь раз, а риск ЦП выше в четыре раза, чем среди людей, родившихся без сиблингов. Риск ЦП не различается между близнецами, родившимися первыми и вторыми, хотя риск ранней смерти выше у второго. При этом риск ЦП увеличивается при наличии мертворожденного близнеца (на 5%), умершего после рождения близнеца (на 6%) и близнеца с ЦП (на 12%). Хотя значительная часть более высокого риска ЦП среди близнецов обусловлена более ранними родами при многоплодной беременности, даже среди рожденных в срок он выше [23].
Несмотря на то, что ЦП в целом чаще встречается у мальчиков (на 30%), среди однополых и разнополых близнецов риск не различается [23]. Пока непонятно, почему в 88% случаев ЦП развивается только у одного из близнецов, предполагается роль генетики, массы тела и строения плаценты. У дихорионических близнецов каждый плод имеет отдельную амниотическую оболочку (внутреннюю) и отдельную хорионическую оболочку (наружную). Монохорионические близнецы вместе находятся в одной хорионической оболочке, из-за чего менее изолированы, и риск развития ЦП у второго близнеца при таком строении плаценты в 2–3 раза выше [24].
Нарушения беременности
Задержка роста плода (fetal growth restriction) означает, что масса тела при рождении ниже, чем ожидаемая для соответствующего срока. Это состояние увеличивает риск развития ЦП в 4–6 раз для рожденных как раньше срока, так и в срок [25]. Тем не менее, эпидемиологические исследования показывают, что срок родов является более важным фактором риска ЦП, чем масса тела при рождении [26].
Материнские инфекции во время беременности нарушают функционирование плаценты и эмбриональное развитие плода. Это значительно увеличивает риск расстройств нейроразвития — расстройств аутистического спектра [27], СДВГ, шизофрении [28]. Некоторые вирусные инфекции (герпес, цитомегаловирус, краснуха также могут вносить незначительный вклад в развитие ЦП [29]. Акушерские инфекции на поздних сроках беременности (хореоамниотит) увеличивают риск ЦП в два раза у недоношенных и в пять раз у рожденных в срок [30]. Цитомегаловирус, например, может нарушать процессы миграции нейронов в ходе созревания головного мозга, приводя к неврологическим нарушениям [31].
Перинатальный период
Перинатальный период развития включает первый месяц после рождения, и перинатальный ишемический инсульт (чаще всего из-за тромба в средней мозговой артерии) вносит значительный вклад в развитие ЦП у младенцев, рожденных в срок, особенно с гемиплегической формой [32]. Причины перинатального инсульта плохо изучены, ученые предполагают роль врожденного порока сердца, бактериальных и вирусных менингитов, хориоамниотита и тромбоза плаценты, преэклампсии и задержки роста плода [33].
Генетика
Уже в 21 веке ряд исследователей стали выражать предположения, что некоторые генетические варианты (полиморфизмы генов) могут увеличивать риск и тяжесть ЦП. Обзор генетических факторов ЦП 2017 года [34] ссылается на эпидемиологические исследования, оценивающие долю генетически детерминированных случаев в 30%. Как и в подавляющем большинстве заболеваний [35–37], не существует какого-то «гена церебрального паралича», а сотни генов вносят исчезающе малый вклад по отдельности, накладываясь на разнообразные негенетические факторы риска. Именно генетическое разнообразие может лежать в основе слабой взаимосвязи перинатальной асфиксии и последующего развития ЦП.
Самый изученный ген в контексте предрасположенности к ЦП — это ген аполипопротеина Е (АроЕ), который широко известен в первую очередь как фактор риска развития поздней формы болезни Альцгеймера [38] (с ранней формой связаны другие гены — APP, PS1, PS2). Несколько эпидемиологических исследований в разных странах обнаружили, что некоторые полиморфизмы этого гена увеличивают тяжесть симптомов ЦП, в то время как другие ее снижают [39], [40]. Другие исследования предположили связь генов, отвечающих за свертывание крови, с риском внутриутробного инсульта, но пока она остается под вопросом [41].
Мета-анализ 16 исследований 2017 года [42] проанализировал полиморфизмы 13 генов, включая АроЕ, факторы свертывания крови и факторы воспаления, и нашел достоверную связь только с интерлейкином-6, одним из ключевых воспалительных факторов иммунной системы. Процессы воспаления играют важную роль в развитии самого широкого спектра заболеваний, включая неврологические и психические [43].
Активно продолжаются [34] исследования роли генов, участвующих в формировании синаптических контактов между нейронами (ZC4H2 [44]), метаболизме нейромедиаторов глутамата и ГАМК [45], клеточного каркаса (ADD3 [46]), расположения глутаматных АМРА рецепторов на клеточной мембране (АР4 [47]).
Заключение
Перечисленные факторы не являются взаимоисключающими, и исследования показывают, что их наложение увеличивает риск развития ЦП — неонатальное воспаление вместе с недоношенностью или пренатальным воспалением [48]; недоношенность и задержка роста плода вместе с механической вентиляцией легких [49]. С другой стороны, некоторые исследования связывают те или иные факторы риска с развитием конкретных форм ЦП, так уже упоминалась особенно сильная связь постнатального инсульта у рожденных в срок младенцев с развитием гемиплегии [32]. Кроме того, развитие сопутствующих когнитивных нарушений и эпилепсии, согласно некоторым исследованиям, более вероятно при гемиплегии, чем при других формах [50].
Однако из-за того, что диагноз ЦП многие дети получают только в возрасте двух лет, к этому времени часто трудно ретроспективно восстановить детали протекания беременности и родов, что осложняет реконструкцию причинно-следственных связей. Еще сложнее ситуация с факторами риска, не связанными напрямую с беременностью (здоровье и возраст матери, генетика, загрязнение окружающей среды) — для этого необходимы масштабные проспективные исследования с отслеживанием судьбы родившихся детей в течение первых лет жизни. На сегодняшний день понимание факторов риска ЦП не помогает снижать эти риски, поэтому пока более эффективной выглядит стратегия разработки терапевтических методов снижения пагубных эффектов недоношенности, перинатальной асфиксии и осложнений беременности, также дальнейшее изучение генетических факторов риска. Введение в практику сульфата магния [51] и гипотермии [52] стало резким прорывом в неонатологии младенцев, родившихся недоношенными или с асфиксией. Однако формирование больших биобанков с биологическими образцами матерей и новорожденных, развитие медицинской генетики [53] и вычислительных мощностей, формирование больших международных исследовательских коллабораций вселяет надежду в значительный прогресс не только в нашем понимании нейробиологии церебрального паралича.
Литература
- От двигательных расстройств до шизофрении: тесная связь дофаминовых рецепторов и фосфодиэстераз;
- I worried my cerebral palsy would halt my progress in science—but I found a path forward — American Association for the Advancement of Science (AAAS);
- Steven J. Korzeniewski, Jaime Slaughter, Madeleine Lenski, Peterson Haak, Nigel Paneth. (2018). The complex aetiology of cerebral palsy. Nat Rev Neurol. 14, 528-543;
- Sarah McIntyre, Shona Goldsmith, Annabel Webb, Virginie Ehlinger, Sandra Julsen Hollung, et. al.. (2022). Global prevalence of cerebral palsy: A systematic analysis. Develop Med Child Neuro. 64, 1494-1506;
- Vidya Bhushan, Nigel Paneth, John L. Kiely. (1993). Impact of Improved Survival of Very Low Birth Weight Infants on Recent Secular Trends in the Prevalence of Cerebral Palsy. Pediatrics. 91, 1094-1100;
- Iona Novak, Cathy Morgan, Lars Adde, James Blackman, Roslyn N. Boyd, et. al.. (2017). Early, Accurate Diagnosis and Early Intervention in Cerebral Palsy. JAMA Pediatr. 171, 897;
- Susan M Reid, Charuta D Dagia, Michael R Ditchfield, John B Carlin, Dinah S Reddihough. (2014). Population‐based studies of brain imaging patterns in cerebral palsy. Develop Med Child Neuro. 56, 222-232;
- Linda S. de Vries, Ingrid C. van Haastert, Manon J.N.L. Benders, Floris Groenendaal. (2011). Myth: Cerebral palsy cannot be predicted by neonatal brain imaging. Seminars in Fetal and Neonatal Medicine. 16, 279-287;
- Обёртка для аксона;
- Спокоен как GABA;
- Белок альфа-синуклеин — важный участник проявления болезни Паркинсона?;
- Болезнь Паркинсона и астроциты: новый взгляд на лечение нейродегенеративных заболеваний;
- Karin B. Nelson, Jonas H. Ellenberg. (1986). Antecedents of Cerebral Palsy. N Engl J Med. 315, 81-86;
- K Himmelmann, G Hagberg, P Uvebrant. (2010). The changing panorama of cerebral palsy in Sweden. X. Prevalence and origin in the birth‐year period 1999–2002. Acta Paediatrica. 99, 1337-1343;
- Трансляционные исследования в нейробиологии;
- Модельные организмы: грызуны;
- Грызун особого назначения;
- Мышь против всех болячек;
- Karl C. K. Kuban, T. Michael O’Shea, Elizabeth N. Allred, Nigel Paneth, Deborah Hirtz, et. al.. (2014). Systemic Inflammation and Cerebral Palsy Risk in Extremely Preterm Infants. J Child Neurol. 29, 1692-1698;
- Waldemar A. Carlo, Scott A. McDonald, Jon E. Tyson, Barbara J. Stoll, Richard A. Ehrenkranz, et. al.. (2011). Cytokines and Neurodevelopmental Outcomes in Extremely Low Birth Weight Infants. The Journal of Pediatrics. 159, 919-925.e3;
- Mary Lynne Reuss, Nigel Paneth, Jennifer A. Pinto-Martin, John M. Lorenz, Mervyn Susser. (1996). The Relation of Transient Hypothyroxinemia in Preterm Infants to Neurologic Development at Two Years of Age. N Engl J Med. 334, 821-827;
- https://biomolecula.ru/specials/clinical-trials;
- Ann I Scher, Bev Petterson, Eve Blair, Jonas H Ellenberg, Judy K Grether, et. al.. (2002). The Risk of Mortality or Cerebral Palsy in Twins: A Collaborative Population-Based Study. Pediatr Res. 52, 671-681;
- Minakami H., Honma Y., Matsubara S., Uchida A., Shiraishi H., Sato I. (1999). Effects of placental chorionicity on outcome in twin pregnancies. A cohort study. The Journal of Reproductive Medicine. 44, 595–600;
- Stephen Jarvis, Svetlana V Glinianaia, Maria-Giulia Torrioli, Mary-Jane Platt, Maria Miceli, et. al.. (2003). Cerebral palsy and intrauterine growth in single births: European collaborative study. The Lancet. 362, 1106-1111;
- E Blair. (1996). The undesirable consequences of controlling for birth weight in perinatal epidemiological studies.. Journal of Epidemiology & Community Health. 50, 559-563;
- Расстройство аутистического спектра: «дети дождя»;
- Болезнь потерянных связей;
- Schendel D.E. (2001). Infection in pregnancy and cerebral palsy. Journal of the American Medical Women's Association. 56, 105–108;
- Yvonne W. Wu, John M. Colford, Jr. (2000). Chorioamnionitis as a Risk Factor for Cerebral Palsy. JAMA. 284, 1417;
- M‐L Engman, I Lewensohn‐Fuchs, M Mosskin, G Malm. (2010). Congenital cytomegalovirus infection: the impact of cerebral cortical malformations. Acta Paediatrica. 99, 1344-1349;
- PAUL UVEBRANT. (1988). HEMIPLEGIC CEREBRAL PALSY AETIOLOGY AND OUTCOME. Acta Paediatrica. 77, 1-100;
- C. Li, J. K. Miao, Y. Xu, Y. Y. Hua, Q. Ma, et. al.. (2017). Prenatal, perinatal and neonatal risk factors for perinatal arterial ischaemic stroke: a systematic review and meta‐analysis. Euro J of Neurology. 24, 1006-1015;
- Michael C Fahey, Alastair H Maclennan, Doris Kretzschmar, Jozef Gecz, Michael C Kruer. (2017). The genetic basis of cerebral palsy. Develop Med Child Neuro. 59, 462-469;
- GWAS и психогенетика: консорциумы в поисках ассоциаций;
- Диагностика РАС и генетика;
- Гены и безумие: генетическое тестирование в психиатрии;
- Alberto Serrano-Pozo, Sudeshna Das, Bradley T Hyman. (2021). APOE and Alzheimer's disease: advances in genetics, pathophysiology, and therapeutic approaches. The Lancet Neurology. 20, 68-80;
- Espen Lien, Guro L Andersen, Yongde Bao, Heather Gordish‐Dressman, Jon S Skranes, et. al.. (2013). Apolipoprotein
E polymorphisms and severity of cerebral palsy: a cross‐sectional study in 255 children inN orway. Develop Med Child Neuro. 55, 372-377; - Espen Lien, Guro Andersen, Yongde Bao, Heather Gordish‐Dressman, Jon S. Skranes, et. al.. (2015). Genes determining the severity of cerebral palsy: the role of single nucleotide polymorphisms on the amount and structure of apolipoprotein E. Acta Paediatrica. 104, 701-706;
- The South Australian Cerebral Palsy Research Group, M. E. O’Callaghan, A. H. MacLennan, E. A. Haan, G. Dekker. (2009). The genomic basis of cerebral palsy: a HuGE systematic literature review. Hum Genet. 126, 149-172;
- DE WU, YAN-FENG ZOU, XIAO-YAN XU, XIAO-LIANG FENG, LI YANG, et. al.. (2011). The association of genetic polymorphisms with cerebral palsy: a meta-analysis. Developmental Medicine & Child Neurology. 53, 217-225;
- Воспаленный рассудок;
- Hiromi Hirata, Indrajit Nanda, Anne van Riesen, Gai McMichael, Hao Hu, et. al.. (2013). ZC4H2 Mutations Are Associated with Arthrogryposis Multiplex Congenita and Intellectual Disability through Impairment of Central and Peripheral Synaptic Plasticity. The American Journal of Human Genetics. 92, 681-695;
- Clare N Lynex, Ian M Carr, Jack P Leek, Rajgopal Achuthan, Simon Mitchell, et. al.. (2004). Homozygosity for a missense mutation in the 67 kDa isoform of glutamate decarboxylase in a family with autosomal recessive spastic cerebral palsy: parallels with Stiff-Person Syndrome and other movement disorders. BMC Neurol. 4;
- Michael C. Kruer, Tyler Jepperson, Sudeshna Dutta, Robert D. Steiner, Ellen Cottenie, et. al.. (2013). Mutations in gamma adducin are associated with inherited cerebral palsy. Annals of Neurology. 74, 805-814;
- Annemieke J.M.H. Verkerk, Rachel Schot, Belinda Dumee, Karlijn Schellekens, Sigrid Swagemakers, et. al.. (2009). Mutation in the AP4M1 Gene Provides a Model for Neuroaxonal Injury in Cerebral Palsy. The American Journal of Human Genetics. 85, 40-52;
- ; for the ELGAN Study Investigators, Alan Leviton, Raina N. Fichorova, T. Michael O’Shea, Karl Kuban, et. al.. (2013). Two-hit model of brain damage in the very preterm newborn: small for gestational age and postnatal systemic inflammation. Pediatr Res. 73, 362-370;
- Michael P Collins, John M Lorenz, James R Jetton, Nigel Paneth. (2001). Hypocapnia and Other Ventilation-Related Risk Factors for Cerebral Palsy in Low Birth Weight Infants. Pediatr Res. 50, 712-719;
- Yukihiro Kitai, Kazuhiro Haginoya, Satori Hirai, Kayo Ohmura, Kaeko Ogura, et. al.. (2016). Outcome of hemiplegic cerebral palsy born at term depends on its etiology. Brain and Development. 38, 267-273;
- Agustín Conde-Agudelo, Roberto Romero. (2009). Antenatal magnesium sulfate for the prevention of cerebral palsy in preterm infants less than 34 weeks' gestation: a systematic review and metaanalysis. American Journal of Obstetrics and Gynecology. 200, 595-609;
- Susan E Jacobs, Marie Berg, Rod Hunt, William O Tarnow-Mordi, Terrie E Inder, Peter G Davis. (2013). Cooling for newborns with hypoxic ischaemic encephalopathy. Cochrane Database of Systematic Reviews;
- Настоящее и будущее генетических тестов.