
Чем заедать тоску? Механизмы антидепрессивного действия средиземноморской и кетогенной диет
30 декабря 2020
Чем заедать тоску? Механизмы антидепрессивного действия средиземноморской и кетогенной диет
- 4385
- 5
- 13
Рисунок в оригинальном разрешении
иллюстрация Софии Смоленской
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Депрессия остается самым распространенным психическим расстройством, при этом за последние 40 лет психофармакология практически не продвинулась в ее лечении — больше трети пациентов не помогают никакие современные антидепрессанты. В последние годы всё больше заболеваний связывают с нарушениями gut-brain axis — взаимодействия головного мозга с кишечником. В связи с этим большие надежды в лечении депрессии возлагают на нефармакологическое воздействие с помощью различных диет. В этой статье рассматриваются основные физиологические механизмы антидепрессивного действия средиземноморской и кетогенной диет.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2020/2021.

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
История лечения депрессии
По данным Всемирной организации здравоохранения, на 2017 год 264 миллиона человек в мире страдает депрессией, что делает ее самым распространенным психическим расстройством [1]. Несмотря на грандиозный скачок в нашем понимании физиологических механизмов депрессии за последние полвека и широкий арсенал антидепрессантов [2], до сих пор около 40% пациентов существующие препараты не помогают [3]. В первой половине ХХ века депрессию лечили опиатами, вызывающими сильную зависимость, в 50-х годах появились первые антидепрессанты — ингибиторы моноаминоксидазы (МАО). МАО — это фермент, разрушающий нейромедиаторы дофамин [4], серотонин [5] и норадреналин [6] в синаптических контактах системы вознаграждения. Одновременно появился и второй класс традиционных антидепрессантов — трициклические. Они подавляют не расщепление нейромедиаторов, а их удаление из синаптической щели [7], и, кроме того, связываются с рецепторами серотонина [8]. Оба класса препаратов создают условия, в которых нейромедиаторы [9] (вещества, посредством которых общаются нейроны) действуют на рецепторы дольше, а это усиливает работу центров, отвечающих за положительные эмоции (рис. 1).
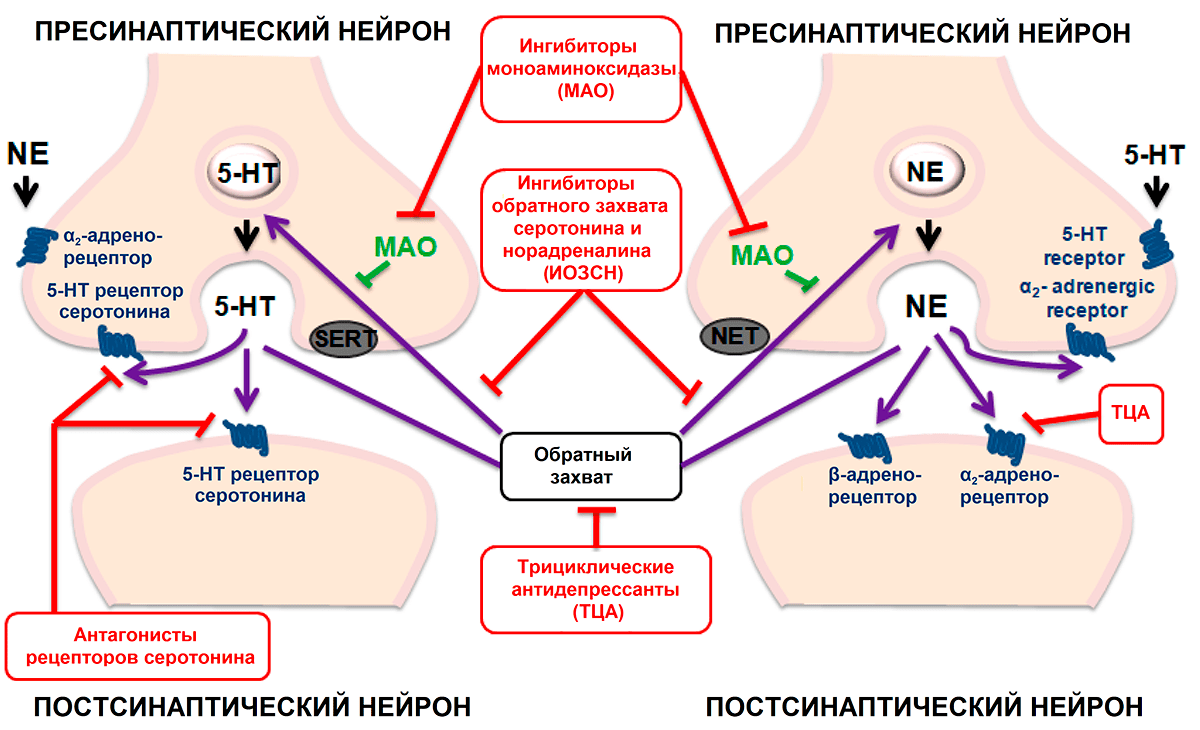
Рисунок 1. Механизм действия классических антидепрессантов. Ингибиторы моноаминоксидазы (МАО) подавляют ферментативное расщепление нейромедиатора в синаптической щели. Ингибиторы обратного захвата серотонина и норадреналина подавляют активность переносчиков серотонина (SERT) и норадреналина (NET). Трициклические антидепрессанты подавляют обратный захват серотонина и норадреналина, а также связываются с их рецепторами.
Однако широкий спектр молекул-мишеней [10] приводил к различным побочным эффектам, и в конце 1970-х появились более специфичные селективные ингибиторы обратного захвата серотонина (СИОЗС, SSRI), норадреналина (СИОЗН, NRI) или их обоих (СИОЗСиН, SNRI)). Спустя 40 лет СИОЗС (флуоксетин, пароксетин, сертралин, циталопрам, эсциталопрам) остаются самым распространенным классом антидепрессантов, а существенных прорывов в фармакологии депрессии за это время почти не было. Исключением стали разработанные в начале XXI века быстрые антидепрессанты, действующие на рецепторы не моноаминов (дофамина, серотонина или норадреналина), а глутамата [11]. Один из них — эскетамин — в 2020 году получил разрешение FDA для лечения депрессии [12]. В западных странах активно ведутся исследования по использованию в качестве антидепрессантов каннабиноидов [13] и псилоцибина [14], запрещенных к использованию и распространению на территории Российской Федерации [15], [16].
Отсутствие существенного прогресса в фармакологических подходах [17] к лечению депрессии заставило ученых обратить свой взгляд на нефармакологические пути воздействия [18] на лимбическую систему — комплекс структур мозга, отвечающий за мотивацию и эмоции, так же как и за их вегетативные проявления. Так, в начале XXI века стали бурно развиваться исследования microbiome-gut-brain axis, то есть взаимодействия между головным мозгом, кишечником и живущими в нем микроорганизмами. В этой статье рассказывается об эффективности использования диет для терапии депрессии и об известных физиологических механизмах этого действия.
Вещества, поступающие в организм с пищей, демонстрируют широкий спектр эффектов не только на метаболизм и заболевания внутренних органов, но и на поведение и психические расстройства. Ожирение и депрессия связаны тесной двусторонней зависимостью: метаанализ показал, что присутствие одного заболевания существенно увеличивает риск другого (депрессия → ожирение на 37%; ожирение → депрессия на 18%) [19]. В основе этой связи лежат как психологические причины (с одной стороны, стремление «заесть» стресс при депрессии, с другой стороны, неудовлетворенность своим телом и осуждение общества при ожирении), так и общие физиологические механизмы (рис. 2) [20]. В связи с этим диета кажется перспективным подходом, помогающим справиться одновременно и с избыточным весом/ожирением, и с депрессией.
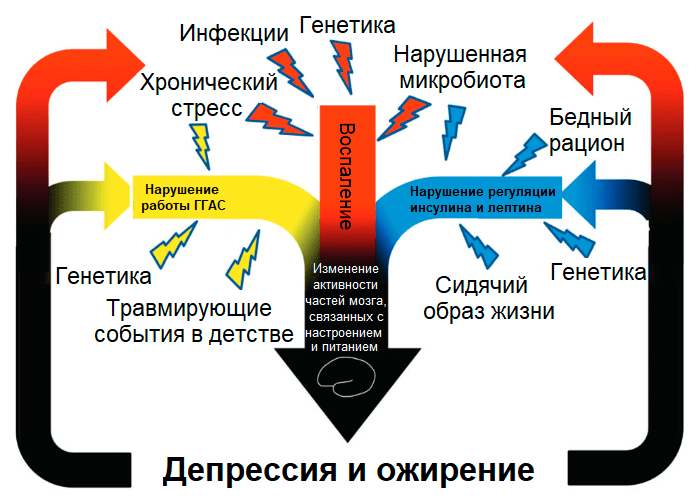
Рисунок 2. Общие факторы риска депрессии и ожирения приводят к высокой степени коморбидности (сопутствующего течения) обоих расстройств. Предполагается, что диеты могут оказывать одновременный терапевтический эффект как на метаболические нарушения, так и на психические расстройства.
Механизмы патогенеза депрессии
Чтобы понять, через какие механизмы принимаемая пища может влиять на наше поведение, эмоциональное состояние и психические расстройства, сначала необходимо в общих чертах описать патогенез депрессии. О причинах депрессии мы говорить не будем: есть психосоциальные факторы, есть сугубо физиологические факторы, есть даже генетическая предрасположенность [21] (ее оценивают в 37% [22], хотя известные гены [23] пока объясняют лишь 8–9% [24]). Сосредоточимся на изменениях, происходящих в организме человека, страдающего депрессией. Их можно объединить в пять моделей депрессии — моноаминовую, нейроэндокринную, нейротрофическую, нейровоспалительную и глутаматную. Рассмотрим их подробнее, а затем обсудим, как поступающие с пищей вещества могут влиять на эти механизмы, ослабляя или усиливая депрессивные симптомы.
Моноаминовая гипотеза стала первой моделью депрессии. Она была сформулирована в 1965 году [25] и основывалась на успешном применении трициклических антидепрессантов и ингибиторов моноаминоксидазы [26]. Нарушение работы моноаминовых структур мозга у пациентов с депрессией было многократно подтверждено посмертно (снижение содержания моноаминов в мозге) и прижизненно (снижение активности областей мозга на МРТ), так же как и в десятках различных моделей на экспериментальных животных [27].
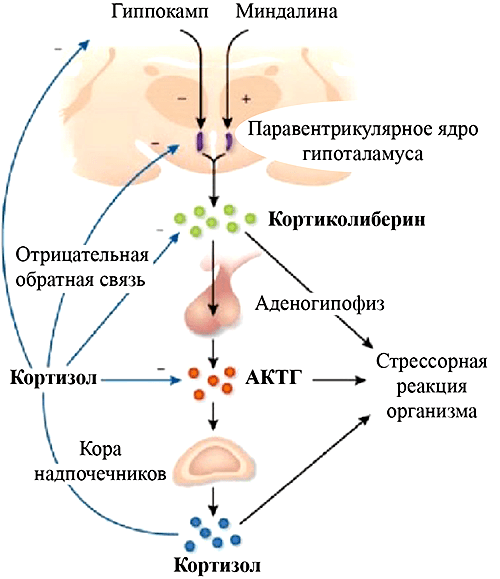
Рисунок 3. Схема гипоталамо-гипофизарно-адренокортикальной системы и ее регуляции
Нейроэндокринная модель основана на описанной в 1940-х годах ведущей роли гормонов надпочечников адреналина и кортизола в реализации соответственно острой и хронической стрессорной реакции организма [28]. Так как депрессия является основным психическим расстройством, ассоциированным с сильным стрессом, неудивительно, что нарушение работы этих систем занимает центральную роль в ее патогенезе. Негативные стимулы (психологические и физиологические) через структуры лимбической системы (прежде всего амигдалу) активируют систему «гипоталамус — гипофиз — кора надпочечников» (далее ГГАС — гипоталамо-гипофизарно-адренокортикальная система), что приводит к секреции кортизола. Это гормон, усиливающий питание нейронов глюкозой, чтобы они поскорее придумали, как бы выбраться из этой неприятной ситуации. В норме тот же кортизол подавляет активность ГГАС в виде отрицательной обратной связи — ключевого механизма саморегуляции биологических систем. Делает это кортизол в основном не напрямую, а через гиппокамп — там он связывается с рецепторами на нейронах, а они посылают тормозные ГАМК-ергические проекции в гипоталамус, подавляя его активность (рис. 3). При депрессии количество этих рецепторов снижается, и обратная связь нарушается — кортизола в крови много, но при длительном действии он уже не помогает нейронам, а, наоборот, нарушает их работу [29].
Нейротрофическая модель непосредственно связана с нейроэндокринной. В том же 1965 году выяснилось, что в гиппокампе в течение жизни могут образовываться новые нейроны [30], [31] (в 1993 году вторая такая зона была обнаружена в стенках боковых желудочков мозга). А раз гиппокамп играет ключевую роль в подавлении активности ГГАС, то нейрогенез может поддерживать эту функцию, а значит, быть мишенью для антидепрессантов. Нейрогенез действительно снижается в гиппокампе пациентов с депрессией и у модельных животных, в то время как антидепрессанты, хоть и не все, его восстанавливают [32]. У мышей и крыс нейрогенез в гиппокампе оценивают посмертно, у людей же с депрессией изучать его напрямую можно только у жертв суицида [33], а прижизненно его можно оценить по изменению объема гиппокампа на МРТ. Косвенно о нем можно судить по содержанию в крови и спинномозговой жидкости нейротрофического фактора BDNF — ключевого регулятора деления, созревания и дифференцировки нервных клеток [34]. Оно снижается у пациентов с депрессией и возвращается к нормальному уровню после приема антидепрессантов [35]. Другая (можно даже сказать основная) функция гиппокампа — консолидация памяти (то есть перевод информации из кратковременной памяти в долговременную), поэтому у людей в депрессии часто не только подавленное настроение, но и проблемы с запоминанием новой информации и рассеянность.
Нейровоспалительная модель депрессии была предложена в конце XX века. Хотя теория общего адаптационного синдрома Ганса Селье описывает подавление иммунитета среди трех основных признаков хронического стресса, воспалительные реакции в нервной системе играют важную роль в патогенезе депрессии. По современным представлениям, острый стресс и кратковременное увеличение уровня кортизола тормозит работу иммунных органов и клеток, в то время как на фоне хронического стресса всё происходит наоборот. При длительном подъеме кортизола чувствительность к нему (то есть количество и работа рецепторов) снижается не только в структурах мозга, но и в иммунной системе, а это приводит к усилению воспалительных процессов.
Воспалительный ответ при депрессии и подавленное эмоциональное состояние во время болезни (sickness behavior) отражают двухстороннюю связь между воспалением и депрессией [36]. Предполагается, что в нашем эволюционном прошлом sickness behavior (сложно подобрать русский аналог) способствовало экономии энергии для борьбы с инфекцией и заживлением ран посредством усиления тревожности и снижения социальной и исследовательской активности. Однако агрессивная и полная опасности среда осталась в прошлом, а исправно работающие иммунные механизмы теперь оборачиваются с одной стороны аллергиями и аутоиммунными заболеваниями, а с другой психическими расстройствами [37]. В мозге воспалительные реакции [38] опосредуются не лейкоцитами, как в крови и периферических тканях, а глиальными клетками нервной ткани — астроцитами и микроглией. Они выделяют цитокины (гормоны иммунной системы), которые помогают нашему организму бороться с внешними опасностями. Повышенное содержание провоспалительных цитокинов обнаруживается как в крови пациентов с депрессией, так и в мозге жертв суицида. Прием антидепрессантов, в свою очередь, нормализует уровень провоспалительных цитокинов, а их повышенное содержание в крови может быть маркером фармакорезистентной депрессии.
Процессы нейровоспаления тесно связаны с другими ключевыми механизмами депрессии. В физиологических условиях микроглия выполняет ряд функций, не связанных напрямую с иммунной защитой от патогенов. Будучи родственниками макрофагов крови, микроглиальные клетки фагоцитируют мертвые нейроны и глию. Другая важнейшая роль микроглии — регуляция синаптических контактов. Хорошо известно, что пластичность мозга и процессы памяти во многом обусловлены постоянным образованием новых синаптических связей и усилением работающих синапсов (долговременная потенциация) наряду с ослаблением и исчезновением неработающих. Один из механизмов элиминации синапсов — фагоцитоз микроглией дендритных шипиков (мельчайших отростков, которыми нейроны образуют контакты с аксонами других нейронов). С другой стороны избирательный фагоцитоз направляет нейрогенез в гиппокампе [39], регулируя выживаемость и апоптоз вновь образованных нейронов (рис. 4). Однако избыточная активация микроглии может полностью подавить этот важный процесс, приводя к нарушениям нейрогормональной регуляции, нейропластичности и памяти при ряде психических расстройств. В свою очередь фармакологическое подавление гиперактивной микроглии может помогать при некоторых формах депрессии [40].
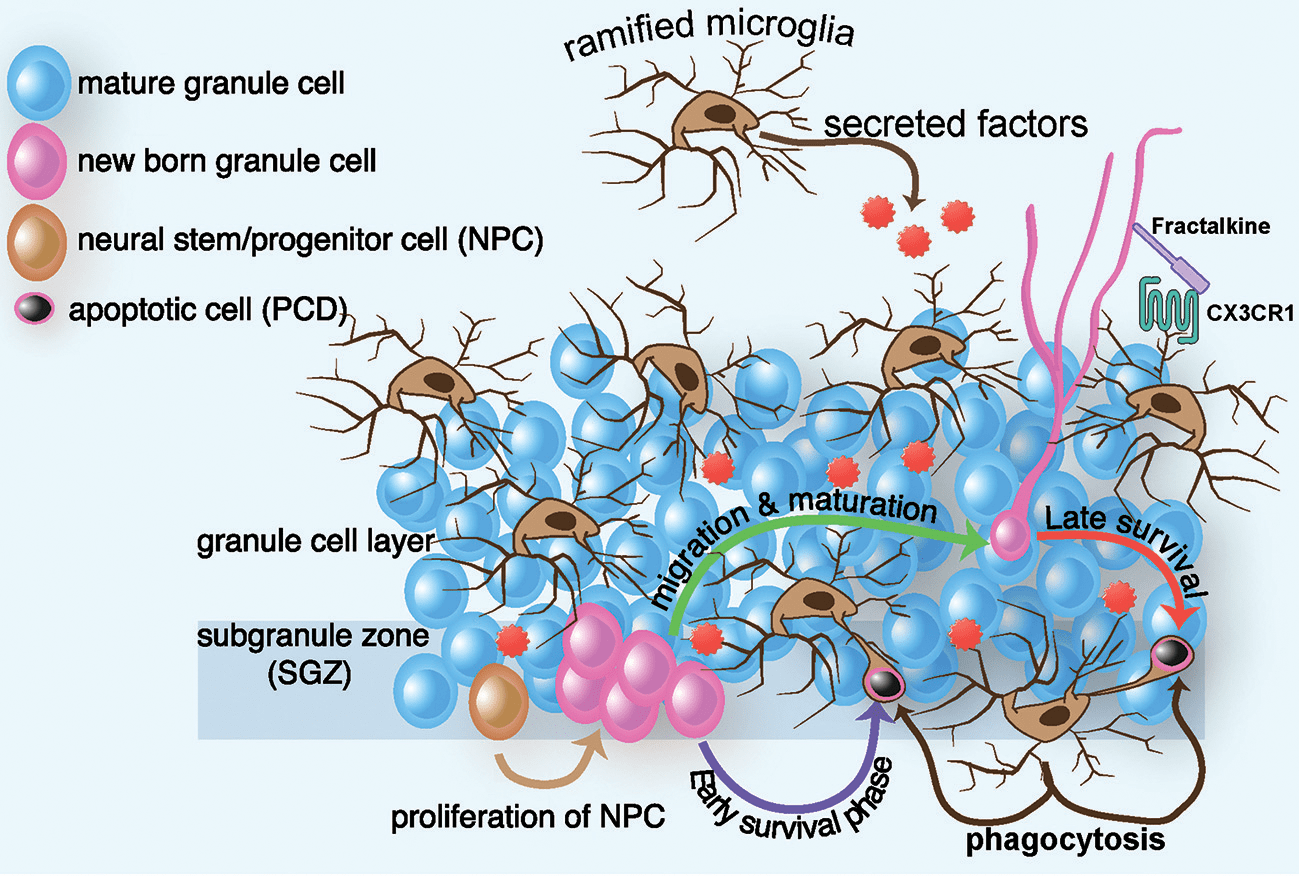
Рисунок 4. Схема нейрогенеза в гиппокампе и участии в нем микроглии. Нейрогенез начинается с нервных стволовых клеток (neural progenitor cells, NPC — коричневая клетка). 1 стадия — их деление в субгранулярной зоне зубчатой извилины гиппокампа. 2 — выживание, большая часть образовавшихся клеток (красные) погибает. Микроглия (коричневые разветвленные клетки) запускает апоптоз образовавшихся клеток (за счет секреции регуляторных факторов) и фагоцитирует умирающие. 3 — миграция созревающих нейронов в другие области гиппокампа. 4 — дифференцировка зрелых нейронов (синие клетки) в клетки разных типов (возбуждающие пирамидные нейроны, тормозные интернейроны).
Глутаматная модель депрессии основана на антидепрессивном эффекте блокатора глутаматных NMDA-рецепторов кетамина и его производного эскетамина. Похожая история произошла с нашим пониманием механизмов шизофрении [41] — изначально господствовала дофаминовая модель, но позже стало ясно, что глутаматергическая система играет не менее важную роль.
Как видно, все эти механизмы патогенеза депрессии тесно связаны друг с другом. Это подтверждается и множественными эффектами антидепрессантов, которые не только усиливают работу моноаминовых систем (их основная мишень), но также нормализуют секрецию гормонов стресса, подавляют воспаление и восстанавливают нейрогенез в гиппокампе.
Диета как средство лечения депрессии
Теперь вернемся к диете и ее влиянию на описанные выше процессы. Потребление высокого количества как жиров, так и углеводов не только увеличивает риск ожирения, метаболических и сердечно-сосудистых заболеваний [42]. Оно также усиливают активность ГГАС, тревожные и депрессивные симптомы, нарушает нейропластичность, нейрогенез и память. В клетках организма нарушается выработка энергии и защита от окислительного стресса [43], что может приводить к их гибели и развитию воспаления. С другой стороны, все описанные механизмы могут быть мишенью различных диет (рис. 5). Терапевтический эффект на психические расстройства в наибольшей степени изучен для средиземноморской и кетогенной диет, на которых мы и сосредоточим свое внимание.
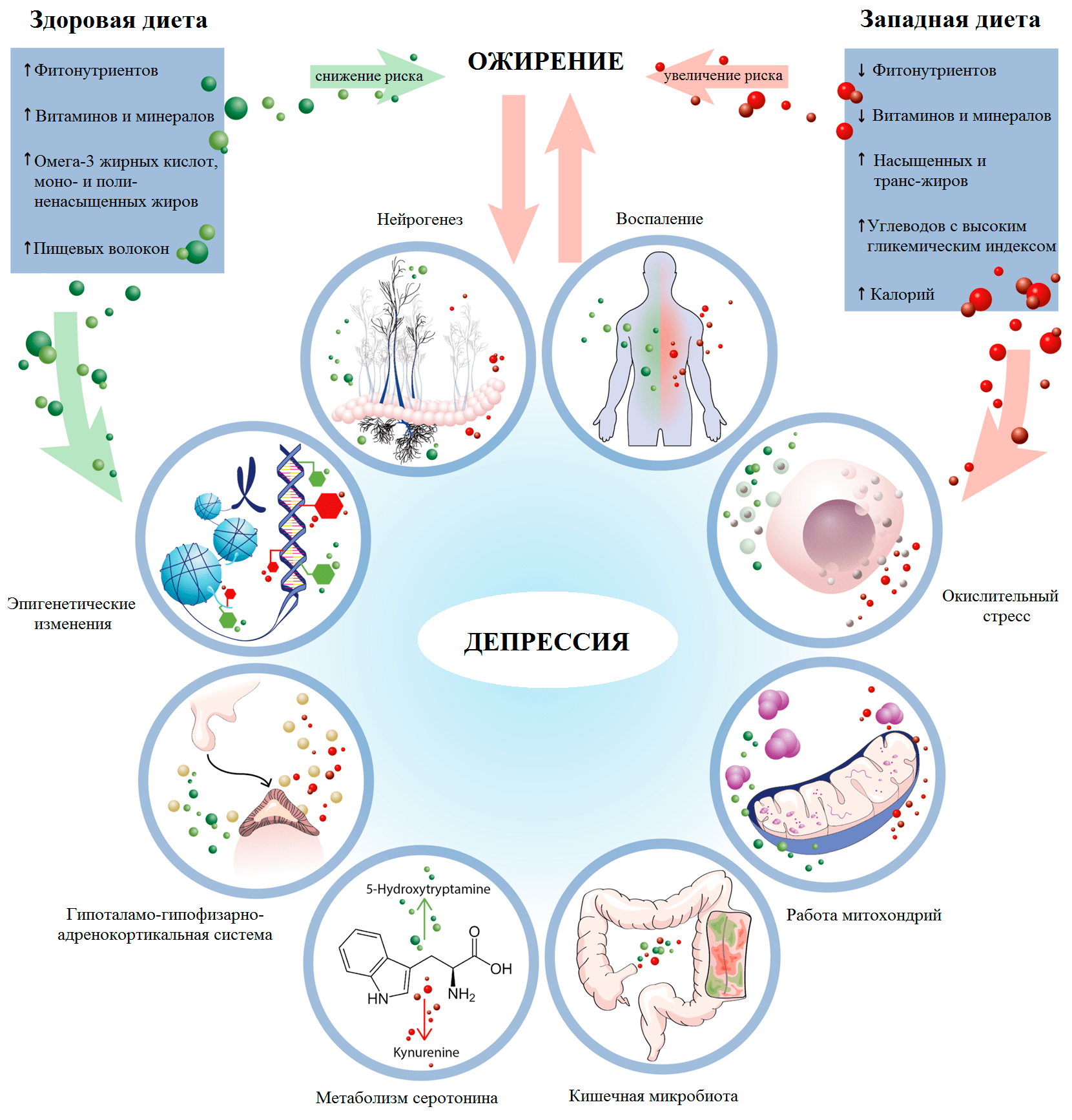
Рисунок 5. Ключевые механизмы терапевтического и патогенного действия рациона на депрессию и ожирение
Средиземноморская диета приковала внимание врачей и ученых, когда было замечено, что жители Средиземноморского региона отличаются крепким здоровьем и высокой продолжительностью жизни [44]. Они едят много рыбы и растительной пищи (фрукты, овощи, бобы и злаки), а использование оливкового масла обеспечивает высокое потребление полиненасыщенных жирных кислот и низкое потребление насыщенных. Птицы и, особенно, красного мяса в их рационе мало, молоко представлено лишь в виде сыра и йогурта, ну и завершает картину ежедневный бокал вина за обедом (рис. 6) [45]. Главными действующими лицами средиземноморской диеты считаются витамины группы В и омега-3 полиненасыщенные жирные кислоты [46] — они укрепляют клеточные мембраны, подавляют воспалительные процессы и улучшают работу нейромедиаторных систем. Антиоксидантный эффект диеты кроме того обеспечивается высоким содержанием витаминов А, С и Е в оливковом масле [47].
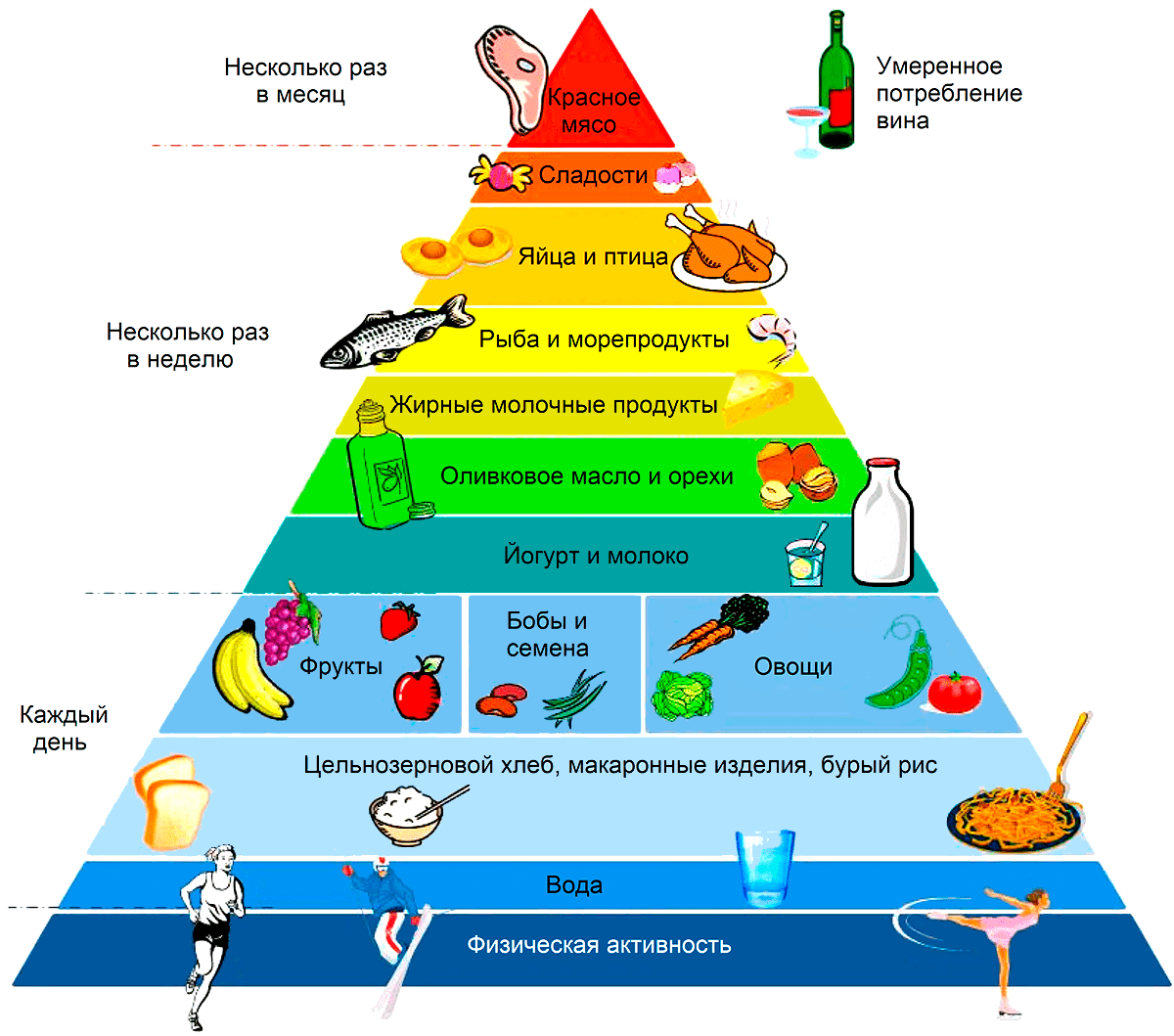
Рисунок 6. Средиземноморская диета. Ежедневное потребление: цельнозерновые злаки (хлеб, паста, бурый рис), фрукты, овощи, бобы, злаки, бокал вина, много воды. Несколько раз в неделю: сладости, яйца и птица, рыба и морепродукты, жирные молочные продукты (сыр, йогурт, молоко), оливковое масло, орехи. Несколько раз в месяц: красное мясо. Постоянная физическая активность.
Клинические испытания и их метаанализы показали эффективность средиземноморской диеты как в предотвращении [48], так и в терапии депрессии [49]. В экспериментах антидепрессивный эффект средиземноморской диеты был напрямую связан с моноаминной системой — высокое потребление омега-3 кислот улучшало работу серотониновых синаптических контактов в мозге крыс [50]. У медсестер, подверженных хроническому стрессу, прием омега-3 кислот в качестве пищевой добавки снижал не только депрессивные симптомы, но и уровень кортизола в крови [51]. Улучшает средиземноморская диета и нейрогенез в гиппокампе, что например было обнаружено у мышей, которым добавляли в пищу кокосы и чернику [52]. И при средиземноморской диете, и при добавлении в пищу омега-3 кислот, в крови испытуемых возрастал уровень нейротрофического фактора BDNF, обеспечивая антидепрессивный эффект [53]. Наконец, уже упомянутое антиокислительное действие компонентов средиземноморской диеты обеспечивает ее противовоспалительный эффект, также играющий важную роль в терапии депрессии.
В одном масштабном исследовании вычисляли воспалительный индекс диеты, основываясь на известных эффектах ее компонентов. Оказалось, что чем меньше в составе пищи веществ с провоспалительным действием и больше с противовоспалительным, тем выше антидепрессивный эффект диеты [49]. Роль микроглии в таком эффекте средиземноморской диеты изучена мало, но эксперименты на животных показывают подавление ее активности витаминами и омега-3 кислотами в моделях инсульта, сотрясения мозга, рассеянного склероза и нейроинфекции. В недавней статье подавление активности микроглии связали с антидепрессивным эффектом омега-3 кислот при удалении яичников у крыс (модель депрессии менопаузы) [54]. Если подробнее изучить литературу про микроглиальные изменения при депрессии и диете, то можно встретить данные об активации микроглии как при психических расстройствах, так и при их лечении. Дело тут в том, что активация микроглии может идти по двум путям — провоспалительному М1 и противовоспалительному М2. Так вот, при депрессии микроглия активируется в провоспалительную популяцию М1, а диета и антидепрессанты переводят ее в терапевтическое состояние М2 [55].
Кетогенная диета была предложена для лечения эпилепсии в 1920-х годах и с тех пор ее эффективность подтверждена множеством клинических испытаний и их метаанализами [56]. Суть диеты в том, что в отсутствии углеводов (их содержание снижено до 1–2%) и избытке жиров (80%) печень превращает последние в кетоновые тела, которые (в отличие от жиров) могут проникать в мозг (рис. 7). В нейронах кетоновые тела служат более эффективным источником энергии, чем глюкоза, снижают окислительный стресс и дают противовоспалительный эффект. Хотя в классической кетогенной диете преобладают длинноцепочечные жирные кислоты (омега-3 и омега-6 полиненасыщенные), современные исследования показывают, что среднецепочечные жирные кислоты (содержащие от 6 до 12 углеродных атомов) более эффективны для генерации кетоновых тел. Поэтому альтернативная кетогенная диета богата кокосовым маслом — идеальным источником среднецепочечных жирных кислот [57].
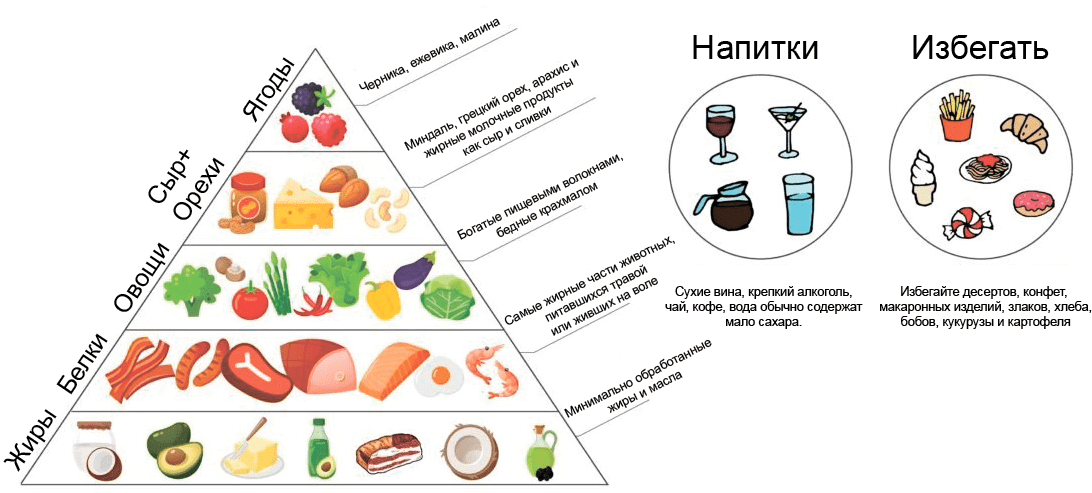
Рисунок 7. Схема кетогенной диеты. Важнейшие источники полезных жиров и жирных кислот — кокосовое, сливочное и оливковое масла, авокадо. Важнейшие источники белков — мясо, рыба, морепродукты, птица, яйца. Растительная пища с высоким содержанием пищевых волокон и низким содержанием крахмала — овощи (брокколи, капуста, баклажаны, помидоры) и грибы. Орехи и жирный сыр для незаменимых белков и жиров. Из напитков рекомендуются чай, кофе, вода, из алкоголя — сухое вино и крепкие напитки. Не рекомендуется употреблять десерты и конфеты, мучные изделия, злаки, бобы, пищу, богатую крахмалом (кукуруза, картофель).
В начале XX века стало накапливаться всё больше результатов экспериментальных и клинических исследований, свидетельствующих о грандиозном терапевтическом потенциале кетогенной диеты. В разной степени ее эффективность показана для лечения болезней Альцгеймера и Паркинсона, инсультов и мигрени, бокового амиотрофического склероза, синдрома дефицита внимания и гиперактивности (СДВГ), аутизма и шизофрении, наркотической зависимости и, наконец, депрессии. Кетогенная диета снижала депрессивные симптомы у людей с избыточным весом и ожирением, однако клинических испытаний ее эффективности для лечения депрессии пока не проводилось. В моделях на животных кетогенная диета снижала тревожно-депрессивное поведение, улучшала социальное поведение и память, причем как у здоровых животных, так и в моделях психических расстройств [58].
Механизмы антидепрессивного действия кетогенной диеты изучены намного хуже, чем средиземноморской. Совсем мало данных о ее влиянии на работу моноаминовых структур мозга и ГГАС, а работы, связывающие их с антидепрессивным эффектом диеты, отсутствуют вовсе. Однако во-первых, роль моноаминов показана в давно изучаемом противоэпилептическом эффекте кетогенной диеты — так, мышам, дефектным по гену синтеза норадреналина, она не помогала при химически вызванных судорогах [59]. Во-вторых, кетогенная диета помогает при расстройствах, в патогенезе которых нарушения работы моноаминовых структур играют ведущую роль — шизофрении, СДВГ, болезни Паркинсона. Касательно кортизола — у здоровых людей кетогенная диета не меняла его уровень в крови, а клинических исследований ее эффекта на работу ГГАС при депрессии пока не проводилось [60].
Участие кетоновых тел в энергетическом метаболизме лежит в основе эффекта диеты на нейрогенез и нейровоспаление. Интенсивность нейрогенеза определяется последовательными процессами — делением нервных стволовых клеток, их выживанием, миграцией и дифференцировкой во взрослые нейроны. По существующим представлениям антиоксидантный эффект кетоновых тел препятствует апоптозу — программируемой клеточной гибели, часто запускаемой окислительным стрессом. Кетоновые тела вдвое увеличивают количество белков электрон-транспортной цепи митохондрий, в результате энергии образуется больше, а свободных радикалов — меньше. А именно свободные радикалы (в первую очередь активные формы кислорода — супероксид, перекись водорода [43]) запускают апоптоз, который на тканевом уровне может перерасти в воспалительную реакцию [61]. Нарушение работы митохондрий играет в патогенезе депрессии столь важную роль, что в недавнем исследовании депрессивные симптомы у мышей удалось снизить пересадкой митохондрий от их здоровых сородичей [62]. Хронический стресс и системное воспаление снижало у мышей ветвление отростков микроглиальных клеток, которое восстанавливалось кетогенной диетой [63]. Ветвление микроглии влияет на ее взаимодействие с окружающими нейронами и может оказывать нейропротекторный эффект, подавляя фагоцитоз и апоптоз нервных клеток. Так же как и в случае с омега-3 кислотами, кетоновые тела стимулируют превращение воспалительной и нейротоксичной микроглии М1 в нейропротекторную М2 [64].
Несмотря на высокую эффективность кетогенной диеты при лечении весьма широкого спектра вегетативных нарушений, неврологических заболеваний и психических расстройств, поддержание кетогенной диеты представляет собой невероятно трудную задачу. Исследования показывают, что придерживаться такой строгой диеты необычайно сложно, люди срываются и могут получить расстройство пищевого поведения. А в случае лечения депрессии негативные эмоции, вызванные столь строгими ограничениями, могут лишь усугубить психологическое состояние. Поэтому использовать кетогенную диету не для лечения диагностированного ожирения, а чтобы похудеть к лету — плохая идея. Не говоря уже о том, что при некоторых нарушениях метаболизма и склонности к атеросклерозу, кетогенная диета может серьезно навредить здоровью [65]. Поэтому ученые и врачи активно ищут способы снизить степень ограничений при диете, оставив ее достаточно эффективной. Один из путей — фармакологическое повышение уровня кетоновых тел в крови без необходимости соблюдать столь строгую диету. Экспериментальные исследования такой «кетогенной диеты в таблетках» показали свою эффективность в моделях судорожных состояний у мышей [66].
Как мы видим, современная наука раскрыла довольно много физиологических механизмов, лежащих в основе антидепрессивного эффекта средиземноморской и кетогенной диет. Другие режимы питания — низкожировая диета, общее снижение потребляемых калорий [67] и частоты приема пищи, даже твердость и мягкость пищи оказывают положительные эффекты на депрессивное состояние и некоторые из рассмотренных в статье процессы. Возрастающее внимание к здоровому образу жизни и полезному питанию с одной стороны и рост частоты встречаемости тревожно-депрессивных и других психических расстройств несомненно ведут к более детальному изучению их механизмов. Так что хочется надеяться, что с каждым годом лечение депрессии как новыми антидепрессантами, так и различными нефармакологическими подходами вроде диеты будет всё более и более эффективным. Следить за этим прогрессом необычайно интересно.
Эпилог
В статье я намеренно не стал говорить еще об одном важнейшем элементе терапевтического эффекта диет [68] при лечении психических расстройств — кишечной микробиоте [69]. Это отдельная огромная тема, которой посвящены многие статьи на «Биомолекуле» [69–71], значительная часть научно-популярного бестселлера «Очаровательный кишечник» и тысячи научных статей и обзоров. Выдающийся ирландский нейрофизиолог Джон Крайан первым стал активно изучать роль микробиоты кишечника в психических расстройствах [72] и до сих пор остается самым авторитетным специалистом в этой области. В литературе накоплен большой объем данных о роли кишечной микробиоты в терапевтических эффектах средиземноморской [73] и кетогенной [74] диет, так же как и о ее взаимосвязи с ГГАС [75], нейрогенезом в гиппокампе [76] и микроглией [77]. Бактерии секретируют огромное разнообразие биологически активных веществ, оказывающих влияние на мозг через симпатические и парасимпатические нервы, секрецию гормонов и цитокинов клетками кишечника и прилегающих кровеносных сосудов [78]. Роль кишечной микробиоты в патогенезе депрессии, шизофрении [41], аутизме [79] и множества других психических расстройств настолько высока, что пересадка кала [80] пациентов мышам и крысам со стерильным кишечником может воспроизводить у них соответствующие нарушения поведения [81]. Эта тема пока таит в себе множество загадок, но человечество возлагает большие надежды на терапевтический потенциал кишечной микрофлоры.
Литература
- Depression and other common mental disorders: global health estimates. (2017). WHO;
- Краткая история антидепрессантов;
- Paul E. Holtzheimer, Helen S. Mayberg. (2011). Stuck in a rut: rethinking depression and its treatment. Trends in Neurosciences. 34, 1-9;
- Дофаминовые болезни;
- Серотониновые сети;
- Тайны голубого пятна;
- Мозг, общение нейронов и энергетическая эффективность;
- Рецептор медиатора настроения;
- Как происходит выделение нейромедиатора;
- Поиск лекарственных мишеней;
- Очень нервное возбуждение;
- Jaskaran B Singh, Ella J Daly, Maju Mathews, Maggie Fedgchin, Vanina Popova, et. al.. (2020). Approval of esketamine for treatment-resistant depression. The Lancet Psychiatry. 7, 232-235;
- Каннабиноиды в медицине: тупик или перспективное направление?;
- Новая жизнь психоделиков;
- Sachin Patel, Mathew N. Hill, Joseph F. Cheer, Carsten T. Wotjak, Andrew Holmes. (2017). The endocannabinoid system as a target for novel anxiolytic drugs. Neuroscience & Biobehavioral Reviews. 76, 56-66;
- Robin L Carhart-Harris, Mark Bolstridge, James Rucker, Camilla M J Day, David Erritzoe, et. al.. (2016). Psilocybin with psychological support for treatment-resistant depression: an open-label feasibility study. The Lancet Psychiatry. 3, 619-627;
- Три поколения лекарств;
- Лекарство от депрессии: как электричество разгоняет тоску;
- Munim Mannan, Abdullah Mamun, Suhail Doi, Alexandra Clavarino. (2016). Is there a bi-directional relationship between depression and obesity among adult men and women? Systematic review and bias-adjusted meta analysis. Asian Journal of Psychiatry. 21, 51-66;
- Yuri Milaneschi, W. Kyle Simmons, Elisabeth F. C. van Rossum, Brenda WJH Penninx. (2019). Depression and obesity: evidence of shared biological mechanisms. Mol Psychiatry. 24, 18-33;
- GWAS и психогенетика: консорциумы в поисках ассоциаций;
- «Депрессивные» гены и «грустный» мозг: где, как и почему возникает депрессия;
- Гены и безумие: генетическое тестирование в психиатрии;
- David M. Howard, 23andMe Research Team, Mark J. Adams, Toni-Kim Clarke, Jonathan D. Hafferty, et. al.. (2019). Genome-wide meta-analysis of depression identifies 102 independent variants and highlights the importance of the prefrontal brain regions. Nat Neurosci. 22, 343-352;
- JOSEPH J. SCHILDKRAUT. (1965). THE CATECHOLAMINE HYPOTHESIS OF AFFECTIVE DISORDERS: A REVIEW OF SUPPORTING EVIDENCE. AJP. 122, 509-522;
- Hirschfeld R.M. (2000). History and evolution of the monoamine hypothesis of depression. The Journal of clinical psychiatry. 61 Suppl 6, 4–6;
- P W Gold. (2015). The organization of the stress system and its dysregulation in depressive illness. Mol Psychiatry. 20, 32-47;
- Как толщина миелина и эпигенетика помогают устойчивости к стрессу;
- Carmine M. Pariante, Stafford L. Lightman. (2008). The HPA axis in major depression: classical theories and new developments. Trends in Neurosciences. 31, 464-468;
- Всё, что вы всегда хотели знать о взрослом нейрогенезе, но боялись спросить;
- Joseph Altman, Gopal D. Das. (1965). Autoradiographic and histological evidence of postnatal hippocampal neurogenesis in rats. J. Comp. Neurol.. 124, 319-335;
- Ronald S. Duman, Lisa M. Monteggia. (2006). A Neurotrophic Model for Stress-Related Mood Disorders. Biological Psychiatry. 59, 1116-1127;
- Молекулярные маркеры самоубийства;
- Лечение болезни Паркинсона нейротрофическими факторами: есть ли свет в конце туннеля?;
- Carl Björkholm, Lisa M. Monteggia. (2016). BDNF – a key transducer of antidepressant effects. Neuropharmacology. 102, 72-79;
- Взаимодействие нервной и иммунной систем: предпосылки новой терапии;
- Andrew H. Miller, Charles L. Raison. (2016). The role of inflammation in depression: from evolutionary imperative to modern treatment target. Nat Rev Immunol. 16, 22-34;
- Воспаленный рассудок;
- Почему помощники нейронов «ползают» и «прыгают»?;
- Raz Yirmiya, Neta Rimmerman, Ronen Reshef. (2015). Depression as a Microglial Disease. Trends in Neurosciences. 38, 637-658;
- Болезнь потерянных связей;
- Нутригеномика: питание vs. заболевания;
- Активный кислород: друг или враг, или О пользе и вреде антиоксидантов;
- Нутригеронтология: питание vs. старение;
- W C Willett, F Sacks, A Trichopoulou, G Drescher, A Ferro-Luzzi, et. al.. (1995). Mediterranean diet pyramid: a cultural model for healthy eating. The American Journal of Clinical Nutrition. 61, 1402S-1406S;
- Рыба жизни. Когда не только геном определяет продолжительность жизни;
- A Sánchez-Villegas, P Henríquez, M Bes-Rastrollo, J Doreste. (2006). Mediterranean diet and depression. Public Health Nutr.. 9, 1104-1109;
- Camille Lassale, G. David Batty, Amaria Baghdadli, Felice Jacka, Almudena Sánchez-Villegas, et. al.. (2019). Healthy dietary indices and risk of depressive outcomes: a systematic review and meta-analysis of observational studies. Mol Psychiatry. 24, 965-986;
- Natalie Parletta, Dorota Zarnowiecki, Jihyun Cho, Amy Wilson, Svetlana Bogomolova, et. al.. (2019). A Mediterranean-style dietary intervention supplemented with fish oil improves diet quality and mental health in people with depression: A randomized controlled trial (HELFIMED). Nutritional Neuroscience. 22, 474-487;
- Nurul Uyun Abdul Aziz, Samaila Musa Chiroma, Mohamad Aris Mohd Moklas, Mohd Ilham Adenan, Amin Ismail, Mohamad Taufik Hidayat Baharuldin. (2020). Antidepressant-Like Properties of Fish Oil on Postpartum Depression-Like Rats Model: Involvement of Serotonergic System. Brain Sciences. 10, 733;
- Leila Jahangard, Mahmoud Hedayati, Roghayeh Abbasalipourkabir, Mohammad Haghighi, Mohammad Ahmadpanah, et. al.. (2019). Omega-3-polyunsatured fatty acids (O3PUFAs), compared to placebo, reduced symptoms of occupational burnout and lowered morning cortisol secretion. Psychoneuroendocrinology. 109, 104384;
- Catarina Rendeiro, David Vauzour, Marcus Rattray, Pierre Waffo-Téguo, Jean Michel Mérillon, et. al.. (2013). Dietary Levels of Pure Flavonoids Improve Spatial Memory Performance and Increase Hippocampal Brain-Derived Neurotrophic Factor. PLoS ONE. 8, e63535;
- Almudena Sánchez-Villegas, Cecilia Galbete, Miguel Ángel Martinez-González, J. Alfredo Martinez, Cristina Razquin, et. al.. (2011). The effect of the Mediterranean diet on plasma brain-derived neurotrophic factor (BDNF) levels: The PREDIMED-NAVARRA randomized trial. Nutritional Neuroscience. 14, 195-201;
- Bin Wu, Qingen Song, Yongkang Zhang, Changshui Wang, Mengqi Yang, et. al.. (2020). Antidepressant activity of ω-3 polyunsaturated fatty acids in ovariectomized rats: role of neuroinflammation and microglial polarization. Lipids Health Dis. 19;
- Marco Prinz, Josef Priller. (2014). Microglia and brain macrophages in the molecular age: from origin to neuropsychiatric disease. Nat Rev Neurosci. 15, 300-312;
- Laura Lyons, Natasha E. Schoeler, Dean Langan, J. Helen Cross. (2020). Use of ketogenic diet therapy in infants with epilepsy: A systematic review and meta‐analysis. Epilepsia. 61, 1261-1281;
- Katrin Augustin, Aziza Khabbush, Sophie Williams, Simon Eaton, Michael Orford, et. al.. (2018). Mechanisms of action for the medium-chain triglyceride ketogenic diet in neurological and metabolic disorders. The Lancet Neurology. 17, 84-93;
- Elisa Brietzke, Rodrigo B. Mansur, Mehala Subramaniapillai, Vicent Balanzá-Martínez, Maj Vinberg, et. al.. (2018). Ketogenic diet as a metabolic therapy for mood disorders: Evidence and developments. Neuroscience & Biobehavioral Reviews. 94, 11-16;
- Patricia Szot, David Weinshenker, Jong M Rho, Thomas W Storey, Philip A Schwartzkroin. (2001). Norepinephrine is required for the anticonvulsant effect of the ketogenic diet. Developmental Brain Research. 129, 211-214;
- Jeff S. Volek, Matthew J. Sharman. (2004). Cardiovascular and Hormonal Aspects of Very-Low-Carbohydrate Ketogenic Diets. Obesity Research. 12, 115S-123S;
- Sookyong Koh, Nina Dupuis, Stéphane Auvin. (2020). Ketogenic diet and Neuroinflammation. Epilepsy Research. 167, 106454;
- Yun Wang, Jing Ni, Ce Gao, Liming Xie, Lingyan Zhai, et. al.. (2019). Mitochondrial transplantation attenuates lipopolysaccharide- induced depression-like behaviors. Progress in Neuro-Psychopharmacology and Biological Psychiatry. 93, 240-249;
- Chao Huang, Peng Wang, Xing Xu, Yaru Zhang, Yu Gong, et. al.. (2018). The ketone body metabolite β-hydroxybutyrate induces an antidepression-associated ramification of microglia via HDACs inhibition-triggered Akt-small RhoGTPase activation. Glia. 66, 256-278;
- Gerwyn Morris, Basant K. Puri, Michael Maes, Lisa Olive, Michael Berk, Andre F. Carvalho. (2020). The role of microglia in neuroprogressive disorders: mechanisms and possible neurotherapeutic effects of induced ketosis. Progress in Neuro-Psychopharmacology and Biological Psychiatry. 99, 109858;
- Hoon Chul Kang, Da Eun Chung, Dong Wook Kim, Heung Dong Kim. (2004). Early- and Late-onset Complications of the Ketogenic Diet for Intractable Epilepsy. Epilepsia. 45, 1116-1123;
- Andrea Viggiano, Raffaele Pilla, Patrick Arnold, Marcellino Monda, Dominic D׳Agostino, Giangennaro Coppola. (2015). Anticonvulsant properties of an oral ketone ester in a pentylenetetrazole-model of seizure. Brain Research. 1618, 50-54;
- Добавки не будет: голодание продлевает мышам жизнь. А что насчет людей?;
- Почему так сложно похудеть, или Влияние кишечной микробиоты на метаболизм;
- Микробиом кишечника: мир внутри нас;
- Клетчатка на пользу потомкам;
- Новые функции кишечной микрофлоры;
- Чего от нас хотят микробы?;
- Federica Del Chierico, Pamela Vernocchi, Bruno Dallapiccola, Lorenza Putignani. (2014). Mediterranean Diet and Health: Food Effects on Gut Microbiota and Disease Control. IJMS. 15, 11678-11699;
- Antonio Paoli, Laura Mancin, Antonino Bianco, Ewan Thomas, João Felipe Mota, Fabio Piccini. (2019). Ketogenic Diet and Microbiota: Friends or Enemies?. Genes. 10, 534;
- Błażej Misiak, Igor Łoniewski, Wojciech Marlicz, Dorota Frydecka, Agata Szulc, et. al.. (2020). The HPA axis dysregulation in severe mental illness: Can we shift the blame to gut microbiota?. Progress in Neuro-Psychopharmacology and Biological Psychiatry. 102, 109951;
- Ebere S. Ogbonnaya, Gerard Clarke, Fergus Shanahan, Timothy G. Dinan, John F. Cryan, Olivia F. O’Leary. (2015). Adult Hippocampal Neurogenesis Is Regulated by the Microbiome. Biological Psychiatry. 78, e7-e9;
- Kira Irving Mosher, Tony Wyss-Coray. (2015). Go with your gut: microbiota meet microglia. Nat Neurosci. 18, 930-931;
- Jane A. Foster, Linda Rinaman, John F. Cryan. (2017). Stress & the gut-brain axis: Regulation by the microbiome. Neurobiology of Stress. 7, 124-136;
- Расстройство аутистического спектра: «дети дождя»;
- Микробы из глубинки. Стоит ли нам трансплантировать себе фекалии дикарей, чтобы вернуть былое здоровье;
- John R. Kelly, Yuliya Borre, Ciaran O' Brien, Elaine Patterson, Sahar El Aidy, et. al.. (2016). Transferring the blues: Depression-associated gut microbiota induces neurobehavioural changes in the rat. Journal of Psychiatric Research. 82, 109-118;
- Lúcio Ricardo Leite Diniz, Marilia Trindade de Santana Souza, Joice Nascimento Barboza, Reinaldo Nóbrega de Almeida, Damião Pergentino de Sousa. (2019). Antidepressant Potential of Cinnamic Acids: Mechanisms of Action and Perspectives in Drug Development. Molecules. 24, 4469;
- Kamani Liyanarachchi, Richard Ross, Miguel Debono. (2017). Human studies on hypothalamo-pituitary-adrenal (HPA) axis. Best Practice & Research Clinical Endocrinology & Metabolism. 31, 459-473;
- Carmelina Gemma, Adam D. Bachstetter. (2013). The role of microglia in adult hippocampal neurogenesis. Front. Cell. Neurosci.. 7;
- Wolfgang Marx, Melissa Lane, Meghan Hockey, Hajara Aslam, Michael Berk, et. al.. (2020). Diet and depression: exploring the biological mechanisms of action. Mol Psychiatry.






