Две стороны инкретинов: спасение от ожирения и новые угрозы
05 декабря 2025
Две стороны инкретинов: спасение от ожирения и новые угрозы
- 809
- 0
- 5
Популярность агонистов рецепторов инкретинов, таких как семаглутид и тирзепатид, вывела на первый план вопросы их долгосрочной безопасности. Соблазнительная простота фармакологического решения таких сложных проблем, как лечение ожирения и сахарного диабета 2 типа, может скрывать новые, еще не до конца изученные риски.
Рисунок в оригинальном разрешении.
иллюстрация Анастасии Самоукиной
-
Автор
-
Редакторы
-
Рецензент
-
Иллюстратор
Агонисты рецепторов глюкагоноподобного пептида-1 совершили переворот в терапии сахарного диабета 2 типа и ожирения. В этой статье мы взглянем на эволюцию этих препаратов и проанализируем их потенциал в лечении сопутствующих заболеваний. Конечно же, не оставим без внимания нежелательные явления и проблему доступности этой инновационной терапии. Как обеспечить равный доступ к прорывным препаратам для всех, чтобы никто не ушел обиженным? Как пациенту справиться со вопросом самостоятельного введения лекарства? Ответы на эти вопросы ждут вас в новой статье спецпроекта «Биомолекулы» «Метаболизм, аппетит и инкретины»!
Метаболизм, аппетит и инкретины
Пища давно стала неотъемлемой частью массовой культуры и мощным двигателем экономики. Растущий уровень жизни позволяет нам потреблять всё больше и больше калорий, однако у этой истории прогресса есть и обратная сторона. Нередко людям приходится платить за чрезмерный гедонизм иммунометаболическими болезнями. Прежде всего ожирением и тесно связанным с ним диабетом 2 типа, которые уже давно успели стать одними из самых распространенных неинфекционных заболеваний во всем мире. В этом спецпроекте мы поговорим о том, как ученым удалось сделать практически невозможное — взять под контроль пищевой инстинкт и, в итоге, скорректировать пищевое поведение человека. А еще о том, какие перспективы и риски в этом направлении видит современная наука.
Селебрити, социальные сети и реклама на билбордах... Речь могла бы идти про антивозрастной крем или, быть может, «Биомолекула» решила взвесить риски и пользу средств от загара? Поразительно, но нет. Сегодня наш рассказ пойдет отнюдь не про модные бренды бьюти-средств, как сперва можно подумать, а (опять) про фармакологические средства с доказанной эффективностью.
Впрочем, удивление вполне оправданно. На рынке лекарственных средств действительно не так уж и часто можно встретить препараты, которым удалось не только совершить революцию в терапии, но и проникнуть в массовую культуру. У агонистов рецепторов глюкагоноподобного пептида-1 (ГПП-1), первоначально созданных для лечения сахарного диабета 2 типа (СД2), это получилось. Когда ученые открыли у этих средств дополнительный эффект, связанный с устойчивым снижением массы тела, масс-медиа буквально взорвались! Сейчас, если мы начнем искать в мире соцсетей информацию по этим лекарствам, то, скорее всего, наткнемся на какой-нибудь блог о похудении, а не на историю борьбы с диабетом.
Почему же так вышло? История агонистов рецепторов ГПП-1 во многом уникальна. Эти передовые препараты появились именно тогда, когда ожирение стало серьезной общемировой проблемой в развитых странах. Как говорится, в нужном месте, в нужное время — коммерческий успех лекарств предопределен. Однако на самом деле сами инкретины были открыты намного раньше, еще в прошлом веке, а препараты на основе агонистов их рецепторов появились в 2000–10-х годах (см. таймлайн на рис. 1).
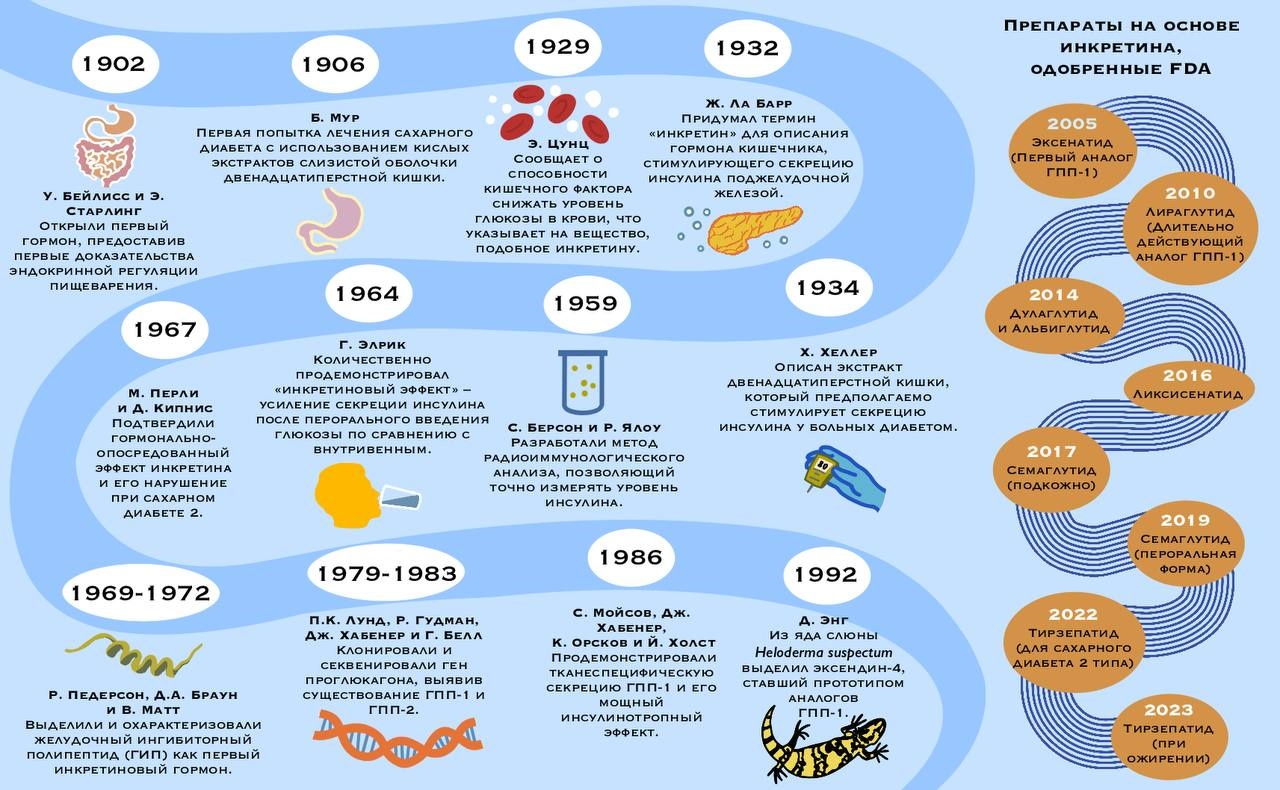
Рисунок 1. История открытия агонистов рецепторов ГПП-1 и ГИП. В 1932 году Жан Ля Барр впервые употребил термин «инкретин» (от англ. INtestine seCRETion INsulin) для описания гормона ЖКТ, усиливающего секрецию инсулина поджелудочной железой. Точный уровень инсулина в крови тогда ученым было трудно определить, поэтому теория инкретинов оставалась спорной до 1950-х годов, когда был изобретен радиоиммунный анализ, который позволил точно измерять уровень инсулина.
После этого в 1964 году Харольд Элрик подтвердил предыдущие теории, количественно измерив повышение инсулина в ответ на введение глюкозы. Оказалось, что больше инсулина выделяется именно при пероральном введении глюкозы по сравнению с внутривенным [1]. Авторы исследования сделали вывод, что существует еще некий неизвестный фактор, который увеличивает секрецию инсулина в ЖКТ.
В 1969 году был успешно выделен пептид, который тремя годами позднее получил название «желудочный ингибиторный полипептид». Сейчас это вещество известно нам как глюкозозависимый инсулинотропный полипептид (ГИП). Оказалось, что ГИП обладает эффектом инкретинов.
В 1980-х годах ученые пытались ингибировать действие ГИП, но дополнительная секреция инсулина снижалась только на 30% [2]. А это значит, что существует другой инсулинотропный гормон, который тоже высвобождается в ЖКТ ответ на глюкозу. Его необходимо было найти. Исследования продолжились.
На арену выходят генетические методы. В 1982 году было опубликовано исследование, изучающее мРНК предшественника глюкагона рыб, согласно которому ген кодирует не один, а три пептида (глюкагон и еще два неизвестных). Их поиски увенчались успехом, после проведения секвенирования нужных генов. Ученые выяснили, что промежуточных пептидов может быть больше, а среди продуктов процессинга предшественника глюкагона нашлись глюкагоноподобные пептиды 1 и 2. ГПП-2 лишен инсулинотропных эффектов, а вот ГПП-1 является инкретином.
Настало время коммерциализировать результаты многолетних исследований. Конечно, фармацевтические компании не могли обойти столь яркое открытие стороной. В 2000–10-х гг. были зарегистрированы препараты первого поколения: эксенатид, лираглутид, дулаглутид, албиглутид и ликсисенатид. Некоторые из них еще находятся на рынке, но значительно проигрывают более новым семаглутиду и тирзепатиду. Более подробно об эволюции агонистов рецепторов ГПП-1 можно почитать в этом обзоре [3].
иллюстрация Анастасии Самоукиной по [3]
Но что же стало научной основой для этого прорыва? Ключом послужило открытие инкретинов — гормонов, регулирующих уровень глюкозы после приема пищи. Это открытие дало старт разработке двух принципиально разных классов препаратов. С одной стороны, появились ингибиторы дипептидилпептидазы ДПП-4 — фермента, расщепляющего естественный ГПП-1. С другой — были созданы агонисты рецепторов ГПП-1, так называемые миметики инкретинов.
С фармакологической точки зрения, агонисты рецепторов ГПП-1 представляют собой устойчивые к разрушению аналоги человеческого глюкагоноподобного пептида-1. Их основное преимущество заключается в способности обеспечивать продолжительную и стабильную стимуляцию рецепторов ГПП-1 в организме. При этом механизм их действия принципиально отличается от других противодиабетических средств. Агонисты ГПП-1 избирательно активируются только при повышении уровня глюкозы в крови, что обеспечивает низкий риск развития гипогликемии — одного из самых опасных побочных эффектов традиционной терапии.
Но что делает миметики рецепторов инкретинов по-настоящему уникальными, так это их множественное действие. Помимо снижения уровня глюкозы, они способствуют уменьшению массы тела, снижению артериального давления и, возможно, оказывают нейропротективное действие!
Сейчас на рынке преобладают препараты, созданные на основе семаглутида и другого вещества нового класса — тирзепатида. Тирзепатид обладает двойным эффектом и, помимо активации рецепторов ГПП-1, также стимулирует рецепторы другого инкретина — глюкозозависимого инсулинотропного полипептида (ГИП). За счет двойного механизма вещество обладает высокой эффективностью и безопасностью.
Основной центральный механизм агонистов рецепторов ГПП-1 — активация проопиомеланокортин (POMC)-нейронов гипоталамуса, что способствует возникновению чувства насыщения. Так, в исследовании на клетках было показано, что длительная стимуляция POMC-нейронов семаглутидом снижает окисилительный стресс и нейродегенерацию [4]. Помимо центрального действия ГПП-1 связывается со своими рецепторами (подробнее см. рис. 5) в желудке, снижается скорость его опорожнения [5]. Так пища дольше находится в желудке, а это значит, что чувство насыщения тоже продлевается. ГПП-1 рецепторы есть и в кишечнике, поэтому при их активации перистальтика кишечника снижается, что дополнительно продлевает чувство сытости. Подробнее об этих механизмах мы говорили в первой статье спецпроекта [6].
ГПП-1 взаимодействует еще и со своими рецепторами в поджелудочной железе, где стимулирует глюкозозависимую выработку инсулина и ингибирует эффекты глюкагона. Для людей, страдающих СД2, это очень важно, ведь это ключевой механизм регуляции уровня сахара в крови. Однако ГПП-1 и другие инкретины, синтезируемые нашим организмом, долго не живут и расщепляются при помощи ДПП-4 в течение всего лишь нескольких минут. Для устойчивого эффекта этого явно недостаточно. Поэтому при создании препаратов, чтобы избежать необходимости колоть их при каждом приеме пищи, ученые изменили аналоги ГПП-1 так, чтобы ДПП-4 не могла их быстро расщепить (рис. 2). В результате таких модификаций семаглутид и тирзепатид требуют введения всего лишь один раз в неделю.
Также доступны на рынке препараты и другого класса — ингибиторы ДПП-4, например, ситаглиптин (рис. 2). Глиптины — это малые молекулы, их производство менее затратно. Согласно клиническим исследованиям [7], [8], они менее эффективны у пациентов с СД2 по сравнению с семаглутидом, а массу тела практически не снижают. Глиптины представлены в виде таблеток и часто назначаются пациентам с СД2 вместе с метформином.
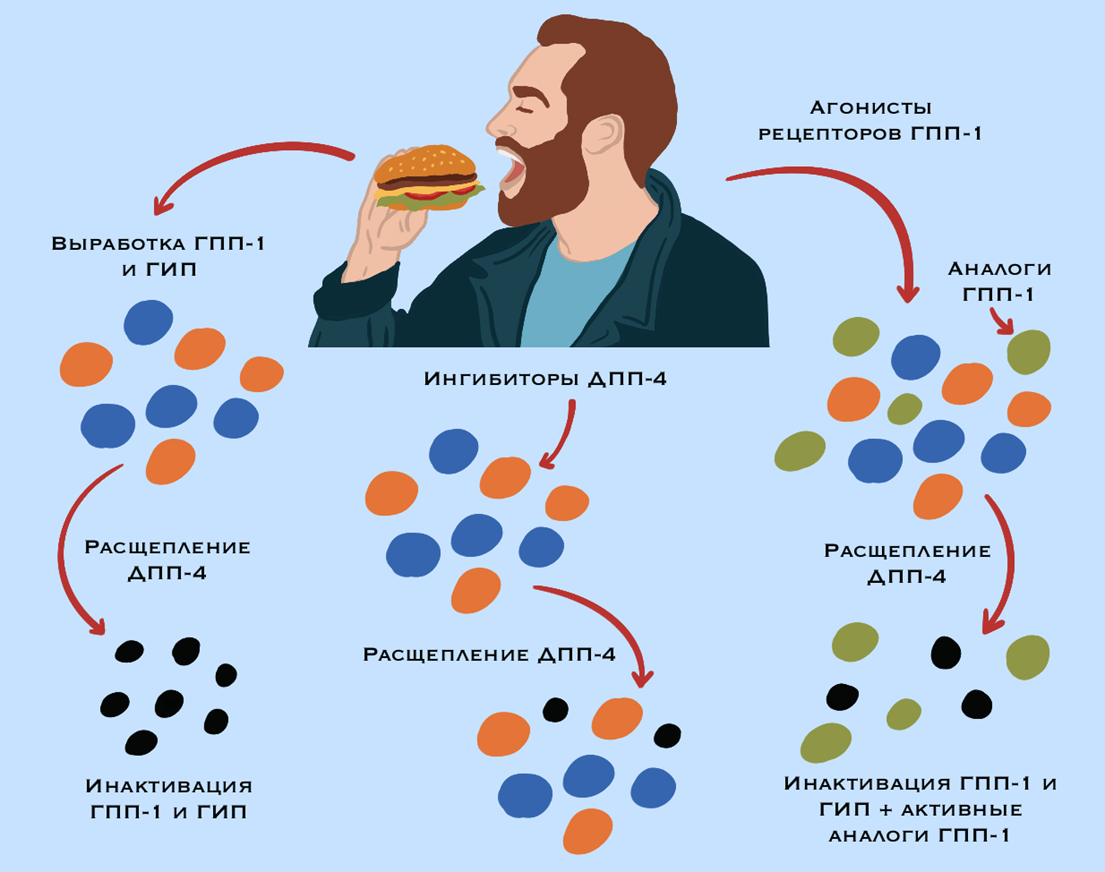
Рисунок 2. Стратегии усиления инкретинового сигнала. На схеме представлены фармакологические подходы к продлению действия инкретиновых гормонов (ГПП-1 и ГИП), которые высвобождаются в ответ на прием пищи и в течение нескольких минут инактивируются ДПП-4.
Ингибиторы ДПП-4 блокируют сам фермент. В результате естественные инкретины, высвобождаемые после еды, разрушаются гораздо медленнее, и их физиологический сигнал сохраняется дольше.
Помимо естественных гормонов, вводятся устойчивые к расщеплению ДПП-4 аналоги ГПП-1. Фермент ДПП-4 инактивирует естественные инкретины, но не может разрушить синтетические аналоги, что обеспечивает пролонгированный и мощный эффект.
иллюстрация Анастасии Самоукиной
Приятные неожиданности
Рецепторы ГПП-1 расположены не только в ЖКТ и гипоталамусе. По этой причине ученым удалось обнаружить у синтетических аналогов гормона и другие позитивные эффекты. Один из самых мощных, позволяющих агонистам рецепторов ГПП-1 хорошо смотреться на фоне других антидиабетических препаратов, — это кардиопротекция.
Сперва ученые сосредоточились на изучении сердечно-сосудистых рисков. Логика вполне понятная: сердечно-сосудистые катастрофы остаются основной причиной смерти людей во всем мире [9]. Практически для всех агонистов рецепторов ГПП-1 проведены клинические исследования. Оказалось, что они снижают риски возникновения инфаркта, инсульта и смертность от сердечно-сосудистых заболеваний (табл. 1). Но затем обнаружили и другие положительные эффекты [10]. Например, препарат хорошо показал себя в плане лечения хронической болезни почек и борьбы с синдромом обструктивного апноэ сна (СОАС), при котором у пациентов возникает частичная или полная остановка дыхания во сне. Качество сна ухудшается, нарушается насыщение кислородом некоторых областей мозга. Кроме этого, у больных может осложняться течение СД2 и растет риск развития патологий сердечно-сосудистой системы. В клинических исследованиях было показано, что тирзепатид помогает пациентам с СОАС не только в отношении «сердечных» симптомов, но и улучшает качество сна [11].
Про эти и другие эффекты «Биомолекула» писала несколько лет назад в статье «Оземпик: больше, чем средство для похудения» [12]. На тот момент были доступны данные лишь о результатах доклинических испытаний на моделях нейродегенеративных заболеваний, а клинических исследований не было. Ранее активно изучался ликсисенатид для лечения нейродегенераций (табл. 1), однако компания-производитель отозвала препарат с рынка из-за экономических причин (видимо, проигрывая конкуренцию с новыми препаратами). На данные момент стало известно, что улучшение ранней болезни Альцгеймера на фоне семаглутида не происходит. Еще несколько исследований на эту тему пока не закончены.
Позитивные новости о новых свойствах вещества на этом не закончились. Два года назад начала появляться информация об ослаблении зависимостей на фоне приема агонистов рецепторов ГПП-1, так как их рецепторы есть и в областях мозга [13], отвечающих за систему вознаграждения. Сейчас мы уже знаем и то, что семаглутид снижает тягу к алкоголю и никотину (табл. 1). Ученые намерены изучить этот момент подробнее и на примере других инкретинов. Так, в настоящее время ведется набор пациентов в клинические исследования, призванные изучить эффективность тирзепатида в ослаблении алкогольной зависимости.
| Название исследования | Препарат | Что исследовали? | Результаты |
|---|---|---|---|
| SUSTAIN-6 [14] | Семаглутид | Кардиопротективные эффекты | Положительные |
| SUMMIT [15] | Тирзепатид | ||
| LEADER [16] | Лираглутид | ||
| REWIND [17] | Дилаглутид | ||
| Ретроспективное исследование [18] | Семаглутид, лираглутид и тирзепатид | Кардиопротективные эффекты у пациентов с СД2 и синдромом обструктивного апноэ сна | Положительные, причем тирзепатид оказался более эффективным |
| FLOW [19] | Семаглутид | Защита почек | Положительные |
| Ретроспективное исследование [20] | Тирзепатид | Положительные | |
| Рандомизированное исследование [21] | Семаглутид | Алкогольная и никотиновая зависимость | Положительные |
| Наблюдательное исследование [22] | Семаглутид, тирзепатид | Алкогольная зависимость | Положительные |
| ESSENCE [23] | Семаглутид | Стеатогепатит | Положительные |
| SURMOUNT-OSA [11] | Тирзепатид | Синдром обструктивного апноэ сна | Положительные |
| Ретроспективное исследование [24] | Семаглутид, тирзепатид | Положительные, причем тирзепатид оказался более эффективным | |
| Ретроспективное исследование [25] | Лираглутид, семаглутид, тирзепатид | Остеоартрит | Положительные |
| LIXIPARK [26] | Ликсисенатид | Болезнь Паркинсона (ранние стадии) | Положительные |
| Проспективное пилотное исследование [27] | Лираглутид | Хроническая мигрень | Положительны |
Затем, уже в 2025 году, было показано [23], что на фоне приема семаглутида происходит улучшение состояния пациентов, страдающих жировой болезнью печени. Кроме того, в это же время появились новые данные о роли миметиков инкретинов в борьбе с совершенно другим заболеванием — остеоартритом (воспалительным заболеванием суставов; табл. 1). Остеоартрит сильно ухудшает качество жизни людей, страдающих им, ограничивая трудовую активность. Ситуация усугубляется при наличии лишнего веса, который дополнительно нагружает суставы. Немаловажным моментом здесь оказалось еще и то, что использование тирзепатида и семаглутида для людей с остеоартритом колена может быть еще и экономически выгодным для системы здравоохранения [28]. Для судьбы лекарства это несомненный плюс. Реальность жестока: правительства разных стран гораздо активнее вкладывают деньги в разработку и продвижение лекарств, способных помочь потенциально трудоспособным людям. Ведь именно они платят налоги, заставляют деньги «крутиться», а экономику — работать.
Не обошлось без изучения инкретинов и в сфере терапии онкологических заболеваний. Здесь исследования показали, что прием агонистов рецепторов ГПП-1 может быть связан с увеличением выживаемости пациентов, страдающих раком яичников [29] и нейроэндокринными неоплазиями [30]. Да и в целом снижает общий риск возникновения рака [31].
Ученые добрались и до неврологических болезней. Оказалось, что прием лираглутида улучшал состояние пациентов, страдающих хронической мигренью [27]. Интересно, что этот эффект не зависел от массы тела больных. В дополнение к этому, специалистам удалось добиться еще одного важного результата: улучшения когнитивных функций у страдающих СД2 [32]. Правда, пациентами в этом исследовании были не люди, а мыши, поэтому делать выводы пока рано.
Но и это не все положительные эффекты. В ходе наблюдений специалисты заметили у пациентов, принимавших агонисты ГПП-1, еще и улучшение эректильной функции [33]. Это открытие особенно важно, учитывая, что эректильная дисфункция часто сопутствует СД2 и серьезно влияет на качество жизни пациентов.
Не принимайте без рецепта, и сейчас поймете, почему
Инкретины могут показаться поистине волшебным средством. Но нам все же стоит помнить золотое правило фармакологической терапии: если у лекарства нет побочных эффектов, то и действующего вещества там, скорее всего, нет. Агонисты инкретинов, конечно же, не стали исключением. Раз уж они демонстрируют столь выраженные положительные эффекты, логично предположить наличие и побочных действий. И практика это подтверждает. Наиболее частые нежелательные явления при приеме препаратов на основе семаглутида связаны с желудочно-кишечным трактом. Пациенты чаще всего сообщают о тошноте, рвоте, диареи, боли в животе или запорах.
Однако спектр возможных осложнений оказался шире. Если ранее было известно о противопоказаниях для людей с острым панкреатитом и медуллярным раком щитовидной железы, то в 2025 году появились новые данные. Согласно им, прием агонистов рецепторов ГПП-1 может быть связан с повышенным риском развития гипотонии, обмороков, артрита, камней в почках и нефрита. При этом уровень возникновения нежелательных явлений значительно варьируется между разными препаратами [34]. Семаглутид занял промежуточное положение: на его долю пришлось 44,4% всех случаев нежелательных явлений, что более чем в 19 раз превышает показатель тирзепатида (2,3%), но уступает лираглутиду (53,2%).
Медуллярный рак щитовидной железы изначально наблюдался в экспериментах на животных [35]. Хотя распространенность рака щитовидной железы составляет менее 1% [36], компании-производители все равно добавили этот диагноз как противопоказание, а эндокринологи часто не просто проводят опрос, но и обследуют щитовидную железу перед назначением агонистов рецепторов инкретинов. На данный момент нет убедительных данных на людях о связи приема агонистов рецепторов ГПП-1 и возникновения рака щитовидной железы [37], но совсем исключать такой риск компании и врачи не спешат.
Параллельно с изучением соматических осложнений все большее внимание исследователей привлекает потенциальное влияние агонистов ГПП-1 на психическую сферу. В последнее время в СМИ активно обсуждается возможная связь между приемом этих препаратов и суицидальными мыслями. Действительно, на фоне приема семаглутида и лираглутида были зафиксированы психиатрические нарушения, включая депрессию, тревожность и суицидальные мысли. Однако важный нюанс заключается в том, что частота таких явлений составляет всего 1,2% [34], что требует дополнительного изучения. В других исследованиях был обнаружен риск развития головной боли, мигрени и нарушения обоняния [38], [39]. Кроме того, ученые обнаружили возникновение суицидальных мыслей на фоне приема семаглутида у пациентов, использующих его для снижения веса [38].
Обычно, чем дольше препарат существует на рынке, тем сильнее расширяется спектр нежелательных явлений, связанных с ним. Происходит это просто по причине накопления клинического опыта. Инкретины, опять-таки, не исключение. Особую настороженность у специалистов вызывают вестибулярные расстройства [40]: оба препарата, семаглутид и тирзепатид, ассоциированы с риском возникновения головокружения, причем у семаглутида этот риск выше. Заставляет задуматься еще и новая информация о риске для зрения [41], ведь ретинопатии давно рассматриваются специалистами в качестве потенциального осложнения повышенного уровня глюкозы. Значит, препараты, направленные на борьбу с диабетом, по логике должны затронуть и зрительный анализатор. Что касается инкретинов, семаглутид здесь продемонстрировал менее благоприятный профиль по сравнению с тирзепатидом. Другие же ученые сообщали о возникновении заболеваний зрительного нерва из-за недостаточного кровоснабжения на фоне приема семаглутида [42], хотя авторы подчеркивают, что риски оказались не такими высокими, как о них сообщалось ранее.
Мы уже говорили выше о том, что прием агонистов рецепторов инкретинов снижает общий риск развития онкологических заболеваний, включая менингиому, рак яичников и эндометрия, но, возможно, увеличивает риск развития рака почек [31].
Картина выходит довольно пугающей, не так ли? Но чтобы совсем не впасть в печаль, нам нужно сделать одну важную ремарку. Несмотря на тревожный характер новых данных о возможных осложнениях — от проблем со зрением до психических нарушений — ключевой момент состоит в том, что частота и выраженность желудочно-кишечных нежелательных явлений неизмеримо выше, чем всех остальных вместе взятых. Именно с ними сталкивается большинство пациентов, и они же являются основной причиной отказа от терапии.
Помимо этого, еще очень важно понимать, как происходит сбор такой информации. В государственный надзорный орган или в фармкомпанию поступают сообщения о том, что пациент принимает семаглутид для снижения веса, и у него наблюдается депрессия. При этом нельзя сказать, что депрессия возникла из-за приема семаглутида, причинно-следственной связи здесь нет, есть лишь два процесса, протекающие в теле одного пациента. Что еще произошло с этим пациентом? Какие еще лекарства он принимал? Какой образ жизни вел? В подавляющем большинстве случаев статистике все это, к сожалению, не известно. Поэтому врач всегда взвешивает риски и пользу, и для многих пациентов с СД2 или тяжелым ожирением польза от этих препаратов, состоящая в реальном снижении риска умереть от инфаркта или инсульта, несоизмеримо выше потенциальной опасности развития патологий других органов и систем.
Что же касается здорового человека, желающего просто «похудеть к лету», то его прежде всего должны беспокоить не гипотетические редкие осложнения, а нечто другое. Во-первых, возврат веса после отмены препарата. Ожирение — это хроническое заболевание. Его не вылечить, пропив курс препаратов, даже если это агонисты рецепторов инкретиновых гормонов. После отмены препарата вес вернется точно так же, как после прекращения диеты. Особенно если человек при этом избегает физической активности, не соблюдает гигиену сна, да и в целом ведет не очень-то здоровый образ жизни. Вторая проблема — потеря мышечной массы, когда вместе с жиром «сжигаются» и драгоценные мышцы [43], [44]. Мышечная ткань также, как и жировая, является инсулинозависимой, поэтому ничего удивительного тут нет.
Лекарственные формы не стоят на месте
Большинство пептидных терапевтических средств, включая ключевые препараты для лечения СД2, такие как инсулин и агонисты рецепторов ГПП-1, представляют собой растворы для подкожного введения. Хотя сама методика подкожных инъекций хорошо знакома пациентам с СД2 и может без труда осуществляться самостоятельно в домашних условиях с помощью шприц-ручки, на практике и пациенты, и врачи отдают явное предпочтение более современным автоинжекторам.
Автоинжекторы — это готовые к использованию, стерильные, одноразовые системы, не требующие консервантов. Вместе все эти плюсы сильно снижают риск местных реакций и иммунного ответа. Клинические данные это подтверждают: нежелательных реакций в месте введения инъекции, выполненных с помощью автоинжекторов, не наблюдается [45], а заранее установленная доза, скрытая игла и автоматизированный механизм введения упрощают введение препарата и обучение пациента.
Тут есть еще один важный момент, скорее, психологический. Известно, что приверженность пациента тому или иному способу лечения может зависеть от удобства метода. Неудобные, пугающие инструменты легко могут отпугнуть человека, серьезно снизив его готовность к долгосрочной терапии, что особенно важно в случае СД2 и ожирения. Необходимость каждый день делать себе укол шприцом может заставить человека чувствовать себя перманентно больным, а угнетенное состояние духа, как известно, ни в коем случае не способствует улучшению самочувствия.
Автоинжекторы выигрышно смотрятся и с этой стороны. При использовании шприц-ручки пациент сам дозирует препарат и устанавливает одноразовую иглу, ему не нужно быть постоянно на контроле медработника в случае, если он сам не умеет делать себе инъекции с помощью шприца, которые все же требуют определенной сноровки. А однодозовые автоинжекторы дают возможность не устанавливать одноразовую иглу и не заморачиваться с выставлением дозировки. Результаты исследований это подтверждают: пациенты неоднократно отмечали легкость способа введения лекарства с помощью одноразовых инжекторов [45], предпочитая их многоразовым шприц-ручкам [46].
Объяснить причины такого выбора можно с помощью одной простой аналогии. В плане технологии введения разница между автоинжектором и обычной шприц-ручкой аналогична разнице между автомобилем с автоматической и механической коробкой передач: оба выполняют одну функцию, но первый требует значительно меньше усилий и времени для освоения и минимизирует риск ошибки, особенно на начальном этапе [45].
Если же говорить о принципиально ином способе введения, то стоит обратиться к пероральной форме семаглутида. Казалось бы, таблетки должны решить все проблемы, связанные с инъекциями. Однако здесь есть свои сложности. Семаглутид в таблетках действительно снижает уровень гликированного гемоглобина [48], причем практически так же, как и инъекционные формы. В плане нежелательных явлений обе формы тоже проявляют себя сходным образом. В клинических исследованиях было показано, что частота возникновения ЖКТ симптомов (тошнота, диарея и т.д.) у таблеток [49] и инъекций [44] оказалась сопоставимой.
Ученые проанализировали данные, собранные из реальной медицинской практики за прошлые годы, о том, как пациенты переносят лекарство в разных формах. По сравнению с инъекциями, пероральный прием может быть ассоциирован и с другими нежелательными явлениями со стороны ЖКТ, в том числе панкреатитом [50]. Также учеными была обнаружена связь и с другими последствиями, не упомянутыми в инструкции. Например, с головокружением, повышенным уровнем гликированного гемоглобина, кетоацидозом, раком поджелудочной железы и другими эффектами. Таким пациентам часто приходилось обращаться за экстренной медицинской помощью. Однако здесь есть одно важное «но». Инъекционные формы в клинической практике появились раньше таблетированных. Поэтому у врачей и пациентов накопилось больше опыта аккуратного обращения с дозами уколов. А это значит, что наблюдаемая разница в профиле безопасности может быть связана не только с самой формой препарата, но и с человеческим фактором. Используя таблетки, пациенты могут без проблем самостоятельно изменять количество получаемого средства. Например, принимать двойную дозу, если пропустили предыдущую, или как-то иначе нарушать строгие правила приема.
К тому же, на всасывание таблеток в желудочно-кишечном тракте влияет множество факторов: что и когда человек поел, кислотность желудка, одновременный прием других лекарств. Это приводит к колебаниям концентрации препарата в крови, что может провоцировать нежелательные реакции. Доза инъекции поступает в организм точно и предсказуемо.
Однако будем честны, подкожные способы введения тоже оказались не лишены проблем. Для инъекционной формы основной проблемой по-прежнему остаются осложнения из-за процедуры введения препарата и нарушение расписания. При этом применение инъекционной формы сопряжено с определенными рисками в работе эндокринной системы. Наблюдается связь с возникновением кист и полипов щитовидной железы. Кроме того, возможно, существует связь с развитием онкологических патологий щитовидной железы.
Подводя итог сказанному выше, нужно отметить, что все это было доказано с помощью наблюдательных исследований на реальных пациентах. К сожалению, при этом специалистам зачастую было неизвестно, принимали ли пациенты вместе с семаглутидом другие лекарства и как тщательно соблюдали дозировки и режим. А это очень важно! Ведь только полная информация о пациенте может помочь врачу правильно учесть все риски при назначении препарата. Поэтому об окончательном подтверждении взаимосвязи между приемом семаглутида в разных формах и возникновением нежелательных явлений говорить еще рано. Науке требуются дополнительные исследования.
Потенциальные новинки на рынке
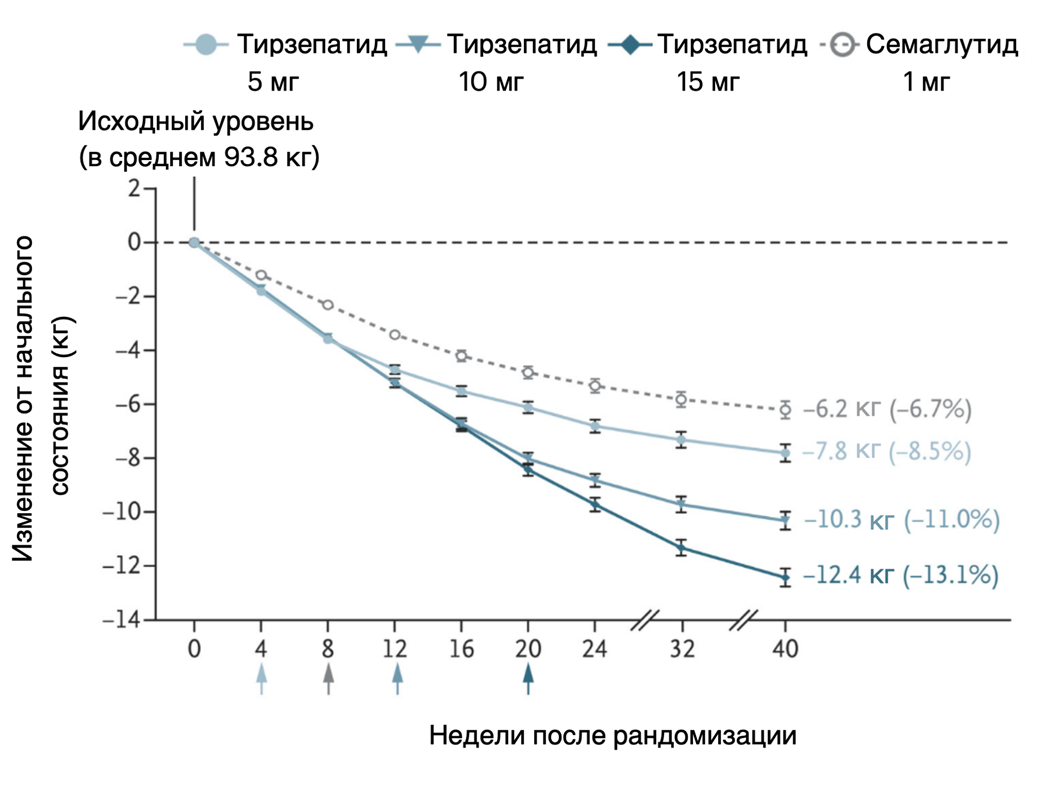
Эволюция инкретиновой терапии за короткое время сделала впечатляющий рывок вперед. Все началось с лираглутида, заложившего фундамент, но обременявшего пациентов необходимостью ежедневных инъекций. Но настоящую революцию совершил семаглутид. С его помощью пациенты могли принимать лекарство всего один раз в неделю — этого было достаточно. Однако триумф средства был недолгим — благодаря двойному механизму действия тирзепатид показал превосходную эффективность в снижении веса (рис. 4) и уровня сахара в крови. Для рейтинга продаж последствия были ожидаемыми: семаглутид быстро уступил новому средству лидирующие позиции на рынке.
Далее события развивались стремительно. Пока мир еще только осваивал эту новинку, научные лаборатории уже представили следующего «игрока» — ретатрутид — тройной агонист, открывающий новую эру в системе многокомпонентного воздействия на метаболизм. Помимо рецепторов ГПП-1 и ГИП, это средство активирует еще и рецептор глюкагона.
Как и предыдущие молекулы, ретатрутид тоже вводят подкожно один раз в неделю. При этом специалисты отмечают, что новое вещество не только эффективно снижает вес, но и не вызывает серьезных побочных эффектов [51]. Так это или иначе, мы вскоре сможем в этом убедиться. Сейчас на третьей фазе находятся сразу 5 клинических исследований: от изучения снижения массы тела и лечения диабета до оценки сердечно-сосудистых явлений и способности улучшать состояние пациентов с остеоартритом [52].
Впрочем, кроме увеличения количества рецепторов, на которые воздействует одна и та же молекула, в терапии существует и другой подход — комбинация уже существующего семаглутида и агонистов других гормонов, влияющих на аппетит. Амилин, один из таких гормонов, секретируется параллельно вместе с инсулином и играет роль в регуляции глюкозы, опорожнении желудка и продлевает чувство сытости.
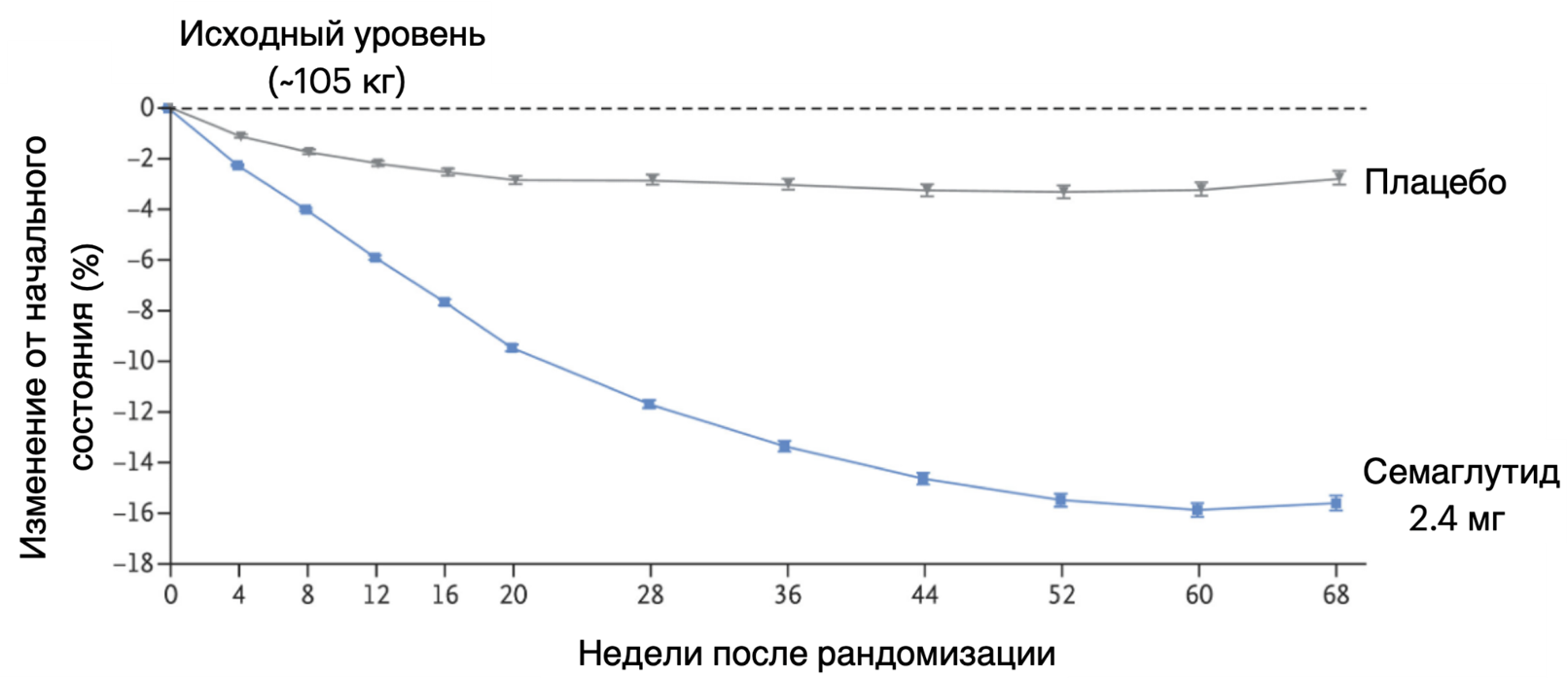
На данный момент исследуется совместное введение семаглутида и кагрилинтида, аналога амилина. За 68 недель эта комбинация снизила массу тела на 20,4% [53]. Нежелательные явления были преходящими и имели легкую или среднюю степень тяжести, затрагивая в основном ЖКТ.
Другой пример — комбинация семаглутида и аналога апелина, еще одного пептида, секреция которого зависит от инсулина и подавляет чувство голода. Ему посвящена отдельная статья на «Биомолекуле»: «Воздействие на апелинергическую систему как перспективное направление биофармацевтики» [54]. Имеющиеся данные доклинических исследований указывают на то, что комбинация агонистов рецепторов апелина и ГПП-1 не только приводит к снижению веса, но и помогает рекомпозиции тела, т.е. одновременному сжиганию жира и наращиванию мышечной массы, при котором общая масса остается практически неизменной [55]. Апелин играет важную роль в насыщении мышц кислородом и участвует в регенерации мышц [56], [57], что может решить проблему потери мышечной массы при похудении.
Сейчас на животных ученые исследуют также и комбинации агонистов рецепторов ГПП-1 с еще одним пептидом — YY, важным для регуляции аппетита. Совместное введение семаглутида и агониста пептида YY привело к большему снижению массы тела по сравнению с одним семаглутидом (14,0±4,9% vs 9,9±1,5%) [58].
Интересным механизмом обладает также препарат MariTide — агонист рецепторов ГПП-1 и антагонист ГИП. Благодаря пролонгированному действию, препарат вводится всего один раз в месяц. Результаты второй фазы клинических исследований подтвердили выраженный эффект в снижении веса — за 52 недели терапии было достигнуто уменьшение массы тела на 8–12% [59]. При этом побочные эффекты наблюдались преимущественно на небольших дозах, а с увеличением дозы их частота снижалась. Само существование такого препарата может показаться нелогичным, ведь часть эффекта MariTide — ингибирование ГИП, что абсолютно противоположно механизму уже знакомого нам тирзепатида. Как же получается, что оба механизма могут быть клинически значимыми?
Точного ответа на этот вопрос мы еще не знаем, ведь рецептор ГИП работает как сложный переключатель. С одной стороны, активация рецепторов ГИП усиливает положительные эффекты ГПП-1. Отдельно агонисты рецепторов ГИП работают плохо для лечения диабета, потому что по сравнению со здоровыми людьми у пациентов с СД2 снижен инсулинотропный эффект ГИП из-за резистентности к нему [60]. С резистентностью к ГИП частично можно бороться аналогами ГПП-1, которые независимо снижают уровень глюкозы. Вероятно, снижение веса на фоне тирзепатида достигается смещением агонизма в сторону рецептора ГПП-1, а не за счет активации рецепторов ГИП.
С другой стороны, сам по себе ГИП приводит к увеличению кровоснабжения жировых клеток, насыщения их питательными веществами и накоплению жиров [61]. Также ГИП способствует выработке адипокинов, что увеличивает локальное воспаление. Всего этого хотелось бы избежать при похудении.
Есть разные теории, объясняющие этот парадокс [62]. Одна из них — при хронической активации ГИП возникает резистентность к нему, а значит, тирзепатид функционально работает так же, как и MariTide. Другая говорит о том, что агонисты и антагонисты ГИП влияют на разные популяции нейронов в ЦНС, но оба эффекта приводят к продолжительному чувству сытости у мышей. Еще одна теория предполагает, что если на одной клетке экспрессированы оба рецептора — и ГПП-1, и ГИП — то секреция инсулина синергично усиливается. Все это ученым только предстоит подтвердить или опровергнуть в будущем.
Прочитав все написанное выше, можно подумать, что эра семаглутида уже осталась окончательно позади, но это не совсем так. Фармхимики все же стараются вдохнуть в саму концепцию новую жизнь. Так, одно из направлений — создание агонистов рецепторов ГПП-1 в виде таблетки. Но это уже не пептидные аналоги ГПП-1, а синтетические «малые молекулы». Хорошим примером является орфоглипрон (рис. 5) [63], который снижает как уровень гликированного гемоглобина, так и вес в зависимости от дозы, что было исследовано в 3 фазе клинических испытаний [64].
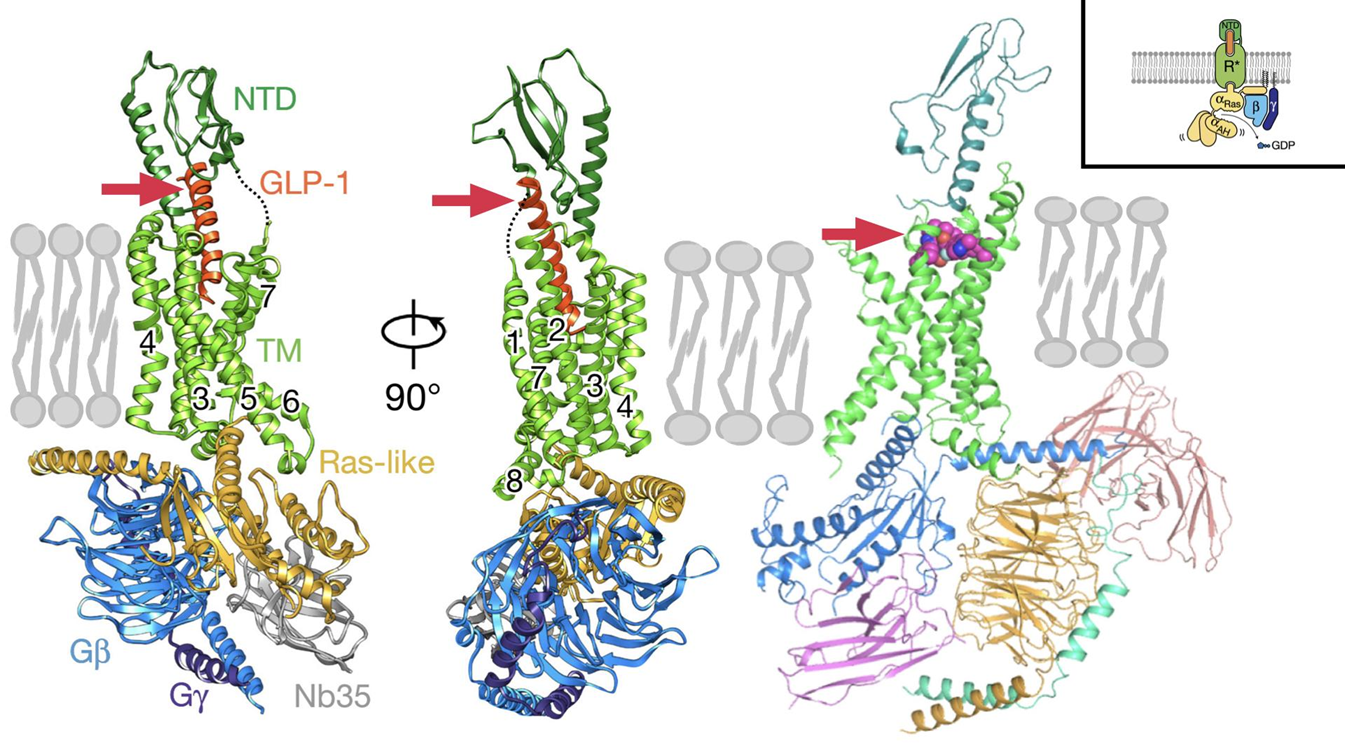
Рисунок 5. Связывание рецептора ГПП-1 с пептидным агонистом семаглутидом (слева и посередине) и низкомолекулярным агонистом орфоглипроном (справа). Рецепторы ГПП-1, глюкагона и ГИП — яркие представители семейства B G-белоксопряженных рецепторов . Рецепторы этого класса в дополнение к «фирменной» фишке всех GPCR — пучку из семи трансмембранных ɑ-спиралей — также имеют большой внеклеточный N-концевой домен (NTD), захватывающий пептидный гормон из раствора и вставляющий его N-концом себе в трансмембранный домен (ТМ), где находится распознающий центр, активация которого меняет всю конформацию рецептора и запускает внутриклеточный каскад реакций, инициируемый G-белком. ГПП-1 (GLP-1) взаимодействует с шестью ТМ-спиралями, а орфоглипрон — только с четырьмя, но этого оказывается достаточно для схожего с семаглутидом эффекта.
GPCR’ам на «Биомолекуле» посвящен отдельный раздел, а также множество статей, начиная от механизмов работы нашего зрительного фотосенсора родопсина [65] и адренорецепторов [66], [67] до тонкостей аллостерической регуляции GPCR [68].
адаптировано автором из [69] и [70]. На сайте Protein Data Bank можно интерактивно покрутить эти структуры GLP-R1 в комплексе с семаглутидом или орфоглипроном.
Пока еще рано говорить о регистрации этого вещества, потому что у науки уже есть негативный опыт с другим низкомолекулярным аналогом ГПП-1 — дануглипроном, который провалился из-за гепатотоксичности. Что касается перорального семаглутида, в начале года FDA приняло заявку на его регистрацию для снижения массы тела у пациентов с избыточным весом при одновременном наличии других связанных с ожирением заболеваний. Однако биодоступность таблеток ниже, чем подкожных уколов, а значит, доза перорального семаглутида выше .
Стартовая доза подкожного семаглутида составляет 0,25 мг в неделю, а потом она постепенно повышается до 2,4 мг для лечения СД2. Постепенное увеличение дозы дает организму время привыкнуть и снижает частоту побочных явлений на ЖКТ. Пациенту проще адаптироваться, не испытывая постоянной тошноты. Пероральный семаглутид также зарегистрирован FDA для лечения СД2 с дозировками от 3 до 14 мг в сутки, в России он также появился в 2025 году. Однако таблетку для снижения веса испытывали в дозировках еще выше: 25 мг и 50 мг. За 64 недели вес снизился на 13,6% на фоне приема 25 мг [49].
Еще одно направление в терапии СД2 и ожирения с помощью инкретинов сосредоточилось на генетической разработке агонистов рецептора ГПП-1. Нуклеотидная последовательность, кодирующая аналог ГПП-1, встраивается в аденоассоциированный вирусный вектор и затем доставляется до ядра клетки пациента. Тут ученые, помимо ГПП-1, в качестве гена-кандидата для снижения веса рассматривают также лептин и его рецептор, проопиомеланокортин, PPARy, MC4R и другие молекулы [71]. Про них рассказано в статье «Аппетит как мишень: почему все попытки обуздать ожирение и диабет проваливались, пока не появились агонисты рецепторов инкретинов» [6].
Подробнее об аденоассоциированных вирусах и генной терапии можно прочитать статьи на «Биомолекуле»: «Крохотные курьеры: как аденоассоциированные вирусы спасают жизни» [72], «Время первых: как аденоассоциированные вирусы стали лучшими в доставке генов in vivo» [73].
Хотя исследования генетического аналога ГПП-1 пока еще не добрались до стадии клинических испытаний, но данные уже довольно многообещающие: однократное введение снижает вес и уровень глюкозы у мышей с ожирением, вызванным избыточным потреблением пищи. Препарат демонстрирует саморегулирующийся эффект: у мышей с исходно нормальным весом не наблюдается чрезмерного снижения массы тела. Это указывает на снижение рисков при достижении пациентом целевых, физиологических показателей веса.
Доступность препаратов на рынке: кризис закончен?
Когда на смену семаглутиду пришел его мощный преемник — тирзепатид, — все, казалось бы, могли вздохнуть с облегчением. Врачи получили более эффективный инструмент, а пациенты — новые надежды. Но у этой медали быстро нашлась и оборотная, проблемная сторона.
Чтобы минимизировать побочные эффекты на ЖКТ, агонисты рецепторов инкретинов назначают сначала в низкой дозе, а затем постепенно увеличивают ее до терапевтической. В погоне за лучшим результатом система столкнулась с неожиданным риском: когда пациента с максимальной дозы семаглутида из-за дефицита лекарства на рынке или каких-либо иных причин переводят на тирзепатид, врач вынужден начинать все заново. Новый препарат нужно начинать принимать «с нуля», то есть опять начать с низкой, неэффективной дозировки. В результате этого у пациента развивается состояние «глюкозных качелей» — резкие и частые колебания уровня сахара в крови, когда он то поднимается слишком высоко (гипергликемия), то падает слишком низко (гипогликемия). Для людей, страдающих диабетом, это может быть даже смертельно опасно.
Помимо проблемы уровня глюкозы, остро стоит еще и вопрос о доступности инновационных терапий. За последние несколько лет государственные структуры по-разному справлялись с дефицитом семаглутида, который неизбежно наступал из-за недостатка мощностей производителя и большого количество желающих получить «волшебное средство» для легкого похудения.
Без механизмов регулирования такие препараты, как агонисты ГПП-1, действительно могут усугубить медико-социальное неравенство. И это не голословное предположение. Согласно социально-экономическим исследованиям, в Швеции препараты на основе семаглутида для использования не по показаниям (офф-лейбл) чаще всего покупали именно люди с высоким доходом [74]. Такая тенденция наблюдалась повсеместно. Так, масштабное исследование показало, что интерес к агонистам рецепторов ГПП-1 оставался неизменно высоким в «богатых» странах, в то время как менее экономически благополучные страны с высоким индексом ожирения часто оказывались лишенными полноценного доступа к лекарству [75].
К сожалению, это не новая история. У нее есть печальный, но поучительный прецедент. Похожая ситуация ранее уже складывалась с антигипертензивными препаратами и статинами, которые изначально также быстрее всего распространялись в странах с высоким уровнем дохода. Расширение доступа к ним заняло десятилетия и произошло в основном благодаря истечению сроков патентной защиты и появлению дженериков. С агонистами рецепторов ГПП-1 возникает та же проблема, и решать ее нужно уже сейчас.
Один из вариантов выхода из этой непростой ситуации с дефицитом предложили в США. Там аналоги ГПП-1 были разрешены к изготовлению и продаже в композитных аптеках. Это аналог наших отечественных производственных аптек [76]. В таких аптеках часто изготавливают лекарства по индивидуальным рецептам, что позволяет избежать многих юридических сложностей и серьезно сократить время пути лекарства от производителя до пациента. В такой системе врач составляет индивидуальный рецепт, персонально для каждого больного. Например, может изменяться дозировка или вспомогательные вещества в зависимости от нужд конкретного пациента.
Звучит неплохо, но и у такого подхода есть свои подводные камни. В США препараты, изготовленные в производственной аптеке, не приравниваются к одобренным FDA и регулируются не так строго, как проверенные госорганами средства. Субстанции в такие аптеки часто попадают из Китая или Индии, а проверка качества остается на совести аптеки. Из плюсов для пациента — стоимость на готовый препарат из производственной аптеки будет ниже, чем на препарат, выпущенный крупной фармкомпанией. Цена на агонисты ГПП-1 может быть дополнительно снижена еще и в том случае, если страховка пациента не покрывает затраты на шприц-ручку. В композитной аптеке ему вполне могут изготовить препарат в виде раствора с более дешевым шприцем для подкожного введения.
Эта гибкая модель доказала свою эффективность в период острого дефицита. В 2025 году FDA объявило, что нехватка тирзепатида и семаглутида преодолена. Производители нарастили мощности и в полной мере удовлетворяют спрос на национальном уровне.
В России не выписывают рецепты для ручного изготовления на высокотехнологичные препараты, а копировать препарат, защищенный патентом, запрещено. То есть решить «американским» способом дефицит препаратов, к сожалению, не представляется возможным. Одним способом помочь пациентам с СД2 стало включение семаглутида в особый список, ЖНВЛП (тирзепатид в него не входит).
С другой стороны, была дана возможность производить аналоги ГПП-1 локально. После того, как зарубежные компании-производители перестали поставлять семаглутид и тирзепатид в Россию, вопрос о создании отечественных средств встал довольно остро. Чтобы решить эту проблему, в случае с семаглутидом подключился механизм принудительного лицензирования: через суд было разрешено производить этот препарат. Производство было локализовано, а цена на препарат значительно снизилась по сравнению с зарубежным оригиналом. С тирзепатидом дела обстоят проще — патент на него в России не зарегистрирован. Благодаря этому продажи аналогов ГПП-1 в первом квартале 2025 года в России увеличились в шесть раз.
Эпоха терапевтической революции, начатая инкретиновыми препаратами, вступает в новую фазу. Первоначальная шумиха и кризис доступности уступают место стабильности рынка и растущей демократизации лечения. За тирзепатидом, сегодняшним лидером, уже видны очертания новых претендентов — многоцелевых агонистов и пероральных аналогов. В этом стремительном развитии ключевым становится баланс: с одной стороны, мы накапливаем все более детальный портрет безопасности, требующий взвешенного подхода, а с другой — видим, что эти молекулы остаются мощнейшим инструментом в борьбе с СД2 и ожирением, а их потенциал в новых областях, таких как остеоартрит, продолжает обнадеживающе раскрываться. Дорога вперед — это не слепая гонка за новинками, а осознанное применение поистине прорывных средств с постоянно растущей доказательной базой.
Литература
- H. ELRICK, L. STIMMLER, C. J. HLAD, Y. ARAI. (1964). Plasma Insulin Response to Oral and Intravenous Glucose Administration1. The Journal of Clinical Endocrinology & Metabolism. 24, 1076-1082;
- R. Ebert, H. Unger, W. Creutzfeldt. (1983). Preservation of incretin activity after removal of gastric inhibitory polypeptide (GIP) from rat gut extracts by immunoadsorption. Diabetologia. 24;
- Arthur Anatolievich Lee, Victoria Alexandrovna Khotina, Dmitry Alexandrovich Kashirskikh, Olga Evgenevna Voronko, Vagif Ali oglu Gasanov, Andrey Valentinovich Vasiliev. (2025). Incretin-Based Therapies Through the Decades: Molecular Innovations and Clinical Impact. Medical Sciences. 13, 269;
- Mazzaferro S., Chen H. et. al.GLP1R Agonists Activate Human POMC Neurons. Cell Press. — 38 p.;
- Daniel J. Drucker. (2018). Mechanisms of Action and Therapeutic Application of Glucagon-like Peptide-1. Cell Metabolism. 27, 740-756;
- Аппетит как мишень: почему все попытки обуздать ожирение и диабет проваливались, пока не появились агонисты рецепторов инкретинов;
- Julio Rosenstock, Dale Allison, Andreas L. Birkenfeld, Thalia Marie Blicher, Srikanth Deenadayalan, et. al.. (2019). Effect of Additional Oral Semaglutide vs Sitagliptin on Glycated Hemoglobin in Adults With Type 2 Diabetes Uncontrolled With Metformin Alone or With Sulfonylurea. JAMA. 321, 1466;
- Yutaka Seino, Yasuo Terauchi, Takeshi Osonoi, Daisuke Yabe, Nobuyuki Abe, et. al.. (2018). Safety and efficacy of semaglutide once weekly vs sitagliptin once daily, both as monotherapy in
J apanese people with type 2 diabetes. Diabetes Obesity Metabolism. 20, 378-388; - Сосудистые катастрофы и травмы ЦНС: можно ли спасти поврежденный мозг;
- Daria Abasheva, Alberto Ortiz, Beatriz Fernandez-Fernandez. (2024). GLP-1 receptor agonists in patients with chronic kidney disease and either overweight or obesity. Clinical Kidney Journal. 17, ii19-ii35;
- Atul Malhotra, Ronald R. Grunstein, Ingo Fietze, Terri E. Weaver, Susan Redline, et. al.. (2024). Tirzepatide for the Treatment of Obstructive Sleep Apnea and Obesity. N Engl J Med;
- Оземпик: больше, чем средство для похудения;
- Amber L. Alhadeff, Laura E. Rupprecht, Matthew R. Hayes. (2012). GLP-1 Neurons in the Nucleus of the Solitary Tract Project Directly to the Ventral Tegmental Area and Nucleus Accumbens to Control for Food Intake. Endocrinology. 153, 647-658;
- Steven P. Marso, Stephen C. Bain, Agostino Consoli, Freddy G. Eliaschewitz, Esteban Jódar, et. al.. (2016). Semaglutide and Cardiovascular Outcomes in Patients with Type 2 Diabetes. N Engl J Med. 375, 1834-1844;
- Milton Packer, Michael R. Zile, Christopher M. Kramer, Seth J. Baum, Sheldon E. Litwin, et. al.. (2025). Tirzepatide for Heart Failure with Preserved Ejection Fraction and Obesity. N Engl J Med. 392, 427-437;
- Steven P. Marso, Gilbert H. Daniels, Kirstine Brown-Frandsen, Peter Kristensen, Johannes F.E. Mann, et. al.. (2016). Liraglutide and Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med. 375, 311-322;
- Hertzel C Gerstein, Helen M Colhoun, Gilles R Dagenais, Rafael Diaz, Mark Lakshmanan, et. al.. (2019). Dulaglutide and cardiovascular outcomes in type 2 diabetes (REWIND): a double-blind, randomised placebo-controlled trial. The Lancet. 394, 121-130;
- Alex E. Henney, David R. Riley, Matthew Anson, Megan Heague, Gema Hernadez, et. al.. (2025). Comparative Efficacy of Tirzepatide, Liraglutide, and Semaglutide in Reduction of Risk of Major Adverse Cardiovascular Events in Patients with Obstructive Sleep Apnea and Type 2 Diabetes: Real-World Evidence. Annals ATS. 22, 1042-1052;
- Vlado Perkovic, Katherine R. Tuttle, Peter Rossing, Kenneth W. Mahaffey, Johannes F.E. Mann, et. al.. (2024). Effects of Semaglutide on Chronic Kidney Disease in Patients with Type 2 Diabetes. N Engl J Med. 391, 109-121;
- SHIZUKA KANEKO, TOMONAO HIROBATA. (2025). 378-P: Enhanced Renal Protective Effects of Tirzepatide in T2D People. Diabetes. 74;
- Christian S. Hendershot, Michael P. Bremmer, Michael B. Paladino, Georgios Kostantinis, Thomas A. Gilmore, et. al.. (2025). Once-Weekly Semaglutide in Adults With Alcohol Use Disorder. JAMA Psychiatry. 82, 395;
- Fatima Quddos, Zachary Hubshman, Allison Tegge, Daniel Sane, Erin Marti, et. al.. (2023). Semaglutide and Tirzepatide reduce alcohol consumption in individuals with obesity. Sci Rep. 13;
- Arun J. Sanyal, Philip N. Newsome, Iris Kliers, Laura Harms Østergaard, Michelle T. Long, et. al.. (2025). Phase 3 Trial of Semaglutide in Metabolic Dysfunction–Associated Steatohepatitis. N Engl J Med. 392, 2089-2099;
- Onur Baser, Yuanqing Lu, Shangrui Chen, Shangrui Chen, Erdem Baser. (2024). Tirzepatide and Semaglutide for the Treatment of Obstructive Sleep Apnea and Obesity: A Retrospective Analysis. MRAJ. 13;
- Onur Baser, Katarzyna Rodchenko, Elizabeth Vivier, Isabel Baser, Yuanqing Lu, Munira Mohamed. (2024). The impact of approved anti-obesity medications on osteoarthritis. Expert Opinion on Pharmacotherapy. 25, 1565-1573;
- Wassilios G. Meissner, Philippe Remy, Caroline Giordana, David Maltête, Pascal Derkinderen, et. al.. (2024). Trial of Lixisenatide in Early Parkinson’s Disease. N Engl J Med. 390, 1176-1185;
- Simone Braca, Cinzia Valeria Russo, Antonio Stornaiuolo, Gennaro Cretella, Angelo Miele, et. al.. (2025). Effectiveness and tolerability of liraglutide as add‐on treatment in patients with obesity and high‐frequency or chronic migraine: A prospective pilot study. Headache. 65, 1831-1838;
- Daniel J. Betensky, Karen C. Smith, Jeffrey N. Katz, Catherine Yang, David J. Hunter, et. al.. (2025). The Cost-Effectiveness of Semaglutide and Tirzepatide for Patients With Knee Osteoarthritis and Obesity. Ann Intern Med. 178, 1549-1560;
- Min Wang, Tong Dong, Maria Lucero, Wanchun Pan, Xin Wang, et. al.. (2025). Association between glucagon-like peptide-1 receptor agonists and ovarian cancer survival: A population-based cohort study. Gynecologic Oncology. 199, 57-63;
- Manal S. Fawzy, Awwad Alenezy, Jessan A. Jishu, Issa Khan, Ahmad Dessouky, et. al.. (2025). Survival Benefits of GLP-1 Receptor Agonists in Patients with Neuroendocrine Neoplasms: A Large-Scale Propensity-Matched Cohort Study. Cancers. 17, 1593;
- Hao Dai, Yongqiu Li, Yao An Lee, Ying Lu, Thomas J. George, et. al.. (2025). GLP-1 Receptor Agonists and Cancer Risk in Adults With Obesity. JAMA Oncol. 11, 1186;
- Yan Zhu, Yi He, Hongyan Yang, Yanbo Gao, Yan Wang, et. al.. (2025). Semaglutide ameliorates diabetes-associated cognitive dysfunction in mouse model of type 2 diabetes. PLoS One. 20, e0326897;
- Dimitris Kounatidis, Natalia G. Vallianou, Eleni Rebelos, Kalliopi Vallianou, Evanthia Diakoumopoulou, et. al.. (2025). The Impact of Glucagon-like Peptide-1 Receptor Agonists on Erectile Function: Friend or Foe?. Biomolecules. 15, 1284;
- Mansour Tobaiqy, Hajer Elkout. (2024). Psychiatric adverse events associated with semaglutide, liraglutide and tirzepatide: a pharmacovigilance analysis of individual case safety reports submitted to the EudraVigilance database. Int J Clin Pharm. 46, 488-495;
- Lars Wichmann Madsen, Jeffrey A. Knauf, Carsten Gotfredsen, Andrew Pilling, Ingrid Sjögren, et. al.. (2012). GLP-1 Receptor Agonists and the Thyroid: C-Cell Effects in Mice Are Mediated via the GLP-1 Receptor and not Associated with RET Activation. Endocrinology. 153, 1538-1547;
- Catalin Feier, Razvan Vonica, Alaviana Faur, Diana Streinu, Calin Muntean. (2024). Assessment of Thyroid Carcinogenic Risk and Safety Profile of GLP1-RA Semaglutide (Ozempic) Therapy for Diabetes Mellitus and Obesity: A Systematic Literature Review. IJMS. 25, 4346;
- Ana E. Espinosa De Ycaza, Juan P. Brito, Rozalina G. McCoy, Hui Shao, Naykky Singh Ospina. (2024). Glucagon-Like Peptide-1 Receptor Agonists and Thyroid Cancer: A Narrative Review. Thyroid®;
- Wenchao Lu, Shihan Wang, Huilin Tang, Tao Yuan, Wei Zuo, Yuling Liu. (2025). Neuropsychiatric adverse events associated with Glucagon-like peptide-1 receptor agonists: a pharmacovigilance analysis of the FDA Adverse Event Reporting System database. Eur. Psychiatr.. 68;
- Edward J Modestino, Abdalla Bowirrat, Kai-Uwe Lewandrowski3, Alireza Sharafshah, Rajendra D Badgaiyan, et. al.. (2024). Hemiplegic Migraines Exacerbated using an Injectable GLP-1 Agonist for Weight Loss. Act Scie Neuro. 12-18;
- Eman A. Toraih, Awwad Alenezy, Mohammad H. Hussein, Shahmeer Hashmat, Saitej Mummadi, et. al.. (2025). The Risk of Vestibular Disorders with Semaglutide and Tirzepatide: Findings from a Large Real-World Cohort. Biomedicines. 13, 1049;
- Moiz Lakhani, Angela T.H. Kwan, Andrew Mihalache, Marko M. Popovic, Keean Nanji, et. al.. (2025). Association of Glucagon-Like Peptide-1 Receptor Agonists With Optic Nerve and Retinal Adverse Events: A Population-Based Observational Study Across 180 Countries. American Journal of Ophthalmology. 277, 148-168;
- Cindy X. Cai, Michelle Hribar, Sally Baxter, Kerry Goetz, Swarup S. Swaminathan, et. al.. (2025). Semaglutide and Nonarteritic Anterior Ischemic Optic Neuropathy. JAMA Ophthalmol. 143, 304;
- Takuya Karasawa, Ran Hee Choi, Cesar A. Meza, Subhasmita Rout, Micah J. Drummond, et. al.. (2025). Unexpected effects of semaglutide on skeletal muscle mass and force-generating capacity in mice. Cell Metabolism. 37, 1619-1620;
- John P.H. Wilding, Rachel L. Batterham, Salvatore Calanna, Melanie Davies, Luc F. Van Gaal, et. al.. (2021). Once-Weekly Semaglutide in Adults with Overweight or Obesity. N Engl J Med. 384, 989-1002;
- Søren Snitker, Christina Egebjerg, Marie Frederiksen, Thomas Sparre. (2022). Ease‐of‐use and acceptability of the novel semaglutide 2.4 mg single‐dose pen‐injector in people with overweight or obesity in the
STEP 8 phaseIII trial. Diabetes Obesity Metabolism. 24, 2273-2276; - Louis S. Matza, Kristina S. Boye, Katie D. Stewart, Karin S. Coyne, Paula K. Wullenweber, et. al.. (2020). Assessing patient PREFERence between the dulaglutide pen and the semaglutide pen: A crossover study (PREFER). Diabetes Obesity Metabolism. 22, 355-364;
- Andreas Schneider, Reto Jost, Christoph Jordi, Jakob Lange. (2023). Autoinjectors for large-volume subcutaneous drug delivery: a review of current research and future directions. Expert Opinion on Drug Delivery. 20, 815-830;
- Gian Paolo Fadini, Benedetta Maria Bonora, Mariangela Ghiani, Roberto Anichini, Elena Melchionda, et. al.. (2024). Oral or injectable semaglutide for the management of type 2 diabetes in routine care: A multicentre observational study comparing matched cohorts. Diabetes Obesity Metabolism. 26, 2390-2400;
- Sean Wharton, Ildiko Lingvay, Pawel Bogdanski, Ruben Duque do Vale, Stephan Jacob, et. al.. (2025). Oral Semaglutide at a Dose of 25 mg in Adults with Overweight or Obesity. N Engl J Med. 393, 1077-1087;
- Kaibin Niu, Maoxia Fan, Wulin Gao, Chen Chen, Guohua Dai. (2024). Adverse events in different administration routes of semaglutide: a pharmacovigilance study based on the FDA adverse event reporting system. Front. Pharmacol.. 15;
- Kibret Enyew Belay, Rebil Heiru Jemal, Aloys Tuyizere. (2024). Innovative Glucagon-based Therapies for Obesity. Journal of the Endocrine Society. 8;
- Juan P. Frías, Melanie J. Davies, Julio Rosenstock, Federico C. Pérez Manghi, Laura Fernández Landó, et. al.. (2021). Tirzepatide versus Semaglutide Once Weekly in Patients with Type 2 Diabetes. N Engl J Med. 385, 503-515;
- W. Timothy Garvey, Matthias Blüher, Cynthia Karenina Osorto Contreras, Melanie J. Davies, Eva Winning Lehmann, et. al.. (2025). Coadministered Cagrilintide and Semaglutide in Adults with Overweight or Obesity. N Engl J Med. 393, 635-647;
- Воздействие на апелинергическую систему как перспективное направление биофармацевтики;
- ZHICHAO WANG, WENXI LI, LIHONG HU, ZHENZHEN ZHU, NA LIU, et. al.. (2025). 1688-P: Novel Oral Apelin Receptor Agonist PSTC1201 for Selective Weight Loss with Muscle Preservation When Combined with Semaglutide in DIO Mice Model. Diabetes. 74;
- Roland Ligetvári, István Szokodi, Gabriella Far, Éva Csöndör, Ákos Móra, et. al.. (2023). Apelin as a Potential Regulator of Peak Athletic Performance. IJMS. 24, 8195;
- Emmeran Le Moal, Yuguo Liu, Jasmin Collerette-Tremblay, Simon Dumontier, Paul Fabre, et. al.. (2024). Apelin stimulation of the vascular skeletal muscle stem cell niche enhances endogenous repair in dystrophic mice. Sci. Transl. Med.. 16;
- Marie Oertel, Christian G Ziegler, Michael Kohlhaas, Alexander Nickel, Simon Kloock, et. al.. (2024). GLP-1 and PYY for the treatment of obesity: a pilot study on the use of agonists and antagonists in diet-induced rats. Endocrine Connections. 13;
- Ania M. Jastreboff, Donna H. Ryan, Harold E. Bays, Peter R. Ebeling, Mia G. Mackowski, et. al.. (2025). Once-Monthly Maridebart Cafraglutide for the Treatment of Obesity — A Phase 2 Trial. N Engl J Med. 393, 843-857;
- P. V. Højberg, T. Vilsbøll, R. Rabøl, F. K. Knop, M. Bache, et. al.. (2009). Four weeks of near-normalisation of blood glucose improves the insulin response to glucagon-like peptide-1 and glucose-dependent insulinotropic polypeptide in patients with type 2 diabetes. Diabetologia. 52, 199-207;
- Sravan K. Thondam, Daniel J. Cuthbertson, John P.H. Wilding. (2020). The influence of Glucose-dependent Insulinotropic Polypeptide (GIP) on human adipose tissue and fat metabolism: Implications for obesity, type 2 diabetes and Non-Alcoholic Fatty Liver Disease (NAFLD). Peptides. 125, 170208;
- Mette Marie Rosenkilde, Jyothis Thomas George, Murielle M. Véniant, Jens Juul Holst. (2025). GIP Receptor Antagonists in the Pharmacotherapy of Obesity: Physiologic, Genetic, and Clinical Rationale. Diabetes. 74, 1334-1338;
- N+1: Низкомолекулярный оральный агонист ГПП-1 помог снизить массу тела;
- Julio Rosenstock, Stanley Hsia, Luis Nevarez Ruiz, Sarah Eyde, David Cox, et. al.. (2025). Orforglipron, an Oral Small-Molecule GLP-1 Receptor Agonist, in Early Type 2 Diabetes. N Engl J Med. 393, 1065-1076;
- Зрительный родопсин — рецептор, реагирующий на свет;
- Новый рубеж: получена пространственная структура β2-адренорецептора;
- Структуры рецепторов GPCR «в копилку»;
- Аллостерические регуляторы GPCR: ключи от всех замков;
- Yan Zhang, Bingfa Sun, Dan Feng, Hongli Hu, Matthew Chu, et. al.. (2017). Cryo-EM structure of the activated GLP-1 receptor in complex with a G protein. Nature. 546, 248-253;
- Takahiro Kawai, Bingfa Sun, Hitoshi Yoshino, Dan Feng, Yoshiyuki Suzuki, et. al.. (2020). Structural basis for GLP-1 receptor activation by LY3502970, an orally active nonpeptide agonist. Proc. Natl. Acad. Sci. U.S.A.. 117, 29959-29967;
- Motahareh Sheikh-Hosseini, Mohammad Moarefzadeh, Alyaa Abdulhussein Alsaedi, Ahmed M. Amshawee, Sahar Kareem Al-Mozani, et. al.. (2025). Innovative gene therapy strategies for tackling obesity. Egypt J Med Hum Genet. 26;
- Крохотные курьеры: как аденоассоциированные вирусы спасают жизни;
- Время первых: как аденоассоциированные вирусы стали лучшими в доставке генов in vivo;
- Laura Pazzagli, Ylva Trolle Lagerros. (2024). Socioeconomic and Demographic Inequalities in Off-Label Prescription of Glucagon-Like Peptide-1 Receptor Agonists: A Swedish Descriptive Cohort Study. Obes Facts. 130-138;
- Zahra Azizi, Fatima Rodriguez, Themistocles L. Assimes. (2024). Digital Footprints of Obesity Treatment: GLP-1 Receptor Agonists and the Health Equity Divide. Circulation. 150, 171-173;
- Экстемпоральные лекарственные препараты: как изготавливают лекарства в аптеке.