Аппетит как мишень: почему все попытки обуздать ожирение и диабет проваливались, пока не появились агонисты рецепторов инкретинов
31 октября 2025
Аппетит как мишень: почему все попытки обуздать ожирение и диабет проваливались, пока не появились агонисты рецепторов инкретинов
- 895
- 0
- 5
Борьба с лишним весом нередко приводила к тяжелым последствиям. Отчаянные диеты и опасные препараты стоили людям здоровья, а иногда и жизни. Современная медицина, кажется, нашла способ решить проблему. Агонисты рецептора ГПП-1 стали настоящим спасением: в комплексе с активным образом жизни и правильным пищевым поведением, они помогают обрести баланс, избавляя от необходимости идти на опасные жертвы.
Рисунок в оригинальном разрешении.
иллюстрация Анастасии Самоукиной
-
Автор
-
Редакторы
-
Рецензент
-
Иллюстратор
Ожирение и сахарный диабет 2 типа приобрели масштабы глобальной пандемии и уже успели создать беспрецедентную нагрузку на системы здравоохранения по всему миру. Почему человечество проигрывает битву с лишним весом? Эта статья прослеживает тернистый путь поиска решения — от смертельно опасных «радужных таблеток» до современных «чудо-лекарств».
Мы начинаем спецпроект «Метаболизм, аппетит и инкретины», чтобы рассказать, как простое желание влезть в красивое платье может обернуться трагедией и заставить регуляторы навсегда изъять препарат из продажи. Разберемся, в чем же заключается революция агонистов инкретиновых гормонов, и, конечно же, не обойдем вниманием вопросы их безопасности и эффективности. Современная наука уже созрела для того, чтобы не бороться с организмом, а помогать ему вернуться в норму через тонкую настройку естественных механизмов. Это значит, что у человечества появился шанс победить лишний вес.
Метаболизм, аппетит и инкретины
Пища давно стала неотъемлемой частью массовой культуры и мощным двигателем экономики. Растущий уровень жизни позволяет нам потреблять всё больше и больше калорий, однако у этой истории прогресса есть и обратная сторона. Нередко людям приходится платить за чрезмерный гедонизм иммунометаболическими болезнями. Прежде всего ожирением и тесно связанным с ним диабетом 2 типа, которые уже давно успели стать одними из самых распространенных неинфекционных заболеваний во всем мире. В этом спецпроекте мы поговорим о том, как ученым удалось сделать практически невозможное — взять под контроль пищевой инстинкт и, в итоге, скорректировать пищевое поведение человека. А еще о том, какие перспективы и риски в этом направлении видит современная наука.
Умерьте ваши аппетиты, мои милые, и вы победите человеческую природу, — обратился владелец школы к Николасу, говоря с полным ртом, набитым ростбифом и гренками.
Ожирение вместе с диабетом захватывают планету
Юная Мэри Линнен завершала подготовку к самому важному дню своей жизни. Ресторан, список гостей, красивые приглашения — последние приготовления к торжеству были завершены. Оставалось лишь выбрать наряд. Мэри очень хотела пойти под венец в красивом платье. Для того, чтобы наряд смотрелся особенно эффектно, Мэри начала принимать комбинацию препаратов фен-фен (фенфлюрамин и фентермин) — в конце 1990-х эти лекарства были популярным средством для похудения. Девушка не имела избыточной массы тела, но все-таки решилась на курс. Мисс Линнен, как и множество других женщин того времени, поверила, что быстрое похудение — это безопасный путь к красоте. Она принимала фен-фен всего лишь 24 дня — не так уж и долго по меркам подобных препаратов. Казалось, что всё шло к идеальной свадьбе. До тех пор, пока маленькая хитрость, призванная сделать свадебный образ безупречным, не превратилась в настоящую трагедию (рис. 1).

Рисунок 1. Мэри Линнен, одна из самых «громких» жертв фен-фена. Последние месяцы своей жизни она провела с трубкой, которая шла от портативной помпы в ее груди к приборам жизнеобеспечения. Все это время Мэри находилась под постоянной угрозой сердечного приступа, постоянно принимая лекарства стоимостью более 200 000 долларов.
Спустя восемь месяцев после начала приема фен-фена девушка ослепла на один глаз, а еще через месяц умерла в возрасте 30 лет. В 1997 году это была первая громкая смерть от легочной гипертензии, вызванной фен-феном. Комбинация этих препаратов тогда всё еще не была одобрена FDA (Food and Drug Administration), однако врачи свободно выписывали людям рецепты на оба средства. Фен-фен активно продвигался в СМИ не только в США, но и в Европе. За один 1996 год было выписано более 18 миллионов рецептов суммарно на оба вещества. О рисках легочной гипертензии писали еще в 1995 году, но именно случай Мэри Линнен стал самым громким делом в суде, став спусковым крючком волны общественного недовольства. После этого прецедента FDA буквально засыпали сообщениями о проблемах в работе сердечного клапана у людей, принимавших фен-фен. В итоге препарат был снят с продаж в том же году.
Мэри Линнен не страдала клиническим ожирением и, конечно же, не нуждалась в столь радикальном препарате. Но для некоторых людей резкое похудение и правда может быть вопросом выживания. В современном обществе ожирение уже довольно давно стало общемировой проблемой, снижающей качество жизни людей и повышающей шансы умереть от сопутствующих заболеваний сердечно-сосудистой и респираторной систем, а также от рака или сахарного диабета 2 типа (СД2). Сегодня нам известно, что ожирение сильно снижает продолжительность жизни [1]: умеренная выраженность заболевания (при ИМТ 30–35) сокращает жизнь в среднем на три года, а тяжелая (ИМТ > 40) — на 10 лет. Это эквивалентно курению в течение всей жизни. Проблема приобрела настолько масштабный характер, что эпидемиологи вполне заслуженно стали называть ожирение и тесно связанный с ним СД2 настоящей пандемией XXI века. Дело дошло до того, что в развитых странах уже более 50% взрослых страдают проблемами с лишним весом, причем доля сильного ожирения продолжает неуклонно расти (рис. 2). Но отметим, что «лучший» ИМТ, при котором наблюдается наименьшая смертность, — 22,5–25, а в общественном сознании даже он часто воспринимается как «слишком высокий».
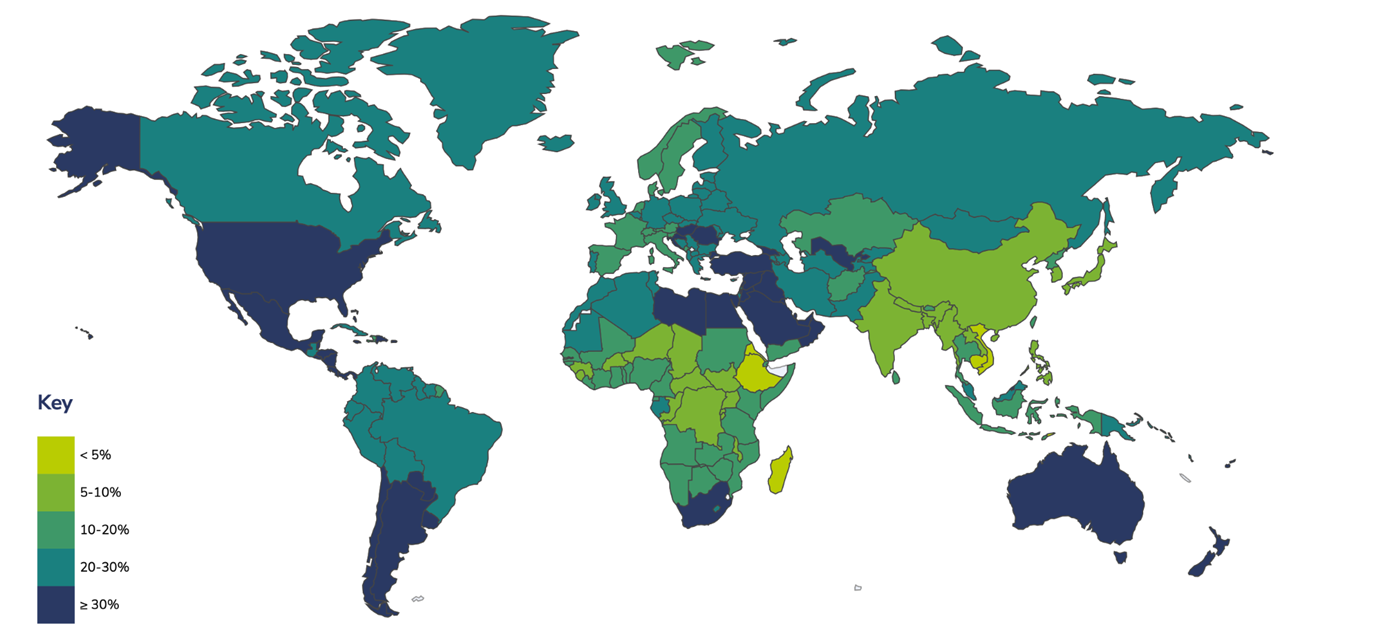
Рисунок 2. Глобальная распространенность ожирения (ИМТ≥ 30). Другие карты можно посмотреть на сайте Всемирной Федерации Ожирения.
Причины проблемы
Всему живому на Земле необходима энергия. Одни организмы способны получать ее из солнечного света. Другие же извлекают энергию путем переваривания съеденной пищи. Если говорить конкретнее, то энергию мы извлекаем из содержащихся в пище макронутриентов, главным образом, углеводов. Наша пищеварительная система расщепляет их до простого сахара — глюкозы. Это важнейший источник клеточной энергии, «топливо», которое поддерживает все процессы в организме. Из-за высокого уровня глюкозы в крови поджелудочная железа стремится его скорректировать и вырабатывает всё больше инсулина. Если человек продолжает потреблять калории, не давая организму адаптироваться, то развивается инсулинорезистентность (ИР). Кроме этого, если уровень глюкозы в крови всегда высокий, то она становится токсичной для организма. В таком случае простой сахар начинает вступать в реакцию с белками и жирами, нарушая их структуру и функцию. Страдают мелкие сосуды, иногда развиваются слепота, почечная недостаточность, ускоряется развитие атеросклероза. Высокий уровень глюкозы провоцирует образование огромного количества свободных радикалов, которые тоже разрушают клетки. Именно поэтому корректировать гипергликемию препаратами и следить за уровнем глюкозы в крови так важно для пациентов с СД2.
С инсулинорезистентностью связано одно из ключевых осложнений ожирения. Избыточно потребленные вещества откладываются в виде жира в подкожной клетчатке и брюшной полости. Как только места в подкожной клетчатке не остается, жир накапливается в печени и мышцах, превращаясь в висцеральный. Висцеральные жировые клетки выделяют воспалительные адипокины, которые, в свою очередь, способствуют возникновению ИР. Чрезмерно разросшиеся жировые клетки привлекают внимание иммунной системы (рис. 3), в результате чего макрофаги синтезируют еще больше провоспалительных цитокинов. В конце концов непрекращающийся воспалительный процесс приводит к почечной недостаточности и жировой болезни печени, а также сердечно-сосудистым заболеваниям (про последние на «Биомолекуле» уже есть отдельная подробная статья! [2]).
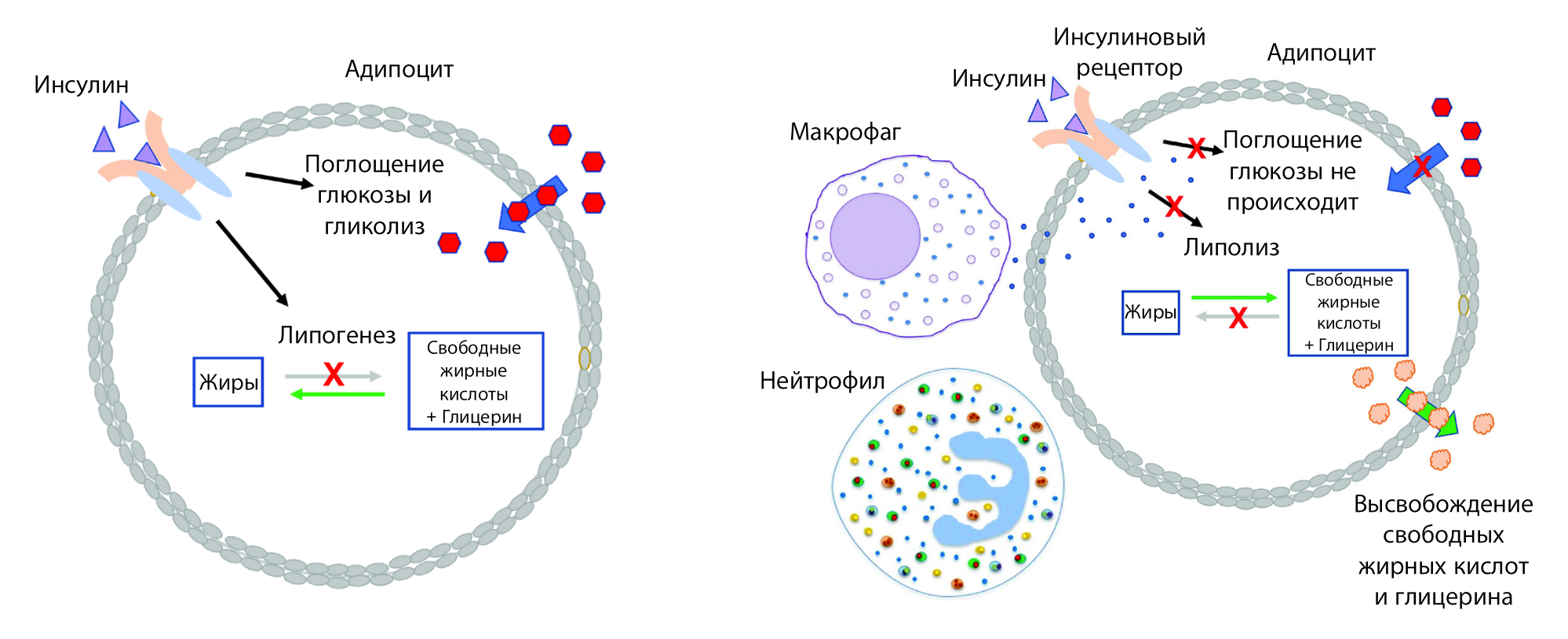
Рисунок 3. Механизм действия инсулина в норме (слева) и при ожирении (справа). Связывание инсулина со своим рецептором на адипоцитах приводит к захвату глюкозы, подавлению липолиза и способствует липогенезу, то есть запасанию жира. При ожирении адипоциты могут или разрастаться в размерах или увеличивать свое количество. При этом концентрация секретируемого лептина тоже растет. В гипертрофированной жировой ткани находится большое количество макрофагов и нейтрофилов, которые секретируют много провоспалительных агентов (цитокинов). Цитокины нарушают передачу инсулинового сигналинга, из-за чего глюкоза не может запасаться в жировых клетках, и они в панике пытаются «сжечь» огромные жировые капли. К сожалению, это только усугубляет ситуацию: свободные жирные кислоты и глицерин выбрасываются в кровоток, вместе с высоким уровнем глюкозы повреждают клетки, поддерживая воспаление.
И вот здесь начинает формироваться одна из самых типичных для страдающих ожирением людей проблем — сахарный диабет 2 типа. СД2 развивается из-за того, что инсулинозависимые ткани стали устойчивыми к действию этого гормона. Главная задача инсулина — утилизировать глюкозу в организме, в том числе в жировой ткани. Но если она воспалена, этого сделать уже не получится. Процесс развивается постепенно. Сначала ожирение приводит к метаболическому синдрому , который включает в себя ИР и нарушение метаболизма липидов. Это состояние можно обернуть вспять. Но вот если его не лечить, то развивается СД2.
Подробнее о метаболическом синдроме, а также о случаях, когда ожирение может быть незаметным и коварным, рекомендуем почитать статью на «Биомолекуле»: «Коварная стройность и безопасная полнота: метаболический синдром и сахарный диабет вне обычных границ индекса массы тела» [3]. В этой статье также рассказывается о популяции людей с «метаболически здоровым» ожирением, когда ожирение не приводит к развитию СД2. Мы же здесь рассмотрим классические случаи.
Чтобы понять масштаб проблемы, давайте просто взглянем на цифры. С 1990 года по наши дни количество больных СД2 увеличилось вчетверо, а к середине XXI века специалисты пророчат увеличение числа таких пациентов до 1,31 миллиардов человек!
Восток и запад болеют по-разному
Природа формирования избыточной массы очень сложна и зависит не только от энергетического баланса между получаемыми и затрачиваемыми калориями, но и от окружающей среды и наследственной предрасположенности. Эндокринные заболевания также способны вызывать чрезмерное накопление жировой ткани, однако глобальная статистика говорит о том, что нездоровые пищевые привычки вшестеро чаще становятся причиной ожирения, чем все остальные факторы, вместе взятые [24].
Отношение людей к пище не раз кидало из стороны в сторону: от образа тучной палеолитической «Венеры» и культа гедонизма до библейского греха чревоугодия и современной моды на здоровое питание. Поэтому распространенность ожирения — это не просто медицинский, но и глубоко культурный феномен. Сравнение пищевых традиций и эстетических идеалов в разных регионах мира дает ключ к пониманию причин эпидемии.
США прочно удерживают лидерство по количеству людей с ожирением, и одна из главных причин этого — повсеместное потребление сладких напитков [25]. Газировки, энергетики и даже «здоровые» соки часто содержат огромные дозы сахара, в первую очередь, фруктозы. «Жидкие» калории не утоляют голод, хотя по количеству энергии часто равны или превышают полноценный обед. Большая концентрация фруктозы способствует образованию жировой ткани, развитию воспаления и оксидативному стрессу, вызывающему дополнительные повреждения самых разных клеток. Ведь структурно фруктоза не так уж сильно отличается от глюкозы. Кроме того, фруктозная диета нарушает сигналинг инсулина и является одной из главных причин роста ИР в США.
Высокое потребление «фруктозных» сиропов привело к эпидемии ожирения на Западе, что заставляет задуматься о потенциальном вреде для диабетиков сладостей, на которых написано, что они не содержат сахара. Сама по себе фруктоза имеет низкий гликемический индекс, но при большом ее употреблении уровень инсулина в крови все равно увеличивается [26]. Важно помнить, что даже такие сладости можно есть только в ограниченном количестве, потому что вместо глюкозы они содержат фруктозу или другие сахарозаменители, которые при переедании точно так же могут стать причиной ИР и привести к метаболическому синдрому [27].
В то время как на Западе сложилась культура высокопереработанной пищи, во многих азиатских странах исторически доминируют иные установки. Традиционные азиатские диеты, такие как японская или корейская, делают акцент на свежих продуктах, ферментированной пище, рыбе и овощах. Родители с детства прививают привычку к натуральным вкусам, не поощряя увлечение ультрапроцессированными снеками (рис. 4). Для японских школьников брокколи — одно из любимых блюд, которое часто берут с собой в школу, а вот сладкий зеленый перец там не очень-то любят.

Рисунок 4. В популярном мультфильме «Головоломка» для Японии создатели адаптировали сцену с пиццей, где брокколи были показана в негативном ключе.
В азиатских культурах распространены высокие и строгие стандарты красоты, где стройность ассоциируется не только с здоровьем, но и с самодисциплиной и социальным статусом. Это создает мощный психологический барьер для переедания. Отсутствие культуры постоянного потребления очень вкусной, но насыщенной сахаром и жиром пищи помогает сохранить здоровую работу дофаминовой системы вознаграждения в мозге. В то время как на Западе такая пища приводит к формированию самой настоящей пищевой зависимости, при которой нормальная еда уже не приносит удовлетворения [28].
Уроки бариатрической хирургии
Когда диеты, лекарства и изменение образа жизни не приносят долгосрочного результата, на сцену выходит один из самых эффективных на сегодня методов лечения морбидного ожирения и СД2: бариатрическая операция (БО), по сути — хирургическое уменьшение объема желудка. Данные многолетних наблюдений впечатляют: в отличие от диет, эффект от которых обычно сходит на нет за 1–2 года, БО обеспечивает долгосрочную ремиссию [29]. Спустя 5–12 лет сохраняется эффект от операции, заключающийся в 20% снижении веса и коррекции метаболического синдрома. Уникальность бариатрической хирургии — не столько в механическом ограничении объема желудка, сколько в перестройке физиологии организма. Происходит увеличение количества L-клеток, экспрессирующих ГПП-1, который подавляет аппетит и усиливает секрецию инсулина, что приводит к ремиссии СД2 практически сразу после операции. Меняется и состав кишечной микробиоты, которая также влияет на аппетит и общий уровень воспаления.
Аппетит приходит во время еды
А теперь, обсудив все минусы ожирения, давайте поговорим о механизмах работы аппетита и о его естественной регуляции.
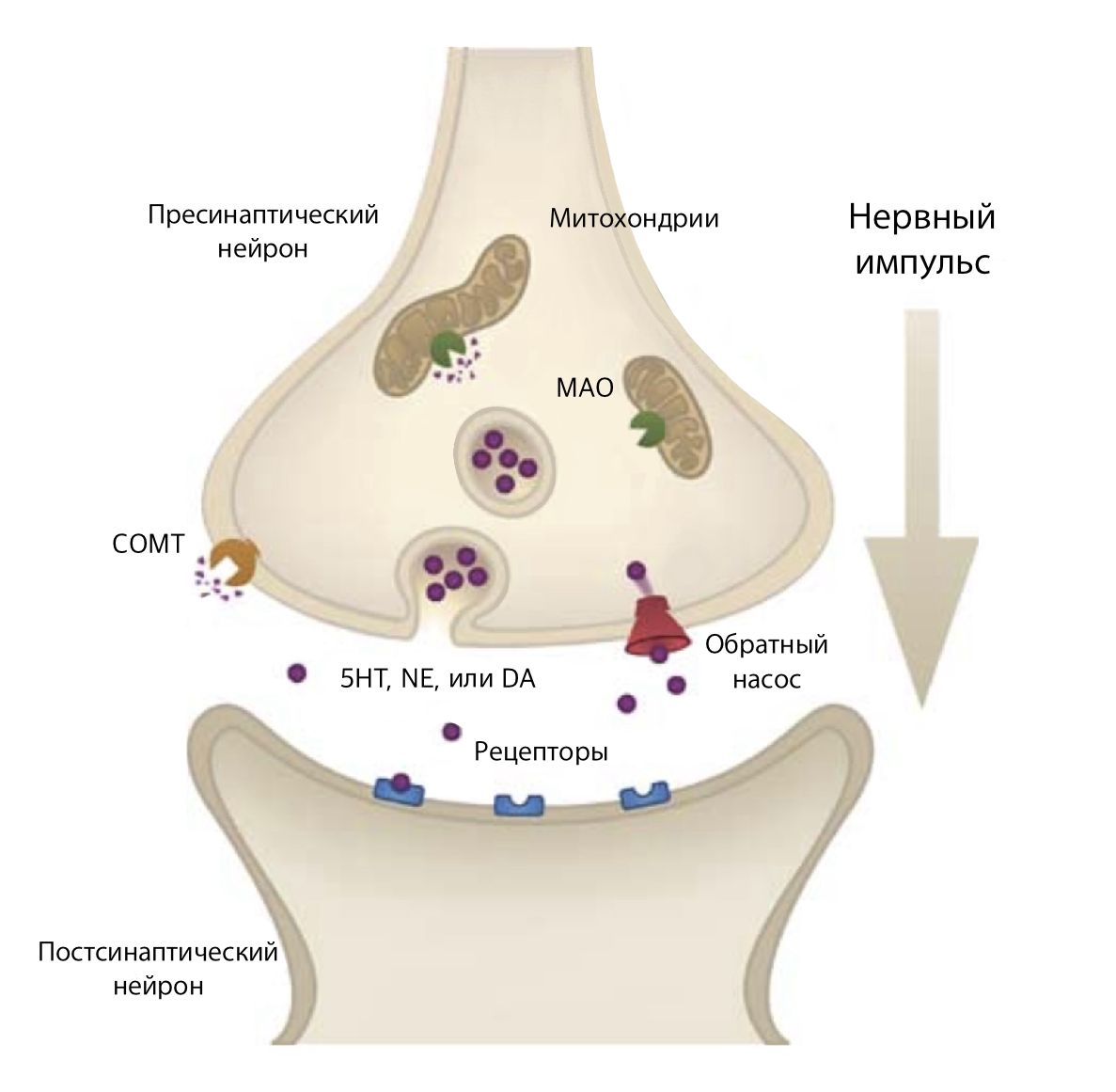
Аппетит — это не просто чувство голода, а сложнейший нейрогормональный механизм, который эволюция оттачивала миллионы лет. Его регуляция происходит в мозге, прежде всего в гипоталамусе, куда стекаются сигналы от пищеварительной системы. В гипоталамусе есть популяции нейронов, которые стимулируют и подавляют аппетит [30]. Они называются орексигенными и анорексигенными, соответственно. Они находятся в дугообразном ядре, клетки которого чувствительны к воздействию гормонов: лептину и грелину. Грелин вырабатывается в ЖКТ в ответ на «пустой желудок» [31]. Это самый главный гормон голода. Лептин, с другой стороны, вырабатывается в жировой ткани и обладает противоположным действием. Количество лептина пропорционально жировой ткани, поэтому у людей с ожирением часто высокий уровень лептина приводит к лептинорезистентности. При этом заглушается чувство насыщения. Кроме этого, лептин снижает активность орексигенных нейронов, отвечающих за чувство голода.
Помимо грелина и лептина, в регуляции аппетита задействованы и другие гормоны ЖКТ [39]. Мы уже упоминали, что в ответ на рост концентрации глюкозы в крови наш организм начинает синтезировать инсулин. Помимо периферического действия, у него также есть и центральное [40]. При взаимодействии инсулина с анорексигенными нейронами гипоталамуса они отправляют сигнал к адипоцитам, чтобы активировать расщепление жиров. А связывание инсулина со своим рецептором на орексигеннных нейронах важно для регуляции синтеза глюкозы в печени. Инсулин и лептин действуют синергично, позитивно подкрепляя действие друг друга [41].
Гормональная регуляция аппетита — это сложная сеть, где быстрые сигналы (холецистокинин, грелин) взаимодействуют с долгосрочными (лептин, инсулин). Ведь, кроме сахара, еда обычно содержит еще белки и жиры, которые поступают в тонкий кишечник, где в ответ вырабатывается холецистокинин. Холецистокинин активирует блуждающий нерв, который передает сигнал о насыщении прямо во время еды. Помимо холецистокинина в тонком кишечнике вырабатываются инкретины (такие как ГПП-1 и ГИП). ГПП-1 усиливает глюкозозависимую секрецию инсулина, снижает секрецию глюкагона, а в мозге активирует анорексигенные популяции нейронов напрямую в дугообразном ядре [42]. Они посылают сигнал «сытости» и, тем самым, снижают аппетит на уровне ЦНС.
Ты — это то, что ты ешь
Кишечный микробиом — это экосистема из миллионов бактерий, которая действует в тесной связи с организмом человека и может влиять на него. В толстом кишечнике бактерии ферментируют пищевые волокна и производят короткоцепочечные жирные кислоты (КЦЖК), улучшающие здоровье кишечника, стимулируя выработку слизи [43]. Эти продукты могут связываться с рецепторами на L-клетках кишечника и усиливать секрецию ГПП-1, способствуя высвобождению инсулина после приема пищи. У людей с преддиабетом наблюдается снижение бактерий, вырабатывающих КЦЖК, что часто связано с диетами, основанными на пище с высоким содержанием жира и низким содержанием клетчатки.
Кроме побочных продуктов, некоторые бактерии вырабатывают ГАМК, серотонин, дофамин и другие гормоны, которые, видимо, могут взаимодействовать с нейронами дугообразного ядра и некоторыми другими, где проницаемость гематоэнцефалического барьера повышена [44]. Это подтверждается и тем, что, например, при добавлении ГАМК в пищу у ягнят увеличивался аппетит [45]. Серотонин тоже может связываться со своими рецепторами в этой области мозга и повышать аппетит.
Кишечник служит барьером между мукозальной иммунной системой и микроорганизмами, которые там живут. Некоторые из них — наши симбионты, тогда как другие попадают извне и являются патогенными. Иммунная система помогает поддерживать баланс между «хорошими» и «плохими». При дисбиозе, когда нарушается баланс микробиоты, увеличивается доля патогенных микробов, провоцирующих местное воспаление [46]. А из-за него нарушаются белки плотных контактов, кишечник начинает пропускать бактериальные токсины (такие как липополисахарид) в кровоток. В ответ на это привлекаются иммунные клетки, которые тоже секретируют цитокины как локально в кишечнике, так и вне его. Увеличивается количество провоспалительных молекул, которые потом попадают мозг и активируют микроглию. Это нарушает чувствительность к гормонам ЖКТ, может возникнуть лептинорезистентность. Также воспаление в кишечнике напрямую угнетает работу L-клеток, снижая синтез ГПП-1.
Здоровый микробиом работает как союзник, помогая контролировать аппетит через производство полезных метаболитов и гормонов. Дисбиоз же превращает кишечник в источник хронического воспаления, которое разрушает тонкие механизмы регуляции голода и сытости, способствуя перееданию и развитию ожирения.
Волшебного ингредиента не существует
Мы начали наш рассказ с трагичного случая Мэри Линнен. К сожалению, он не единичен. Вообще, история препаратов для подавления аппетита — это настоящая череда из отозванных лицензий на лекарственные средства. Стремление обуздать голод с помощью таблеток раз за разом наталкивалось на непреложное правило: необдуманное вмешательство в столь тонкие материи, как регуляция аппетита, попросту небезопасно. В итоге, путь от одобрения FDA до изъятия лекарств с прилавков аптек стал вполне обычной историей для множества таких препаратов.
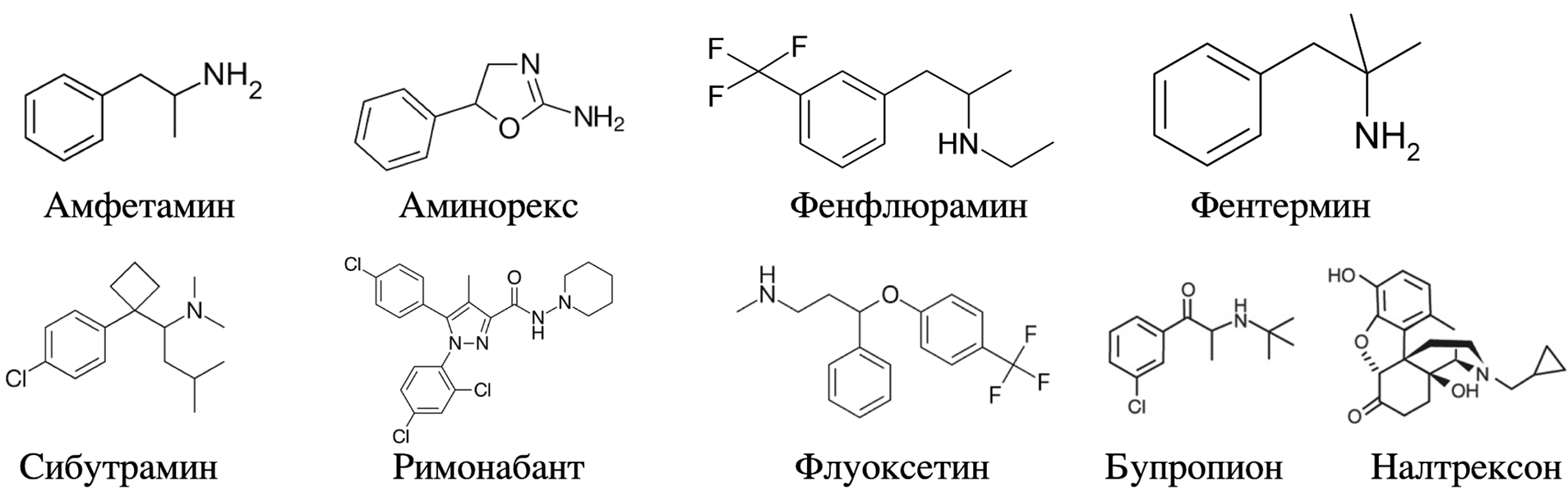
Дело началось еще в 40-х годах прошлого века, когда фармакологи впервые начали предлагать использовать амфетамины в качестве средств для похудения. Механизм их действия заключается в нарушении работы транспортеров норадреналина и дофамина, в результате их концентрация в синапсе увеличивается, что приводит к снижению чувства голода. Препараты были довольно эффективными: 44% пациентов, получающих амфетамины, теряли более 0,45 кг в течение недели, в то время как в группе плацебо только 26% добровольцев достигали такого впечатляющего результата [47]. Однако в итоге препараты этого класса были запрещены из-за того, что вызывали сильное привыкание.
Еще более дикой сейчас кажется эпоха «радужных таблеток», которые назначались с 1940-х по 1960-е годы [48]. В их, состав помимо амфетаминов, входили гормоны щитовидной железы, диуретики, сердечные гликозиды, барбитураты, кортикостероиды и еще несколько растительных препаратов. В результате приема такого «коктейля», кроме привыкания, возникала еще и артериальная гипертензия с токсическим поражением миокарда. Нередко — с летальным исходом [49].
Ученые пытались модифицировать химическую структуру амфетамина, чтобы снизить риски для ЦНС, но тщетно. Вместе с внесенными изменениями у веществ пропадал эффект подавления аппетита. Кроме того, у пациентов, принимавших модифицированные амфетамины, стали возникать уже новые, ранее незнакомые врачам побочные эффекты. Так, для аналога амфетамина аминорекса, который применялся в Европе, была отмечена серьезная легочная гипертензия. К сожалению, о такой серьезной проблеме специалисты узнали далеко не сразу. Аминорекс сперва вызвал настоящий фурор в 1960-х в Швейцарии, Австрии и Германии [50]. «Аминорексовая» эпидемия продолжалась около 10 лет, и в итоге логично завершилась изъятием лекарства, однако легочная гипертензия никуда не делась. Болезнь осталась с принимавшими аминорекс на всю жизнь. Только в Швейцарии к началу 80-х годов скончались 34 пациента — почти половина от общего числа людей, получивших этот диагноз после курса аминорекса (рис. 6).
Чуть позднее структурным, но не функциональным аналогом амфетамина стал фенфлюрамин, появившийся в 1970-х гг. Основной механизм его действия заключался в частичном ингибировании обратного захвата серотонина [51], прямом стимулировании высвобождения серотонина и взаимодействии с серотониновыми рецепторами. Главным недостатком было то, что снижение веса было лишь временным явлением. Препарат не обладал особой специфичностью, из-за чего вызывал депрессию, также у пациентов наблюдались проблемы с легочными сосудами. Позже применялся в комбинации с фентермином (fen-phen, тот самый фен-фен, который принимала Мэри), механизм действия которого заключается не только в высвобождении серотонина и дофамина, но также и норадреналина. Последствия приема этой «гремучей» смеси подробно не изучались, но препараты всё же были доступны по отдельности. Поэтому врачи могли без проблем выписать их для снижения веса, даже несмотря на отсутствие одобрения со стороны FDA. К каким последствиям такая самодеятельность привела, нам уже прекрасно известно.
Правда, история фен-фена на этом не закончилась. Он продолжает жить на фармрынке, но в качестве отдельных компонентов. Так, после отзыва «фенфлурамина-жиросжигателя» [52], спустя несколько месяцев после смерти Мэри, он вновь был одобрен FDA в 2020 году, но уже в качестве лекарства для детей с тяжелой формой эпилепсии. Фентермин также не был предан забвению окончательно. Сейчас он применяется в комбинации с другим препаратом, топираматом, предназначенным для облегчения симптомов эпилепсии и мигрени. Интересно, что последний тоже приводил к снижению веса у пациентов; курирующие исследование врачи отмечали такое следствие неоднократно. Однако препарат вызывал еще и сильные побочные эффекты, такие как нарушения памяти, внимания и мышления. Кроме того, многие пациенты после окончания курса стали жаловаться на появление навязчивых суицидальных мыслей. По этой причине дальнейшее изучение топирамата как средства для снижения веса прекратили. Впрочем, в дальнейшем выяснилось, что частота побочных эффектов снижалась при добавлении к нему фентермина [53]. А пациенты при этом теряли 7–10% массы тела в течение 56 недель в зависимости от дозировки. К счастью, продвинуть комбинацию на рынок это не помогло. В России она остается незарегистрированной, а фентермин входит в перечень наркотических средств, оборот которых подлежит контролю.
Другой препарат «серотонинового» класса — флуоксетин — продвигался изначально как антидепрессант [54]. В ходе клинических исследований заметили небольшую дозозависимую потерю веса, однако затем вес у пациентов стал возвращаться даже во время приема флуоксетина, что сделало разницу с группой плацебо совсем незначительной [55]. В итоге флуоксетином ожирение лечить не стали, но как антидепрессант он вполне себе существует и по сей день.
С 2008 года сильнодействующим веществом в России признан еще один препарат — сибутрамин, — также действующий за счет ингибирования обратного захвата серотонина и норадреналина. В этом же году его применение приостановили в Европе и в США, где он был одобрен для снижения веса еще в 1997 году. При его приеме пациенты теряли около 5 кг по сравнению с плацебо примерно за 44–54 недели, но страдали от небольшого повышения давления [56]. В итоге после дополнительного исследования безопасности на пациентах с СД2 и сердечно-сосудистыми заболеваниями было обнаружено, что у 16% принимавших сибутрамин развивались инфаркты и инсульты с летальным исходом [53].
Антагонист каннабиноидного рецептора 1 (CB1R) римонабант был одобрен FDA в 2006 году [57]. По сравнению с плацебо наблюдалось снижение веса на 4,8 кг в течение года. Препарат хорошо переносился, а из популярных побочных эффектов наблюдались не такие страшные, на первый взгляд (особенно по сравнению с предыдущим примером!) тошнота и диарея, но встречались также тревожность, депрессия, нарушения сна. Уже в 2007 году препарат был отозван с формулировкой, что риски превышают потенциальные преимущества. Оказалось, что вместе с депрессией и тревожностью у пациентов появлялись суицидальные мысли. Позже были попытки сделать антагонист CB1R , который не обладал бы центральным действием, но дальше доклинических исследований дело не продвинулось.
Известно, что активация CB1R увеличивает аппетит и активирует POMC-нейроны [58]. Восстановление сигнализации лептина при блокаде CB1R обусловлено увеличением MC4R сигналинга в гипоталамусе [59]. Подробнее о каннабиноидных рецепторах можно почитать в статье «Биомолекулы».
В 2000-х годах фармацевтические компании вернулись к идее стимулировать дофаминовую и норадреналиновую системы. Бупропион, который еще и активирует анорексигенные популяции нейронов в гипоталамусе, изначально применялся для лечения депрессии и никотиновой зависимости. Вес пациентов, принимавших бупропион в комбинации с налтрексоном, антагонистом опиоидных рецепторов, за 56 недель снижался на 6,4%, а в группе плацебо всего на 1,2%. В группе препарата пациентов, достигших 5% снижения веса, было на 17% больше, чем в группе плацебо [61]. Не обошлось и без побочных эффектов: наблюдалось депрессивное настроение, тревожность, а также риск возникновения судорог. На данный момент эта комбинация одобрена FDA для лечения избыточного веса, но в России применяется только налтрексон как монопрепарат для лечения алкогольной и наркотической зависимости.
С одной стороны, скандалы вокруг смертельно опасных лекарств надолго укрепили скепсис в отношении высокорезультативных препаратов для похудения. С другой — мировое медицинское сообщество продолжало искать эффективное и безопасное средство лечения ожирения, ведь эпидемиологический прогноз Всемирной организации здравоохранения оставался по-прежнему неблагополучным. После десятилетий поисков, перепадов и трагедий — от «радужных таблеток» до опасных антидепрессантов и запрещенных «жироубийц» — казалось бы, история фармакологической борьбы с ожирением зашла в тупик. Каждый новый препарат, обещавший легкую победу над весом, рано или поздно оказывался либо неэффективным, либо смертельно опасным. Врачи и пациенты устали от цикла надежд и разочарований.
Кардинально правила игры изменились лишь во втором десятилетии XXI века, когда фармацевтические компании разработали новый подход к терапии СД2. Специалисты Novo Nordisk учли негативный опыт применения серотонинергического подхода к терапии инсулин-зависимых патологий. Дизайн лекарств нового типа было решено сосредоточить вокруг другой части механизма регуляции аппетита. А именно — инкретинов. Вместо малых молекул были разработаны пептидные препараты, которые имитируют наши собственные гормоны.
Оказалось, что, в отличие от предыдущих классов препаратов, подавляющих аппетит, агонисты инкретинов обладают более мягким действием, заключающемся в усилении сигналов сытости и продления чувства насыщения. Такой подход оказался на удивление эффективен: здоровые добровольцы без СД2 теряли около 15% веса за 68 недель приема лекарства [62].
Кроме влияния на аппетит, инкретины также привлекли внимание ученых как перспективные препараты для лечения самых разных заболеваний: от сонного апноэ до алкогольной и никотиновой зависимости. Такой обширный эффект можно объяснить тем, что рецепторы ГПП-1 находятся в разных тканях, а не только в L-клетках кишечника. Например, еще и в гипоталамусе. Потенциально агонисты ГПП-1 обладают кардио- и нейропротекцией, могут укреплять кости и, конечно же, снижают инсулинорезистентность и нормализуют синтез инсулина .
Авторы «Биомолекулы» уже не первый раз пишут об агонистах ГПП-1 как о фармацевтических веществах, а потому здесь мы не будем пускаться в слишком большие подробности. Однако рекомендуем всем читателям ознакомиться со статьями «Берега»: «Новые лекарства от ожирения — настоящий прорыв в медицине последних лет» [63], N+1: «Больше не ешь. Как отключить у человека аппетит и что будет потом» [64] и самой «Биомолекулы»: «Оземпик: больше, чем средство для похудения» [65].
Такой успех не мог остаться незамеченным. Рынок агонистов инкретинов продолжает активно развиваться и сейчас. Семаглутид, вызвавший такой интерес общественности, вводится один раз в неделю с постепенным увеличением дозировки для снижения побочных эффектов на ЖКТ. Уже сейчас доступен на рынке тирзепатид — агонист двойного действия, который связывается не только с рецепторами ГПП-1, но и ГИП (глюкозозависимого инсулинотропного пептида). По сравнению с семаглутидом, он более эффективен в снижении веса и уменьшении сантиметров в талии [66].
Разработка новых препаратов продолжается. Уже появляются исследования тройных агонистов [67], которые помимо ГПП-1 и ГИП также активируют рецептор глюкагона, что, вероятно, активирует липолиз в адипоцитах [68]. На данный момент этот препарат — ретатрутид — находится на 3 фазе клинических испытаний. Помимо этого, появляются функциональные агонисты апелина [69] и амилина [70], [71], которые изучаются в том числе и в комбинации с агонистами ГПП-1. Привлекают внимание и низкомолекулярные агонисты ГПП-1 [72] и апелина [73], которые могут сделать производство препарата намного дешевле и доступнее.
Параллельно с этим совершенствуются и способы введения препаратов. Как уже упоминалось, агонисты инкретинов — это пептидные препараты, биодоступность которых намного выше в инъекционных формах, чем в таблетках, которые неизбежно попадают в желудок и там частично расщепляются. Как и инсулин, агонисты инкретинов продают преимущественно в виде раствора для подкожного введения. Если изначально пациентам приходилось делать стандартный подкожный укол один раз в неделю — процесс, который требовал осторожности, навыков и часто вызывал страх или чувство тревоги, — то вскоре на смену иголке и шприцу пришла удобная шприц-ручка: компактная, эргономичная, с интуитивным механизмом дозирования. Она выглядит и работает как простая ручка, а не пугающее медицинское устройство. Психологически это очень важный момент! Ведь с шприц-ручкой в руках человек перестает ощущать себя больным, ему не нужно каждый раз вспоминать, что он делает укол. Он просто нажимает кнопку — и лечение проходит без лишнего стресса.
Сегодня на рынке уже появляются однодозовые автоинжекторы, или, по-другому, автоинъекторы. Это устройства, которые сами вводят препарат за доли секунды, автоматически, без необходимости держать иглу, регулировать глубину или силу нажатия. Инжектор сам берет на себя всю ответственность. Он вводит дозу точно, быстро, почти без боли, а затем безопасно деактивируется. Особенно ценится эта технология пожилыми людьми, а также и другими пациентами с ограниченной подвижностью, ведь именно они чаще всего сталкиваются с проблемами ожирения и СД2.
Празднуем победу?
Несмотря на все успехи последних лет, делать поспешные выводы всё же пока рано. Новые препараты-агонисты ГПП-1 и ГИП не повторили ни одного из трагических сценариев, знакомых нам по истории фармакологии. Во всяком случае, пока. Но мы должны помнить, что грубое вмешательство в такой сложный процесс, как регуляция аппетита, всегда чревато непредсказуемыми последствиями. Тут работает простая истина, общая для всех лекарств: если у препарата нет побочного эффекта, то, скорее всего, и действующее вещество в нем отсутствует. Мы уже проходили это с трагедией фен-фена, где фатальную роль сыграли как просчеты госрегуляторов, так и безответственное назначение незарегистрированных комбинаций врачами. Сегодня главная угроза исходит от иной, но столь же опасной практики бездумного офф-лейбл использования инкретинов без медицинского контроля.
Яркой иллюстрацией этого стал не получивший широкой огласки, но глубоко поучительный случай 56-летней Триш Вебстер. Стремясь похудеть к свадьбе дочери, она в течение пяти месяцев принимала агонисты инкретинов — сначала семаглутид, рекламу которого она увидела по телевизору, а затем его аналог лираглутид. За пять месяцев она сбросила 14 кг. Однако цена оказалась чудовищной. Женщина и ее семья проигнорировали первые признаки надвигавшейся беды. По-хорошему, недомогание должно было заставить людей немедленно прекратить терапию, но, к сожалению, было уже поздно. Триш скоропостижно скончалась от необратимого поражения пищеварительной системы.
В этом году эксперты FDA дополнили клинические рекомендации по лечению ожирения у взрослых людей с помощью семаглутида. Теперь его категорически запрещено принимать пациентами с параличом желудка — как раз такой болезнью и страдала Триш Вебстер. Эта история, по форме напоминающая дело Мэри Линнен, наглядно демонстрирует один важный момент. Главная опасность сегодня заключается не в самом препарате, а в его применении без врачебного контроля. С появлением агонистов ГПП-1 и ГИП социальные медиа и инфлюэнсеры всех мастей стали раскручивать истории о пациентах, стремительно похудевших на одном лишь приеме чудодейственного препарата, от которого просто меньше хочется есть.
Например, семаглутид — один из первых появившихся на рынке агонистов инкретинов — на самом деле разрабатывался как антидиабетическое средство и не предназначен для снижения веса. Однако именно он стараниями селебрити стал безумно популярен среди людей, стремящихся похудеть всеми правдами и неправдами. Novo Nordisk предупреждали, что при появлении тошноты, рвоты или диареи препарат должен быть немедленно отменен, но волну медийного шторма было уже не остановить. Всемирную сеть заполонили комментарии с вопросами о том, где можно достать волшебное средство. Желательно, не имея при этом на руках рецепта от врача. В результате фармрынок не выдержал взрывного спроса: Novo Nordisk оказались не в состоянии производить препарат в количестве, необходимом даже для тех, кому он был необходим по медицинским показаниям. Настолько мощным оказался наплыв людей, стремящихся заполучить семаглутид в обход назначений и похудеть, даже не имея при этом явных проблем с лишним весом. Подробнее об истории успеха Novo Nordisk можно почитать в статье «Оземпик: больше, чем средство для похудения» [65].
На пороге новой эры
Как и любому направлению в науке, фармакотерапии ожирения пришлось преодолеть немало проблем на своем пути. Трагедии прошлого заставили ученых глубже изучать сложнейшие механизмы регуляции аппетита. В результате этого мы уже можем наблюдать окончательную смену парадигмы. Упорная борьба с естественными потребностями организма уступила место тонкой настройке его природных процессов. Этот переход от конфронтации к диалогу со своим телом — ключевое достижение, которое, несмотря на все нерешенные вопросы, открывает оптимистичные перспективы в лечении самых разных заболеваний.
Именно об этих перспективах мы и поговорим в наших будущих материалах. Первая статья Спецпроекта о регуляции аппетита подошла к концу. Мы проследили путь от трагических ошибок прошлого к современным агонистам инкретинов. Далее мы расскажем, как в препаратах, изначально созданных для борьбы с ожирением и диабетом, ученые внезапно обнаружили и другие полезные свойства. Мы постараемся взвесить все «за» и «против», отделив доказанные преимущества революционных средств от потенциальных рисков, и объясним, почему современные формы введения таких лекарств, вроде инжекторов, в перспективе могут стать золотым стандартом безопасности терапии.
Литература
- Prospective Studies Collaboration. (2009). Body-mass index and cause-specific mortality in 900 000 adults: collaborative analyses of 57 prospective studies. The Lancet. 373, 1083-1096;
- Кардиопротекция при сахарном диабете;
- Коварная стройность и безопасная полнота: метаболический синдром и сахарный диабет вне обычных границ индекса массы тела;
- Ya. R. Timasheva, Zh. R. Balkhiyarova, O. V. Kochetova. (2021). Current state of the obesity research: genetic aspects, the role of microbiome, and susceptibility to COVID-19. Probl Endokrinol (Mosk). 67, 20-35;
- Robert Wolfgang Schwenk, Heike Vogel, Annette Schürmann. (2013). Genetic and epigenetic control of metabolic health. Molecular Metabolism. 2, 337-347;
- Kristin L Ayers, Benjamin S Glicksberg, Alastair S Garfield, Simonne Longerich, Joseph A White, et. al.. (2018). Melanocortin 4 Receptor Pathway Dysfunction in Obesity: Patient Stratification Aimed at MC4R Agonist Treatment. The Journal of Clinical Endocrinology & Metabolism. 103, 2601-2612;
- Maryam Ahmadian, Jae Myoung Suh, Nasun Hah, Christopher Liddle, Annette R Atkins, et. al.. (2013). PPARγ signaling and metabolism: the good, the bad and the future. Nat Med. 19, 557-566;
- Amanda Janesick, Bruce Blumberg. (2011). Minireview: PPARγ as the target of obesogens. The Journal of Steroid Biochemistry and Molecular Biology. 127, 4-8;
- Béatrice Desvergne, Jérôme N. Feige, Cristina Casals-Casas. (2009). PPAR-mediated activity of phthalates: A link to the obesity epidemic?. Molecular and Cellular Endocrinology. 304, 43-48;
- Abibe Useini, Inken Kaja Schwerin, Georg Künze, Norbert Sträter. (2024). Structural Studies on the Binding Mode of Bisphenols to PPARγ. Biomolecules. 14, 640;
- Sun-Il Choi, Hee-Yeon Kwon, Xionggao Han, Xiao Men, Ye-Eun Choi, et. al.. (2021). Environmental obesogens (bisphenols, phthalates and parabens) and their impacts on adipogenic transcription factors in the absence of dexamethasone in 3T3-L1 cells. The Journal of Steroid Biochemistry and Molecular Biology. 214, 105994;
- Эпигенетика: невидимый командир генома;
- Дофаминовые болезни;
- Gene-Jack Wang, Nora D Volkow, Jean Logan, Naoml R Pappas, Christopher T Wong, et. al.. (2001). Brain dopamine and obesity. The Lancet. 357, 354-357;
- Conner W. Wallace, Steve C. Fordahl. (2022). Obesity and dietary fat influence dopamine neurotransmission: exploring the convergence of metabolic state, physiological stress, and inflammation on dopaminergic control of food intake. Nutr. Res. Rev.. 35, 236-251;
- Tomas Kukucka, Nikola Ferencova, Zuzana Visnovcova, Igor Ondrejka, Igor Hrtanek, et. al.. (2024). Mechanisms Involved in the Link between Depression, Antidepressant Treatment, and Associated Weight Change. IJMS. 25, 4511;
- Katy A. van Galen, Anouk Schrantee, Kasper W. ter Horst, Susanne E. la Fleur, Jan Booij, et. al.. (2023). Brain responses to nutrients are severely impaired and not reversed by weight loss in humans with obesity: a randomized crossover study. Nat Metab. 5, 1059-1072;
- Очень нервное возбуждение;
- Jonas Petersen, Mette Q. Ludwig, Vaida Juozaityte, Pablo Ranea-Robles, Charlotte Svendsen, et. al.. (2024). GLP-1-directed NMDA receptor antagonism for obesity treatment. Nature. 629, 1133-1141;
- Воздействие на апелинергическую систему как перспективное направление биофармацевтики;
- Трогательная и жгучая — за что вручили Нобелевскую премию по медицине (2021);
- Stewart Christie, Gary A. Wittert, Hui Li, Amanda J. Page. (2018). Involvement of TRPV1 Channels in Energy Homeostasis. Front. Endocrinol.. 9;
- Жгучий перец облегчит боль;
- Venkatesh L. Murthy, Rui Xia, Abigail S. Baldridge, Mercedes R. Carnethon, Stephen Sidney, et. al.. (2020). Polygenic Risk, Fitness, and Obesity in the Coronary Artery Risk Development in Young Adults (CARDIA) Study. JAMA Cardiol. 5, 263;
- George A Bray, Samara Joy Nielsen, Barry M Popkin. (2004). Consumption of high-fructose corn syrup in beverages may play a role in the epidemic of obesity. The American Journal of Clinical Nutrition. 79, 537-543;
- Samir Softic, Kimber L. Stanhope, Jeremie Boucher, Senad Divanovic, Miguel A. Lanaspa, et. al.. (2020). Fructose and hepatic insulin resistance. Critical Reviews in Clinical Laboratory Sciences. 57, 308-322;
- Concetta Schiano, Vincenzo Grimaldi, Michele Scognamiglio, Dario Costa, Andrea Soricelli, et. al.. (2021). Soft drinks and sweeteners intake: Possible contribution to the development of metabolic syndrome and cardiovascular diseases. Beneficial or detrimental action of alternative sweeteners?. Food Research International. 142, 110220;
- Adrian Carter, Joshua Hendrikse, Natalia Lee, Murat Yücel, Antonio Verdejo-Garcia, et. al.. (2016). The Neurobiology of “Food Addiction” and Its Implications for Obesity Treatment and Policy. Annu. Rev. Nutr.. 36, 105-128;
- Ricardo V. Cohen, Mauricio A. Azevedo, Carel W. Le Roux, Lorraine PMLP Caldeon, Alexandre Luque, et. al.. (2024). Metabolic/Bariatric Surgery is Safe and Effective in People with Obesity, Type 2 Diabetes Mellitus and Chronic Kidney Disease: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. OBES SURG. 34, 4097-4105;
- Katharina Timper, Jens C. Brüning. (2017). Hypothalamic circuits regulating appetite and energy homeostasis: pathways to obesity. Disease Models & Mechanisms. 10, 679-689;
- Ken Howick, Brendan Griffin, John Cryan, Harriët Schellekens. (2017). From Belly to Brain: Targeting the Ghrelin Receptor in Appetite and Food Intake Regulation. IJMS. 18, 273;
- Sebastián Zagmutt, Paula Mera, M. Carmen Soler-Vázquez, Laura Herrero, Dolors Serra. (2018). Targeting AgRP neurons to maintain energy balance: Lessons from animal models. Biochemical Pharmacology. 155, 224-232;
- Hossein Mehrabi, Pushkar Bansal, John Jutoy, Yat Ho Chan, Mitchell F. Roitman, et. al.. (2025). Optogenetic activation of hypothalamic AgRP neurons in transgenic zebrafish larvae increased food intake. Sci Rep. 15;
- N. R. Levens, M. Félétou, J.-P Galizzi, J.-L. Fauchére, O. Della-Zuana, M. Lonchampt. (2004). NPY Effects on Food Intake and Metabolism. Handbook of Experimental Pharmacology. 283-325;
- Спокоен как GABA;
- Andrew R. Rau, Shane T. Hentges. (2019). GABAergic Inputs to POMC Neurons Originating from the Dorsomedial Hypothalamus Are Regulated by Energy State. J. Neurosci.. 39, 6449-6459;
- Ликбез по ЦНС;
- Coleen Roger, Adèle Lasbleiz, Maxime Guye, Anne Dutour, Bénédicte Gaborit, Jean-Philippe Ranjeva. (2022). The Role of the Human Hypothalamus in Food Intake Networks: An MRI Perspective. Front. Nutr.. 8;
- Juliana Austin, Daniel Marks. (2009). Hormonal Regulators of Appetite. International Journal of Pediatric Endocrinology. 2009, 1-9;
- Andrew C. Shin, Nika Filatova, Claudia Lindtner, Tiffany Chi, Seta Degann, et. al.. (2017). Insulin Receptor Signaling in POMC, but Not AgRP, Neurons Controls Adipose Tissue Insulin Action. Diabetes. 66, 1560-1571;
- Marie Amitani, Akihiro Asakawa, Haruka Amitani, Akio Inui. (2013). The role of leptin in the control of insulin-glucose axis. Front. Neurosci.. 7;
- Zoltán Péterfi, Anett Szilvásy-Szabó, Erzsébet Farkas, Yvette Ruska, Charles Pyke, et. al.. (2021). Glucagon-Like Peptide-1 Regulates the Proopiomelanocortin Neurons of the Arcuate Nucleus both Directly and Indirectly via Presynaptic Action. Neuroendocrinology. 111, 986-997;
- Karly E. Masse, Van B. Lu. (2023). Short-chain fatty acids, secondary bile acids and indoles: gut microbial metabolites with effects on enteroendocrine cell function and their potential as therapies for metabolic disease. Front. Endocrinol.. 14;
- Miao Yu, Bing Yu, Daiwen Chen. (2024). The effects of gut microbiota on appetite regulation and the underlying mechanisms. Gut Microbes. 16;
- D.M. Wang, B. Chacher, H.Y. Liu, J.K. Wang, J. Lin, J.X. Liu. (2015). Effects of γ-aminobutyric acid on feed intake, growth performance and expression of related genes in growing lambs. Animal. 9, 445-448;
- Markus F Neurath, David Artis, Christoph Becker. (2025). The intestinal barrier: a pivotal role in health, inflammation, and cancer. The Lancet Gastroenterology & Hepatology. 10, 573-592;
- George A. Bray. (1993). Use and Abuse of Appetite-Suppressant Drugs in the Treatment of Obesity. Ann Intern Med. 119, 707-713;
- Feingold K., Ahmed S., Anawalt B. An Historical Review of Steps and Missteps in the Discovery of Anti-Obesity Drugs. South Dartmouth (MA): MDText.com, Inc. 2000;
- Christopher T. Lum, Stephen M. Stahl. (2012). Opportunities for reversible inhibitors of monoamine oxidase-A (RIMAs) in the treatment of depression. CNS Spectr.. 17, 107-120;
- Alfred P. Fishman. (1999). Aminorex to Fen/Phen. Circulation. 99, 156-161;
- Серотониновые сети;
- Fenfluramine and dexfenfluramine withdrawn from market. American Journal of Health-System Pharmacy. 54, 2269-2270;
- Ann A. Coulter, Candida J. Rebello, Frank L. Greenway. (2018). Centrally Acting Agents for Obesity: Past, Present, and Future. Drugs. 78, 1113-1132;
- Лекарства от психических расстройств: как не сойти с ума в эпоху современной фармакологии?;
- LL Darga, L Carroll-Michals, SJ Botsford, CP Lucas. (1991). Fluoxetine's effect on weight loss in obese subjects. The American Journal of Clinical Nutrition. 54, 321-325;
- David E. Arterburn, Paul K. Crane, David L. Veenstra. (2004). The Efficacy and Safety of Sibutramine for Weight Loss. Arch Intern Med. 164, 994;
- Ann A. Coulter, Candida J. Rebello, Frank L. Greenway. (2018). Centrally Acting Agents for Obesity: Past, Present, and Future. Drugs. 78, 1113-1132;
- Marco Koch, Luis Varela, Jae Geun Kim, Jung Dae Kim, Francisco Hernández-Nuño, et. al.. (2015). Hypothalamic POMC neurons promote cannabinoid-induced feeding. Nature. 519, 45-50;
- Daniela Cota. (2017). The brain strikes back: Hypothalamic targets for peripheral CB 1 receptor inverse agonism. Molecular Metabolism. 6, 1077-1078;
- Каннабиноиды в медицине: тупик или перспективное направление?;
- Jang Won Son, Sungrae Kim. (2020). Comprehensive Review of Current and Upcoming Anti-Obesity Drugs. Diabetes Metab J. 44, 802-818;
- John P.H. Wilding, Rachel L. Batterham, Salvatore Calanna, Melanie Davies, Luc F. Van Gaal, et. al.. (2021). Once-Weekly Semaglutide in Adults with Overweight or Obesity. N Engl J Med. 384, 989-1002;
- «Берег»: «Новые лекарства от ожирения — настоящий прорыв в медицине последних лет»;
- N+1: «Больше не ешь. Как отключить у человека аппетит и что будет потом»;
- Оземпик: больше, чем средство для похудения;
- Louis J. Aronne, Deborah Bade Horn, Carel W. le Roux, Wayne Ho, Beverly L. Falcon, et. al.. (2025). Tirzepatide as Compared with Semaglutide for the Treatment of Obesity. N Engl J Med. 393, 26-36;
- Ania M. Jastreboff, Lee M. Kaplan, Juan P. Frías, Qiwei Wu, Yu Du, et. al.. (2023). Triple–Hormone-Receptor Agonist Retatrutide for Obesity — A Phase 2 Trial. N Engl J Med. 389, 514-526;
- Maria J. Pereira, Ketan Thombare, Assel Sarsenbayeva, Prasad G. Kamble, Kristina Almby, et. al.. (2020). Direct effects of glucagon on glucose uptake and lipolysis in human adipocytes. Molecular and Cellular Endocrinology. 503, 110696;
- YAN WANG, SHIJUN YAN, MATTHEW BANICKI, MARY COCHRAN, CLAUDIA PORTILLO, et. al.. (2024). 118-OR: The Apelin Receptor Agonist Azelaprag Increases Weight Loss in Diet-Induced Obese Mice on Incretin Agonists and Restores Body Composition and Muscle Function to That of Lean Controls. Diabetes. 73;
- Kirsten Dahl, Søren Toubro, Sohan Dey, Ruben Duque do Vale, Anne Flint, et. al.. (2025). Amycretin, a novel, unimolecular GLP-1 and amylin receptor agonist administered subcutaneously: results from a phase 1b/2a randomised controlled study. The Lancet. 406, 149-162;
- Olivia Tysoe. (2025). Combined amylin analogue and GLP1 receptor agonist therapies are highly promising for weight loss. Nat Rev Endocrinol. 21, 524-524;
- N+1: «Низкомолекулярный оральный агонист ГПП-1 помог снизить массу тела»;
- Khan P.: Functional Agonists of the Apelin (APJ) Receptor. National Center for Biotechnology Information (US), 2010.