ВПЧ: вирус, вызывающий рак
27 января 2023
ВПЧ: вирус, вызывающий рак
- 5455
- 3
- 13
Вирус ВПЧ может годами не выдавать своего присутствия. Между тем, сохраняясь в организме, он год за годом воздействует на клетки слизистых, постепенно превращая их в раковые. Рисунок в полном размере.
иллюстрация Ирины Ефремовой
-
Автор
-
Иллюстратор
В этой статье спецпроекта о вакцинации мы поговорим о самых «тихих» вирусах, против которых делают прививки. Они могут годами существовать в организме, не вызывая симптомов; чаще всего на этом инфекция и заканчивается. Но иногда коварный захватчик изменяет зараженные клетки настолько, что они становятся злокачественными. В отличие от возбудителей кори или ветрянки, подобных агрессивным налетчикам, сразу начинающим «жечь деревню», вирусы папилломы человека (ВПЧ) часто действуют как незаметные диверсанты. Самые коварные из них убивают хозяина — но лишь спустя много лет, и оттого угроза долгое время остается неочевидной.
Вакцинация

Партнер публикации этой статьи — российская биофармацевтическая компания ООО «Нанолек», основанная в 2011 году и специализирующаяся на производстве импортозамещающих лекарственных препаратов для профилактики и терапии социально значимых заболеваний.
Один из лидеров по производству педиатрических вакцин в РФ, входит в топ-3 производителей вакцин для российского Национального календаря профилактических прививок. Также в фокусе компании — препараты для лечения онкологических, орфанных и других заболеваний.
Изобретение вакцин кардинально изменило жизнь человечества. Многие болезни, уносившие тысячи, а то и миллионы жизней ежегодно, теперь практически не встречаются. В этом спецпроекте мы не только рассказываем об истории возникновения вакцин, общих принципах их разработки и роли вакцинопрофилактики в современном здравоохранении (этому посвящены первые три статьи), но и подробно говорим о каждой вакцине, включенной в Национальный календарь прививок, а также вакцинах против гриппа и вируса папилломы человека. Вы узнаете о том, что собой представляет каждый из возбудителей болезней, какие существуют варианты вакцин и чем они различаются между собой, затронем тему поствакцинальных осложнений и эффективности вакцин.
Пандемия COVID-19, разгоревшаяся весной 2020 года, в очередной раз напомнила человечеству, что ему практически нечего противопоставить вездесущим вирусам . Эффективных противовирусных препаратов в арсенале современной медицины — раз два и обчелся . На данный момент самым действенным инструментом в борьбе с опасными вирусными инфекциями является вакцинация. И тут ученым есть, чем похвастать: например, вакцины против нового коронавируса создали и зарегистрировали в рекордно короткие сроки .
На «Биомолекуле» можно найти не одну статью о болезни COVID-19 и вирусе SARS-CoV-2, который ее вызывает. Среди таких публикаций: «Хроника распространения SARS-CoV-2» [1], «Как вылечить COVID-19? (Спойлер: пока точно не знаем, но догадываемся)» [2], «COVID-19: отвечаем на вопросы» [3], «Животные как объект для проведения испытаний вакцин против COVID-19: необходимость или излишество» [4] и др.
О современных медикаментах против вирусных инфекций читайте в статьях «Иллюзия уверенности» [5], «Пилюля от гриппа: современные противовирусные средства» [6] и «Гепатит С: решенная проблема?» [7]. Ну а достаточно полную сводку по коронавирусным вакцинам дадут публикации «“Спутник V”, “ЭпиВакКорону”, “Модерну” делать будем? Ликбез по вакцинам против коронавируса» [8] и инфографика «Гонки вакцин 2020» [9].
Но не все вирусы получили всемирную известность благодаря тому, что вызывают яркие эпидемии с множеством случаев тяжелого течения и смертей за относительно короткое время. В то время как SARS-CoV-2 или грипп действуют в открытую, другие вирусные агенты успешно скрываются.
О прививках против гриппа, которые положено делать каждую осень, мы рассказывали в статье «Неуловимый грипп» [10]. А об исторических бесчинствах гриппа читайте тут: «Объяснена различная вирулентность вирусов гриппа — возбудителей “испанки”» [11].
Иногда нужно приложить немало усилий, чтобы распознать врага и доказать, что именно он вызывает болезнь. Именно так произошло с вирусами папилломы человека (ВПЧ). Некоторые из них способны приводить к онкологическим заболеваниям, и ученым потребовалось немало времени, чтобы разобраться в причинно-следственных связях (кстати, ВПЧ — не единственные вирусы, вызывающие рак, но об этом позже). Когда все точки над i были расставлены, вакцины против ВПЧ появились довольно быстро; сейчас многие страны уже включили их в свои прививочные календари. В недалеком будущем это, надеемся, случится и в России.
История изучения вирусов папилломы человека
О том, что у людей могут возникать бородавки, было известно очень давно. Первые письменные источники, в которых были описаны эти новообразования, датируются еще временами Гиппократа. Древнеримский ученый и врач Цельс, живший в начале нашей эры, создал первую классификацию, в которой поделил все кожные бородавки на три группы: акрохордоны (встречаются только у детей и исчезают самостоятельно), тимионы (бугристые, с обильным кровоснабжением) и мирмеции (в настоящее время известны как подошвенные бородавки) [12], [13].
Со времен этих первых описаний в изучении папилломавирусной инфекции не происходило ничего интересного почти до XX столетия. Средневековье породило много теорий, не имеющих отношения к действительности: считалось, что бородавки возникают от прикосновения к жабам, цыплятам, коровам и другими животным; от мытья рук в воде, в которой были сварены яйца; и даже от мастурбации [13].
Тем не менее наука не стояла на месте. В 1842 году итальянский врач Ригони-Штерн решил проанализировать заболеваемость раком шейки матки (РШМ) среди жительниц Италии. Он обнаружил, что у девственниц и монахинь это онкологическое заболевание встречалось намного реже, чем среди замужних женщин и вдов. Таким образом, Ригони-Штерну впервые удалось связать заболеваемость раком шейки матки с половыми контактами. Впоследствии ученые неоднократно успешно заражали подопытных и даже себя бородавками, втирая в кожу ткани патологических образований, полученные от больных людей [12], [14]. Так было доказано, что бородавки вызывает некий инфекционный агент.
В 1907 году стало понятно, что кожные и половые бородавки — это вирусное заболевание. Итальянский доктор Джузеппе Чуффо получил экстракт из остроконечных кондилом и пропустил его через фильтр, который задерживал бактерии и грибки. После того, как полученный фильтрат втирали в кожу, на ней возникали бородавки. А значит, их появление было связано не с бактериями или грибами, а с самыми мелкими патогенами — вирусами. Поначалу считалось, что все кожные и половые бородавки вызывает один и тот же вирус. Но впоследствии оказалось, что это не так. Ученые открывают новые типы ВПЧ до сих пор.
В 1949 году удалось наконец рассмотреть кристаллические вирусоподобные частицы в ткани папилломы кожи — ученые впервые увидели ВПЧ собственными глазами [12], [14], [15]. Получить подробное изображение вирусов папилломы человека с помощью электронной микроскопии [14] удалось гораздо позднее, в 1960-е годы, а в 1982 году были секвенированы геномы вирусов папилломы крупного рогатого скота 1 типа и папилломы человека типа 1a [16–18].
Роль вирусов в развитии онкологических заболеваний изучали многие специалисты, в том числе и российские. В 30-е годы прошлого столетия советский иммунолог и вирусолог Лев Александрович Зильбер , опираясь на серию экспериментов, в которых он пропускал образцы опухолевых тканей через фильтр и прививал животным, предположил, что вирусы могут запускать процесс превращения нормальных клеток в раковые [19].
С именем Зильбера связывают также открытие клещевого энцефалита: «Клещевой энцефалит: крошечный укус — серьезные последствия» [20].
Огромное значение в ранней диагностике онкологических заболеваний, связанных с папилломавирусной инфекцией, сыграли работы греческого врача Георгиоса Николау Папаниколау. В 1920 году он начал изучать патологические изменения в клетках органов женской репродуктивной системы. В 1928 году Папаниколау переехал в США и опубликовал работу, в которой утверждал, что можно выявлять злокачественные клетки в шейке матки с помощью цитологических мазков. В научном сообществе к новой методике поначалу отнеслись скептически: в то время считалось, что диагностировать рак шейки матки можно только путем биопсии после операции. Но спустя некоторое время многие врачи убедились, что цитологический мазок — весьма эффективный метод обнаружения атипичных клеток. Эта простая и недорогая процедура быстро нашла широкое применение, стала золотым стандартом в ранней диагностике РШМ и сегодня известна как мазок Папаниколау, или ПАП-тест, который применяется в виде стандартного скрининга [21].
В 1976 году произошло событие, которое помогло окончательно связать вирусы папилломы человека с онкологическими заболеваниями и стало первым шагом к созданию вакцин против ВПЧ. Немецкий ученый Харальд цур Хаузен опубликовал гипотезу о том, что вирусы папилломы человека способствуют развитию рака шейки матки. В 1983 году он идентифицировал онкогенные ВПЧ 16 и 18 типов (рис. 2). В 2008 году ученый получил за свои работы Нобелевскую премию по физиологии и медицине [14] .
О жизни и работе Харальда цур Хаузена можно почитать в нашей статье «Увидевший вирусы в раке. Харальд цур Хаузен» [22]. Интересно, что Нобелевскую премию он получил только спустя 25 лет после своего открытия. О том, как это было, читайте в статье «Нобелевскую премию 2008 года по физиологии и медицине вручили за вирусологические исследования» [23].
Со времен открытий цур Хаузена прошло много лет, но вирусы папилломы человека продолжают находиться под пристальным вниманием ученых. И это не удивительно, ведь ВПЧ — один из немногих видов вирусов, способных вызывать онкологические заболевания, а рак шейки матки по-прежнему остается глобальной проблемой здравоохранения. Чтобы понимать, как бороться с таким опасным врагом, его нужно хорошо знать в лицо.

Рисунок 2. История борьбы с ВПЧ. В Древней Греции «отец медицины» Гиппократ начал изучение ВПЧ-инфекции, а первая классификация бородавок, вызванных ВПЧ, обязана своим появлением древнеримскому ученому Авлу Корнелию Цельсу. Тем не менее вплоть до 19 века в обществе бытовало мнение, что бородавки — признак греха или плод черной магии. Только в 1842 году, когда Ригони-Штерн в Италии обнаружил, что раку шейки матки замужние женщины и вдовы подвержены больше, чем девственницы и монахини, изучение ВПЧ получило новый толчок. В 1907 году другой итальянец, Джузеппе Чуффо, доказал вирусное происхождение кондилом, а в 1949 году в ткани папилломы кожи впервые были обнаружены кристаллические вирусоподобные частицы. Затем, в 1928 году, всемирно известный врач Георгиос Николау Папаниколау предложил метод ранней диагностики РШМ с помощью взятия цитологического мазка из цервикального канала (ПАП-тест). В 1930-е годы свою лепту в исследование ВПЧ как причины развития рака внес отечественный ученый Лев Александрович Зильбер, а в 1976 году Харальд цур Хаузен окончательно связал РМШ с вирусами папилломы человека. Позднее, в 1983 году, именно он описал онкогенные ВПЧ 16 и 18 типов. В 1990-е годы в Университете Квинсленда Яном Гектором Фрейзером и Цзянь Чжоу была разработана первая вакцина против ВПЧ. В 2006 году в США получила одобрение вакцина «Гардасил», в 2007 году вакцина «Церварикс» появилась в Австралии. Самая молодая вакцина против ВПЧ — «Гардасил-9», была зарегистрирована в 2014 году и защищает от девяти генотипов ВПЧ, среди которых семь относятся к вирусам высокого онкогенного риска, а еще два (типы 6 и 11 ) — к вирусам низкого онкогенного риска, но чаще других вызывают аногенитальные бородавки.
иллюстрация Ирины Ефремовой
Кто вы, мистер ВПЧ?
Вирусы папилломы — большая группа, которая включает более 200 разных типов, из них более 150 заражают человека (это и есть ВПЧ). Животные познакомились с этими вирусами, видимо, около 350 миллионов лет назад, когда появились первые рептилии. Сейчас эти возбудители встречаются у рептилий, птиц и млекопитающих, включая человека. У земноводных и рыб папилломавирусных инфекций не бывает. Вирусы папилломы — одни из тех вирусов, которые медленно эволюционируют вместе со своими хозяевами и вызывают хронические, зачастую бессимптомные инфекции.
По меркам вирусов ВПЧ относятся к карликам. Диаметр их частиц составляет 30 нм, что примерно в четыре раза меньше, чем у ВИЧ и вируса гриппа . Кстати, в отличие них, ВПЧ «голые», у них нет мембраны, заимствованной у клеток-хозяев. Отсюда и разница в размерах.
О вирусах гриппа и вакцинах против них мы уже писали в статье «Неуловимый грипп» [10].
Вирусная частица ВПЧ имеет форму икосаэдра, но внешне больше напоминает сферу (рис. 3). Внутри находится ДНК, которая кодирует два типа белков:
- Ранние белки (early proteins, E-proteins) отвечают за размножение вируса и регулируют экспрессию (активность) его генов. Они способны привести к злокачественному перерождению клеток, особенно это касается белков E6 и E7. Например, ранний белок E6 связывается с белком человека p53 — «стражем генома», убивающим клетки с поврежденной ДНК, и способствует его разрушению.
- Поздние белки (late proteins, L-proteins) — это строительный материал для оболочки (капсида) вирусной частицы. Среди них нужно особо отметить белок L1 — именно он используется в современных вакцинах в качестве антигена, вызывающего иммунную реакцию.
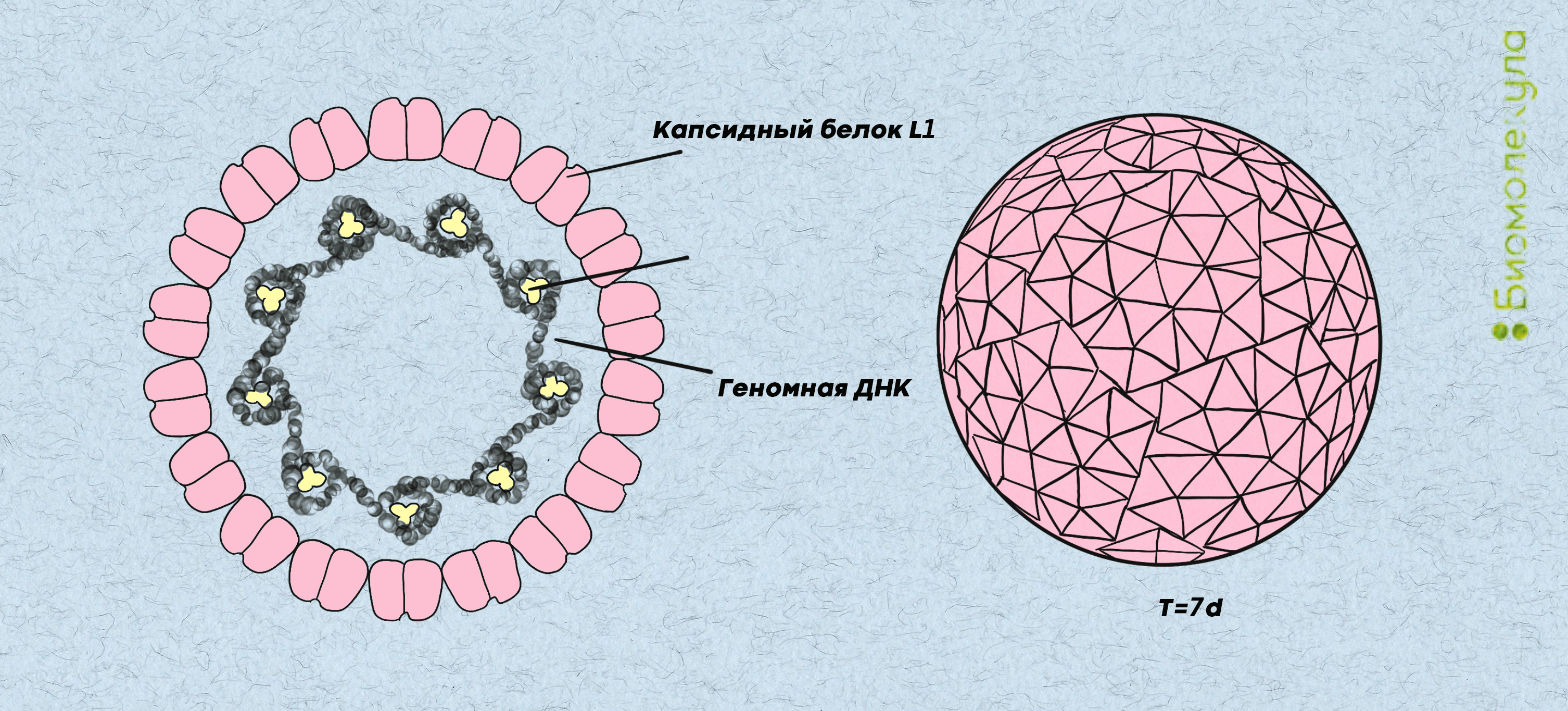
Рисунок 3. Строение вирусов папилломы человека. Внутри находится генетический материал. Розовым цветом обозначена белковая оболочка, на которую реагирует иммунная система, когда происходит заражение.
рисунок Ирины Ефремовой по данным сервиса Viral Zone
Заражение вирусом происходит половым путем, а также во время тесного контакта «кожа к коже», в том числе от матери к ребенку во время родов. Причем человек заразен, даже если у него нет симптомов. Папилломавирусную инфекцию нельзя «подцепить» в бассейне и общественном туалете, а также просто при прикосновении к другому человеку, например, во время рукопожатия.
После попадания в организм ВПЧ поражает кератиноциты — клетки, из которых состоят кожа и слизистые оболочки. Молодые зараженные клетки, которые находятся в самых нижних слоях (обычно вирус проникает в кожу через повреждения — ссадины, царапины и пр.), постепенно созревают, продвигаются в верхние слои, и тут новые вирусные частицы выходят наружу (рис. 4). За счет такой связи с жизненным циклом клеток-хозяев ВПЧ сложно культивировать в лаборатории [16], [24].
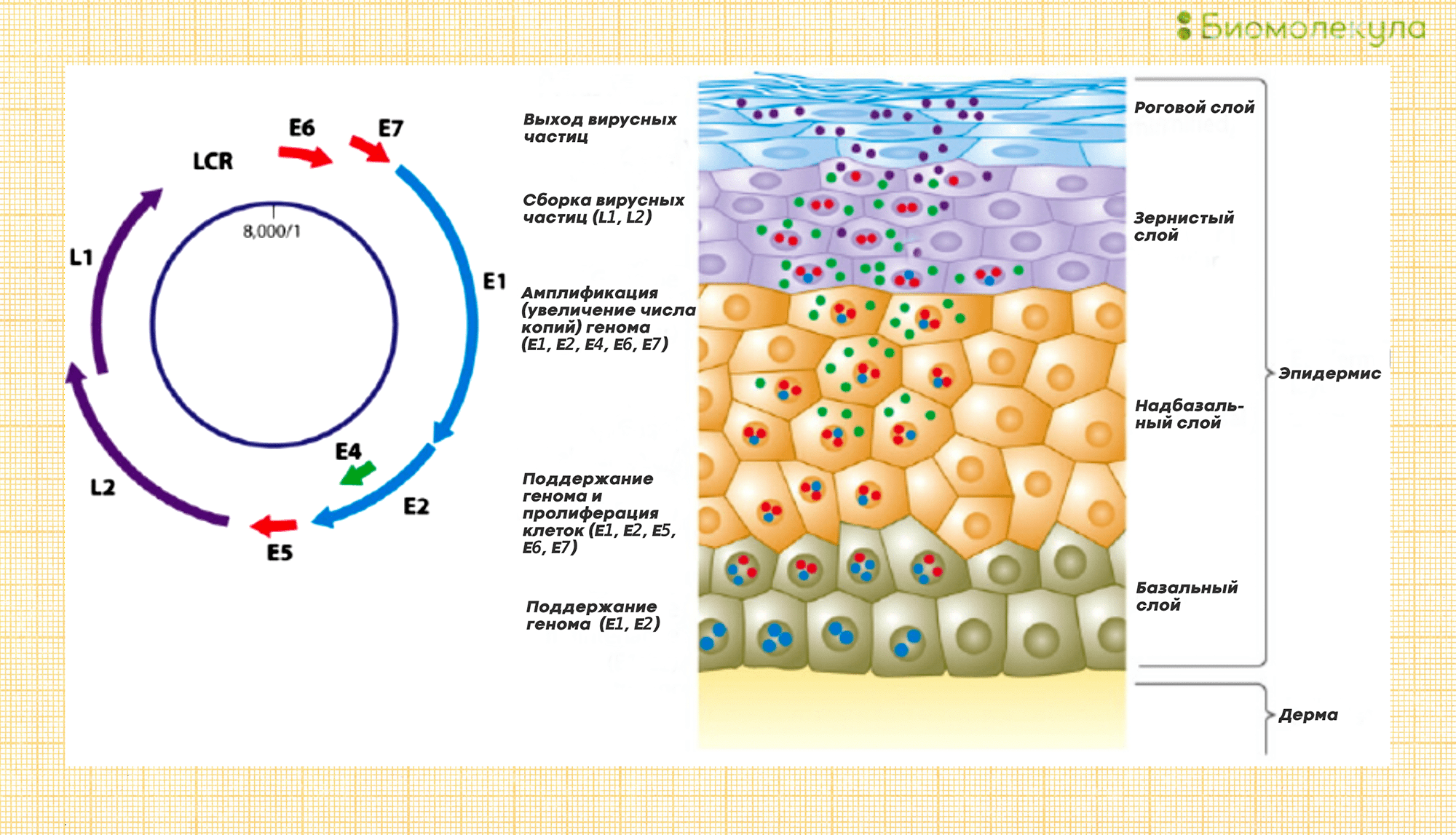
Рисунок 4. Жизненный цикл ВПЧ. Слева разными цветами показана последовательность синтеза вирусных белков. Справа — схема продвижения вируса в слоях эпидермиса.
От бородавки до злокачественной опухоли
Типичное проявление инфекции, вызванной ВПЧ, — папилломы, или, обычным языком, вирусные бородавки. Собственно, за это вирусы и получили свое название. Несмотря на то, что ВПЧ широко распространены (в какой-то момент заражается примерно половина людей, ведущих половую жизнь [25]), они вызывают симптомы далеко не у всех зараженных, и далеко не всегда опасны. Чаще всего инфекция протекает латентно — нет ни симптомов, ни клинических проявлений; человек даже не подозревает, что заражен. Иногда встречается субклиническое течение, при котором ярких, заметных симптомов нет, но заболевание может быть обнаружено во время обследования. Например, вирусные кондиломы шейки матки или влагалища зачастую не доставляют женщине никаких проблем, и их обнаруживают врачи-гинекологи во время профилактических осмотров [26].
Клинические формы с ярко выраженными симптомами встречаются редко. Например, по данным американских исследователей, распространенное проявление папилломавирусной инфекции — остроконечные кондиломы («половые бородавки») — встречаются только у 1% людей, активно ведущих половую жизнь [26].
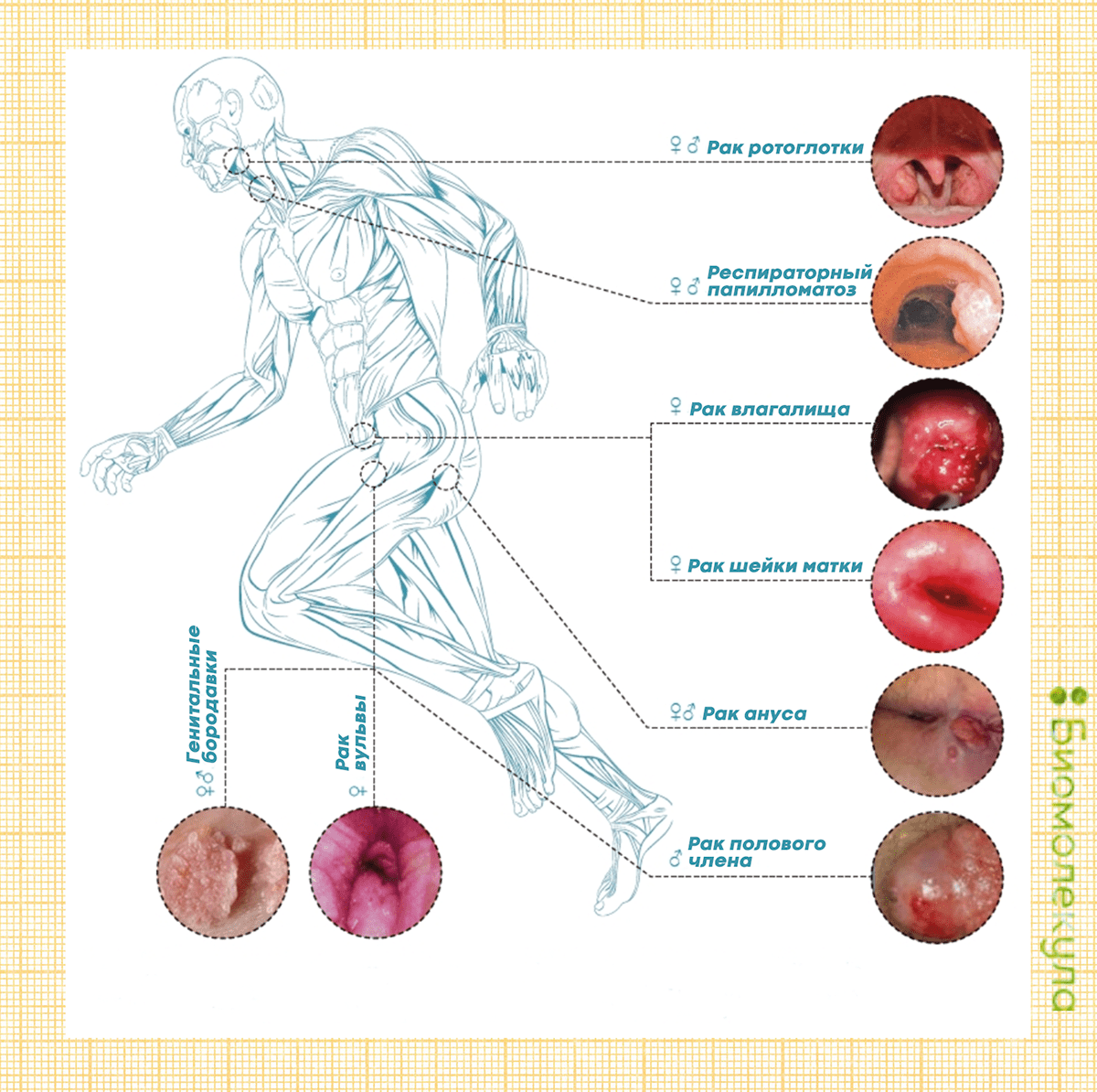
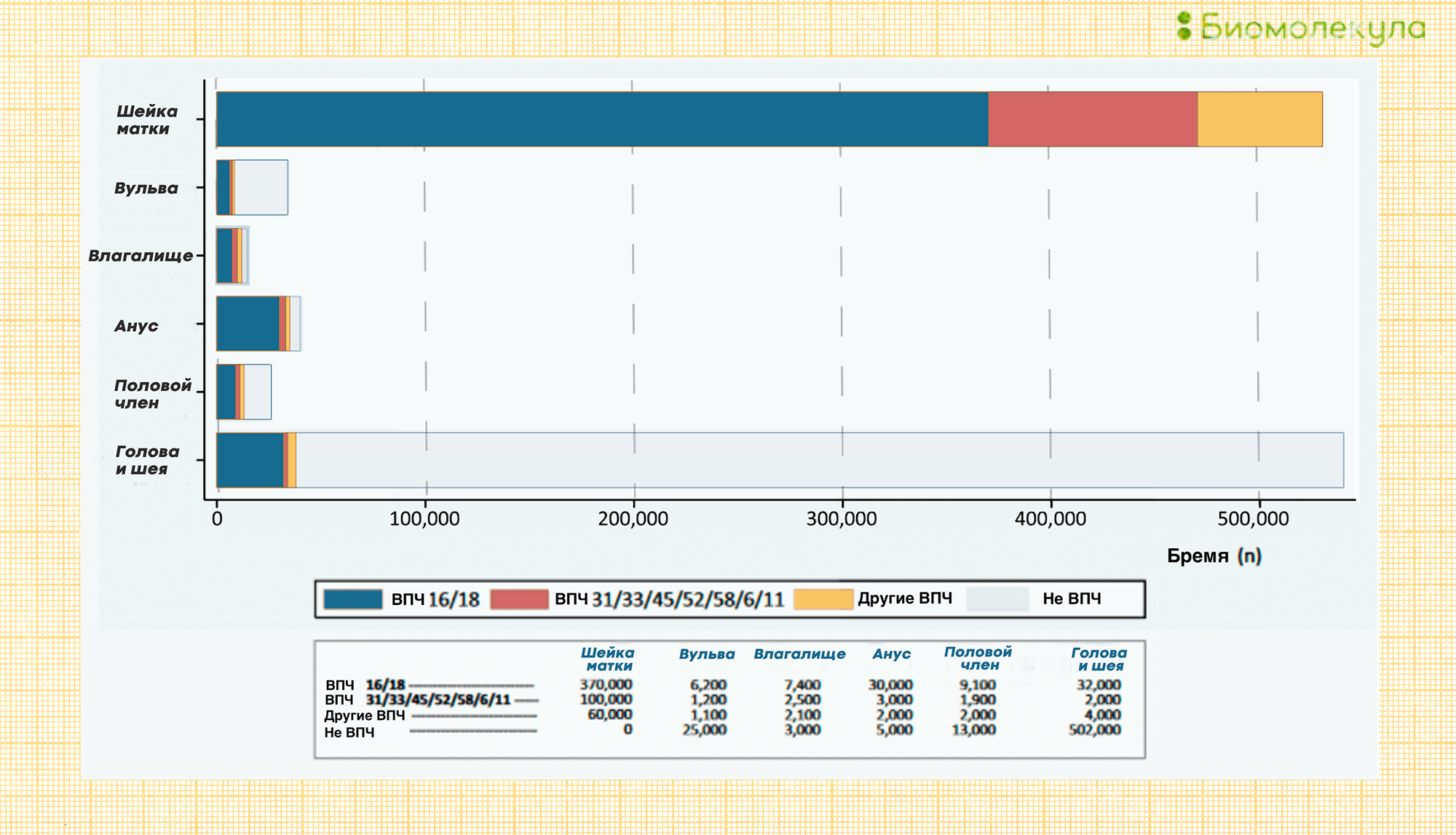
Но, конечно, основной интерес медицинского сообщества к ВПЧ вызван не их связью с бородавками, а тем, что некоторые вирусы папилломы, присутствуя в организме в форме хронической инфекции, могут приводить к злокачественному перерождению клеток. В зависимости от способности вызывать рак, все ВПЧ делятся на вирусы высокого и низкого риска. Большинство относится ко второй группе, многих из них ученые даже предлагают рассматривать как комменсалов — «квартирантов», которые не приносят ни вреда, ни пользы. Вирусов высокого риска, способных вызывать онкологические заболевания, не так много — всего 15 генотипов (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68, 73 и 82) [27], [28]. На рисунке 5 можно видеть, какие типы ВПЧ связаны с различными доброкачественными заболеваниями и злокачественными опухолями.
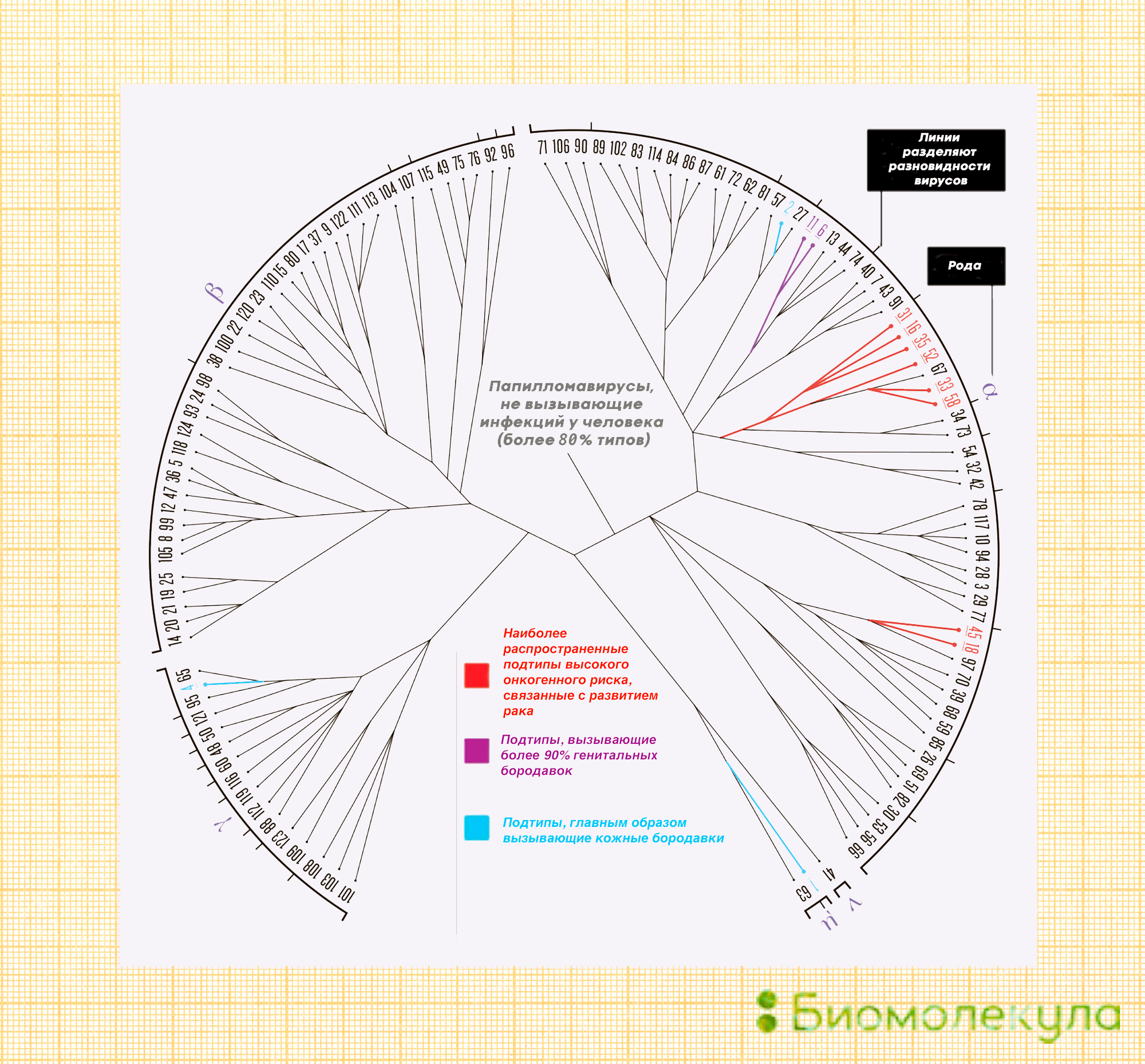
Рисунок 5. Родословное дерево вирусов папилломы. Разными цветами отмечены типы, которые вызывают злокачественные опухоли, кожные и генитальные бородавки у человека. На рисунке видно, что эти заболевания связаны с разными типами вирусов.
Итак, проявления болезни во многом зависят от того, каким именно типом вируса был заражен человек (табл. 1). Однако то, станет ли болезнь хронической и приведет ли к серьезным проблемам, также зависит и от других факторов, например, иммунного статуса больного, наличия у него сопутствующих инфекций (герпеса, хламидиоза и др.), вредных привычек и так далее.
| Название заболевания | Описание | Типы ВПЧ |
|---|---|---|
| Инфекции слизистых оболочек | ||
| Остроконечные кондиломы (рис. 6а) | Чаще всего возникают в области половых органов. Кондилома выглядит как узелок, может иметь вид цветной капусты, быть плоской. Она может располагаться на ножке или широком основании, иметь розовый цвет. Размеры бывают разными: некоторые образования едва можно рассмотреть, и их выявляет только врач во время осмотра, а другие достигают очень больших размеров. У мужчин остроконечные кондиломы чаще всего возникают на половом члене, у женщин — в области наружных половых органов, на слизистой оболочке шейки матки. «Половые бородавки» постоянно трутся о белье, это вызывает боль, кровотечения, способствует раздражению кожи и воспалению. У людей с остроконечными кондиломами повышен риск развития рака в области половых органов и ануса [29], [30] | В 90% случаев — 6 и 11. Также в остроконечных кондиломах обнаруживаются ВПЧ 2, 16, 18, 30–33, 35, 39, 41–45, 51–56 и 59 типов |
| Очаговая эпителиальная гиперплазия (болезнь Хека, рис. 6б) | Редкое доброкачественное поражение слизистой оболочки рта, чаще встречается у детей и женщин. Проявляется в виде узелков, чаще всего на слизистой оболочке нижней губы, реже — в области верхней губы, языка, дна ротовой полости, неба, ротоглотки | Чаще всего 13 и 32 типы |
| Дисплазия и рак шейки матки | Вирусы папилломы человека обнаруживаются в большинстве случаев при предраковых изменениях и злокачественных опухолях шейки матки | В 70% случаев к раку шейки матки приводят ВПЧ 16 и 18 типов [31] |
| Рак в области половых органов и ануса | ВПЧ обнаруживаются у многих пациентов с раком вульвы, влагалища, полового члена, заднего прохода | Чаще всего 16 тип. Реже встречаются другие типы |
| Рак головы и шеи | ВПЧ считаются основным фактором риска развития плоскоклеточного рака головы и шеи. Чаще всего вирусы обнаруживаются при раке ротоглотки и миндалин. Пациенты со злокачественными опухолями, ассоциированными с ВПЧ, имеют более благоприятный прогноз за счет более высокой чувствительности раковых клеток к химиопрепаратам | Чаще всего 16 тип. Реже 18, 31, 33 и 35 типы |
| Респираторный папилломатоз | В группе риска дети в возрасте 3–4 лет и взрослые старше 40 лет. Папилломы возникают на слизистой оболочке гортани, что может приводить к грубому, «лающему» кашлю, ощущению кома в горле, боли в ушах, изменению голоса, охриплости. Большие папилломы приводят к нарушению дыхания | 6, 11 и 16 типы |
| Инфекции кожи | ||
| Обыкновенные (вульгарные) бородавки (рис. 6 в) | Бывают единичными и множественными, разных размеров. При ослабленном иммунитете становятся многочисленными, и от них сложнее избавиться. Как правило, возникают на тыльной поверхности кистей рук, у детей — на коленях | Обычно 1, 2, 4, 27 и 57 типы. У людей, руки которых часто переохлаждаются и подвергаются действию влаги, в бородавках обнаруживается ВПЧ 7 типа |
| Подошвенные бородавки | Болезненные бляшки из уплотненной огрубевшей кожи желтого цвета. Если сковырнуть такую бляшку, на ее месте появляется кровоточивость или черные точки — это тромбированные капилляры. Обычно встречаются у детей | Чаще всего 1 и 4 типы. Также встречаются ВПЧ 57, 60, 63, 65 и 66 типов |
| Плоские бородавки | Слегка приподнятые участки кожи обычного цвета или пигментированные. Могут иметь гладкую или слегка шероховатую поверхность. Чаще всего возникают на лице, тыльной поверхности рук | Чаще всего 3 и 10 типы |
| Нитевидные бородавки | Образования на ножке, которые растут перпендикулярно или под некоторым углом к коже. Обычно возникают на лице и шее | Те же, что и при обыкновенных бородавках, особенно часто 2 тип |
| Пигментные бородавки | Могут быть разного цвета, от серого до черно-коричневого. Появляются на ладонях, подошвах, боковых поверхностях кистей, стоп, пальцев | Чаще всего 4, 60 и 65 типы |
| Эпидермоидные кисты | Доброкачественные образования в виде полости, стенки которой образованы клетками сальной железы или волосяного фолликула. Внутри находится белок кератин, кожное сало и продукты его разрушения | 57 и 60 типы |
| Рак кожи | Болезнь Боуэна — поверхностный плоскоклеточный рак кожи in situ («на месте»). Злокачественная опухоль, клетки которой пока еще не распространяются в окружающие ткани. В 3–5% случаев трансформируется в инвазивный рак и начинает метастазировать. Также доказана роль ВПЧ в развитии злокачественных опухолей кожи у людей с ослабленным иммунитетом (например, при ВИЧ-инфекции, приеме иммунодепрессантов) | Те же типы, что вызывают поражения слизистых оболочек. Иногда 2, 6, 11, 54, 58, 61, 62 и 73 типы |
Среди всех злокачественных опухолей, связанных с ВПЧ (рис. 7), наибольшую опасность представляет рак шейки матки (рис. 8). По данным Информационного центра по ВПЧ (создан совместными усилиями Каталонского института онкологии и Международного агентства по изучению рака), ежегодно во всем мире диагностируют больше 6500 тысяч новых случаев этого заболевания и более 340 тысяч женщин умирают от него. С ним связано около 7,5% смертей от всех онкопатологий. При этом 70% всех случаев рака шейки матки и предраковых состояний связано с двумя типами ВПЧ — 16 и 18 [31]. А вместе с другими типами ВПЧ высокого онкогенного риска (31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68, 73 и 82) они ответственны более чем за 95% всех случаев рака шейки матки. 19% приходится на типы 31, 33, 45, 52 и 58, остальные приводят к развитию онкозаболеваний реже. Если иммунная система женщины работает нормально, то рак шейки матки, если и развивается, то только спустя 15–20 лет после заражения. До этого женщина может не испытывать никаких симптомов и считать себя здоровой. При иммунодефиците, вызванном ВИЧ-инфекцией и другими причинами, этот срок сокращается до 5–10 лет.
Главными факторами риска развития рака ротовой полости и глотки считаются курение и частое употребление алкоголя. Но в последние годы врачи замечают тревожную статистику: эти опухоли всё чаще встречаются у молодых людей, которые не курят и не злоупотребляют спиртным. Этих пациентов объединяет другая особенность — до заболевания у них было много половых партнерш, и многие практиковали оральный секс. Это приводило к заражению ВПЧ высокого онкогенного риска со всеми вытекающими последствиями. К слову, лечить злокачественные опухоли головы и шеи, вызванные ВПЧ, легче, чем те, что связаны с курением и алкоголем. Они лучше поддаются облучению и химиопрепаратам. Но это слабое утешение. Очевидно, тут нужны эффективные меры профилактики [32].
Существуют ли эффективные методы лечения?
Эффективных противовирусных препаратов против ВПЧ не существует. Но в большинстве случаев они и не требуются: как правило, инфекция проходит сама в течение нескольких месяцев; 90% пациентов выздоравливают в течение двух лет. Если бородавки имеют большие размеры и причиняют дискомфорт, вызывают симптомы, или у пациента обнаружены предраковые изменения, прибегают к хирургическим методам. Важно понимать, что удаление новообразования, вызванного ВПЧ-инфекцией — это симптоматическое лечение. Оно не избавляет от вируса, поэтому в будущем может произойти рецидив [31], [35], [36]. Аногенитальные бородавки, например, возвращаются в 20–30% случаев.
Вирусные бородавки можно удалить разными способами:
- Крем «Имиквимод» — он работает как усилитель местной иммунной защиты: активирует выработку интерферона и цитокинов (воспалительных молекул).
- «Кондилин» — препарат местного применения в виде раствора. Обладает антимитотическим действием (не дает клеткам размножаться) и является клеточным ядом.
- «Вереген» — препарат местного применения, в котором действующими веществами являются катехины. Механизм его действия изучен плохо, но он помогает уничтожать остроконечные кондиломы, вызванные ВПЧ.
- Криохирургия — метод удаления новообразований с помощью очень низкой температуры. Обычно для этого применяют жидкий азот.
- Обычное иссечение — с помощью скальпеля, хирургических ножниц, сбривания новообразования, выступающего над поверхностью кожи.
- Электрохирургия — иссечение с помощью специального инструмента (электрокоагулятора), на который подается электрический ток. Он сильно нагревает и прижигает ткани.
- Лазерная хирургия.
- Удаление с помощью радиоволновой хирургии [35], [36].
После операций при дисплазии шейки матки в большинстве случаев женщина в будущем сможет завести детей. Но если у молодой женщины выявлен рак шейки матки, то с большой вероятностью после лечения беременность станет невозможной. Во-первых, нередко приходится полностью удалять матку. Во-вторых, лучевая терапия и химиотерапия поражают яичники, и, как правило, курс лечения приводит к бесплодию. Однако некоторые решения этой проблемы всё же доступны. Например, можно заранее сохранить свои яйцеклетки в банке половых клеток (они там будут находиться в «замороженном» состоянии), а потом воспользоваться услугой суррогатного материнства.
Можно ли защититься от папилломавирусной инфекции?
Рекомендации по профилактике ВПЧ-инфекции опираются на два главных фактора. Во-первых, главная опасность вирусов папилломы человека в том, что некоторые из них вызывают онкологические заболевания. Во-вторых, эти вирусы распространяются главным образом через половые контакты. Эксперты Всемирной организации здравоохранения предлагают три уровня профилактики в разных возрастных группах (табл. 3).
| Первичная профилактика — для девочек 9–14 лет (для профилактики заражения ВПЧ) | Вакцинация против ВПЧ |
| Первичная профилактика — для всех мальчиков и девочек (для профилактики заражения ВПЧ) |
|
| Вторичная профилактика для женщин 25 лет и старше (для своевременной диагностики предраковых изменений и рака) |
|
| Третичная профилактика — для всех женщин по показаниям (для повышения выживаемости при онкологических заболеваниях) | Своевременная диагностика уже возникшего рака с помощью скрининга и немедленное начало лечения. |
Эксперты из Американского общества рака рекомендуют такую схему скрининга:
- Регулярные скрининговые исследования проходить всем женщинам по достижении возраста 25 лет.
- Женщинам в возрасте 25–65 лет сдавать анализы на ВПЧ один раз в пять лет. Можно раз в пять лет выполнять тесты, которые сочетают определение ВПЧ с мазком Папаниколау, или раз в три года — только мазок Папаниколау.
- В 65 лет скрининг можно прекратить, но только если до этого женщина регулярно сдавала анализы, и у нее в течение последних лет не были обнаружены ВПЧ, атипичные клетки в мазках, и если в течение 25 лет у нее в шейке матки не было предраковых изменений.
- Если у женщины удалили матку (но не из-за рака или тяжелых предраковых изменений), то ей можно прекратить скрининг. Если у женщины было удалено тело матки, но осталась шейка, то скрининг нужно продолжить.
- Даже если женщина проходила вакцинацию против ВПЧ, ей нужно придерживаться всех вышеперечисленных рекомендаций [37].
Что касается мер профилактики заражения ВПЧ-инфекцией, то не все они одинаково эффективны. Например, презервативы обеспечивают некоторую защиту, но не на 100%. Наиболее надежная мера — вакцинация, но ее наиболее эффективно проводить до того, как произошло заражение, то есть до начала половой жизни. При этом в случае, если прививка не сделана, ее рекомендуют делать и взрослым — как мужчинам, так и женщинам до 45 лет.
История создания «вакцины против рака»
Вакцины против ВПЧ были созданы благодаря разработкам двух профессоров из Квинслендского университета в Австралии: Яна Фрейзера и Цзянь Чжоу (рис. 11). Эти ученые еще в 1990-е годы начали работу по созданию вирусоподобных частиц, которые напоминали бы по своим антигенным свойствам ВПЧ и могли быть использованы для иммунизации. В 1991 году Фрейзер и Чжоу представили свои результаты научному сообществу. Затем последовали еще семь лет разработок и тестов, и вскоре были завершены испытания новой вакцины на людях. Было доказано, что она эффективно защищает против четырех типов ВПЧ: 6, 11, 16 и 18. Наконец, крупные клинические испытания показали, что прививка обеспечивает практически 100% защиту от ВПЧ 16 и 18 типов — основных виновников развития рака шейки матки. По итогам этих исследований новая вакцина в 2006 году была одобрена к применению американским Управлением по санитарному надзору за качеством продуктов и медикаментов (FDA), а также в Австралии. В 2007 году она была зарегистрирована уже в 80 странах мира. Препарат получил название «Гардасил». Изначально он предназначался для профилактики рака шейки матки у женщин. В 2009 году его одобрили для профилактики остроконечных кондилом, в 2010 году — для профилактики предраковых изменений ануса, вызванных ВПЧ, у представителей обоих полов [39], [40]. «Гардасил» зарегистрирован и в России. Показания к применению включают профилактику предраковых генитальных поражений и поражений анального канала, аденокарциномы шейки матки in situ, внутриэпителиальной неоплазии вульвы и влагалища (ВПЧ типов 6, 11, 16 и 18), рака шейки матки, вульвы, влагалища и анального канала (ВПЧ типов 16 и 18), а также аногенитальных кондилом (ВПЧ типов 6 и 11).

Рисунок 11. Цзянь Чжоу и Ян Фрейзер, создатели первой вакцины против вирусов папилломы человека
В 2007 году в Австралии была зарегистрирована вторая вакцина против ВПЧ — «Церварикс». В 2009 году ее одобрило и FDA, но в Америке она не получила большой популярности, потому что, в отличие от «Гардасила», защищала только от двух типов ВПЧ — 16 и 18 [39], [40].
Самой современной вакциной является «Гардасил 9», зарегистрированная в США в 2014 году. Она защищает от всех типов ВПЧ, против которых работает «классический» «Гардасил», и еще от пяти: 31, 33, 45, 52 и 58 [39], [40]. За счет такого большого охвата прививка «Гардасилом 9» способна предотвращать около 90% всех случаев рака шейки матки и появления аногенитальных кондилом, до 80% дисплазии шейки матки высокого риска и до 95% рака вульвы, влагалища и анального канала, вызванных заражением ВПЧ [40].
Интересно, что благодаря одному замечательному свойству иммунной системы прививки могут защищать не только от вирусов, против которых направлены. Речь идет о перекрестном иммунитете. Когда иммунная система «знакомится» с одним вирусом, она может распознавать и другие, родственные. Это происходит и в случае с вакцинами против ВПЧ.
Вакцины против ВПЧ сегодня
В современном мире доступны три вакцины против ВПЧ (их основные характеристики представлены в таблице 4). Все они созданы одним и тем же способом. В качестве антигена (агента, вызывающего иммунную реакцию) в них применяют искусственно синтезированные белки, подобные вирусным поверхностным белкам L1. Их получают с помощью методов генной инженерии в клетках бактерий, дрожжей, насекомых. Вместе L1-белки соединяются в структуру, напоминающую оболочку вируса : получаются своего рода «вирусы-зомби». Они выглядят для иммунной системы как вирусы, заставляют ее реагировать, но в них нет ДНК, и они не способны заражать клетки (рис. 12) [41].
О том, как происходит самосборка вирусных частиц, и для чего ее можно использовать, мы рассказывали в статье «Вирусы-платформы: яд во благо» [42].
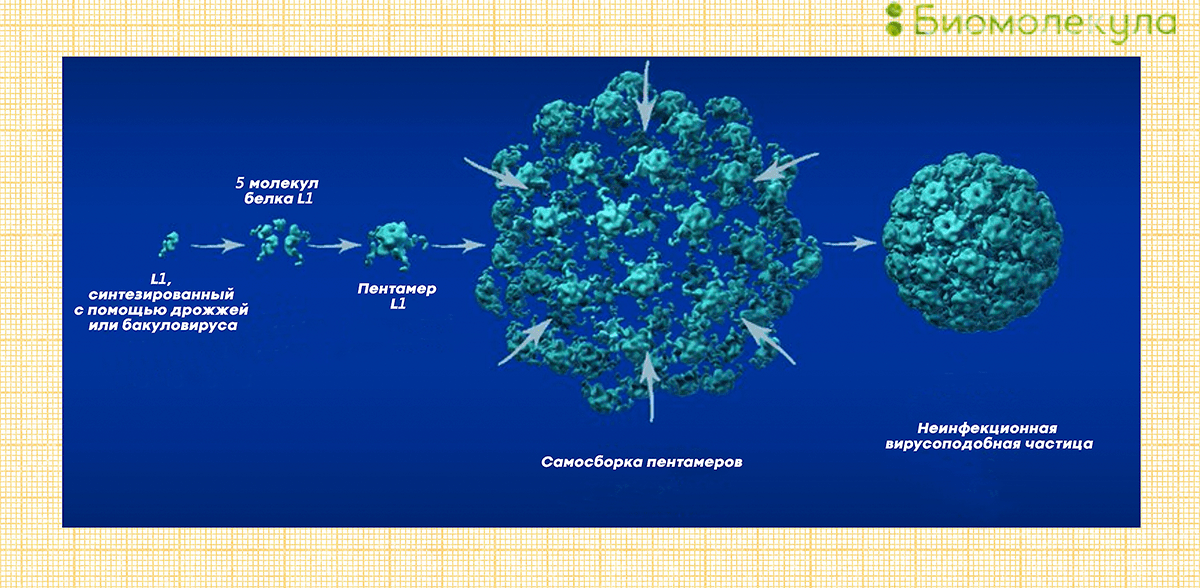
Рисунок 12. Строение вирусоподобных частиц в вакцине «Гардасил». Вирусные белки L1, синтезированные с помощью дрожжей или бакуловируса, образуют пентамеры и собираются в сферическую оболочку. Но эта оболочка пустая — в ней нет ДНК, — а значит, она не может вызвать инфекцию. Зато в ответ на нее развивается иммунная реакция.
презентация Маргарет Стэнли HPV vaccines: where to next?
| «Гардасил» («Силгард») | «Церварикс» | «Гардасил-9» | |
|---|---|---|---|
| Тип вакцины | Рекомбинантная, вирусоподобные частицы из L1-белка | ||
| Производитель | Merck | GlaxoSmithKline | Merck |
| Типы ВПЧ, против которых защищает | Четырехвалентная (против четырех типов ВПЧ): 6, 11, 16, 18 | Двухвалентная (против двух типов ВПЧ): 16 и 18 | Девятивалентная (против девяти типов ВПЧ): 6, 11, 16, 18, 31, 33, 45, 52, 58 |
| Заболевания, от которых защищает |
|
|
|
| Против каких ВПЧ создает перекрестный иммунитет | 31, 33, 52, 58 | 31, 33 | нет необходимости, так как изначально защищает против всех основных типов ВПЧ, связанных с онкологическими заболеваниями |
В России сертифицированы только две вакцины: «Гардасил 9» в РФ пока получить нельзя [41]. Сейчас в нашей стране ведется разработка собственных препаратов. В 2020 году стало известно, что российская биофармацевтическая компания «НАНОЛЕК» и научно-производственная компания «КОМБИОТЕХ» стали партнерами и собираются производить отечественную вакцину против 6, 11, 16 и 18 типов ВПЧ [44]. В 2021 году пресс-служба российской фармацевтической компании «Р-Фарм» сообщила о подписании договора с китайской биотехнологической компанией Beijing Health Guard по разработке и коммерциализации вакцины против девяти типов ВПЧ. В рамках соглашения планируется провести III фазу клинических испытаний [45]. В марте 2022 года «НАНОЛЕК» уже объявил, что первая партия вакцины выйдет в 2024 году.
Кого и как нужно вакцинировать?
Обновленная стратегия ВОЗ по борьбе с РШМ подразумевает включение иммунизации против ВПЧ в профилактике рака шейки матки и других онкологических заболеваний. Они рекомендовали всем странам включить иммунизацию против вирусов папилломы в национальные календари профилактических прививок всех стран, причем в случае нехватки ресурсов в первую очередь вакцинировать женщин, которые не могут регулярно проходить скрининг. Рекомендации ВОЗ включают три уровня профилактики.
Первичная профилактика в первую очередь направлена на иммунизацию девочек 9–14 лет. Также желательно санитарное и сексуальное просвещение, пропаганда безопасного секса среди подростков, раздача презервативов и мужское обрезание.
Вторичная профилактика заключается в проведении скринингов для женщин старше 35 лет и своевременное лечение предрака.
Наконец, в рамках третичной профилактики должно быть обеспечено лечение инвазивного рака у пациентов в любом возрасте.
- Прививать в первую очередь нужно всех девочек в возрасте 9–14 лет до начала половой жизни.
- Стандартная схема предусматривает введение двух доз вакцины с интервалом в 6 месяцев.
- Максимальная продолжительность интервала между двумя дозами вакцины не установлена, но не стоит превышать 12–15 месяцев.
- Если интервал между двумя дозами был меньше 5 месяцев, то нужно ввести третью дозу, причем не менее чем через шесть месяцев после первой.
- Людей старше 15 лет и с ослабленным иммунитетом (в том числе с ВИЧ — вне зависимости от того, получает ли пациент лечение) нужно вакцинировать тремя дозами: вторая — спустя 1–2 месяца после первой, третья — через шесть месяцев после первой.
- Вакцинацию мальчиков проводить рекомендуется, но не в приоритетном порядке, так как в первую очередь нужно защитить девочек от риска рака шейки матки — это особенно актуально для стран, в которых не хватает вакцин [43].
К 2030 году ВОЗ надеется прийти к показателям «90–70–90»:
- 90% девочек полностью иммунизированы к 15 годам;
- 70% женщин проходят скрининг в 35 лет и повторно – в 45;
- 90% женщин с диагностированным заболеванием шейки матки получают соответствующее лечение.
Похожие рекомендации представлены на сайте американских Центров по контролю и профилактике заболеваний (CDC), но там отдельно упоминаются взрослые люди:
- вакцинацию против ВПЧ рекомендуется проводить в плановом порядке детям в 11 и 12 лет (можно начинать с 9 лет);
- люди моложе 26 лет также могут пройти вакцинацию, если не делали этого в детстве — двумя или тремя дозами, в зависимости от возраста;
- непривитым людям старше 26 лет, желающим вакцинироваться, нужно проконсультироваться с врачом: в этой возрастной группе иммунизация не приносит большой пользы, потому что многие уже заражены — но для тех, кто не заражен, это эффективная мера профилактики. Для людей старше 45 лет вакцины против ВПЧ не лицензированы;
- вторую дозу нужно ввести через 6–12 месяцев после первой;
- если промежуток между первой и второй дозами составил меньше 5 месяцев, то нужно ввести третью дозу;
- три дозы вакцины нужно вводить людям 15–26 лет, а также лицам с ослабленным иммунитетом [46].
В настоящее время 126 стран внедрили вакцинацию против ВПЧ в национальные программы иммунизации, при этом в 39 странах в программы включена иммунизация как девочек, так и мальчиков (рис. 13). В России этой прививки пока нет в Национальном календаре профилактических прививок, но она включена в «Идеальный прививочный календарь» Союза педиатров России, о котором мы рассказывали в статье «Вакцинация перед школой: гайд для родителей» [47]. Специалисты предлагают двухдозовую схему вакцинации для детей 9–13 лет и трехдозовую для тех, кто старше. Возможна ускоренная трехдозовая схема, когда вторую дозу вводят через один месяц после первой, а третью — через три месяца [48].
Ожидается, что вакцинация против ВПЧ войдет в российский Национальный календарь прививок в 2026 году, но в некоторых регионах ее уже сейчас можно пройти бесплатно по ОМС.
- в Москве и Московской области — для девочек 12–13 лет;
- в Тульской области — для девочек 12 лет;
- в Калужской области — для девочек 12–13;
- в Санкт-Петербурге — для всех с 9 до 26 лет;
- в Республике Карелия — для девочек 12 лет из учреждений для детей-сирот;
- в Оренбургской области — для девочек 12 лет, живущих в детских домах;
- в Республике Башкортостан — для девочек 9–13 лет;
- в Свердловской области — для детей 13 обоего пола;
- в Челябинской области — для мальчиков и девочек 12 лет;
- в Новосибирской области;
- в Республике Бурятия — для девочек 10–12 лет, находящихся в трудной жизненной ситуации, и для некоторых других категорий;
- в Сахалинской области — для девочек старше 9 лет;
- в Республике Алтай — для девочек 10–14 лет;
- в Республике Удмуртия — для девочек 9–13 лет;
- в Республике Татарстан — для девочек 9–12 лет, имеющих отягощенный онкологический анамнез;
- в Ярославской области — для девочек 11 лет из детских домов;
- в Ростовской области — для девочек 12 лет с отягощенным анамнезом по РМШ или тех, кто живет в закрытых коллективах.
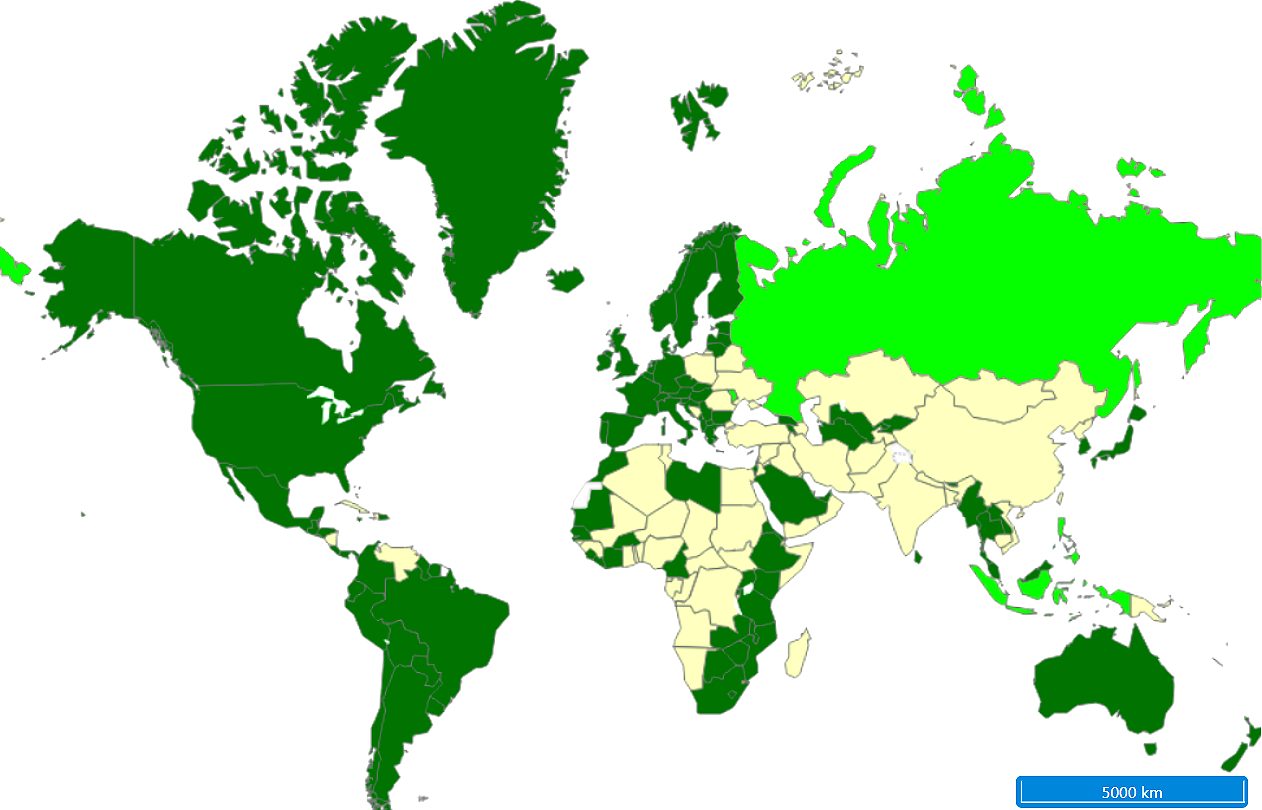
Рисунок 13. Состояние программ плановой вакцинации против ВПЧ в мире. Темным цветом отмечены страны, в которых введена плановая вакцинация. Ярко-зеленые страны — те, в которых плановая вакцинация введена частично, в отдельных регионах. Светло-салатовые страны пока не ввели иммунизацию. В некоторых странах в рамках национальных календарей прививают только девочек, так как именно для них в первую очередь опасны ВПЧ высокого онкогенного риска. Но есть и такие, где в программу включены мальчики.
Насколько эффективна вакцинация?
Тот факт, что все три вакцины против ВПЧ были зарегистрированы относительно недавно, вовсе не означает, что они пока еще плохо изучены. Как и любое новое лекарство, они прошли все необходимые клинические испытания, и ученые тщательно оценили их эффективность и безопасность (рис. 14). Опыт использования также говорит сам за себя. Только вдумайтесь в эту цифру — с момента регистрации первой вакцины против ВПЧ в 2006 году уже ввели порядка 500 млн доз этих препаратов.

Рисунок 14. Все три зарегистрированные ВПЧ-вакцины прошли клинические испытания, в которые были включены десятки тысяч участников. FDA и FIGO (Международная федерация акушеров-гинекологов) заключили, что препараты обладают превосходным профилем эффективности и безопасности.
HPV Vaccination is Safe and Effective, рисунок адаптирован
Вакцины против ВПЧ показали высокую эффективность как в отношении защиты от самих вирусов, так и от связанных с ними онкологических заболеваний. После того, как в США началась вакцинация в 2006 году, в течение следующего десятилетия девочки-подростки стали заражаться ВПЧ на 86% реже, а женщины старше 20 лет — на 71% реже. Врачи-гинекологи стали выявлять меньше остроконечных кондилом и предраковых изменений в шейке матки. Когда вакцины стали широко применять в других странах, то там увидели похожие результаты [50].
Рак шейки матки развивается спустя многие годы после заражения ВПЧ, поэтому сложно изучать, насколько хорошо от него защищают вакцины (рис. 15). Но в течение пяти лет инфекция может вызвать предраковые изменения, «рак на месте», и эти состояния можно использовать как индикаторы. Именно их отслеживали во время клинических исследований, и результаты показали, что вакцины действительно очень сильно снижают риск их развития. Например, обзор от 2006 года шести исследований, в которых участвовали 47 236 женщин, показал, что после вакцинации против ВПЧ на 93% снижается риск поражений шейки матки, влагалища, вульвы и области ануса [51], [52].
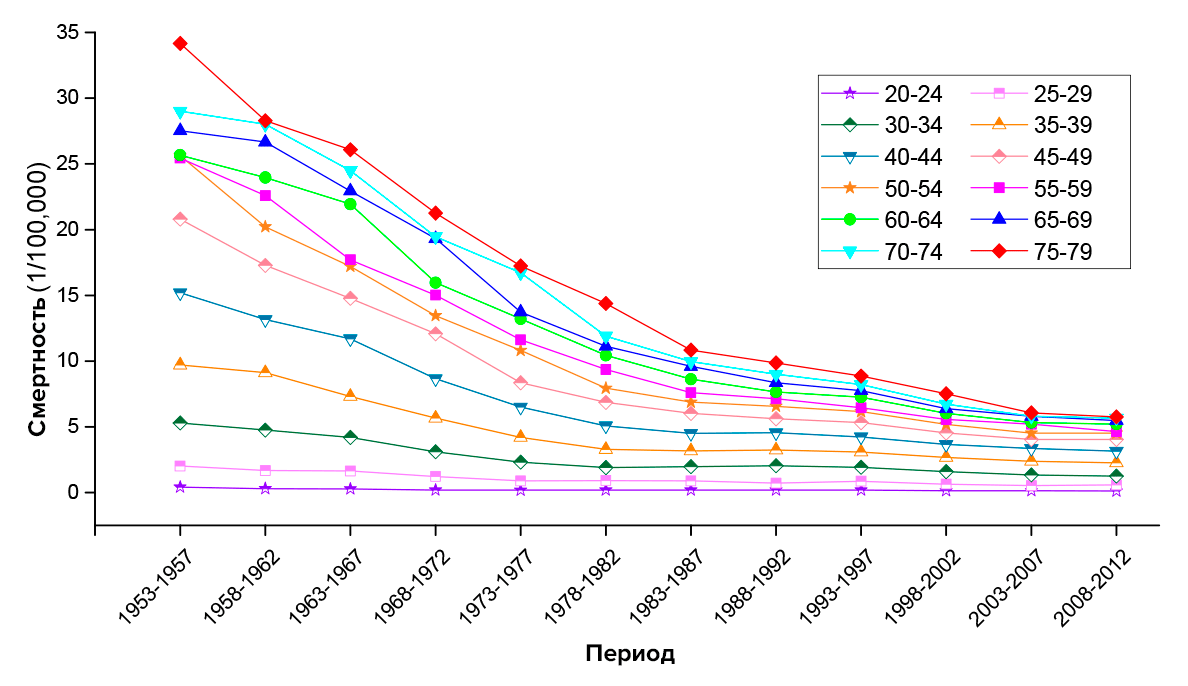
Рисунок 15. Динамика смертности от рака шейки матки на 100 000 населения в США в разных возрастных группах. Видно, как совершенствование методов лечения, скрининги и вакцинация помогли спасти много жизней.
Лабораторные исследования показывают, что практически у всех привитых, которые до этого не были заражены ВПЧ, вырабатывается много антител против возбудителя. Контрольные проверки спустя 10 лет и больше показывают, что защита сохраняется [50], [51].
Надо ли бояться побочных эффектов от вакцины?
Как и любые лекарственные препараты, вакцины против ВПЧ могут вызывать некоторые побочные эффекты. Но, как и у всех вакцин, они обычно легкие и быстро проходят — бояться не стоит. Возможные нежелательные реакции от прививки и рядом не стояли с той опасностью, которую создают вирусы папилломы высокого онкогенного риска — иначе новые вакцины не были бы зарегистрированы.
Например, с 2006 по 2014 год в США было введено 67 миллионов доз вакцины. После этого сообщалось о 25 176 случаев побочных эффектов, 92,4% из которых были легкими — они не представляли опасности для жизни, не вызывали долгосрочных проблем со здоровьем и не требовали госпитализации. Число смертельных случаев измерялось несколькими десятками, но, когда ученые проанализировали эти данные, то не нашли связи с прививкой. Чаще всего причиной становился сахарный диабет, другие инфекции, сердечная недостаточность, употребление наркотиков [55].
Во время клинических испытаний ученые чаще всего обнаруживали у участников лишь такие нежелательные реакции:
- Обмороки — весьма распространенное явление. Но связаны они не с вакциной, а с тем, что многие люди боятся уколов. Самая большая опасность в том, что во время падения можно получить серьезную травму. Поэтому после прививки человека просят 15 минут полежать или посидеть.
- У 20–90% испытуемых в месте укола возникает боль, покраснение, отек. Такая реакция характерна для многих вакцин, и она довольно быстро проходит.
- У 10–13% людей в течение 15 дней температура тела повышалась до 37,7 °С и более.
- Серьезных побочных эффектов не было обнаружено [46].
Одно из самых страшных осложнений после введения любых вакцин — анафилактический шок: тяжелая аллергическая реакция, которая может привести к смерти. Она возникает сразу после прививки, и на этот случай в любом прививочном кабинете есть противошоковый набор, чтобы сразу оказать помощь. Поэтому после прививки нужно полчаса посидеть возле прививочного кабинета.
В 2020 году австралийские ученые провели большой анализ — они проверили, как часто возникали побочные эффекты после введения 9 миллионов доз четырехвалентной вакцины «Гардасил» в течение 11 лет. Оказалось, что анафилактический шок развивается лишь у трех пациентов из миллиона [56].
Хотя вакцинация против ВПЧ безопасна, она всё же имеет некоторые противопоказания:
- Если у человека есть тяжелая аллергия на латекс, то его не стоит прививать двухвалентной вакциной «Церварикс». Она выпускается в предварительно заполненных шприцах, в наконечниках которых может содержаться латекс.
- Если человек страдает тяжелыми хроническими заболеваниями, то вакцинацию нужно проводить с осторожностью, предварительно проконсультировавшись с лечащим врачом.
- При тяжелых острых заболеваниях вакцинацию нужно отложить до выздоровления.
- При легких острых заболеваниях, например, простуде, вакцинация обычно не противопоказана [46].
Следующий шаг: терапевтические вакцины
Существующие вакцины против ВПЧ защищают от опасных вирусов, только если привиться до заражения. Но многие женщины уже инфицированы, и эту проблему тоже нужно решать. Пока врачи могут предложить только регулярно проходить скрининги и надеяться, что вирусы папилломы не приведут к раку, или онкологическое заболевание будет обнаружено на ранней стадии, когда возможно эффективное лечение. Но в будущем ситуация может измениться.
Ученые уже не первый год занимаются разработкой терапевтических вакцин. Эти препараты направлены против двух онкогенов ВПЧ — E6 и E7. Именно они помогают клеткам становиться «бессмертными» и способствуют злокачественному перерождению. На данный момент созданы разные типы таких вакцин [57]:
- векторные — когда антигены возбудителя «загружают» в безвредные бактерии или вирусы и вводят их в организм;
- пептидные — состоят из белков вируса, против которых нужно сформировать иммунитет;
- ДНК- и РНК-вакцины — содержат генетический материал, который, попадая в организм, заставляет его синтезировать вирусные белки;
- вакцины на основе дендритных (антигенпрезентирующих — они «знакомят» T-лимфоциты с новыми антигенами) клеток — направлены не против самих ВПЧ, а против клеток, претерпевших злокачественную трансформацию [58];
- вакцины на основе раковых клеток — помогают сформировать иммунитет против опухолевых антигенов — аномальных белков, которые синтезируют эти клетки.
Многие из этих препаратов уже прошли доклинические, а некоторые даже клинические исследования. Но ни один пока не зарегистрирован и не применяется в клинической практике.
Заключение
Опыт применения вакцин против ВПЧ показал, что они безопасны, и при этом надежно защищают от вирусов, которые вызывают онкологические заболевания, и которыми очень легко заразиться.
Эксперты из Всемирной организации здравоохранения разработали глобальную стратегию по ликвидации рака шейки матки как проблемы общественного здравоохранения. Ожидается, что в течение ближайшего столетия это поможет сохранить более 62 миллионов женских жизней. Важной частью этой программы станет вакцинация против ВПЧ: до 2030 года профилактическими прививками должно быть охвачено не менее 90% девочек-подростков. Параллельно необходимо, чтобы 70% женщин прошли скрининг на рак шейки матки хотя бы дважды в жизни, и чтобы врачи своевременно выявляли и лечили 90% предраковых поражений.
Для врачей и ученых уже не стоит вопрос о том, нужно ли включать прививки от папилломавирусов в национальные прививочные календари. Несомненно, в ближайшее время это произойдет и в России. А для жителей нашей страны, которые хотят защитить свое здоровье и здоровье своих детей, не дожидаясь официальных предписаний, такая возможность есть уже сейчас.
Литература
- Хроника распространения SARS-CoV-2;
- Как вылечить COVID-19? (Спойлер: пока точно не знаем, но догадываемся);
- COVID-19: отвечаем на вопросы;
- Животные как объект для проведения испытаний вакцин против COVID-19: необходимость или излишество;
- Иллюзия уверенности;
- Пилюля от гриппа: современные противовирусные средства;
- Гепатит C: решенная проблема?;
- «Спутник V», «ЭпиВакКорону», «Модерну» делать будем? Ликбез по вакцинам против коронавируса;
- Гонки вакцин 2020;
- Неуловимый грипп;
- Объяснена различная вирулентность вирусов гриппа — возбудителей «испанки»;
- Syrjänen S. and Syrjänen K. (2008). The history of papillomavirus research. Cent. Eur. J. Public Health, Supplement. 16, S7–S41;
- Bakalar N. (2011). Human papillomavirus, 1985. The New York Times;
- Marianna Karamanou, Emmanovil Agapitos, Antonis Kousoulis, George Androutsos. (2010). From the humble wart to HPV: a fascinating story throughout centuries. Oncol Rev. 4, 133-135;
- M. J. Strauss, E. W. Shaw, H. Bunting, J. L. Melnick. (1949). "Crystalline" Virus-Like Particles from Skin Papillomas Characterized by Intranuclear Inclusion Bodies.. Experimental Biology and Medicine. 72, 46-50;
- Zhi-Ming Zheng. (2006). Papillomavirus genome structure, expression, and post-transcriptional regulation. Front Biosci. 11, 2286;
- Ellson Y. Chen, Peter M. Howley, Arthur D. Levinson, Peter H. Seeburg. (1982). The primary structure and genetic organization of the bovine papillomavirus type 1 genome. Nature. 299, 529-534;
- O. Danos, M. Katinka, M. Yaniv. (1982). Human papillomavirus 1a complete DNA sequence: a novel type of genome organization among papovaviridae.. The EMBO Journal. 1, 231-236;
- Киселев Л.Л., Абелев Г.И., Киселев Ф.Л. (2003). Лев Зильбер — создатель отечественной школы медицинских вирусологов. «Вестник Российской академии наук». 73(7), 647–659;
- Клещевой энцефалит: крошечный укус — серьезные последствия;
- SY Tan, Y Tatsumura. (2015). George Papanicolaou (1883–1962): Discoverer of the Pap smear. smedj. 56, 586-587;
- Увидевший вирусы в раке. Харальд цур Хаузен;
- Нобелевскую премию 2008 года по физиологии и медицине вручили за вирусологические исследования;
- John Doorbar, Nagayasu Egawa, Heather Griffin, Christian Kranjec, Isao Murakami. (2015). Human papillomavirus molecular biology and disease association. Rev. Med. Virol.. 25, 2-23;
- Kevin A. Ault. (2006). Epidemiology and Natural History of Human Papillomavirus Infections in the Female Genital Tract. Infectious Diseases in Obstetrics and Gynecology. 2006, 1-5;
- Juckett G. and Hartman-Adams H. (2010). Human papillomavirus: clinical manifestations and prevention. Am. Fam. Physician. 10, 1209–1214;
- Mark Schiffman, Philip E Castle, Jose Jeronimo, Ana C Rodriguez, Sholom Wacholder. (2007). Human papillomavirus and cervical cancer. The Lancet. 370, 890-907;
- Nicole Reddout, Todd Christensen, Anthony Bunnell, Dayne Jensen, Devin Johnson, et. al.. (2007). High risk HPV types 18 and 16 are potent modulators of oral squamous cell carcinoma phenotypes in vitro. Infect Agents Cancer. 2;
- Ching-Yi Cho, Yu-Cheng Lo, Miao-Chiu Hung, Chou-Cheng Lai, Chun-Jen Chen, Keh-Gong Wu. (2017). Risk of cancer in patients with genital warts: A nationwide, population-based cohort study in Taiwan. PLoS ONE. 12, e0183183;
- Maria Blomberg, Soren Friis, Christian Munk, Andrea Bautz, Susanne K. Kjaer. (2012). Genital Warts and Risk of Cancer: A Danish Study of Nearly 50 000 Patients With Genital Warts. The Journal of Infectious Diseases. 205, 1544-1553;
- Рак шейки матки. (2022). ВОЗ;
- Risk factors for oral cavity and oropharyngeal cancers. (2021). American Cancer Society;
- Braaten K.P. and Laufer M.R. (2008). Human papillomavirus (HPV), HPV-related disease, and the HPV vaccine. Reviews in obstetrics & gynecology. 1, 2–10;
- От поцелуя до лимфомы один вирус;
- Human papillomavirus (HPV) infection. (2021). CDC;
- Anogenital warts. (2021). CDC;
- The American Cancer Society guidelines for the prevention and early detection of cervical cancer. (2021). American Cancer Society;
- 12 методов в картинках: полимеразная цепная реакция;
- The history of the HPV vaccine. (2020). Noman;
- Benjamin J. Lieblong, Brooke E. E. Montgomery, L. Joseph Su, Mayumi Nakagawa. (2019). Natural history of human papillomavirus and vaccinations in men: A literature review. Health Sci Rep. 2, e118;
- Вакцинопрофилактика заболеваний, вызванных вирусом папилломы человека: федер. клинич. рекомендации. М.: «ПедиатрЪ», 2016. — 40 с.;
- Вирусы-платформы: яд во благо;
- Guide to introducing HPV vaccine into national immunization programmes. (2016). WHO;
- Рак можно предотвратить: НАНОЛЕК и НПК «Комбиотех» объявляют о начале совместного проекта по разработке и выводу на рынок первой полностью отечественной вакцины против вируса папилломы человека. (2020). «НАНОЛЕК»;
- «Р-Фарм» и Beijing Health Guard подписали соглашения по разработке и коммерциализации в России девятивалентной вакцины для профилактики ВПЧ. (2021). «Р-Фарм»;
- HPV vaccine recommendations. (2021). CDC;
- Вакцинация перед школой: гайд для родителей;
- Вакцинопрофилактика заболеваний, вызванных вирусом папилломы человека (руководства по профилактике заболевания/синдромов). Министерство здравоохранения РФ, 2017. — 25 с.;
- Винокурова С.В. (2022). Вирусы папилломы человека 6 и 11 типов: распространенность, патогенность и онкогенность. «Вопросы практической кольпоскопии. Генитальные инфекции». 4, 6–16;
- HPV vaccine safety and effectiveness. (2021). CDC;
- Вакцины против вируса папилломы человека (документ по позиции ВОЗ). (2009). ВОЗ;
- Lidia Rosi Medeiros, Daniela Dornelles Rosa, Maria Inês da Rosa, Mary Clarisse Bozzetti, Roselaine Ruviaro Zanini. (2009). Efficacy of Human Papillomavirus Vaccines. International Journal of Gynecological Cancer. 19, 1166-1176;
- Гардасил (Gardasil). Vidal;
- Nicholas B. Schmuhl, Katherine E. Mooney, Xiao Zhang, Laura G. Cooney, James H. Conway, Noelle K. LoConte. (2020). No association between HPV vaccination and infertility in U.S. females 18–33 years old. Vaccine. 38, 4038-4043;
- White M.D. (2014). Pros, cons, and ethics of HPV vaccine in teens-Why such controversy? Translational andrology and urology. 3(4), 429–434;
- Anastasia Phillips, Megan Hickie, James Totterdell, Julia Brotherton, Aditi Dey, et. al.. (2020). Adverse events following HPV vaccination: 11 years of surveillance in Australia. Vaccine. 38, 6038-6046;
- Andrew Yang, Emily Farmer, T. C. Wu, Chien-Fu Hung. (2016). Perspectives for therapeutic HPV vaccine development. J Biomed Sci. 23;
- Yin W., Duluc D., Joo H., Oh S. (2016). Dendritic cell targeting vaccine for HPV-associated cancer. Cancer cell & microenvironment. 4, e1482;
- Jos Verssimo, Thales Allyrio Arajo de Medeiros Fernandes. (2012). Human Papillomavirus: Biology and Pathogenesis. Human Papillomavirus and Related Diseases - From Bench to Bedside - A Clinical Perspective;
- James Mitchell Crow. (2012). HPV: The global burden. Nature. 488, S2-S3;
- Beatriz Serrano, María Brotons, Francesc Xavier Bosch, Laia Bruni. (2018). Epidemiology and burden of HPV-related disease. Best Practice & Research Clinical Obstetrics & Gynaecology. 47, 14-26;
- Laia Bruni, Mireia Diaz, Leslie Barrionuevo-Rosas, Rolando Herrero, Freddie Bray, et. al.. (2016). Global estimates of human papillomavirus vaccination coverage by region and income level: a pooled analysis. The Lancet Global Health. 4, e453-e463;
- Jinyao Wang, Zhiqiang Bai, Zhenkun Wang, Chuanhua Yu. (2016). Comparison of Secular Trends in Cervical Cancer Mortality in China and the United States: An Age-Period-Cohort Analysis. IJERPH. 13, 1148.