Заклятые друзья и закадычные враги: как бактериофаги и бактерии сосуществуют миллионы лет
17 мая 2024
Заклятые друзья и закадычные враги: как бактериофаги и бактерии сосуществуют миллионы лет
- 1646
- 0
- 9
После чтения большинства материалов о бактериофагах в интернете создается впечатление, что единственная цель этих вирусов — уничтожать бактерии. На самом деле отношения в микромире намного сложнее. Фаги могут выступать по отношению к бактериям и как враги, и как союзники. Они успешно сосуществуют многие миллионы лет и вместе сильно влияют не только друг на друга, но и на всю биосферу. Рисунок в полном размере.
иллюстрация Анастасии Самоукиной
-
Автор
-
Редактор
-
Иллюстратор
В этой статье спецпроекта, посвященного бактериофагам, мы посмотрим на вирусы бактерий под несколько иным углом, чем это принято делать. Мы уже рассказывали, как бактериофаги атакуют и уничтожают микроорганизмы, как это свойство можно использовать в ветеринарии, сельском хозяйстве и медицине. Теперь же попытаемся отойти от образа безжалостных хищников и рассмотрим взаимоотношения между фаговыми и бактериальными сообществами во всей их сложности и многогранности. Спойлер: эти отношения далеко не всегда враждебные.
Бактериофаги

Партнер спецпроекта — НПЦ «Микромир» — производитель препаратов с бактериофагами для применения в медицине и ветеринарии.
Бактериофаги — это вирусы, заражающие бактериальные клетки. Они составляют наиболее многочисленную и эволюционно древнюю группу вирусов в биосфере Земли. Бактериофаги играют важную роль в контроле численности микробных популяций и в горизонтальном переносе бактериальных генов, выступая в качестве векторных систем.
В спецпроекте мы дадим общую информацию о бактериофагах, истории их изучения, использовании в лаборатории, попытках применения в медицине и ветеринарии и возможных будущих применениях.
Третий путь в изучении фагов
Традиционно изучение вирусов бактерий шло по двум направлениям. Исследователи постсоветского пространства продолжили основную линию, заложенную одним из первооткрывателей бактериофагов Феликсом д’Эреллем. Они активно занимались разработкой фагопрепаратов [78] и их внедрением в клиническую практику [1].
В странах Запада интерес к терапевтическому применению фагов практически сошел на нет, когда появились первые антибиотики. Здесь вирусы бактерий стали инструментом изучения фундаментальных основ жизни. Например, бактериофаги помогли установить, что молекула ДНК отвечает за наследственность. Изучать генетику и молекулярную биологию на вирусах — этих простейших существах, состоящих лишь из короткой ДНК и белков, — оказалось легче, чем на любых других организмах. Поэтому, в частности, фаг лямбда надолго стал «рабочей лошадкой» молекулярных биологов. Мы рассказывали об этом подробно в материале «Модельные организмы: фаг лямбда» [2].
Во времена холодной войны эти два пути сильно разошлись. В Советском Союзе до 1964 года не лучшим образом относились к генетике, а западные врачи с опаской посматривали на фаготерапию как на часть «советской медицины».
К 1980–1990-м годам уже и генетика была давно реабилитирована в СССР, и на Западе фагопрепаратами снова начали интересоваться на фоне нарастающей проблемы антибиотикорезистентности (о ней мы рассказывали в материале «Антибиотики и антибиотикорезистентность: от древности до наших дней» [3]). Два пути стали воссоединяться, но тут обнаружилось, что есть и третий путь в изучении вирусов бактерий: широкий, неизведанный и таящий немало сокровищ для пытливых умов. Многие ученые стали интересоваться экологией бактериофагов и вопросами их успешного сосуществования с бактериями. Открытия, сделанные впоследствии на этом пути, оказались полезны и для молекулярной биологии, и для фаготерапии, и для других сфер.
Как они сосуществуют?
В статье «Огромный и загадочный мир бактериофагов» [4] мы довольно подробно рассказывали о том, как бактерии пытаются защищаться от заражения фагами, а вирусы обзаводятся механизмами обхода этой защиты.
Бактериофаги не всегда могут добраться до своих жертв из-за того, что те спасаются в разных «укрытиях». А если встреча всё же происходит, то бактерия может предотвратить адсорбцию фага, проникновение его ДНК внутрь клетки, разрушить его генетический материал или принести себя в жертву, чтобы не стать фабрикой по производству новых фаговых частиц.
И даже при успешной инфекции вирус не всегда сразу уничтожает жертву. Он может выбрать лизогенный жизненный цикл, встроиться в бактериальную хромосому в виде профага и существовать так очень долго, передаваясь следующим поколениям микроорганизмов. Многие такие фаги дарят бактериям новые полезные гены, благодаря трансдукции и лизогенной конверсии (см. статью «Фаги-оруженосцы на службе у бактерий» [5]).
Все эти явления весьма интересны, но ими экология бактериофагов далеко не ограничивается. Эти вирусы сосуществуют с бактериями многие миллионы лет, и у них было время, чтобы сделать отношения сложными и многогранными.
«Мы одна стая»: фаговый quorum sensing
Несмотря на примитивное строение, бактерии умеют общаться между собой и действовать как одна стая. Происходит это благодаря чувству кворума (quorum sensing). Этот термин вошел в лексикон микробиологов в 1994 году; придумал его американский профессор Стивен Винанс. Но само явление открыли и начали изучать намного раньше — в начале 1970-х годов [6].
Микроорганизмы общаются между собой с помощью сигнальных молекул, которые называются аутоиндукторами. Удивительно, но «языки» разных видов бактерий различаются так же, как у людей. У некоторых микроорганизмов довольно большой словарный запас, и они используют множество разных сигналов, а другие способны реагировать только на несколько видов.
Чувство кворума координирует поведение бактериальных клеток. Оно играет важную роль в таких процессах, как биолюминесценция, образование спор, конъюгация, формирование биопленок. О том, что такое quorum sensing и как на него можно влиять, мы рассказывали в материале «Бактерии, молчать! Как и зачем вносить помехи в межклеточное общение» [7]. В общих чертах работа этого механизма показана на рисунке 1 [8], [9].
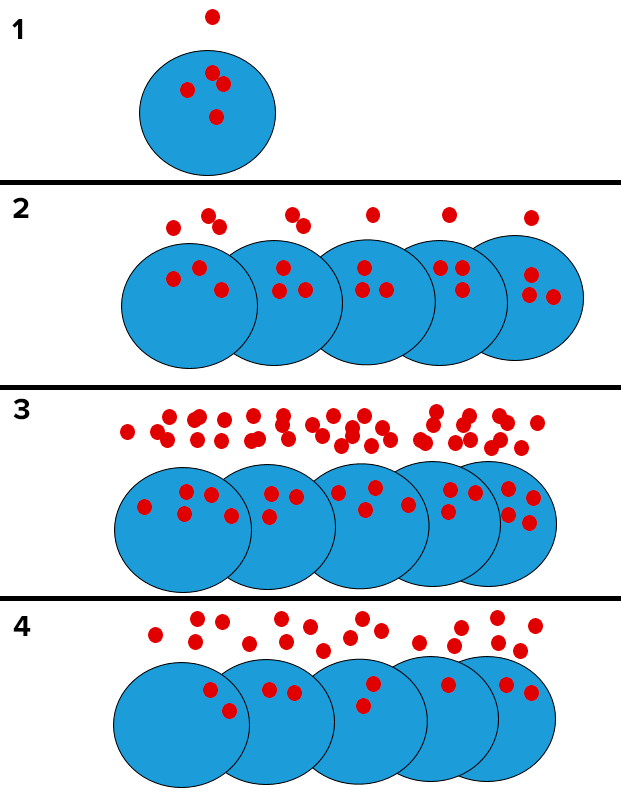
Рисунок 1. Схема работы бактериального чувства кворума. Бактериальная клетка выделяет во внешнюю среду сигнальные молекулы — аутоиндукторы (1). По мере размножения и роста числа клеток увеличивается и внеклеточная концентрация аутоиндуктора (2). В определенный момент она достигает критического значения (3), и в результате его дальнейшее выделение во внешнюю среду становится энергетически невыгодным, и аутоиндуктор накапливается внутри клеток. Это приводит к изменению экспрессии генов и определенным эффектам. В результате и продукция самого аутоиндуктора падает, и его внеклеточная концентрация снижается (4).
То, что бактерии могут вот так запросто «переговариваться» и координировать свои действия, — факт удивительный. Но прокариоты — всё же клеточная форма жизни, и от них в принципе можно ожидать чего-то подобного. Казалось бы, куда уж там вирусам: они даже сами размножаться не умеют, а вне организма хозяев и вовсе ведут себя как неживые. Но у бактериофагов, оказывается, тоже есть свое чувство кворума.
Вирулентные фаги ведут себя весьма просто и прямолинейно. Нашел подходящую клетку, заразил, захватил, наделал своих копий, уничтожил хозяина, — поколение за поколением воспроизводится одна и та же программа. Поведение умеренных фагов сложнее. Им нужно выбирать между литическим и лизогенным жизненными циклами, а во втором случае еще и сделать так, чтобы нескольким вирусам не пришлось драться за ресурсы внутри одной клетки. Приходится учитывать интересы собратьев, тут-то и оказываются полезны механизмы, которые можно подвести под понятие чувства кворума.
С момента, когда бактериофаг вступает в лизогенный жизненный цикл и переходит в состояние профага, его интересы начинают совпадать с интересами клетки-хозяина. Если бактерии чувствуют себя хорошо и активно размножаются — вирусу тоже отлично, число его копий растет. Паразит не горит желанием делиться ресурсами с собратьями, и уж тем более ему не хочется, чтобы бактерию разрушил какой-нибудь залетный фаг. Поэтому многие профаги научились защищать хозяев от суперинфекции. Для этого используются разные механизмы.
Некоторые профаги меняют структуры на поверхности бактериальных клеток, чтобы другие вирусы не смогли прикрепиться. Например, встречаются модификации O-антигена — полисахаридной структуры на поверхности большинства грамотрицательных бактерий, напоминающей «шерсть»; пилей (ворсинок) IV типа [10]. Продукты профаговых генов колифагов Ф80 и N15 блокируют адсорбцию суперинфицирующих фагов Т1, Ф80 и N15 на поверхности клетки-хозяина [11].
В других случаях активируются защитные механизмы внутри клетки или на популяционном уровне. Так, профаг P22 сальмонелл (Salmonella typhimurium) не препятствует проникновению собратьев в инфицированную им клетку, но, когда те уже оказываются внутри, продукт его гена sieA не дает встроиться ДНК других вирусов в бактериальную хромосому [11]. Профаги некоторых грамотрицательных бактерий кодируют белок BstA. Он обеспечивает коллективную защиту микроорганизмов от других вирусов путем абортивной инфекции. Зараженная клетка погибает, при этом размножения «чужого» фага не происходит, и он не может распространяться дальше [12].
Умеют бактериофаги общаться и с помощью сигнальных молекул. Конечно, сами вирусы эти соединения синтезировать не могут, поэтому используют в качестве «переводчиков» бактерий-хозяев. Эти коммуникации начали изучать совсем недавно. Так, в 2017 году были опубликованы результаты исследования, о котором мы рассказывали в материале «Бактериофаг-1 Бактериофагу-2, приём!» [13].
Во время этого исследования ученые обнаружили механизм общения между фагами, названный арбитриумной системой. Сделать открытие помогла случайность. Изначально планировалось проверить, какие соединения вырабатывают сенные палочки (B. subtilis), зараженные вирусом phi3T. Ожидалось, что микроорганизмы способны продуцировать какие-нибудь сигнальные молекулы, защищающие собратьев от заражения. В итоге такое соединение обнаружилось — белок из 43-х аминокислотных остатков, получивший название AimP. Но структура его оказалась закодирована не в бактериальной хромосоме, а в гене профага. Впоследствии от AimP отделяется пептид из шести аминокислот, который был назван арбитриумом. Чем больше этого пептида поступает в клетку, тем выше вероятность, что при заражении тем же фагом инфекция пойдет по лизогенному пути. А при достижении определенной критической концентрации литический жизненный цикл становится практически невозможным [14].
Это интересное открытие с учетом того факта, что зачастую преобладание лизиса или лизогении зависит не только от внешних факторов, но и от плотности популяции бактерий, числа фагов, которое приходится на одного хозяина [11]. Другие внутренние механизмы регуляции пока по большей части скрыты пеленой тайны. Знания о них могли бы принести практическую пользу — например, для фаготерапии.
В то время как одни фаги заставляют бактерий синтезировать сигнальные молекулы, в геноме других закодирована структура белков-рецепторов к этим сигналам. Один из них удалось обнаружить авторам научной работы, опубликованной в 2022 году. Обычно грамотрицательные бактерии используют в качестве аутоиндукторов N-ацил-гомосеринлактоны (HSL), а эффекты этих соединений реализуются через рецепторы LuxR-типа. Во время исследования было обнаружено, что в геноме фага ARM81ld, заражающего водные бактерии из семейства Aeromonas, закодирована структура похожего рецептора, получившего название LuxRARM81ld. Этот рецептор реагирует на соединение C4-HSL, продуцируемое самими бактериями, и запускает литический цикл. Профаг активируется и убивает хозяина [15].
Мало того, оказалось, что другие бактерии синтезируют соединения, блокирующие рецептор LuxRARM81ld. Например, аутоиндуктор C8-HSL, продуцируемый вибрионами Фишера (Vibrio fischeri), живущими в воде по соседству с Aeromonas, ингибирует LuxRARM81ld и тем самым защищает хозяев профага от гибели [15].
Интересно ведет себя умеренный вибриофаг VP882. В его геноме закодирован гомолог (соединение с похожей структурой и функцией) VqmA — DPO-связывающего рецептора бактерии. У микроорганизмов этот рецептор участвует в чувстве кворума и реагирует на аутоиндуктор под названием DPO. Фаговый гомолог называется VqmAPhage. Когда численность бактерий увеличивается и концентрация DPO повышается, VqmAPhage связывается с ним. Дальше запускается цепочка событий, которая приводит к индукции профагов и лизису клеток. С помощью такого механизма VP882 подгадывает момент и запускает лизис, когда бактерий становится много, и вероятность заразить новые клетки наиболее высока (рис. 2) [16].
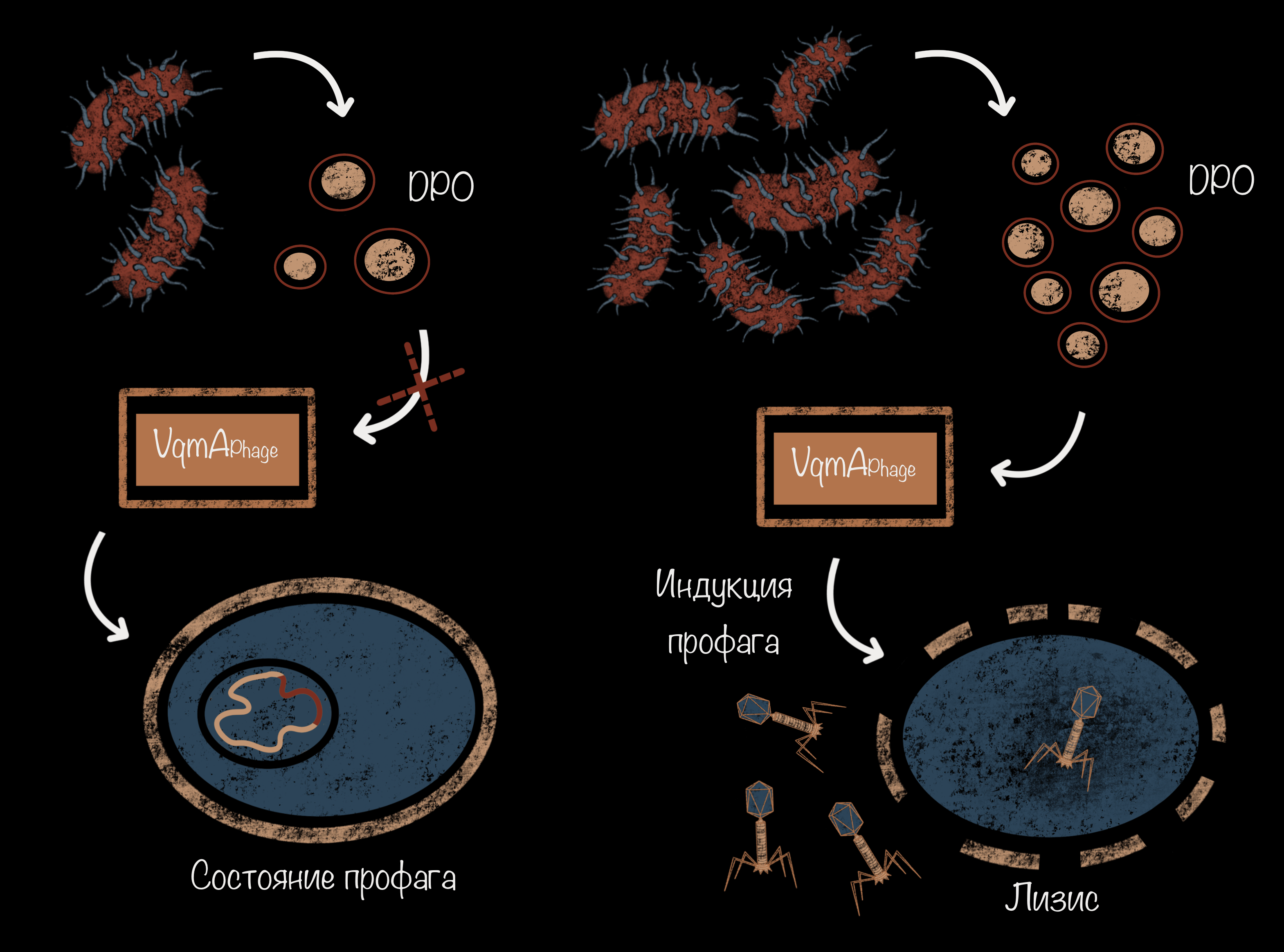
Рисунок 2. Хитрое поведение вибриофага VP882. Слева — ситуация, когда бактерий мало. Фаговый белок VqmAPhage ни с чем не реагирует, и вирус находится в состоянии профага. Справа численность бактерий-хозяев высока. Концентрация DPO повышается, VqmAPhage взаимодействует с этой сигнальной молекулой, происходит индукция профага и начинается литический цикл.
иллюстрация Анастасии Самоукиной по [16]
Ученые получают всё больше доказательств того, что бактериальный и фаговый quorum sensing существуют не отдельно друг от друга. Вероятно, они связаны в единую сложную систему.
Понятия в мире фагов
Чаще всего сосуществование бактерий и фагов описывают словосочетанием «гонка вооружений» (arms-race dynamics). Это самая знаменитая модель. Она яркая, образная, понятная и хорошо запоминающаяся, но в то же время крайне упрощенная и однобокая. Суть идеи довольно проста. Обе стороны постоянно мутируют и совершенствуются: бактерии — чтобы противостоять заражению, а вирусы — чтобы обходить эти механизмы защиты. Битва эта ведется с переменным успехом, а победить в итоге не может никто [17].
Главная проблема этой модели в том, что многие исследования, посвященные коэволюции бактерий и фагов, показывают: гонка вооружений есть, но не продолжается бесконечно. Ее хватает максимум на несколько циклов бактериальных мутаций и вирусных контрмутаций [18], [19]. На то есть две причины:
- Геном фага маленький и постоянно поставлять мутации не может. Если бы гонка затянулась, то довольно быстро настал бы момент, когда вирусам «нечем крыть». По такой логике они давно должны были исчезнуть [17–19].
- У микроорганизмов тоже есть проблема. Полезные мутации — зачастую не «бесплатное» приобретение: ради них приходится чем-то жертвовать. Например, фаг может выбрать в качестве рецептора белок, необходимый для захвата питательных веществ. Мутация гена этого белка может сделать микроорганизмы «невидимыми» для фагов, но они будут хуже питаться и медленнее размножаться. Чем больше таких небесплатных приобретений, тем выше вероятность получить на выходе суперустойчивую к фагам бактерию, совершенно неприспособленную в остальных отношениях [17], [20].
Очевидно, отношения между бактериями и фагами намного сложнее, чем банальное стремление «задавить» вторую сторону. Ученые предложили еще несколько моделей (рис. 3). Все они являются гипотетическими и не могут претендовать на абсолютную точность. Природа — не математика, где всё можно описать одной простой формулой.
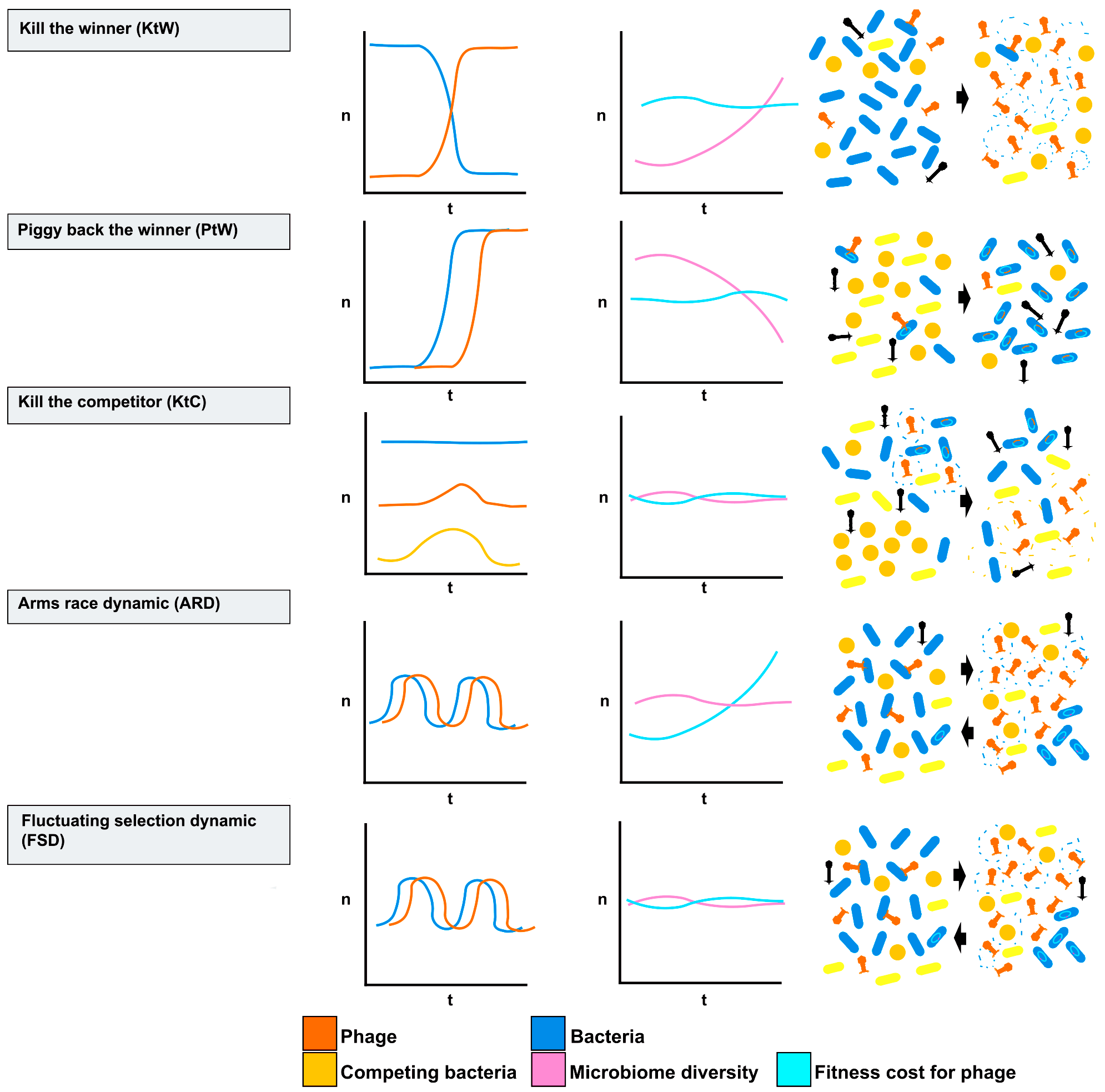
Рисунок 3. Гипотетические модели взаимодействия между популяциями фагов и бактерий. Ни одна из них не является абсолютно точной и не работает во всех случаях. Но каждая довольно неплохо описывает стратегии определенных вирусов в определенных средах.
Kill the winner (KtW, «Убей победителя»)
- Фаги поражают самые многочисленные бактерии.
- Преобладает литическое взаимодействие.
- Лизогения отмечается редко.
- Процветают разнообразные пары «фаг—бактерия».
- Увеличивается биоразнообразие микроорганизмов за счет контроля их численности.
Piggy back the winner (PtW, «Оседлай победителя»)
- Фаги заражают наиболее многочисленные бактерии и существуют в лизогенном жизненном цикле.
- Процветают наиболее успешные бактерии.
- Лизис бактериальных клеток встречается редко.
- Сокращается биоразнообразие микроорганизмов.
Kill the competitor (KtC, «Убей конкурента»)
- Фаги уничтожают потенциальных конкурентов своих хозяев.
- В результате индукции профагов погибает часть популяции.
- «Защищенные» фагами бактерии получают преимущество.
- Сокращается лизогения.
- Поддерживается биоразнообразие.
Arms race dynamic (ARD, «Гонка вооружений»)
- Фаги действуют как фактор естественного отбора устойчивых бактерий.
- Преобладает литическое взаимодействие.
- Отбираются определенные пары «фаг—бактерия».
- Лизогения встречается редко.
- Поддерживается биоразнообразие.
Fluctuating-selection dynamics (FSD, «Динамика флуктуирующего отбора»)
- Фаги действуют как фактор естественного отбора и способствуют селекции устойчивых бактерий, но со временем условия меняются, и преимущество получают другие микроорганизмы.
- Преобладает литический жизненный цикл, иногда встречается лизогения.
- Отбираются определенные пары «фаг—бактерия».
- Поддерживается биоразнообразие.
Kill-the-winner («Убей победителя»)
Волков называют санитарами леса, потому что они помогают контролировать численность травоядных животных, и экосистеме это приносит большую пользу. В биологии такие взаимодействия описываются математической моделью Лотки—Вольтерры (рис. 4). Модель kill-the-winner (рис. 5) можно рассматривать как ее частный случай. Чем более многочисленны бактерии какого-нибудь вида в определенной среде, тем выше вероятность, что на них будут «натыкаться» фаги. А по мере сокращения численности заражение, наоборот, будет происходить всё реже. Если же плотность микроорганизмов окажется ниже так называемого порога репликации, то вероятность встречи бактерии и дееспособного соответствующего ей вируса стремится к нулю [21], [22].
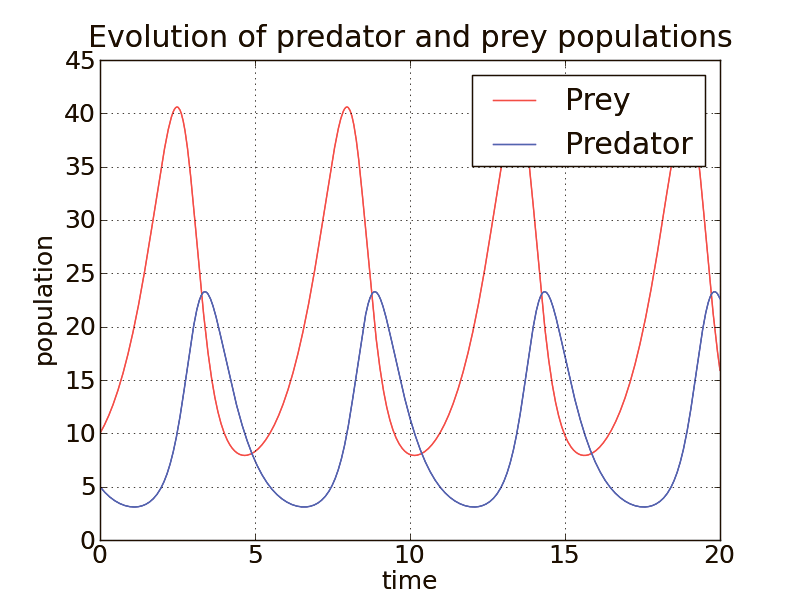
Рисунок 4. Модель Лотки—Вольтерры. Когда численность травоядных сильно увеличивается, для хищников появляется много еды, и их популяция тоже растет. Но вскоре это приводит к тому, что жертв остается всё меньше, и снова наступают «тощие годы». Условным волкам становится нечего есть, их поголовье сокращается, и тут уже наступают благоприятные условия для условных косуль. За счет этого численность хищников (синяя линия) постоянно следует за численностью жертв (красная линия) и повторяет ее динамику с некоторым запозданием. Аналогично можно описать отношения между паразитами и их хозяевами, а также между некоторыми другими живыми существами.
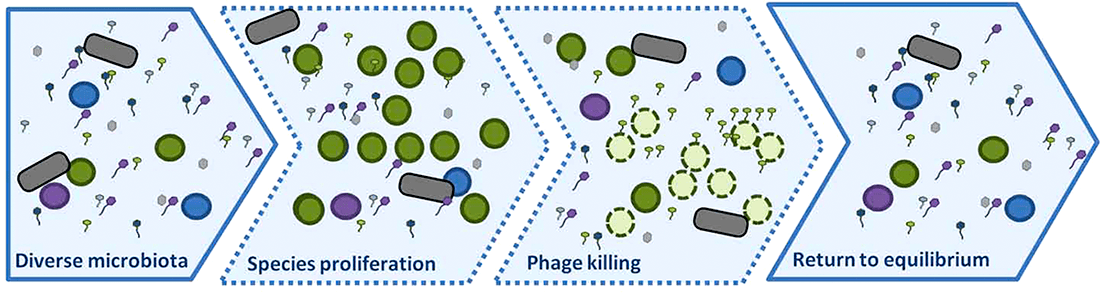
Рисунок 5. Так работает модель kill-the-winner. Поначалу микрофлора отличается большим разнообразием. На втором рисунке бактерии одного вида (зеленые кружки) активно размножаются и становятся самыми многочисленными. В итоге фаги чаще их поражают, их популяция сильно сокращается, и снова наступает равновесие.
Уничтожая в первую очередь самые многочисленные и быстрорастущие популяции бактерий, фаги тем самым помогают поддерживать разнообразие микробных сообществ. А для самих микроорганизмов это означает, что нужно искать золотую середину между скоростью размножения, потреблением ресурсов и устойчивостью к бактериофагам [17], [23].
Модель «убей победителя» находит подтверждения на практике. Например, с помощью нее можно объяснить высокую активность многих редких микробных сообществ в морской воде [23]. Но то, что встречается в океанах, не получилось обнаружить в других средах — например, в организме человека. Ученые проводили исследования, но так и не обнаружили проявления модели kill-the-winner в кишечнике людей, лошадей и свиней. Вероятно, это связано с полутвердой структурой кишечного содержимого, где бактерии защищены укрытиями [21].
Не всё так гладко и с морской водой. В теории модель kill-the-winner предсказывает, что фаги вряд ли позволят концентрациям самых успешных бактерий перешагнуть порог в 10 000 клеток на мл. На деле же, например, отдельные экотипы доминантных фотосинтезирующих цианобактерий Prochromococcus вполне могут достигать численности 200 000 клеток на мл, а гетеротрофные бактерии Pelagibacter — 125 000 клеток на мл [17].
Да и в основе своей концепция kill-the-winner имеет слабые места. В теории могут появиться бактерии, для которых устойчивость к фагам практически ничего не будет стоить, или «плату» за нее получится компенсировать другими мутациями. Такой «супермикроб» вполне мог бы захватить многие экологические ниши. Но этого до сих пор не произошло [17]. Недостатки и нестыковки не отвергают модель, но указывают на то, что это далеко не единственный механизм сосуществования бактерий и фагов.
Piggyback-the-winner («Оседлай победителя»)
Чтобы процветать, фагам вовсе не обязательно убивать бактерии и вообще как-либо с ними бороться. Можно размножаться вместе: ведь многие бактериофаги являются умеренными и способны существовать в лизогенном состоянии. Каждый зараженный микроорганизм передает копии профага своим потомкам, поэтому вирусам выгодно, чтобы численность бактерий-носителей росла.
Такая модель была названа piggyback-the-winner, или «оседлай победителя». Ученым удалось ее наблюдать в некоторых микробных сообществах — например, на коралловых рифах [24] и в организме человека. Умеренные фаги в составе нашего вирома в большинстве [25], и их взаимодействия с микрофлорой бывают весьма сложными.
В 2016 году журнал Biofilms Microbiomes опубликовал научную работу, авторы которой предложили модель сосуществования вирусов и бактерий на слизистых оболочках. В нижних слоях слизи, где высока концентрация муцина, микроорганизмов мало, а фаги более «злые» и обычно вызывают литическую инфекцию. В верхних слоях, напротив, численность представителей микрофлоры велика, а те же самые фаги предпочитают лизогению и спят в геномах хозяев в виде профагов [26].
Получается двухуровневая система, которая работает как две линии обороны против болезнетворных бактерий. Когда патоген попадает в верхние слои слизи, ему приходится конкурировать с многочисленной местной микробиотой. А если он добирается до нижних слоев, то его уничтожают фаги (рис. 6) [26].
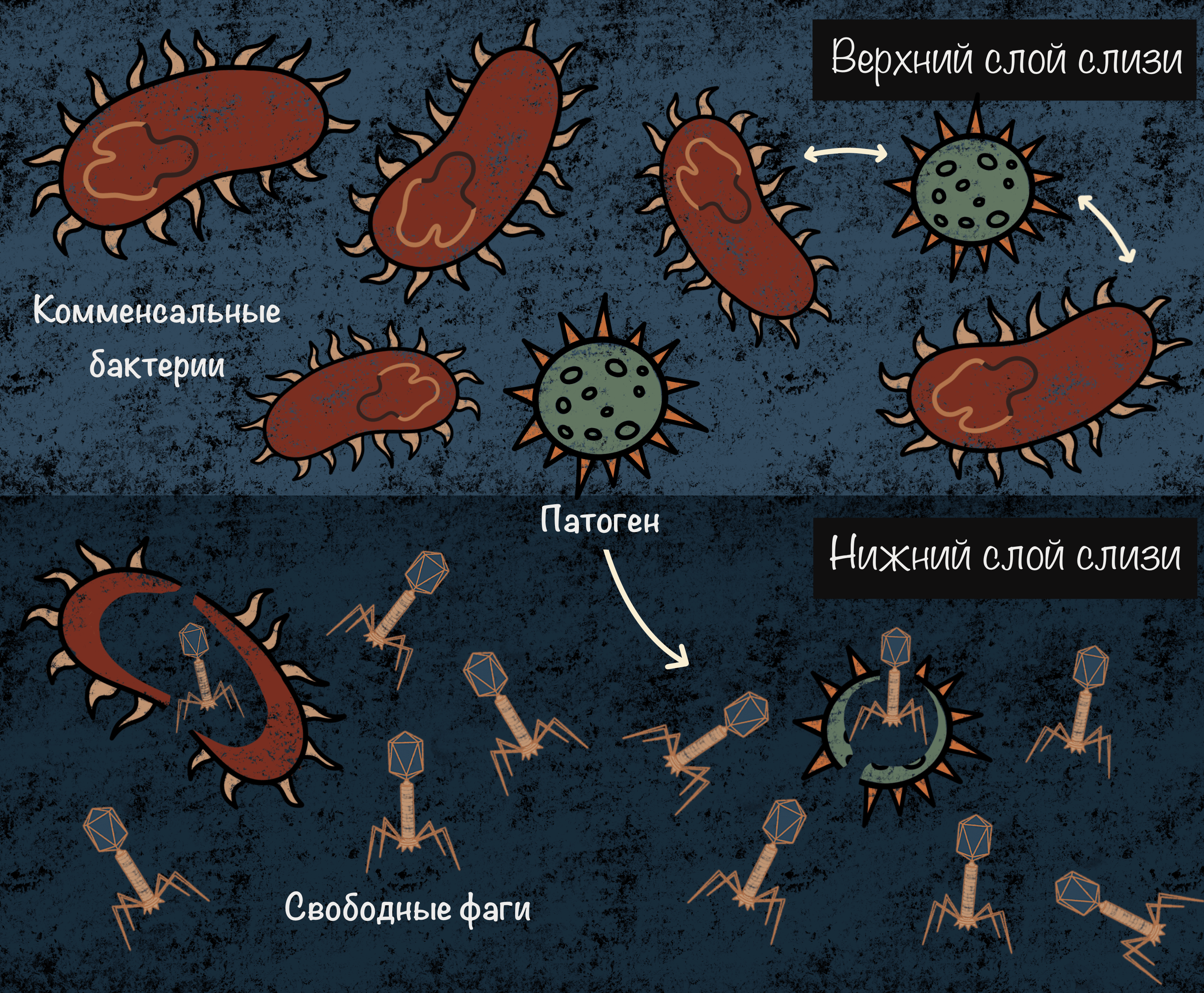
Рисунок 6. Схематическое изображение принципа piggyback-the-winner на слизистых оболочках человека. Численность комменсальных бактерий высока в верхнем слое слизи с низкой концентрацией муцина. Свободные фаги наиболее многочисленны в более нижних слоях, за счет прямой адгезии к элементам слизи. Высокая численность микроорганизмов в верхнем слое благоприятствует лизогении, а низкая глубже — литической инфекции. Когда вторгается патоген, сначала ему приходится конкурировать с многочисленными комменсалами, а при проникновении вглубь его убивают бактериофаги. Если же попадется устойчивый к фагам патоген, то для организма это может означать проблемы.
иллюстрация Анастасии Самоукиной по [26]
Kill-the-competitor («Убей конкурента»)
Другие названия этого механизма — «биологическое оружие» (biological weapon) и «убей родственника» (kill-the-relative). Его можно рассматривать как дополнение к piggyback-the-winner. Профагам выгодно, когда их хозяева активно размножаются, и невыгодно, если их численность уменьшается. Одной из причин сокращения популяции может стать борьба за ресурсы с другими бактериальными штаммами. Известно, что умеренные фаги могут при определенных условиях переходить от лизогенного цикла к литическому и уничтожать конкурентов. За счет этого их «основные» хозяева продолжают процветать. В частности, ученые наблюдали такое явление в кишечнике человека на примере штамма V583 микроорганизмов Enterococcus faecalis и составных фагов ΦV1/7 [21], [27–29].
Fluctuating-selection dynamics («Динамика флуктуирующего отбора»)
Как и гипотеза гонки вооружений, эта модель пытается описать антагонизм между фагами и бактериями, но в ином ключе. По этой концепции мутации не происходят регулярно, а новые микроорганизмы могут быть как более, так и менее устойчивыми к бактериофагам. Разнообразие поддерживается за счет того, что естественный отбор благоприятствует то одним, то другим бактериям [17].
В качестве простого примера можно привести один теоретически существующий вид бактерий и соответствующий им один вид фагов. Когда эти микроорганизмы становятся доминирующими, то реализуется стратегия kill-the-winner, и фаги тоже начинают активно размножаться. В это время получают преимущество другие виды бактерий, малочисленные и медленно размножающиеся. Но постепенно численность чувствительных бактерий сокращается, а параллельно остается всё меньше и соответствующих им вирусов. Когда их становится критически мало, резистентные микроорганизмы теряют преимущество, а чувствительные снова начинают активно размножаться. За счет существования таких динамических систем и поддерживается биоразнообразие [17].
«Грабеж и мародерство» vs «Остаемся зимовать»
Эту образную модель предложили авторы одного исследования, посвященного микробным сообществам океанов и опубликованного в 2019 году. Ученые сравнили тактику фагов с поведением пиратов XVII–XVIII столетий. Еще более точным будет сравнение действий вирусов с налетами викингов. Когда погода благоприятствовала, головорезы приплывали в чужое поселение, грабили и сжигали его. А во время сезона штормов и зимой они опасались уходить в море, поэтому оставляли дома жертв целыми и пережидали в них непогоду. А если в это время приходили крепкие парни из чужого клана, то захватчики помогали жертвам обороняться. Главной целью становился не разбой, а выживание (рис. 7) [30].
Напрашивается весьма яркая аналогия с литическим и лизогенным жизненными циклами бактериофагов. Когда бактерий много, вирус после заражения разрушает метаболизм хозяина и перенаправляет его на синтез новых фаговых частиц. Литический цикл в приоритете: кругом полно «добычи», хватит на всё потомство. В неблагоприятных же условиях более выгодной становится лизогения. Причем возбудитель заинтересован в том, чтобы бактерия-носитель была хорошо приспособлена к окружающей среде и активно размножалась. О том, как профаги наделяют микроорганизмы новыми полезными свойствами, мы еще поговорим ниже [30].

Рисунок 7. Забавная иллюстрация, на которой фаги сравниваются с викингами. Вверху: модель «Грабеж и мародерство». Вирус перенаправляет все ресурсы хозяина на собственную репликацию. Дело заканчивается сборкой новых фаговых частиц и лизисом бактериальной клетки. Внизу: модель «Остаемся зимовать». Вирус поселяется в бактерии в виде профага и дарит ей гены, наделяющие полезными свойствами. Бактерия может стать устойчивой к заражению другими бактериофагами, неблагоприятным внешним факторам. Ее метаболизм может измениться и повысить выживаемость.
иллюстрация Анастасии Самоукиной по [30]
Не только убивают, но и гибнут
Коль скоро бактериофаги стабильно сосуществуют с бактериями, очевидно, они должны не только размножаться, но и погибать. Когда вирус находится во внешней среде, то слова «жизнь» и «смерть» можно применять по отношению к нему лишь в кавычках, потому что вне организма хозяина он ведет себя скорее как неживая частица. Правильнее говорить о распаде, разрушении фаговых частиц, в результате чего они теряют способность заражать микроорганизмы. Эти процессы происходят регулярно и повсеместно.
Почему же бактериофаги разрушаются? Причин довольно много [31]:
- Ультрафиолетовое излучение вызывает повреждение нуклеиновых кислот и белковых молекул. У человека ультрафиолет в больших дозах приводит к солнечным ожогам, раку кожи и меланоме, а вирус может уничтожить сразу на месте. Считается, что это одна из основных причин инактивации фаговых частиц в природе — по крайней мере, там, куда способно дотянуться солнечное ультрафиолетовое излучение, например, на разных открытых поверхностях, в верхних слоях водоемов [32–34].
- Выедание простейшими. Что для бактерий смертельная угроза — то для эукариотов потенциальная пища. Простейшие могут поедать как зараженные микроорганизмы, так и свободные вирусы. Например, есть исследования, в которых такое наблюдали у морских гетеротрофных жгутиконосцев [35] и инфузорий [36]. Иногда в связи с этими паразитически-пищевыми треугольниками упоминают еще одну гипотетическую модель отношений в микромире: «убить убийцу победителя». Впрочем, считается, что хищничество простейших вносит небольшой вклад в смертность фагов в глобальных масштабах.
- Разрушение ферментами, которые выделяются в окружающую среду при гибели бактериальных клеток [34], [37].
- Адсорбция на различных частицах и высыхание — основные причины инактивации бактериофагов в почве [34].
- Свободные радикалы и другие окислители [31].
- Иммунная система вносит свой вклад в уничтожение вирусов в организме животных и человека. Ведь иммунитет не понимает, что фаги — наши друзья, для него они такие же чужеродные и подозрительные, как и реально опасные микроорганизмы [38].
- Поедание бактериями. Неожиданно, но такой биологический механизм контроля численности фагов, вероятно, тоже есть. По крайней мере, доказательства его существования нашли авторы исследования, опубликованного в 2021 году в журнале Microorganisms [39]. Они обнаружили, что хищничество со стороны бактерий семейства Aeromonadacea является одной из главных причин сокращения численности бактериофагов T4 в проанализированных осадках сточных вод. Один из штаммов этих микроорганизмов растет и здравствует на T4 в качестве единственного источника углерода, азота и фосфора. В своей работе авторы назвали такое пожирание «широко распространенным и недооцененным типом биоконтроля» и выразили надежду, что их коллеги заинтересуются данным явлением и начнут его активно изучать [39].
Дары фагов: как они влияют на бактерии и наделяют их новыми свойствами?
Каждую секунду на Земле происходит примерно 1023–1025 заражений микроорганизмов бактериофагами [47]. При этом глобально вирусы бактерий ежесекундно переносят путем трансдукции около 2×1016 генов [48]. Отсюда можно заключить, что фаги, сами того не подозревая, стали важнейшим фактором поддержания генетического разнообразия своих жертв-хозяев. Хотя бактерии эволюционируют быстрее, чем более сложные организмы, у них этот процесс всё равно происходит довольно медленно. Горизонтальный перенос генов — это «быстрая эволюция», и бактериофаги задействованы в ней самым активным образом [46], [49]. Причем полезное применение находится не только умеренным, но и вирулентным фагам:
- Лизогенная конверсия — явление, при котором отношения фага и бактерии перестают быть враждебными и по сути оборачиваются симбиозом. У многих умеренных вирусов прокариот есть гены, которые им самим ни для чего не нужны. Они не влияют ни на течение лизогенного жизненного цикла, ни на его переход к лизису. Но эти вирусные гены могут наделить микроорганизм новыми полезными свойствами. Возникновение этих свойств и называется лизогенной конверсией. Например, бактерия начинает вырабатывать токсин или фермент, эффективнее вызывая инфекцию у человека или животных [4], [50].
- Фаговая трансдукция — перенос генов одних бактерий в другие клетки с помощью вирусов. Фаг может забрать кусочек бактериальной ДНК разными способами. При специфической трансдукции индуцированный профаг, переходя в литический цикл, не совсем правильно вырезается из хромосомы и случайно забирает с собой соседние гены. При общей трансдукции рандомные кусочки бактериальной ДНК случайным образом упаковываются в вирусные частицы, когда происходит их сборка во время литического цикла [51], [52].
- Трансформация с участием фагов. Трансформацией называется разновидность горизонтального переноса генов, когда бактериальная клетка поглощает внеклеточную ДНК. Микроорганизмы, которые умеют так делать, называются компетентными [53]. Помимо хромосомы, в бактериальных клетках еще есть отдельные более короткие молекулы ДНК — плазмиды. Есть данные, что при разрушении бактериальных клеток некоторыми популяциями вирулентных фагов эти плазмиды остаются сохранными, выделяются вовне, и в дальнейшем их могут использовать другие микроорганизмы. Например, так могут распространяться гены устойчивости к антибиотикам [54].
- Фаговые плазмиды (фаг-плазмиды, профаг-плазмиды) — это фаги и плазмиды одновременно (да, есть и такие). По сути своей это умеренный фаг, который не встроился в хромосому, а решил остаться в клетке в виде плазмиды. Таких вирусов внутри бактерии может быть одновременно много. Они распространяются между клетками горизонтально как фаги или передаются вертикально как плазмиды. При некоторых условиях такой генетический элемент может окончательно превратиться либо в бактериофаг, либо в плазмиду. Основное значение профаг-плазмид в том, что они распространяют гены устойчивости к антибиотикам [55–59].
Влияние фагов на экологическое поведение бактерий не ограничивается привнесением новых генов. Эффекты вирусов многообразны и могут касаться самых разных аспектов жизни микробных сообществ. В первой статье цикла мы рассказывали, как бактерии защищаются с помощью биопленок (см. также «Биопленки. Как живется в бактериальных многоэтажках?» [60]), а вирусы изобретают способы проникать в эти «бактериальные крепости». Но некоторые бактериофаги, наоборот, помогают формировать биопленки.
В качестве примера можно привести нитевидный умеренный фаг Pf1, заражающий синегнойные палочки (Pseudomonas aeruginosa). Когда бактерии формируют биопленку, некоторые вирусы таинственным образом превращаются в гипервирулентные формы. Пока не удалось разобраться, как и почему это происходит, но последствия довольно хорошо изучены. В итоге часть микроорганизмов гибнет, причем происходит это в основном глубоко внутри колонии. Находящиеся там бактерии активно отращивают ворсинки — они и становятся рецепторами для фагов. Когда эти клетки погибают, на их месте остаются каналы. По ним выжившие синегнойные палочки получают питательные вещества [31].
Кроме того, сами вирусы Pf1 и ДНК уничтоженных ими бактерий становятся важными компонентами матрикса биопленки. Фаговые частицы взаимодействуют с другими веществами и образуют жидкокристаллические структуры: это помогает биопленкам лучше прилипать к поверхностям и не высыхать [31].
Завершая этот небольшой обзор фагов как механизма переноса генов и поддержания биоразнообразия бактерий, остается ответить на один закономерно возникающий вопрос: «Если бактериофаги обладают такими свойствами, то не опасно ли делать из них лекарства для борьбы с бактериальными инфекциями?». А ну как вирус вместо борьбы с патогеном, наоборот, усилит его?
Действительно, в теории фаги могут способствовать распространению генов устойчивости к антибиотикам. На практике таких случаев обнаружено не было. Очевидно, если применять для лечения бактериальных инфекций только литические фаги и тщательно проверять их геном, то риски стремятся к нулю.
«Серые кардиналы» в биосфере и организме человека
Каждый бактериофаг по отдельности очень мал, но их общая численность на нашей планете составляет около 1031. Это самые многочисленные существа на Земле, и вместе они представляют собой огромную невидимую силу. Бактериофаги регулируют жизнь бактериальных сообществ и косвенно влияют на всех живых существ, включая человека.
Вирусы в биосфере — это слон в комнате, замеченный, наконец, наукой. Так, подсчитано, что в современных морских экосистемах от 6% до 26% фотосинтетически фиксированного углерода переходит в пул растворенного органического вещества за счет вирусного лизиса клеток [71]. Проделки фагов существенно влияют на глобальные потоки органического вещества, климат, состав микробных сообществ, а вследствие этого — и на здоровье животных и человека.
Горизонтальный перенос генов с участием фагов играет в экосистемах не менее важную роль, чем просто разрушение бактерий с выделением вовне органического вещества. Лучше всего это явление изучено на морских фагах. Вирусы могут нести так называемые вспомогательные метаболические гены (auxiliary metabolic genes, AMG), зачастую кодирующие критически важные процессы метаболизма микроорганизмов-хозяев, например, белки, участвующие в фотосинтезе, выведении из клетки фосфатов, азотистом, аминокислотном, углеводном обменах, выработке энергии. Наделяя бактерии такими полезными способностями, вирусы усиливают их метаболизм и тем самым ускоряя собственное распространение. А параллельно получает пользу вся экосистема. Разных AMG так много, что их делят по функциям на несколько классов, при этом их гены могут продолжать изменяться в составе вируса, а внутри бактерии может происходить их рекомбинация с ДНК хозяина. За счет этого белки приобретают новые свойства, а бактерии эволюционируют [72].
Исследования показывают, что фаговая трансдукция наиболее активно происходит в морской среде. При этом некоторые исследования пошатнули представление о том, что фаги очень привередливы и специфически поражают только определенный вид или штамм микроорганизмов. Некоторые исследования показывают, что фаговая трансдукция может охватывать довольно широкий спектр микроорганизмов. Например, вирусоподобные частицы, которые выделяются из морских бактерий, могут переносить определенные гены в ауксотрофные кишечные палочки и наделять их способностью к прототрофии (синтезу из неорганических соединений) аминокислот. Также есть данные, что гены путем трансдукции могут передаваться кишечным палочкам от бактерий из геотермальных источников [73]. Эти данные существенно усложняют картину взаимоотношений в фагово-бактериальных сообществах. Ученым еще предстоит подробно оценить эти процессы и их значение в глобальных масштабах.
После всего вышеописанного образ фагов как исключительно безжалостных убийц становится весьма бледным и неубедительным. Скорее их можно сравнить с опытными пастухами-селекционерами микромира. Они влияют на поведение бактерий, обеспечивают их генетическое разнообразие, иногда помогают им, защищают, а периодически — «пускают на мясо». Экология бактериофагов — молодая наука, и в ней много terra incognita. А значит, вирусологи и другие специалисты, изучающие этих удивительных существ, в ближайшем будущем точно не останутся без работы.
Литература
- Dmitriy Myelnikov. (2018). An Alternative Cure: The Adoption and Survival of Bacteriophage Therapy in the USSR, 1922–1955. Journal of the History of Medicine and Allied Sciences. 73, 385-411;
- Модельные организмы: фаг лямбда;
- Антибиотики и антибиотикорезистентность: от древности до наших дней;
- Огромный и загадочный мир бактериофагов;
- Фаги-оруженосцы на службе у бактерий;
- Yevgeniy Turovskiy, Dimitri Kashtanov, Boris Paskhover, Michael L. Chikindas. (2007). Quorum Sensing: Fact, Fiction, and Everything in Between. Advances in Applied Microbiology. 191-234;
- Бактерии, молчать! Как и зачем вносить помехи в межклеточное общение;
- Sathivel Thivijan, Lanka Jeewanie Samarakoon Undugoda, Ruwani Nilushi Nugara, Pathmalal Marakkale Manage, Kasun Madhusanka Thambulugala, Sagarika Dilpushpi Kannangara. (2023). Quorum sensing capability of wine microbial consortium involved in spontaneous fermentation of regional wine production. S. 8, 0-0;
- Melissa B. Miller, Bonnie L. Bassler. (2001). Quorum Sensing in Bacteria. Annu. Rev. Microbiol.. 55, 165-199;
- Joseph Bondy-Denomy, Jason Qian, Edze R Westra, Angus Buckling, David S Guttman, et. al.. (2016). Prophages mediate defense against phage infection through diverse mechanisms. The ISME Journal. 10, 2854-2866;
- Menghui Zhang, Tianyou Zhang, Meishun Yu, Yu-Lei Chen, Min Jin. (2022). The Life Cycle Transitions of Temperate Phages: Regulating Factors and Potential Ecological Implications. Viruses. 14, 1904;
- Siân V. Owen, Nicolas Wenner, Charles L. Dulberger, Ella V. Rodwell, Arthur Bowers-Barnard, et. al.. (2021). Prophages encode phage-defense systems with cognate self-immunity. Cell Host & Microbe. 29, 1620-1633.e8;
- «Бактериофаг-1 Бактериофагу-2, приём!»;
- Zohar Erez, Ida Steinberger-Levy, Maya Shamir, Shany Doron, Avigail Stokar-Avihail, et. al.. (2017). Communication between viruses guides lysis–lysogeny decisions. Nature. 541, 488-493;
- Justin E. Silpe, Olivia P. Duddy, Bonnie L. Bassler. (2022). Natural and synthetic inhibitors of a phage-encoded quorum-sensing receptor affect phage–host dynamics in mixed bacterial communities. Proc. Natl. Acad. Sci. U.S.A.. 119;
- Olivia P. Duddy, Bonnie L. Bassler. (2021). Quorum sensing across bacterial and viral domains. PLoS Pathog. 17, e1009074;
- Sarit Avrani, Daniel A. Schwartz, Debbie Lindell. (2012). Virus-host swinging party in the oceans. Mobile Genetic Elements. 2, 88-95;
- Richard E. Lenski, Bruce R. Levin. (1985). Constraints on the Coevolution of Bacteria and Virulent Phage: A Model, Some Experiments, and Predictions for Natural Communities. The American Naturalist. 125, 585-602;
- Jay T. Lennon, Jennifer B. H. Martiny. (2008). Rapid evolution buffers ecosystem impacts of viruses in a microbial food web§. Ecology Letters. 11, 1178-1188;
- Christian Winter, Thierry Bouvier, Markus G. Weinbauer, T. Frede Thingstad. (2010). Trade-Offs between Competition and Defense Specialists among Unicellular Planktonic Organisms: the “Killing the Winner” Hypothesis Revisited. Microbiol Mol Biol Rev. 74, 42-57;
- Marianne De Paepe, Marion Leclerc, Colin R. Tinsley, Marie-Agnès Petit. (2014). Bacteriophages: an underestimated role in human and animal health?. Front. Cell. Infect. Microbiol.. 4;
- Anastasios Marantos, Namiko Mitarai, Kim Sneppen. (2022). From kill the winner to eliminate the winner in open phage-bacteria systems. PLoS Comput Biol. 18, e1010400;
- Naureen Z., Dautaj A., Anpilogov K., Camilleri G., Dhuli K., Tanzi B. et al. (2020). Bacteriophages presence in nature and their role in the natural selection of bacterial populations. Acta bio-medica: Atenei Parmensis. 91(13-S), e2020024;
- B. Knowles, C. B. Silveira, B. A. Bailey, K. Barott, V. A. Cantu, et. al.. (2016). Lytic to temperate switching of viral communities. Nature. 531, 466-470;
- Marzanna Łusiak-Szelachowska, Beata Weber-Dąbrowska, Maciej Żaczek, Jan Borysowski, Andrzej Górski. (2020). The Presence of Bacteriophages in the Human Body: Good, Bad or Neutral?. Microorganisms. 8, 2012;
- Cynthia B Silveira, Forest L Rohwer. (2016). Piggyback-the-Winner in host-associated microbial communities. npj Biofilms Microbiomes. 2;
- Teagan L Brown, Oliver J Charity, Evelien M Adriaenssens. (2022). Ecological and functional roles of bacteriophages in contrasting environments: marine, terrestrial and human gut. Current Opinion in Microbiology. 70, 102229;
- Cristina Howard-Varona, Katherine R Hargreaves, Stephen T Abedon, Matthew B Sullivan. (2017). Lysogeny in nature: mechanisms, impact and ecology of temperate phages. ISME J. 11, 1511-1520;
- Breck A. Duerkop, Charmaine V. Clements, Darcy Rollins, Jorge L. M. Rodrigues, Lora V. Hooper. (2012). A composite bacteriophage alters colonization by an intestinal commensal bacterium. Proc. Natl. Acad. Sci. U.S.A.. 109, 17621-17626;
- Joanna Warwick-Dugdale, Holger H. Buchholz, Michael J. Allen, Ben Temperton. (2019). Host-hijacking and planktonic piracy: how phages command the microbial high seas. Virol J. 16;
- Летаров А.В. Современные концепции биологии бактериофагов. М.: ТД «ДеЛи», 2019.;
- Eric F. Tom, Ian J. Molineux, Matthew L. Paff, James J. Bull. (2018). Experimental evolution of UV resistance in a phage. PeerJ. 6, e5190;
- Tomlinson S. UV Irradiation on Bacteriophage Survival: Honors Theses. — Coastal Carolina University, 2010. — 142 p.;
- Markus G. Weinbauer. (2004). Ecology of prokaryotic viruses. FEMS Microbiol Rev. 28, 127-181;
- JM González, CA Suttle. (1993). Grazing by marine nanofiagellates on viruses and virus-sized particles: ingestion and digestion. Mar. Ecol. Prog. Ser.. 94, 1-10;
- Marcel D. O. Pinheiro, Mary E. Power, Barbara J. Butler, Vivian R. Dayeh, Robin Slawson, et. al.. (2007). Use of Tetrahymena thermophila To Study the Role of Protozoa in Inactivation of Viruses in Water. Appl Environ Microbiol. 73, 643-649;
- K. Moebus. (1992). Laboratory investigations on the survival of marine bacteriophages in raw and treated seawater. Helgolander Meeresunters. 46, 251-273;
- Amanda Carroll-Portillo, Henry C. Lin. (2019). Bacteriophage and the Innate Immune System: Access and Signaling. Microorganisms. 7, 625;
- Jean-Jacques Godon, Ariane Bize, Hoang Ngo, Laurent Cauquil, Mathieu Almeida, et. al.. (2021). Bacterial Consumption of T4 Phages. Microorganisms. 9, 1852;
- Просто о сложном: CRISPR/Cas;
- Противофаговая линия Мажино в клетках прокариот: новые открытия;
- Ron L. Dy, Rita Przybilski, Koen Semeijn, George P.C. Salmond, Peter C. Fineran. (2014). A widespread bacteriophage abortive infection system functions through a Type IV toxin–antitoxin mechanism. Nucleic Acids Research. 42, 4590-4605;
- Anna Lopatina, Nitzan Tal, Rotem Sorek. (2020). Abortive Infection: Bacterial Suicide as an Antiviral Immune Strategy. Annu. Rev. Virol.. 7, 371-384;
- Rasmus Skytte Eriksen, Namiko Mitarai, Kim Sneppen. (2020). Sustainability of spatially distributed bacteria-phage systems. Sci Rep. 10;
- Stephen T. Abedon. (2011). Lysis from without. Bacteriophage. 1, 46-49;
- Harald Brüssow, Carlos Canchaya, Wolf-Dietrich Hardt. (2004). Phages and the Evolution of Bacterial Pathogens: from Genomic Rearrangements to Lysogenic Conversion. Microbiol Mol Biol Rev. 68, 560-602;
- Kang Hao Cheong, Tao Wen, Sean Benler, Jin Ming Koh, Eugene V. Koonin. (2022). Alternating lysis and lysogeny is a winning strategy in bacteriophages due to Parrondo's paradox. Proc. Natl. Acad. Sci. U.S.A.. 119;
- Eric C. Keen. (2015). A century of phage research: Bacteriophages and the shaping of modern biology. BioEssays. 37, 6-9;
- Мобильные генетические элементы прокариот: стратификация «общества» бродяжек и домоседов;
- John W. Little. (2014). Lysogeny, Prophage Induction, and Lysogenic Conversion. Phages. 37-54;
- Christine L. Schneider. (2017). Bacteriophage-Mediated Horizontal Gene Transfer: Transduction. Bacteriophages. 1-42;
- Yin Ning Chiang, José R. Penadés, John Chen. (2019). Genetic transduction by phages and chromosomal islands: The new and noncanonical. PLoS Pathog. 15, e1007878;
- Haruka Hasegawa, Erika Suzuki, Sumio Maeda. (2018). Horizontal Plasmid Transfer by Transformation in Escherichia coli: Environmental Factors and Possible Mechanisms. Front. Microbiol.. 9;
- Eric C. Keen, Valery V. Bliskovsky, Francisco Malagon, James D. Baker, Jeffrey S. Prince, et. al.. (2017). Novel “Superspreader” Bacteriophages Promote Horizontal Gene Transfer by Transformation. mBio. 8;
- Eugen Pfeifer, Rémy A. Bonnin, Eduardo P. C. Rocha. (2022). Phage-Plasmids Spread Antibiotic Resistance Genes through Infection and Lysogenic Conversion. mBio. 13;
- Xiaoyu Shan, Rachel E. Szabo, Otto X. Cordero. (2023). Mutation-induced infections of phage-plasmids. Nat Commun. 14;
- Eugen Pfeifer, Eduardo P. C. Rocha. (2024). Phage-plasmids promote recombination and emergence of phages and plasmids. Nat Commun. 15;
- Eugen Pfeifer, Rémy A. Bonnin, Eduardo P. C. Rocha. (2022). Phage-Plasmids Spread Antibiotic Resistance Genes through Infection and Lysogenic Conversion. mBio. 13;
- Eugen Pfeifer, Eduardo P.C. Rocha Phage-plasmids promote genetic exchanges between phages and plasmids and create novel ones — Cold Spring Harbor Laboratory;
- Биопленки. Как живется в бактериальных многоэтажках?;
- Шарипова М.Р. Курс лекций по генетической инженерии: учебное пособие. Казань: К(П)ФУ, 2015. — 114 с.;
- 12 методов в картинках: генная инженерия. Часть I, историческая;
- 12 методов в картинках: генная инженерия. Часть II: инструменты и техники;
- Молекулярное клонирование, или как засунуть в клетку чужеродный генетический материал;
- Время первых: как аденоассоциированные вирусы стали лучшими в доставке генов in vivo;
- Лентивирусные векторы: как они стали лучшими векторами для терапии ex vivo;
- «Спутник V» и не только: сказ об аденовирусных вакцинах;
- Banerjee S. (2023). Vectors for gene cloning — Plasmids and Bacteriophage. Microbe Notes;
- Векторы космидные и фазмидные. «База знаний по биологии человека»;
- Luísa Czamanski Nora, Cauã Antunes Westmann, Leonardo Martins‐Santana, Luana de Fátima Alves, Lummy Maria Oliveira Monteiro, et. al.. (2019). The art of vector engineering: towards the construction of next‐generation genetic tools. Microbial Biotechnology. 12, 125-147;
- Telesphore Sime-Ngando. (2014). Environmental bacteriophages: viruses of microbes in aquatic ecosystems. Front. Microbiol.. 5;
- Bonnie L Hurwitz, Jana M U’Ren. (2016). Viral metabolic reprogramming in marine ecosystems. Current Opinion in Microbiology. 31, 161-168;
- Paul J.H. (1999). Microbial gene transfer: an ecological perspective. J. Mol. Microbiol. Biotechnol. 1, 45–50;
- Бактериофаги для отделения интенсивной терапии: российские исследователи проверили новый подход;
- A.V. Grechko, M.M. Gurkova, M.A. Zhdanova, A.Yu. Zurabov, F.M. Zurabov, et. al.. (2024). Prevention of nosocomial pneumonia recurrence using a bacteriophage cocktail in intensive care unit. Rus. J. Anes. Reanim.. 39;
- Bree Cummins, Tomáš Gedeon, Kelly Spendlove. (2015). On the Efficacy of State Space Reconstruction Methods in Determining Causality. SIAM J. Appl. Dyn. Syst.. 14, 335-381;
- Martin Ploss, Andreas Kuhn. (2010). Kinetics of filamentous phage assembly. Phys. Biol.. 7, 045002;
- Бактериофаги в медицине.