Лекарства от психических расстройств: как не сойти с ума в эпоху современной фармакологии?
11 апреля 2025
Лекарства от психических расстройств: как не сойти с ума в эпоху современной фармакологии?
- 5539
- 0
- 21
Психические заболевания могут буквально разрывать личность человека на части. Бредовые идеи и галлюцинации, тревожность и депрессия, перепады настроения и дереализация — всё это страшные испытания, с которыми призваны бороться современная нейрофармакология и психиатрия.
Рисунок в оригинальном разрешении.
иллюстрация Елены Беловой
-
Автор
-
Редакторы
-
Иллюстратор
Психические заболевания испокон веков преследовали человечество и вызывали в людях страх и отторжение. Ведь они затрагивали личность человека, его душу, а также поднимали философские и теологические вопросы о том, что такое нормальность. Казалось, что душу нельзя излечить, как нарыв или перелом, поэтому прогресс в лечении психических заболеваний долгое время стоял на месте. Больных людей изолировали от общества и хорошо если обеспечивали достойными условиями существования.
С развитием доказательной медицины ученые поняли, что иногда душевные болезни могут быть изучены и успешно излечены правильным подбором лекарственных соединений, воздействующих на мозговую активность. В продолжении спецпроекта «Нейрофармакология» мы поговорим о том, как эта наука развивалась в психиатрии до наших дней и какие открытия ждут нас в будущем.
Нейрофармакология

Заболевания нервной системы — одна из самых сложных и важных областей медицины. Их фармацевтическое лечение очень осложняется наличием гематоэнцефалического барьера, который не пропускает в мозг некоторые вещества. Необходимость обойти этот барьер, а также сложности при подборе мишеней и особенно трудности в понимании патогенеза большинства болезней — вот проблемы, которые приходится преодолевать при разработке новых лекарств от заболеваний нервной системы. Этот спецпроект расскажет о трудностях в лечении «нервных болезней», о тех победах, которые уже находятся у нас на счету, а также о перспективах развития этой области фармакологии.
Партнер спецпроекта — биотехнологическая компания LEENERS. Современные исследовательские лаборатории LEENERS — это место, где совершаются научные открытия и рождаются лекарственные препараты нового поколения.
Быть Избранным всё равно что быть влюблённым. Никто не говорит тебе, что ты влюблен. Ты просто знаешь это.
Пифия в фильме «Матрица»
У психических заболеваний есть две особенности, которые ставят их особняком среди других болезней:
- Они, как правило, не представляют непосредственной угрозы жизни пациента, не выводят из строя жизненно важные органы, как раковые опухоли, аутоиммунные процессы и другие патологии, но драматически снижают качество жизни, отравляют существование больных и именно этим ставят жизнь под угрозу. При разговоре о психических заболеваниях люди часто упираются в определение понятия «болезнь»: оказывается, болезнь — это не только то, что объективно угрожает жизни и здоровью, но и то, что снижает субъективное качество существования.
- И из этого выводится вторая особенность психических заболеваний: очень часто они основаны на субъективных симптомах. Только пациент знает, грустно ли ему, страшно ли, видит ли он галлюцинации, помогает ли ему терапия. Из-за этого и диагностика, и лечение психических расстройств не могут полностью избежать субъективности. Более 50 лет назад в эксперименте Розенхана обнаружилось, что с огромной вероятностью симулянтов психиатры воспринимают как больных, а больных — как симулянтов. С тех пор в психиатрии появились более четкие критерии диагностики; врачи оценивают влияние симптомов на поведение и способность человека работать/учиться и жить нормальной самостоятельной жизнью, а также на такие параметры, как нарушения сна, аппетита и самоповреждающее поведение/суициды. Это не может полностью исключить субъективность психиатрических диагнозов, но достаточно ее уменьшает.
Очень краткая история психиатрии
На заре истории человечества психические заболевания, видимо, не считались болезнью, а воспринимались как дар или проклятие духов, как возможность связаться с высшими силами. В некоторых случаях в обществе возникала социальная роль, которая на взгляд современного человека показалась бы ролью демонстративного сумасшедшего — можно вспомнить сибирских шаманов или русских юродивых. У древних греков была богиня безумия Мания (Μανία), влиянием которой, судя по всему, объяснялись некоторые психические расстройства, а также неумение контролировать эмоции. Именно μῆνις (форма слова Μανία) — ослепляющий нездоровый гнев — надо было воспеть богине в первой строке Илиады.
От древних греков и близких народов, видимо, идет философское противопоставление смертного материального тела и бессмертного нематериального «духа» (сама по себе концепция отдельного духа есть у многих народов, но мы унаследовали ту, что разработали в Древней Греции и Месопотамии). Сейчас мы понимаем, что никакого отдельного и тем более бессмертного духа не существует, а характер и личность человека — результат деятельности его мозга, то есть конкретной части его тела. Однако концепция отдельной «души» пустила глубокие корни в наш язык, восприятие мира и представление о самих себе, что сильно осложнило развитие нейробиологии и психиатрии. В частности, долгое время предполагалось, что телесные болезни иногда излечимы, а вот душевные — это нечто отдельное, чуть ли не мистическое и уж точно неизлечимое.
Мы мало знаем об исследованиях и лечении психических заболеваний до эпохи Средневековья. Начиная с этого времени известно, что для душевнобольных строили отдельные учреждения — не столько для лечения, сколько для изоляции их от общества. Примерно с XVI века строительство таких учреждений стало нормальной практикой по всей Европе. О том, как там обращались с больными, хорошо говорит цитата Розалинды, персонажа пьесы Уильяма Шекспира: «Любовь — чистое безумие и, верьте мне, не меньше настоящего сумасшествия также достойна темной кельи и плети».
К XVII–XVIII векам в лучших европейских умах мало-помалу укрепляется мысль, что душевные болезни имеют под собой не мистическую, а материальную основу, а значит доступны для изучения и лечения. Возникает множество теорий возникновения психических заболеваний — на современный взгляд диких, но зато основанных на физиологических, а не метафизических, причинах. Больных постепенно перестают истязать и мучить опасным и бессмысленным лечением. Отдельно упомянем главврача Парижского приюта для душевнобольных времен Великой французской революции — Филиппа Пинеля (рис. 1). Пинель освободил психически больных от железных оков, оставив только смирительные рубашки.

Рисунок 1. Тони Робер-Флёри «Доктор Филипп Пинель освобождает от оков психически больных в больнице Сальпетриер в 1795 году», 1876 г.
Не сказать, что в конце XVIII — начале XIX века появились какие-то новые методы лечения. Однако стали весьма популярны «физические процедуры», больше похожие на пытки: порки, клеймление раскаленным железом, погружения в холодную воду — методы, призванные повлиять на психику пациента своим радикализмом и внезапностью. Никуда не делся и опиум с вызывающей рвоту чемерицей. Ученые разделились на «психиков» и «соматиков», спор между которыми длился почти три десятка лет. Впрочем, оба течения были по-своему неправы. «Соматики» считали, что мозг не имеет отношения к психическим расстройствам, так как те вызваны нарушениями дыхания, пищеварения и кровоснабжения. «Психики» считали, что во всем виновато вмешательство «горячих страстей», поэтому вовсю использовали меры смирения души (холодные ванны и принудительное стояние).
В XIX веке Жан-Этьен Доминик Эскироль продолжил реформы Пинеля. Эскироль заложил основы научно-клинической психиатрии, ввел понятие ремиссий и интермиссий, различие между иллюзиями и галлюцинациями, а также другие важные идеи. В 1832 году им была организована первая лечебница-поселение для душевнобольных — ферма св. Анны. В это время формировалась основа биологических знаний о психических болезнях с акцентом на связи с мозгом. Мейнерт, Клейст и Вернике уделяют в своих исследованиях большое внимание нейроанатомической основе психозов и предлагают классификацию психических расстройств на основе локализации поражений головного мозга. Психиатры XIX века обращают всё больше внимания на изучение соматической сферы больных в поисках причин психических расстройств.
Период с конца XIX по начало XX века можно полноправно считать зарождением современной психиатрии такой, как мы ее видим сейчас. В этот период были последовательно и научно обоснованно описаны все основные понятия и термины: Э. Крепелин и Е. Блейлер сформулировали понятие шизофрении; Ж. Фальре, Ж. Байярже и Э. Крепелин описали маниакально-депрессивный психоз (сейчас определяется как биполярное аффективное расстройство, БАР); а С.С. Корсаков дал описание алкогольного полиневритического психоза. Этими именитыми психиатрами было описано множество типичных симптомов психических расстройств типа шизофазии или мании преследования.
Однако именно Эмиль Крепелин стал тем, кто первый начал применять нозологический подход в психиатрии. К началу XX века ученые накопили богатый материал наблюдений. Это позволило Крепелину выделить устойчивые нозологические единицы — психические болезни, которые были схожи по своим симптомам у многих пациентов на протяжении веков наблюдений. Кроме того, Крепелин активно продвигал идею о возможном наследственном характере психических заболеваний. Наконец, врачам стала доступна строгая систематика и классификация патологий, что при правильном диагнозе позволяло назначать общепринятые стратегии лечения.
Здесь мы подбираемся к главному — введению в практику психиатрии новых биологических методов вмешательства. Помимо простой седации больных наркотическими препаратами, было введено несколько других довольно смелых подходов. Радикальным методом стало появление в 1930-х годах электросудорожной терапии (ЭСТ), которая хоть и напоминает пытку, но до сих пор применяется при крайне тяжелых случаях депрессии и кататонии, резистентных к лечению препаратами. В 1936 открылась черная страница в психиатрии: были введены в практику операции лоботомии и лейкотомии [1] (избирательное разрушение мозговой ткани), сломавшие жизни огромному количеству пациентов. В 1937 году стали практиковать погружение больных шизофренией в инсулиновую кому, в надежде перезагрузить их мозг. Очень рискованный метод, который в некоторых случаях и правда вызывал стойкую ремиссию, но был сопряжен с большим риском для здоровья и в итоге был изъят из практики.
Как мы видим, не все методы прошли проверку временем, однако медицина начала двигаться в правильном направлении, встав на поиск лечения заболеваний как решения чисто биологической проблемы. Сейчас, в XXI веке, психиатрия остается одной из самых бурно развивающихся областей медицины с несомненными успехами, но и со специфическими сложностями и противоречиями.
Диагностические критерии совершенствуются, диагнозы становятся всё точнее — но мы не понимаем главного: что есть психическое заболевание, откуда оно берется, где грань, отличающая здоровую психику от больной, особенности характера от патологических признаков заболевания? Лекарства всё точнее бьют в цель и дают всё меньше побочек, но сам механизм их действия большей частью остаётся загадкой.
Также психиатрия как область, связанная с человеческой личностью и характером, задает этические вопросы, немыслимые для других медицинских областей. Например, в психиатрии существует принудительное лечение пациента против его воли (потому что предполагается, что воля его парализована болезнью).
Психиатрия — не единственная такая «принудительная» отрасль медицины — так же принудительно лечат, например, и некоторых инфекционных больных.
И как именно принимать решение о принудительном лечении — тоже не всегда понятно. Скажем, если пациент сам не страдает от своего состояния и не приносит физического вреда окружающим, но приносит психологический — надо ли его принудительно госпитализировать или нет?
Наконец, психиатрия — область медицины с огромной социальной и политической нагрузкой, ведь она определяет грань нормы и ненормальности. В разное время в разных странах психическими отклонениями считались гомосексуальность и женская потребность в сексе (она называлась нимфоманией или «бешенством матки»), а оппозиционно настроенных граждан Советского Союза часто клали в психиатрические больницы с диагнозом «вялотекущая шизофрения». И наоборот: чередование периодов вдохновения и упадка, которое в европейской романтической традиции воспринималось как неотъемлемый и скорее положительный признак таланта, с точки зрения современной психиатрии выглядит как биполярное расстройство, а зацикленность на пережитом военном опыте и неумение встроиться в мирную жизнь, которое когда-то было проявлением «типично мужского характера», сейчас считается ярким симптомом посттравматического стрессового расстройства (ПТСР).
А теперь попробуем понять главное: какова же та самая биологическая природа психических расстройств, к которой наконец пришла современная психиатрия?
Что такое психика и психические заболевания
Конечно, мы (и никто на свете) не можем полноценно ответить на этот вопрос! Но мы решили хотя бы немного обрисовать азбучные истины современной нейробиологии и психиатрии, чтобы опираться на них, рассказывая о фармакологическом лечении психических расстройств.
В мозге работает несколько ключевых медиаторных систем, и почти о каждой из них у нас на «Биомолекуле» выходили большие статьи, с которыми мы советуем вам ознакомиться . Каждая из систем отвечает за некую свою область психики: от мотивации до когнитивной деятельности, от внимания до регуляции настроения, причем «зоны влияния» разных медиаторных систем пересекаются. Проблема в том, что сами эти области психики довольно сложно формализовать и четко очертить, а значит, и точно исследовать их затруднительно, а результаты всегда будут иметь широкое пространство для интерпретации.
Вот эти бесценные труды: «Дофаминовые болезни», «Серотониновые сети», «Тайны голубого пятна», «Молекула здравого ума», «Спокоен как GABA», «Очень нервное возбуждение» [2–7].
В каждой медиаторной системе есть свои нейроны, производящие медиатор (дофаминергические нейроны у дофаминовой, серотонинергические у серотониновой и так далее), свои метаболические каскады, определяющие синтез и распад этого медиатора, свой набор рецепторов к медиатору и так далее. У каждого человека и даже, возможно, у одного человека в разные периоды жизни нейромедиаторные системы имеют свои особенности: разное соотношение тех или иных рецепторов, разный уровень метаболизирования медиатора, разный состав нейромодуляторов и множество других тонкостей. В некотором смысле фингерпринт (то есть уникальный состав, подобно отпечатку пальца) нейромедиаторных систем — это биохимическая основа уникальной человеческой личности: в зависимости от того, сколько человеку «отсыпали» каких нейромедиаторов, рецепторов, ферментов, он будет более или менее тревожным, агрессивным, мотивированным и так далее. Разумеется, нельзя сводить всю уникальность индивидуальной психики к одним только медиаторам, помимо них личность определяется множеством других параметров; но вклад медиаторов, очевидно, велик.
Патогенез психических заболеваний хотя бы частично связан с нарушением работы разных медиаторных систем — временным или постоянным. При шизофрении, психозах страдает преимущественно дофаминергическая система; при депрессиях — судя по всему, серотонинергическая; при СДВГ (синдроме дефицита внимания и гиперактивности) — норадренергическая с серьезным вкладом дофаминергической и так далее. Помимо нейромедиаторных есть, конечно, и другие факторы, определяющие поломки нашей психики, но именно нейромедиаторные нарушения мы умеем хоть худо и бедно, но чинить с помощью фармакологии.
Психофармакологические препараты, их доклинические и клинические испытания
По сути, все психофармакологические препараты — это вещества, «юстирующие» работу тех или иных нейромедиаторных систем разными способами: блокируя или стимулируя различные рецепторы, влияя на обратный захват медиаторов, модулируя метаболизм медиаторов и так далее. К сожалению, пока нет таких волшебных средств, чтобы отъюстировать систему «вчистую», поправив только нужное и не затронув ничего лишнего (и это связано с тем, что мы про большинство заболеваний едва понимаем, что там вообще сломалось и значит — что надо чинить).
К тому же фармакологический поиск в психиатрии исходит из того, что можно путем воздействия на молекулярную мишень добиться улучшений в течении заболевания. Это работает в случае онкологических, аутоиммунных и многих других заболеваний, однако в случае мозга мы, видимо, имеем дело с патологией более высокого порядка — на уровне нейронных сетей и ансамблей клеток. Поэтому создание лекарств в этой области — до сих пор скорее вопрос удачи, результат проб и ошибок (в отличие от других областей медицины, где мы уже умеем филигранно разрабатывать под конкретную задачу антитела или действовать с помощью генной терапии).
Влияния на психику таких молекул часто непредсказуемы до момента собственно клинических исследований на психически больных пациентах: например, лекарство могло разрабатываться как антидепрессант, а оказывалось антипсихотиком, или разрабатывалось как антипсихотик, а оказывалось анксиолитиком. Кроме этого, для многих психотропных лекарств фармацевтический эффект показан, а механизм действия так и остается неясным.
Клиническим исследованиям посвящен отдельный спецпроект «Биомолекулы»: там рассказывается об их принципах и фазах; а также, например, почему лекарства сначала тестируют на здоровых людях и уж затем — на больных. Начните вот с этой статьи: «С миру по нитке: как соединились компоненты клинического исследования» [8].
Доклинические исследования на животных моделях, которые для других заболеваний обычно неплохо предсказывают эффект испытываемого лекарства на людях, в случае психических болезней имеют ограниченную ценность, ведь тонкая психика — это, по сути, и есть одно из главных отличий между людьми и животными, и проявление у животных «человеческих» психических нарушений не всегда возможно в принципе, а если даже оно и наблюдается — их очень трудно достоверно подтвердить и можно оценивать только по косвенным признакам: изменению социального и сексуального поведения, характерного для данных животных, уровня агрессии, обучаемости и других обобщенных характерик. Исследования обычно проводятся на грызунах, а также иногда на маленьких нечеловекообразных обезьянах, которые проще в содержании, чем шимпанзе, но обладают более сложным социальным и когнитивным поведением, чем грызуны. Существует набор тестов на животных, имитирующих симптомы того или иного психического заболевания. Такие тесты были разработаны для большого депрессивного расстройства, БАР, шизофрении, тревожного расстройства, СДВГ и так далее — подробнее читайте в статье «Трансляционная психиатрия — как моделировать психические расстройства на животных?» [9].
И о них «Биомолекула» рассказывала в отдельном спецпроекте: почитайте материал «От живого к неживому. Доклинические исследования сегодня и завтра» [10]. Ведь прежде, чем испытывать что-то на человеке, нужно хотя бы принципиально понять, может ли эта молекула лечить, а главное — не будет ли токсичной. Вот почему вряд ли когда-либо удастся полностью отказаться от исследований на животных, хотя всё больше их проводится уже на клетках («Лекарство в пробирке: доклинические исследования in vitro» [11]) или и вовсе на органах-на-чипе («Органы-на-чипе: когда технология сплетается с жизнью» [12]).
Как правило, «психически больные животные» получаются в результате индукции «болезни» определенными препаратами или в результате воздействия стресса и других внешних условий. Нам также доступно выведение линий животных, склонных к психическим расстройствам, путем селективного скрещивания или генетических манипуляций с известными нам генами психопатологий. Но и эти модели, разумеется, несовершенны.
Увы, пока что современная фармакология лечит психические проблемы не аккуратно нажимая на необходимые кнопки, а ахая со всей силы молотком по клавиатуре в приблизительно нужном месте и даже не всегда понимает, куда именно она ударила. В результате, помимо желаемых улучшений в одной психической сфере, мы можем получить серьезные нарушения в другой, а кроме того, и непсихические проблемы — метаболические, двигательные, сердечно-сосудистые. К тому же, во многих случаях хронических психических расстройств требуется длительный прием медикаментов, чтобы медиаторные нарушения не вернулись в патологическое русло, и при длительном приеме побочные действия как бы накапливаются, оказывая всё большее и большее влияние на жизнь пациента. Наконец, некоторые из препаратов, обсуждаемых в этой статье, могут вызывать наркотическую зависимость. Именно поэтому применять психофармакологические препараты самостоятельно без назначения врача, советовать их другим и вообще использовать без медицинской необходимости опасно и бессмысленно (и это дисклеймер).
А после дисклеймера мы уже готовы открыть вам чарующий мир психофармакологии. В следующих главах мы разберем психофармакологические препараты по порядку, и начнем с первых открытых лекарств — антипсихотиков.
Антипсихотики, или нейролептики
Для многих психотических заболеваний — шизофрении [13], психозов и так далее — характерно разделение симптомов на несколько групп:
- Позитивные (хотя ничего позитивного и тем более оптимистичного в них нет), при которых в психике пациента появляется что-то лишнее, обычно это психотические симптомы: галлюцинации, бред или дезорганизация мышления.
- Негативные, при которых в психике, наоборот, происходит утрата нормальных функций (эмоционального реагирования, мотивации): человек становится апатичным, снижается его мотивация к ранее привычным и понятным занятиям (например, уходу за собой).
- Отдельно описывают также когнитивные симптомы — нарушения внимания и памяти, которые хоть и не достигают той же степени тяжести, как при деменции, но всё равно ухудшают способность человека к адаптации.
- Также отдельно выделяют аффективные симптомы, но для шизофрении они мало характерны или мало влияют на течение болезни, даже если проявляются.
Непонятно, почему у больных возникают эти симптомы (мы вообще плохо понимаем патогенез психических заболеваний), зато вот уже 75 лет у нас есть оружие для борьбы с позитивными симптомами — нейролептики.
При всех своих серьезных недостатках и побочных действиях, нейролептики — это что-то вроде фармакологической волшебной палочки, позволяющей избирательно подавить позитивные симптомы психического заболевания, не выключая пациента из реальности, в отличие от опиатов, барбитуратов и других седативных средств из прошлого, которые просто «вырубали» буйных больных, погружая их в наркотический сон.
Судя по всему, позитивная симптоматика при психических расстройствах крепко связана с дофаминергической активностью (см. «базовую» статью «Дофаминовые болезни» [2]). Дофамин производится несколькими группами нейронов в мозге; к этому медиатору есть пять типов рецепторов. Почти все нейролептики «играют» именно с различными дофаминовыми рецепторами, по-разному влияя на психику и вызывая разные побочные эффекты.
Помимо дофамина, в позитивную симптоматику психических заболеваний, видимо, вносят свой вклад и другие моноамины: норадреналин и серотонин. Поскольку по своей структуре все они похожи, некоторые нейролептики затрагивают и определенные норадреналиновые и серотониновые рецепторы (таким образом, не только убирая психоз, но и влияя на тревожность и настроение). Однако и нежелательные явления от такого влияния оказываются широки. Наконец, некоторые нейролептики затрагивают холинергическую систему (и, соответственно, имеют побочки в когнитивной сфере) и гистаминовые рецепторы с соответствующими побочками.
Есть три поколения нейролептиков — типичные, атипичные и нейролептики третьего поколения. Разберем их по порядку.
Типичные нейролептики
Открытие антипсихотиков началось с разработки антигистаминных препаратов для хирургии. Группа химиков под руководством Поля Шарпантье экспериментировала с производными фенотиазина, исследуя его антигистаминные свойства в качестве предоперационного препарата. В 1949 году французский военный хирург Анри-Мари Лабори использовал прометазин, производное фенотиазина, совместно с барбитуратами для предотвращения хирургического шока, и назвал это «литическим коктейлем». Он заметил, что пациенты, которые были чрезвычайно встревожены, под действием коктейля вдруг становились спокойными, расслабленными и безразличными к окружающей обстановке, превращались в подавленных и сотрудничающих, как будто им сделали «фармакологическую лоботомию».
Исследования фенотиазинов продолжались до 1950 года, когда было разработано хлорированное производное промазина: RP-4560, позже названное хлорпромазином, которое не только обладало антигистаминными свойствами, но также несло успокоительный эффект (рис. 2). Лабори пытался убедить психиатров в терапевтическом использовании препарата в психиатрии, но никто во врачебном сообществе не хотел его слушать [14].
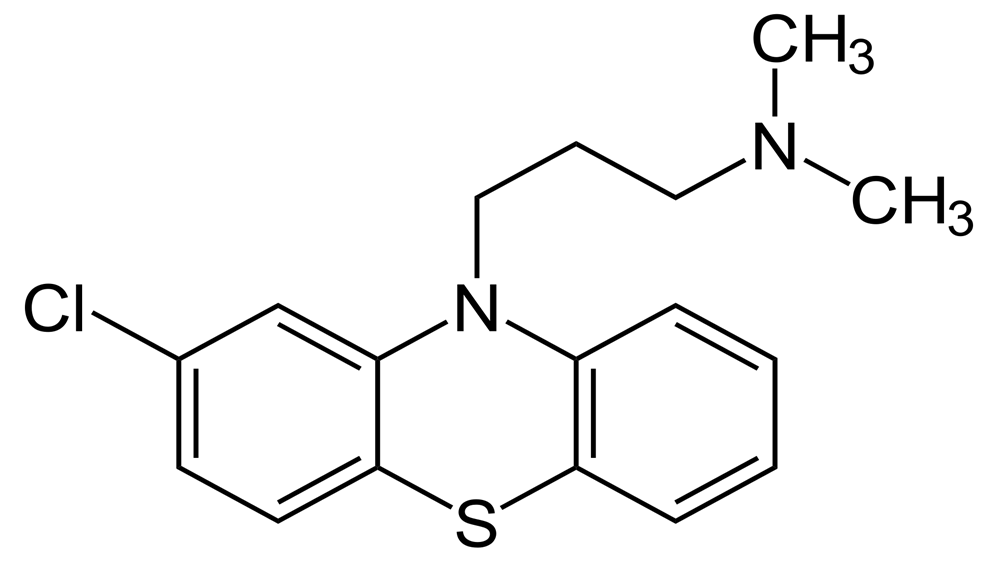
Рисунок 2. Структура хлорпромазина.

Рисунок 3. Плакат с рекламой хлорпромазина в США, под торговым названием Торазин.
British Association for Psychopharmacology: Chlorpromazine, the first antipsychotic medication: history, controversy and legacy
Наконец, психиатр Джозеф Хэммон впервые попробовал этот препарат в 1952 году на пациенте с психозом. Пациент не только вошел в ремиссию, но и смог поддерживать это состояние. Его выписали через три недели. Исследователи проигнорировали этот эффект, потому что пациент принимал другие лекарства, такие как барбитураты и опиаты, а также проходил электросудорожную терапию. В том же году Жан Деле и Пьер Деникер провели исследование на другом пациенте, используя только хлорпромазин. Терапия сопровождалась снижением двигательной активности и безразличием к окружающей действительности. Феномену дали название «нейролептический синдром» (не путать со злокачественным нейролептическим синдромом, о котором речь ниже). Слово «нейролептический» на латыни означает «то, что берет за нервы».
В 1954 году было проведено историческое исследование на психотических пациентах, которое, наконец, было рандомизированным и плацебо-контролируемым. Исследование окончательно доказало эффективность хлорпромазина. Хлорпромазин стал использоваться психиатрами по всему миру и окончательно доказал существование нейробиологической, материальной основы психических заболеваний. Первый нейролептик, да еще один из самых мощных — стопроцентное попадание (рис. 3).
Следующим появился всем известный галоперидол, который относится к бутирофенонам. Он был синтезирован в 1958 году в бельгийской лаборатории Пола Янссена. Лаборатория Янссена тогда пыталась разработать более мощный анальгетик. Галоперидол оказался слабее опиоидов как анальгетик, но после него, как и после хлорпромазина, подопытные мыши впадали в каталепсию — полный психофизический ступор, при котором люди или животные могут надолго замирать в любых, даже самых неудобных позах. Галоперидол показал еще большую эффективность борьбе с психозом и галлюцинациями, чем его предшественник [15]. Параллельно с ним появились и другие антипсихотики первого поколения — трифлуоперазин, тиоридазин и флуфеназин. Они все имели схожий с галоперидолом эффект, но обладали опасными неврологическими побочными эффектами. Дофамин, помимо психических функций, регулирует также тонкие точные движения; неаккуратная коррекция дофаминовой передачи нейролептиками эти движения нарушает и приводит к так называемому экстрапирамидному нейролептическому синдрому: подергиваниям конечностей, тремору, паркинсоноподобным нарушениям движений. Кроме этого, у многих больных типичные нейролептики, выключая позитивные психические симптомы, взамен как бы включали негативные — исчезновение интереса к жизни, депрессию, ощущение «отсутствия собственной личности»; также иногда они вызывали спутанность сознания. Наконец, на некоторых пациентов они не действовали: очевидно, у этих больных проблема была не в тех рецепторах, на которые влияли данные нейролептики.
Помимо этого, в редких случаях типичные антипсихотики могли вызвать злокачественный нейролептический синдром — лихорадку, мышечные нарушения и другие проблемы, которые иногда приводили к гибели пациента.
Атипичные нейролептики
В 1950-х появились первые трициклические антидепрессанты, о которых пойдет речь дальше. Позже было обнаружено, что некоторые из этих соединений обладают нейролептическими свойствами, но почти без побочных эффектов типичных нейролептиков. Первый такой нейролептик — клозапин — окончательно завоевал фармацевтический рынок только к 1990 году после долгих приключений, когда в клинических испытаниях у него то обнаруживались, то оказывались статистически незначимыми различные нежелательные эффекты. Вслед за клозапином появились сходные по фармакологическому действию рисперидон, оланзапин, кветиапин и зипрасидон, получившие название атипичных антипсихотиков. В целом у второго поколения антипсихотиков более щадящие побочки, чем у первого, но, к сожалению, и они иногда вызывают серьезные метаболические и эндокринные проблемы — прежде всего, «увеличение массы тела, ассоциированное с приемом АП» (antipsychotic induced weight gain, AIWG). AIWG может привести к метаболическим расстройствам, таким как дислипидемия и нарушения углеводного обмена (вплоть до диабета II типа), что, в свою очередь, увеличивает риски сердечно-сосудистых заболеваний. Длительный прием антипсихотиков может привести к повышению уровня гормона пролактина. У каких-то препаратов эти побочные эффекты выражены сильнее, у каких-то меньше, но риски присутствуют у всех.
Считается, что типичные антипсихотики прежде всего воздействуют именно на дофаминовые рецепторы. В то же время, атипичные меньше влияют на метаболизм дофамина, но больше на метаболизм серотонина и других нейротрансмиттеров.
Третье поколение антипсихотиков
В последнее, третье [16], поколение антипсихотиков стали выделять препараты, фармакологическое действие которых лежит в диапазоне «прямой D2-агонизм — обратный D2-агонизм»: так называемые «частичные агонисты дофаминовых рецепторов». Они воздействуют на дофаминовые ауторецепторы, находящиеся на пресинаптической мембране; их активация означает, что в синаптической щели так много дофамина, что его синтез и выброс надо уменьшать. Интересно, что и дофамин, и агонисты D2 имеют более высокую эффективность в этих ауторецепторах по сравнению с постсинаптическими D2-рецепторами. Это объясняет, почему поведенческая реакция на полный агонист D2 обычно двухфазна в зависимости от дозы, с торможением, наблюдаемым при низких дозах (результат стимуляции ауторецепторов), и стимуляцией при более высоких дозах (прямая постсинаптическая активация). Одним из основных механизмов, объясняющих этот двухфазный эффект, является больший резерв пресинаптических рецепторов D2 по сравнению с постсинаптическими.
Арипипразол — первый антипсихотик третьего поколения, вышедший на рынок в 2002 году; это частичный агонист D2-рецепторов с высоким сродством и низкой способностью активировать рецептор. Если по патологическим причинам внеклеточного дофамина много (например, в мезолимбических областях, вовлеченных в позитивные симптомы), арипипразол конкурирует с дофамином и вызывает частичный антагонизм, так как активирует рецепторы в меньшей степени, чем сам дофамин. И наоборот, в ситуациях, когда внеклеточные концентрации дофамина низкие, препарат может занимать дополнительные рецепторы и вызывать их частичную активацию, тем самым поддерживая баланс дофамина в норме.
В 2015 году появились модификации арипипразола брекспипразол и карипразин. Из-за ограниченного спектра рецепторов, на которые эти препараты действуют, для них характерны невысокие риски эндокринных и неврологических побочных эффектов.
Для всех антипсихотиков характерен феномен «антипсихотического порога». То есть до определенной дозировки эти препараты вызывают лишь неспецифичные седативные эффекты. Однако при блокаде дофаминергической активности на 65% уже наблюдается антипсихотическое действие. При 72% препарат начинает повышать уровень пролактина в организме, а блокада на 78% может вызвать экстрапирамидные симптомы. Получающийся диапазон в 60–80% (в зависимости от пациента) является терапевтическим окном для данных препаратов.
Что дальше?
Нейролептики, даже самые «продвинутые», всё еще очень несовершенны, и фармакологический поиск идеальных средств от психозов не прекращается. Из последних новостей упомянем препарат Cobenfy, разработанный компанией Karuna Therapeutics (приобретена BMS) для лечения шизофрении. Он воздействует не на дофаминовые, а на мускариновые ацетилхолиновые рецепторы. Препарат показал эффективность в клинических испытаниях, был одобрен и вышел на рынок в конце 2024 года.
Современная разработка антипсихотиков сейчас старается отойти от модуляции дофаминовых рецепторов. На смену им в качестве мишеней приходят соединения, действующие на глутаматные, холиновые, ГАМК -рецепторы и нейропептиды. Такие препараты пока находятся на стадии клинических и доклинических испытаний.
Теперь, разобравшись с позитивными симптомами психических заболеваний, перейдем к негативным, а точнее — к лекарствам, которые от них помогают.
Антидепрессанты
Депрессия может быть как отдельным психическим заболеванием, так и симптомом других заболеваний (например, негативным симптомом при некоторых психических расстройствах). Характеризуется она подавленностью, потерей энергии, чувством вины. В пограничных случаях депрессию сложно отличить от мрачного характера или нормальной реакции на жизненные невзгоды.
До сих пор неизвестен физиологический механизм депрессии (о его загадках у нас на сайте есть прекрасная статья «Краткая история антидепрессантов» [17]), зато известно, что почти все лекарства, помогающие от депрессии, как-то влияют на баланс моноаминовых нейромедиаторов, прежде всего серотонина. От грубейших средств, изменяющих этот баланс практически необратимо и имеющих множество опасных для жизни побочек, фармакологический поиск привел нас к филигранным антидепрессантам, которые убирают депрессию, почти ничего нужного при этом не испортив.
Перед тем, как погрузиться в изучение антидепрессантов, отметим важный момент. Антидепрессант — это не средство, на какое-то время повышающее настроение. Таких средств существует множество от каннабиса до героина, все они в той или иной степени опасны и вызывают привыкание, а главное — после прекращения их действия настроение падает еще ниже, чем было. Антидепрессант — это средство, при правильном использовании убирающее саму депрессию. Некоторое привыкание к ним возможно, но после отвыкания (иногда сопровождаемого синдромом отмены) депрессия уже не возвращается.
А теперь разберем антидепрессанты по порядку их возникновения.
Ингибиторы МАО
История антидепрессантов [17] началась совершенно случайно — всему виной чудесный успех пенициллина в годы второй мировой войны. В 1950-х годах американским химикам и фармакологам было поручено найти такое же эффективное лекарство от туберкулеза, и они начали экспериментировать с излишками ракетного топлива, оставшимися со времен войны. Два синтезированных вещества — ипрониазид и изониазид — казались многообещающими кандидатами благодаря их способности уничтожать бактерии (рис. 4). После клинических испытаний исследователи поразились, что эти лекарства еще и заметно подняли настроение подавленным туберкулезным больным. Таким образом, ипрониазид и изониазид стали основными компонентами первых антидепрессантов — ингибиторов фермента моноаминоксидазы (МАО) [18].
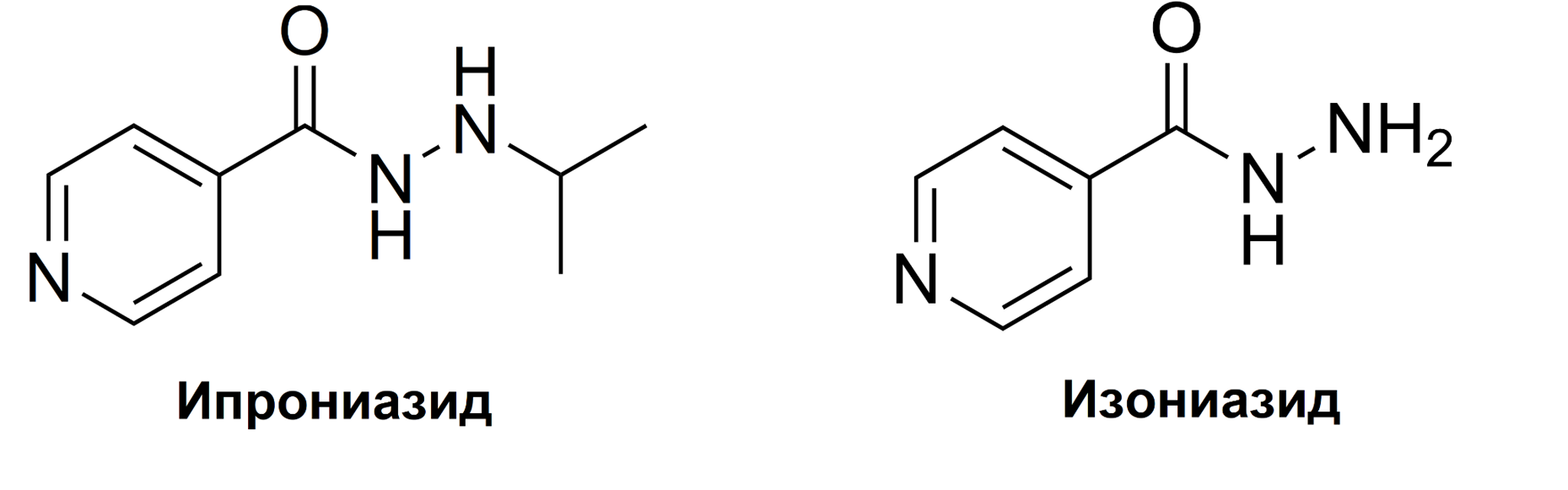
Рисунок 4. Структурные формулы ипрониазида и изониазида. Своей структурой они весьма напоминают серотонин и дофамин
«Википедия»
Объяснить фармакологический эффект этих препаратов стало возможно благодаря возникшей в 1960-х годах моноаминовой гипотезе, которая предполагает, что у пациентов с депрессией истощены концентрации моноаминов — серотонина, норадреналина и дофамина. Ипрониазид и изониазид ингибировали МАО — фермент, который эти моноамины, собственно, и разрушал. Антидепрессанты стали первым кирпичиком в доказательстве этой гипотезы. Вторым стал резерпин — алкалоид, извлеченный из растения Rauwolfia serpentina, который использовался для лечения гипертонической болезни в 1950-х годах; вскоре было обнаружено, что резерпин провоцирует депрессию у некоторых пациентов [19]. В результате ряда работ стало понятно, что резерпин ингибирует везикулярный транспортер моноаминов и, как следствие, истощает моноамины мозга [20–23]. Так основной целью при лечении депрессии стал подъем уровня моноаминов разными способами.
Впрочем, моноаминовая гипотеза не может ответить на все вопросы возникновения депрессии и требует дальнейших изысканий. Более поздние клинические исследования показали, что истощенные концентрации серотонина, норадреналина и дофамина могут быть связаны с депрессией не так прямолинейно.
Например, истощение моноаминов у здоровых людей не вызывает депрессивных симптомов [24]. Более того, истощение моноаминов или триптофана не усиливает симптомы депрессии у пациентов с большим депрессивным расстройством [25], [26]. Поэтому современное понимание моноаминовой гипотезы предполагает, что истощение моноаминов может играть скорее модуляторную роль, влияя на остальные нейробиологические системы (например, на внутриклеточную сигнализацию или другие нейротрансмиттерные и нейропептидные системы) [27].
Итак, вернемся к обнаруженным ингибиторам МАО (рис. 5) — фермента, производящего окислительное дезаминирование (то есть разрушение) производимых организмом аминов (серотонина, дофамина, адреналина и норадреналина) и похожих на них экзогенных веществ (тирамина, бензиламина и т. д.). Существует две изоформы этого фермента — МАО-А и МАО-B с разным распределением в организме.
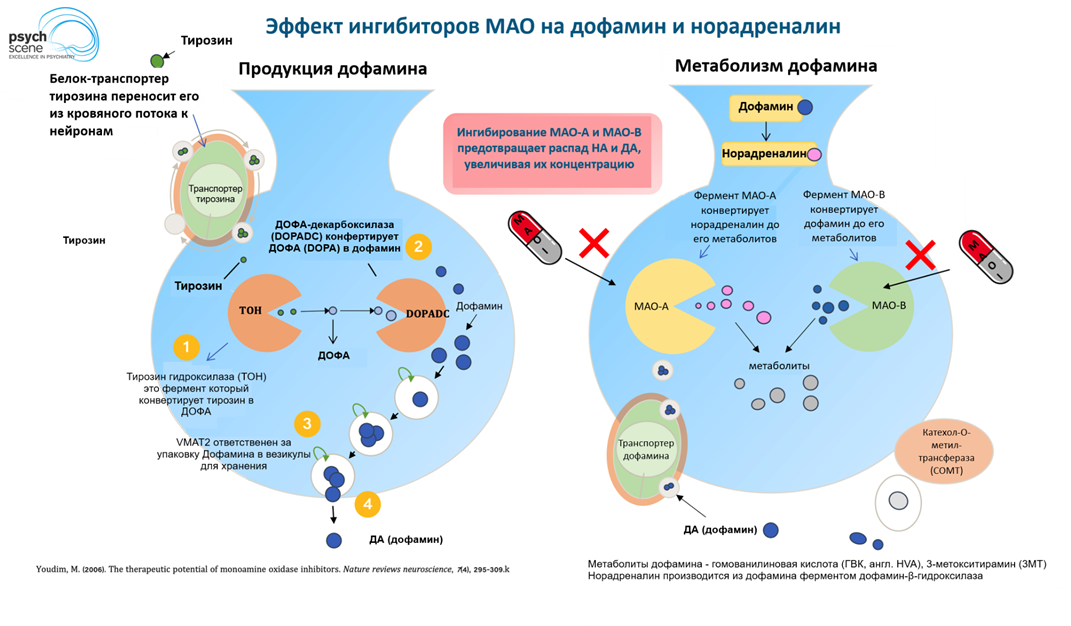
Рисунок 5. Влияние ингибиторов МАО на дофамин и норадреналин. Слева: аминокислота тирозин, получаемая с пищей, транспортируется с кровью в нейроны, где с помощью фермента тирозин-гидроксилазы конвертируется в предшественник дофамина дигидроксифенилаланин (ДОФА, англ. DOPA). Фермент ДОФА-декарбоксилаза превращает ДОФА в дофамин. Белок-транспортер VMAT2 (везикулярный переносчик моноаминов 2) пакует получившийся дофамин в везикулы. Справа: В везикулах дофамин с помощью фермента дофамин-β-гидроксилазы превращается в норадреналин. После выполнения своей функции норадреналин и дофамин будут утилизированы ферментами МАО-А и МАО-B, соответственно. Однако прием ингибиторов МАО заблокирует эти ферменты и предотвратит распад нейромедиаторов. Метаболиты распада норадреналина и дофамина утилизируются ферментом катехол-О-метилтрансферазой (англ. COMT).
МАО-А в первую очередь отвечает за дезаминирование серотонина, мелатонина, норадреналина и адреналина [30], [31]. МАО-B — за расщепление дофамина, а также синтетических психоактивных веществ фенилэтиламина и бензиламина [32], [33]. Если МАО ингибировать, в пресинаптическом пространстве увеличиваются концентрации моноаминов [32]. Ипрониазид ингибирует МАО необратимо, и это опасно, потому что он блокирует распад тирамина и норадреналина, концентрации которых повышаются и вызывают побочные эффекты (например, гипертонию). Появляется даже так называемый «сырный синдром», когда организм становится не способен переработать тирозин, который в большом количестве содержится в молочных продуктах. Из-за этого, а также других серьезных осложнений, ипрониазид в результате сняли с продажи. После этого было разработано несколько других антидепрессантов того же класса, но ингибирующих МАО деликатнее и без таких опасных побочек. Хотя они до сих пор широко используются, появилось много альтернатив — например, трициклические антидепрессанты.
Трициклические антидепрессанты
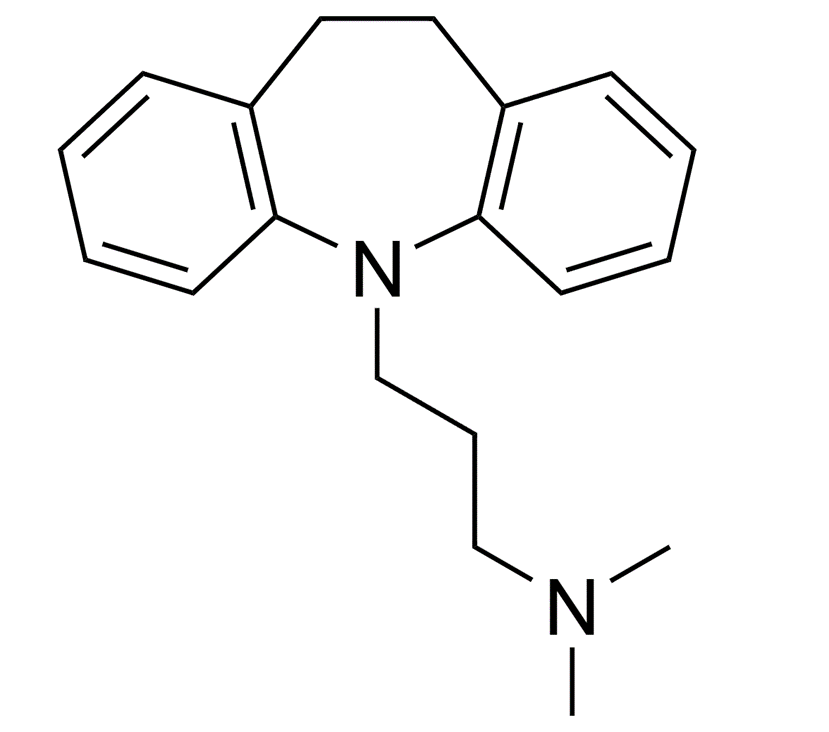
Рисунок 6. Структура имипрамина — первого трициклического антидепрессанта.
После открытия и успеха хлорпромазина для лечения шизофрении [34] продолжился поиск более мощных антипсихотических препаратов путем модификаций той же антигистаминной структуры. Наконец, в 1951 году была получена многообещающая молекула — имипрамин (рис. 6), которая после исследования на пациентах психиатрической клиники не показала антипсихотических свойств, зато сильно улучшила состояние больных с тяжелой депрессией, но без тех побочных эффектов, что сопровождали лечение ингибиторами МАО.
Имипрамин (Тофранил®) был одобрен в 1959 году Управлением по пищевым продуктам и лекарствам США (FDA) для лечения большого депрессивного расстройства. Этот препарат стал первым из класса трициклических антидепрессантов (ТЦА). Название класса ТЦА основано на молекулярном ядре из трех колец потому, что механизм действия был неизвестен на момент открытия (что отличает их от других веществ, классифицированных на основе механизма действия).
ТЦА имеют более широкий фармакологический профиль по сравнению с другими антидепрессантами. Они сильно ингибируют два транспортера обратного захвата — серотонина и норадреналина. Кроме того, ТЦА блокируют три типа рецепторов: 1) постсинаптические адренорецепторы α1 и α2; 2) постсинаптические мускариновые рецепторы; 3) постсинаптические гистаминовые рецепторы H1 [35–38] (рис. 7).
Рисунок 7. Синапс во время обратного захвата нейромедиатора белком-транспортером. Какие-то нейромедиаторы подхватываются белком для обратного захвата и повторного использования, а какие-то безвозвратно теряются и утилизируются.
иллюстрация Елены Беловой, адаптированная из «Википедии»
ТЦА безопаснее, чем ингибиторы МАО, потому что действуют обратимо и более контролируемо, однако широкий фармакологический спектр трициклических антидепрессантов делает их препаратами с сильным воздействием на ЦНС.
Считается, что именно ингибирование обратного захвата норадреналина и серотонина транспортными белками отвечает за терапевтические эффекты ТЦА и приводит к повышению концентрации норадреналина и серотонина в синаптической щели пациентов. Селективность в отношении транспортеров норадреналина или серотонина зависит от структуры соединений. Однако большинство ТЦА более селективны в отношении переносчика норадреналина, чем серотонина [36], [37]. Поскольку ТЦА — также антагонисты мускариновых, гистаминовых и адренорецепторов, с ними возможны побочки в виде головокружения, ухудшения памяти и сонливости.
Селективные ингибиторы обратного захвата серотонина
В конце 1960-х годов всё чаще начали появляться доказательства значительной роли серотонина в развитии большого депрессивного расстройства (БДР). Например, одно посмертное исследование выявило снижение концентрации серотонина у пациентов с депрессией, совершивших суицид [39]. В результате фармацевтическая компания Eli Lilly начала разрабатывать лиганды, которые селективно ингибировали бы обратный захват серотонина в переносчиках серотонина. Как следствие, они увеличивали бы концентрацию нейромедиатора в синаптической щели для дальнейшей стимуляции постсинаптических серотониновых рецепторов. Их первым успехом стал препарат флуоксетин. Первое исследование, посвященное его роли в качестве антидепрессанта, увидело свет в 1974 году [40]. Через год эти же ученые доказали, что флуоксетин является мощным и селективным ингибитором обратного захвата серотонина с относительно слабым сродством к переносчику норадреналина [41]. Эта работа выделила новую фармакологическую категорию антидепрессантов — селективных ингибиторов обратного захвата серотонина (СИОЗС) (рис. 8).
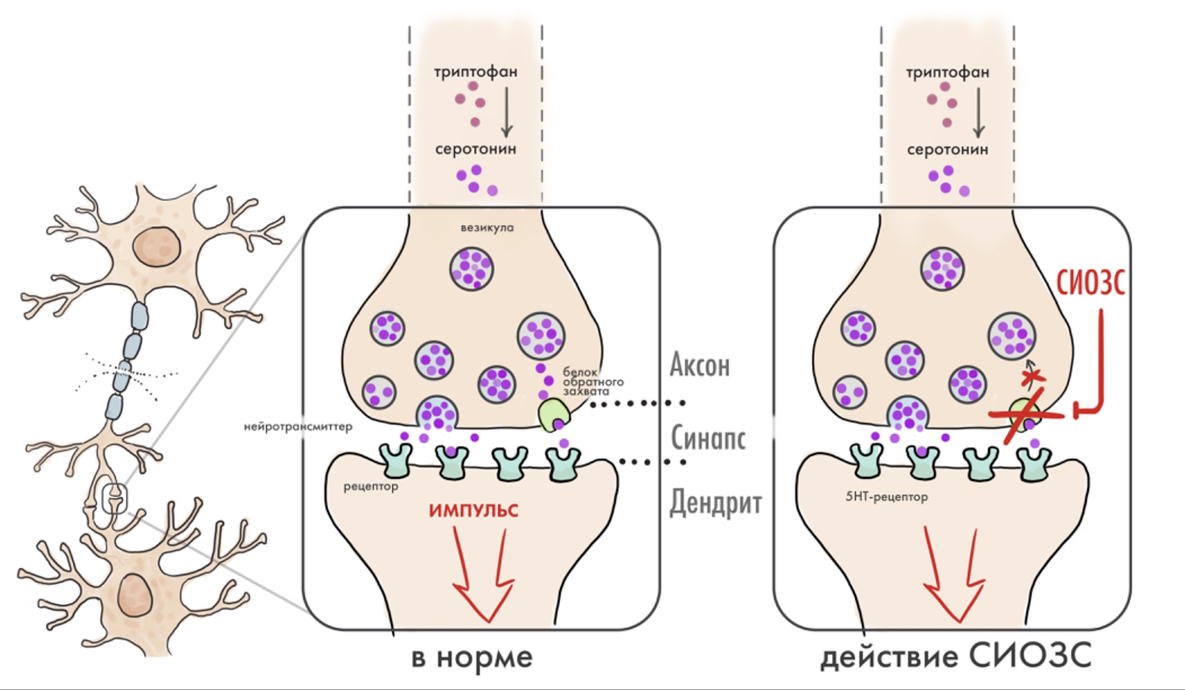
Рисунок 8. Механизм действия селективных ингибиторов обратного захвата серотонина (СИОЗС). В норме серотонин синтезируется из триптофана, пакуется в везикулы, а затем высвобождается в синаптической щели. Белок-транспортер обратного захвата серотонина возвращает нейромедиатор в пресинаптический терминал для повторного использования. Во время приема СИОЗС обратный захват блокируется, и концентрация серотонина в синаптической щели таким образом увеличивается.
иллюстрация Елены Беловой на основе Biorender
Флуоксетин был одобрен FDA в декабре 1987 года и был выпущен на рынок в январе 1988 года под торговым названием Prozac®. Да-да, тот самый Прозак, который многие американские врачи повально выписывали в 90-е годы при любом намеке на депрессию, что нашло свое отражение в кинематографе. С тех пор FDA одобрило несколько других СИОЗС — например, сертралин (Zoloft®), циталопрам (Celexa®), пароксетин (Paxil®) и эсциталопрам (Lexapro®). Эти препараты сейчас тоже на слуху у обывателей — именно с них начинается подбор терапии легких и средних форм депрессивных и тревожных расстройств в наше время.
СИОЗС оказались в 20–1500 раз более селективны в отношении ингибирования обратного захвата серотонина по сравнению с норадреналином на уровне соответствующих транспортных белков и минимально связываются с другими постсинаптическими рецепторами (адренергическими α1, α2 и β; гистаминовыми H1; мускариновыми; и дофаминовыми D2) [36].
СИОЗС (например, флуоксетин и циталопрам) также не стимулируют высвобождение серотонина или норадреналина пресинаптически. Поэтому оказывают слабое или вообще не оказывают прямого фармакологического действия на постсинаптические серотониновые рецепторы (например, 5-HT-1A, 5-HT-2A и 5-HT-2С) [36], [37]. Таким образом, увеличение активности постсинаптических серотониновых рецепторов, вызванное СИОЗС, происходит в результате повышения концентрации серотонина в синаптической щели именно из-за ингибирования его обратного захвата, а не из-за прямого связывания препарата с постсинаптическим рецептором.
Однако и тут есть своя ложка дегтя. Наиболее распространенные нежелательные эффекты СИОЗС — тошнота, головокружение, бессонница и сексуальная дисфункция. Тем не менее, многие эффекты проходят после так называемого «периода входа» — примерно через пару недель приема. Лучше всего антидепрессанты работают вкупе с психотерапией.
Селективные ингибиторы обратного захвата серотонина и норадреналина (СИОЗСН)
Очередным классом антидепрессантов стали препараты, которые селективно ингибируют обратный захват не только серотонина, но и норадреналина. Первый из них — венлафаксин — вышел на рынок США в 1993 году. Следом появились такие препараты, как дулоксетин (Cymbalta®) и милнаципран (Savella®). Все они были одобрены для лечения депрессивного расстройства.
СИОЗСН похожи на ТЦА в том, что тоже подавляют обратный захват серотонина и норадреналина белками-транспортерами этих нейромедиаторов. Однако их выгодно отличает то, что они не воздействуют ни на какие другие рецепторы. Доказательств того, что СИОЗСН эффективнее СИОЗС, пока немного. Да и нежелательные эффекты примерно такие же.
Последние исследования показали, что депрессия может быть не только результатом химического дисбаланса моноаминов в мозге, как считалось ранее. Поэтому продолжился поиск препаратов, нацеленных на другие медиаторные системы. И тут ученых осенило. Раз глутамат является основным возбуждающим нейромедиатором, в противовес тормозящей ГАМК (гамма-аминомасляной кислоте), не может ли он иногда быть причиной тревоги и депрессии? Так на сцене появились атипичные антидепрессанты.
Атипичные антидепрессанты
В попытках прицелиться в новые мишени в последние годы появляются новые атипичные антидепрессанты — гепирон (Exxua), эскетамин (Spravato), брексанолон (Zulresso), зуранолон (Zurzuvae) и декстрометорфан-бупропион (Auvelity) [33]:
- Эскетамин, один из энантиомеров кетамина. Традиционно используемый в качестве анестетика, кетамин в последние годы привлек внимание своей способностью быстро облегчать симптомы депрессии. Этот новый препарат в виде назального спрея использует уникальный механизм действия, который включает воздействие на глутаматную систему мозга. Это отличает его от традиционных антидепрессантов, которые фокусируются на серотонине. Однако он обладает рядом нежелательных явлений, таких как диссоциация, сонливость, тошнота, рвота, головокружение, апатия, тревога, летаргия, гипертония и эффект «опьянения». Одобрен FDA в 2019 году.
- Брексанолон одобрен FDA в 2019 году для лечения послеродовой депрессии, сложно излечимой формы БДР. Новый препарат вводится внутривенно и действует как положительный аллостерический модулятор рецептора ГАМК-А. Препарат уже показал высокую эффективность и стал важной вехой фармакологической помощи молодым матерям.
- Зуранолон — подобно брексанолону, это нейроактивный стероид, обладающий антидепрессантными свойствами. И он тоже был заявлен для лечения послеродовой депрессии. В отличие от предыдущего препарата, плюсом является то, что его можно принимать перорально. Отвечает за модуляцию активности синаптических и экстрасинаптических рецепторов ГАМК. Одобрен FDA в 2023 году.
- Декстрометорфан-бупропион одобрен FDA в 2022 году — двойное действие для повышенной эффективности. Декстрометорфан модулирует один из видов рецепторов глутамата — NMDA, судя по всему, вовлеченного в патогенез депрессии; в то время как бупропион действует на рецепторы норадреналина и дофамина. Эта комбинация нацелена на несколько путей, потенциально повышая эффективность и уменьшая побочные эффекты. Хотя бупропион некоторое время уже применялся как антидепрессант, его совместное использование с декстрометорфаном расширяет наше понимание атипичных антидепрессантов.
- Наконец, гепирон, вышедший на рынок в США в 2023 году, бьет по серотониновой мишени, но с другой стороны: вместо того, чтобы блокировать обратный захват серотонина, он сам по себе действует как селективный агонист серотониновых 1A рецепторов и обеспечивает быстрое облегчение симптомов депрессии. Кроме, того он оказался безопаснее многих существующих антидепрессантов, хотя в его нежелательных эффектах числится повышение частоты суицидальных намерений и серотониновая интоксикация.
Анксиолитики
Тревожность — это нормальное свойство характера, но в избыточных нездоровых количествах она может быть симптомом как отдельного тревожного расстройства, так и других психических заболеваний — некоторых видов шизофрении, обсессивно-компульсивного расстройства и так далее. Соединения, которые снижают тревожность и обладают сильным седативным действием, были доступны людям на протяжении столетий — например, это всем известные этанол, опий и каннабис — однако они вызывали настолько опасные побочки и такое тяжелое привыкание, что современное лечение тревожности обходится без них. В 1860-е для лечения тревоги стали использовать бромиды калия и натрия, а в 1903 синтезировали первые барбитураты. Почти полвека эти небезопасные и вызывающие зависимость средства были основным спасением от тревожности, пока в 1950-х годах химик Фрэнк Бергер не синтезировал мепробамат (рис. 9).
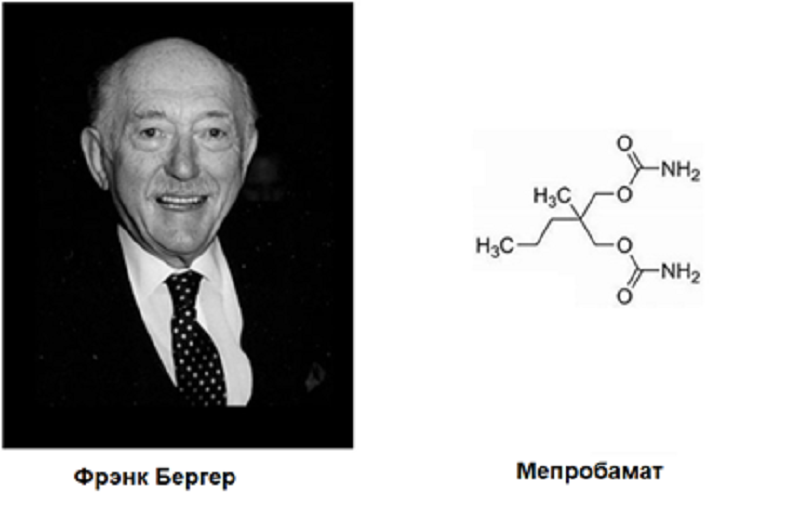
Рисунок 9. Фото Фрэнка Бергера и структура синтезированного им вещества.
При синтезе он применил направленный рациональный подход. Ранее он синтезировал миорелаксант мефенезин и рассудил, что модификации его химического ядра могут привести к усилению успокоительных свойств [37]. Мепробамат вышел на фармацевтический рынок США в 1955 году, произведя фурор и создав большой спрос. Однако быстро выяснилось, что он способен вызывать привыкание и физическую зависимость.
Другие фармацевтические компании срочно подключились к разработке своих анксиолитиков — спрос на средство от тревожности был высок. Поэтому следующим на рынок вышел хлордиазепоксид — исторически первый препарат из класса бензодиазепинов. Попал в продажу в 1959 году, почти сразу после открытия: до талидомидовой катастрофы и связанного с ней пересмотра процедуры клинических исследований от синтеза нового соединения до его выхода на рынок проходила всего пара-тройка лет.
Подробности читайте в спецпроекте «Постклинические исследования»: «Доверяй, но проверяй: как контролируют эффективность и безопасность лекарств и других продуктов после регистрации?» [42].
Затем из структуры хлордиазепоксида был синтезирован другой знаменитый транквилизатор бензодиазепинового ряда — диазепам (нашел клиническое применение в 1965 году), впоследствии даже включенный Всемирной организацией здравоохранения в список основных лекарственных средств. Однако проблемы с зависимостью от препарата и излишний седативный эффект толкали фармацевтические компании на разработку более селективных средств для ослабления тревожности.
Случались и провалы, такие как метаквалон, который был запатентован в 1962 году, а поступил в продажу в 1970-х годах (рис. 10). Выяснилось, что препарат приводит к наркотической зависимости и вообще стал популярным «наркотиком для вечеринок» из-за вызываемого легкого чувства эйфории. Это повлекло его запрет и изъятие с рынка в 1983 году.

Рисунок 10. Реклама метаквалона под торговым названием Quaalude.
Бензодиазепины, несмотря на их аддиктивные свойства, в наше время всё еще используются как анксиолитики, но уже в совокупности с антидепрессантами. Часто при тревожных расстройствах, совместно с антидепрессантами-СИОЗС прописывают прием таких бензодиазепиновых препаратов как феназепам или клоназепам. Седативное действие бензодиазепинов может быть выражено сильно (диазепам, ксанакс, феназепам и клоназепам) и слабо (медазепам, тофизопам и прочие — они также называются «дневными анксиолитиками»). Продажа этих препаратов строго контролируется, и они могут быть получены только по рецепту врача.
Обычно выделяют следующие действия анксиолитиков: противотревожное, седативное, центральное миорелаксирующее, противосудорожное (лекарства от эпилепсии), снотворное и вегетостабилизирующее (снижают высокое давление, убирают тахикардию, потливость, синдром раздраженного кишечника).
Анксиолитики бензодиазепинового ряда — агонисты ГАМК-А-рецепторов: этим и обусловлен их «тормозящий» эффект на психику. Кстати, аналогичное действие было выявлено и у наркотических барбитуратов или давно применяемых бромидов [38], [39].
Хотя бензодиазепины были разработаны и успешно выпущены на рынок для лечения тревожности, модификации их базовой структуры привели к появлению ряда препаратов для лечения эпилепсии и судорожных расстройств [40], индукции анестезии (мидазолам [41]), лечения паники (клоназепам [43]), алкогольной абстиненции и проблем сна (золпидем и залеплон [44], [45]).
Однако негативные свойства бензодиазепинов (прежде всего вызываемое ими привыкание) заставили искать анксиолитики «за пределами бензодиазепинового ядра». Первым из них стал буспирон, синтезированный в 1968 и одобренный FDA как препарат для лечения генерализованного тревожного расстройства в 1986 году. Это пример препарата, провалившегося на испытаниях как нейролептик для лечения шизофрении, но зато работавшего как анксиолитик. Препарат стимулирует серотониновые рецепторы 5-HT1А. При этом для пресинаптических рецепторов, которые ингибируют высвобождение серотонина, он является полным агонистом.
Другим признанным «атипичным» мягким транквилизатором стал препарат гидроксизин (известен в России как Атаракс или Вистарил). Изначально это антигистаминный препарат первого поколения из семейства пиперазинов, однако в наше время всё чаще используется как анксиолитик. Был открыт фармкомпанией Union Chimique Belge (UCB) в 1955–56 годах и практически сразу вышел на рынок от лица фарм-гиганта Pfizer. Применялся как антигистаминное средство дерматологами, а уже в 1960-х врачи заметили его противотревожные свойства. Гидроксизин — мощный обратный агонист гистаминовых H1-рецепторов (не блокирует их полностью, а лишь снижает активность) [46]. При этом для другого «небензодиазепинового» популярного в России препарата под торговым названием Афобазол не было установлено эффективности, которая бы подтверждалась рандомизированными двойными слепыми плацебо-контролируемыми исследованиями с достаточной выборкой.
В этом разделе мы перечислили основные и общеизвестные транквилизаторы-анксиолитики. Конечно, список веществ с противотревожными свойствами намного больше, и сейчас в разработке находится множество соединений различной природы. Большая часть из них селективно нацелена на систему ГАМК-рецепторов. Целью фармакологов является поиск противотревожного препарата, лишенного главных недостатков бензодиазепинов — снотворного эффекта и наркотической зависимости.
И надо отметить еще один важный момент. Антидепрессанты, как мы уже обсудили, в идеальном случае «излечивают» депрессию, то есть после курса лечения симптомы исчезают надолго или навсегда. Но анксиолитики — это всего лишь «скорая помощь», купирующая острый приступ тревоги и возбуждения, но не само тревожное расстройство.
Нормотимики
Отдельная группа заболеваний в психиатрии — аффективные расстройства (расстройства настроения). При них эмоции и настроение пациента неадекватны реальности. Например, при самом, пожалуй, известном заболевании этой группы — биполярном аффективном расстройстве (БАР) — у пациента без связи с окружающей действительностью чередуются фазы депрессии и мании — болезненно повышенного настроения, ускорения мышления и речи и двигательного возбуждения.
Для лечения таких расстройств есть отдельный класс лекарств — нормотимики, задача которых — стабилизировать настроение и предотвратить его резкие перепады. Эта задача может показаться интуитивно недостижимой. Можно по отдельности представить себе лекарства, которые убирают депрессию (антидепрессанты) и те, которые убирают манию (антипсихотики), но как найти средство, которое бы отменяло само переключение между этими патологиями? Неужели и само переключение между настроениями имеет молекулярные мишени для удара?
Но, как ни странно, средства, устраняющие устойчивые изменения настроения, есть, и (что совсем не странно) мы почти не понимаем молекулярные механизмы их работы. Причем многие из этих средств — очень грубые и неспецифические, имеющие широкий спектр побочек, в том числе не касающихся нервной системы. С нормотимиками связана и еще одна загадка: многие из них также действуют как антиконвульсанты и поэтому используются для лечения эпилепсии. Откуда вдруг такое странное совпадение в терапии между этими не очень близкими заболеваниями — неясно, и гипотезы, пытающиеся объяснить эту связь, пока не выдерживают серьезной критики.
Соли лития
Первым успешным классом нормотимиков стали соли щелочного металла лития. Психический эффект лития был известен еще с античных времен. Первым, кто (почти) научно доказал его эффективность, стал австралийский врач Джон Кейд в конце 1940-х. Именно он заметил симптомы маниакальной фазы у больных с нарушением работы щитовидной железы (метаболизм йода имеет сильное влияние на психику: например, гипертиреоз вызывает симптомы, напоминающие генерализованное тревожное расстройство и манию; а гипотиреоз наоборот — депрессивные симптомы). Ранее, в XIX веке, с помощью солей лития лечили подагру, которая приводит к накоплению мочевой кислоты в организме. После долгих и сейчас довольно странно выглядящих экспериментов с мочой маниакальных больных и морскими свинками Джон Кейд предположил, что причина заболевания — некая «психическая подагра» и попробовал полечить солями лития бедных животных. Животные после такого лечения не реагировали на раздражители, даже болевые, а их подвижность и аппетит значительно снизились — так Кейд установил психотропные свойства солей лития.
Тогда Джон Кейд решил и дальше испытывать на свинках разные соли лития, прежде всего карбонат. Через два часа после введения тестируемого препарата у животных наблюдалось состояние летаргии, которое исчезало еще через два часа. Теперь врач задумался о пользе солей лития для маниакальных пациентов. Вначале он по заветам Гиппократа испытал на себе цитрат лития. Испытание обошлось без последствий, хотя, конечно же, это не было доказательством его безопасности. Не мудрствуя лукаво, врач прописал 1200 мг цитрата лития в день больному мужчине в прогрессирующей на протяжении пяти лет маниакальной фазе. Мужчине стало легче буквально за пять дней, и он покинул больницу. Кейд прописал ему постоянный прием карбоната лития, так как он вызывал меньшую тошноту, чем цитрат.
Затем Кейд провел ряд испытаний на пациентах с маниакальной и депрессивной симптоматикой и меланхолической депрессией. Результаты этих исследований были опубликованы в 1949 году в The Medical Journal of Australia в статье под названием «Соли лития в лечении психотического возбуждения» [47]. Кейд даже выдвинул теорию, что маниакальное расстройство вызвано дефицитом лития в организме, что, конечно же, не подтвердилось.
Использование солей лития в психиатрии было отодвинуто до конца 1960-х годов из-за успеха нейролептиков и антидепрессантов. Несмотря на то, что многие психиатры стали бороться за их одобрение с органами здравоохранения, препарат лития был впервые одобрен FDA лишь в 1970 году, показав преимущество для маниакальных больных перед хлорпромазином [48].
Механизм действия солей лития на нервную систему весьма обширен и сложен. В первую очередь, литий — это антагонист натриевых каналов [49], из-за чего ухудшается нервная проводимость в нервных и мышечных клетках — отсюда мышечная слабость. Литий также влияет на метаболизм и транспорт некоторых моноаминов (серотонин, норадреналин). Еще он может блокировать активность ферментов, участвующих в синтезе инозитола — вещества, регулирующего чувствительность нейронов.
В основе лечения препаратами лития биполярных расстройств также лежит их свойство относительно селективно ингибировать киназу 3 гликогенсинтетазы (GSK-3) — важный фермент для модуляции психической активности.
Как итог: соли лития действительно помогают больным с биполярным аффективным расстройством, если принимать их на постоянной основе. Эффективность лития для лечения хронической депрессии не была доказана. Нежелательные явления — тошнота, боли в желудке и диарея. Кроме того, наблюдаются расстройства со стороны ЦНС в виде тремора, астении, головокружения и депрессии. Применение препаратов лития также ассоциировано со снижением почечной функции, развитием гипотиреоза (нарушения выработки гормонов щитовидной железы) и гиперкальциемии (повышением концентрации ионов кальция в крови). Вследствие чего перед их применением и после начала приема необходимо проходить обследование состояния щитовидной железы и уровня гормонов. Поэтому препараты лития выписываются пациентам с большой осторожностью.
Вальпроевая кислота и ее соли
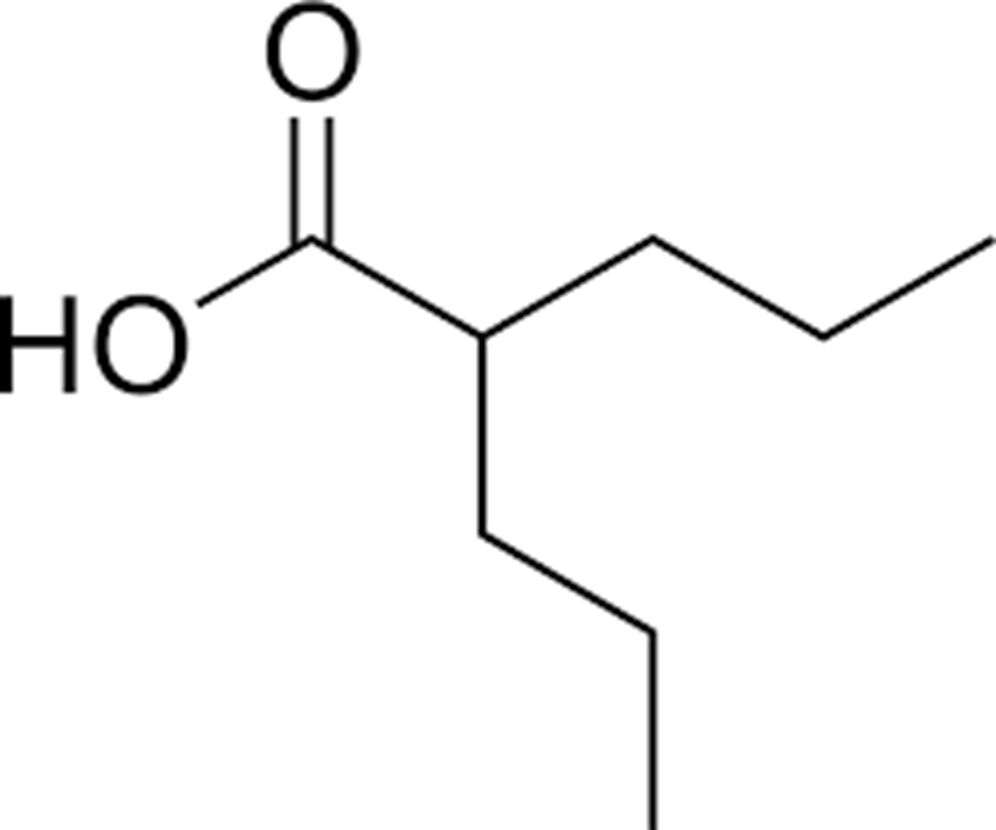
Рисунок 11. Вальпроевая кислота.
Вальпроевая кислота (рис. 11) — 2-пропилвалериановая кислота — была впервые синтезирована в 1881 году, но не находила фармакологического применения из-за того, что плохо растворяется в воде; но хорошо — в жирной среде, и поэтому использовалась как промышленный органический растворитель. После Второй мировой войны ее стали применять как растворитель для лекарств. Это и стало ключом к открытию ее фармацевтических свойств.
В 1963 году Джордж Карраз и его коллеги изучали противосудорожную активность производных спазмолитика келлина. Неожиданно они обнаружили, что активность у исследуемого состава есть, но она не связана с дозировками келлина. Оказалось, что всё дело в вальпроевой кислоте, в которой его растворяли. После того, как Карраз и члены его команды узнали, что вальпроевая кислота обладает противоэпилептическим эффектом, они синтезировали вальпромид (Depamide®) и вальпроат натрия, производные вальпроевой кислоты.
Ряд исследований показал пользу вальпроевой кислоты для лечения не только эпилепсии [50], но и биполярного расстройства. В итоге популярность набрали препараты из вальпроевой кислоты, вальпроата натрия и их смеси (дивалпроекс натрия). Препараты стали доступны в Европе с конца 60-х и начала 70-х годов, а в 1983 г. вальпроат был одобрен в США. Рост популярности производных вальпроевой кислоты для лечения расстройств настроения совпал с введением в практику солей лития. Количество назначений производных вальпроевой кислоты росло вплоть до 1990-х, а затем стало снижаться из-за появления атипичных антидепрессантов и антипсихотиков.
Существует ряд гипотез о механизме действия вальпроевой кислоты. В чем-то он похож на действие солей лития, например через воздействие на потенциал-зависимые натриевые каналы. Кроме того, есть исследования, доказывающие действие солей вальпроевой кислоты на ГАМК-А рецепторы, либо на ферменты, утилизирующие ГАМК [51].
Вальпроевая кислота — сильный тератоген (то есть вызывает пороки развития плода), поэтому беременным и даже просто женщинам детородного возраста назначается лишь тогда, когда все остальные возможности терапии уже исчерпаны.
Производные карбамазепина
Карбамазепин — трициклическое противосудорожное соединение — был разработан в конце 1950-х годов в лабораториях компании JR Geigy в Базеле. Его эффективность для лечения эпилепсии и седативные свойства были доказаны рядом исследований в 1960-х годах [51].
Впервые карбамазепин стал применяться в Японии (рис. 12) для лечения биполярного расстройства из-за нехватки в больницах солей лития. Доктора Такэдзаки и Ханаока сообщили о эффективности карбамазепина для лечения биполярного расстройства в статье, опубликованной на английском языке в 1971 году [52]. Преимущества карбамазепина в лечении биполярного аффективного расстройства продолжили изучать и другие японские врачи, такие как Теруо Окума [53].

Рисунок 12. Реклама использования карбамазепина в лечении биполярного расстройства со страниц японской медицинской прессы 1970-х годов.
Другой препарат из этого класса — окскарбазепин — тоже был синтезирован в 1960-х годах, однако был одобрен к применению в разных странах только в 1990–2000-е годы. От карбамазепина он структурно отличается только наличием дополнительного атома кислорода. В некоторых тестах показал даже чуть большую эффективность, чем у предшественника, однако тут необходимы дополнительные клинические испытания. Механизм действия производных карбамазепина не изучен до конца, но уже известно, что их эффекты обусловлены в том числе блокированием натриевых каналов в нейронах ЦНС.
Другие противосудорожные и антипсихотические нормотимики
Здесь следует отметить ряд других важных препаратов-нормотимиков.
- Ламотриджин — гетероциклическое соединение, синтезированное в начале 1980-х годов в Wellcome Research Laboratories в рамках программы по разработке новых противоэпилептических средств. Был окончательно одобрен FDA в 1994 году как лекарство от эпилепсии. Врачи также отметили, что препарат улучшает настроение и коммуникативные навыки у проходящих лечение пациентов с эпилепсией. За период 1990-х годов была доказана его эффективность при лечении биполярного расстройства. Наконец, было подтверждено, что комбинация лития и ламотриджина безопасна и полезна при рефрактерной биполярной депрессии. Ламотриджин селективно связывает и ингибирует потенциал-чувствительные натриевые каналы, стабилизируя пресинаптические нейронные мембраны и ингибируя пресинаптическое высвобождение глутамата и аспартата. Однако до конца механизм его действия не изучен. Также существует теория, что ламотриджин может взаимодействовать с потенциал-чувствительные кальциевыми каналами, что приводит к его широкому спектру активности.
- Габапентин был одним из первых противоэпилептических препаратов третьего поколения, который изучался при биполярном расстройстве, для лечения мании. По строению сходен с молекулой ГАМК (GABA) [6] — отсюда и название. Однако исследования не показывают его существенного влияния на ГАМК-систему. По имеющимся данным, габапентин — это блокатор кальциевых каналов с рядом побочных влияний на ЦНС, в результате чего применяется и для лечения нейропатической боли.
- Топирамат был открыт в 1979 году. Первоначально он был синтезирован как гипогликемическое средство (снижающее уровень глюкозы). Фактически, топирамат — это сахар, производное фруктозы. Узнав, что его потенциальная эффективность при диабете ограничена, исследователи изучили топирамат на моделях животных с различными заболеваниями и доказали его противосудорожную эффективность на крысах. Эффективность в качестве нормотимика пока вызывает вопросы.
- Блокаторы кальциевых каналов. Открытые в 1960-х годах, такие препараты как верапамил, нифедипин, нимодипин и их последующие производные могут применяться в качестве альтернативной терапии биполярного расстройства и эпилептических припадков.
Уникальные биохимические свойства атипичных антипсихотиков, о которых рассказывалось выше (клозапин, оланзапин, рисперидон, кветиапин, зипразидон, арипипразол, азенапин и карипразин), также позволили использовать их в качестве стабилизаторов настроения. Их стали применять в этом направлении благодаря способности антагонизировать дофаминовые рецепторы, а также воздействовать на многие системы нейротрансмиттеров [54]. Поэтому оланзапин и кветиапин уже стали «классикой жанра» при биполярном расстройстве.
Психостимуляторы
Это вещества, которые усиливают психическую активность — концентрируют внимание, снимают усталость, рассеивают апатию, повышают мотивацию и настроение. Звучит очень подозрительно, и не зря: большинство стимуляторов — небезобидные вещества, вызывающие психологическую зависимость и имеющие серьезные побочки. Некоторые из веществ, ранее использовавшихся как стимуляторы, ныне считаются наркотиками, а другие находятся буквально на грани получения этого статуса. Стимуляторы обычно влияют на метаболизм катехоламинов (дофамина и норадреналина). Используются они для концентрации внимания при СДВГ, для снятия патологической сонливости при нарколепсии, а также для корректировки негативных симптомов типа апатии при некоторых психических расстройствах (например, шизофрении).
Исторически первым современным психостимулятором был ныне запрещенный как наркотик амфетамин, ингибирующий обратный захват катехоламинов. Изначально он использовался как сосудосуживающее средство (например, для снятия заложенности носа), но быстро переквалифицировался в психостимулятор — лекарство от нарколепсии; депрессии; средство, снижающее аппетит; и даже как препарат для лечения болезни Паркинсона. Почти сразу же он начал использоваться как рекреационный наркотик, а вскоре обнаружились его опасные побочные действия: амфетамин нарушает сон, может вызвать беспокойство вплоть до панических атак, а также психоз, очень похожий на шизофренический. Во время Второй мировой войны амфетамин и его производные использовались в армиях разных стран, чтобы улучшить выносливость бойцов (с тяжелыми для них последствиями). Постепенно амфетамин «изгнали из приличного общества» и перестали использовать в медицинских целях, хотя некоторые его производные под серьезным контролем до сих пор используются для лечения СДВГ и нарколепсии в некоторых странах [55]. Например, декс- и лиздексамфетамин (Dexedrine и Elvanse, соответственно) успешно уменьшают симптомы СДВГ у детей и взрослых.
Вообще, с СДВГ и его лечением сложилась сложная ситуация: начиная от популярности диагноза в социальных сетях и заканчивая сложностями диагностики ввиду недостатка знаний у специалистов. Несмотря на это, СДВГ остается реальной проблемой для десятков тысяч детей и взрослых по всему миру, и там, где не срабатывают педагогические и психотерапевтические способы, на помощь приходят лекарства.
Сходный с амфетаминами механизм действия имеет еще одно средство от СДВГ и нарколепсии — риталин (метилфенидат): он ингибирует обратный захват катехоламинов. Проблемы с ним похожие: эйфория, психологическая зависимость, нарушения сна и аппетита. В некоторых странах (в том числе в России) он запрещен как наркотик, в других (в том числе в США, некоторых европейских странах) разрешен для ограниченного применения и относительно широко используется в том числе для лечения детей.
Наконец, еще одно средство от СДВГ, которое формально иногда не относят к психостимуляторам, — атомоксетин (в России продается под этим названием, а в других странах — под разными торговыми наименованиями, самое распространенное из которых — Страттера). Это ингибитор обратного захвата норадреналина, который также, судя по всему, задевает метаболизм дофамина, серотонина и ГАМК. В отличие от риталина и тем более амфетаминов, атомоксетин, судя по всему, не вызывает зависимости, а также имеет более щадящие побочки.
Наконец, стимулятором можно назвать и всем известный кофеин, который мы потребляем с кофе и чаем [56]. Кофеин блокирует пуриновые рецепторы семейства А1 и A2A, которые реагируют на накопившийся аденозин [57–59]. Поскольку аденозин образуется из АТФ при отрезании всех ее фосфатных энергетических «хвостиков» и в некотором смысле свидетельствует об энергетическом истощении клетки, можно условно назвать пуриновые рецепторы «рецепторами усталости» (хотя этим, конечно, их роль не ограничивается). А кофеин, блокируя рецепторы, не дает клетке «осознать» эту усталость. При повышении дозировки кофеин также начинает антагонизировать рецепторы ГАМК-А.
Также в последнее время наметился рост интереса к исследованию производного амфетамина — MDMA — для лечения ПТСР. В 2024 году компания Lykos подала заявку на одобрение по этому показанию в FDA, однако получила отказ: FDA не устроило, что в исследование включались пациенты, имевшие опыт использования MDMA, а значит, полного ослепления добиться не удалось. Компания собирается повторить заявку.
Ноотропы и другие фуфломицины
Помимо вышеперечисленных препаратов, на рынке РФ и некоторых других стран существует бессчётное множество так называемых ноотропов: лекарств, которые должны улучшать когнитивные способности. Однако ни в одном достоверном исследовании не было показано достаточно эффектов от ноотропов. При этом, некоторые ноотропы — небезобидные средства, которые могут принести человеку вред, не принеся пользы. Поэтому ни один из них мы здесь разбирать не будем, а вам не советуем их пробовать. Кроме того, в России в качестве успокаивающего, слабого противотревожного и антидепрессивного средства популярен глицин, для которого также не существует надежных доказательств эффективности.
Заключение
За три четверти века, минувшие с открытия хлорпромазина, психонейрофармакология прошла большой путь и подобрала эффективные препараты для терапии многих заболеваний, в результате чего большинство пациентов были переведены из психиатрических клиник на амбулаторное лечение.
Вскоре на смену эйфории, сопровождавшей эру Прозака, пришло осознание того, что каждое новое поколение препаратов демонстрирует все более незначительные преимущества в эффективности по сравнению со старыми. За последние два десятилетия новых психотропных препаратов появлялось всё меньше из-за перенасыщения рынка, роста затрат на исследования и большого притока различных дженериков. Мы стали свидетелями существенного упадка энтузиазма у фармкомпаний. Многие из них отказались от разработки психотропных препаратов. Это заставило ученых переосмыслить подход к изучению, искать новые мишени и механизмы, а также пересмотреть дизайн клинических и доклинических испытаний. Прогресс замедлился, но не остановился.
Большой проблемой всё еще является отношение пациентов к лечению. Многие психические заболевания требуют пожизненного лечения, в то время как многие больные даже не могут осознать у себя наличие болезни и необходимости ее лечить. Поэтому в последнее время внимание фармкомпаний привлекли инъекционные формы препаратов длительного действия, которые будут вводиться под присмотром врача.
Конечно, остается множество других проблем. Среди огромного числа населения планеты грамотность в вопросах психического здоровья находится в зачаточном состоянии, а медицинские услуги для многих недоступны. Новые эффективные средства после выхода на рынок стоят дорого и не доступны широкому потребителю. Но рано или поздно и они станут не дороже аспирина.
В заключение хочется сказать, что развитие препаратов в психиатрии — это достижение, сопоставимое с открытием антибиотиков. Пускай эти лекарства не так часто спасали жизнь, как пенициллин, но зато многие люди смогли сохранить спокойствие и рассудок назло любому безумию вокруг.
Литература
- Эгаш Мониш: премия за убийство Макмерфи;
- Дофаминовые болезни;
- Серотониновые сети;
- Тайны голубого пятна;
- Молекула здравого ума;
- Спокоен как GABA;
- Очень нервное возбуждение;
- С миру по нитке: как соединились компоненты клинического исследования;
- Трансляционная психиатрия — как моделировать психические расстройства на животных?;
- От живого к неживому. Доклинические исследования сегодня и завтра;
- Лекарство в пробирке: доклинические исследования in vitro;
- Органы-на-чипе: когда технология сплетается с жизнью;
- Болезнь потерянных связей;
- Francisco López-Muñoz, Cecilio Alamo, Eduardo cuenca, Winston Shen, Patrick Clervoy, Gabriel Rubio. (2005). History of the Discovery and Clinical Introduction of Chlorpromazine. Annals of Clinical Psychiatry. 17, 113-135;
- Bernard Granger, Simona Albu. (2005). The Haloperidol Story. Annals of Clinical Psychiatry. 17, 137-140;
- Richard Mailman, Vishakantha Murthy. (2010). Third Generation Antipsychotic Drugs: Partial Agonism or Receptor Functional Selectivity?. CPD. 16, 488-501;
- Краткая история антидепрессантов;
- Молекулярные маркеры самоубийства;
- John C. Muller. (1955). DEPRESSION AND ANXIETY OCCURRING DURING RAUWOLFIA THERAPY. JAMA. 159, 836;
- Kirshner N. (1962). Uptake of catecholamines by a particulate fraction of the adrenal medulla. Science. 135, 107–108;
- Parkhurst A. Shore, Alfred Pletscher, Edward G. Tomich, Arvid Carlsson, Ronald Kuntzman, Bernard B. Brodie. (1957). ROLE OF BRAIN SEROTONIN IN RESERPINE ACTION. Annals of the New York Academy of Sciences. 66, 609-617;
- W. H. Newhouse. (1955). Compositional Lineation and Its Relation to Complex Folding. Science. 122, 284-284;
- Weiner N. (1972). Modification of Norepinephrine Synthesis in Intact Tissue by Drugs and during Shor-term Adrenergic Nerve Stimulation. Pharmacological Reviews. 24, 203–221;
- Ronald M. Salomon, Helen L. Miller, John H. Krystal, George R. Heninger, Dennis S. Charney. (1997). Lack of behavioral effects of monoamine depletion in healthy subjects. Biological Psychiatry. 41, 58-64;
- Robert M Berman, Gerard Sanacora, Amit Anand, Lisa M Roach, Madonna K Fasula, et. al.. (2002). Monoamine depletion in unmedicated depressed subjects. Biological Psychiatry. 51, 469-473;
- Pedro L. Delgado. (1994). Serotonin and the Neurobiology of Depression. Arch Gen Psychiatry. 51, 865;
- Charney D. S. (1998). Monoamine dysfunction and the pathophysiology and treatment of depression. Journal of Clinical Psychiatry. 59, 11–14;
- Joanna Moncrieff, Ruth E. Cooper, Tom Stockmann, Simone Amendola, Michael P. Hengartner, Mark A. Horowitz. (2023). The serotonin theory of depression: a systematic umbrella review of the evidence. Mol Psychiatry. 28, 3243-3256;
- Sameer Jauhar, Danilo Arnone, David S. Baldwin, Michael Bloomfield, Michael Browning, et. al.. (2023). A leaky umbrella has little value: evidence clearly indicates the serotonin system is implicated in depression. Mol Psychiatry. 28, 3149-3152;
- G. Heninger, P. Delgado, D. Charney. (1996). The Revised Monoamine Theory of Depression: A Modulatory Role for Monoamines, Based on New Findings From Monoamine Depletion Experiments in Humans. Pharmacopsychiatry. 29, 2-11;
- E Billett. (2004). Monoamine Oxidase (MAO) in Human Peripheral Tissues. NeuroToxicology. 25, 139-148;
- Kenneth I. Shulman, Nathan Herrmann, Scott E. Walker. (2013). Current Place of Monoamine Oxidase Inhibitors in the Treatment of Depression. CNS Drugs. 27, 789-797;
- Iain C. Campbell, Paul J. Marangos, Alexandra Parma, Nancy A. Garrick, Dennis L. Murphy. (1982). Localization of monoamine oxidases A and B in primate brains relative to neuron-specific and non-neuronal enolases. Neurochem Res. 7, 657-666;
- Шизофрения и гены: поиск иголки в стоге сена;
- Bernadette Cusack, Albert Nelson, Elliott Richelson. (1994). Binding of antidepressants to human brain receptors: focus on newer generation compounds. Psychopharmacology. 114, 559-565;
- Owens M. J. (1997). Neurotransmitter receptor and transporter binding profile of antidepressants and their metabolites. Journal of Pharmacology and Experimental Therapeutics. 283, 1305–1322;
- Connie Sánchez, John Hyttel. (1999). . Cellular and Molecular Neurobiology. 19, 467-489;
- S.Neil Vaishnavi, Charles B Nemeroff, Susan J Plott, Srinivas G Rao, Jay Kranzler, Michael J Owens. (2004). Milnacipran: a comparative analysis of human monoamine uptake and transporter binding affinity. Biological Psychiatry. 55, 320-322;
- David Murray Shaw, Francis E. Camps, Eric G. Eccleston. (1967). 5-Hydroxytryptamine in the Hind-Brain of Depressive Suicides. Br J Psychiatry. 113, 1407-1411;
- David T. Wong, Jong S. Horng, Frank P. Bymaster, Kenneth L. Hauser, Bryan B. Molloy. (1974). A selective inhibitor of serotonin uptake: Lilly 110140, 3-(p-Trifluoromethylphenoxy)-n-methyl-3-phenylpropylamine. Life Sciences. 15, 471-479;
- Wong D. T.(1975). A new selective inhibitor for uptake of serotonin into synaptosomes of rat brain: 3-(p-trifluoromethylphenoxy). N-methyl-3-phenylpropylamine. Journal of Pharmacology and Experimental Therapeutics. — 193, 804–811;
- Доверяй, но проверяй: как контролируют эффективность и безопасность лекарств и других продуктов после регистрации?;
- Richard B. Rothman, Michael H. Baumann, Christina M. Dersch, Dana V. Romero, Kenner C. Rice, et. al.. (2001). Amphetamine-type central nervous system stimulants release norepinephrine more potently than they release dopamine and serotonin. Synapse. 39, 32-41;
- F. M. BERGER. (1947). THE MODE OF ACTION OF MYANESIN. British Journal of Pharmacology and Chemotherapy. 2, 241-250;
- Phil Skolnik, Steven M. Paul, Jefferey L. Barker. (1980). Pentobarbital potentiates GABA-enhanced [3H]-diazepam binding to benzodiazepine receptors. European Journal of Pharmacology. 65, 125-127;
- MM Lo, SH Snyder. (1983). Two distinct solubilized benzodiazepine receptors: differential modulation by ions. J. Neurosci.. 3, 2270-2279;
- J.W. Dundee, N.J. Halliday, K.W. Harper, R.N. Brogden. (1984). Midazolam A Review of its Pharmacological Properties and Therapeutic Use. Drugs. 28, 519-543;
- Davidson J. R. T. (1997). Use of benzodiazepines in panic disorder. Journal of Clinical Psychiatry. 58, 26–31;
- О чем не знал Гальвани: пространственная структура натриевого канала;
- Эпилепсия, методы ее лечения и роль вальпроевой кислоты в терапии заболевания;
- Jeffrey M. Witkin, Lalit K. Golani, Jodi L. Smith. (2021). New and Emerging Antiepileptic Drugs. Burger's Medicinal Chemistry and Drug Discovery. 1-30;
- Ed Day, Chris Daly. (2022). Clinical management of the alcohol withdrawal syndrome. Addiction. 117, 804-814;
- D.J. Sanger, G. Perrault, E. Morel, D. Joly, B. Zivkovic. (1987). The behavioral profile of zolpidem, a novel hypnotic drug of imidazopyridine structure. Physiology & Behavior. 41, 235-240;
- Bernard Beer, John R. Ieni, Wen‐Hui Wu, Donald Clody, Peter Amorusi, et. al.. (1994). A Placebo‐Controlled Evaluation of Single, Escalating Doses of CL 284,846, a Non‐Benzodiazepine Hypnotic. The Journal of Clinical Pharma. 34, 335-344;
- Дивный новый мир психоделической терапии;
- Влияние кофеина;
- Giuseppe Guaiana, Corrado Barbui, Andrea Cipriani. (2010). Hydroxyzine for generalised anxiety disorder. Cochrane Database of Systematic Reviews;
- Аденозиновые рецепторы: история великого обмана;
- Вторая жизнь АТФ: от главной батарейки до нейромедиатора.