Медицина и эпигеном
17 июня 2022
Медицина и эпигеном
- 3469
- 0
- 12
Некоторые генетические болезни затрагивают не кодирующие последовательности генов, а некодирующие участки ДНК (например, энхансеры) — и таким образом становятся уже эпигенетическими. Примеры энхансеропатии — синдром Прадера–Вилли, при котором теряется один из энхансеров, или бета-талассемия, при которой утрачивается несколько регуляторов.
Рисунок в оригинальном разрешении.
иллюстрация Михаила Гурьева
-
Автор
-
Редакторы
-
Рецензенты
-
Иллюстратор
Темы
Эпигенетика регулирует экспрессию генов, а, следовательно, ее нарушения ведут к дерегуляции и часто — к болезням. Эти заболевания (назовем их эпигенетическими) имеют как генетическую основу (например, мутации в хроматиновых белках и делеции энхансеров), так и идут от эпигенетики напрямую (например, когда меняются модификации гистонов). Это как редкие генетические синдромы, так и куда более распространенные болезни — такие как нейродегенеративные и рак. В завершении спецпроекта по Эпигенетике поговорим о том, как эта, казалось бы, достаточно абстрактная тема непосредственно влияет на здоровье.
Эпигенетика
Эпигенетика — с одной стороны, молодая и бурно развивающаяся наука. С другой стороны, в этой науке уже сложился фундамент основных понятий и концепций. Цель спецпроекта — рассказать об основных концепциях эпигенетики просто, но в то же время со всех сторон. Читатель узнает, какие молекулы и структуры стоят за передачей наследственной информацией и какими механизмами осуществляется эта передача. Часть контента позаимствована из блога автора Friends of Chromatin.

Генеральный партнер спецпроекта — компания «Диаэм».
Это крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Партнер этой статьи — компания «Химэксперт», официальный дистрибьютор известного во всем мире производителя реагентов и оборудования для генетических исследований QIAGEN. Компания QIAGEN также известна как разработчик технологий амплификации ДНК и массового параллельного секвенирования. QIAGEN активно развивает технологии удобного и автоматизированного секвенирования ДНК для определения родства, этногеографического происхождения, фенотипических характеристик, а также секвенирования митохондриальной ДНК и анализа статуса метилирования ДНК для определения тканевой принадлежности образца и предположения возраста человека по его биологическому образцу.
Уинстон Черчилль — знаменитый премьер-министр, управлявший Великобританией в середине XX века — на закате своей карьеры перенес два инсульта. После первого он стал жаловаться на «туман в глазах», из-за чего врач поставил ему диагноз «спазм мозговых сосудов». Однако многие современники полагают, что у Черчилля в возрасте 76 лет развилась болезнь Альцгеймера, которая, хотя и была описана еще в 1907 году, в те времена крайне редко фигурировала в диагнозах.
Сегодня нейродегенеративные заболевания — серьезная общественная проблема, по некоторым оценкам затрагивающая до 50 миллионов людей по всему миру; и считается, что это число удвоится в течение ближайших 20–30 лет по мере старения населения. Есть мнение, что эти болезни не беспокоили человечество до «суетного» 20 века; но в действительности они, вероятно, были всегда, просто в последнее время стремительно возрастает их значимость по мере того, как человечество справляется с сердечно-сосудистыми заболеваниями и раком. И, несмотря на огромные затрачиваемые на борьбу ресурсы, медицина перед нейродегенеративными заболеваниями фактически бессильна [1–3].
Болезнь Альцгеймера с поздним началом проявляется после 65 лет. Это самая распространенная форма деменции, характеризующаяся, в частности, накоплением в мозге амилоидных бляшек, сопровождающим разрушение нейронов [4], [5]. Сначала исследователи с энтузиазмом бросились бороться с этими бляшками, но лекарства против них прямо-таки с треском провалились в клинических испытаниях [6]. Похоже, что бета-амилоид, формирующий бляшки при болезни, не самая правильная мишень для терапии [2]. Следовательно, нужно искать другие механизмы (возможно, предшествующие образованию бляшек), на которые стоило бы нацелиться.
Несколько исследований сконцентрировались на эпигенетических изменениях при нейродегенерации и зафиксировали сопутствующие изменения метилирования и ацетилирования гистонов. Некоторые ученые полагают, что прицел на эпигенетику может помочь вылечить болезнь Альцгеймера [7]! Так, в мышах ингибирование гистон-деацетилаз показало многообещающие результаты: например, вальпроат уменьшил количество амилоида, количество бляшек и поведенческие отклонения в мышиной модели болезни Альцгеймера [8–10]. Однако проблема в том, что эти ингибиторы часто неспецифичны и могут повлиять на нейропротективные механизмы, завязанные на гистон-деацетилазы.
Несмотря на это, эпигенетическая тема продолжает активно исследоваться. Сравнение образцов мозга пациентов с болезнью Альцгеймера и без нее показало, что гены некоторых белков, навешивающих ацетильные группы на H3K9 и H3K27, экспрессируются больше при болезни Альцгеймера, а ацетилирование самих гистонов повышено [7]. А если заменить гистоны на мутантные формы с метионином в позициях H3K9 и H3K27 в мухах с моделью болезни Альцгеймера, то такие мутантные гистоны меньше метилируются, больше ацетилируются, и болезнь в мушках усугубляется [7]. У мушек нет болезни Альцгеймера в прямом смысле слова : у них возникает амилоидная дегенерация глаз, однако эта модель — важный, и главное, легко осуществимый первый шаг для выявления механизмов, связанных с болезнью.
Накопление амилоидов в клетках приводит к разным последствиям в разных организмах и тканях, а, следовательно, и разным симптомам. Поэтому так сложно создать животную модель такого заболевания. Фактически для доклинических исследований приходится пользоваться модельными организмами и наблюдениями на клеточных культурах, однако пока это лучшее, чем мы располагаем [11].
Болезнь Альцгеймера — только верхушка айсберга заболеваний, в которые вовлечена эпигенетика. Эпигенетически регулируются и некоторые виды рака, и редкие генетические синдромы. Как уже упоминалось в предыдущих статьях спецпроекта, главные эпигенетические «действующие лица» — это метилирование ДНК и влияние некодирующих последовательностей ДНК; молекулы, прочно ассоциированные с ДНК; и молекулы, плавающие в нуклеоплазме/цитоплазме, но способные ассоциироваться с хроматином на короткое время. Соответственно, дерегуляция каждого из этих игроков может вести к изменению экспрессии генов и заболеваниям.
В этой статье мы попытаемся рассмотреть разные типы эпигенетических болезней, однако не будем подробно останавливаться на их лечении (эта тема была рассмотрена в других статьях [12]), а сосредоточимся на молекулярных механизмах, нарушение которых приводит к болезням.
Эпигенетические болезни: какие они бывают?
Эпигенетические болезни развиваются от неправильной регуляции генов, вызванной поломками в хроматине. В частности, могут возникать делеции и мутации в некодирующих участках ДНК, например, в энхансерах, запускающих экспрессию генов (это происходит, например, при бета-талассемии). Может нарушаться и метилирование ДНК — как мы помним, оно служит для «выключения» экспрессии; а если его убрать, молчащие гены (например, онкогены) могут активироваться и вызывать болезнь (это случается при некоторых видах рака, например, лейкемии и карциноме почки [13]).
Интересный механизм, который, вероятно, может довести до рака, был описан совсем недавно и связан с разделением фаз в ядре клетки — когда образуются аномальные жидкие капли, сближающие отдаленные участки генома, из-за чего в итоге меняется экспрессия генов, что и приводит к болезни [14]. Отдельно следует поговорить о репарации ДНК — раковые клетки очень уязвимы к ее ингибированию, и это активно используют в клинической терапии.
Нарушение метилирования ДНК и влияние некодирующих последовательностей
Энхансеропатии: от генетической основы к эпигенетической регуляции
Поскольку некодирующие последовательности ДНК активно участвуют в регуляции генов [15], их изменение напрямую или через связанные белки может эту регуляцию нарушить, изменить фенотип и вызвать заболевания. Давайте рассмотрим болезни, связанные с нарушением такой регуляции или мутациями в энхансерах, — энхансеропатии [16].
Напомним, что энхансеры гена — это фрагменты ДНК, расположенные далеко от промотора в линейном геноме, но способные контактировать с ним в пространстве и стимулировать транскрипцию [17], [18]. Энхансеры несут характерные метки гистонов — H3K4me1 и H3K27ac. Несмотря на свою «некодирующесть», энхансеры транскрибируются, и похоже, именно сама транскрипция, а не появляющаяся некодирующая РНК, важна для эпигенетического статуса энхансеров.
Хотя, похоже, этот контакт может длиться совсем недолго [19].
И вот, некоторые болезни связаны не с генами как таковыми, а с мутациями или делециями в их энхансерах (рис. 1). Например, бета-талассемия (заболевание, нарушающее функции гемоглобина) возникает в результате утраты энхансера , регулирующего ген бета-глобина. В отличие от серповидноклеточной анемии, здесь страдает не структура гемоглобина, а уровень его экспрессии. Это, в свою очередь, ведет к анемии, некоторые формы которой, к сожалению, могут укорачивать жизнь. Однако уже сейчас при своевременной пренатальной диагностике возможно лечение недуга с помощью генной терапии плода [20].
А если честно, то не одного энхансера, а сразу нескольких — в составе так называемой зоны контроля локуса (LCR) [16].
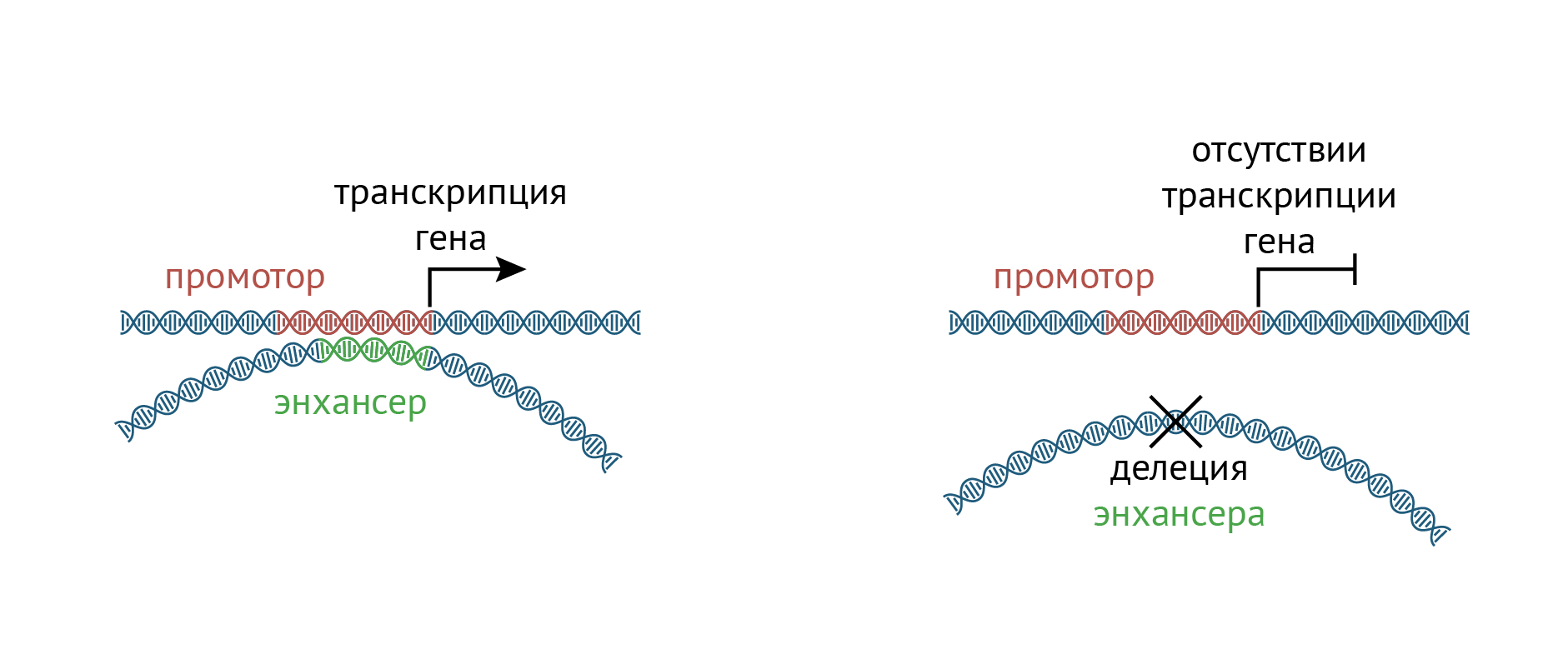
Рисунок 1. Как делеция энхансеров влияет на транскрипцию генов. При отсутствии энхансера не происходит активации промотора, а, следовательно, ген транскрибируется в меньших количествах. Например, при делеции нескольких энхансеров гена бета-глобина возникает бета-талассемия (подробности в тексте).
иллюстрация Михаила Гурьева
Есть и более сложный патогенез: иногда мутации затрагивают не сами гены и даже не их энхансеры, а белки, навешивающие на энхансеры гистоновые метки. Наряду с редкими (орфанными) генетическими синдромами [21], энхансеропатиями являются и некоторые виды рака [16].
Когда метилирование нарушает импринтинг
В третьей статье спецпроекта («Наследование и эпигеном» [23]) мы разбирали феномен геномного импринтинга — когда гены читаются неодинаково с отцовских и материнских хромосом благодаря избирательному метилированию ДНК. Оказывается, есть заболевания, связанные с нарушением этого процесса.
Как мы помним, чтение импринтированных генов контролируется специальными некодирующими участками контроля импринтинга (ICRs) и их метилированием. Утеря этих некодирующих участков (делеция) ведет к болезням: например, при синдромах Прадера—Вилли и Ангельмана в большинстве случаев возникает делеция на 15-й хромосоме в одном из ICR. Синдром Прадера–Вилли сопровождается отставанием развития, инфантильной гипотонией, невозможностью нормально питаться и летаргией; за этим следует гиперфагия и ожирение. При синдроме Ангельмана у пациентов часто возникает неконтролируемое желание смеяться; они также отстают в развитии, имеют минимальные вербальные навыки, проблемы с равновесием и судороги. Некоторые проявления (в частности, гипопигментация) характерны для обоих синдромов [24].
Нарушение импринтинга может вести и к раку, когда возникают проблемы с наследованием в ходе клеточных делений. Один такой пример — потеря импринтинга гена IGF2 при раке кишечника. В этом случае экспрессируется больше белка, чем в норме, что ведет к неконтролируемому росту клеток и канцерогенезу [25], [26]. Действительно, ингибиторы метилтрансфераз используют для лечения определенных лейкозов [12].
Злая эпихимера как результат транслокаций
Хроматин, помимо ДНК, составлен из множества разных молекул — однако не все они имеют ДНК-связывающие домены и непосредственно связываются с ней. Есть белковые модули, специфично узнающие метки на гистонах: ацетильные (бромодомены) или метильные (хромодомены). И, разумеется, есть заболевания, происходящие тогда, когда этот прицел сбивается: например, при синовиальной саркоме таким сбитым прицелом служит химерный белок SS18-SSX, возникающий в результате генетической транслокации путем слияния двух половинок:
- SS18 — белка комплекса BAF, осуществляющего ремоделинг хроматина (а, стало быть, оказывающего непосредственное влияние на работу генов);
- SSX (synovial sarcoma X breakpoint; в норме экспрессируется только в семенниках), от которого в химере осталось всего 78 аминокислот, которые и «сбивают прицел».
Синовиальная саркома — довольно редкая опухоль, возникающая, в частности, из синовиальной оболочки суставов. Прогноз такой опухоли зависит от типа саркомы: при однофазной саркоме он неблагоприятен, а при бифазной больные часто выздоравливают.
Химера SS18-SSX не теряет способность входить в состав комплекса BAF, однако модуль SSX наделяет его новыми мутантными свойствами: «нацеливанием» на молчащие polycomb-домены хроматина, где ему совсем не место. И что же ужасного там делает мутантный BAF? Он связывает молчащие гены и активирует их — а ведь не зря говорят: «не буди лихо, пока оно тихо».
SS18-SSX взаимодействует непосредственно с нуклеосомами, причем с их «торцами» , что приводит комплекс в близость с убиквитиновой меткой polycomb — H2A119Ub [27] (рис. 2). И именно случайное совпадение этих модулей, по-разному взаимодействующих с хроматином, и лежит в основе заболевания — соединившись с «молчащим» хроматином, мутантный BAF активирует его, что и приводит к раку.
Вообще-то это необычно: части торцов нуклеосомы заряжены отрицательно, в то время как поверхности самой «катушки», куда наматывается ДНК — положительно [28]. За взаимодействие с торцами отвечают оснóвные аминокислоты модуля SSX.
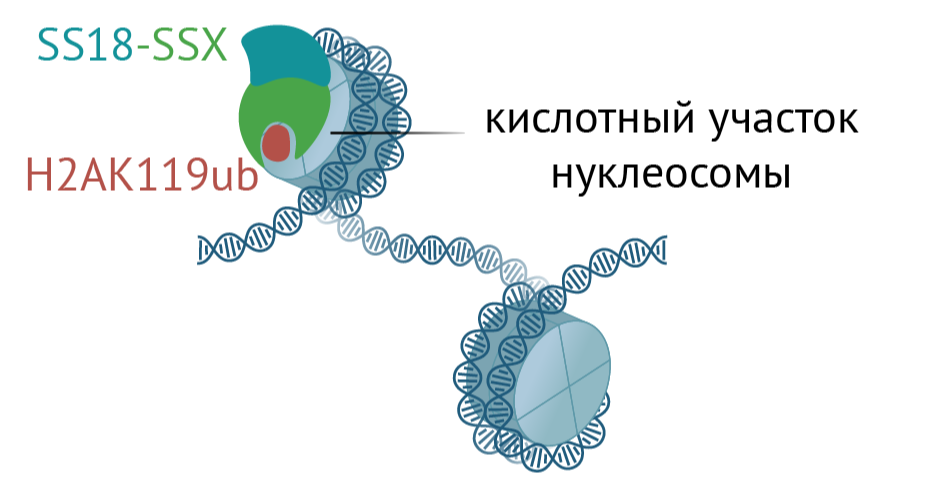
Рисунок 2. Как химера SS18-SSX нацеливается на «молчащие» нуклеосомы. SSX — это химерный белок, состоящий из двух модулей, слившихся по генетической случайности. Один включает химеру в мутантный хроматин-ремоделирующий комплекс BAF, а второй нацеливает его на «молчащий» хроматин с меткой polycomb, где BAF’а в норме не бывает. Так химера способна разбудить молчащее зло и вызвать синовиальную саркому.
иллюстрация Михаила Гурьева
К сожалению, терапия этого заболевания пока еще не основана на эпигенетике: применяется хирургия, лучевая терапия и цитотоксические средства вроде доксорубицина. Но будем надеяться, что изучение злой химеры SS18-SSX поможет разработать ингибиторы, которые бы специфически останавливали такое гибридное связывание с нуклеосомой и загнали бы (эпи)генетическое лихо обратно в берлогу.
Дерегуляция хроматиновых доменов: можно ли повлиять терапией на разделение фаз?
Во второй статье спецпроекта [17] мы уже сталкивались с механизмами формирования хроматиновых доменов, в частности, с разделением фаз. Оттуда мы помни: некоторые молекулы за счет слабых гидрофобных взаимодействий друг с другом образуют жидкие капли в клетках, отдаленно похожие на капли масла в воде [29], [30]. Такие капли, возможно, могут изолировать определенные участки хроматина в одном месте ядра, избирательно пропуская к ним определенные молекулы, которые способны перемещаться через фазу. Похоже, что такой механизм формирования доменов может нарушаться и вести к некоторым видам рака.
Ядро обменивается молекулами с цитозолем через ядерные поры — белковые комплексы в виде корзинок, состоящие из нуклеопоринов. Однако появляется всё больше свидетельств, что нуклеопорины не просто сидят на ядерных порах, а активно участвуют в регуляции хроматина, а также комплексов, важных в митозе [31], [32].
Мы уже сталкивались с транслокациями при раке. Его частный случай — лейкоз — тоже часто сопровождается транслокациями, которые приводят к образованию гибридных генов и экспрессии гибридных белков (тех же химер). Одна из форм лейкоза вызывается экспрессией химер самых разных белков с нуклеопорином 98 (NUP98). Белки это действительно разнообразные, но есть у них и общая черта — наличие неупорядоченных участков: это верный признак белков, образующих жидкие капли в клетках [33], [34]. Благодаря слиянию, такие химеры меняют место жительства: они перестают располагаться в ядерной мембране, а вместо этого «переезжают» в нуклеоплазму.
Вероятно, именно образование аномальных жидких капель NUP98-гибридами вызывает изменение структуры хроматина и ведет к лейкозу. Но как именно? Что плохого в образовании каких-то там капель?
Для ответа на этот вопрос давайте рассмотрим, как химера NUP98-HOXA9 вызывает лейкоз. Что такое NUP98, мы уже знаем, ну а HOXA9 — это важный транскрипционный фактор. Химера, как уже было сказано, формирует отдельную жидкую микрофазу за счет неупорядоченного участка, а вот аналогичный белок, в котором этот участок был удален с помощью мутации, не образует капель и не вызывает лейкоз. Если подсадить клетки с гибридом без неупорядоченного участка мышам, то они не болеют лейкозом — в отличие от контроля.
Гибриды с нуклеопоринами — далеко не единственные молекулы, которые изучают в связи с разделением фаз и нарушение которых ведет к болезням. Аналогично, внимания удостоился гетерохроматиновый белок MeCP2 (Methyl CpG binding protein 2), связывающийся с некоторыми метилированными областями генома и, судя по всему, регулирующий транскрипцию. Мутации в гене MeCP2 ведут к нейродегенеративному заболеванию с тяжелой умственной отсталостью — синдрому Ретта, встречающемуся почти исключительно у девочек.
Так вот, оказалось, что MeCP2 формирует жидкие капли in vitro (даже при сравнительно маленьких концентрациях 300–600 нМ), хотя и при помощи полиэтиленгликоля. Эта способность зависит от небольшого неупорядоченного участка, мутирующего при синдроме Ретта.
Ученые спекулируют на тему того, что в будущем искусственные манипуляции жидкими каплями могут стать одним из видов клинической терапии [37]. И вызывая или ингибируя образование жидких капель, мы сможем манипулировать процессами на хроматине и возвращать их к нормальному состоянию.
Репарация ДНК — идеальная мишень в терапии рака
Дерегуляция процессов на хроматине, которые мы с вами рассмотрели в предыдущих статьях — репликации, транскрипции и починке ДНК, — тоже ведет к заболеваниям [38]. Пожалуй (это не претендующее на объективность авторское мнение), самая активная изучаемая область хроматина, которую связывают с заболеваниями, — это пути починки ДНК и нарушения в них.
Поли-АДФ-рибозо-полимеразы (PARPs) навешивают поли-АДФ-рибозу на разные хроматиновые белки. Их часто ингибируют при лечении рака, так как они нужны для починки ДНК, а их выключение вызывает нестабильность генома и смерть раковых клеток, которые более подвержены такому воздействию, чем обычные клетки организма. Конечно, обычные клетки тоже затрагиваются, что не проходит бесследно: именно поэтому химиотерапия часто сопровождается тяжелыми побочными эффектами.
При ингибировании PARPs задерживаются на местах починки ДНК и не уходят оттуда вовремя. Например, PARP2 в норме не задерживается в местах репарации дольше необходимого, но если ее ингибировать — она там осядет. Аналогичное «оседание» возникает, если не работает онкогенная хеликаза ALC1, которая содействует высвобождению PARP2. В ALC1-нокаутных клетках, где дополнительно ингибируют PARPs, PARP2 задерживается на хроматине, и репарация ДНК не происходит (рис. 3) [39]. Удивительно: патологический процесс — неправильное связывание молекул с хроматином во время генетических процессов в ядре — можно запустить в раковых клетках и прицельно истребить их.
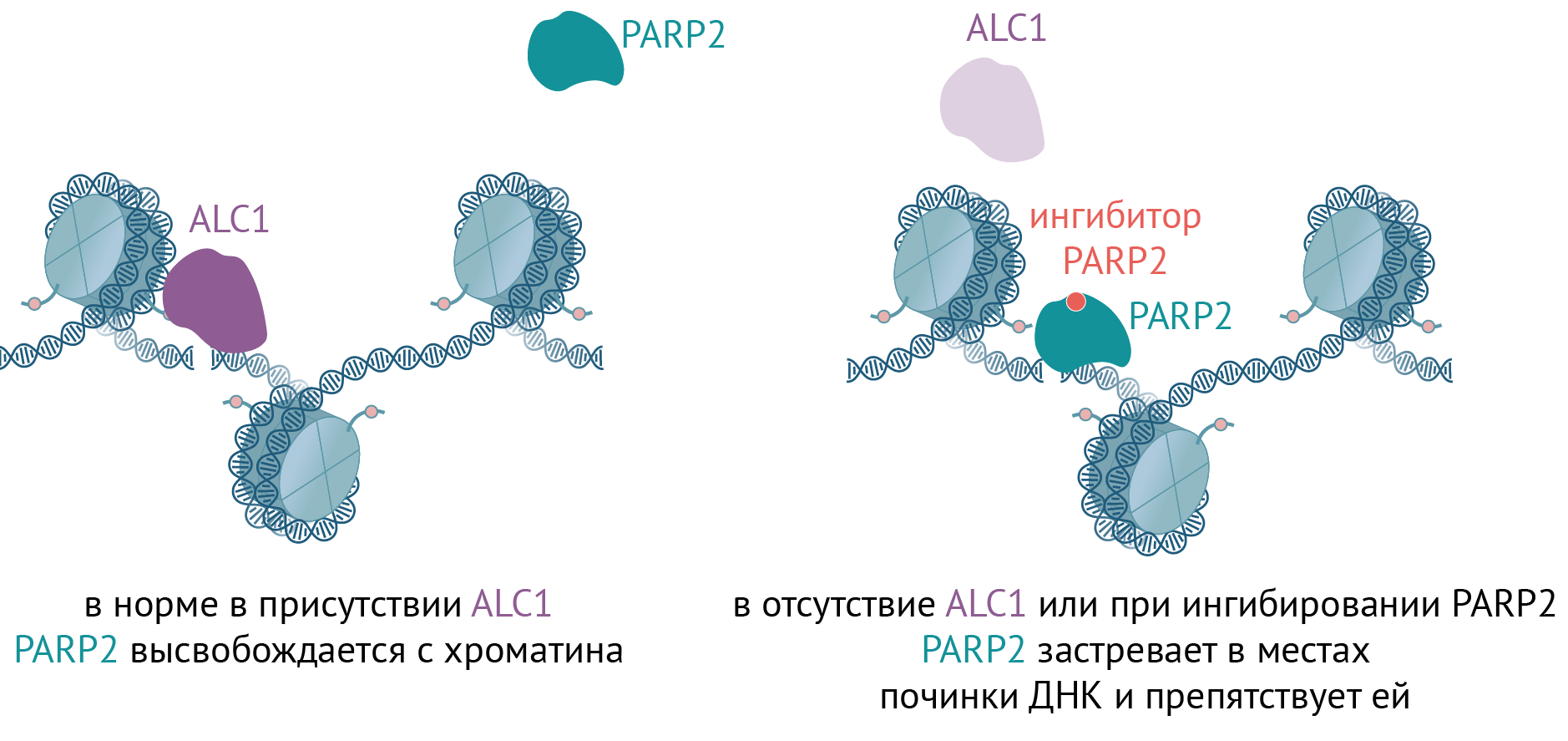
Рисунок 3. PARP2, (не) уходи! Если PARP2 оседает в местах починки ДНК, это ведет к ингибированию репарации. Парадоксально, но это не только плохо, но и хорошо: если это подстроить в раковых клетках, которые более восприимчивы к дефектам репарации, можно уничтожить их.
иллюстрация Михаила Гурьева
И всё-таки раковые клетки стараются стать лучше
Выше мы разобрали некоторые механизмы, когда расстройство хроматиновых молекул ведет к заболеваниям. Интересно, что иногда клетки могут противостоять собственной трансформации, и в этом тоже задействованы эпигенетические механизмы. Причем такие механизмы не являются предохранителем от трансформации, а развиваются уже после того, как она осуществилась, как бы противостоя ей. Получается, несмотря на многочисленные поломки при раке, есть что-то, что работает на восстановление от злокачественности.
ДНК уложена в ядре петлями (их вытягивают специальные белки), некоторые из которых находятся в основании доменов, в которые уложена ДНК. Домены размером 0,1–2 млн нуклеотидных остатков получили название «топологически ассоциированных доменов» (ТАДов) [18], [40]. А еще в геноме выделяют «компартменты» A и B, в пределах которых ДНК взаимодействует преимущественно со своим компартментом; компартмент А находится преимущественно в центре ядра, а B — на периферии и вокруг ядрышка. Это открытие было сделано с помощью контактных карт Hi-C.
Похоже, в ответ на злокачественность клетки могут менять трехмерную организацию генома. В частности, оказалось, что в раке толстой кишки упомянутые компартменты A и B перемешаны по ядру более равномерно. Более того: по картам Hi-C ученые обнаружили третий компартмент I, гипометилированный и содержащий гистоны с метками типа polycomb — H3K27me3.
Почему же образуется этот третий компартмент? Если посмотреть, сколько в компартменте I метилирования в разных образцах кишечника пациентов, то выяснится, что у пациентов в группе высокого риска (то есть у тех, у кого есть опухоль в другой части кишечника) метилирование сильнее. Более того, оказалось, что в опухолях онкогены в этом компартменте замалчиваются (вероятно, благодаря сильному метилированию). Получается, что формирование компартмента I — ответ клеток на развитие опухоли и механизм, сдерживающий рост новообразования [41].
Эпигенетика как средство диагностики
Ученые (да и коммерческие лаборатории) уже давно секвенируют геномы наших клеток, а в крови с диагностической целью определяют белки и метаболиты. Однако в крови плавает и внеклеточная ДНК, намотанная на нуклеосомы, и ее можно использовать для эпигенетической диагностики.
Клетки организма постоянно отмирают и обновляются — например, «покончив с собой» в результате апоптоза. Одна из особенностей этого процесса — фрагментация ДНК, которая высвобождается из клеток. По этой внеклеточной ДНК можно определять аномалии у плода [42] (речь идет о ДНК эмбриона, которая попадает в кровь беременной женщины), ответ опухолей на терапию и другие медицинские параметры. Недавно начали исследовать паттерны метилирования такой ДНК.
Но ДНК, которая высвобождается из клеток, плавает не сама по себе, а в составе хроматина — в основном это моно- и динуклеосомные фрагменты. Соответственно, гистоны на этих нуклеосомах модифицированы так же, как и в клетке в момент апоптоза. На основе этого механизма уже начинают проводить диагностические ChIP-секвенирования основных гистоновых модификаций нуклеосом внеклеточной ДНК.
Казалось бы, если внеклеточные нуклеосомы происходят из апоптотических клеток, то их гистоновые модификации могли бы отличаться от нормального клеточного состояния. Удивительно, но сигнал ChIP-seq внеклеточных нуклеосом похож на результаты независимого ChIP-seq из тканей. Тем не менее, диагностику можно проводить по критерию ткани происхождения внеклеточной ДНК. Так, в здоровых донорах в пул внеклеточной ДНК вносят вклад главным образом мегакариоциты костного мозга, но не эритробласты. У пациентов внеклеточные нуклеосомы часто происходят из апоптотических клеток разных тканей.
Интересно, что сигнал ChIP-seq отражает индивидуальные транскрипционные программы для каждого пациента. Например, в плазме крови одного из пациентов с инфарктом миокарда метка промоторов, H3K4me3, была повышена на генах интерферонового иммунного ответа и генах, на которые садятся транскрипционные факторы развития кардиомиоцитов.
Таким образом, можно отследить эпигенетические черты клеток по внеклеточным нуклеосомам [43]. Конечно, диагнозов по внеклеточным нуклеосомам пока ставить нельзя, нужно больше исследований, пациентов и статистики, чтобы дойти до этого. Однако будем надеяться, это не за горами. Уже есть стартапы, нацеленные на диагностику нуклеосом из биологических жидкостей. Правда, пока таких компаний единицы. Уважаемые читатели, не хотите ли присоединиться и открыть стартап по диагностике рака по внеклеточным нуклеосомам?
Заключение
В этом спецпроекте по эпигенетике мы узнали, как устроен хроматин. Мы рассмотрели, как устроено клеточное ядро и выяснили, почему мамонта всё-таки нельзя клонировать и при чем тут эпигенетическое наследование. Отдельное место мы отвели стыку эпигенетики и молекулярной биологии, рассмотрев некоторые аспекты молекулярно-биологических процессов. Мы узнали, что метаболизм не так далек от эпигенетики, как кажется, и регулирует много всего, включая модификации гистонов, которые появляются из метаболитов.
В этой статье мы попытались показать, что изучение эпигенетики — не просто прихоть сумасшедших ученых, которые не видят в жизни ничего, кроме хроматина и фундаментальной науки. Оно тесно связано с болезнями, которые зачастую вызываются эпигенетическими поломками и могут быть диагностированы, например, по метилированию внеклеточной ДНК. Значительная часть исследований заболеваний, которую мы рассмотрели, еще не дошла до клиники, но это на данный момент и есть тот передовой край науки, фрагменты которого перерастут в разработку лекарств и, возможно, спасут не один миллион жизней.
Литература
- На руинах памяти: настоящее и будущее болезни Альцгеймера;
- Заговор с целью нейродегенерации: бета-амилоид и тау-белок;
- Смерть после жизни, болезнь Альцгеймера и почему мы хотим перемен;
- Уйти на профилактику: деменция как предотвращаемое заболевание;
- Следующая после болезни Альцгеймера: описана новая форма деменции;
- β-амилоид: невидимый враг или тайный защитник? Запутанная тропка болезни Альцгеймера;
- Raffaella Nativio, Yemin Lan, Greg Donahue, Simone Sidoli, Amit Berson, et. al.. (2020). An integrated multi-omics approach identifies epigenetic alterations associated with Alzheimer’s disease. Nat Genet. 52, 1024-1035;
- Ke Xu, Xue-Ling Dai, Han-Chang Huang, Zhao-Feng Jiang. (2011). Targeting HDACs: A Promising Therapy for Alzheimer's Disease. Oxidative Medicine and Cellular Longevity. 2011, 1-5;
- Hong Qing, Guiqiong He, Philip T. T. Ly, Christopher J. Fox, Matthias Staufenbiel, et. al.. (2008). Valproic acid inhibits Aβ production, neuritic plaque formation, and behavioral deficits in Alzheimer's disease mouse models. Journal of Experimental Medicine. 205, 2781-2789;
- S. Peleg, F. Sananbenesi, A. Zovoilis, S. Burkhardt, S. Bahari-Javan, et. al.. (2010). Altered Histone Acetylation Is Associated with Age-Dependent Memory Impairment in Mice. Science. 328, 753-756;
- Трансляционная психиатрия — как моделировать психические расстройства на животных?;
- Пилюли для эпигенома;
- Melanie Ehrlich. (2002). DNA methylation in cancer: too much, but also too little. Oncogene. 21, 5400-5413;
- Sohum Mehta, Jin Zhang. (2022). Liquid–liquid phase separation drives cellular function and dysfunction in cancer. Nat Rev Cancer. 22, 239-252;
- Геном человека: полезная книга, или глянцевый журнал?;
- Edwin Smith, Ali Shilatifard. (2014). Enhancer biology and enhanceropathies. Nat Struct Mol Biol. 21, 210-219;
- Ядро и эпигеном;
- Новый взгляд на геном: не просто цепочка генов, а трехмерная сеть, интегрирующая функциональные домены ядра;
- Annabelle Wurmser, Srinjan Basu. (2022). Enhancer-Promoter Communication: It’s Not Just About Contact. Front. Mol. Biosci.. 9;
- Фетальная генная терапия: от теории — к практике;
- Редко, но метко: орфанные заболевания как вызов современной медицине;
- 454-секвенирование (высокопроизводительное пиросеквенирование ДНК);
- Наследование и эпигеном;
- Huda Y. Zoghbi, Arthur L. Beaudet. (2016). Epigenetics and Human Disease. Cold Spring Harb Perspect Biol. 8, a019497;
- Stephen B. Baylin, Peter A. Jones. (2016). Epigenetic Determinants of Cancer. Cold Spring Harb Perspect Biol. 8, a019505;
- Atsushi Kaneda, Andrew P. Feinberg. (2005). Loss of Imprinting of IGF2: A Common Epigenetic Modifier of Intestinal Tumor Risk. Cancer Res. 65, 11236-11240;
- Matthew J. McBride, Nazar Mashtalir, Evan B. Winter, Hai T. Dao, Martin Filipovski, et. al.. (2020). The nucleosome acidic patch and H2A ubiquitination underlie mSWI/SNF recruitment in synovial sarcoma. Nat Struct Mol Biol. 27, 836-845;
- Kazuhiro Maeshima, Satoru Ide, Kayo Hibino, Masaki Sasai. (2016). Liquid-like behavior of chromatin. Current Opinion in Genetics & Development. 37, 36-45;
- Разделяй и властвуй: роль разделения фаз в жизни клетки;
- Физическая водобоязнь;
- Sahana Holla, Jothy Dhakshnamoorthy, H. Diego Folco, Vanivilasini Balachandran, Hua Xiao, et. al.. (2020). Positioning Heterochromatin at the Nuclear Periphery Suppresses Histone Turnover to Promote Epigenetic Inheritance. Cell. 180, 150-164.e15;
- Hartono, Masaharu Hazawa, Kee Siang Lim, Firli R. P. Dewi, Akiko Kobayashi, Richard W. Wong. (2019). Nucleoporin Nup58 localizes to centrosomes and mid-bodies during mitosis. Cell Div. 14;
- Недоупорядоченные белки;
- Внутренне-неупорядоченные белки — «темная материя» белкового мира;
- Stefan Terlecki-Zaniewicz, Theresa Humer, Thomas Eder, Johannes Schmoellerl, Elizabeth Heyes, et. al.. (2021). Biomolecular condensation of NUP98 fusion proteins drives leukemogenic gene expression. Nat Struct Mol Biol. 28, 190-201;
- Jeong Hyun Ahn, Eric S. Davis, Timothy A. Daugird, Shuai Zhao, Ivana Yoseli Quiroga, et. al.. (2021). Phase separation drives aberrant chromatin looping and cancer development. Nature. 595, 591-595;
- Charles H. Li, Eliot L. Coffey, Alessandra Dall’Agnese, Nancy M. Hannett, Xin Tang, et. al.. (2020). MeCP2 links heterochromatin condensates and neurodevelopmental disease. Nature. 586, 440-444;
- Процессы и эпигеном;
- Charlotte Blessing, Imke Karlijn Mandemaker, Claudia Gonzalez-Leal, Julia Preisser, Adrian Schomburg, Andreas Gerhard Ladurner. (2020). The Oncogenic Helicase ALC1 Regulates PARP Inhibitor Potency by Trapping PARP2 at DNA Breaks. Molecular Cell. 80, 862-875.e6;
- Jesse R. Dixon, Siddarth Selvaraj, Feng Yue, Audrey Kim, Yan Li, et. al.. (2012). Topological domains in mammalian genomes identified by analysis of chromatin interactions. Nature. 485, 376-380;
- Sarah E. Johnstone, Alejandro Reyes, Yifeng Qi, Carmen Adriaens, Esmat Hegazi, et. al.. (2020). Large-Scale Topological Changes Restrain Malignant Progression in Colorectal Cancer. Cell. 182, 1474-1489.e23;
- Неинвазивная диагностика анеуплоидий у плода: от идеи к продукту;
- Ronen Sadeh, Israa Sharkia, Gavriel Fialkoff, Ayelet Rahat, Jenia Gutin, et. al.. (2021). ChIP-seq of plasma cell-free nucleosomes identifies gene expression programs of the cells of origin. Nat Biotechnol. 39, 586-598.