Новости биофармы за 2025 год: персональное генное редактирование, новый класс обезболивающих впервые за 25 лет, новое лекарство от гипертензии и многое другое
16 января 2026
Новости биофармы за 2025 год: персональное генное редактирование, новый класс обезболивающих впервые за 25 лет, новое лекарство от гипертензии и многое другое
- 1330
- 0
- 2
Создание новых лекарств — невероятно сложная и рискованная задача. Очень часто идеи не срабатывают и заканчиваются неудачами. Поэтому так ценны любые положительные результаты, влияющие на здоровье и жизни людей.
Рисунок в полном размере.
иллюстрация Ирины Ефремовой
-
Автор
-
Редакторы
-
Иллюстратор
Темы
С момента публикации последних новостей прошел целый год, и накопилось множество замечательных событий — одобрения новых препаратов, клинические данные, свидетельствующие о неустанном применении новых открытий на практике, новые идеи лечения смертельных заболеваний. Мы постарались отобрать самые интересные и значимые новости за истекший (2025-й) год.
Современные лекарства
Спецпроект о современных лекарствах, истории их создания, методах разработки и тенденциях развития.

Партнер статьи — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Одобрение новых лекарств
Несмотря на все сложности (разгон большой части сотрудников FDA, обезглавливание ряда отделов, потеря институциональной памяти, замена сотрудников с научным способом принятия решений на тех, кто принимает их в угоду политической конъюнктуре) оставшиеся сотрудники FDA делают свою работу: в этом году одобрено 55 новых лекарств, что вполне на уровне прошлых лет.
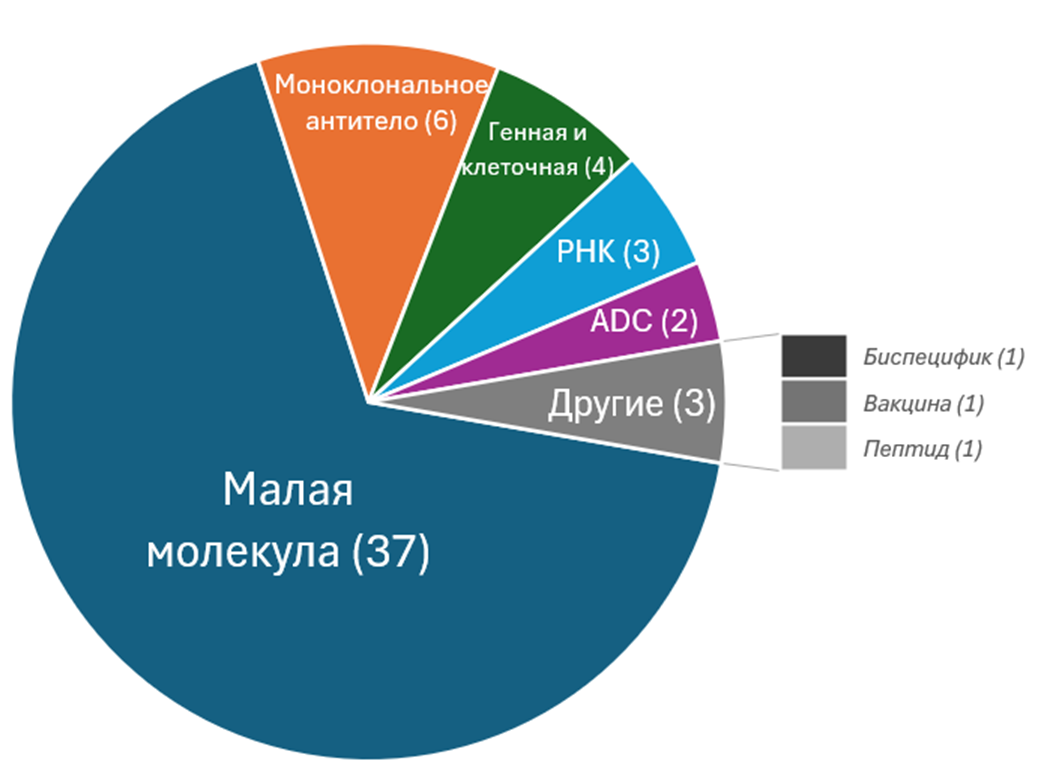
Пройдемся по самым ярким одобрениям, но сначала — немного статистики. В этом году безоговорочно победили малые молекулы — 37 (67%) новых лекарств принадлежат к этому традиционному классу [1], но, как мы увидим дальше, потенциал для инноваций здесь отнюдь не исчерпан (рис. 1А). А вот одобрений в области генной и клеточной терапии всего четыре (против семи в прошлом году [2]) .
Генная терапия — безусловно, очень сложная и дорогостоящая технология, и ее внедрение занимает куда больше времени, чем думали оптимисты. В связи с этим мы даже поставили на паузу наш Спецпроект по генным и клеточным терапиям. Впрочем, все сходятся во мнении, что проблемы здесь больше не научного, а технического и организационного характера: вопрос лишь в том, сколько лет потребуется на их решение.
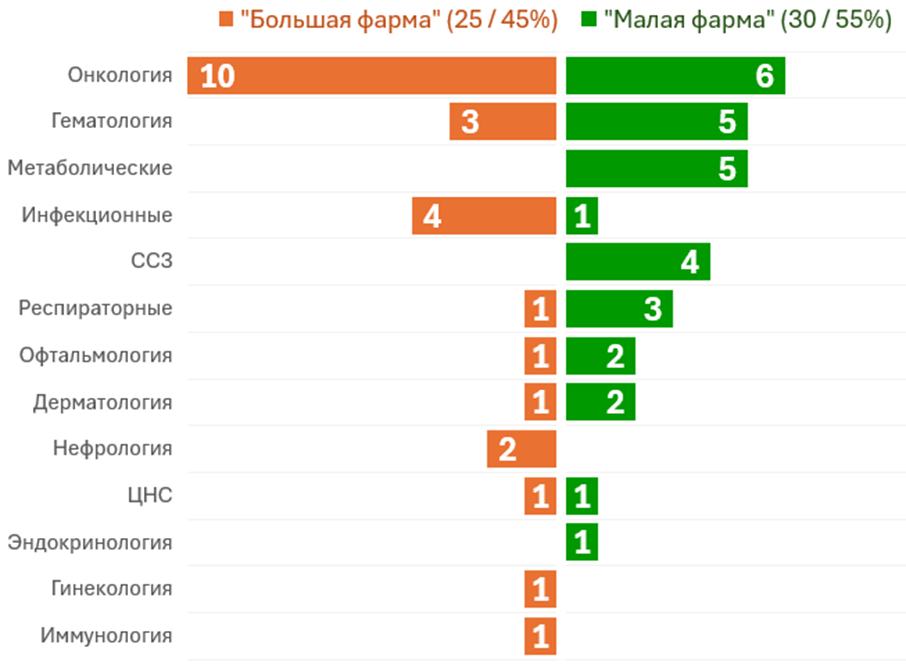
Почти поровну препаратов были поданы на одобрение от большой фармы и от малых компаний. 31 препарат (56%) — первые в классе, то есть с новым механизмом действия или принципиальными отличиями от существующих. 32 препарата (58%) — орфанные, то есть для лечения редких заболеваний [3]. По показаниям традиционно лидирует онкология (16 препаратов), затем идет гематология (8), метаболические, инфекционные, респираторные заболевания (рис. 1Б).
Наиболее важными одобрениями в 2025 году стали ленакапавир и сузетриджин. Первый — препарат Gilead для профилактики ВИЧ в группах риска, который вводится два раза в год. Почему это важно и как это стало возможно — читайте в новостях за 2024 год [4].
Сузетриджин — неопиоидный анальгетик компании Vertex нового класса для лечения острой боли. В свете опиоидного кризиса лекарство, не вызывающее привыкания и других нежелательных эффектов опиоидов, — это настоящий прорыв, пусть даже он оказался не столь эффективен, как рассчитывали. Подробнее о нем также можно прочесть в прошлогодних новостях [4].
Еще одно значимое одобрение ушедшего года — новый антибиотик от гонореи, впервые за почти 30 лет. Гепотидацин компании GSK подавляет деление бактерий, вмешиваясь в процесс репликации бактериальной ДНК [5]. Он ингибирует фермент топоизомеразу, один из ключевых в процессе репликации. Это известная мишень антибиотиков класса фторхинолонов — например, ципрофлоксацина, но гепотидацин делает это по-другому, то есть он активен против тех бактерий, которые выработали резистентность к другим антибиотикам. К нему тоже неизбежно возникнет резистентность, но появление антибиотика нового класса — это всегда хорошо, особенно учитывая снижение интереса индустрии к разработке новых антибиотиков на фоне растущей проблемы резистентности к ним.
В онкологии одной из ярких новостей стало одобрение по раку яичника комбинации двух ингибиторов киназ . Компания Verastem получила одобрение для avutometinib, ингибитора RAF/MEK, в комбинации с defactinib, ингибитором FAK. Одобрение было получено по ускоренной процедуре, после исследования всего на 57 пациентках с редким подвидом рака яичника, которым чаще болеют молодые женщины. Если текущая фаза 3 не подтвердит эффективность терапии, лекарство может быть отозвано с рынка. Кроме того, комбинация показала эффективность в первой линии лечения рака поджелудочной железы — будем надеяться, результаты подтвердятся.
Киназы — ферменты, которые «навешивают» фосфатные группы на другие белки в клетке; они играют важную роль в огромном количестве процессов и стали самым популярным классом мишеней для онкологических и других препаратов.
Еще одно важное одобрение в онкологии — лекарство против одного из видов рака мозга, dordaviprone компании Jazz. Оно получило ускоренное одобрение по диффузной срединной глиоме с мутацией H3 K27M у пациентов старше 1 года. В пяти исследованиях, включавших 50 пациентов, наблюдалось 22% ответов на терапию. Результат может показаться достаточно скромным, но раньше для этой опухоли не существовало других опций, кроме радиации, да и вообще прогресс в лечении раков мозга случается не так часто.
В области РНК-препаратов стоит отметить фитусиран (изначально разработан компанией Alnylam, клиническая разработка велась Sanofi). Этот препарат предназначен для профилактики кровотечений при гемофилии. На рынке есть ряд внутривенных факторов свертывания крови (фактор VIII применяется при гемофилии А, а фактор IX — при гемофилии В), однако у фитусирана есть несколько преимуществ перед ними. Помимо удобства применения (препарат вводится подкожно один раз в месяц), белковые препараты обладают и важным недостатком — у многих пациентов развиваются нейтрализующие антитела, и препараты перестают действовать. Поскольку фитусиран имеет небелковую природу и действует по другому механизму (рис. 2), он потенциально будет помогать и тем пациентам, у которых выработались подобные нейтрализующие антитела. Однако судьба фитусирана была сложной: еще в 2017 году из-за смерти пациента в клиническом исследовании от тромбоза разработка была остановлена. Затем исследования продолжили, но в 2020 году они снова приостанавливались. Тем не менее, в 2025 году FDA все-таки одобрило препарат, после того как Sanofi предусмотрела гибкий подбор дозы и убедительно доказала пользу от препарата [6]. Однако он получил black-box warning («предупреждение в черной рамке»), касающееся риска тромбозов и холецистита.
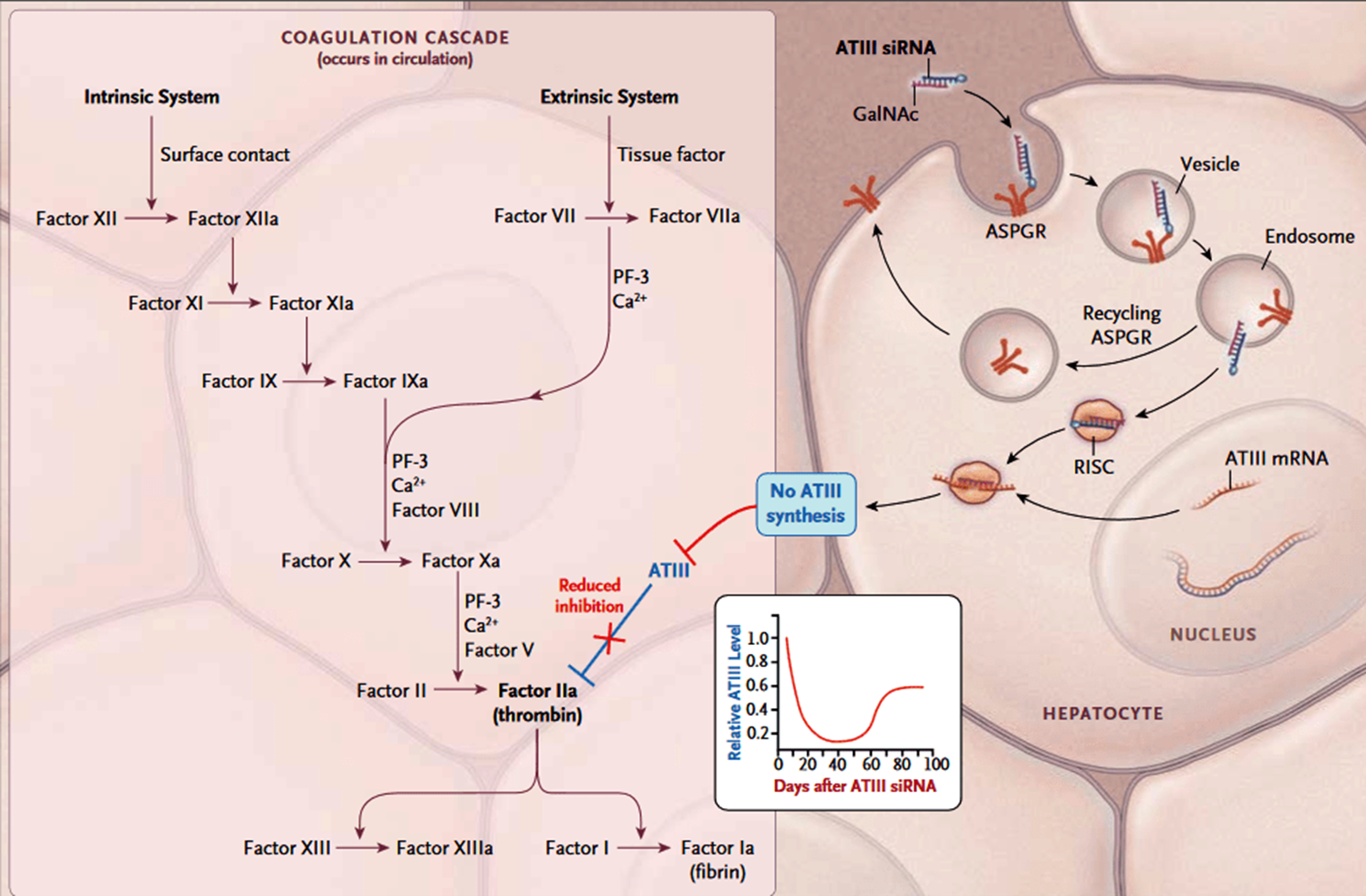
Рисунок 2. Механизм действия фитусирана. Препарат представляет собой двухцепочечную РНК, которая снижает экспрессию антитромбина, что повышает сворачиваемость крови.
Из препаратов генной и клеточной терапии отмечу Papzimeos компании Precigen, который был одобрен для лечения редкого респираторного папилломатоза. При этом заболевании в дыхательных путях вырастают папилломы, вызванные вирусом папилломы человека. Препарат одобрен после исследования фазы 2 (где его вводили курсом в четыре укола) — ведь ничего, кроме хирургии, для лечения болезни пока нет. Лечение привело к полному исчезновению папиллом у 51% пациентов и к снижению потребности в операциях на 86–95%. Papzimeos индуцирует иммунный ответ против HPV-инфицированных клеток, адресно борясь с источником папиллом. Особенность препарата — в том, что для доставки полезной нагрузки тут используется аденовирус гориллы, который обладает низкой иммуногенностью у человека и способен нести до 12 кб полезной нагрузки. Это большой шаг вперед для генной терапии, потому что применимость самого популярного сейчас аденоассоциированного вируса сильно ограничена его иммуногенностью и емкостью в 4,7 кб [7]. Понятно, что у этой технологии хорошие перспективы и в других заболеваниях.
Кб — единица измерения длины ДНК (от англ. Kilobase, то есть тысяча пар нуклеотидных оснований).
Видео 1. Принцип работы платформы компании Precigen.
Теперь перейдем к новостям клинических исследований.
Генная коррекция — впервые системно прямо в организме людей!
Компания Beam доложила о положительных результатах применения технологии редактирования оснований (base editing) прямо в человеческом организме. Больным с генетическим нарушением — дефицитом ɑ1-антитрипсина (генетическим заболеванием, приводящим к тяжелым поражениям легких и печени) — ввели липидные наночастицы с двумя РНК: кодирующей фермент дезаминазу, которая осуществляет редактирование; и направляющей, которая указывает, что именно редактировать (рис. 3).
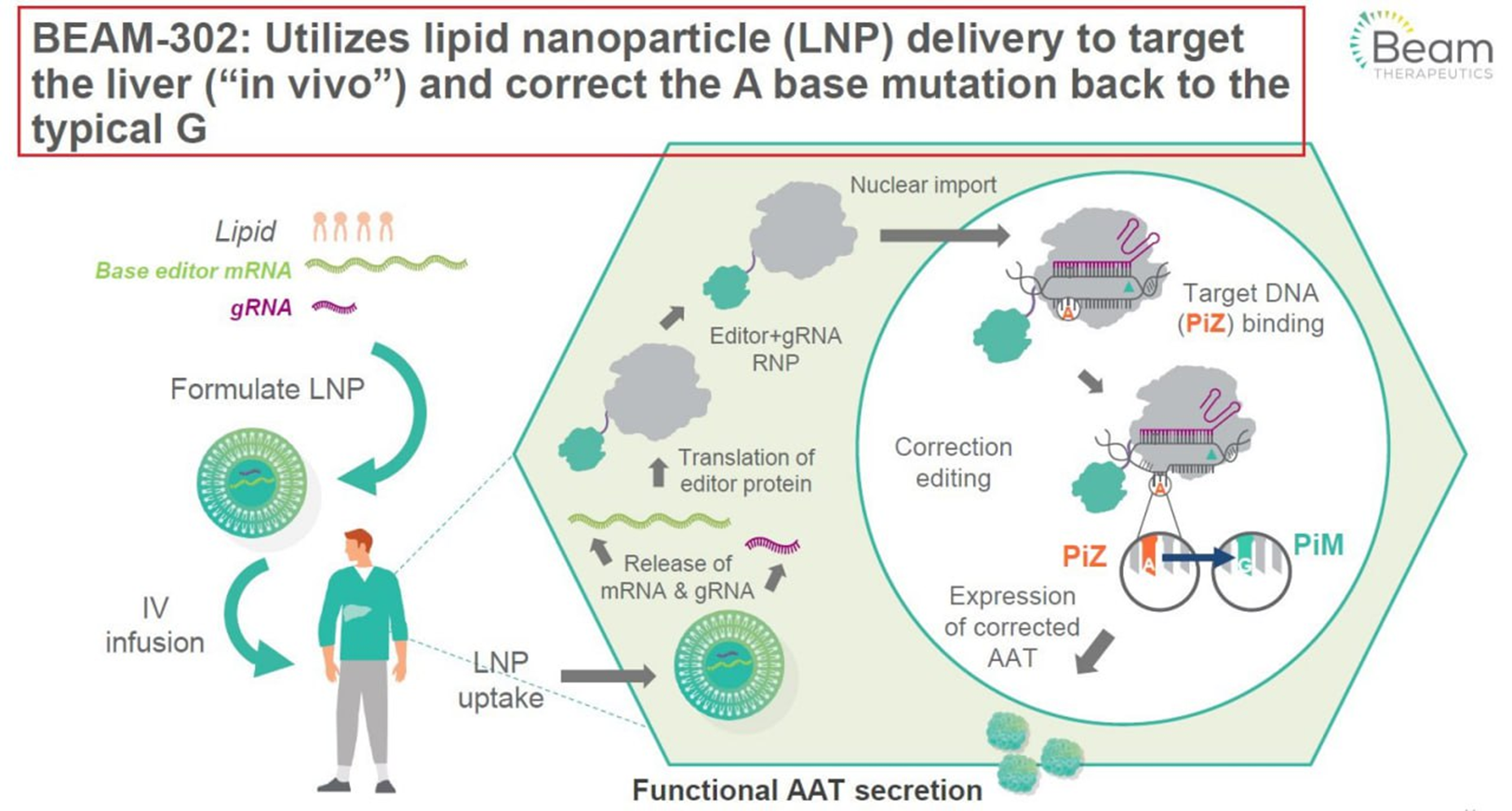
Рисунок 3. Схема механизма действия препарата BEAM-302.
презентация компании Beam
У всех трех пациентов, получивших высшую дозу препарата, уровень ɑ1-антитрипсина поднялся выше необходимого для защиты организма от негативных последствий дефицита. В отличие от технологии редактирования РНК компании Wave (о которой мы писали в новостях прошлого года [2] и в статье «Точный удар: как редактирование мРНК победит неизлечимые болезни» [8]), применение генного редактирования предполагает всего лишь одну инъекцию, способную потенциально вылечить пациента на всю жизнь.
Компания Verve Therapeutics (позднее приобретена Eli Lilly за $1 млрд) получила разрешение от FDA на начало клинического исследования системного in vivo редактирования генома у пациентов с редким заболеванием — гетерозиготной семейной гиперхолестеринемией. Терапия представляет собой одноразовую инъекцию, ведущую к инактивации гена, кодирующего PCSK9 (рис. 4). Против этого белка на рынке уже есть несколько антител и РНК-препарат, снижающие уровень ЛПНП-холестерина (ЛПНП — липопротеины низкой плотности), которые назначаются пациентам с сердечно-сосудистыми заболеваниями для профилактики инфарктов и инсультов. Отключение этого гена, видимо, безопасно — есть люди с «природной» мутацией, инактивирующей этот белок, и у них наблюдаются только положительные эффекты.
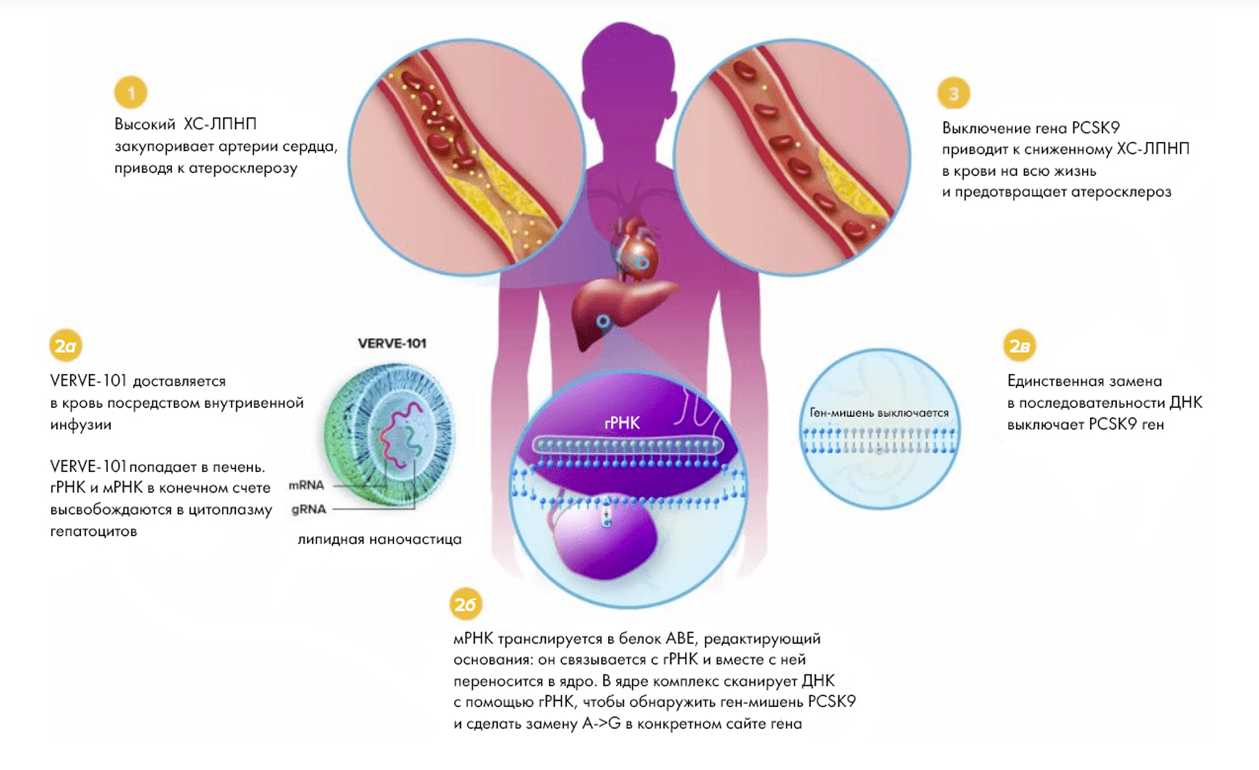
Рисунок 4. VERVE-101 отключает ген PCSK9, участвующий в метаболизме холестерина. Белковый продукт этого гена взаимодействует в организме с особым рецепторным белком на поверхности клеток, отвечающим за связывание молекул липопротеинов низкой плотности («плохого холестерина»), что приводит к деградации этих важных рецепторов. Вследствие этого клетки с разрушенным рецептором больше не могут связывать и поглощать (с последующей утилизацией) «плохой холестерин», что неминуемо повышает его уровни в организме (со всеми вытекающими). VERVE-101 представляет собой компоненты редактора оснований ABE, заключенные в липидные наночастицы, которые при проникновении в клетки печени (а именно в них в основном утилизируется холестерин) меняют в последовательности гена PCSK9 аденин на гуанин, что приводит к отключению этого гена (а значит, и к нивелированию вызванных его деятельностью разрушительных последствий). Поскольку это лекарство использует технологию BE, не ведущую к двойным разрывам, теоретически вероятность неточного редактирования здесь меньше, чем при использовании классической CRISPR.
Сейчас клинические исследования проходит вторая версия продукта, разработанного Verve (у первой были проблемы с безопасностью), и уже показана способность дозозависимо снижать ЛПНП (до 53%). В плане клинической эффективности придется подождать данных более долговременного наблюдения.
Профилактика гриппа, но не вакцина
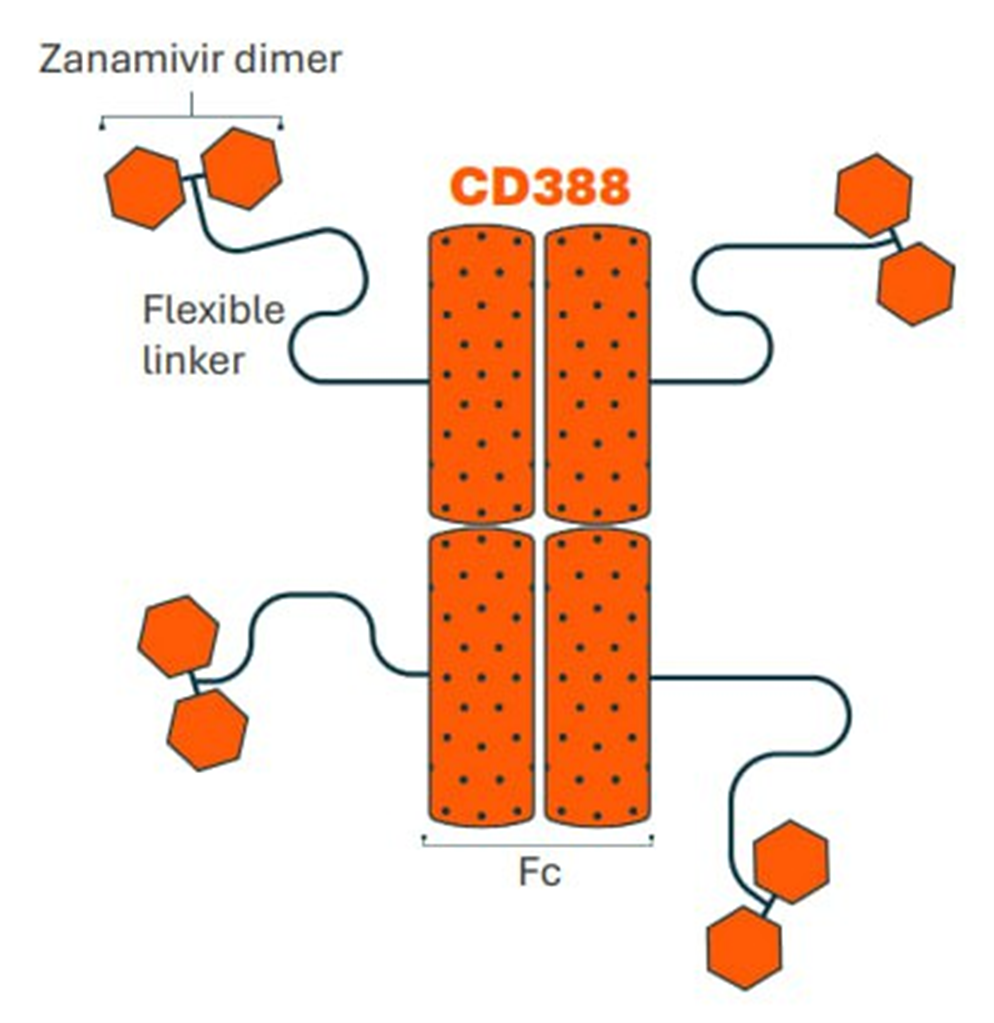
Рисунок 5. Схема препарата CD388 компании Merck/Cidara.
презентация компании
Компания Cidara опубликовала очень интересные данные фазы 2b по профилактике гриппа одним уколом: защита в высшей дозе составила 76%! Препарат тоже необычен: это четыре димера старого противовирусного препарата занамивира, прицепленные к Fc-фрагменту антитела (рис. 5). Такая конъюгация позволяет препарату долго оставаться в крови, так что один укол может защитить на весь сезон (причем от гриппа обоих типов — А и В [9]), то есть как вакцина (хотя это не вакцина, так как не формирует иммунную защиту от вируса). За пределами онкологии совсем не много таких конъюгатов в разработке.
Cidara ранее разработала противогрибковый препарат и даже вывела его на рынок, но выручка была низкой, и они продали разработку. Спасло то, что они еще в 2018 году начали разработку по гриппу, которую сначала вели в сотрудничестве с Johnson&Johnson. И тут опять удар: в 2023 году J&J останавливает разработки по инфекционным заболеваниям. И в 2024 Cidara с поддержкой инвесторов, которые продолжали верить в нее, выкупают права на CD388 и успешно проводят фазу 2b. В ноябре компания была куплена Merck&Co за $9,2 млрд.
Теперь нужно дождаться результатов фазы 3 — вероятно, в этом году.
Nektar — сладость победы после горечи поражений
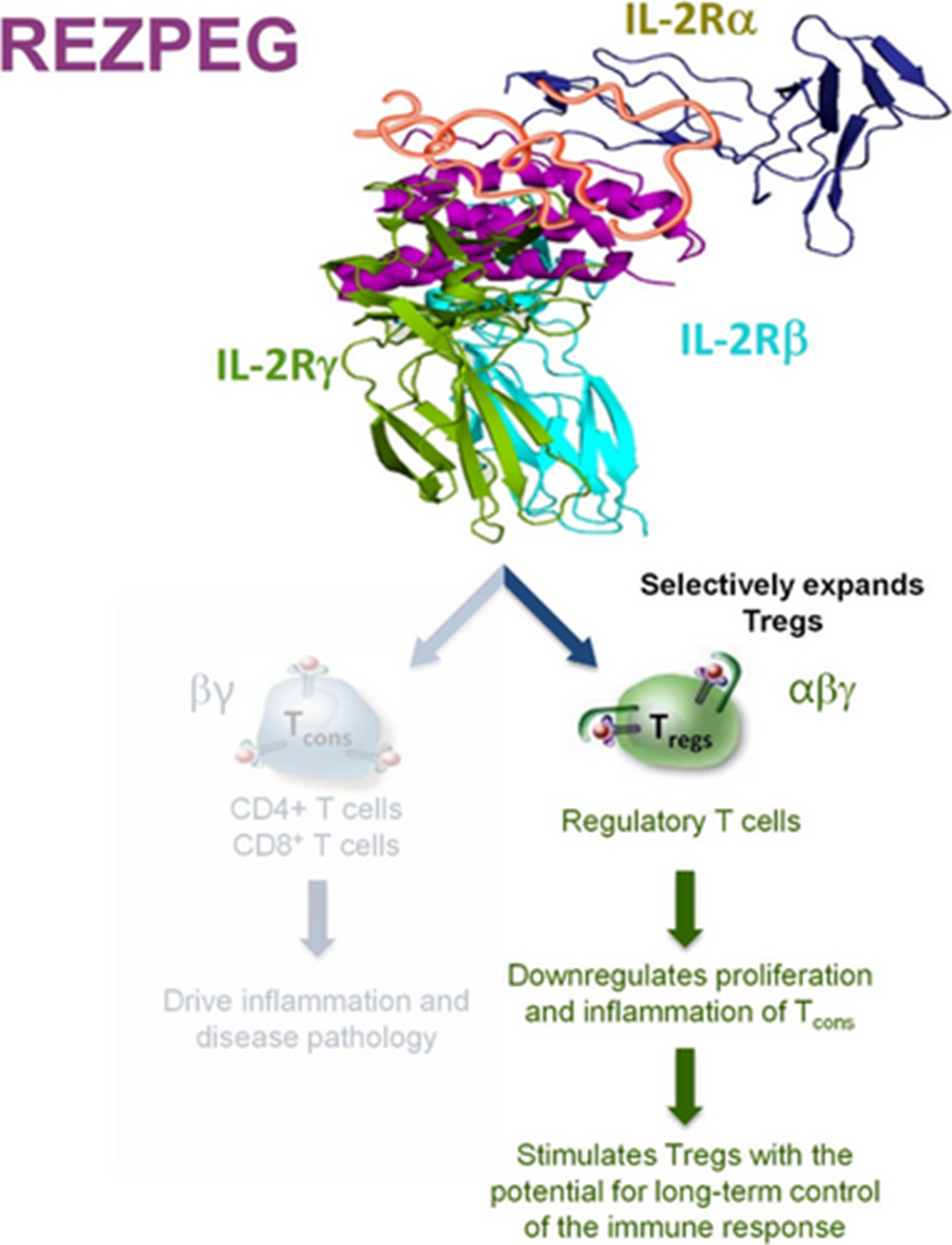
Рисунок 6. Структура и механизм действия Rezpegaldesleukin. Препарат представляет собой пегилированный человеческий рекомбинантный IL-2, который селективно индуцирует Тreg и повышает их супрессорную активность.
Впервые эффективность в фазе 2b показал препарат против аутоиммунных заболеваний, не подавляющий провоспалительные компоненты иммунной системы, а активирующий (условно) противовоспалительный, а именно — регуляторные Т-клетки (Treg) [10]. Я пишу «условно», потому что иммунная система настолько сложна, что тут нет однозначных ярлыков, а любые утверждения сопровождаются оговорками.
Препарат Rezpegaldesleukin у пациентов с атопическим дерматитом (аутоиммунная разновидность экземы) улучшил состояние по шкале EASI (оценивает размер и тяжесть поражения кожи) на 61% на 16 неделе в высшей дозе по сравнению с 31% в плацебо. Препарат представляет собой измененную форму интерлейкина-2 (IL-2), действующую избирательно на Treg (рис. 6). Активация Treg должна обеспечивать долговременный контроль иммунного ответа. Раньше компания в сотрудничестве с BMS разрабатывала IL-2, действующий, наоборот, на эффекторные Т-клетки, активируя их для борьбы с раком, но этот подход провалился. Тогда компания сосредоточилась на аутоиммунных заболеваниях, провалила исследование Rezpegaldesleukin по волчанке, а затем Eli Lilly разорвала коллаборацию с Nektar после данных фазы 1b атопическому дерматиту. Nektar даже подала на Lilly в суд, обвинив в манипуляции данными, нарушении контракта и саботаже, и пустилась в дальнейшую разработку самостоятельно.
Против атопического дерматита уже одобрены препараты, действующие на интерлейкины 13, 4 и 31, на рецептор OX40, на внутриклеточные киназы, то есть конкуренция довольно жесткая — но все препараты не идеальны, поэтому Nektar считает, что место для игрока с новым механизмом действия найдется. Очевидно, так считает и рынок — акции компании взлетели более чем в три раза. Теперь компании предстоит фаза 3, посмотрим, получился ли повторить успех.
Интересно, что в 2025 году Нобелевская премия по физиологии и медицине была вручена именно за регуляторные Т-клетки [11]. На рынке пока нет ни одного препарата, который бы модулировал их напрямую, и Rezpegaldesleukin вполне может им стать.
Поразительный успех в язвенном колите
Малоизвестная французская компания Abivax объявила об успехе двух исследований фазы 3 по язвенному колиту перорального препарата obefazimod. У него совершенно новый механизм действия: он связывается с ядерным белком и индуцирует селективный сплайсинг длинной некодирующей РНК, что приводит к повышению экспрессии микроРНК miR-124. miR-124 связывается с некоторыми мРНК в цитоплазме и понижает экспрессию провоспалительных факторов (видео 2). Это не просто новая мишень, это новый принцип действия! Тем меньше были шансы на успех и тем больше награда, когда всё получилось.
Препарат сначала разрабатывался против ВИЧ, но провалился, и в 2018 компания опубликовала данные фазы 2 по язвенному колиту. С тех пор ей постоянно не хватало финансирования, и она несколько раз чуть не обанкротилась. Подача на одобрение препарата в Европе и США ожидается во второй половине 2026 года.
Видео 2. Obefazimod проникает в ядро и связывается с кэп-связывающим комплексом (CBC), который регулирует сплайсинг длинных некодирующих РНК (long non-coding RNA). Это приводит к активации сплайсинга и повышению уровня microRNA-124. Она связывается с мРНК провоспалительных цитокинов, таких как MCP-1/CCL-2, STAT3, IL-6R, что приводит к снижению их экспрессии и противовоспалительному эффекту.
Интересно, что Нобелевская премия по физиологии и медицине 2024 года была вручена как раз за микроРНК и их ключевую роль в посттранскрипционной регуляции генов [12]. Как и в случае с препаратом Nektar, мы видим, как фундаментальные открытия идут рука об руку с их практическим применением и приводят к появлению новых лекарств.
Феникс в мире биофармы
Компания uniQure легендарна. Основана в 1998 году замечательным ученым и предпринимателем Сандером ван Девентором, разработчиком одного из первых моноклональных антител (инфликсимаба) и основателем одного из крупнейших европейских VC-фондов Forbion.
В 2012 году они вывели на рынок ЕС первый генотерапевтический препарат Glybera [13]. Правда, потом его пришлось отозвать с рынка — за год была продана одна доза. Тогда компания переключилась на генную терапию гемофилии В, успешно разработала и продала ее CSL Behring (одобрена под названием Hemgenix), и занялась болезнью Хантингтона [14]. Это нейродегенеративное заболевание, которое вызывается мутацией в одном-единственном гене, кодирующем белок хантингтин. Однако пока что повлиять на течение заболевания не удавалось, и многие разработки провалились в клинических исследованиях.
В сентябре 2025 года uniQure сообщила об успехе исследования фазы 1/2 — впервые удалось показать достоверное замедление прогрессии заболевания по сравнению с историческим контролем.
С научной точки зрения продукт потрясающий — одноразовый укол вирусного вектора в мозг обеспечивает экспрессию микроРНК, которая предотвращает экспрессию хантингтина. Однако отзывы специалистов оказались более сдержанными:
- количество пациентов в исследовании совсем невелико (опубликованы данные по 12 пациентам);
- терапия сравнивалась в основном с историческим контролем, в контрольной группе исследования было всего 6 пациентов (и их данные не были представлены);
- исследование не было ослеплено (что повышает вероятность влияния плацебо-эффектов на исход).
Тем не менее, компания собиралась подать документы на ускоренное одобрение, так как ранее была договоренность с FDA о такой возможности. Но на встрече с регулятором в ноябре компания получила неожиданный отказ: FDA сказало, что больше не считает данные открытого исследования фазы 1/2 достаточными для одобрения. Компании придется проводить полноценное сравнительное исследование и показывать долгосрочное влияние на функциональные способности и качество жизни пациентов.
Регулятору всё время приходится искать баланс между риском, накопленными доказательствами и скоростью выхода на рынок новых лекарств, и нередко приходится принимать решения, которые не устраивают часть игроков.
Беспрецедентная выживаемость при раке головы и шеи
Компания Merus опубликовала прекрасные данные для своего биспецифического препарата petosemtamab, направленного против рецепторов EGFR и LGR5 на поверхности раковых клеток. Однолетняя выживаемость составила 79% при метастатическом раке головы и шеи (43 пациента). Правда, в исследовании не было контрольной группы, но у подобных пациентов в других исследованиях выживаемость была на уровне 50–60%. Компания запускает исследования фазы 3, и, если результаты окажутся на таком же уровне, новый препарат может поменять подход к лечению рака головы и шеи.
Новая комбинация против множественной миеломы
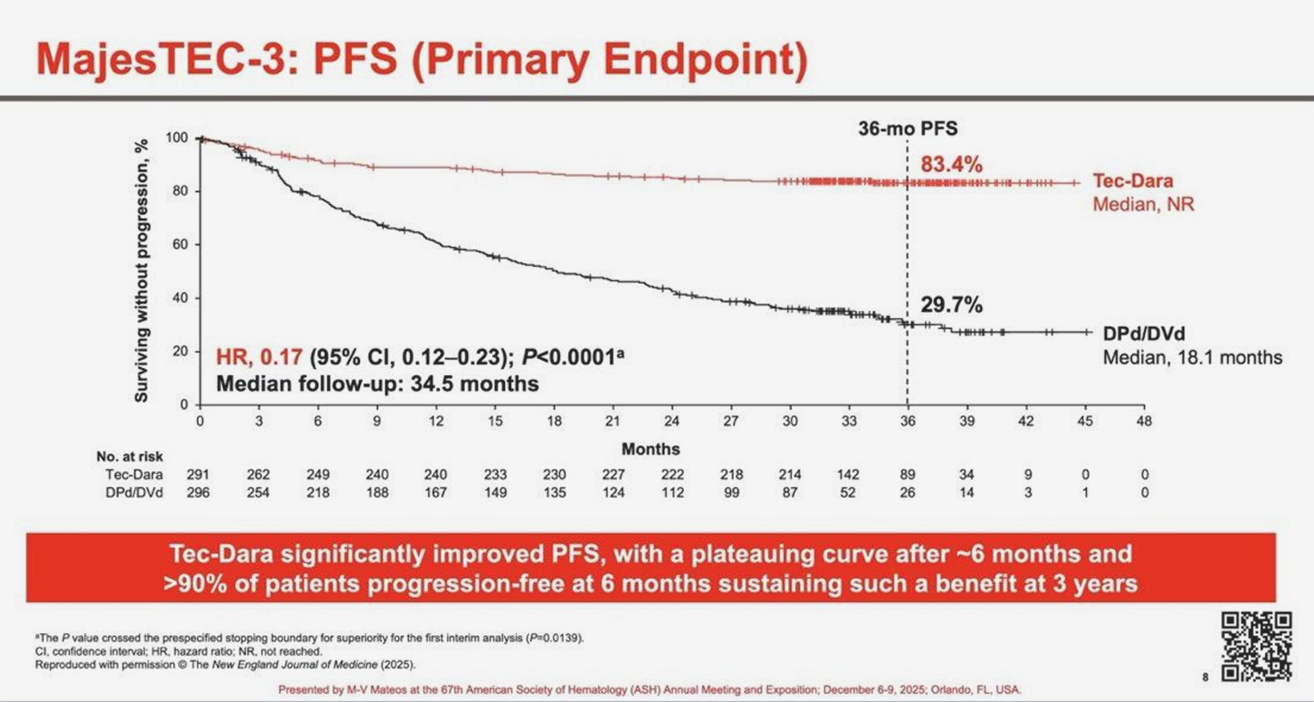
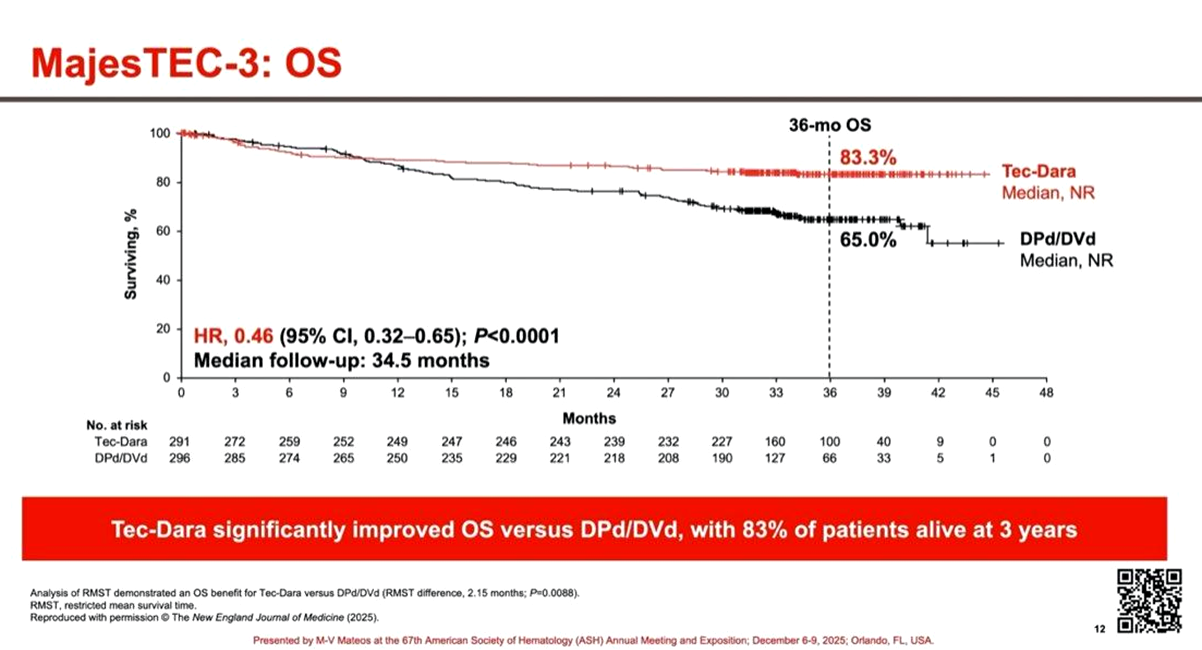
Редко когда видишь такие замечательные графики выживаемости, как на рис. 7, и тогда немедленно хочется ими поделиться. Речь идет об исследовании фазы 3 компании Johnson&Johnson у пациентов с множественной миеломой после прогрессии на предыдущей терапии. В исследовании приняли участие 587 пациентов, примерно половина получила новую комбинацию, а другая половина — стандартную терапию.
Множественная миелома (ММ) — злокачественное заболевание, поражающее плазматические клетки: те самые, которые в норме производят антитела. При перерождении они начинают бесконтрольно делиться, и при этом продолжают производить аберрантные (то есть ненормальные) антитела. Опухоли преимущественно локализованы в костном мозге, и вызывают костные боли и остеопороз. Избыток аберрантных антител вызывает повреждение почек, гипервязкость крови, тромбозы и другие негативные явления.
В последнее десятилетие достигнуты значительные успехи в лечении множественной миеломы благодаря применению таргетных препаратов (как низкомолекулярных, так и антител). Однако большинство пациентов, отвечающих на терапию, затем всё равно прогрессируют, так как выжившие опухолевые клетки находят способ сопротивляться терапии. Кроме того, мишени, на которые направлены лекарства, присутствуют и на здоровых клетках, что приводит к токсичности лечения.
Даратумумаб — хорошо известное антитело против ММ, и в этом исследовании его сочетали с новым биспецифическим антителом teclistamab. Оно одной своей частью связывается с BCMA, белком на поверхности клеток множественной миеломы, а другой — c рецептором CD3 на поверхности Т-лимфоцитов. Тем самым биспецифик пространственно сближает Т-лимфоцит с опухолевой клеткой и активирует его. Комбинация с даратумумабом обеспечивает синергию за счет иммуностимулирующего действия даратумумаба — это и позволило добиться таких впечатляющих результатов в клинике.
Разработок по множественной миеломе очень много, и успехи за последнее десятилетие достигнуты хорошие, но такая эффективность наблюдается редко, и, скорее всего, комбинация станет новым стандартом терапии на второй линии ММ.
Новое лекарство против гипертензии
Устойчивая к лечению гипертензия — большая проблема здравоохранения, ведь высокое давление — один из главных факторов риска инфарктов, инсультов и других сердечно-сосудистых нарушений.
Сразу две компании доложили в 2025 году о положительных результатах исследований фазы 3 для препаратов, принадлежащих к новому классу — селективные ингибиторы альдостеронсинтазы (AS). Они блокируют фермент, вырабатывающий альдостерон — гормон, повышающий удержание воды и натрия и приводящий к повышению кровяного давления. Роль альдостерона давно хорошо известна, и на рынке есть эффективные препараты (например, спиронолактон, эплеренон), которые блокируют связывание альдостерона с рецепторами, но у них есть нежелательные явления, которых можно было бы избежать, если снизить уровень альдостерона. Однако достаточно селективных прямых ингибиторов AS раньше сделать не удавалось, потому что трудно избежать ингибирования похожих ферментов.
Фармгигант AstraZeneca и небольшая компании Mineralys вступают в прямую конкуренцию на этом поле. Профили их препаратов Baxdrostat (рис. 8) [15] и Lorundrostat очень похожи (разве что у Baxdrostat немного длиннее период полувыведения). В фазе 3 оба препарата значимо снижали систолическое давление у пациентов, которым не помогали другие лекарства, и способны были контролировать его на протяжении исследования (12 недель).
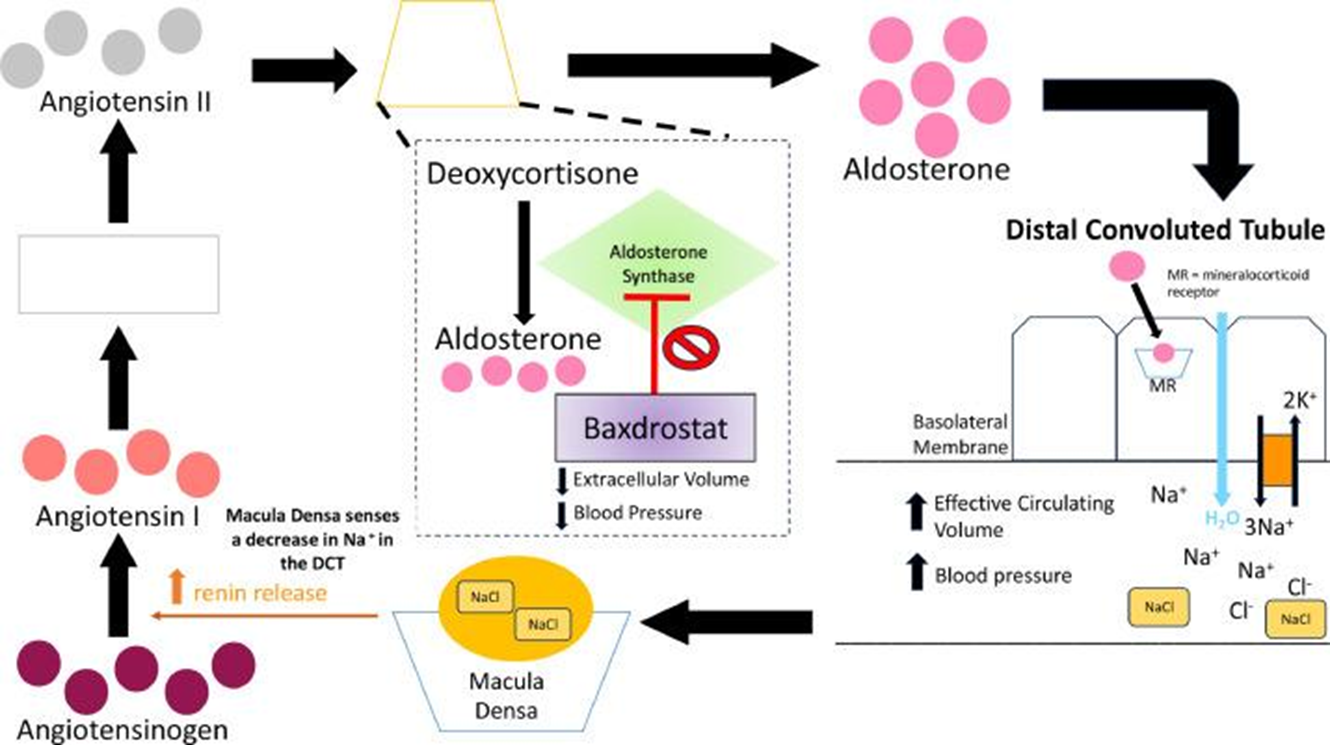
Рисунок 8. Механизм развития гипертензии и механизм действия Baxdrostat.
Конечно, у AstraZeneca больше возможностей проводить исследования по расширению показаний и вообще продвигать свой препарат на этом многомиллиардном рынке (прогнозы дают $5B+). Так что у продукта Mineralys, наверное, будут шансы только в случае приобретения компании.
На этот рынок, впрочем, претендуют и другие игроки — одобренный в 2024 году антагонист рецепторов эндотелина Aprocitentan компании Idorsia и начавший третью фазу РНК-препарат Zilebesiran (Roche/Alnylam), блокирующий продукцию печеночного ангиотензиногена (предшественника ангиотензина II, главного «виновника» повышения давления) c потенциалом подкожного введения 2 раза в год.
Первый аналог орексина от нарколепсии
Нарколепсией страдает 20–40 человек на 100 000 населения, то есть это относительно нечастое, но очень неприятное заболевание, при котором хронически нарушены циклы сна и бодрствования, например, днем может наступить внезапная непреодолимая сонливость, что приводит к резкому снижению качества жизни и работоспособности. Она часто сопровождается катаплексией (внезапной потерей мышечного тонуса), сонным параличом и яркими галлюцинациями, но не имеет отношения к наркомании, хотя название может вводить в заблуждение.
Нарколепсия первого типа (NT1, с катаплексией) характеризуется очень низким уровнем нейропептида орексина в спинномозговой жидкости. Орексин отвечает за сон, бодрствование, аппетит, возбуждение и другие важные процессы [16]. Его снижение связано с гибелью нейронов, которые его вырабатывают, почти всегда в результате аутоиммунных процессов.
Сейчас лечение нарколепсии ограничивается симптоматическими препаратами, которые помогают снижать сонливость и катаплексию, но создание аналогов орексина, которые бы могли влиять на основу патогенеза, наталкивалось на неприемлемую токсичность. Oveporexton компании Takeda стал первым агонистом рецептора орексина (рис. 9), который показал впечатляющие результаты в исследовании фазы 3. По сравнению с плацебо, он существенно снижал сонливость, количество приступов засыпания и катаплексии.
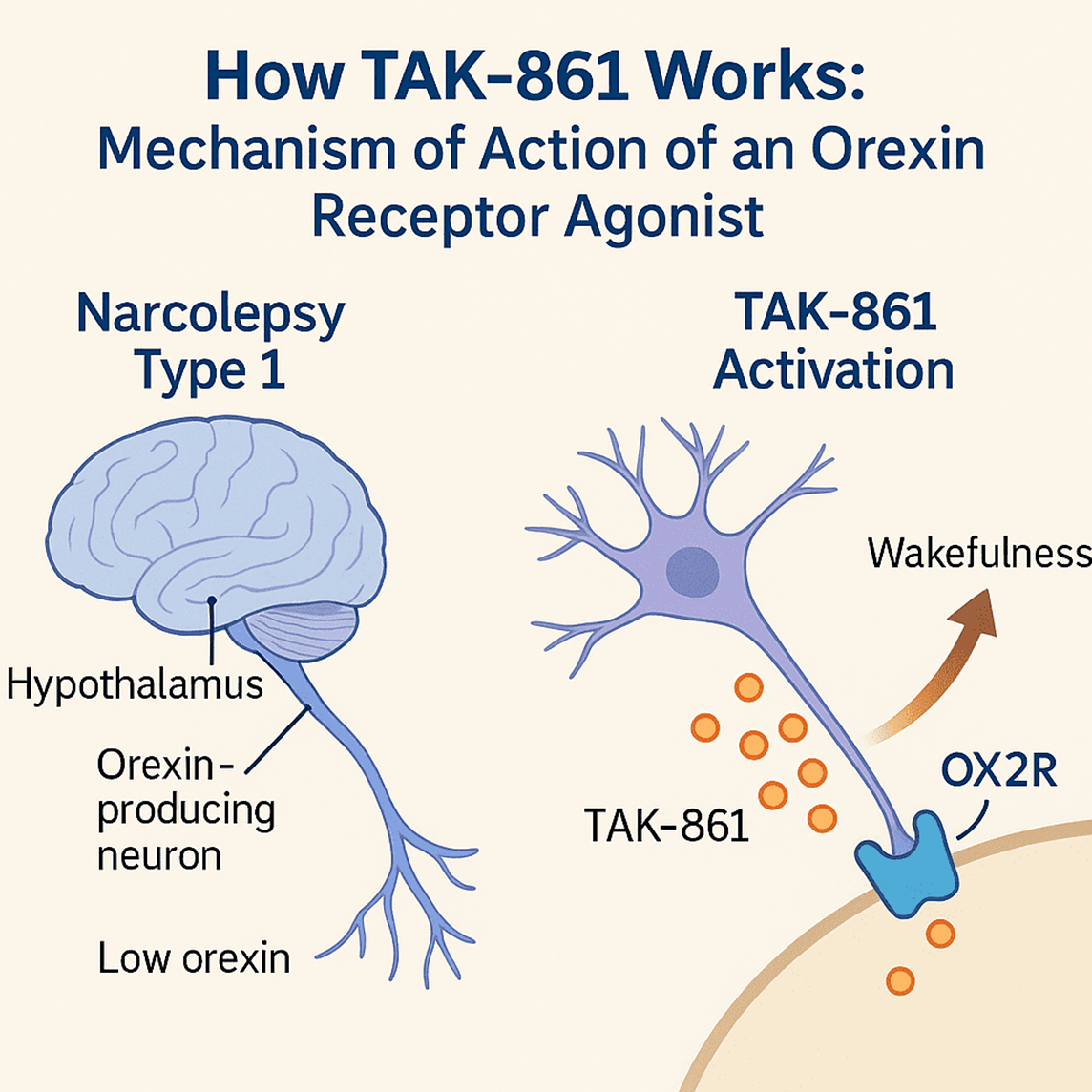
Рисунок 9. Механизм действия Oveporexton (TAK-861).
Препарат представляет собой пероральную малую молекулу, которая хорошо проникает в мозг и селективно связывается в глубоком кармане рецептора орексина OX2 (белок относится к классу GPCR), вызывает конформационные изменения, сходные с «природным» орексином, и активирует рецептор.
Поскольку орексин — важный медиатор множества процессов, не исключено использование его аналогов для лечения других заболеваний, таких как деменции, депрессии и пр.
Клеточная терапия против миодистрофии Дюшенна
Миодистрофия Дюшенна — крепкий орешек с точки зрения терапии: «Тяжелая жизнь без дистрофина: мышечная дистрофия Дюшенна» [17]. Она вызывается мутациями в одном из самых больших генов человека — дистрофине, и приводит к постепенному ослабеванию мышц с возрастом. На рынке уже есть несколько РНК-препаратов и генная терапия компании Sarepta, но до сих пор не утихают споры насчет их эффективности, особенно на фоне рисков и высокой цены.
Компания Capricor подошла к проблеме с другой стороны: вместо исправления генетического дефекта она исследовала введение пациентам донорских клеток сердечной мышцы. Идея в том, что приготовленные особым образом клетки (компания называет их кардиосферами) выделяют в окружающую среду экзосомы, которые снижают воспаление и фиброз в сердечной и скелетных мышцах и содержат факторы, повышающие регенерацию тканей (рис. 10) [18]. В 2024 компания подала в FDA данные исследования фазы 2, где показала положительное влияние на функции верхних конечностей и на сердечные показатели [19] (об излечении речи, конечно, не идет, но терапия замедляет прогрессию болезни). В июле 2025 года компания получила отказ от FDA с требованием предоставить больше данных. И вот в декабре 2025 компания публикует результаты фазы 3, которая достигла своей первичной конечной точки. У 105 пациентов, получавших deramiocel каждые три месяца в течение года, ухудшение функций верхних конечностей происходило на 54% медленнее, чем в группе плацебо. А фракция выброса левого желудочка, по которой судят о сердечной функции, ухудшалась на 91% медленнее. Уж на этих-то данных компания надеется получить одобрение.
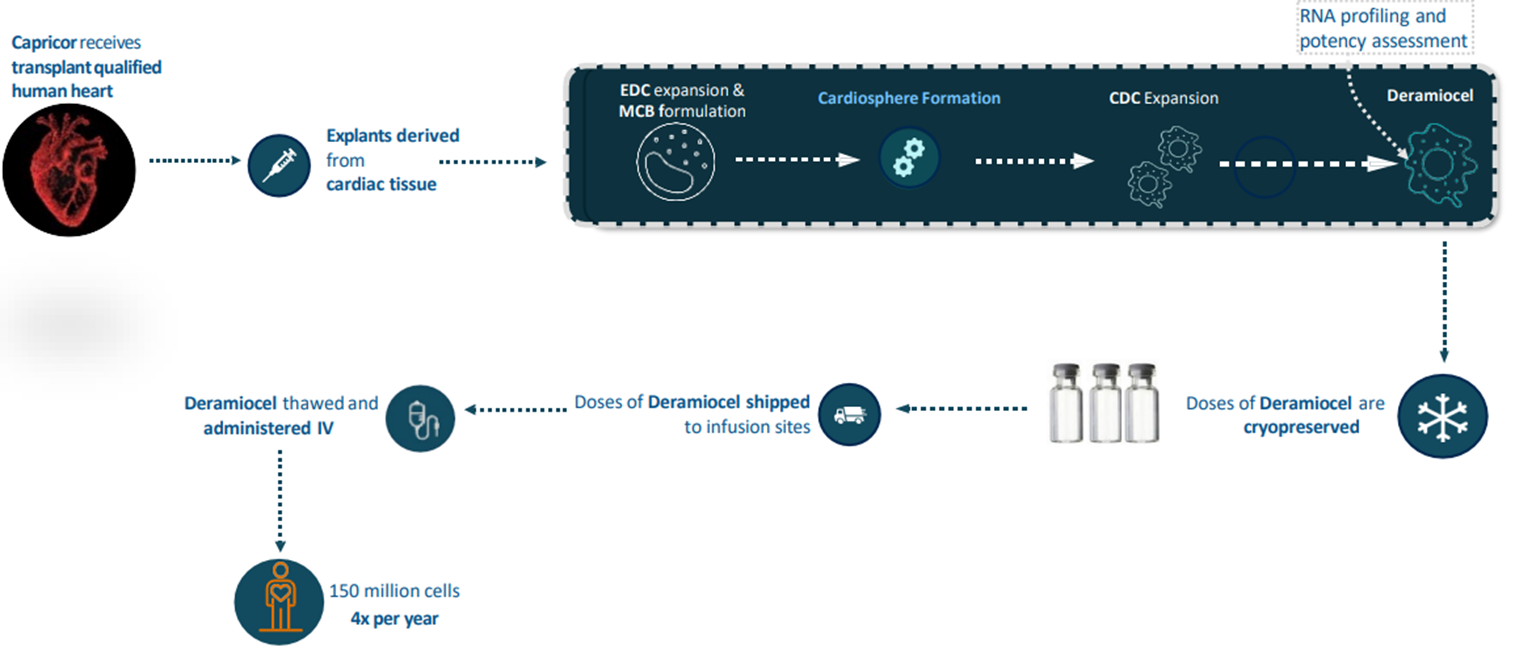
Рисунок 10. Схема производства клеточного продукта Deramiocel компании Capricor.
презентация компании
Генно-инженерная почка свиньи для человека
В настоящий момент людей, у которых отказали почки, переводят на диализ, и затем, при возможности, проводят пересадку почки от донора. Почек на всех не хватает, люди часто ждут пересадки годами, и многие не доживают. Кроме того, есть опасность переноса вирусной инфекции от донора, несмотря на все современные методы контроля [20]. У ксенотрансплантации (от организма другого вида) есть преимущества — большая доступность органов, меньше риск заражения, более здоровые органы. Однако до недавнего времени она была невозможна из-за отторжения органа иммунной системой вследствие межвидовых различий.
Генная инженерия способна решить эту проблему, сделав донорский орган более «человеческим» и, тем самым, менее заметным для иммунной системы. Особенно здесь помогла технология генного редактирования CRISPR/Cas9, за которую в 2020 была вручена Нобелевская премия [21].
Первую пересадку генно-инженерной почки от свиньи к живому человеку провели в 2024 году в Больнице общего профиля Массачусетса в Бостоне. Тогда реципиент прожил два месяца и умер от не связанных с почкой причин, по сообщению врачей. В 2024 было проведено еще две пересадки, но оба раза (через 47 и 130 дней [22]) почку пришлось удалить из-за почечной недостаточности и вернуть пациентов на диализ.
2025 год ознаменовался важной вехой: FDA разрешило провести двум компаниям полноценные клинические исследования пересадки генно-инженерной почки от свиньи. Первая — eGenesis — продолжает исследования бостонской группы. Они внесли в свинью 69 генетических изменений: инактивация свиных генов, бывших причиной острого отторжения почки, введение человеческих генов для регуляции иммунного ответа, снижения воспаления, регулирования каскадов коагуляции и комплемента, и инактивация многочисленных свиных ретровирусов для повышения безопасности. Кроме того, для иммуносупрессии используется таргетный препарат tegoprubart (антитело против CD40L). Такие почки в 2025 году пересадили двум пациентам, но у одного из них через 8 месяцев почка все же отказала. Пока это рекорд длительности выживания генноинженерного органа в организме человека.
Вторая компания — United Therapeutics. Их исследование началось в октябре 2025 года, новостей по пролеченным пациентам пока нет. Продукт содержит 10 генетических изменений. Компания United Therapeutics занималась и ксенотрансплантацией легких, сердца и печени. Впрочем, там пока заметных успехов добиться не удалось — такие рискованные пересадки делали только совсем безнадежным пациентам, и они вскоре умирали. В этом смысле у пересадки почки есть преимущество: если что-то идет не так, пациента можно вернуть на диализ.
Ведутся работы по генно-инженерной ксенотрансплантации и в Китае [23].
Область ксенотрансплантации генно-инженерных органов пока находится в колыбели, но нет сомнения, что по мере понимания механизмов отторжения, совершенствования методов генной модификации и протоколов иммуносупрессии успешность таких трансплантаций будет повышаться. Возможно, когда-то удастся совсем отказаться от донорских человеческих органов и перейти на свиные.
Новые лекарства от малярии
Малярия остается главной причиной детской смертности в Африке, в 2023 там произошло примерно 246 млн случаев заболевания и 569 000 смертей, в основном среди детей. При этом к существующим препаратам на основе природного лекарства артемизинина (за него в 2015 году была вручена Нобелевская премия [24]) у возбудителя малярии плазмодия постепенно вырабатывается резистентность (рис. 11) [25].
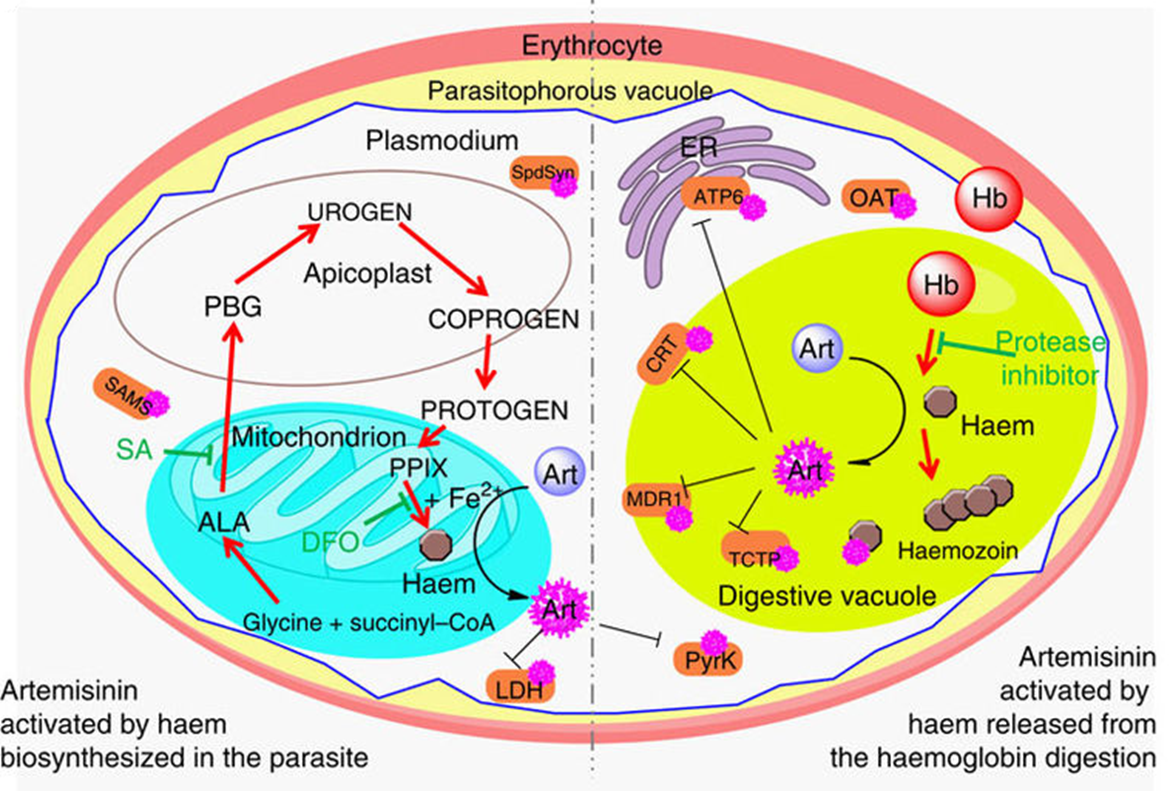
Рисунок 11. Схема активации артемизинина гемом в клетке малярийного плазмодия внутри эритроцита. Малярийный плазмодий на одной из стадий находится внутри эритроцитов, и внутри паразита накапливается свободный гем, вызывающий активацию артемизинина. Однако одна из мутаций приводит к тому, что плазмодий задерживается в той фазе, где гема в его клетках еще мало, и артемизинин действует плохо.
Как нельзя кстати, в 2025 году подоспели результаты фазы 3 новой комбинации компании Novartis [26]: нового ganaplacide (открыт скринингом на антималярийную активность среди 2 млн соединений) с известным lumefantrine. Исследование на 1600 пациентах в 12 африканских странах показало, что новый препарат вылечил 99,2% пациентов против 96,7% в группе тех, кто получал комбинацию с артемизинином. Что важно, новая комбинация была эффективна у тех, кто был заражен резистентным вариантом плазмодия. Единственное, в чем новый препарат уступал старым — высокий уровень рвоты (у 20% пациентов против 3% в контрольной группе). Однако к концу исследования он снизился, так как, вероятно, был связан с горечью порошка, и пациенты научились правильно его принимать.
Идут споры, как лучше поступить — применять препарат прямо сейчас или держать на полке, пока не возникнет широкая резистентность к существующим. Но в последнем случае существует опасность дождаться развития резистентности к lumefantrine, который применяется сейчас.
Сколько препарат будет стоить, Novartis не объявлял, но компания упоминала, что в основном будет раздавать его бесплатно. Сейчас применяется еще две стратегии борьбы с малярией — вакцинация (эффективность которой находится в районе 75%) и уничтожение комаров. К сожалению, комары стали вырабатывать устойчивость к инсектицидам. Но ученые предложили еще один метод: попытаться убить плазмодий в организме комара [27]. Это пытались сделать имеющимися лекарствами, и, хотя они проявляли активность, ее было недостаточно. Тогда ученые подобрали соединения, активные специфически против «комариной» стадии плазмодия. Такими веществами предполагается пропитывать противомоскитные сетки, чтобы препарат проникал через лапки комара. Однако выяснилось, что почти все отобранные соединения плохо проникают в организм насекомого. Пришлось медицинским химикам провести еще раунд оптимизации структуры молекулы, после которого нашлось два препарата, которые убивают плазмодий, проникая через лапки комаров. К ним тоже могут возникнуть устойчивые мутации, но ученые проверили, что такие мутанты не способны покинуть организм комара.
Это может стать важным шагом на пути полной эрадикации малярии в мире (сейчас ВОЗ ставит задачу уничтожить малярию в 30 странах к 2030 году).
Персональное генетическое лекарство всего за семь месяцев
Вскоре после рождения у мальчика Кайла появились очень тревожные симптомы — летаргия и дыхательная недостаточность. Когда врачи провели базовые биохимические анализы, выяснилось, что уровень аммиака в его крови в 30 раз выше нормы — показатель достигал почти 1000 микромоль на литр. В таких концентрациях это вещество грозит тяжелыми нарушениями работы мозга и легко может привести к смерти. Случайное отравление аммиаком в конкретном случае было исключено. Но как тогда опасное вещество могло попасть в кровь новорожденного младенца?
Дело в том, что ион аммония постоянно вырабатывается в теле человека. Это нормальный процесс, который сопровождает метаболизм аминокислот.
В теле любого организма постоянно синтезируются новые и разрушаются старые белки, а человеческий организм в среднем (и при обычной диете) должен ежесуточно выбрасывать около 16,5 грамма азота во внешнюю среду. Первоначальная форма этого азота — аммиак/аммоний, однако за сотни миллионов лет животные научились накапливать токсичное вещество в безопасной, связанной форме (перед тем как окончательно избавиться от него с мочой). Быстро удалять аммоний из организма и не беспокоиться о его токсичности позволяет синтез мочевины — вещества, собранного из двух молекул первоначального аммония.Синтез мочевины из аммония требует энергии и проводится пятью специально предназначенными для этого ферментами. Поломка каждого из них может приводить к тяжелому заболеванию, при этом наиболее опасны нарушения работы ферментов, которые отвечают за самые первые стадии синтеза — в таком случае накапливаются не (относительно безопасные) промежуточные продукты синтеза, а сам (токсичный) аммоний.
Понимая всё это, медики сразу же сделали генетический анализ Кайла и его родителей. Оказалось, что геном всех троих содержит поломку в гене карбамоилфосфатсинтазы (CPS1) — того самого фермента, что отвечает за первую стадию превращения аммония в мочевину. В геноме родителей, помимо поломанной, имелась рабочая копия гена CPS1 (то есть они были здоровыми носителями мутации), а вот в геноме Кайла совпали две неудачных копии гена, что и привело к развитию заболевания.
Для мальчика и его родителей диагноз означал очень плохие новости: повреждение гена CPS1 вызывает очень редкое (1 на 1 300 000 рождений) заболевание, которое приводит к смерти 50% новорожденных в течение первых недель после родов [28]. Единственным методом лечения может стать пересадка печени — именно там находятся основные запасы карбамоилфосфатсинтазы, — однако в первые месяцы ее делать не рекомендуют. К тому моменту, как младенцы дожидаются пересадки, у них уже может развиться тяжелый нейрологический дефицит, потому что высокие концентрации иона аммония в крови в первую очередь поражают мозг. Кроме того, каждая инфекция может стать смертельно опасной, потому что при борьбе с патогенами выделяется много свободного белка, и концентрация аммония в крови повышается.
Как всегда в таких случаях, Кайлу прежде всего назначили поддерживающую терапию и строгую диету с пониженным содержанием белка — чем меньше его в пище, тем меньше аммония требуется выводить из организма. Одновременно медики скооперировались со специалистами по генному редактированию и начали поиски персонализированной терапии для ребенка.
Сперва ученые разработали клеточную линию, которая содержала ту же форму карбамоилфосфатсинтазы, что и у Кайла, и «в пробирке» протестировали предлагаемый метод лечения. Речь идет о так называемом «редактировании оснований» (base-editing), которое позволяет изменять гены более безопасным способом, чем просто CRISPR/Cas9. В отличие от последнего, при редактировании оснований не происходит двуцепочечных разрывов в ДНК — они сами по себе являются для клетки большим стрессом и чреваты нецелевыми мутациями в других частях генома.
Через два месяца после рождения и диагностики была готова мышиная модель заболевания — ее создали специально под новорожденного. Через шесть месяцев были закончены токсикологические исследования терапии на мышах и приматах. Наконец, через семь месяцев Кайл получил первую дозу персонализированного лекарства — в виде простой инъекции.
Препарат представлял собой липидные наночастицы с двумя типами мРНК: одна кодировала редактирующий фермент, вторая указывала этому ферменту, в каком именно месте генома нужно проводить редактирование. По своему составу и методу производства такое лекарство очень похоже на ковидные вакцины Pfizer/BioNTech и Moderna. Разница заключается лишь в «начинке»: в случае вакцин результатом введения препарата является синтез S-белка коронавируса, в случае персонального генетического лекарства — синтез в клетках «набора для починки гена CPS1», то есть фермента-редактора и направляющей РНК.
После первого же введения лекарства биохимические показатели Кайла начали восстанавливаться, он перенес вирусную инфекцию, которая даже не привела к резкому росту аммония в крови. Однако поскольку показатели все-таки не достигли нормальных значений, еще через три недели мальчику ввели утроенную дозу лекарства. После этого восстановление нормального уровня аммония продолжилось, и Кайл уже смог полноценно питаться с точки зрения потребления белка. Он даже нормально перенес еще две инфекции. На момент публикации научной статьи мальчику было уже девять с половиной месяцев [29], а в апреле 2025-го он получил третью — вероятно, последнюю — дозу препарата.
К сожалению, на главный вопрос, касающийся безопасности генетической терапии, — не привело ли редактирование генома к нецелевым изменениям в других местах — ответа пока нет. Чтобы он появился, надо брать у ребенка биопсию печени, а это было сочтено неэтичным. При исследованиях на клеточной линии в одном случае наблюдалась нецелевая замена, но в безопасном участке генома. У мышей нецелевых замен не было даже при введении значительно больших доз, чем вводили потом человеку. Все это внушает надежду, но следует все-таки дождаться новых данных об эффективности и безопасности терапии.
Что можно сказать уже сейчас: скорость, с которой был разработан персонализированный препарат (всего семь месяцев от начала разработки до введения пациенту), безусловно, поражает. Это передний край науки: с момента изобретения метода редактирования оснований Дэвидом Лю (Гарвардский университет) прошло всего девять лет.
По последним данным, мальчик растет и развивается нормально, а прямо перед Новым годом начал делать первые шаги (рис. 12).

Рисунок 12. Кайл Малдун (KJ Muldoon) — первый ребенок, получивший персонализированную терапию методом генного редактирования.
Благодарю за помощь в подготовке материала Ярослава Ашихмина (к.м.н., кардиолога) и Александра Мельникова (сомнолога).
Литература
- Три поколения лекарств;
- Новости биофармы во второй половине 2024 года: клеточная терапия саркомы, новейшее лекарство от шизофрении, опухолевый атлас и многое другое;
- Редко, но метко: орфанные заболевания как вызов современной медицине;
- Биофарма в первом полугодии 2024: неслыханные генные новости, новые показания GLP-1, непокорный Альцгеймер;
- Elizabeth G. Gibson, Ben Bax, Pan F. Chan, Neil Osheroff. (2019). Mechanistic and Structural Basis for the Actions of the Antibacterial Gepotidacin against Staphylococcus aureus Gyrase. ACS Infect. Dis.. 5, 570-581;
- Margaret V. Ragni. (2015). Targeting Antithrombin to Treat Hemophilia. N Engl J Med. 373, 389-391;
- Время первых: как аденоассоциированные вирусы стали лучшими в доставке генов in vivo;
- Точный удар: как редактирование мРНК победит неизлечимые болезни;
- Simon Döhrmann, James Levin, Jason N. Cole, Allen Borchardt, Karin Amundson, et. al.. (2025). Drug–Fc conjugate CD388 targets influenza virus neuraminidase and is broadly protective in mice. Nat Microbiol. 10, 912-926;
- Christie Fanton, Jonathan Zalevsky. (2024). Recent patents in allergy and immunology: The interleukin‐2 receptor pathway agonist rezpegaldesleukin (REZPEG) for the rescue of regulatory T cells in chronic inflammatory and autoimmune diseases. Allergy. 79, 2565-2566;
- Тайны периферической иммунной регуляции — за что вручили Нобелевскую премию по физиологии и медицине (2025)?;
- МикроРНК с огромным влиянием — за что вручили Нобелевскую премию по медицине (2024);
- Генная терапия: познакомьтесь с лекарствами будущего;
- Как спасти Тринадцатую? (Перспективы лечения болезни Хантингтона);
- Sonia Dogra, Swara Shah, Lucas Gitzel, Bharani Pusukur, Aayushi Sood, et. al.. (2023). Baxdrostat: A Novel Aldosterone Synthase Inhibitor for Treatment Resistant Hypertension. Current Problems in Cardiology. 48, 101918;
- Спят усталые игрушки: о регуляции сна и роли орексина в этом процессе;
- Тяжелая жизнь без дистрофина: мышечная дистрофия Дюшенна;
- Музыка регенерации. Секретóм как основа бесклеточной терапии;
- Craig M McDonald, Eduardo Marbán, Suzanne Hendrix, Nathaniel Hogan, Rachel Ruckdeschel Smith, et. al.. (2022). Repeated intravenous cardiosphere-derived cell therapy in late-stage Duchenne muscular dystrophy (HOPE-2): a multicentre, randomised, double-blind, placebo-controlled, phase 2 trial. The Lancet. 399, 1049-1058;
- David K. C. Cooper. (2012). A Brief History of Cross-Species Organ Transplantation. Baylor University Medical Center Proceedings. 25, 49-57;
- РНК, ножницы, геномы: объявлены лауреаты Нобелевской премии по химии 2020;
- Longest human transplant of pig kidney fails — American Association for the Advancement of Science (AAAS);
- Pei Tao, Kaiyu Zhou. (2025). Recent progress in pig-to-human kidney xenotransplantation. Front. Immunol.. 16;
- Названы лауреаты Нобелевской премии-2015 по физиологии и медицине;
- Jigang Wang, Chong-Jing Zhang, Wan Ni Chia, Cheryl C. Y. Loh, Zhengjun Li, et. al.. (2015). Haem-activated promiscuous targeting of artemisinin in Plasmodium falciparum. Nat Commun. 6;
- ‘A sigh of relief’: New malaria drug succeeds in large clinical trial — American Association for the Advancement of Science (AAAS);
- Alexandra S. Probst, Douglas G. Paton, Federico Appetecchia, Selina Bopp, Kelsey L. Adams, et. al.. (2025). In vivo screen of Plasmodium targets for mosquito-based malaria control. Nature. 643, 785-793;
- On behalf of Arbeitsgemeinschaft für Pädiatrische Stoffwechselstörungen (APS); European registry and network for Intoxication type Metabolic Diseases (E-IMD); Erhebungseinheit für Seltene Pädiatrische Erkrankungen in Deutschland (ESPED); Austrian Metabolic Group; Swiss Paediatric Surveillance Unit (SPSU), Susanne Nettesheim, Stefan Kölker, Daniela Karall, Johannes Häberle, et. al.. (2017). Incidence, disease onset and short-term outcome in urea cycle disorders –cross-border surveillance in Germany, Austria and Switzerland. Orphanet J Rare Dis. 12;
- Kiran Musunuru, Sarah A. Grandinette, Xiao Wang, Taylor R. Hudson, Kevin Briseno, et. al.. (2025). Patient-Specific In Vivo Gene Editing to Treat a Rare Genetic Disease. N Engl J Med. 392, 2235-2243.