Новости биофармы во второй половине 2024 года: клеточная терапия саркомы, новейшее лекарство от шизофрении, опухолевый атлас и многое другое
17 января 2025
Новости биофармы во второй половине 2024 года: клеточная терапия саркомы, новейшее лекарство от шизофрении, опухолевый атлас и многое другое
- 1234
- 0
- 6
В 2024 году инноваций меньше не стало: новые одобрения и клинические новости появляются каждую неделю, и всё больше пациентов получают надежду на излечение.
Рисунок в полном размере.
иллюстрация Ирины Ефремовой
-
Автор
-
Редакторы
-
Иллюстратор
Полгода назад мы рассказывали о новостях биофармы за первую половину 2024 года. В обзоре второй половины пойдет речь о статистике новых лекарств, одобренных FDA, о новых ярких препаратах, новостях клинических исследований и фундаментальной биомедицинской науки. Расскажем о первых в своем роде клеточных терапиях, новых применениях лекарств от ожирения, неожиданной пользе вакцинации от опоясывающего лишая и новом подходе к редактированию генов.
Современные лекарства
Спецпроект о современных лекарствах, истории их создания, методах разработки и тенденциях развития.
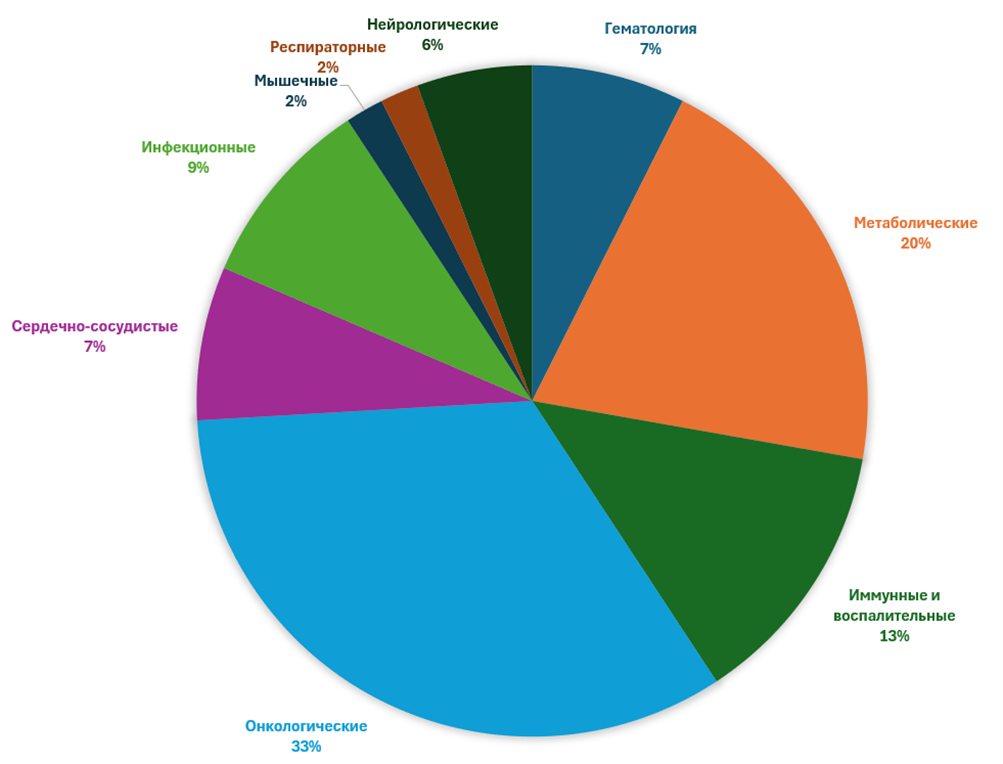
Начнем, как всегда, со статистики. В этом (то есть, 2024-м) году FDA одобрило не так много препаратов, как за год до того [1] , но вполне на уровне последних лет — поток инноваций не иссякает. Всего свет увидело 58 новых препаратов (против 69 в 2023-м), из них целых семь — продукты генной и клеточной терапии (рис. 1A)! Причем все они стали важной вехой в развитии этой передовой отрасли, и о некоторых мы далее расскажем подробнее. Интересно разнообразие областей, хотя онкология лидирует (в прошлом году было всего 16%). Половина одобрений — по орфанным (редким) показаниям (на «Биомолекуле» им посвящен спецпроект: «Редко, но метко: орфанные заболевания как вызов современной медицине») [2], 57% препаратов — первые в классе, то есть с совсем новым механизмом действия (в прошлом году их была всего треть) и впервые так много препаратов подано на одобрение малыми биофармацевтическими компаниями — целых 69%!
Традиции выпускать новости фармацевтической индустрии на «Биомолекуле» дважды в год исполнился годик! Предыдущие выпуски можно прочесть тут: «Биофарма в первом полугодии 2024: неслыханные генные новости, новые показания GLP-1, непокорный Альцгеймер» [3] и «Обзор новостей биофармы за 2023 год» [1]. До того эти материалы долгое время выходили на сайте «XX2 век».
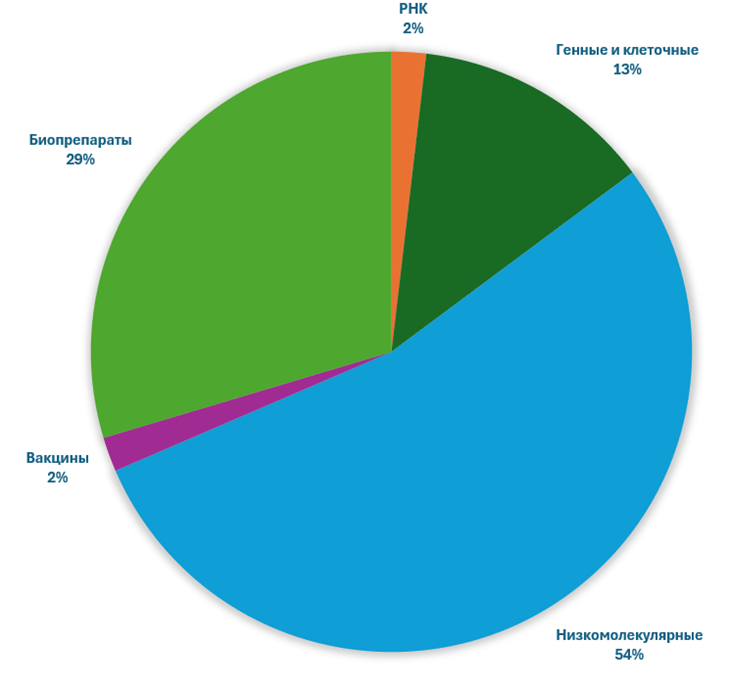
Низкомолекулярные вещества не сдают своих позиций (рис. 1Б): хоть многие и воспринимают эту модальность как «немодную», но больше половины новых лекарств — малые молекулы, и они продолжают приносить огромную пользу пациентам. Вкратце напомним, что очень грубо историю фармацевтики можно разделить на три большие волны инноваций (мы писали об этом в материале «Три поколения лекарств» [4]):
- Низкомолекулярные препараты (малые молекулы), которые вошли в обиход начиная со второй половины 20 века и в основном способны снимать симптомы, но не менять течение болезни и тем более не излечивать.
- Биопрепараты, восхождение которых началось с 1990-х годов, и которые смогли улучшать течение болезней, особенно аутоиммунных, онкологических и некоторых редких генетических. Самые ярким их примерам мы посвятили отдельный спецпроект (читайте: «Краткая история открытия и применения антител» [5] и «Терапевтические моноклональные антитела» [6]).
- Наконец, с 2010-х и по сей день мы становимся свидетелями третьей волны инноваций — передовых терапий, в том числе генных и клеточных (познакомьтесь с лекарствами будущего [7]), которые уже продемонстрировали потенциал излечения некоторых онкологических и редких заболеваний.
Рассмотрим подробнее несколько одобренных во втором полугодии препаратов передовой (и не только) терапии.
Многострадальный Mesoblast
Препарат Ryoncil (remestemcel-L) ознаменовал собой первое одобрение мезенхимальных стволовых клеток (МСК) в США!
Австралийская компания Mesoblast — фирма со сложной судьбой. Препарат донорских клеток [8] из костного мозга был разработан компанией Osiris Therapeutics, которая зарегистрировала его в Новой Зеландии (2011) и Канаде (2010), а затем продукт был продан Mesoblast, продолжившей разработку и зарегистрировавшей продукт в Японии (2015). Применяется он по показанию «рефрактерная к стероидам острая реакция трансплантат против хозяина» (РТПХ) у детей. РТПХ — это осложнение после пересадки гемопоэтических стволовых клеток, которое встречается у нескольких тысяч детей в мире в год.
В 2000-х было проведено исследование этого продукта и на детях, и на взрослых, но оно не достигло первичной конечной точки: результаты в экспериментальной группе почти не отличались от контроля [9]. В подгруппе педиатрических пациентов результаты были лучше, поэтому Mesoblast исследовал препарат у детей в возрасте от двух месяцев, перенесших пересадку донорских гемопоэтических стволовых клеток [10]. 70% детей ответили на терапию, однако исследование было одногрупповым, а не сравнительным, и результаты сравнивали с историческим контролем.
В США компания дважды (!) получала отказ FDA, несмотря на положительную рекомендацию независимого комитета — вопросы вызывала как эффективность, так и процесс контроля производства. И вот, наконец, долгожданное одобрение. Правда, рынок в США — максимум 400–500 пациентов в год, но с регуляторной точки зрения это важный прецедент.
При РТПХ клетки иммунной системы донора, содержащиеся в трансплантате, начинают атаковать ткани пациента. В случае острой РТПХ смертность достигает 35% [11]. Стандартной терапией тут являются стероиды, однако примерно 60% пациентов на них не отвечают. У таких пациентов (рефрактерных к стероидам) долгое время не было стандартной терапии: им дают различные иммуносупрессивные препараты off-label (то есть без одобрения по этому показанию).
Ситуация с лечением острой рефрактерной к стероидам РТПХ начала улучшаться в 2019 году, когда FDA был одобрен руксолитиниб (ингибитор JAK-киназ) компании Incyte для пациентов старше 12 лет. Однако и у него уровень ответов лишь 57%, а для детей младше 12 вообще никаких стандартных опций не существовало [11]. Так что одобрение Mesoblast — важное достижение.
Первая TCR-T терапия
Еще одно важное событие в мире клеточной терапии: FDA впервые одобрило генно-модифицированные клетки для лечения солидной опухоли английской компании Adaptimmune («Биомолекула» уже писала об этом событии [12]). Пока что это очень специальные клетки и относительно узкое показание (синовиальная саркома с особым маркером, примерно 400 пациентов в год в США), но лиха беда начало. Продукт представляет собой собственные клетки пациента, модифицированные подобно CAR-T [13], [14], только на поверхности у них не антительный фрагмент против опухолевого антигена, а наружная часть T-клеточного рецептора (TCR). Поэтому такие клетки называются TCR-T (рис. 2). В данном случае рецептор узнает пептидный фрагмент внутриклеточного белка MAGE-A4, связанный с белком HLA-A*02 на поверхности опухолевой клетки. Дальше, как и в случае CAR-T, ТСR-T клетка активируется и уничтожает раковую.
Пока что терапия подходит даже не для всех пациентов с синовиальной саркомой, а только для тех, у кого присутствует белок MAGE-A4 и у кого молекулы главного комплекса гистосовместимости (Human Leukocyte Antigen, HLA) имеют подтип HLA-A*02 (это примерно половина населения).
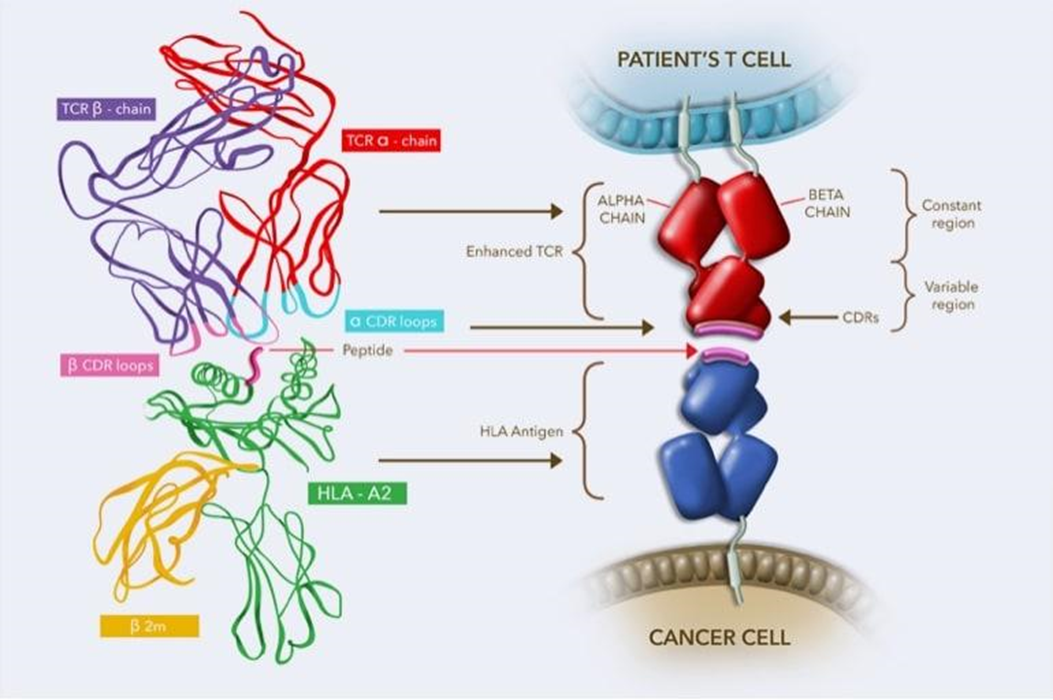
Рисунок 2. Справа: Схема взаимодействия Т-клеточного рецептора на поверхности Т-лимфоцита с пептидом в комплексе с HLA на поверхности раковой клетки. Слева: то же, в молекулярном формате.
В клиническом исследовании у 39% пациентов (44 человека, не ответивших на предыдущую химиотерапию) наблюдался ответ на терапию после однократной инъекции [15]. На этом основании продукт получил условное одобрение: компания должна предоставить данные подтверждающего клинического исследования, а иначе одобрение будет отозвано. Но пока что компания будет продавать продукт за $727 000. У тех, кто ответил на терапию, наблюдается долговременная выживаемость — 70% в течение двух лет.
Это уже второе одобрение клеточной терапии солидных опухолей за год: в феврале компания Iovance получила одобрение немодифицированных опухоль-инфильтрующих лимфоцитов по меланоме (мы писали об этом в обзоре за первую половину года [3]). Однако это первое одобрение модифицированных клеток, первое одобрение по саркоме более чем за 10 лет, и первое одобрение для Adaptimmune.
ATTR с кардиомиопатией
Компания Alnylam — лидер в разработке РНК-терапий — опубликовала одну из самых долгожданных новостей этого года. И она оказалась положительной! Речь идет о лекарстве вутрисиран против редкой болезни — транстиретинового амилоидоза (мы посвящали ему отдельную публикацию: «Руку, ногу и сердце: редкий АТТR-амилоидоз» [16]). Препарат действует по механизму РНК-интерференции [17] и уже был одобрен в 2022 для другой формы ATTR — c полинейропатией [18]. А недавно были опубликованы данные исследования HELIOS-B у пациентов с кардиомиопатией при ATTR. Препарат снизил смертность через 42 месяца на 36% по сравнению с контрольной группой, которая включала и тех, кто получал препарат-конкурент tafamidis (Pfizer). Tafamidis, как и одобренный в ноябре 2024 acoramidis компании BridgeBio, — малая молекула, стабилизатор транстиретина, не дающая неправильно свернутому белку накапливаться в сердечной мышце; принимается два раза в сутки перорально. Вутрисиран же — РНК-препарат, препятствующий синтезу дефектного транстиретина, — вводится раз в три месяца подкожно. И тот, и другой приводят к снижению смертности от этой болезни, но чем больше препаратов, тем лучше, потому что те, кто не переносят один препарат или не отвечают на него, могут перейти на другой.
Пациентов с кардиомиопатией на порядок больше, поэтому за рынок идет такая борьба. В разработке также находится еще один антисмысловой олигонуклеотид Ionis/AstraZeneca, а вот компания Intellia остановила разработку по генному редактированию.
Лекарство от шизофрении нового класса — впервые за 70 лет
В сентябре 2024 года FDA одобрило новый препарат от шизофрении компании Bristol Myers Squibb (BMS) — Cobenfy (xanomeline-trospium, KarXT).
Большинство применяемых сейчас антипсихотиков было разработано до 2010-х годов и эксплуатирует ограниченное число механизмов в мозге, в основном действуя либо через серотониновые, либо через дофаминовые рецепторы [19], [20]; — то есть лекарств с новым механизмом не появлялось уже лет семьдесят. А новые лекарства нужны — далеко не всем подходят существующие. Учитывая то, какая шизофрения загадочная болезнь [20], человечество пока не умеет разрабатывать лекарства от нее полностью рациональным путем (когда изучают молекулярный механизм болезни и, понимая его, делают молекулу), поэтому препараты получаются по большей части методом проб и ошибок. В данном случае, судя по всему, и разработчикам, и пациентам повезло.
Новый препарат — комбинация двух действующих веществ, которые, правда, тоже далеко не из новых, но идея их сочетания оригинальна и весьма остроумна. Первое вещество — ксаномелин (агонист мускариновых рецепторов) — было открыто в начале 1990-х; исследовалось по шизофрении и болезни Альцгеймера, однако использования в клинике не нашло по причине токсичности: препарат хотя и оказывает антипсихотическое действие, но распределяется по всему организму, действует на мускариновые рецепторы в ЖКТ и вызывает нежелательные явления: тошноту, рвоту, диарею, запоры. Поэтому ученые стали искать другое вещество, которое бы «отменило» эффекты ксаномелина на периферии, но не влияло бы на его действие в ЦНС. И вот удача! Такое вещество нашлось — препарат троспиум, который был запатентован аж в 1966 году и с тех пор использовался для лечения синдрома гиперактивного мочевого пузыря. Троспиум — антагонист мускариновых рецепторов, который при этом не проникает в ЦНС. Он связывается с рецепторами, на которые воздействует ксаномелин, везде, кроме мозга (рис. 3).
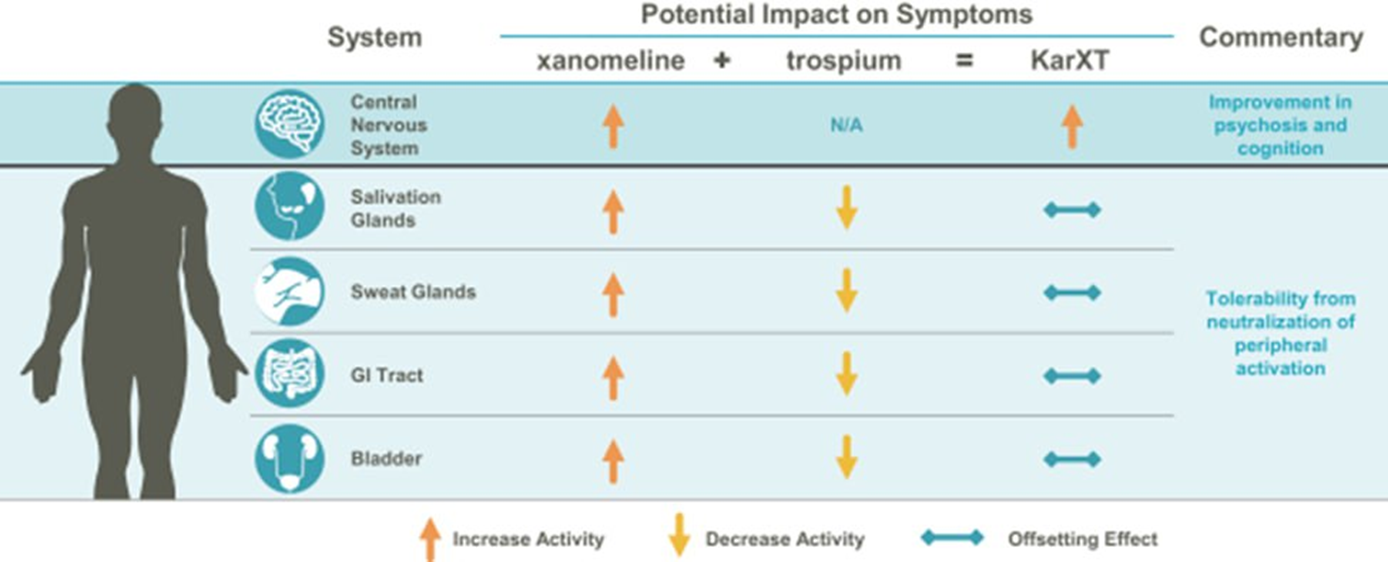
Рисунок 3. Влияние ксаномелина, троспиума и их комбинации на различные системы органов.
Механизм действия позволил добиться успеха в трех исследованиях третьей фазы (что бывает далеко не всегда): нежелательные явления хотя и присутствовали, но были достаточно легкими — из экспериментальной группы выбыло не больше пациентов, чем из группы плацебо. Причем отсутствовали типичные для других антипсихотиков явления, такие как сонливость, набор веса, моторные нарушения. Эффективность также оказалась на высоте: препарат обогнал плацебо на 9,6 пунктов по шкале симптомов шизофрении. Другие конечные точки тоже достоверно улучшились по сравнению с плацебо. Хотя разные исследования сравнивать нельзя, с осторожностью можно сказать, что это не хуже, чем у препаратов на рынке.
Препарат разработала компания Karuna, которая взяла лежавший много лет на полке ксаномелин, выбрала среди более чем 7000 кандидатов троспиум и провела необходимые клинические исследования. В конце 2023 года Karuna была куплена BMS за $14 млрд.
Теперь перейдем к новостям клинических исследований.
Продолжается поступь лекарств от ожирения
В новостях первой половины 2024 я уже писал об успехах тирзепатида в лечении обструктивного апноэ [3]. 20 декабря 2024 года Eli Lilly получила одобрение FDA по этому показанию. Но этим новости аналогов GLP-1 и других препаратов по ожирению далеко не ограничиваются.
Еще в 2020 году семаглутид показал хорошие, хоть и ранние данные по метаболическому ожирению печени MASH (metabolic associated steatohepatitis — раньше это называлось неалкогольным стеатогепатитом). В 2024 году фаза 3 подтвердила успех препарата по этому показанию. Результаты оказались как минимум не хуже, чем у одобренного в марте Ресметирома. Это очень хорошо, потому что MASH долго не поддавалась никакой фармакотерапии, а тут уже второе лекарство, и еще их, возможно, удастся комбинировать для достижения более глубокого эффекта, ведь механизм действия совершенно разный.
На «Биомолекуле» есть прекрасная статья, раскрывающего суть революции, произведенной этим препаратом: «Оземпик: больше, чем средство для похудения» [21].
Помимо сердечно-сосудистых, печеночных заболеваний и сонного апноэ, семаглутид и его друзья уже показали перспективы в лечении следующих болезней:
- Почечная недостаточность: семаглутид показал значительное снижение риска острой почечной недостаточности у пациентов с диабетом 2 типа и хронической болезнью почек [22]. Novo Nordisk собирается подавать досье на одобрение по этому показанию.
- Пред-диабет: тирзепатид показал снижение риска развития диабета на 90% по сравнению с плацебо у пациентов с ожирением и высоким риском развития диабета 2 типа [23].
- Раки, ассоциированные с ожирением: у пациентов, которые принимали агонисты рецептора GLP-1 (семаглутид, тирзепатид, дулаглутид) риск колоректального рака снижался на 44%. Это ретроспективное исследование (были изучены медицинские записи 1,2 млн человек), поэтому о причинно-следственной связи говорить рано. Еще одно ретроспективное исследование записей 1,6 млн человек показало снижение риска для 10 из 13 раков, связанных с ожирением, у диабетиков, принимавших агонисты рецептора GLP-1 [24]. Особое внимание уделяется риску рака поджелудочной железы, поскольку применение агонистов рецептора GLP-1 повышает риск панкреатита, а он может привести к раку. Но специальное ретроспективное исследование показало, что повышенного риска рака поджелудочной при приеме этих препаратов не наблюдается [25]. Единственный рак, относительно которого есть основания предполагать повышение риска — это рак щитовидной железы. Однако для утверждений о причинно-следственной связи и реальном размере эффекта нужны дальнейшие исследования. Пока что семаглутид и его друзья противопоказаны пациентам с повышенным риском развития этого рака.
- Болезнь Альцгеймера. В ретроспективном исследовании было обнаружено, что семаглутид снижал риск развития болезни Альцгеймера у диабетиков на 70% по сравнению с теми, кто принимал только инсулин и на 40% — по сравнению с другими агонистами GLP-1R (в их число не входил тирзепатид, получивший одобрение относительно недавно) [26]. Компания Novo Nordisk начала рандомизированные исследования семаглутида у пациентов с болезнью Альцгеймера ранней стадии, чтобы доказать причинно-следственную связь между приемом семаглутида и защитой от прогрессии болезни [27]. Результаты мы узнаем совсем скоро — в 2025 году.
- Для других нейродегенеративных заболеваний тоже показана ассоциация между приемом агонистов GLP-1R и снижением риска у диабетиков [28]. Недавно в фазе 2 были получены положительные результаты для еще одного агониста GLP-1R — ликсисенатида — по болезни Паркинсона [29]. Правда, результаты еще одного препарата, экзенатида, оказались весьма скромными, и его разработка по болезни Паркинсона продолжена не была [30].
- Алкогольная, никотиновая и наркотическая зависимость. Довольно неожиданный эффект, но, если вдуматься, один из механизмов ожирения — это зависимость от еды. Ретроспективное исследование и тут показало снижение тяги к алкоголю и опиатам у пациентов, принимавших агонисты GLP-1R [31]. А небольшое рандомизированное исследование семаглутида у алкоголиков уже показало предпосылки к эффективности по сравнению с плацебо.
- Аутоиммунные заболевания. Ретроспективное исследование у пациентов с астмой показало снижение астматических приступов аж на 70% у пациентов, получавших семаглутид в сочетании с метформином. Рандомизированное исследование ведется, результаты будут в 2026 году. Началось также исследование тирзепатида по псориазу в сочетании с одним из стандартных препаратов.
- Другие показания, связанные с ожирением: остеоартрит колена [32], периферическая болезнь артерий [33].
Подытожим: надежные доказательства у семаглутида и тирзепатида есть для лечения диабета 2 типа, ожирения, сонного апноэ (только у тирзепатида), снижения рисков сердечно-сосудистых и почечных заболеваний, печеночного стеатогепатита — что уже немало. По остальным показаниям есть очень хорошие предпосылки, но исследования пока идут. Даже если только для части из них будет показана эффективность, это очень сильно расширит их сферу применения и увеличит размер рынка.
Появляется всё больше свидетельств, что эти препараты могут действовать независимо от снижения веса, а значит, есть надежда что они (или их более совершенные аналоги) будут помогать от упомянутых выше заболеваний не только пациентам с ожирением.
Продолжают выходить и данные исследований по ожирению новых препаратов, например, CagriSema (комбинация семаглутида и двойного агониста амилина и кальцитонина) от Novo Nordisk и Maritide от Amgen (биспецифический агонист рецептора GLP-1 и антагонист рецептора GIP). Они показывают эффективность на уровне тирзепатида, то есть в районе 20% снижения веса за год. Идут десятки исследований новых агентов на более ранних стадиях.
В общем, специалисты не зря говорят о том, что появление аналогов GLP-1 стало беспрецедентной революцией в фармацевтике, и впереди нас наверняка ждет много увлекательных открытий.
Pfizer врывается в мир контроля над весом!
... но с другой стороны. В то время как почти вся фарма занята снижением веса, Pfizer успешно протестировал лекарство для его повышения. Сниженный вес — большая проблема, особенно у онкологических больных, которые, несмотря ни на какое питание, не могут набрать достаточный вес (такое состояние называется кахексия). Одобренных лекарств от кахексии не существует.
Pfizer разработал антитело ponsegromab против фактора GDF-15, который связывается с рецептором GFRAIL в мозге и модулирует потерю веса, анорексию и кахексию. Пациенты на высшей дозе препарата набрали на 5,6% веса через 12 недель, в то время как в плацебо-группе вес продолжал снижаться (рис. 4) [34]. Отмечена хорошая переносимость лекарства.
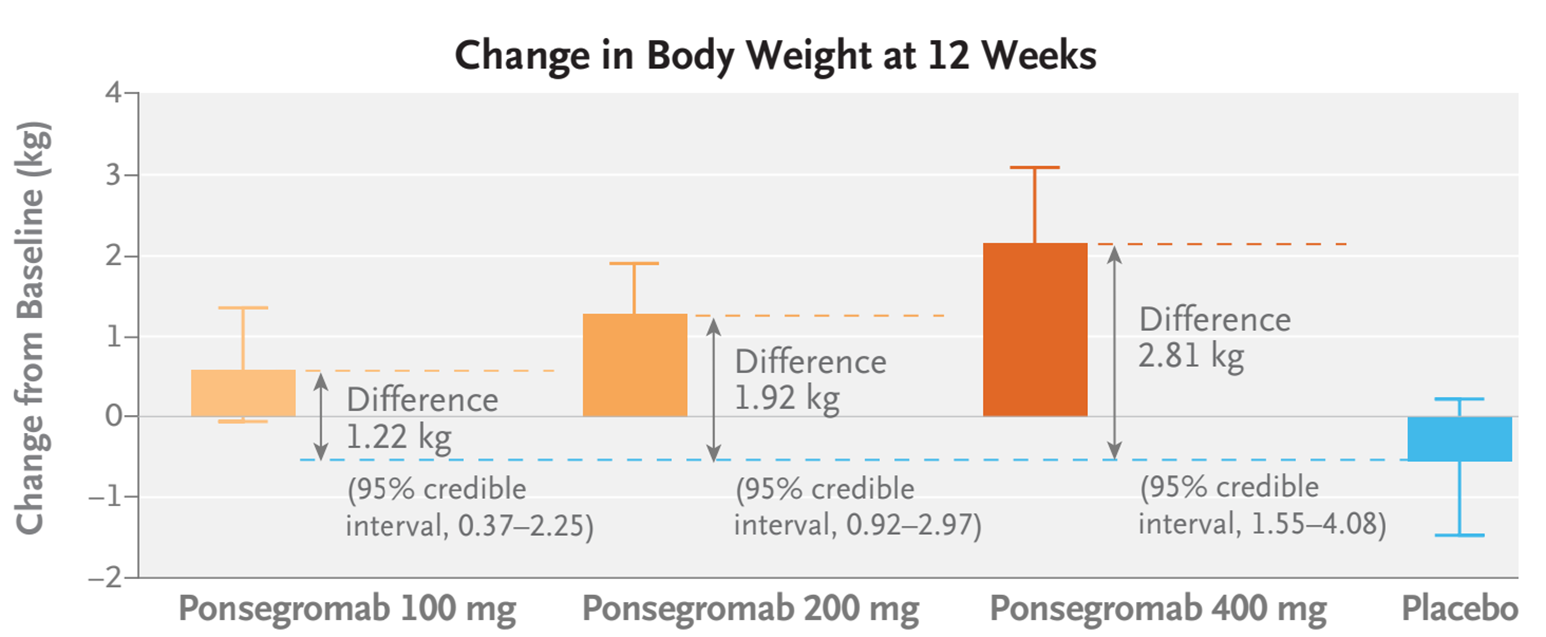
Рисунок 4. Изменение веса под действием разных доз терапевтического антитела и плацебо. Те, кто получал ponsegromab в дозах 100, 200 и 400 мг, прибавили в весе через 12 недель (причем прибавка была тем больше, чем больше доза — хороший признак эффективности), в то время как в плацебо-группе пациенты в среднем немного потеряли в весе.
Первый успех в идиопатическом фиброзе легких за десятилетие
Идиопатический легочный фиброз (ИЛФ) — редкое неизлечимое заболевание легких с высокой летальностью. Идиопатическим он называется потому, что неясно, почему он начинается: известно только, что среди факторов риска — курение и возраст. При этой болезни ткань легких постепенно заменяется фиброзной (соединительной) — попросту говоря, шрамами. Внешние симптомы — затрудненность дыхания и кашель; затем добавляются повышенная утомляемость, боль в суставах, потеря веса. В среднем пациенты умирают через 3–5 лет после постановки диагноза.
Смертность позволяет снизить пересадка легких, однако это очень дорогая и труднодоступная процедура со своими осложнениями. Хотя за последние десять лет на рынок вышло два препарата, снижающие смертность — нинтеданиб [35] и пирфенидон [36], — они помогают не всем и вызывают неприятные нежелательные явления, в первую очередь со стороны ЖКТ. В итоге многие пациенты отказываются от их постоянного приема. Поэтому для лечения ИЛФ требуются новые средства — и на прошлой неделе был объявлен результат большого исследования фазы 3 для препарата nerandomilast компании Boehringer Ingelheim.
Препарат показал статистически значимое преимущество над плацебо по первичной конечной точке — изменению форсированной жизненной емкости легких (FVC) через 52 недели. В начале 2025 компания обещает опубликовать полные данные — тогда мы узнаем, насколько преимущество оказалось клинически значимым. Данные фазы 2 на протяжении 12 недель были вполне убедительными (рис. 5) [37].
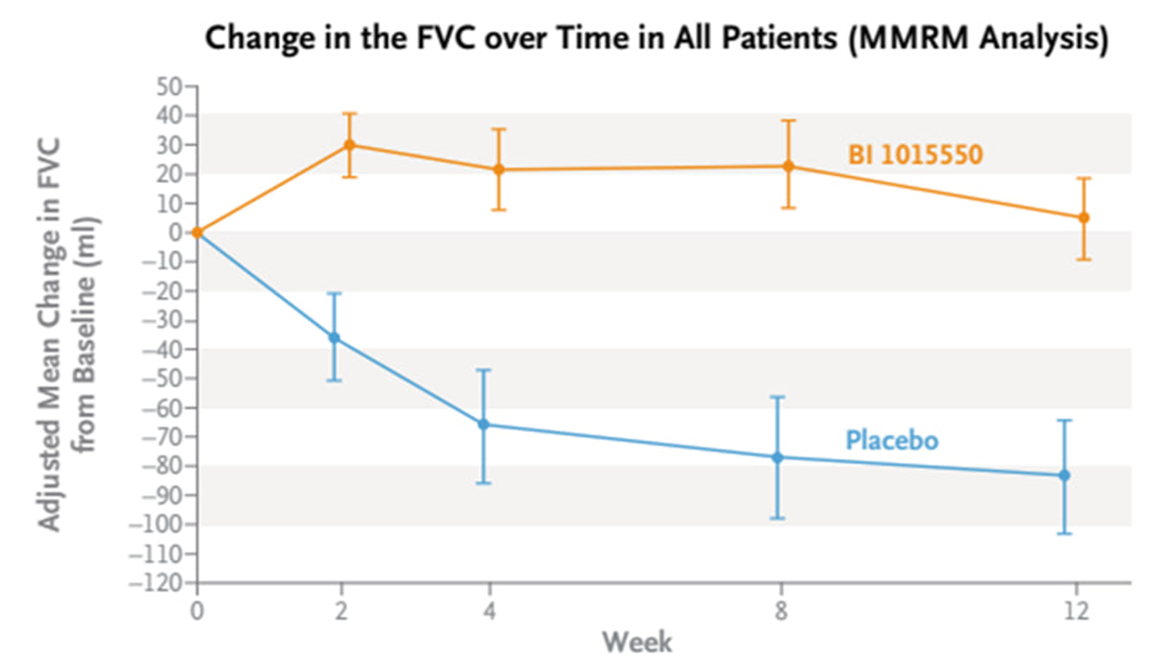
Рисунок 5. Изменение форсированной жизненной емкости легких (FVC) в группе нерандомиласта по сравнению с плацебо (это ключевой показатель, отражающий максимальный объем воздуха, который человек может выдохнуть после глубокого вдоха). У тех, кто принимал препарат, показатель FVC в среднем не изменился через 12 недель, тогда как в группе плацебо упал в среднем на 80 мл.
Препарат представляет собой низкомолекулярный ингибитор фосфодиэстеразы 4B (PDE4B) — фермента, который опосредует фиброз и воспаление и преимущественно экспрессируется в легких [36]. В разработке довольно много препаратов против идиопатического легочного фиброза, а еще больше — уже провалились, так что любой успех здесь — важная новость.
Как снизить риск деменции? Вакцинироваться от лишая?
Появилось еще одно исследование о связи между вакцинацией от опоясывающего лишая и снижением риска деменции [38]. Анализ пяти предыдущих исследований, включавших более 100 000 человек, показал, что у вакцинированных риск развития деменции снижается примерно на 16%. Каков тут механизм и как такое вообще возможно?
Опоясывающий лишай вызывается вирусом Varicella zoster — тем же, которому мы обязаны детской ветрянкой. Проблема с ветрянкой в том, что иммунная система не способна уничтожить вирус полностью: после видимого окончания заболевания он прячется в спинальных ганглиях, и до поры до времени иммунная система контролирует его. Однако со временем контроль ослабевает, вирус просыпается и вызывает значительно более тяжелое заболевание. Опоясывающий лишай, помимо крайне неприятных высыпаний, может приводить к хроническому болевому синдрому и слепоте. Он лечится антивирусными лекарствами, но только в первые 72 часа после начала симптомов, и не всегда болезнь удается диагностировать в этом промежутке времени.
Соответственно, если человек в детстве был привит от ветрянки или позже от опоясывающего лишая (на сегодняшний день в мире одобрено две таких вакцины для людей старше 50), то его шансы заболеть сильно снижаются. При чем же тут деменция?
После своего пробуждения вирус путешествует вдоль нервных пучков и, конечно, попадает и в головной мозг. Ранее при вскрытии больных с болезнью Альцгеймера у них находили повышенные количества вирусов того же семейства, поэтому связь вирусных заболеваний с развитием различных деменций подозревают давно. Уже начато рандомизированное исследование антивирусного препарата валацикловира против болезни Альцгеймера, очень интересно будет увидеть результаты.
Конкурент пембролизумаба
Антитело Китруда (пембролизумаб) компании Merck&Co (MSD) прочно занимает первое место в списке лекарств по уровням продаж уже несколько лет подряд. Поэтому любые новости о препаратах, способных потеснить Китруду с пьедестала, вызывают звучный резонанс.
Недавно наделал шуму биспецифический препарат [39] китайской компании Akeso под названием ivonescimab, когда были опубликованы данные фазы 3 на первой линии рака легкого в сравнении с пембролизумабом. Ivonescimab продлил время до прогрессирования или смерти (PFS) на 49% по сравнению с пембролизумабом, причем эффект наблюдался и в группах с низкой экспрессией PD-L1 — то есть в популяции пациентов, у которой ниже вероятность работы анти-PD-1 препаратов.
Это двойное антитело, направленное как против PD-1, так и против VEGF (vascular endothelial growth factor). VEGF — мишень широко известного препарата Авастин (бевацизумаб), его подавление ограничивает рост сосудов, что должно приводить к ухудшению снабжения опухоли питательными веществами и кислородом и к ее регрессии. Правда, не во всех случаях это работает. Авастин применяется при ряде раков, однако противопоказан при плоскоклеточном раке легкого — он вызывает тяжелые кровотечения в легких. У ivonescimab таких проблем почти не было: частота легочных кровотечений не сильно отличалась от контрольной группы. Вероятно — за счет того, что анти-PD-1 компонент продукта в основном удерживает его в опухоли.
Однако исследование проводилось на китайских пациентах, поэтому есть риск, что результаты не удастся воспроизвести в глобальном исследовании, которое нужно для одобрения в США. Кроме того, остается вопрос, трансформируется ли преимущество PFS в удлинение общей выживаемости — такое в онкологии происходит далеко не всегда.
Помимо монотерапии, ivonescimab исследуется в сочетании с химиотерапией и в более поздних линиях терапии. Если он побьет пембролизумаб и в этих исследованиях, это будет суперуспех. Неслучайно акции Summit (со-разработчика Akeso) выросли с прошлого года почти в 20 раз.
Первое редактирование РНК у людей
Дефицит ААТ (альфа-1-антитрипсин) — генетическое заболевание, приводящее к тяжелым поражениям легких и печени.
Компания Wave Life Sciences представила клинические данные, согласно которым у двух пациентов с дефицитом ААТ уровень фермента превзошел 60% от нормального всего лишь через 15 дней после введения терапии и держался там минимум два месяца! Wave применила свой подход к пациентам, у которых ААТ вообще отсутствует, что позволило оценить эффективность терапии по уровню фермента.
Редактирование РНК стало возможным благодаря открытию эндогенного фермента ADAR (adenosine deaminase acting on RNA, действующая на РНК аденозиндезаминаза) у позвоночных [40]. ADAR связывается с двухцепочечными участками РНК и дезаминирует аденозин. В итоге получается инозин — неканонический нуклеозид, который считывается трансляционным аппаратом клетки как гуанозин, спаривая его с цитозином (рис. 6) [41]. Таким образом, можно изменить закодированную в геноме аминокислоту на другую.
В компании Wave разработали платформу для скрининга подходящих РНК, и именно так им удалось идентифицировать олигонуклеотид, приводящий к перекодированию лизина обратно в глутамат (одна из генетических причин дефицита ААТ — мутация E342K).
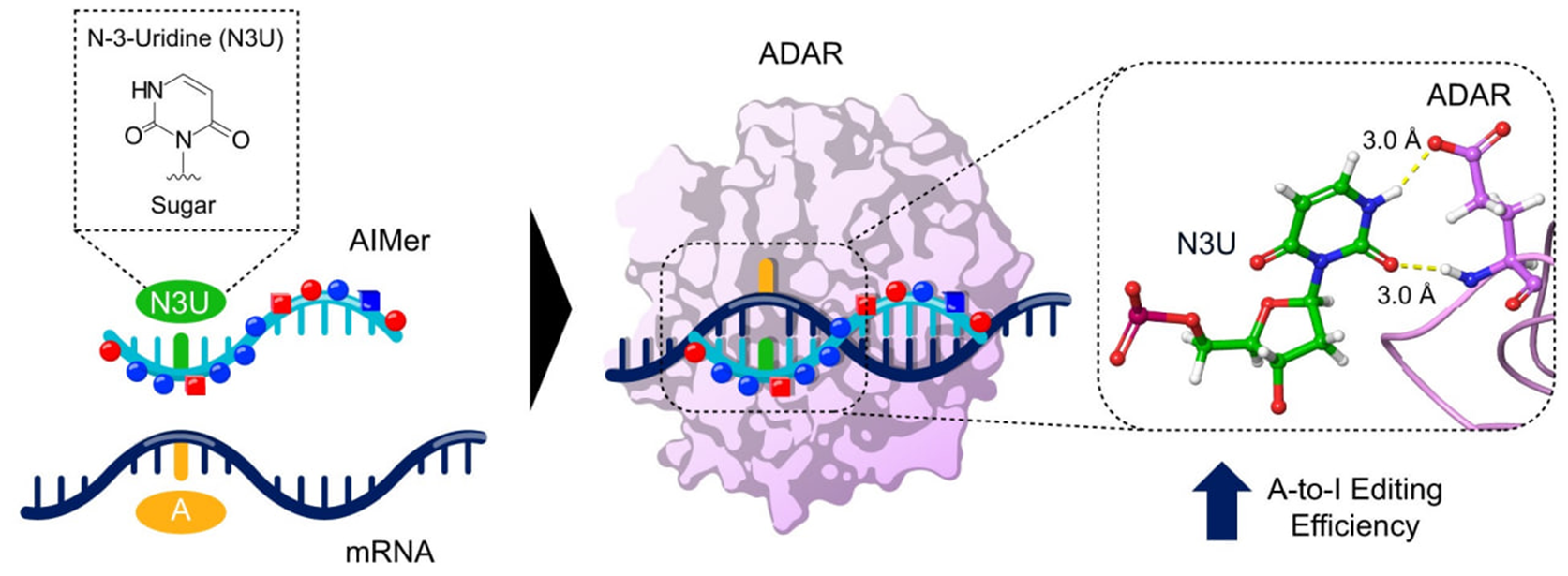
Рисунок 6. Схема редактирования мРНК компании Wave Life Sciences. Кстати, совсем недавно на «Биомолекуле» вышла статья «Точный удар: как редактирование мРНК победит неизлечимые болезни» [42], рассказывающая об успехах компании Wave во всех подробностях — рекомендуем почитать!
У РНК-редактирования огромные перспективы в лечении генетических заболеваний (и не только). Это не удаление и не добавление нового, а именно изменение (рис. 6), что особенно ценно в ряде случаев.
Альтернативный подход к лечению дефицита AAT — генное редактирование методом замены аденина на гуанин прямо в геномной ДНК. Этот подход тестирует компания Beam Therapeutics, она уже начала клиническое исследование, и первые результаты мы узнаем в 2025 году. Однако потребуются данные долговременного наблюдения за безопасностью и эффективностью, чтобы определить, какой из двух подходов более привлекателен.
И, напоследок, несколько новостей более фундаментальной науки.
Новый подход к редактированию генов
В 2024 году был опубликован новый метод редактирования генов — без образования двухцепочечных разрывов ДНК, которые потенциально могут приводить к нежелательным эффектам [43]. Первые методы редактирования генома — ZFN, TALEN, CRISPR/Cas9 — вносят такие разрывы. Prime editing, описанный впервые в 2019 году в статье сотрудников Гарвардской лаборатории во главе с Дэвидом Лю, обходится без двухцепочечных разрывов, но не способен вносить большие изменения [44].
В новом методе для редактирования генома используется так называемая bridge RNA (bRNA), которая может узнавать сразу два участка ДНК — целевой и донорский. Вы добавляете в клетку три компонента: bRNA, донорскую ДНК и фермент рекомбиназу; а на выходе получаете донорскую ДНК, вставленную на место целевой. Ученые продемонстрировали, что таким образом можно не только добавлять, но и вырезать и инвертировать участки ДНК. Правда, пока только в кишечной палочке и не со стопроцентной эффективностью, но это же только начало! Технология открывает новые перспективы более гибкого и безопасного генного редактирования и может стать следующим поколением после CRISPR/Cas9 и prime editing.
Видео 1. Ученые Arc Institute (Пало-Альто, Калифорния, США) открыли механизм рекомбинации ДНК у бактерий, который позволяет вставлять, инвертировать и вырезать большие фрагменты ДНК без двухцепочечных разрывов, что было невозможно с помощью предыдущих методик.
Токсоплазма для доставки лекарств в мозг?
Доставка препаратов за гематоэнцефалический барьер — большая проблема. На «Биомолекуле» ей посвящена специальная статья [45] в рамках спецпроекта «Нейрофармакология». Удивительно, но для решения этой проблемы найден необычный союзник в виде паразитического простейшего — токсоплазмы. Этот паразит размножается только внутри представителей семейства кошачьих, но обладает необычным свойством: если он попадает в животных другого вида (например, крыс), он проникает к ним в мозг и заставляет меньше бояться кошачьих.
Именно свойство хорошо проникать в мозги и привлекло внимание ученых и заставило их начать разработку средства доставки лекарств в мозг на основе токсоплазмы (вот так токсоплазма опосредованно повлияла не только на мозги крыс, но и людей). В Израиле уже основана компания Epeius Pharma, которая занимается этой разработкой, и им уже удалось доставить белок MecP2 (связан с патогенезом редкого заболевания — синдрома Ретта) в нейроны мышей. Теперь исследователи работают над удалением из токсоплазмы всего, что может навредить мозгу человека, чтобы добиться достаточно безопасного способа доставлять лекарства в мозг. Подробнее читайте в статье на «Биомолекуле»: «Да, паразитирую! И дарю новые возможности!» [46].
Трехмерный атлас опухолей
Мы уже писали о клеточных атласах [47] в спецпроекте «Мультиомиксные технологии», упоминали и клеточный атлас опухолей TCGA. В этом году вышел важный апдейт другого проекта The Human Tumor Atlas Network (HTAN) — в журнале Nature было опубликовано сразу 12 статей с новыми данными. HTAN делает акцент на многомерных данных, динамическом наблюдении за клетками и трехмерной визуализации развития онкологических процессов. HTAN широко использует такие современные методы, как секвенирование отдельных клеток [48] и пространственное мультиплексирование (spatial multiplexing — при котором не только определяется последовательность нуклеиновых кислот, но и их положение в клетке), что позволяет перейти на следующий уровень сложности изучения раковых клеток, недоступный при секвенировании нуклеиновых кислот из смеси клеток, как в случае TCGA. Кроме того, такие исследования позволяют восстановить временнýю последовательность процессов, то есть создать 4D-визуализацию опухоли.
Инициатива HTAN началась в 2018 году под эгидой The Cancer Moonshot (программа борьбы с раком, запущенная президентом Бараком Обамой в 2016, возглавлялась вице-президентом Джо Байденом). Программа ведется в 10 центрах в США (рис. 7).
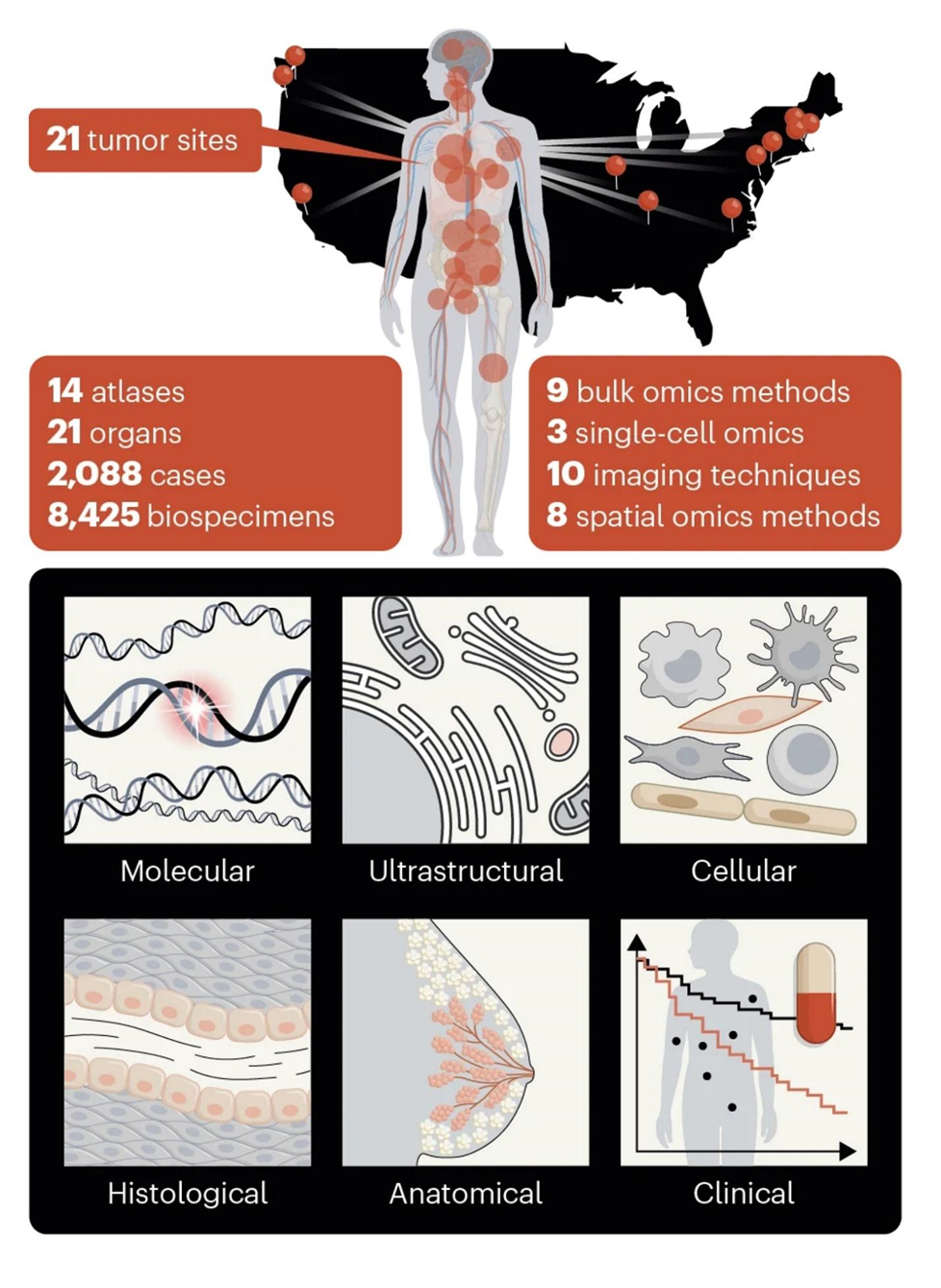
Рисунок 7. Вверху — статистика достижений программы HTAN. Внизу — типы данных, которые комбинируются для получения новой информации о раке
В опубликованных статьях речь идет о следующих достижениях:
- Изучено, как взаимодействуют между собой аберрантные клетки в предраковых образованиях в случае колоректального рака, как затем в ходе опухолевой эволюции отбирается доминирующий клон, дающий начало злокачественной опухоли.
- На модели семейного аденоматозного полипоза изучено, как происходит взаимодействие иммунной системы с формирующимся полипом. Проанализированные данные включают в себя геном, транскриптом, протеом, метаболом, метилом и липидом [49].
- На моделях рака молочной железы и колоректального рака показано, как опухолевое микроокружение взаимодействует с иммунной системой и как происходит инвазия и метастазирование опухолевых клеток в новые органы (на примере печени). Тут — короткое видео с наглядными картинками.
Такие исследования очень важны: во-первых, визуализация всегда помогает лучше понять природу происходящих процессов, во-вторых, всё лучше постигая сложность устройства раковых опухолей, процессы их возникновения и динамику развития, ученые приближаются к созданию новых, более совершенных лекарств.
В 2025 году ожидается множество новостей в области разработки новых лекарств, самые интересные из которых я буду публиковать в своем Телеграм-канале «Инвестиции в крутейшие лекарства», а в полугодовых новостях на «Биомолекуле» — суммировать их, уделяя больше внимания биолого-медицинским вопросам.
Литература
- Обзор новостей биофармы за 2023 год;
- Редко, но метко: орфанные заболевания как вызов современной медицине;
- Биофарма в первом полугодии 2024: неслыханные генные новости, новые показания GLP-1, непокорный Альцгеймер;
- Три поколения лекарств;
- Краткая история открытия и применения антител;
- Терапевтические моноклональные антитела;
- Генная терапия: познакомьтесь с лекарствами будущего;
- Клетки, которые лечат людей;
- Partow Kebriaei, Jack Hayes, Andrew Daly, Joseph Uberti, David I. Marks, et. al.. (2020). A Phase 3 Randomized Study of Remestemcel-L versus Placebo Added to Second-Line Therapy in Patients with Steroid-Refractory Acute Graft-versus-Host Disease. Biology of Blood and Marrow Transplantation. 26, 835-844;
- Joanne Kurtzberg, Hisham Abdel-Azim, Paul Carpenter, Sonali Chaudhury, Biljana Horn, et. al.. (2020). A Phase 3, Single-Arm, Prospective Study of Remestemcel-L, Ex Vivo Culture-Expanded Adult Human Mesenchymal Stromal Cells for the Treatment of Pediatric Patients Who Failed to Respond to Steroid Treatment for Acute Graft-versus-Host Disease. Biology of Blood and Marrow Transplantation. 26, 845-854;
- Donna Przepiorka, Lola Luo, Sriram Subramaniam, Junshan Qiu, Ramadevi Gudi, et. al.. (2020). FDA Approval Summary: Ruxolitinib for Treatment of Steroid-Refractory Acute Graft-Versus-Host Disease. The Oncologist. 25, e328-e334;
- Tecelra: явный прорыв в лечении синовиальной саркомы?;
- Способны ли CAR-Т-клетки уничтожить опухоль?;
- Как первые российские CAR-T-клетки с опухолью боролись;
- Sandra P D'Angelo, Dejka M Araujo, Albiruni R Abdul Razak, Mark Agulnik, Steven Attia, et. al.. (2024). Afamitresgene autoleucel for advanced synovial sarcoma and myxoid round cell liposarcoma (SPEARHEAD-1): an international, open-label, phase 2 trial. The Lancet. 403, 1460-1471;
- Руку, ногу и сердце: редкий АТТR-амилоидоз;
- РНК-интерференция: повторный успех;
- Susan J. Keam. (2022). Vutrisiran: First Approval. Drugs. 82, 1419-1425;
- Дофаминовые болезни;
- Болезнь потерянных связей;
- Оземпик: больше, чем средство для похудения;
- Vlado Perkovic, Katherine R. Tuttle, Peter Rossing, Kenneth W. Mahaffey, Johannes F.E. Mann, et. al.. (2024). Effects of Semaglutide on Chronic Kidney Disease in Patients with Type 2 Diabetes. N Engl J Med. 391, 109-121;
- Ania M. Jastreboff, Carel W. le Roux, Adam Stefanski, Louis J. Aronne, Bruno Halpern, et. al.. (2024). Tirzepatide for Obesity Treatment and Diabetes Prevention. N Engl J Med;
- Lindsey Wang, Rong Xu, David C. Kaelber, Nathan A. Berger. (2024). Glucagon-Like Peptide 1 Receptor Agonists and 13 Obesity-Associated Cancers in Patients With Type 2 Diabetes. JAMA Netw Open. 7, e2421305;
- Rachel Dankner, Havi Murad, Nirit Agay, Liraz Olmer, Laurence S. Freedman. (2024). Glucagon-Like Peptide-1 Receptor Agonists and Pancreatic Cancer Risk in Patients With Type 2 Diabetes. JAMA Netw Open. 7, e2350408;
- William Wang, QuangQiu Wang, Xin Qi, Mark Gurney, George Perry, et. al.. (2024). Associations of semaglutide with first‐time diagnosis of Alzheimer's disease in patients with type 2 diabetes: Target trial emulation using nationwide real‐world data in the US. Alzheimer's & Dementia. 20, 8661-8672;
- Alireza Atri, Howard H. Feldman, Charlotte Thim Hansen, Julie Broe Honore, Peter Johannsen, et. al.. (2022). evoke and evoke+: design of two large‐scale, double‐blind, placebo‐controlled, phase 3 studies evaluating the neuroprotective effects of semaglutide in early Alzheimer’s disease. Alzheimer's & Dementia. 18;
- Nabeela Siddeeque, Mohammad H. Hussein, Ahmed Abdelmaksoud, Julia Bishop, Abdallah S. Attia, et. al.. (2024). Neuroprotective effects of GLP-1 receptor agonists in neurodegenerative Disorders: A Large-Scale Propensity-Matched cohort study. International Immunopharmacology. 143, 113537;
- Wassilios G. Meissner, Philippe Remy, Caroline Giordana, David Maltête, Pascal Derkinderen, et. al.. (2024). Trial of Lixisenatide in Early Parkinson’s Disease. N Engl J Med. 390, 1176-1185;
- Iciar Aviles-Olmos, John Dickson, Zinovia Kefalopoulou, Atbin Djamshidian, Peter Ell, et. al.. (2013). Exenatide and the treatment of patients with Parkinson’s disease. J. Clin. Invest.. 123, 2730-2736;
- Fares Qeadan, Ashlie McCunn, Benjamin Tingey. (2025). The association between glucose‐dependent insulinotropic polypeptide and/or glucagon‐like peptide‐1 receptor agonist prescriptions and substance‐related outcomes in patients with opioid and alcohol use disorders: A real‐world data analysis. Addiction. 120, 236-250;
- Henning Bliddal, Harold Bays, Sébastien Czernichow, Joanna Uddén Hemmingsson, Jøran Hjelmesæth, et. al.. (2024). Once-Weekly Semaglutide in Persons with Obesity and Knee Osteoarthritis. N Engl J Med. 391, 1573-1583;
- Marc P. Bonaca, Andrei-Mircea Catarig, Yasemin Hansen, Kim Houlind, Chethana R, et. al.. (2024). EFFECTS OF 1 MG ONCE-WEEKLY SEMAGLUTIDE ON FUNCTIONAL CAPACITY IN PATIENTS WITH TYPE 2 DIABETES AND PERIPHERAL ARTERIAL DISEASE: TRIAL DESIGN AND BASELINE CHARACTERISTICS FROM STRIDE A 52-WEEK, RANDOMIZED, DOUBLE-BLIND, PLACEBOCONTROLLED TRIAL. Journal of the American College of Cardiology. 83, 2231;
- John D. Groarke, Jeffrey Crawford, Susie M. Collins, Shannon Lubaczewski, Eric J. Roeland, et. al.. (2024). Ponsegromab for the Treatment of Cancer Cachexia. N Engl J Med. 391, 2291-2303;
- James Patrick Finnerty, Aravind Ponnuswamy, Prosjenjit Dutta, Ammar Abdelaziz, Hafiz Kamil. (2021). Efficacy of antifibrotic drugs, nintedanib and pirfenidone, in treatment of progressive pulmonary fibrosis in both idiopathic pulmonary fibrosis (IPF) and non-IPF: a systematic review and meta-analysis. BMC Pulm Med. 21;
- Wenjuan Wu, Lingxiao Qiu, Jizhen Wu, Xueya Liu, Guojun Zhang. (2021). Efficacy and safety of pirfenidone in the treatment of idiopathic pulmonary fibrosis patients: a systematic review and meta-analysis of randomised controlled trials. BMJ Open. 11, e050004;
- Luca Richeldi, Arata Azuma, Vincent Cottin, Christian Hesslinger, Susanne Stowasser, et. al.. (2022). Trial of a Preferential Phosphodiesterase 4B Inhibitor for Idiopathic Pulmonary Fibrosis. N Engl J Med. 386, 2178-2187;
- Sangam Shah, Krishna Dahal, Sangharsha Thapa, Prativa Subedi, Basanta Sharma Paudel, et. al.. (2024). Herpes zoster vaccination and the risk of dementia: A systematic review and meta‐analysis. Brain and Behavior. 14;
- Биспецифические антитела, их мишени и перспективы применения в современной медицине;
- Kazuko Nishikura. (2016). A-to-I editing of coding and non-coding RNAs by ADARs. Nat Rev Mol Cell Biol. 17, 83-96;
- Genliang Lu, Chikdu Shivalila, Prashant Monian, Hui Yu, Ian Harding, et. al.. (2024). Rational design of base, sugar and backbone modifications improves ADAR-mediated RNA editing. Nucleic Acids Research. 52, 10068-10084;
- Точный удар: как редактирование мРНК победит неизлечимые болезни;
- Matthew G. Durrant, Nicholas T. Perry, James J. Pai, Aditya R. Jangid, Januka S. Athukoralage, et. al.. (2024). Bridge RNAs direct programmable recombination of target and donor DNA. Nature. 630, 984-993;
- Andrew V. Anzalone, Peyton B. Randolph, Jessie R. Davis, Alexander A. Sousa, Luke W. Koblan, et. al.. (2019). Search-and-replace genome editing without double-strand breaks or donor DNA. Nature. 576, 149-157;
- Сквозь тернии к нервам: особенности доставки лекарств в нервную систему;
- «Да, паразитирую! И дарю новые возможности!»;
- Медицинская мультивселенная: получится ли у омиксов людей лечить?;
- Одноклеточное секвенирование: разделяй, изучай и властвуй;
- Факты и легенды о мультиомиксных технологиях.